-
人工湿地由于运行简单,维护方便等特点,被广泛应用于养殖废水、农村生活污水、富营养化水体等方面的治理,但传统人工湿地存在的DO分布不均匀,扩散速率慢等问题,限制了污染物的高效去除。近年来的研究发现,通过改变湿地填料、增加曝气等,可以改善湿地内部环境,提高DO浓度,从而有效提升污染物的去除效果。LIU等[1]以红砖、粉煤灰作为填料,通过改变填料构成和配比,实现了污染物的高效去除;王宁等[2]在传统潜流湿地中增加间歇曝气,在强化氮素污染物去除的同时,能够实现氧化亚氮减排。生物炭作为一种性能优良的吸附剂[3],具有疏松多孔的特点,逐渐成为水体污染物去除的重要材料。通过投加生物炭,可以显著提升潜流湿地中氮素污染物的去除效果[4]。SUN等[5]将生物炭应用于间歇曝气湿地流湿地,使TN去除率提高了13.5%。生物炭还可以通过改变湿地环境,改善微生物菌落,促进污染物的去除[6]。DENG等[7]发现,生物炭添加能改变潜流湿地中微生物群落分布特征,增加Thauera、Candidatus Competibacter、Dechloromonas、Desulfobulbus、Chlorobium和Thiobacillus等功能菌属的相对丰度,提高对有机物和氮素污染物的降解能力。尽管已有研究关注了生物炭对潜流湿地污染物去除和微生物群落多样性的影响,但生物炭在间歇曝气湿地中对污染物和功能微生物等作用的研究尚显不足。本研究通过构建室内间歇曝气生物炭湿地,探究湿地中污染物的去除效果,分析微生物群落结构,揭示生物炭对间歇曝气湿地的影响特征,以期为生物炭在湿地工程中的应用提供参考。
全文HTML
-
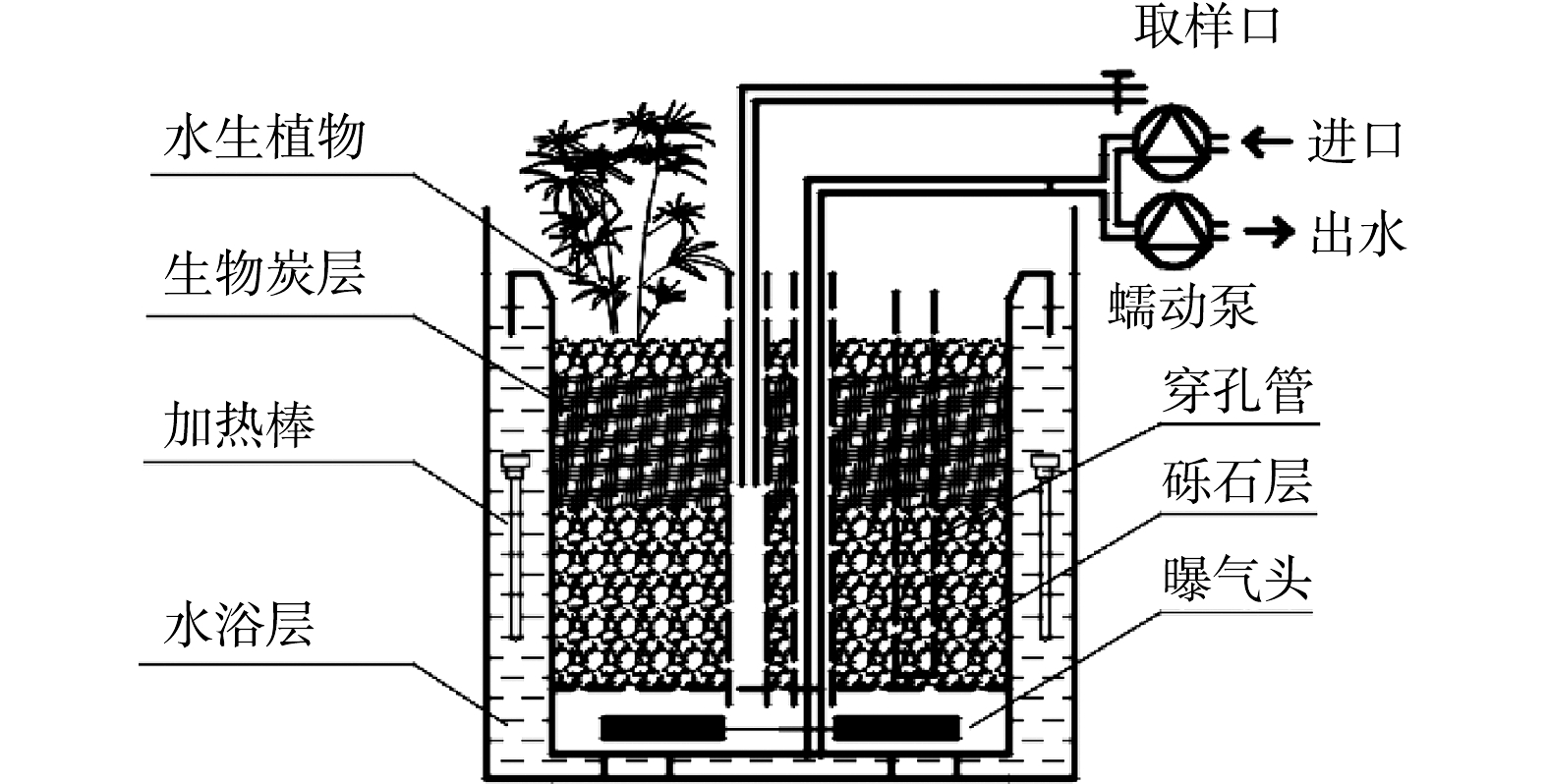
实验湿地装置采用圆柱形聚乙烯容器,每个装置底面积为0.1 m2,深为35 cm。装置内基质填充总高度为33 cm,下部填充粒径为1~3 cm的碎石,上部按0、10%、30%、40%比例填充生物炭,表层覆盖3 cm厚碎石层防止生物炭上浮,并依次命名为CW、BW1、BW2、BW3,每组设置1组平行,共计8个湿地反应器。反应器的结构如图1所示。实验所采用的生物炭参考HUANG等[8]的研究制备,制得的生物炭比表面积为345.92 m2·g‒1,孔径为1.95 nm,孔容为0.246 7 cm3·g‒1。湿地植物选用美人蕉(Canna indica L.),经驯化培养后移栽至反应器内,种植密度30 株·m−2。湿地污泥取自重庆市某生活污水处理厂,在经过人工配水驯化后一次性接种至湿地系统。
反应器中央设有1根直径为3 cm的穿孔管,用于虹吸排水、水样采集和物理化学相关参数的测定。另外布置3根穿孔管,其内部密封并装有与湿地等高的填料(下称填料柱),用于湿地微生物的采集。穿孔管孔径为0.5 cm,孔密度为500~600 个·m−2。反应器外部设有水浴层,控制湿地系统温度为(27±1) ℃,以保障湿地植物和微生物的稳定生长。容器底部设有微型曝气头进行间歇曝气,曝气量采用流量控制器(AST10-DX,阿斯特,北京)控制,曝气时间采用时间开关控制。
-
本实验进水采用人工配水,每升水里包含0.235 g葡萄糖、0.114 g蔗糖、6.3 mg蛋白胨、0.2 g NaHCO3、0.16 g NH4Cl、0.5 g MgSO4·7H2O、0.44 g KH2PO4、0.72 g K2HPO4·3H2O、0.6 g FeSO4·7H2O、0.38 g CaCl2和微量元素液。每升微量元素液成分含量为0.15 g H3BO3、0.03 g CuSO4·5H2O、0.18 g KI、0.12 g MnCl2·4H2O、0.06 g Na2MoO4·2H2O、0.12 g ZnSO4·7H2O、0.15 g CoCl2·6H2O、10 g EDTA-2Na。经多次测定,进水水质为
${\rm{NH}}_4^ + $ -N (41.5±0.5) mg·L−1、TN (43.0±1.2) mg·L−1、COD (360±5) mg·L−1、DO (6.95±0.15) mg·L−1、pH为7.6±0.3。所有反应器均采用间歇曝气,停留时间为24 h,包括4个阶段,每个阶段中曝气段和非曝气段各3 h。每个反应器有效进水量为12 L。 -
1)水质测定分析。本研究历时180 d,稳定运行后选取连续60 d对水质进行测定,每2 d测定1次,其中COD、
${\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N、${\rm{NO}}_2^ - $ -N、TN的测定参见文献中的方法[9],DO采用便携式溶解氧仪(YSI 550A,美国)测定,pH使用台式酸度计(PB-10,德国)测定。2)微生物采集与测定。反应器稳定期间,从填料柱中采集样品,用200 mL进水将填料上的污泥全部洗出,收集泥水混合液,混匀后置于25 mL灭菌离心管中,在10 000 r·min−1转速下离心10 min,用磷酸缓冲液洗涤2次后,取沉淀样品置于−80 ℃下保存。本实验中微生物样品由上海美吉生物医药科技有限公司进行Illumina Miseq高通量测序。细菌所测区间为16S rRNA V3-V4可变区,测序引物为338F-806R。
-
实验数据通过Origin 8.5整理作图,并由SPSS21.0进行数据分析。所有实验数据均采用平均值加减标准差表示。对象之间的差异性分析采用One-way ANOVA(水平包括P<0.05和P<0.01)。
1.1. 湿地系统构建
1.2. 系统运行
1.3. 样品采集与测定
1.4. 数据分析
-
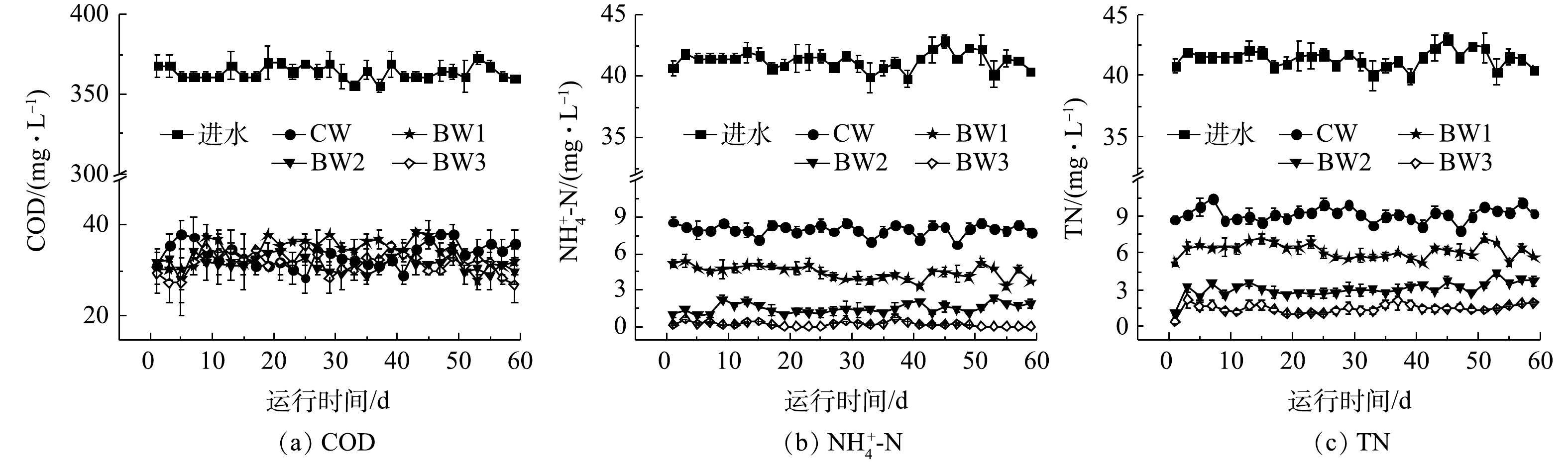
在曝气段,随着生物炭投加比例增加,湿地水体中平均DO浓度也随之显著增加(P<0.05)。BW3水体中平均DO质量浓度为2.5 mg·L−1,与CW相比,曝气段的平均DO质量浓度提高了13.6%(图2(a))。生物炭的多孔结构改善了湿地内部条件[10],有利于氧气的扩散,可帮助提高曝气段水体中DO质量浓度。在非曝气段,尽管生物炭能够提高水体中的DO质量浓度,但影响不显著(P>0.05)。湿地系统出水平均pH为7.15~7.35,呈中性(图2(b)),除BW1出水pH高于CW,BW2~BW3出水pH均低于CW。本研究添加的生物炭为碱性[8],可使湿地出水pH有所升高。但随着生物炭的投加比例的增加,湿地中硝化作用得到增强[11],使硝化过程消耗的碱度大大提升,从而导致湿地系统出水pH有所降低。
-
曝气湿地系统对有机物均表现出较高的去除效果(图3(a)),这与ZHOU等[2,4]的研究结果一致。CW~BW3系统中出水平均COD分别为(34.0±2.0)、(33.0±2.0)、(32.0±2.0)和(32.0±2.0) mg·L−1,去除率均已达到90%以上;BW2和BW3中出水COD显著低于CW。人工湿地中有机物的去除主要依赖于微生物的氧化分解,生物炭的添加增加了曝气段DO质量浓度,利于好氧微生物对有机物的代谢利用。此外,生物炭表面上含有不同功能基团,如羧基、羟基、羰基等[12-14],能够吸附各种有机物,从而降低其迁移率和提高生物利用率[15-17],进而利于有机物的进一步去除。
随着生物炭添加量的增加,各系统
${\rm{NH}}_4^ + $ -N的出水质量浓度也逐渐降低(图3(b))。CW~BW3出水${\rm{NH}}_4^ + $ -N的平均质量浓度分别为(7.95±0.29)、(4.47±0.24)、(1.53±0.25)和(0.24±0.03) mg·L−1,去除率依次为80.76%、85.09%、96.29%和99.43%,生物炭的添加能显著提高${\rm{NH}}_4^ + $ -N去除率,最高可提高18.67%。此结果与GUPTA等[18]的研究结果一致。这是因为:一方面,物炭表面粗糙,且具有较大的比表面积,对${\rm{NH}}_4^ + $ -N有较强吸附作用[19];另一方面,生物炭提高改善湿地内部环境条件,促进了硝化作用,有利于${\rm{NH}}_4^ + $ -N的去除[20]。实验湿地中TN去除趋势与
${\rm{NH}}_4^ + $ -N基本一致。CW~BW3出水TN的平均质量浓度依次为(9.15±1.55)、(6.17±0.91)、(3.08±0.84)和(1.50±1.12) mg·L−1,去除率分别为77.88%、85.78%、92.9%和96.38%,生物炭湿地中TN的去除效果显著高于对照湿地(图3(c))。相较于CW,BW3中TN的去除率提高了18.5%。在各组反应器出水中均未检出${\rm{NO}}_3^ - $ -N和${\rm{NO}}_2^ - $ -N。非曝气段较低的DO质量浓度和充足的有机物[21-22]为反硝化作用提供较好环境条件,利于TN去除。同时还发现,TN去除与生物炭的添加呈现显著正相关关系(P<0.05)。尽管生物炭提高了湿地系统非曝气段的DO质量浓度,但平均DO质量浓度仅为0.5 mg·L−1,未对反硝化造成不利影响。生物炭湿地中曝气段的高效硝化和非曝气段的彻底反硝化显著提升了氮素污染物的去除效果。 -
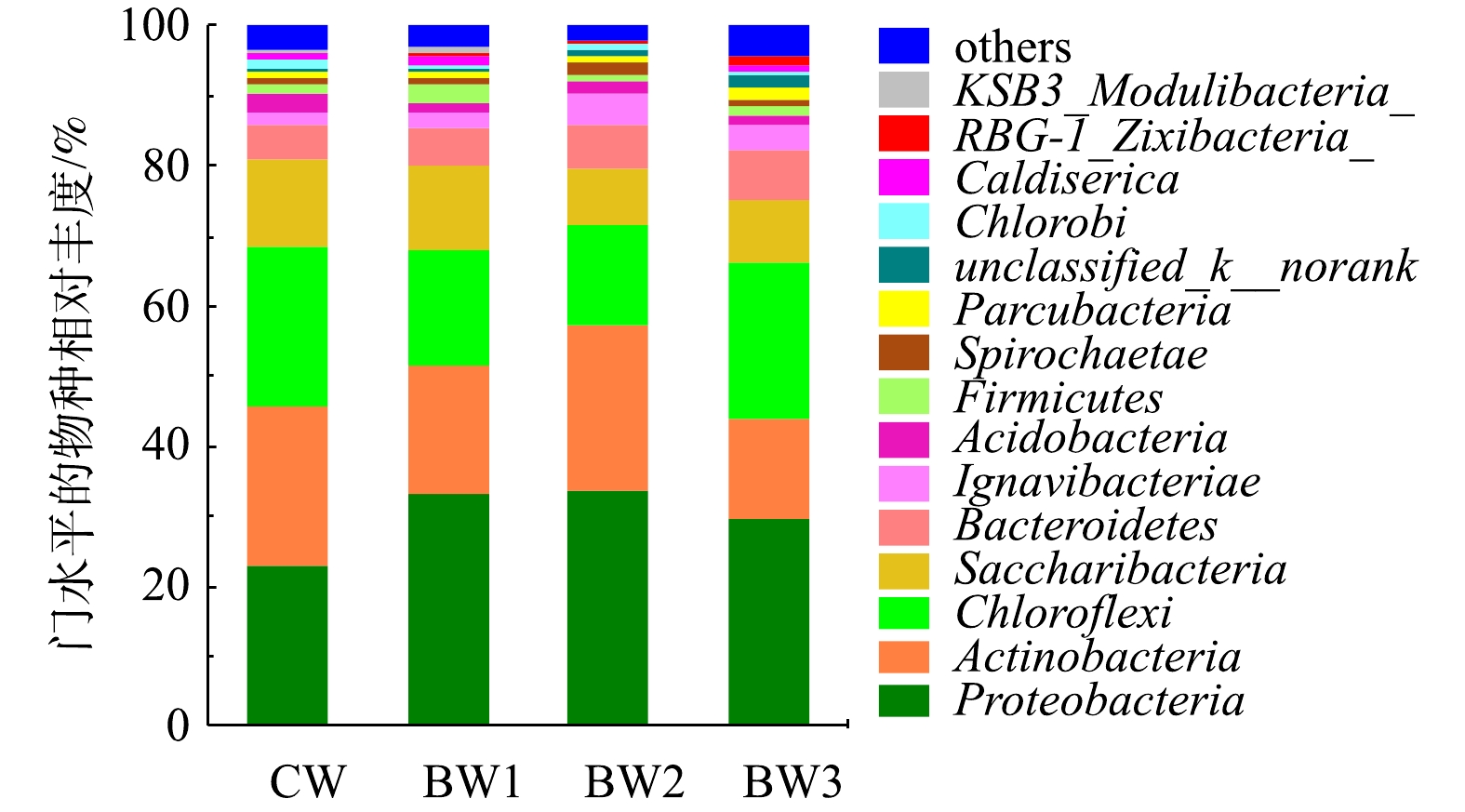
本研究采用Illumina Miseq高通量测序,分析了各反应系统微生物群落结构的特征(图4)。在4个湿地系统中均检测出13种菌门,包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、螺旋体菌门(Saccharibacteria)、拟杆菌门(Bacteroidetess)、Ignavibacteria、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、螺旋体菌门(Spirochaetae)、Parcubacteria、绿菌门(Chlorobi)、嗜热丝菌门(Caldiserica)和芽单胞菌门(Gemmatimonadetes),其中Proteobacteria、Actinobacteria、Chloroflexi和Saccharibacteria的丰度相对较高。Proteobacteria包括β-变形菌亚门(Betaproteobacteria)和γ-变形菌亚门(Gammaproteobacteria),其在生物脱氮除磷[23]和有机物降解中[24]起核心作用。大量的氨氧化菌(AOB)、亚硝酸氧化菌(NOB)和反硝化菌均属于β-变形菌亚门和γ-变形菌亚门[25],间歇曝气能显著提升AOB和NOB的数量[26],生物炭的投加能提高DO质量浓度可增加Proteobacteria丰度。Actinobacteria是1种偏碱性菌[27],添加生物炭降低了出水pH,因此,Actinobacteria数量在生物炭系统中略有降低。整体来看,生物炭添加增加了Bacteroidetess和Proteobacteria的数量,降低了Actinobacteria、Chloroflexi和Saccharibacteria的相对丰度。
为了进一步研究生物炭添加比例对属水平微生物种群结构的影响,取相对丰度占比超过5%的前9个属,其他菌属归于Others(图5)。结果表明,湿地系统中主要的优势菌属有Candidatus_Competibacter属、红游动菌属(Rhodoplanes)、丙酸杆菌科(Propionibacteriaceae)中的1个未知属等,生物炭添加改变了湿地系统中微生物属水平的种群结构。
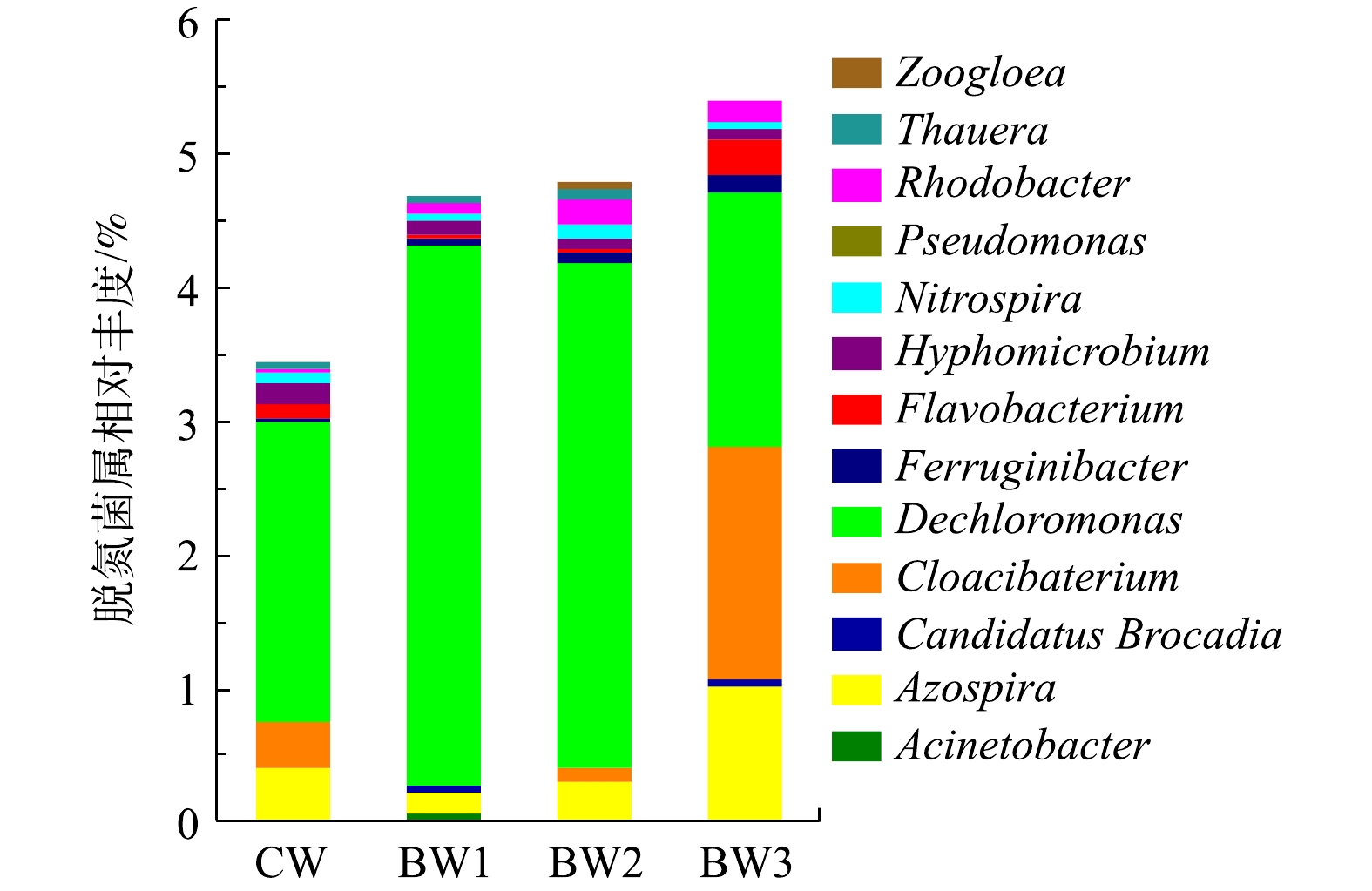
各湿地系统中检出与脱氮相关的菌属共13种(图6),检测到的硝化菌属是硝化螺旋菌属(Nitrospira)。Nitrospira在好氧条件下将
${\rm{NO}}_2^ - $ 氧化为${\rm{NO}}_3^ - $ ,投加生物炭能增加Nitrospira的相对丰度。此外,检测出的反硝化菌属共11种,主要包括脱氯单胞菌(Dechloromonas)、黄杆菌属(Flavobacterium)、固氮螺旋菌属(Azospira)、动交菌(Zoogloea)、陶厄氏菌属(Thauera)、红杆菌(Rhodobacter)、假单胞菌属(Pseudomonas)、生丝微菌(Hyphomicrobium)、Cloacibacterium属、Ferruginibacter属及不动杆菌属(Acinetobacter)。Thauera、Dechloromonas、Hyphomicrobium、Cloacibacterium、Azospira、Rhodobacter均属于兼性菌,Thauera是工业废水处理中降解有机物和反硝化菌的重要种群[28]。Dechloromonas可以将${\rm{NO}}_3^ - $ -N和${\rm{NO}}_2^ - $ -N还原为N2[29],生物炭投加增加了上述6种兼性反硝化菌属的菌落丰度。剩余5种反硝化菌属均需有氧环境,Acinetobacter可参与好氧反硝化过程[30],Flavobacterium的增殖与有活性污泥膨胀关[31]。同时,还检测到1种厌氧氨氧化菌属Candidatus Brocadia。这些功能微生物丰度在本研究的湿地处理系统中均处于较高水平,且在生物炭湿地系统中与脱氮相关的微生物丰度均高于对照湿地。在利于微生物附着的同时[32],生物炭的多孔特性改善了湿地内部DO条件,这利于硝化过程的进行[33-34]。而生物炭对污染物良好的吸附性能,还能为反硝化过程提供必要的营养物质[35]。因此,添加生物炭能够通过增加湿地系统中脱氮相关的微生物丰度,进而改善脱氮效果。
2.1. 生物炭添加量对湿地中DO、pH的影响
2.2. 生物炭添加量对有机物去除及脱氮效果的促进
2.3. 生物炭添加对湿地微生物群落结构特征的改变
-
1)在间歇曝气潜流湿地中,投加生物炭可以显著增加曝气段DO质量浓度,但对非曝气段DO质量浓度影响较小。湿地系统出水呈中性,生物炭的投加未对出水pH造成显著影响。
2)生物炭对湿地系统中有机物去除影响不显著,但投加生物炭可提高
${\rm{NH}}_4^ + $ -N的去除率,投加10%~40%的生物炭可提升7.9%~18.5%的TN去除率,且各反应器出水中均未检出${\rm{NO}}_3^ - $ -N和${\rm{NO}}_2^ - $ -N。3)生物炭改变了湿地系统中微生物种群的相对丰度,可以增加Nitrospira、Thauera、Rhodobacter和Pseudomonas等10余种与脱氮相关的菌属丰度,从而提高脱氮效率。








 下载:
下载: