-
氧化多环芳烃(oxygenated polycyclic aromatic hydrocarbons,OPAHs)是芳族苯环上具有至少一个羰基氧(C=O)的多环芳烃(PAHs)衍生物,其排放源与PAHs相似(即燃烧源与尾气排放源),也可由PAHs经光或化学氧化和生物转化产生[1]. OPAHs具有环境持久性、流动性和强毒性等特点[2],可长期存留于大气[3]、土壤[4]、水体[1]及其沉积物[5]等环境介质中,并通过多种途径(如呼吸吸入、直接接触和饮食摄入)进入生物体[6],进而对生态功能和生物体健康造成潜在影响.
已有研究发现,农业用地、工业用地和林业用地土壤中OPAHs有不同程度的残留量,且更易进入植物根部并富集,部分可向上迁移至茎叶部分,进而可影响植物形态、生长指标(如根芽长)、生理生化指标(如过氧化物酶含量)和生理过程(如线粒体损伤)[7 − 8]. 中国南方某典型城市表层土壤中OPAHs残留量远高于杂环多环芳烃,占比为16.8%[9]. 此外,菲等多环芳烃可诱发氧化应激以加快植物细胞膜脂类氧化进程,亦可导致光合作用和蛋白质生物合成所需基因下调[10],最终诱导植物细胞发生程序性凋亡、细胞器损伤或造成植物坏死病变[11]. Yun等[12]发现,硝基多环芳烃可影响种子萌发和幼苗生长以及导致根尖细胞染色体异常. 最近一项研究表明,OPAHs(如胡桃醌)可抑制玉米与小麦种子萌发生长、促进氧化应激且诱导过氧化物酶基因表达改变[13]. 目前OPAHs植物毒性及其机制的研究较少[2].
本研究以大麦为模式植物,考察不同浓度OPAHs处理下大麦幼苗生长状况和生理生化指标变化,并探讨OPAHs胁迫下抗氧化生理响应,旨在明确OPAHs致大麦毒性效应及其机制,为生态安全评估和环境管理政策提供科学依据.
-
5种OPAHs(1,2-苯并奎宁酮(1,2-Benzanthraquinone)、1,8-萘酐(1,8-Naphthalic anhydride)、9-芴酮(9-Fluorenone)、蒽醌(Anthraquinone)和1,4-萘醌(1,4-Naphthoquinone))购自上海化成工业发展有限公司;二甲基亚砜(DMSO)购自Sigma-Aldrich;30%过氧化氢(H2O2,分析纯)购自天津市方正试剂厂;磷酸盐缓冲液(PBS:0.1 mol·L−1,pH7.0—7.4)购自武汉赛维尔生物科技有限公司;光照培养箱(上海一恒科学仪器有限公司);多功能酶标仪(Thermo Scientific);组织破碎匀浆仪(鼎昊源生物科技有限公司);台式冷冻离心机(Thermo Scientific);恒温水浴锅(常州国华电器有限公司);数显鼓风干燥箱(上海博迅实业有限公司).
-
大麦种子购自河北兴农富民种子销售有限公司;挑选颗粒饱满的大麦种子,经3% H2O2溶液浸泡消毒5 min后用去离子水清洗3—5次,随后于蒸馏水中浸泡4—6 h以进行后续实验. 实验设计为五组,选用5种OPAHs且设置1、3、10 µmol·L−1浓度梯度作为处理组,同体积的1‰ DMSO和蒸馏水分别作为阴性对照(Veh)和空白对照(Con). 浸泡后随机挑选大小一致的种子(n=30)置于铺有两层滤纸培养皿内,培养皿分别添加上述溶液,随即于(25±1)℃和14/10 h的光循环下浸种24、48、72 h后检测每皿种子萌发率(以种子破白为萌发标准),每隔24 h适当更换处理液.
随机选择生长良好且根长1—1.5 cm种子(n=30)置于已添加染毒液的培养皿内,每隔24 h检测大麦幼苗的根长和芽长. 浸种7 d后,剪下幼苗根和茎叶部分,蒸馏水冲洗后于滤纸上晾干,称量鲜重;然后于烘箱105 ℃下烘3 h,80 ℃下烘8 h,称量干重.
-
浸种7 d后,收取并测定叶片中叶绿素(chl)、活性氧(ROS)、过氧化氢(H2O2)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)、维生素E(VE)和类胡萝卜素(Car)等含量. chl和Car采用丙酮-乙醇浸提法[14 − 15];ROS、H2O2、SOD、GSH和VE活性均按照南京建成生物工程研究所试剂盒说明书测定.
-
每组至少3个平行,每个实验至少进行两次重复,所得数据描述性结果统计采用Excel 2016,以平均值±标准差来表示. 结果分析和作图使用GraphPad Prism 8,使用One way ANOVA进行显著性分析. 使用IBM SPSS Statistics 21进行相关性分析.
-
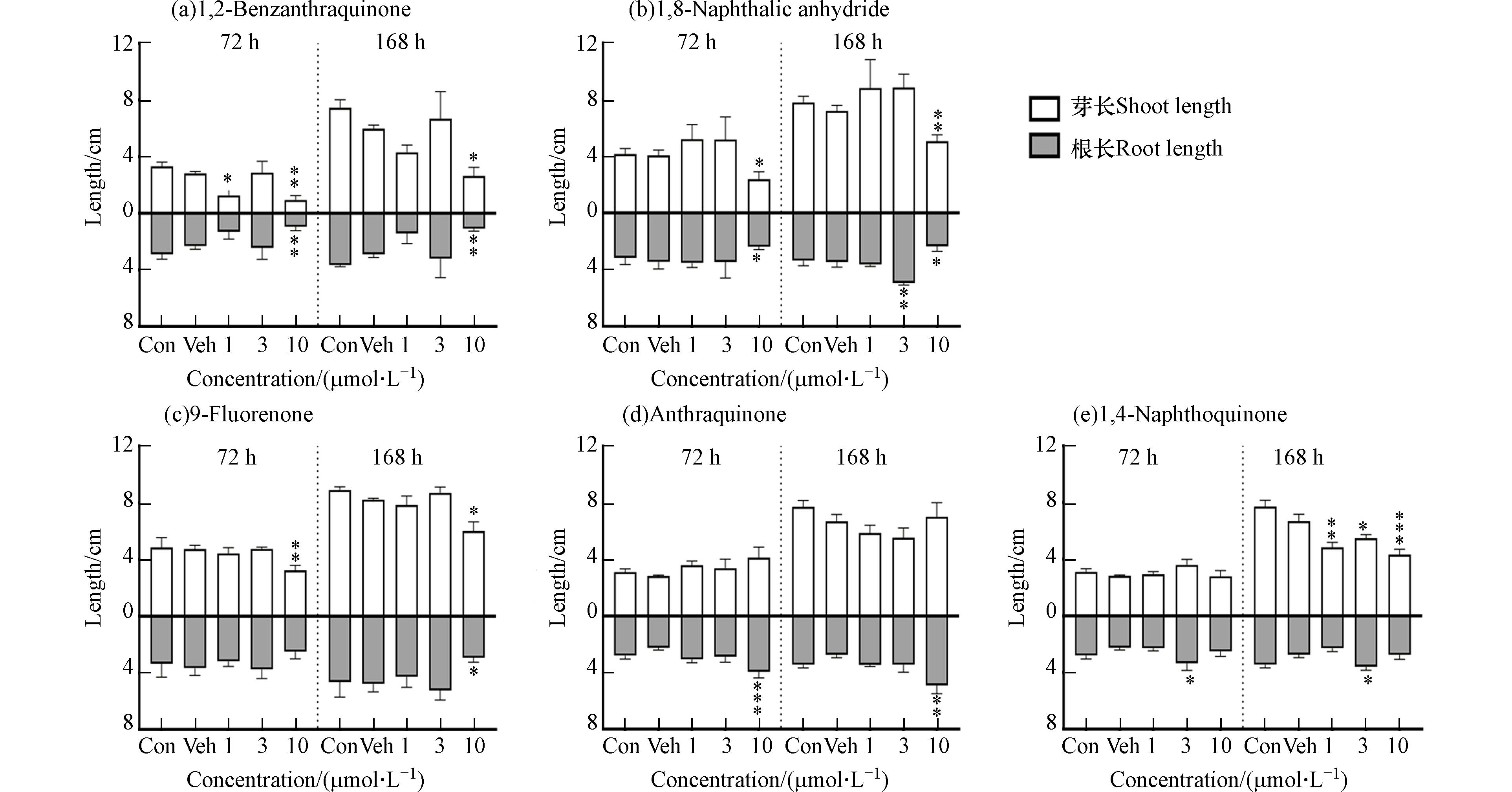
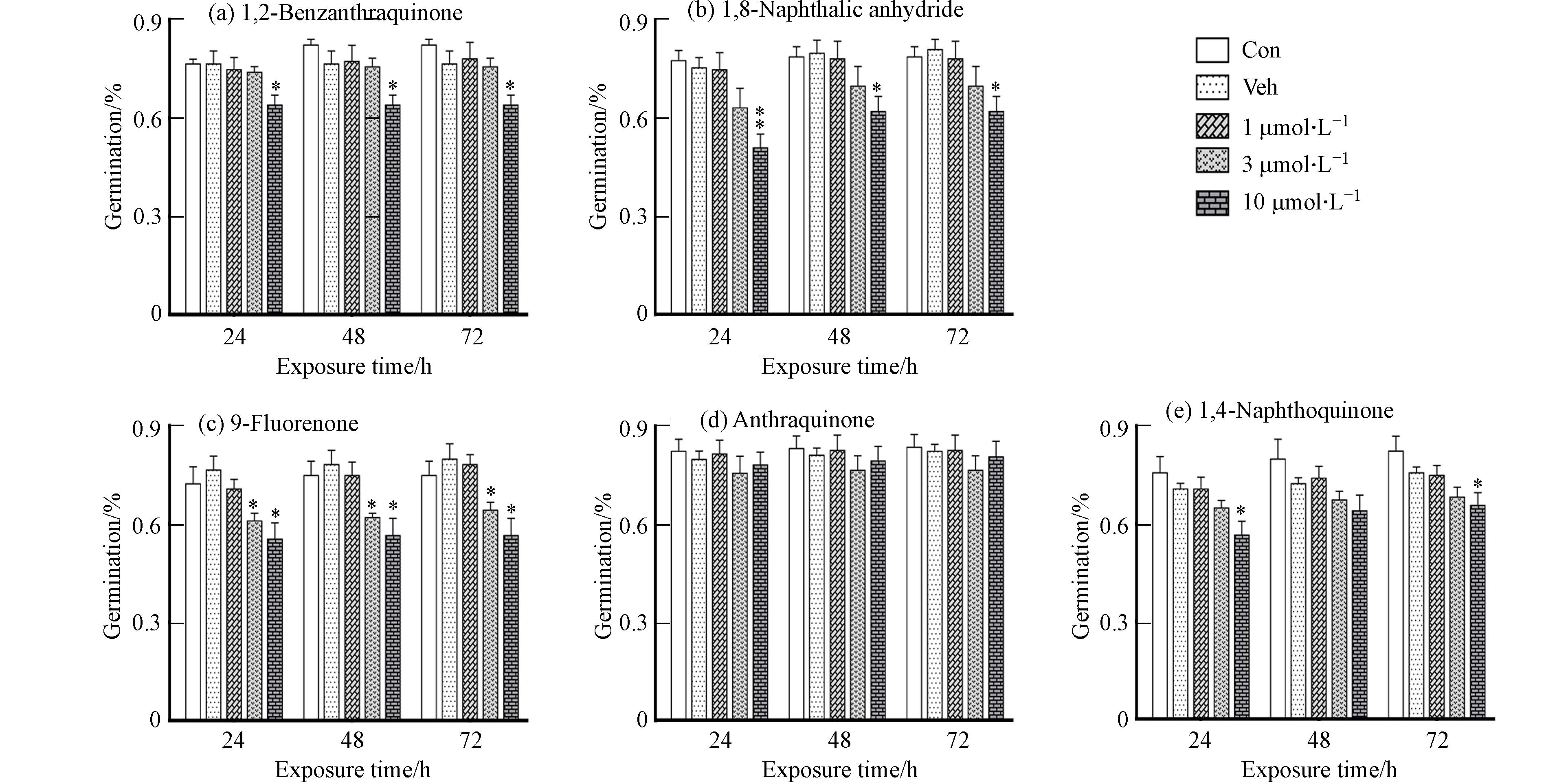
发芽率、芽/根伸长是判断植物毒性的基础指标[16]. 由图1可知,1,2-苯并奎宁酮、1,8-萘酐、9-芴酮和1,4-萘酐等4种OPAHs毒性作用呈剂量依赖关系,即染毒浓度越高,大麦种子萌发率越低. 72 h浸种后,1,2-苯并奎宁酮、1,8-萘酐、9-芴酮和1,4-萘醌10 μmol·L−1浓度处理下对种子萌发有较显著的抑制作用,相对溶剂对照组分别降低了16.3%、23.3%、29.2%和13.2%(P<0.05);24 h浸种后,3 μmol·L−1 9-芴酮可显著抑制种子萌发.
本研究还观察到5种OPAHs浸种72 h和168 h会对芽长和根长产生不同程度的影响(图2). 除蒽醌外,其余4种OPAHs浸种大麦后均降低了其幼苗芽伸长,且高浓度组抑制作用最强. 10 μmol·L−1浓度下,1,2-苯并奎宁酮、1,8-萘酐和9-芴酮浸种72 h,对芽伸长已显示出较明显的毒性作用,相对于溶剂对照组分别降低66.3%(P<0.01)、41.0%(P<0.05)和31.6%(P<0.01);而1,4-萘醌浸种168 h后可显著抑制芽伸长. 此外,168 h浸种后,10 μmol·L−1 1,2-苯并奎宁酮、10 μmol·L−1 1,8-萘酐和10 μmol·L−1 9-芴酮可抑制根伸长,相对于溶剂对照组分别降低62.6%(P<0.01)、32.2%(P<0.05)和38.7%(P<0.05);有趣的是,10 μmol·L−1 蒽醌和3 μmol·L−1 1,4-萘醌促进了根伸长,增加了79.2%(P<0.01)和31.0%(P<0.05).
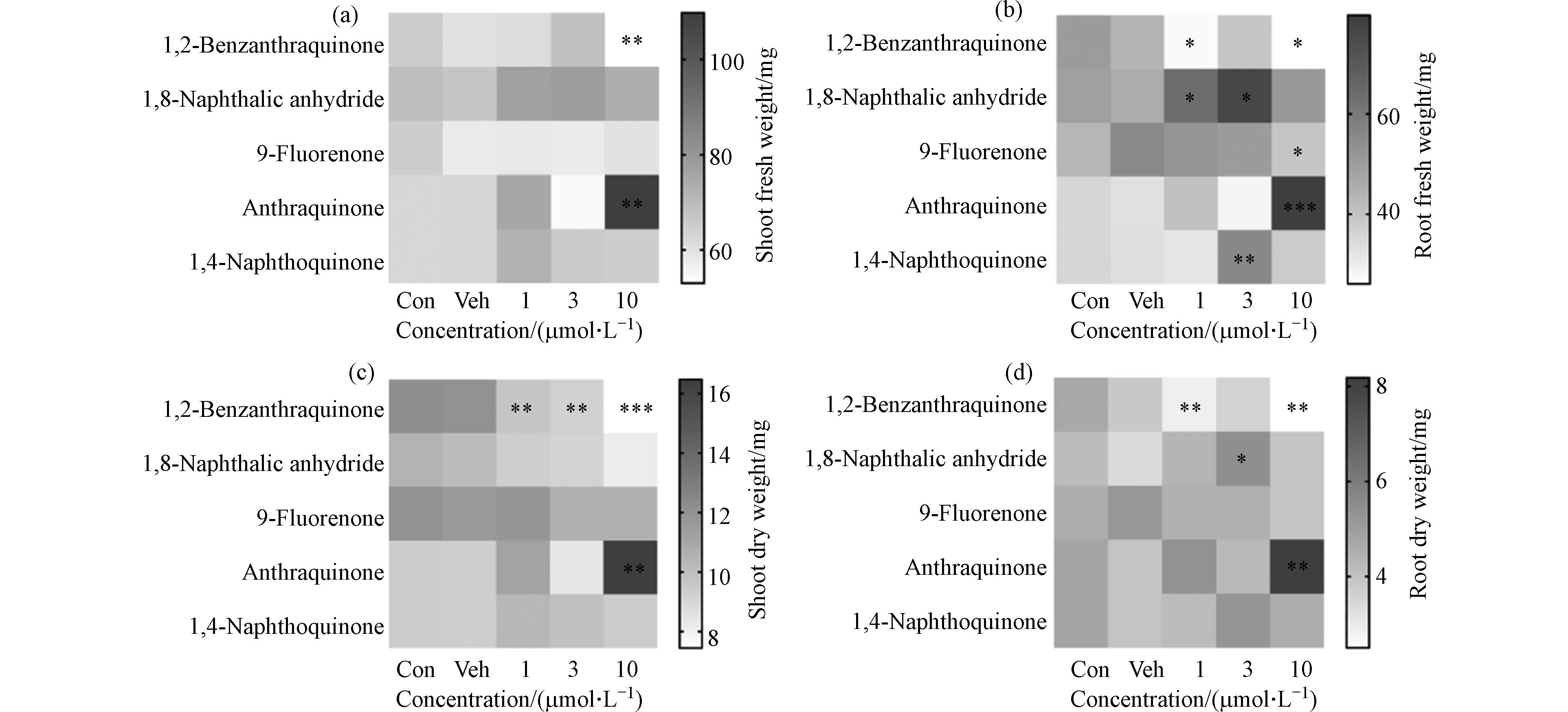
此外,5种OPAHs染毒大麦7 d后可对幼苗根芽生物量有不同程度的干扰(图3). 10 μmol·L−1 1,2-苯并奎宁酮显著降低了大麦根芽生物量,表现为芽的干(鲜)重和根的干(鲜)重相较于溶剂对照组分别减少38.4%(11.8%)(P<0.01)和36.9%(44.2%)(P<0.05). 而10 μmol·L−1 蒽醌却显著增加了根芽生物量. 上述结果表明,OPAHs对大麦幼苗生长具有差异毒性作用,可能源于苯环数以及官能团数量与位置的不同[17]. Sytykiewicz等[13]的研究结果也发现了类似现象,表明OPAHs具有较高的植物毒性.
-
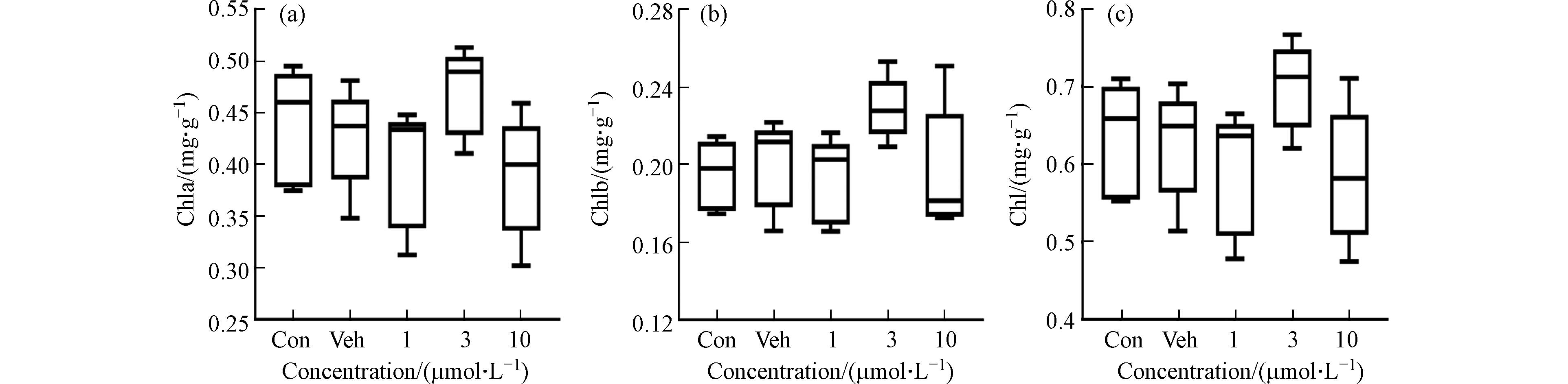
外源环境污染物胁迫植物发生光合作用、氧化损伤等一系列的生理响应过程[18]. 由图4可知,不同浓度1,2-苯并奎宁酮染毒对大麦叶片叶绿素a、叶素绿b和总叶绿素含量变化无生物学显著差异,与Stepan等[19]研究结果类似.
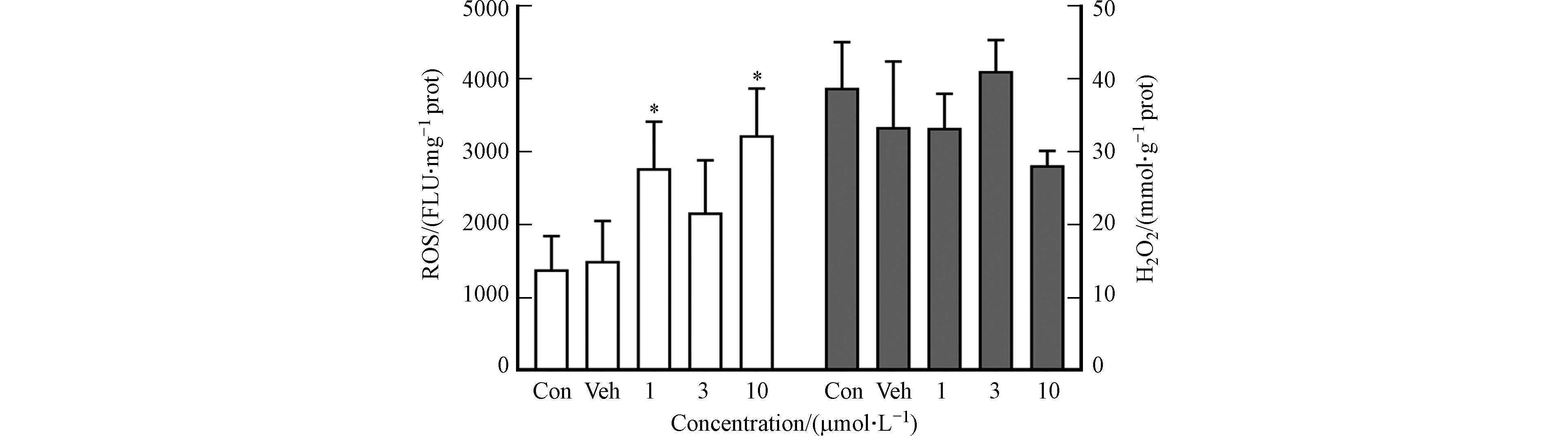
植物受到环境胁迫时,活性氧和过氧化氢会过度积累,进而导致脂质过氧化[20]. 本研究探讨1,2-苯并奎宁酮染毒后大麦叶片ROS和H2O2含量的变化,如图5所示. 1,2-苯并奎宁酮染毒后叶片ROS含量随浓度升高呈增加-减少-再增加变化趋势,与Veh组相比分别增加85.1%(P<0.05),44.5%和115.3%(P<0.05);H2O2含量在3 μmol·L−1下增加23.0%,但无生物学显著变化. 文献报道污染物可破坏植物体内氧平衡,导致H2O2、超氧自由基(O2·−)和羟基自由基(HO·)等ROS产生并存留于叶绿体、线粒体和过氧化物酶体等细胞器中,进而导致植物氧化损伤[21]. 在本研究中,1,2-苯并奎宁酮染毒引起ROS显著变化但H2O2无统计学差异,可能是其他自由基参与诱导氧化损伤过程.
-
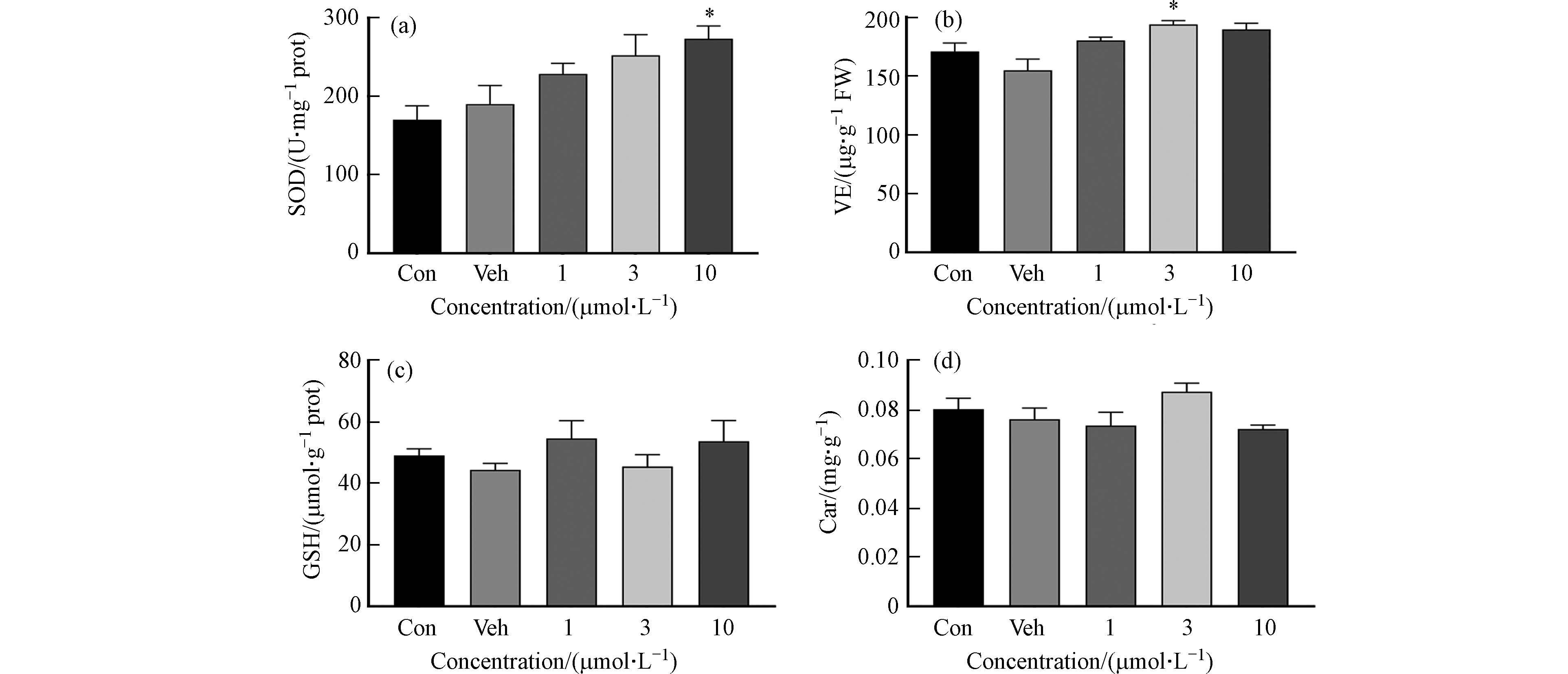
植物受外源性污染物胁迫后可启动抗氧化防御以降低ROS含量[22]. 在该过程中,植物产生的超氧化物歧化酶(SOD)和谷胱甘肽(GSH)等抗氧化物质可缓解氧化应激. 本研究选取SOD、VE、GSH和Car等四种抗氧化酶/剂[23]阐述1,2-苯并奎宁酮胁迫下大麦抗氧化生理响应情况,结果如图6所示. 1,2-苯并奎宁酮染毒后可导致SOD、VE、GSH和Car有不同程度的变化,仅SOD和VE有统计学差异. 3 μmol·L−1和10 μmol·L−1浓度1,2-苯并奎宁酮染毒后,SOD活性相对于Veh组分别增加32.6%和43.8%(P<0.05),VE活性分别提高25.0%(P<0.05)和22.3%,其中SOD活性于10 μmol·L−1浓度显著增加,而VE活性于3 μmol·L−1浓度显著增加. 前人研究提示,在污染物胁迫下抗氧化酶活性和抗氧化剂含量在不同的植物品种以及不同浓度污染物之间有所差异[24]. 本研究,SOD和VE活性的增加表明它们在大麦叶片缓解氧化应激起到关键作用;而GSH和Car无显著变化,可能是由于OPAHs物质和染毒时间等差异所致.
-
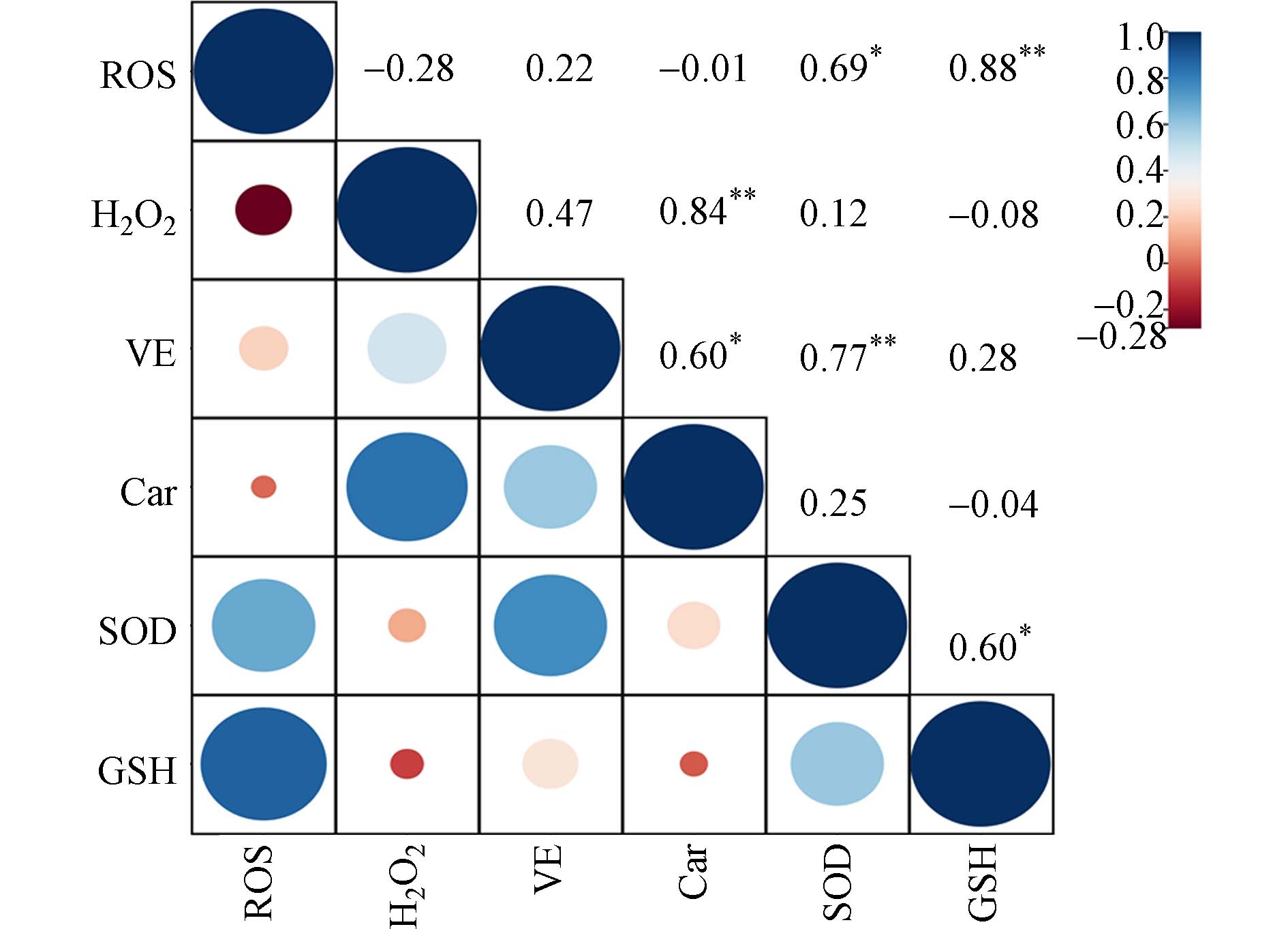
使用Pearson相关性分析研究抗氧化分子与氧化应激指标之间的关系,结果见图7. 抗氧化分子对ROS、H2O2的响应具有差异性,其中ROS与SOD、GSH均呈显著正相关,相关系数分别为0.69(P<0.05)、0.88(P<0.01);H2O2与Car呈极显著相关(P<0.01),表明大麦抗氧化系统可以维持体内ROS水平以防御氧化应激伤害,进而使幼苗正常生长发育. 此外,SOD分别与VE、GSH之间具有相关性(P<0.05),提示抗氧化分子之间也可以相互作用以减弱大麦氧化损伤. 结果可以发现,SOD、GSH和Car是大麦叶片主要的抗氧化物,且在1,2-苯并奎宁酮处理下,SOD表现出较强的抗氧化作用.
-
(1)OPAHs染毒抑制大麦种子萌发和幼苗生长,但结构不同显示出毒性效应差异. 1,2-苯并奎宁酮和9-芴酮两种酮类物质抑制根系生长,蒽醌和1,4-萘醌两种萘醌类物质促进根系生长,而1,8-萘酐在根系生长上表现出“低促高抑”的现象. 对于生物量,1,2-苯并奎宁酮抑制作用最为明显,蒽醌却促进其增加.
(2)1,2-苯并奎宁酮对大麦叶片光合作用未产生明显影响,但可诱导活性氧含量呈浓度依赖性增加,过氧化氢含量却无显著变化. 在此过程中,超氧化物歧化酶和维生素E含量呈现相同变化趋势,但还原型谷胱甘肽和类胡萝卜素并未产生明显效应,提示1,2-苯并奎宁酮胁迫植物抗氧化生理响应以降低氧化损伤,其中超氧化物歧化酶响应最强.
(3)超氧化物歧化酶是大麦体内清除OPAHs诱导氧化应激所产生的活性氧自由基的主要抗氧化酶.
氧化多环芳烃对大麦幼苗生长及抗氧化生理响应的影响
Effects of oxygenated polycyclic aromatic hydrocarbons on growth and antioxidant physiological response of barley seedling
-
摘要: 近年来,多环芳烃衍生物—氧化多环芳烃(OPAHs)因其较高的环境检出和生态风险而备受关注. 为明确植物幼苗对OPAHs累积的响应,本研究采用水培实验和植物生理学手段探讨不同浓度OPAHs(1、3、10 μmol·L−1)胁迫下大麦生长发育、光合作用和氧化损伤及其抗氧化防御能力. 结果表明,OPAHs降低大麦种子萌发率、根芽伸长率和根芽干鲜重等指标,增加活性氧、过氧化氢水平以及抗氧化物质含量,但对叶绿素等光合色素无显著影响. 相关性分析显示,超氧化物歧化酶、还原型谷胱甘肽和类胡萝卜素参与叶片抑制氧化损伤过程,其中超氧化物歧化酶在1,2-苯并奎宁酮胁迫下的抗氧化防御中起到关键作用.Abstract: Recently, polycyclic aromatic hydrocarbons derivatives—oxygenated polycyclic aromatic hydrocarbons (OPAHs) are widely noticed due to their high environment detection and ecological risk. To clarify the reponse of OPAHs accumulation in plant seedlings, this study investigated growth, photosynthesis, oxidative damages and antioxidant defense in barley under OPAHs stresses at different concentrations(1, 3, 10 µmol·L−1) via hydroponic experiments and plant physiological methods. The results showed that OPAHs inhibited index, such as barley seed germination, root elongation, bud elongation, shoot and root biomass, elevated the levels of ROS and H2O2, and induced antioxidant accumulation, but not significantly affecting photosynthetic pigment content such as chlorophylls. The correlation analysis further indicated superoxide dismutase, glutathione and carotenoid were involved in the inhibition of oxidative damages in barley leaves. Among them, superoxide dismutase was essential for antioxidant defense under 1,2-benzan-thraquinone stress.
-

-
-
[1] QIAO M, QI W X, LIU H J, et al. Oxygenated polycyclic aromatic hydrocarbons in the surface water environment: Occurrence, ecotoxicity, and sources[J]. Environment International, 2022, 163: 107232. doi: 10.1016/j.envint.2022.107232 [2] 张玉洁, 云洋. 环境中的氧化多环芳烃综述[J]. 环境化学, 2021, 40(1): 150-163. doi: 10.7524/j.issn.0254-6108.2020022802 ZHANG Y J, YUN Y. Oxygenated polycyclic aromatic hydrocarbons in the environment: A review[J]. Environmental Chemistry, 2021, 40(1): 150-163(in Chinese). doi: 10.7524/j.issn.0254-6108.2020022802
[3] XIA W W, LIANG B, CHEN L, et al. Atmospheric wet and dry depositions of polycyclic aromatic compounds in a megacity of Southwest China[J]. Environmental Research, 2022, 204: 112151. doi: 10.1016/j.envres.2021.112151 [4] CHEN W S, XIAN W X, HE G Y, et al. Occurrence and spatiotemporal distribution of PAHs and OPAHs in urban agricultural soils from Guangzhou City, China[J]. Ecotoxicology and Environmental Safety, 2023, 254: 114767. doi: 10.1016/j.ecoenv.2023.114767 [5] KONG J J, HAN M S, CAO X Y, et al. Sedimentary spatial variation, source identification and ecological risk assessment of parent, nitrated and oxygenated polycyclic aromatic hydrocarbons in a large shallow lake in China[J]. Science of the Total Environment, 2023, 863: 160926. doi: 10.1016/j.scitotenv.2022.160926 [6] 李晨光, 李维霞, 张璟, 等. 人体血浆中多环芳烃及含氧多环芳烃的暴露特征及健康风险评估[J]. 环境化学: 2023, 42(6): 1784-1791. LI C G, LI W X, ZHANG J, et al. Exposure characteristics and health risk assessment of polycyclic aromatic hydrocarbons and oxygenated derivatives in human plasma[J]. Environmental Chemistry 2023, 42(6): 1784-1791(in Chinese).
[7] SHEN Y, LI J F, SHI S N, et al. Application of carotenoid to alleviate the oxidative stress caused by phenanthrene in wheat[J]. Environmental Science and Pollution Research, 2019, 26(4): 3593-3602. doi: 10.1007/s11356-018-3832-y [8] KRZYSZCZAK A, DYBOWSKI M, JOŚKO I, et al. The antioxidant defense responses of Hordeum vulgare L. to polycyclic aromatic hydrocarbons and their derivatives in biochar-amended soil[J]. Environmental Pollution, 2022, 294: 118664. doi: 10.1016/j.envpol.2021.118664 [9] REN K F, WEI Y, LI J H, et al. Polycyclic aromatic hydrocarbons (PAHs) and their derivatives (oxygenated PAHs, azaarenes, and sulfur/oxygen-containing heterocyclic PAHs) in surface soils from a typical city, South China[J]. Chemosphere, 2021, 283: 131190. doi: 10.1016/j.chemosphere.2021.131190 [10] JAJOO A, MEKALA N R, TOMAR R S, et al. Inhibitory effects of polycyclic aromatic hydrocarbons (PAHs) on photosynthetic performance are not related to their aromaticity[J]. Journal of Photochemistry and Photobiology B:Biology, 2014, 137: 151-155. doi: 10.1016/j.jphotobiol.2014.03.011 [11] AHAMMED G J, GAO C J, OGWENO J O, et al. Brassinosteroids induce plant tolerance against phenanthrene by enhancing degradation and detoxification in Solanum lycopersicum L[J]. Ecotoxicology and Environmental Safety, 2012, 80: 28-36. doi: 10.1016/j.ecoenv.2012.02.004 [12] YUN Y, LIANG L Y, WEI Y, et al. Exposure to Nitro-PAHs interfere with germination and early growth of Hordeum vulgare via oxidative stress[J]. Ecotoxicology and Environmental Safety, 2019, 180: 756-761. doi: 10.1016/j.ecoenv.2019.05.032 [13] SYTYKIEWICZ H, KOZAK A, LESZCZYŃSKI B, et al. Transcriptional profiling of catalase genes in juglone-treated seeds of maize (Zea mays L. ) and wheat (Triticum aestivum L. )[J]. Acta Biologica Hungarica, 2018, 69(4): 449-463. doi: 10.1556/018.69.2018.4.7 [14] 周武先, 段媛媛, 卢超, 等. 高效提取3种不同类型植物叶片色素的方法[J]. 西北农业学报, 2019, 28(1): 97-104. doi: 10.7606/j.issn.1004-1389.2019.01.012 ZHOU W X, DUAN Y Y, LU C, et al. Efficient methods for extracting pigments from three different types of plant leaves[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2019, 28(1): 97-104(in Chinese). doi: 10.7606/j.issn.1004-1389.2019.01.012
[15] 尚誉, 杨丰隆, 董轶茹, 等. 矸石山及其周边村庄土壤浸出液对大麦的毒性作用[J]. 环境科学, 2020, 41(6): 2936-2941. SHANG Y, YANG F L, DONG Y R, et al. Toxicity of soil leachate from coal gangue and its surrounding village of barley(Hordeum vulgare)[J]. Environmental Science, 2020, 41(6): 2936-2941(in Chinese).
[16] ULLAH H, LI X P, PENG L Y, et al. In vivo phytotoxicity, uptake, and translocation of PbS nanoparticles in maize (Zea mays L. ) plants[J]. Science of the Total Environment, 2020, 737: 139558. doi: 10.1016/j.scitotenv.2020.139558 [17] ZHU J H, ZOU Z H, SHEN Y, et al. Increased ZnO nanoparticle toxicity to wheat upon co-exposure to phenanthrene[J]. Environmental Pollution, 2019, 247: 108-117. doi: 10.1016/j.envpol.2019.01.046 [18] WEI H Y, SONG S J, TIAN H L, et al. Effects of phenanthrene on seed germination and some physiological activities of wheat seedling[J]. Comptes Rendus Biologies, 2014, 337(2): 95-100. doi: 10.1016/j.crvi.2013.11.005 [19] ZEZULKA Š, KUMMEROVÁ M, BABULA P, et al. Lemna minor exposed to fluoranthene: Growth, biochemical, physiological and histochemical changes[J]. Aquatic Toxicology, 2013, 140-141: 37-47. doi: 10.1016/j.aquatox.2013.05.011 [20] AHLUWALIA O, SINGH P C, BHATIA R. A review on drought stress in plants: Implications, mitigation and the role of plant growth promoting rhizobacteria[J]. Resources, Environment and Sustainability, 2021, 5: 100032. doi: 10.1016/j.resenv.2021.100032 [21] MILLER G, SUZUKI N, CIFTCI-YILMAZ S, et al. Reactive oxygen species homeostasis and signalling during drought and salinity stresses[J]. Plant, Cell & Environment, 2010, 33(4): 453-467. [22] SELOTE D S, KHANNA-CHOPRA R. Antioxidant response of wheat roots to drought acclimation[J]. Protoplasma, 2010, 245(1): 153-163. [23] GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 909-930. doi: 10.1016/j.plaphy.2010.08.016 [24] AHAMMED G J, YUAN H L, OGWENO J O, et al. Brassinosteroid alleviates phenanthrene and pyrene phytotoxicity by increasing detoxification activity and photosynthesis in tomato[J]. Chemosphere, 2012, 86(5): 546-555. doi: 10.1016/j.chemosphere.2011.10.038 -



 下载:
下载: