-
蓝藻水华是全球水环境面临的严重污染问题之一,不仅影响水质,还对水生生物及人类健康构成潜在威胁[1]。铜绿微囊藻(Microcystis aeruginosa)是蓝藻水华中最常见的蓝藻种类之一,其快速增殖以及释放的有害物质对水质安全和生态环境构成了极大的威胁。在藻华发生过程中,微囊藻释放的藻毒素,尤其是微囊藻毒素(Microcystins),是主要的有害物质之一,具有很强的肝毒性和致癌性[2-3]。在已鉴定的200多种微囊藻毒素变体中,微囊藻毒素-LR(MC-LR)是最常见且毒性最强的[4-5]。为应对蓝藻水华带来的生态风险和健康威胁,研究人员已经开发了多种藻华治理技术,以有效减少水体中的蓝藻数量及其释放的毒素。
目前,针对藻华的防控方法主要有物理、化学和生物等多种技术。物理防控方法如人工搅拌、曝气和遮光等手段能够抑制藻类的繁殖,但这些方法通常仅能提供短期效果,且需要持续维护[6]。化学除藻法因其高效性受到广泛关注[7],尤其是铜基化合物杀藻技术被认为是一种有效的水华控制手段,如硫酸铜的使用能迅速杀灭藻类[8]。然而,传统铜基化学杀藻技术存在显著的二次污染风险,残留的铜离子可能对水体及水生生物产生长期生态危害,导致鱼类中毒或破坏底栖生物群落[9]。低压电场驱动的增强电场处理技术对微生物具有较好的灭活效果[10-12],近年来,研究人员已逐步将其用于藻细胞中高价值物质的提取及藻华的控制[13-14]。有研究表明利用铜基电极搭配低压电场驱动的电场增强技术(低能耗原位铜电离技术)可实现藻细胞的有效灭活,其基本原理是通过低压电场驱动铜基电极原位电离释放铜离子,从而实现对藻细胞的快速有效灭活,同时减少外源性铜的过量输入[15-16]。该技术在一定程度上克服了传统铜基化学杀藻剂可能引发的二次污染问题,残留铜离子浓度显著降低,对水体及生态系统的长期影响较小。此外,电场驱动的铜电离技术具有较高的可控性,可根据水体中藻类的生长状况动态调整铜离子的释放量,实现更精准的治理效果。
然而,目前针对铜电离技术在蓝藻水华不同时期的适用性及技术边界条件仍缺乏系统研究。例如,不同生长期的蓝藻在生理特性及藻际环境条件上存在显著差异,可能显著影响铜电离技术的杀藻效率及藻毒素释放情况[17-18]。此外,如何平衡铜离子的释放量与生态安全性,以及优化关键工艺参数以适应复杂的自然水体环境,仍有待进一步研究。因此,本研究利用低能耗原位铜电离杀灭处于不同生长期(迟缓期、对数期、稳定期、衰亡期)的铜绿微囊藻,分析不同工艺参数条件(电压、流速)下的强化杀藻效能,同时通过分析胞内及胞外微囊藻毒素的含量来评估该技术在水华不同时期的藻毒素释放风险。
全文HTML
-
实验中所用水华蓝藻为铜绿微囊藻(Microcystis aeruginosa),购自中国科学院淡水藻种库(FACHB-315),使用BG-11培养基进行培养。培养条件如下:温度(25±1) ℃,光照强度3 600 lux,光暗比12 h∶12 h,每天摇瓶2~3次,以确保藻细胞充分混合和均匀生长。
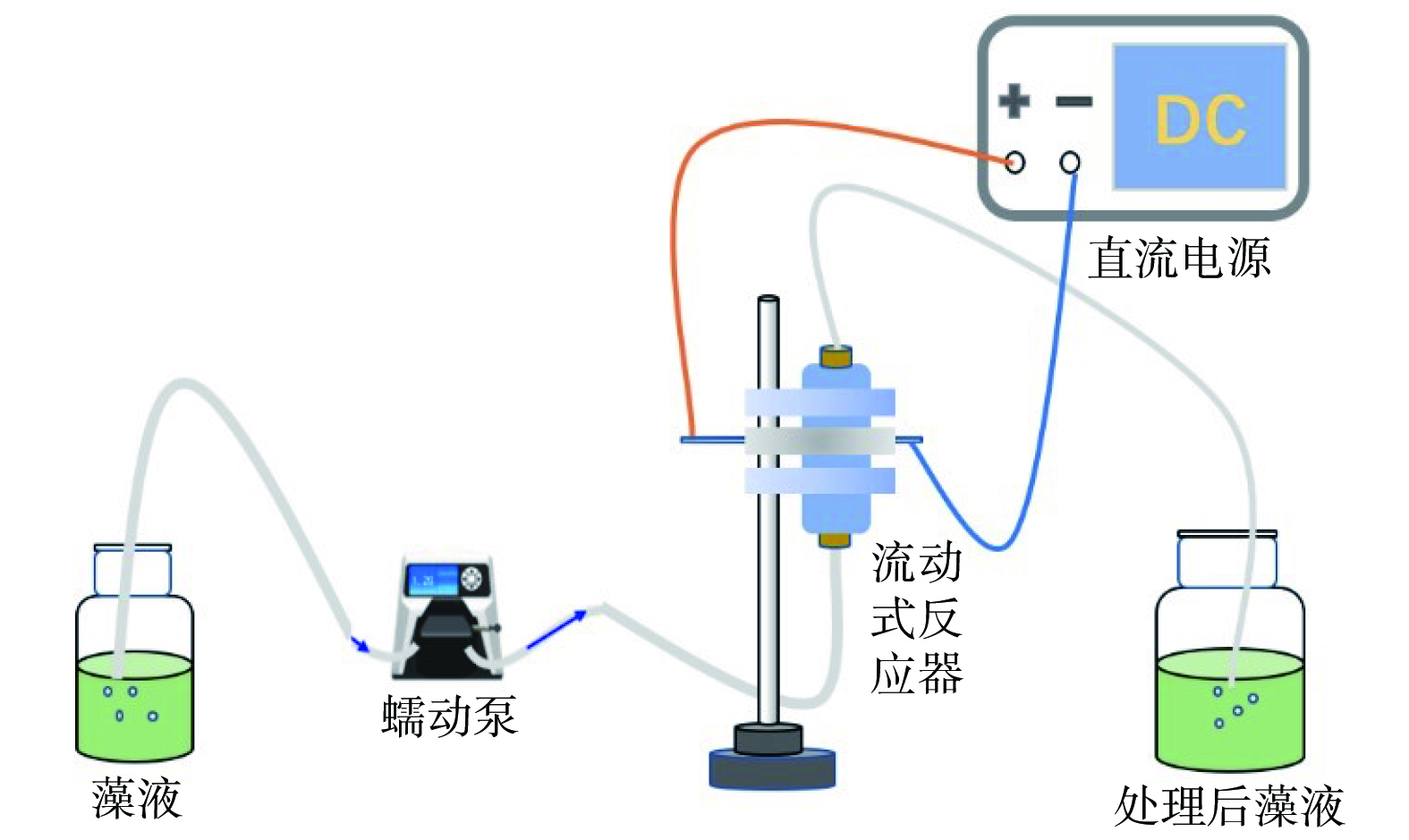
实验所用低压电场驱动的流动式反应装置如图1所示,由蠕动泵、直流电源、流动式反应器组成,其中流动式反应器是按海绵垫片、导电片、电极、绝缘垫片、电极从上到下装入有机玻璃同轴电极支架所构成。电极所用的材料为铜网(100目,100 mm×100 mm),有效面积为0.785 cm2。
-
将铜绿微囊藻接种于BG-11培养基中,根据其生长曲线将接种后第5、15、25和35 d分别定为迟缓期、对数期、稳定期和衰亡期取样时间点。取处于不同生长期的铜绿微囊藻培养液,通过低压电场原位铜电离装置进行杀藻处理,反应装置的工况条件(电压/电流)共设置4组,分别为0.5 V/(10 mL·min−1)、0.5 V/(2 mL·min−1)、1.0 V/(10 mL·min−1)和1.0 V/(2 mL·min−1)。
测定经过低能耗原位铜电离不同运行工况条件处理后的铜绿微囊藻的藻细胞活性及抗氧化活性,随后对处理后的藻细胞进行96 h生长监测,测定处理后第0、24、48、72、96 h的藻细胞光密度(OD680)和光合活性。为了分析杀藻过程中微囊藻毒素的释放情况,对48和96 h的胞外及胞内微囊藻毒素进行测定。
-
藻细胞活性通过SYTOX Green死细胞核酸染料荧光染色后利用流式细胞仪(FACSMelody-BD COE)分析确定,光合作用活性利用叶绿素荧光仪(AquaPen -AP110/C,捷克FluorCam公司)进行测定,藻细胞生长情况通过监测OD680变化来确定。藻细胞抗氧化酶及丙二醛(MDA)的测定方法如下:取10 mL藻液在4 ℃下以4 000 r·min−1的转速离心10 min,用0.05 mol·L−1的磷酸缓冲液洗涤藻细胞沉淀三次,重悬至2 mL然后用超声波细胞破碎仪破碎细胞10 min(设定参数amplitude:80%、pulse on:2 s、pulse off:4 s),最后以相同转速再次离心10 min,得到的上清液用于抗氧化酶活性和MDA的测定。其中超氧化物歧化酶(SOD)的测定采用总SOD活性检测试剂盒(NBT法,碧云天,货号S0109),过氧化氢酶(CAT)采用过氧化氢酶检测试剂盒(碧云天,货号S0051),MDA的测定采用脂质氧化检测试剂盒(碧云天,货号S0131S)。
胞内及胞外MC-LR的提取步骤如下:分别取2 mL藻液样品置于5 mL离心管中,离心(13 000 r·min−1、4 ℃、10 min)后取出上清液,为胞外藻毒素。另一份藻样经超声破碎后(破碎条件与酶活测定相同),在EZ-II蒸发器中蒸发至干燥。干燥后的样品在80%甲醇水溶液(2 mL)中重悬后,在分散萃取器中以2 500 r·min−1的转速搅拌5 min。之后在13 000 r·min−1下离心10 min清除细胞碎片,得到的上清液为胞内藻毒素。MC-LR的测定采用酶联免疫吸附试剂盒(上海源桔生物科技中心)。
-
本研究结果表示为均值±标准偏差。采用Microsoft Excel 2019对实验数据进行单因素方差分析(ANOVA),并用最小显著性差异检测法进行多重比较,“*”表示具有显著性差异(p ≤ 0.05),“**”表示具有极显著差异(p ≤ 0.01)。采用Origin Pro 2022进行绘图。
1.1. 实验材料与装置
1.2. 实验方法
1.3. 分析方法
1.4. 数据分析方法
-
在不同工况条件下对不同时期铜绿微囊藻进行藻灭活处理,共设置5个组别(电压/流速= 0.5 V/(10 mL·min−1)、0.5 V/(2 mL·min−1)、1.0 V/(10 mL·min−1)、1.0 V/(2 mL·min−1)和对照组),利用流式细胞仪进行藻细胞活性检测,根据测试结果分别标记活细胞(Live cell)、受伤细胞(Injured cell)和死细胞(Dead cell)3部分,如图2所示。电压为1.0 V,流速为 2 mL·min−1的条件下,处理迟缓期的藻细胞后死细胞占比可达22.60%,受伤细胞可达19.70%;处理对数期的藻细胞后死细胞和受伤细胞的占比分别可达20.90%和12.40%。在电压为0.5 V时,较低的流速(2 mL·min−1)使得铜绿微囊藻的灭活效果显著提升,尤其是在对数期和稳定期的藻细胞灭活上更为突出。相比于较高流速(10 mL·min−1),较低流速条件下的死细胞比率分别增加了162.01%和278.02%。这一现象可能与铜离子在水中的反应动力学和流体动力学特性有关,较低流速可以减少铜离子的扩散损失,使其更集中地作用于藻细胞,从而导致铜离子对藻细胞的渗透和破坏作用更加显著,从而提高了灭活效果。
当藻细胞在超过临界强度的电场中暴露一段时间后,水分子会在跨膜电势的作用下穿透细胞的脂质双层,形成孔洞,从而增加细胞膜的通透性[19]。然而,如果电场强度不足或作用时间过短,细胞膜可能会逐渐恢复至原始状态[20]。这种可逆的电穿孔作用可能造成细胞的亚致死性损伤。本研究中当电压增加到1.0 V时,相同流速条件下(2 mL·min−1),对于迟缓期和对数期藻细胞的灭活效果进一步增强,死细胞比率分别提高了12.44%和74.17%。这种效果的增强可以归因于较高电压下产生的更强的电场作用,导致铜离子释放速率加快,进而加剧了藻细胞的损伤和死亡。受伤细胞的比率也随电压的增加而提升,表明更高的电压不仅加速了细胞死亡,也加剧了细胞的亚致死性损伤。此外,在相同条件下,迟缓期的活细胞比例低于对数期,其灭活效果优于对数期。LI等[17]使用相同剂量的CuSO4处理稳定期和对数期的铜绿微囊藻,结果发现迟缓期藻细胞比对数期更为敏感,可达到较高的抑制率。
此外,较高电压下可能引发的氧化应激反应和细胞膜损伤也是导致铜绿微囊藻细胞死亡率上升的重要因素。然而,对于衰亡期铜绿微囊藻,并未呈现随着电压增大死细胞比率也随之增大的现象,反而经铜电离处理后活细胞比率有所增加,这可能是由于衰亡期的铜绿微囊藻细胞所处环境营养较为缺乏,且已经历了自然的老化过程,细胞功能逐渐丧失,代谢活动显著减弱[21]。此时,细胞对外界环境的反应变得迟钝,电场和铜离子的作用可能无法像对数期或稳定期那样有效地引发进一步的细胞损伤和死亡,反而作为微量元素对藻细胞生长表现出促进效应。本研究中对于迟缓期和对数期最佳灭活效果的电压和流速为1.0 V和2 mL·min−1,对于稳定期达到最佳灭活效果的条件为电压1.0 V和流速10 mL·min−1。由此可见,可根据水华蓝藻所处生长期的不同来调节系统的参数以实现最佳灭活效果。
-
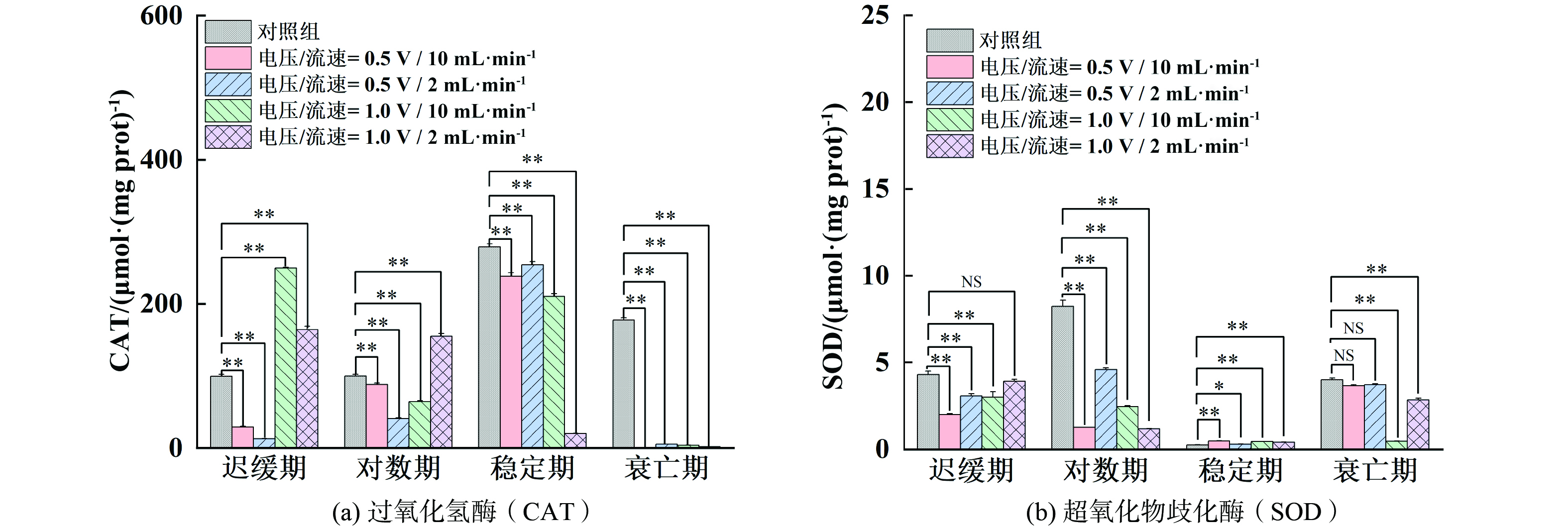
细胞内的抗氧化系统能够帮助抵御外界环境带来的压力。当藻细胞受到胁迫时,活性氧(ROS)如过氧化氢、超氧阴离子和羟基自由基等会被诱导产生,从而引发氧化应激反应[22]。过量的ROS会严重影响藻细胞的活性。抗氧化酶如SOD、CAT和过氧化物酶(POD),以及一些非酶促抗氧化分子(如还原性谷胱甘肽GSH和抗坏血酸AsA)在缓解ROS诱导的氧化损伤中起到关键作用[23]。铜绿微囊藻经原位铜电离处理后藻细胞的CAT、SOD活力变化及MDA含量如图3所示。对于迟缓期和对数期的藻细胞,电压为0.5 V时,较低流速(2 mL·min−1)显著提高了CAT的活性,而电压增大到1.0 V时,CAT活性进一步提升。同时,在这两个时期,SOD活性随着电压的增大显著提高,特别是流速较低(2 mL·min−1)时的1.0 V条件下。这说明在低流速高电压条件下更容易刺激铜绿微囊藻产生氧化应激反应。对于稳定期和衰亡期的藻细胞,经过原位铜电离后CAT活性也随着电压的增大显著上升,特别是在较低流速下。衰亡期的CAT水平尽管有所上升,但幅度相对较小,这可能与细胞在该阶段代谢减弱有关,相比之下,衰亡期SOD活性变化不明显,甚至在高电压条件下也未显著增加,表明细胞在衰亡期对氧化应激的反应较弱。
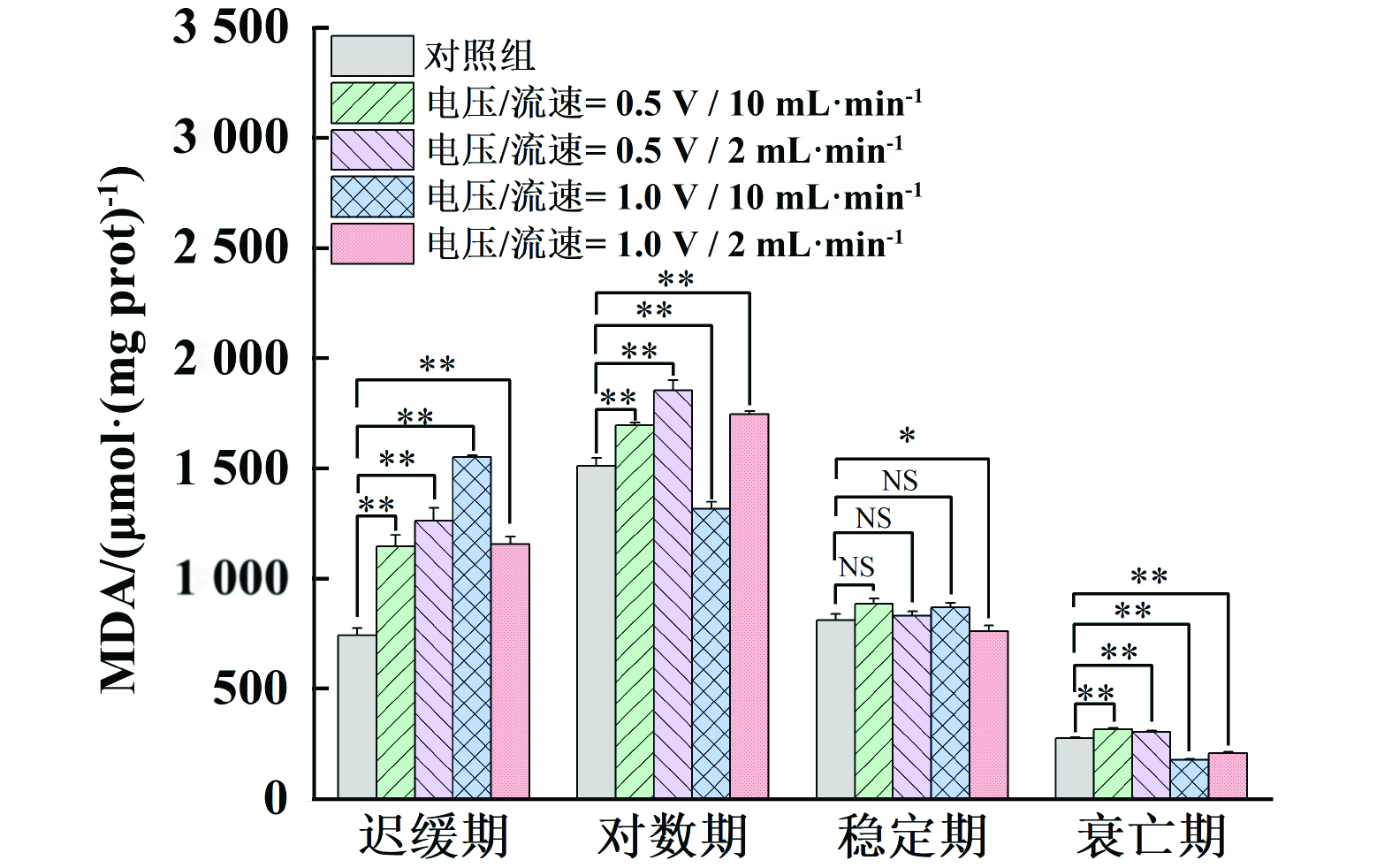
MDA是细胞脂质过氧化的产物,其含量越高表明细胞受损越严重。如图4所示,在迟缓期和对数期下处理后的藻细胞,MDA水平随着电压的增大而显著增加,迟缓期电压升高效果更明显,对数期降低流速效果更明显,尤其是在较低流速下,1.0 V电压条件下的MDA水平最高,说明细胞膜受到的氧化损伤最大。稳定期MDA含量在不同条件下变化不大,可能是由于此时期细胞膜已相对稳定,受到的损伤较少。衰亡期的MDA水平也没有显著增加,这与细胞在该阶段对电压变化反应较弱的结果相一致。
-
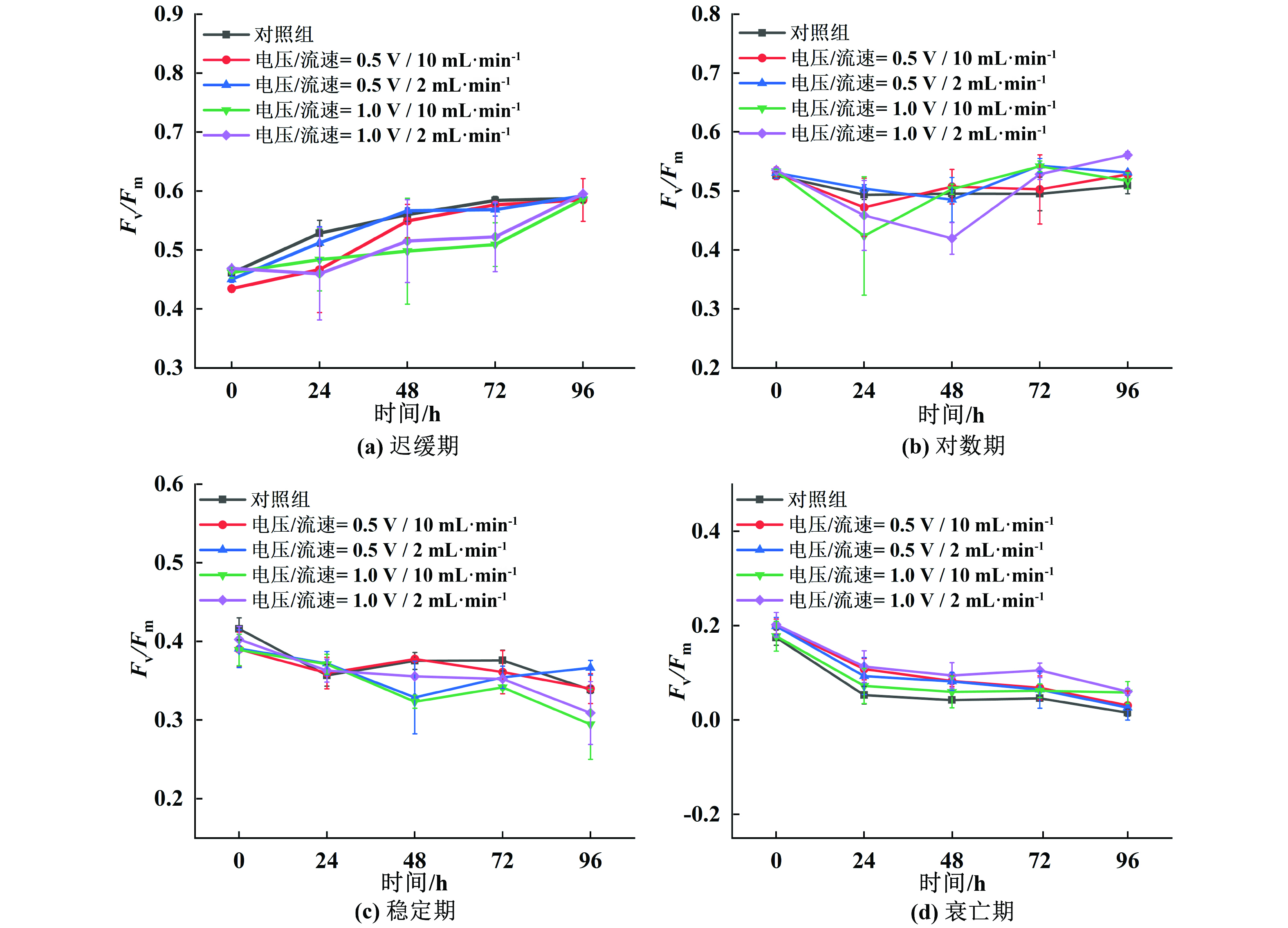
为了明确原位铜电离处理对不同生长期铜绿微囊藻的灭活效果维持情况,将处理后的各生长期铜绿微囊藻进行96 h再培养同时监测其生长情况,OD680-96 h抑制率如图5所示。结果发现相对于未经铜电离处理的实验组而言,经过处理的不同时期细胞生长时期都呈现出不同程度的生长抑制,说明经过低能耗铜电离处理后,尽管没有施加电压,但体系中释放的铜离子能够在一定程度上继续对藻细胞产生抑制作用。LIU等[24]研究表明对低压电场驱动的铜电离反应装置施用1 V电压,当流速为1、5和10 mL·min−1时,总铜浓度大约分别为1 000、500~600、300~400 μg·L−1,其中在1和5 mL·min−1的流速下体系中溶解铜浓度分别为46.2和29.0 μg·L−1,大部分的铜被吸附在藻细胞表面或被藻细胞吸收。而另有研究表明当铜浓度大于5 000 μg·L−1时,Scenedesmus quadricauda受到显著抑制,其比生长速率从0.46降低到0.08[25]。由此可见,本研究中铜绿微囊藻经低压电场处理后,体系中还残留部分铜离子,一方面可催化细胞ROS生成导致发生氧化应激反应,破坏细胞抗氧化酶系统[26],另一方面铜离子被藻细胞吸收后可与细胞内的许多重要酶系发生作用,抑制其活性[27]。对于迟缓期铜绿微囊藻,较高电压下藻细胞的OD680-96 h抑制率高于较低电压,可能是由于提高电压后对藻细胞的电穿孔作用增强,且释放更多的铜离子,对藻细胞造成的损伤更强,这与较高电压下(1.0 V)受伤细胞比率大于较低电压(0.5 V)的结果一致。对数期是细胞生长最活跃的阶段,经过较高电压(1.0 V)和低流速(2 mL·min−1)处理后的藻细胞OD680-96 h抑制率仍可达到40%。由此可见,原位铜电离应用于抑制对数期藻细胞生长时效果更加稳定。
光合作用是藻细胞生长最重要的活动,最大量子产率Fv/Fm可表明PSII系统的活性,研究表明铜可以通过破坏PSII 中的电子传输来抑制光合作用[24,28]。如图6所示,经低流速铜电离处理后迟缓期藻细胞Fv/Fm值在72 h内均低于对照组,说明低流速下铜电离对迟缓期藻细胞的抑制效果可继续维持,这是由于低流速条件下残留在体系中的溶解铜含量更高,会对藻细胞产生生长抑制作用[15]。类似地,高电压低流速处理后对数期藻细胞Fv/Fm数值在48 h内从0.54降低到0.42,抑制率达到16%,这与藻细胞光密度抑制的结果相一致。稳定期Fv/Fm数值随时间推移降低,由此可见铜电离处理的抑制效果可在一段时间内得到保持。然而,对于衰亡期藻细胞,铜电离处理后反而表现出光合活性的提升,这与图2中处理后活细胞比例增加的结果一致。出现这种现象的原因可能在于,衰亡期藻细胞处于营养缺乏的状态,而体系中的铜离子作为微量元素,部分满足了细胞对矿物质的需求,暂时延缓了细胞的衰亡过程[29],从而表现出一定的生长促进效应。
-
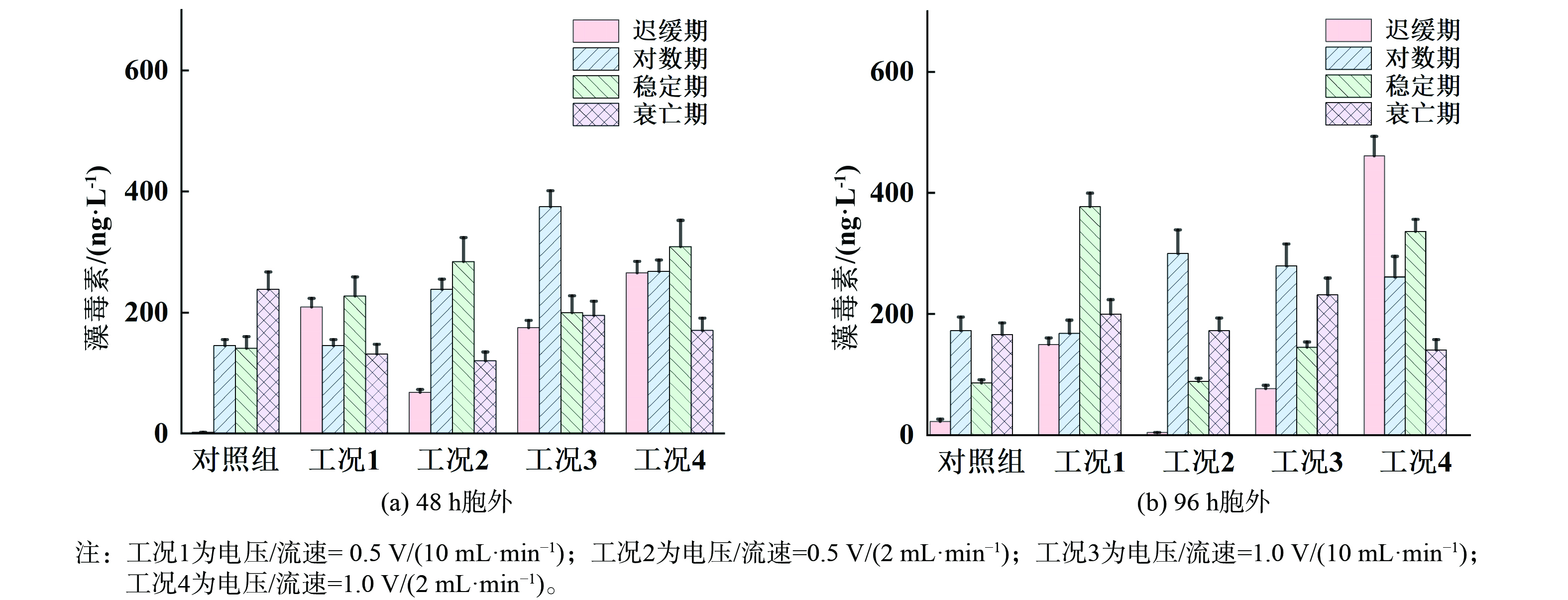
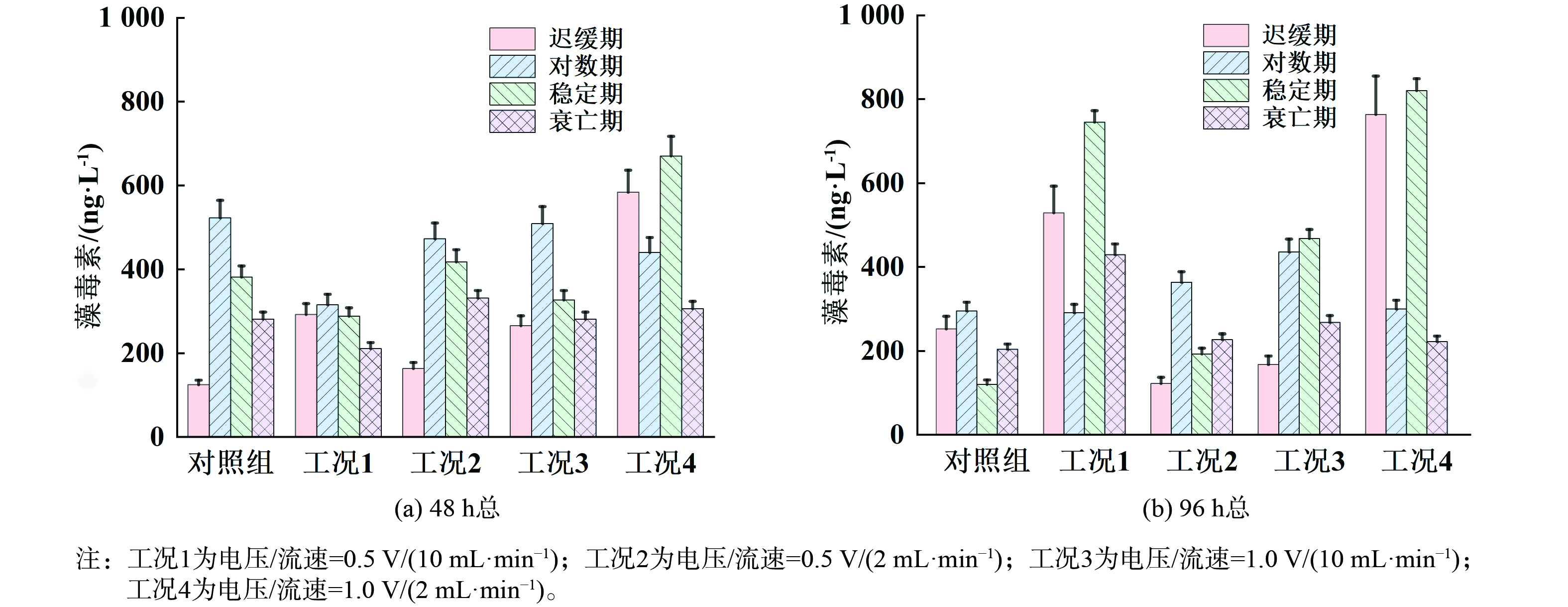
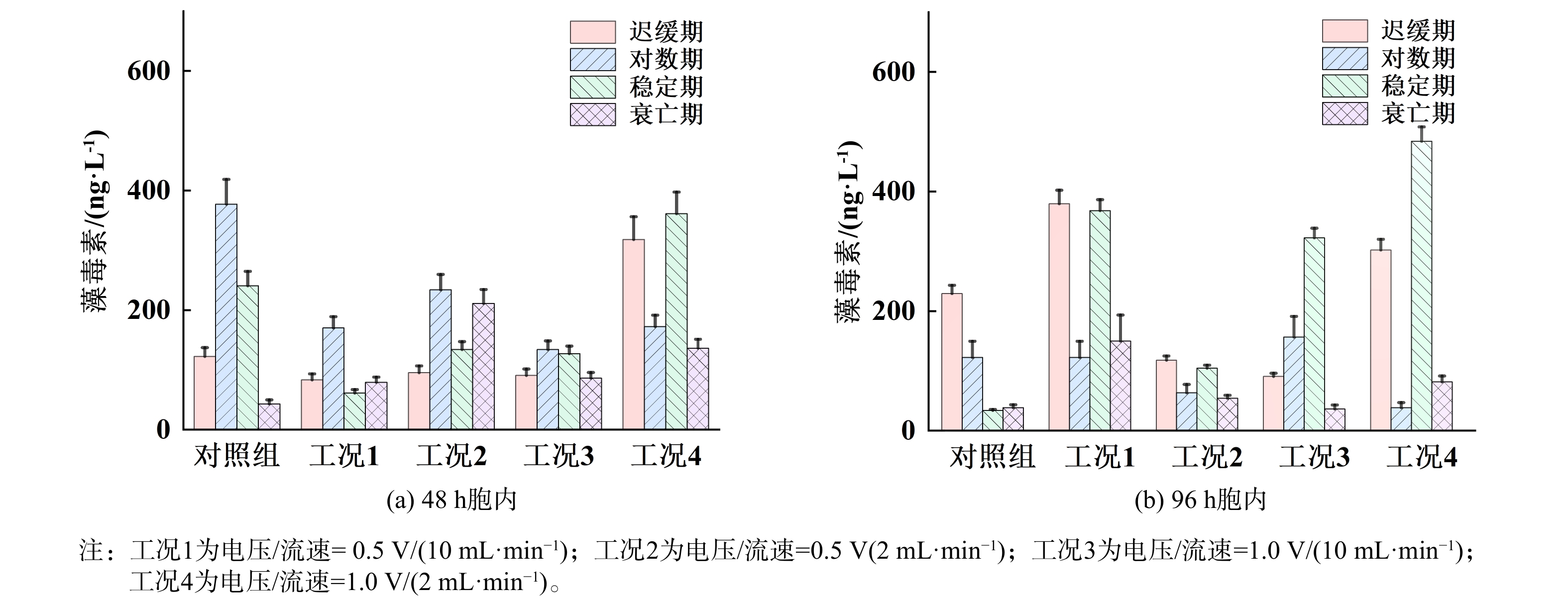
水华治理的目标不仅是灭活藻细胞,还需避免在处理过程中导致大量胞内藻毒素的释放。如果仅关注藻细胞的灭活而忽视胞内藻毒素释放,可能会加剧水体污染。了解不同处理条件下胞内、胞外藻毒素的分布情况,可以帮助选择最佳的处理参数,最大限度减少藻毒素释放。本研究测定了不同生长期铜绿微囊藻经原位铜电离处理后在48和96 h内胞外及胞内藻毒素的含量,分别如图7和8所示。对于迟缓期和稳定期来说,经高电压和低流速(1.0 V/(2 mL·min−1),工况4)处理后48 和96 h胞内和胞外藻毒素含量均有大幅增加,其中48 h内总藻毒素含量相比于对照组分别增大了3.83和0.63倍,96 h内总藻毒素含量分别增大了2.55和6.32倍(图9),说明该条件下虽然可取得较好藻细胞灭活效果,同时也增大了藻毒素释放的风险。但对于对数期来说,经铜电离处理后48 h胞内藻毒素含量均有所降低,尤其对于高电压和低流速,96 h胞内藻毒素含量仍低于对照组,这可能是由于铜离子在水中的浓度较高,并且作用时间较长。铜离子能够破坏藻细胞的细胞膜和细胞壁结构,抑制其正常的生理活动,特别是光合作用等代谢过程,这与图6对数期藻细胞Fv/Fm数值显著降低的结果相一致。同时有研究表明氯化作用可破坏膜完整性来灭活藻细胞,使用相同浓度的次氯酸钠杀灭不同生长期铜绿微囊藻时,稳定期细胞膜完整性损失的速率常数高于对数期,因此稳定期会释放更多的藻毒素[18,30]。由此可见,对数期胞内藻毒素含量降低一方面可能是由于细胞膜破损释放到胞外,这与胞外藻毒素含量增加的而结果相一致(图7)。另一方面,对数期是藻类细胞活跃增殖的阶段,此时细胞代谢旺盛,毒素的合成也较为迅速[18,31]。而由图9可知,对数期藻细胞48 和96 h的总微囊藻毒素的含量均相较于对照组有所降低,说明在铜电离的作用下,细胞发生氧化应激反应,代谢确实受到抑制,毒素合成速率降低,导致总藻毒素的含量显著下降。
2.1. 低能耗原位铜电离对不同生长期铜绿微囊藻细胞活性的影响
2.2. 低能耗原位铜电离对不同生长期铜绿微囊藻细胞氧化应激水平的影响
2.3. 低能耗原位铜电离处理后不同生长期铜绿微囊藻细胞再生长状态分析
2.4. 低能耗原位铜电离处理后不同生长期微囊藻毒素释放风险分析
-
1)低能耗原位铜电离系统对于迟缓期和对数期铜绿微囊藻最佳灭活效果的电压和流速为1.0 V和2 mL·min−1,此时藻细胞具有较高的CAT、SOD活性以及MDA水平,受到了较强的氧化应激和膜损伤,会增大藻毒素释放风险。
2)对于稳定期达到最佳灭活效果的条件为电压1.0 V和流速10 mL·min−1,而衰亡期藻细胞经铜电离处理后表现出生长促进效应,且Fv/Fm值高于对照组,光合活性有所提升。但由于细胞代谢减弱,铜电离系统中电压和流速的变化对细胞氧化应激的影响较为有限。
3)经高电压和低流速条件(1.0 V/(2 mL·min−1))的铜电离处理后,对数期藻细胞OD680-96 h抑制率可达到40%,同时可有效抑制对数期藻细胞的代谢活性和藻毒素合成,可实现高效藻细胞灭活的同时降低藻毒素释放的风险。



 下载:
下载: