-
磷作为一种不可再生资源,其单向循环更加剧了磷资源的短缺问题[1],DANA等[2]预测2030年将达到磷产量的高峰,地球上的磷矿资源将在50~60 a内消耗殆尽。此外,有研究[3]表明,水体中磷质量浓度达到0.01~0.02 mg·L−1即可发生水体富营养化[4],而城市生活污水处理厂磷排放是地表水体中磷污染的主要来源之一。因此,污水中磷的去除和资源化回收已经成为资源与环境领域的研究热点。
目前,较为常见的除磷技术有混凝技术、沉淀技术和吸附技术[5]。其中,吸附技术因能耗低、环境友好、经济高效、磷资源可回收而被广泛应用于磷资源的回收处理[6-8]。在众多吸附材料中,La、Ce等稀土金属元素因选择性高、吸附能力强、稳定性好、无毒害作用而成为除磷功能材料[9],其中Ce是储量最丰富的稀土元素,不仅在强酸强碱环境下很有强的稳定性,而且在水洗过程中不易洗脱[10-11]。HE等[12]研究发现,Ce(Ⅲ)溶于水会发生水解反应,产生大量OH−,从而增强与PO43−的配体交换作用。此外,Ce掺杂的二元金属材料也被用于PO43−-P的吸附研究[10, 13-14]。SU等[10]通过调配Ce/Zr比,制备了一系列Ce-Zr二氧化物纳米吸附剂,发现Ce0.8Zr0.2O2对PO43−-P的吸附量高达112.23 mg·g−1,且吸附后的PO43−极易被NaOH脱附,但纯金属氧化物合成的纳米材料在水中分离较困难。目前,Ce-Zr双金属吸附剂的研究较少,且大部分都集中于纯氧化物的合成,相对而言以载体负载形式的Ce基吸附剂的合成很少。研究表明[15],载体的加入不仅可以减少金属氧化物的消耗,也可以为PO43−-P提供更多的活性位点,增强吸附剂的吸附能力。因此,有必要对负载载体的Ce-Zr双金属吸附剂进行除磷研究。
本研究采用溶剂热法,制备了Ce-Zr双金属负载污泥基生物炭材料(SZCCO),研究了SZCCO吸附PO43−-P的吸附等温线、吸附动力学、影响因素,探讨了吸附饱和后SZCCO的再生和重复利用性能以及动态吸附过程,并通过比较吸附前后SZCCO的形貌、晶相结构和元素形态的变化揭示了SZCCO吸附除磷的机制。
-
本研究所用污泥基生物炭是北京市某污水处理厂剩余污泥高温炭化制备而成的。ZrCl4、(CH2OH)2购于上海阿拉丁生化科技有限公司,CeCl3购于上海麦克林生化科技有限公司,PEG2000、无水CH3COONa、CH4N2O、NaOH、HCl、NaCl、无水C2H5OH、KH2PO4、C8H4K2O12Sb2、C6H8O6、(NH4)6Mo7O24·4H2O、KCl、KHCO3、KNO3、K2SO4、HA均购于国药集团化学试剂有限公司,所有试剂均为分析纯。
除动态实验外,其他实验均采用补充磷的去离子水进行。动态实验中所用的实际水样是以北京市某污水处理厂二沉池出水为基础按如下程序配制的:将二沉池出水采集后1 h内运至实验室(组成和性质如表1所示)后,通过定性滤纸进行过滤处理,然后添加KH2PO4使得PO43−-P浓度为5 mg·L−1,并存放于4 ℃的冰箱中备用。
-
SZCCO的制备流程如下:称取一定量的无水CeCl3和ZrCl4,加入60 mL (CH2OH)2中进行超声溶解,然后往该溶液中依次加入3.6 g无水CH3COONa (螯合剂)、0.5 g CH4N2O (沉淀剂)、1 g PEG2 000 (分散剂)、0.5 g污泥基生物炭(载体),将搅拌均匀的混合液密封于100 mL反应釜中,于180 ℃下反应12 h,冷却至室温,开盖取出水热合成的产物,除去表层未负载到污泥基生物炭上的金属及其氧化物,剩余产物使用纯水和乙醇洗涤五次后进行冷冻干燥,将干燥后的产物研磨至粉末备用。
-
静态吸附实验中,SZCCO的投加量均为0.3 g·L−1;除pH影响实验外,含PO43−-P水样的初始pH均采用0.1 mol·L−1 HCl或0.1 mol·L−1 NaOH溶液调至7.0±0.1;除动力学实验外的其他吸附实验时间均为24 h。所有吸附后的水样测定前均经过0.45 μm滤膜过滤,然后存放于4 ℃下待测。
吸附等温线实验是将0.3 g·L−1的SZCCO分别投加到50 mL初始PO43−-P质量浓度范围为0~100 mg·L−1的系列溶液中进行吸附;吸附动力学实验是将0.3 g·L−1的SZCCO投加到1 L初始PO43−-P质量浓度为50 mg·L−1的溶液中,固定时间间隔采集上清液进行测定;在pH影响实验中,采用0.1 mol·L−1 HCl或0.1 mol·L−1 NaOH溶液分别调节PO43−-P水样的初始pH 2~11,吸附平衡后分别测定上清液中PO43−-P的浓度和pH;共存物质影响是将Cl–、NO3–、SO42−、HCO3−、溶解性有机物腐殖酸(HA)的浓度均设定10、50和100 mg·L−1 3个浓度梯度,PO43−-P的质量浓度为2 mg·L−1,吸附平衡后,测定上清液中PO43−-P的浓度;SZCCO的循环吸附程序如下,将0.3 g·L−1的SZCCO投加到1 L二沉池出水配水中,吸附12 h后,将吸附饱和的SZCCO离心分离、水洗烘干,然后通过分别比较1.5 mol·L−1 NaOH和0.5 mol·L−1 NaCl、Na2CO3、NaHCO3混合物作为再生液的脱附率,采用最适合的再生液进对吸附饱和的SZCCO进行脱附再生,再生12 h后将SZCCO分离取出、水洗干燥进行下一次吸附/脱附实验,整个过程循环5次。
-
往直径15 mm、高150 mm的磨砂玻璃吸附柱中填充0.6 g (2.92 cm3) SZCCO建立除磷动态吸附柱,上端进水、下端出水,流速为0.8 mL·min−1,空床接触时间(Empty Bed Contact Time, EBCT)为3.65 min,穿透值设定为0.1 mg·L−1。穿透实验结束后,将吸附柱中的SZCCO取出,进行脱附再生,完成后重新填充吸附柱进行动态吸附。
-
本实验均重复3次。所有数据均通过OriginPro 2018C计算平均值和标准偏差。单位质量SZCCO对PO43−-P的吸附量根据式(1)进行计算。
式中:q为磷吸附量,mg·g−1;C0和C为初始磷和最终磷的质量浓度,mg·L−1;V为吸附液体积,L;m为SZCCO的质量,g。
采用Langmuir(式(2))和Freundlich(式(3))模型进行吸附等温线的拟合。采用准一级(式(4))、准二级(式(5))动力学模型和Weber-Morris颗粒内扩散模型(式(6))进行吸附动力学的模拟。
式中:qe为达到吸附平衡时的吸附量,mg·g−1;qm为最大吸附量,mg·g−1;KL 为Langmuir模型的吸附常数,L·mg−1;KF 为Freundlich模型的吸附常数,(mg·g−1)·(mg·L−1)−n;Ce为平衡是水样中磷的浓度,mg·g−1;n为Freundlich吸附模型的指数。
式中:qt 为t时刻的吸附量,mg·g−1;t为吸附过程的时间,min;k1 为准一级动力学方程的速率常数,min−1;k2为准二级动力学方程的速率常数,g∙(mg·h)−1;kd为Weber-Morris颗粒内扩散模型的速率常数,mg·g−1·min0.5;t0.5为时间的0.5次幂,min0.5;C为与吸附边界层厚度有关的常数。
-
利用钼酸铵分光光度法对水样中的磷含量进行测定;使用X射线衍射仪(XRD,Bruker D8 ADVANCE,美国)表征SZCCO吸附前后及再生材料物相组成和结构;通过场发射扫描电子显微镜(SEM-EDS,SU8 010,日本)观察吸附剂和污泥基生物炭表面形貌结构;采用Zeta电位测量仪(Nano Z,英国)对材料进行Zeta电位分析;通过激光粒度仪(Mastersizer 3 000,Malvern,英国)测定SZCCO和污泥基生物炭的粒径;利用全自动比表面积及孔隙度分析仪(BET,Micromeritics ASAP 2 460,美国)测定吸附剂和污泥基生物炭的比表面积和孔径;通过傅里叶变换红外光谱仪(FTIR,Vertex 70,Bruker)表征SZCCO吸磷前后的官能团和键态结构变化;通过X光电子能谱仪(XPS,Thermo Fisher Scientific Nexsa G2,美国)对SZCCO吸磷前后元素组成、含量以及形态的变化进行表征。
-
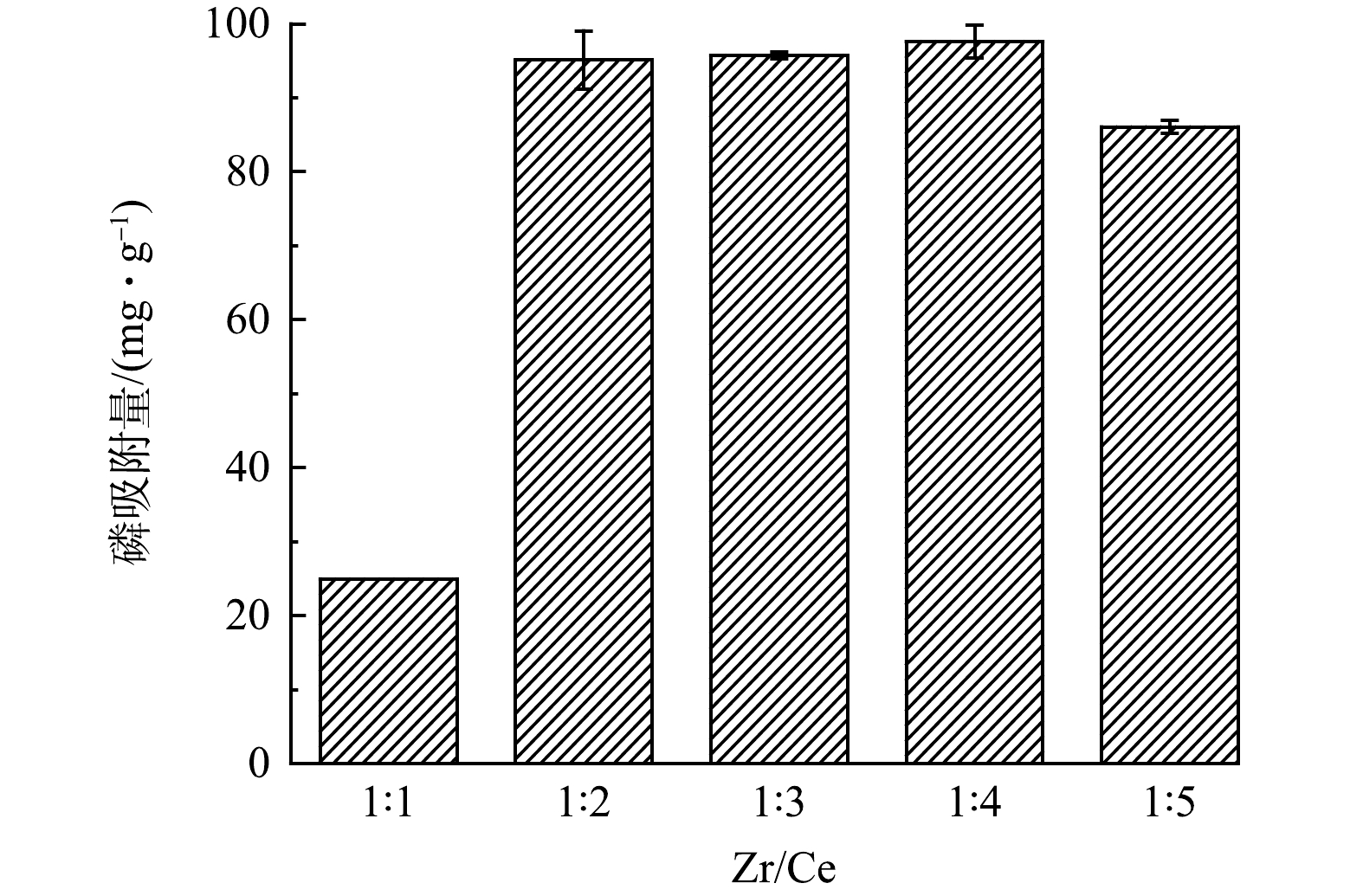
ZHANG等[16]研究表明,双金属吸附剂中金属氧化物负载量对吸附PO43−-P起到关键作用。Ce和Zr可以形成二元氧化物CexZr1-xO2,其中Ce含量的变化会导致其产物结构、表面积和稳定性的差异[10]。因此,在制备SZCCO的过程中,固定制备体系中ZrCl4的量为5 mmol,改变CeCl3的量,使Zr与Ce的摩尔比依次为1﹕1、1﹕2、1﹕3、1﹕4、1﹕5,2种金属在制备体系中总摩尔浓度依次为0.1、0.15、0.2、0.25、0.3 mol·L−1。图1为制备溶液中不同Zr/Ce比下SZCCO对PO43−-P吸附量的变化。当Zr与Ce的比值从1﹕1增加到1﹕2,吸附量大幅提高,随着Zr/Ce比进一步增加到1﹕4,PO43−-P吸附量略有提高,但变化不显著,但Zr/Ce比增加到1﹕5时,SZCCO对PO43−-P的吸附量呈现明显下降的趋势。LI等[17]的研究表明,镧氢氧化物(La(OH)3)在纤维素水凝胶表面的分散性对纤维素阳离子水凝胶(CCH@La)的PO43−-P吸附容量影响很大,高分散导致吸附活性位点的增加,分散性低会引起功能金属化合物在载体表面的聚集,降低吸附活性位点。因此,SZCCO制备体系中Ce质量的持续增加会导致生物炭单位表面上Ce化合物负载量的增加,到一定程度后(Zr/Ce比=1∶5)会产生聚集现象,降低吸附PO43−-P的活性位点。因此,后续实验选择Zr与Ce含量分别为5 mmol和10 mmol(1∶2)的制备体系下生成的SZCCO,其PO43−-P吸附量可达93.78 mg·g−1。
-
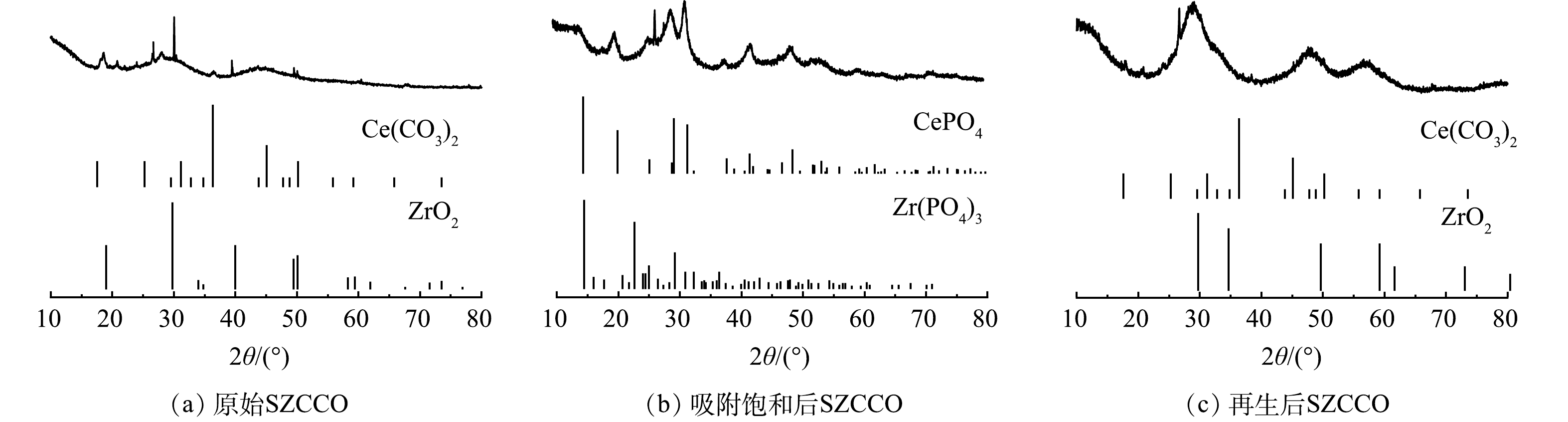
图2为SZCCO吸附PO43−-P前后及再生的XRD图。其中,图2(a)~(c)分别为原始SZCCO、吸附PO43−-P后SZCCO和再生后SZCCO的XRD图谱。如图2(a)所示,在以20°、30°、40°和50°为中心出现的宽峰为ZrO2,表明SZCCO中存在大量ZrO2成分;在衍射峰为17°、24°、29°、34°、41°出现的尖峰与标准的立方晶型Ce(CO3)2相匹配,这也与WANG等[18]的研究结果一致。以上结果表明,SZCCO为Ce(CO3)2—ZrO2双金属负载污泥基生物炭材料。
材料的基本性质如表2所示,SZCCO的比表面积、孔径和孔体积较污泥基生物炭提升较大,这也与文献中结果一致[17, 19],结合污泥基生物炭和SZCCO的SEM图谱(图3(a)~(c))可以看出,污泥基生物炭表面较平整、无裂痕,但SZCCO表面形成了明显的片状结构,这使得SZCCO的比表面积增加,提供的活性位点数量也随之增加[20]。此外,由SZCCO的EDS能谱(图3(d)~(g))可以看出,Zr、Ce在污泥基生物炭表面成功负载且均匀分布。
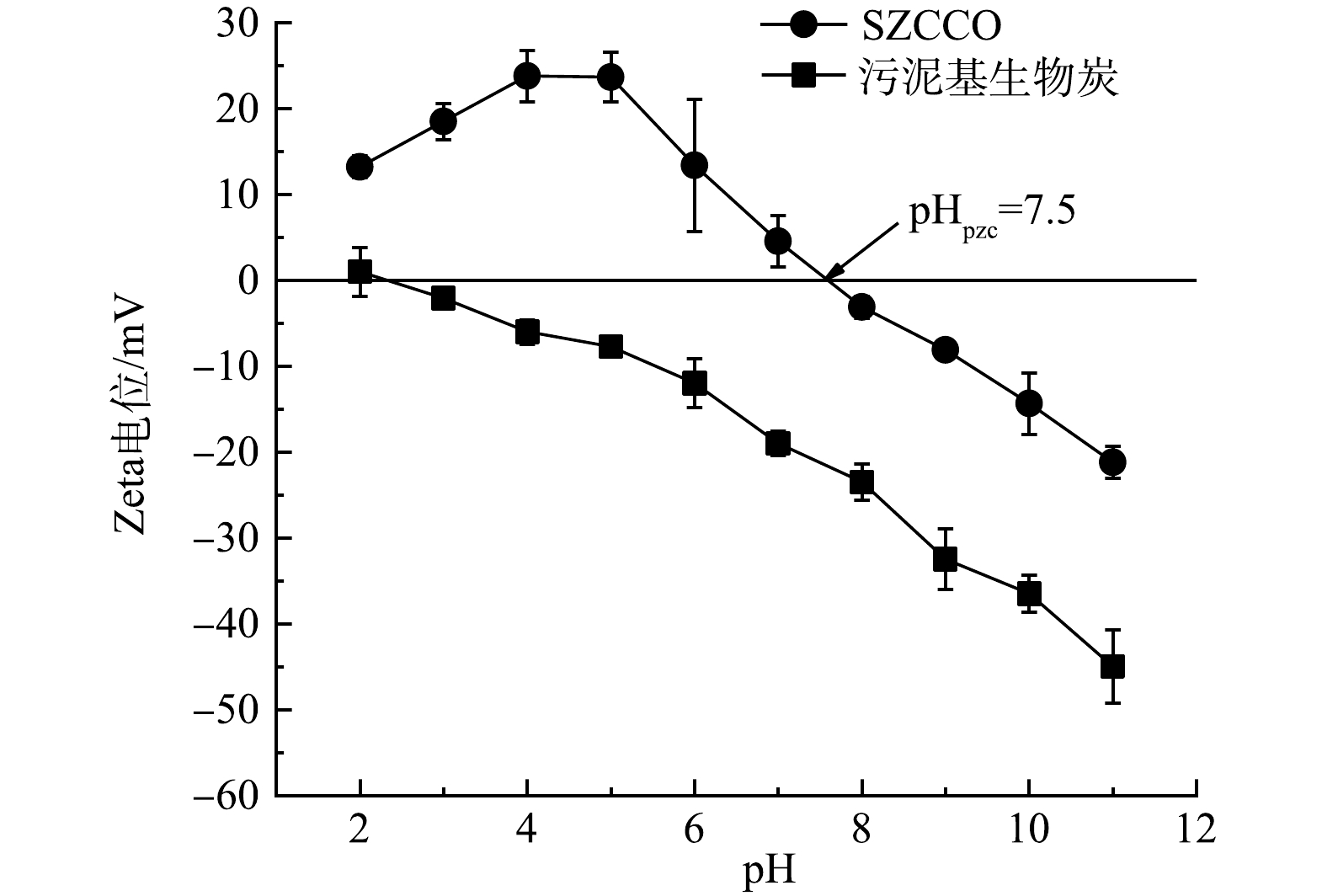
污泥基生物炭和SZCCO的Zeta电位图如图4所示。SZCCO的等电点(pHpzc)为7.5,表明pH<7.5时,SZCCO表面带正电荷,可以以静电作用吸附PO43−-P,当pH>7.5时,SZCCO表面带负电荷,与PO43−-P之间发生静电排斥,不利于吸附。对比污泥基生物炭的Zeta电位图可以看出,Zr和Ce的加入使得材料表面正电荷增多,吸附性能增强,这也与其他污泥基生物炭改性前后的结果一致[21]。
-
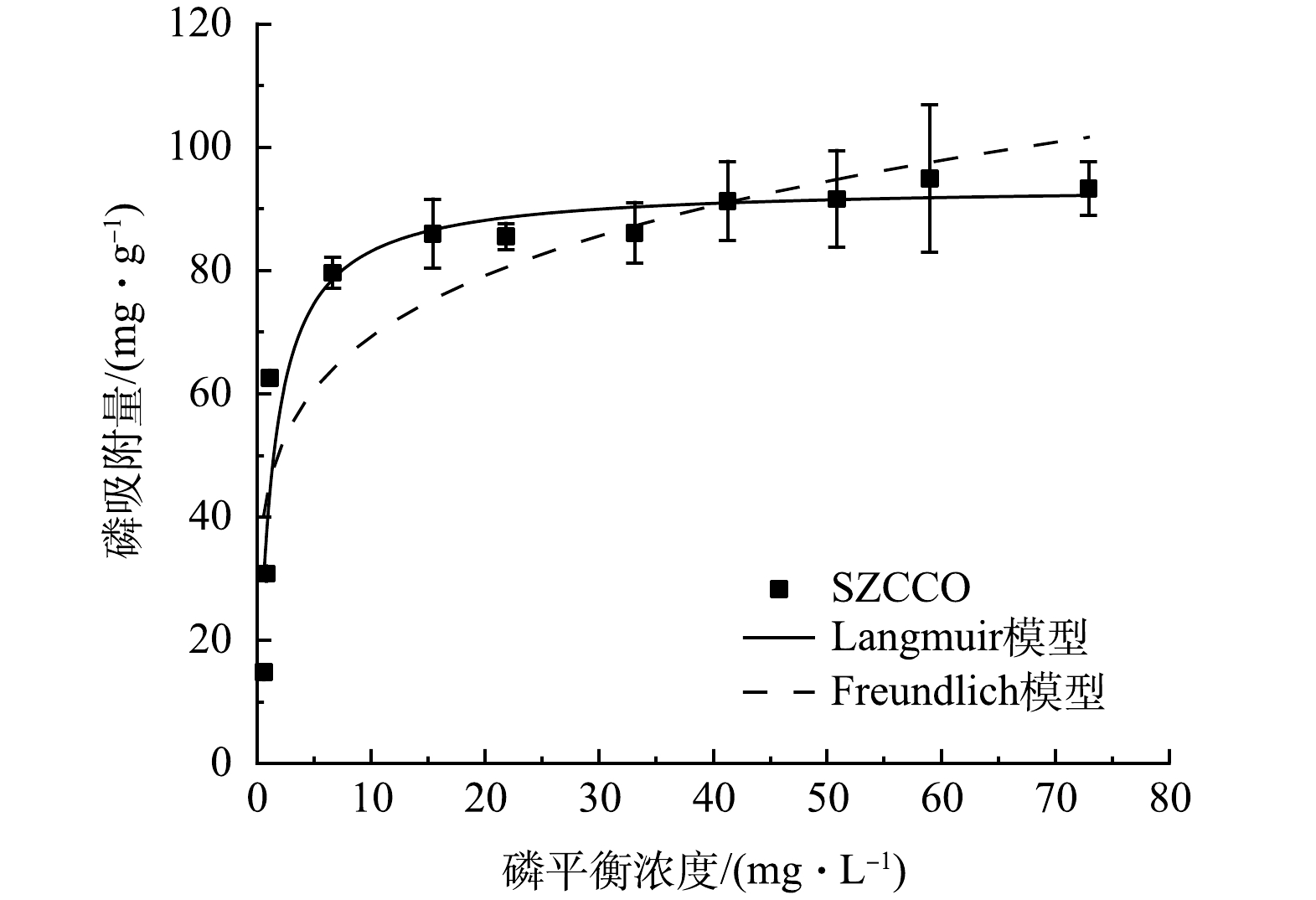
1)吸附等温线。图5为SZCCO的吸附等温线。如图5所示,随着磷平衡浓度的增加,SZCCO对PO43−-P的吸附量迅速提升,当磷平衡质量浓度超过15 mg·L−1时,SZCCO的吸附量逐渐趋于平缓。采用Langmuir模型和Freundlich模型对吸附等温线数据进行拟合,相关拟合结果如表3所示,Langmuir的拟合系数(R2=0.90)大于Freundlich的拟合系数(R2 =0.77),表明Langmuir吸附等温模型更适合SZCCO对PO43−-P的吸附过程,因此,该过程可用单层均相吸附模型模拟[22],其饱和吸附量为93.78 mg·g−1。
2)吸附动力学。图6为SZCCO的吸附动力学曲线。如图6(a)所示,SZCCO对PO43−-P的吸附量在4 h内急剧增加,其中,在吸附时间为50、100、150和200 min时,其吸附量分别可达到饱和吸附量的60.22%、73.12%、84.41%和90.65%。当吸附10 h后,SZCCO对PO43−-P的吸附量变化趋势逐渐平缓。采用准一级模型、准二级模型和Weber-Morris颗粒内扩散模型对SZCCO吸附PO43−-P的动力学进行拟合,拟合结果如表4所示。准二级动力学模型(R2=0.99)比准一级动力学模型(R2=0.97)更符合实际的动力学过程,说明吸附过程以化学吸附为主。Weber-Morris颗粒内扩散模型的拟合结果进一步解释了吸附的速率控制因素。如图6(b)所示,SZCCO对PO43−-P的吸附过程可分为3个阶段:第1阶段PO43−-P通过边界层扩散到SZCCO表面,这一阶段吸附速率最快;第2阶段PO43−-P进入SZCCO内部被吸附,这一阶段的吸附速率小于第1阶段,主要是由于表面吸附位点减少以及静电斥力和内部传质阻力的增大;第3阶段SZCCO对PO43−-P的吸附速率最慢,这是由于吸附位点逐渐达到饱和。3个阶段直线的截距均不为0,表明该吸附过程为颗粒内扩散和液膜扩散共同主导。
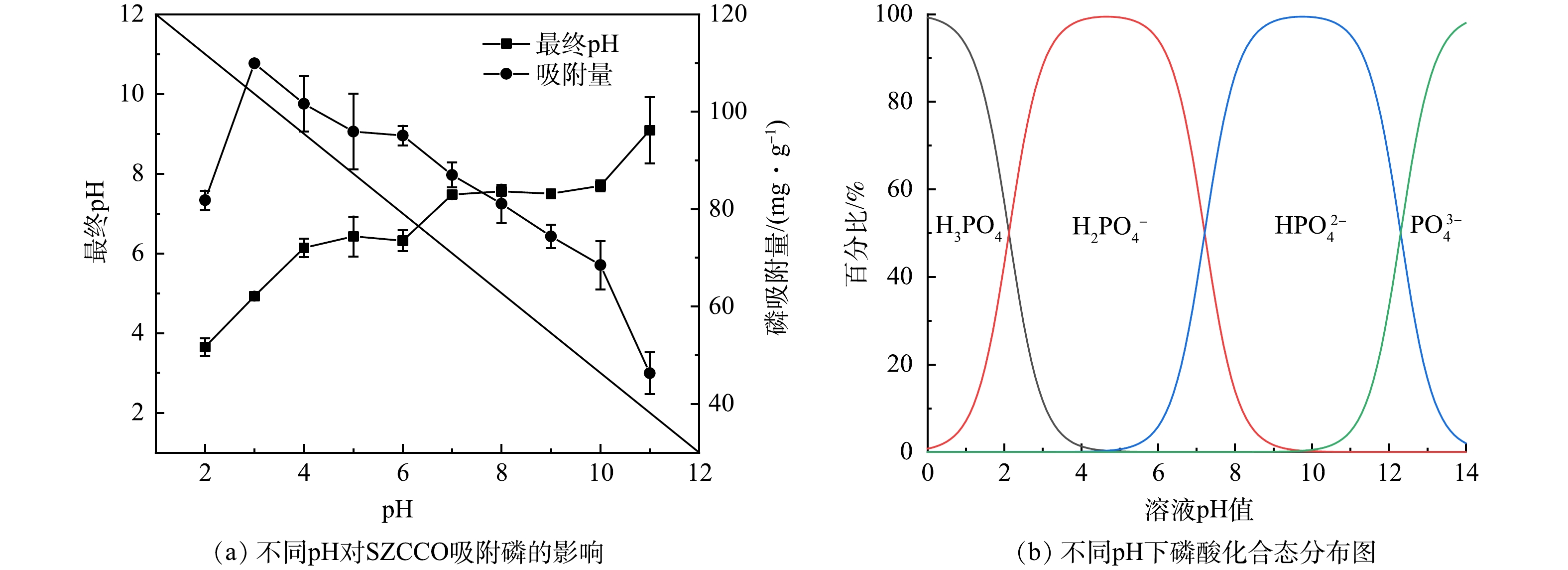
3) pH的影响。pH对水—固界面的物理化学相互作用有重要影响[23]。图7为不同pH对SZCCO吸附PO43−-P的影响及磷酸根的分布图。如图7(a)所示,在pH=3.0时,SZCCO对PO43−-P的吸附量达到最大值,为109.91 mg·g−1。当pH进一步增加到7.0时,SZCCO的吸附量下降至87.00 mg·g−1。随着pH增加至碱性(8.0~11.0),SZCCO的吸附量呈近似线性下降趋势,最终降至46.29 mg·g−1。这种变化趋势与SZCCO的Zeta电位变化趋势一致(图4)。
如图7(b)所示,pH=2.0时,H3PO4是磷酸盐存在的主要形态,尽管此时SZCCO上的—OH基团被质子化,但与H3PO4无法发生静电吸附,而且SZCCO上功能金属的溶解释放会降低其吸附量,因此,吸附量处于较低水平。随着pH由2.0增加到3.0,磷酸根以H2PO4−为主,在SZCCO质子化基团与H2PO4−的静电吸引作用以及表—OH与H2PO4−配体下,磷吸附量提升至最高,此时,溶液pH提高也表明SZCCO表面—OH与H2PO4−配体交换后释放到水溶液中[24]。在pH=4.0~7.0内,HPO42−、H2PO4−共存,SZCCO表面的CO32−与溶液中H+结合,PO43−-P吸附由静电作用和配体交换两种作用主导,但Zeta电位的下降导致这一阶段吸附量有所下降,这一阶段pH的升高一方面是由于—OH与PO43−-P配体交换释放到水溶液中,另一方面是由于配体交换产生的CO32−与溶液中的H+结合生成HCO3−,导致了H+减少。随着pH进一步升高,溶液变为碱性,SZCCO表面呈现负电性(图4),此时OH−与PO43−所占比例逐渐增加,由于静电排斥和OH−的竞争,磷吸附量进一步下降,当pH升高至11.0时,静电排斥以及OH−的竞争十分显著,磷吸附量急剧下降。但此时CO32−与PO43−之间仍可以进行配体交换,同时,SZCCO表面Ce、Zr与PO43−-P之间的lewis酸碱作用也可以部分抵消其吸附量的下降[25]。这一阶段溶液中pH降低的主要原因是OH−与PO43−竞争吸附位点,导致OH−减少[26]。
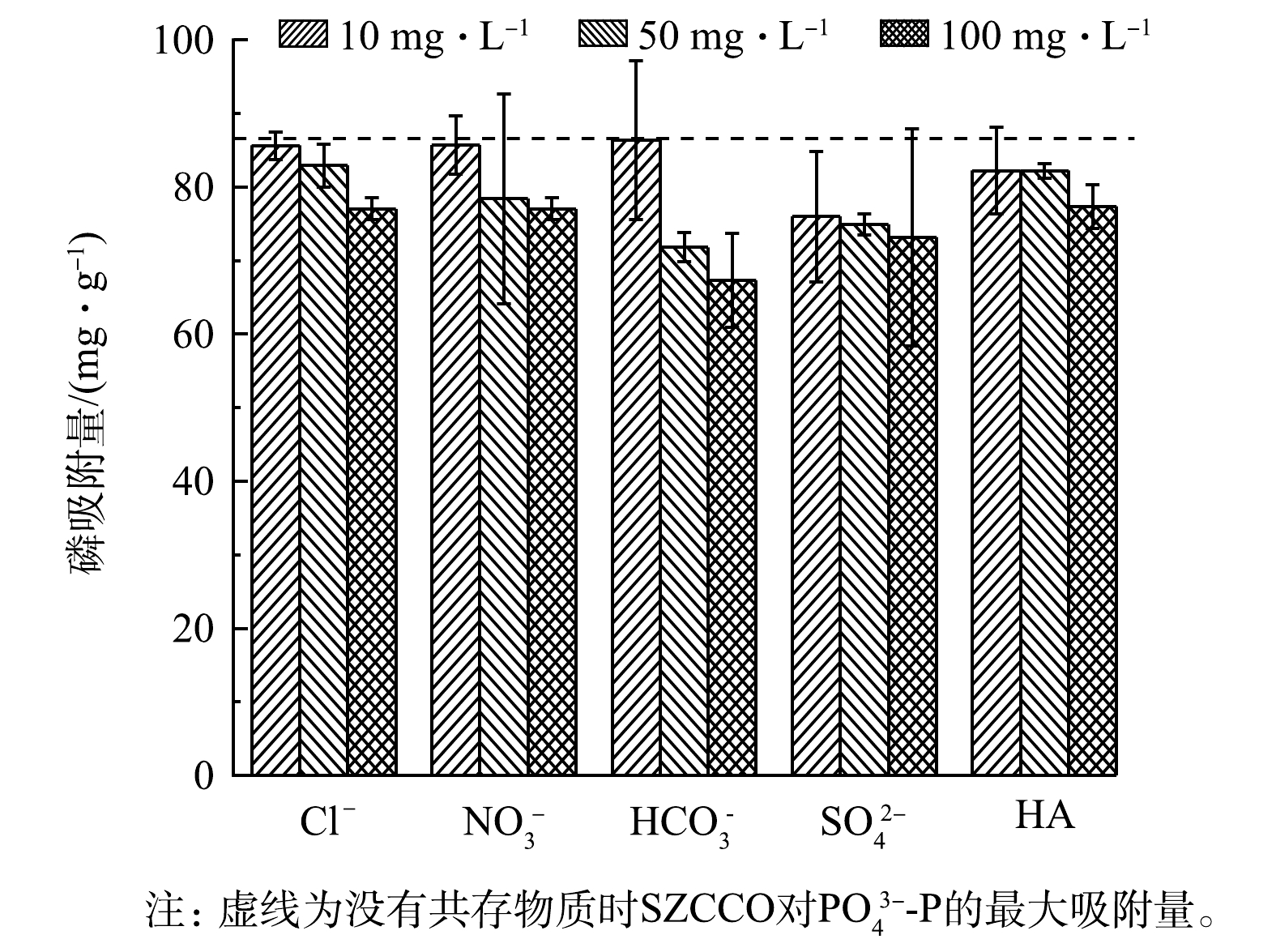
4)共存物质的影响。共存物质对SZCCO吸附PO43−-P影响的结果如图8所示。可见,高浓度的Cl−、NO3−、HCO3−、HA和三种浓度的SO42−均会对SZCCO吸附PO43−-P产生抑制作用。其中,Cl−和NO3−在静电作用下会与材料表面基团形成外表面络合物[27],与PO43−-P竞争吸附位点,导致吸附量下降。HCO3−会水解产生OH−,不仅与PO43−-P竞争吸附位点,也会使溶液pH升高,不利于PO43−-P的吸附,此外,HCO3−的存在也会改变SZCCO表面CO32−的解离平衡,进而影响其与PO43−-P的配体交换作用[19]。SO42−带2个负电荷,相较于带1个负电荷的H2PO4−,与SZCCO之间的静电作用更为显著;另一方面,SO42−的离子半径(0.230 nm)与H2PO4−的离子半径(0.238 nm)接近,更容易与H2PO4−竞争活性位点[28]。HA是芳香族化合物,表面有很多带负电的官能团,会与PO43−-P竞争吸附位点[29],同时HA也会与金属形成络合物降低PO43−-P的吸附[30]。
5)再生与重复利用。再生能力是评价吸附剂质量的重要因素,因此,本实验采用1.5 mol·L−1 NaOH分别和0.5 mol·L−1 NaCl、Na2CO3和NaHCO3组合成混合液作为再生液对吸附饱和的SZCCO进行脱附再生,其中使用NaOH+NaCl、NaOH+Na2CO3和NaOH+NaHCO3作为再生液的脱附率分别为88.33%、90.47%和96.50%。可见,采用1.5 mol·L−1 NaOH和0.5 mol·L−1 NaHCO3再生液的脱附效果最好。
图9为SZCCO对低浓度磷废水(5 mg·L−1)的多次吸附/再生效果图。如图9所示,在5次吸附/再生循环中,SZCCO对PO43−-P的吸附量和使用1.5 mol·L−1 NaOH和0.5 mol·L−1 NaHCO3再生液进行解吸的脱附率分别为93.48、91.84、89.73、88.50、89.42 mg·g−1和96.50%、93.00%、92.42%、93.14%、91.22%。结果表明,SZCCO经过5次再生与重复利用,SZCCO对PO43−-P的吸附量略有下降,但依然保持在初始吸附量的95%左右,表现出良好的吸附再生性能,证明了SZCCO在工程应用上具有很好的实用性。
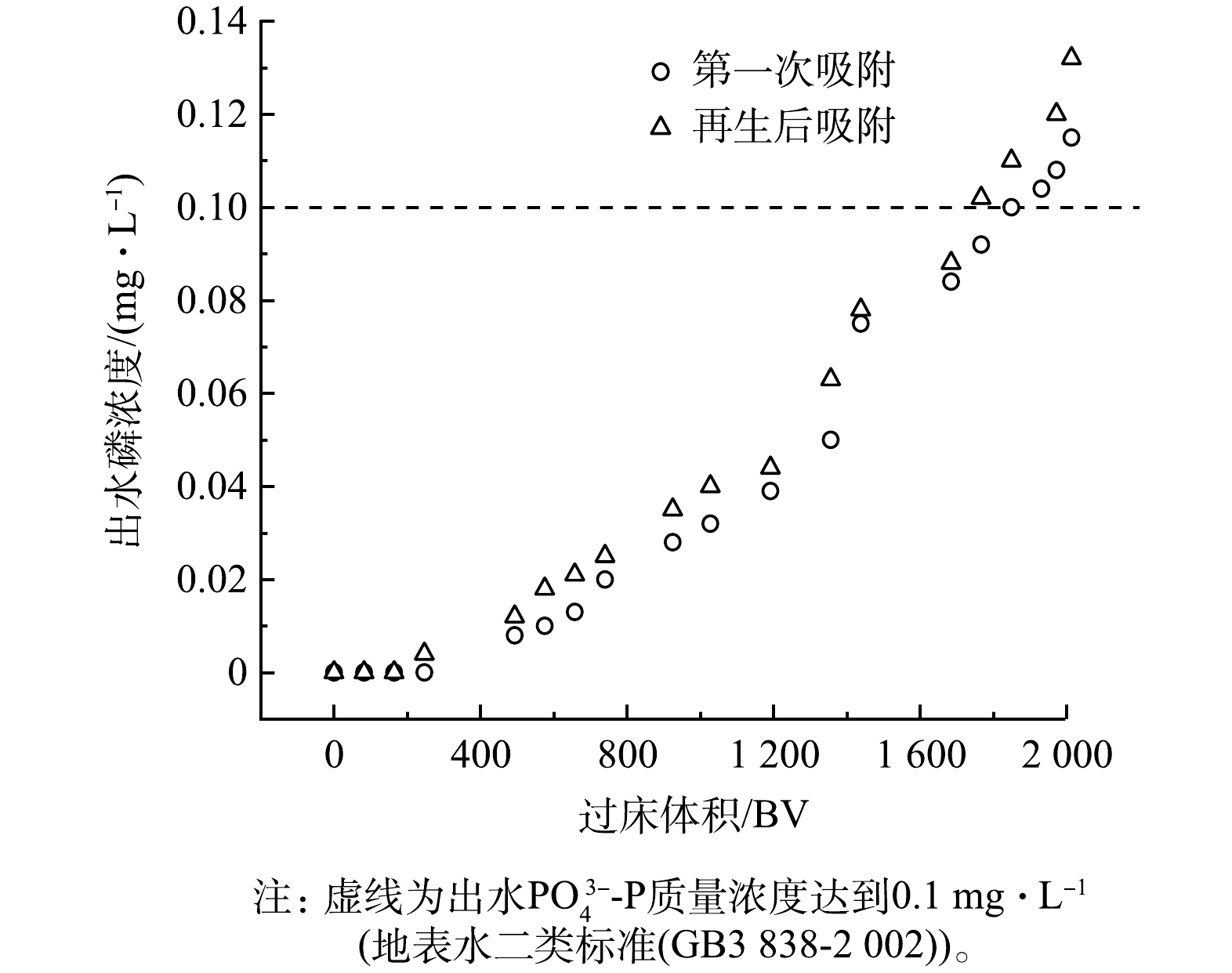
6) SZCCO吸附柱的动态运行。在含Cl−、SO42−、NO3−、HCO3−、HA等竞争离子的5 mg·L−1的磷溶液中进行动态吸附柱实验。SZCCO的吸附穿透曲线如图10所示,SZCCO第1次吸附的穿透体积为1 849 BV,动态吸附量为44.99 mg·g−1,吸附后的SZCCO在再生液中脱附12 h后,再次进行穿透实验,其穿透体积较第一次吸附略有下降,但仍稳定在1 767 BV(43.00 mg·g−1)。因此,SZCCO是一种有效且稳定的除磷吸附剂,具有潜在的实际应用价值。
-
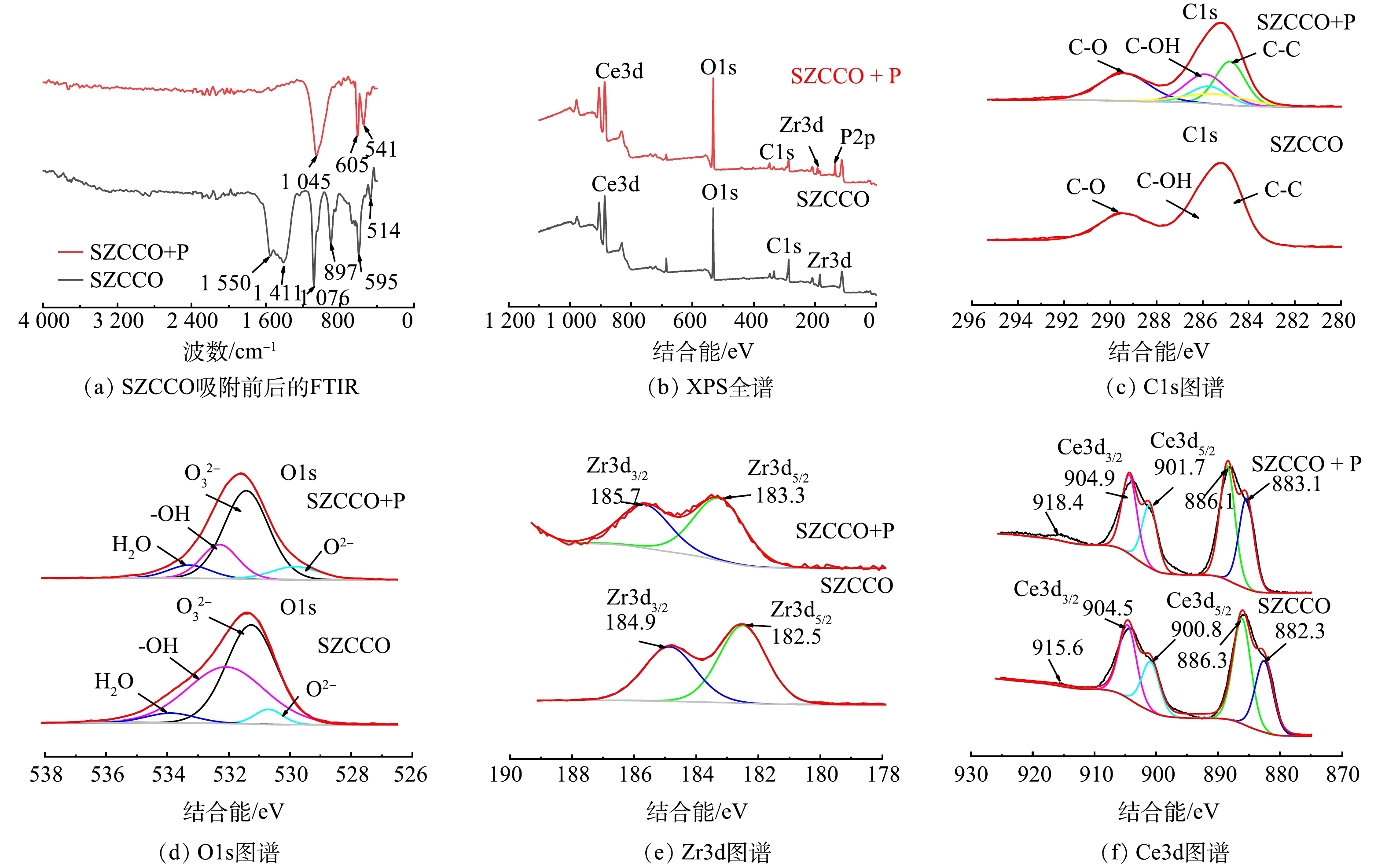
由吸附PO43−-P后SZCCO的XRD图谱(图2(b))分析可知,其衍射峰在20°、30°、40°、50°出现的尖峰与CePO4和Zr(PO3)4的标准图谱相匹配,表明PO43−成功吸附到SZCCO表面。此外,原始SZCCO的等电点(pHpzc)为7.5,吸附PO43−-P后SZCCO在pH=7.5时的Zeta电位为−10.68 mV,该Zeta电位的下降应该是PO43−-P吸附到SZCCO表面导致的。
此外,由SZCCO的FTIR光谱(图11(a))所示,吸附前,在1 550 cm−1、1 411 cm−1出现的吸附峰分别来自污泥基生物炭中醛基(—COH)或酮基(—COR')的C=O伸缩振动[31],1 076 cm−1和897 cm−1处的对称收缩峰是污泥基生物炭中CO32−(C—O和C=O)的弯曲振动峰[32],595 cm−1和514 cm−1处的吸收峰属于Ce—O键和Zr—O键的特征峰[33-34],表明生物炭表面负载了Ce、Zr金属氧化物形态或碳酸形态化合物。吸附PO43−-P后,1 550、1 411、1 076和897 cm−1处的C=O、C—O特征峰和595 cm−1和514 cm−1处的Ce—O、Zr—O特征峰均彻底消失,新出现的1 045、541和605 cm−1处的吸收峰均对应于P—O的拉伸振动[32, 35],表明PO43−-P与SZCCO表面的Ce、Zr的氧化物形态或CO32−形态发生了配体交换[36]。
为了进一步研究PO43−-P与SZCCO之间的相互作用,对SZCCO的XPS光谱进行了分析,吸附前后的全谱、C1s、O1s、Zr3d和Ce3d的精细谱图如图11(b)~(f)所示。其中,结合能在886、533、285和183 eV处的峰分别为Ce3d、O1s、C1s和Zr3d;吸附PO43−-P后的SZCCO,在134.7 eV处检测到P2p的特征峰,证实了SZCCO表面成功捕获了PO43−-P。由图11(c)所示,284.8 eV出现的最强峰代表C=C,表明SZCCO具有丰富的石墨化结构[26],位于285.9、288.5 eV处的峰代表了C—OH、C=O和—COO的峰,表明C与O的不同结合形式,这也与图11(d)基本一致。图11(d)中,吸附后,—OH和CO32−所占比例有所下降,这一现象也说明SZCCO表面—OH和CO32−与PO43−-P发生了配体交换作用。SZCCO吸附PO43−-P后,Ce和Zr的结合能向更高的位置偏移(图e~f),表明Zr、Ce均参与了吸附过程[37]。
再生后SZCCO的XRD图谱如图2(c)所示,其中CePO4和Zr(PO3)4的晶相消失,出现了Ce(CO3)2和ZrO2的晶相,这表明PO43−-P在SZCCO材料表面解吸。但再生后SZCCO的XRD图谱中ZrO2、Ce(CO3)2的特征峰比原始SZCCO的宽,相应的Ce(CO3)2和ZrO2的晶相趋向无定形结构;同时,再生后SZCCO在pHpzc=7.5时Zeta电位为0.158 mV,稍高于原始SZCCO等电点下的Zeta电位。
-
1)成功制备了Ce-Zr双金属负载污泥基生物炭SZCCO,其对水中PO43−-P的饱和吸附量为93.78 mg·g−1。吸附动力学符合准二级动力学模型,SZCCO在较宽的pH范围内呈现出良好的吸附性能,且常见的共存物质对其吸附均无较大影响。
2)经5次吸附-再生循环,SZCCO对PO43−-P的吸附量仍保持在初始吸附量的95%左右,表现出良好的吸附特性。
3) SZCCO吸附PO43−-P的主要机制是库伦吸引、材料表面—OH和CO32−与PO43−-P的配体交换。
Ce-Zr负载污泥基生物炭吸附水中PO43−的性能与机制
Performance and mechanism of PO43−-P adsorption in water on Ce-Zr loaded sludge-based biochar
-
摘要: 磷资源的短缺和含磷废水排放造成的水体富营养化是目前关注的热点问题。本研究采用溶剂热法制备出了以污泥基生物炭为载体、负载Ce-Zr双金属的吸附剂SZCCO ( Zr-Ce CO32− sludge-based biochar)。通过XRD、SEM、FTIR、XPS等对SZCCO进行了表征,探讨了SZCCO吸附PO43−-P的等温线、动力学、影响因素,解析了相应的吸附机制。结果表明,SZCCO吸附PO43−-P的等温线符合Langmuir的吸附等温线模型,拟合的饱和吸附量可达93.78 mg·g−1。吸附动力学曲线符合准二级动力学模型,表明该吸附过程主要为化学吸附。在pH为2.0~10.0时,SZCCO对PO43−-P的吸附量均保持在70 mg·g−1以上。Cl–、NO3–、SO42−、HCO3−、溶解性有机物腐殖酸(HA)等的共存对PO43−-P的吸附影响较小,表明SZCCO对PO43−-P具有良好的吸附选择性。经过5次吸附再生后,对PO43—P的吸附量仍保持在初始吸附量的95%左右,具有较强的重复利用性,利用XRD对再生后的SZCCO进行表征,结果表明再生产物为Ce(CO3)2和ZrO2。采用SZCCO为填料的吸附柱处理初始PO43−-P质量浓度为5 mg·L−1的二沉池出水的配水,穿透体积可达1 849 BV,动态吸附量为44.99 mg·g−1。吸附前后SZCCO的Zeta电位、FTIR和XPS图谱的变化分析结果表明SZCCO吸附PO43−-P的主要机制为静电作用、表面—OH和CO32−与PO43−-P之间的配体交换,配体交换产物为CePO4和Zr(PO3)4。
-
关键词:
- 污泥基生物炭 /
- Ce-Zr双金属负载 /
- PO43−-P /
- 静电作用 /
- 配体交换
Abstract: The shortage of phosphorus resources and the eutrophication caused by the discharge of wastewater containing phosphorus are the hot issues at present. In this study, a type of SZCCO adsorbent (Zr-Ce CO32− sludge-based biochar) was synthesized with sludge-based biochar as the carrier and Ce-Zr bimetallic loading by a solvothermal method. XRD(X-ray diffraction), SEM(Scanning Electron Microscope), FTIR(Fourier Transform Infrared Spectroscopy), XPS(X-ray Photoelectron Spectroscopy) and other advanced instruments were used to characterize the SZCCO. The isotherm, kinetics and influencing factors of PO43−-P adsorption on the SZCCO were studied, and the corresponding adsorption mechanism was analyzed. The results indicate that the isotherm models of SZCCO adsorption to PO43−-P conforms to Langmuir model, and the fitted maximum adsorption capacity can reach 93.78 mg·g−1. The adsorption kinetics curve conforms to the pseudo-second-order models, suggesting that PO43−-P adsorption on the SZCCO could be controlled by the chemical adsorption. Within the pH range of 2.0~10.0, the adsorption capacity remained above 70 mg·g−1.The coexistence of Cl−、NO3–、SO42−、HCO3− and humic acid (HA) has slight effect on the adsorption of PO43−-P, indicating that SZCCO has a good adsorption selectivity towards PO43−-P. After 5 cycles of adsorption regeneration, its adsorption capacity still remained around 95% of the initial adsorption capacity, indicating the strong reusability of SZCCO; the regenerated SZCCO was characterized by XRD, Ce(CO3)2 and ZrO2 occurred on it. The adsorption column with SZCCO as the packing material was used to treat the effluent of the secondary settling tank with the initial PO43−-P mass concentration of 5 mg·L−1, the penetration volume could reach~1849 BV, and the dynamic adsorption capacity was~44.99 mg·g−1. Compared with the Zeta potential, FTIR, and XPS spectra of SZCCO before and after adsorption, the main adsorption mechanism to PO43−-P is electrostatic interaction and ligand exchange between surface —OH and PO43—P or surface CO32− and PO43−-P, and the ligand exchange products are CePO4 and Zr(PO3)4.-
Key words:
- sludge-based biochar /
- Ce Zr bimetallic loading /
- PO43−-P /
- electrostatic interaction /
- ligand exchange
-

-
表 1 二沉池出水组成和性质
Table 1. Chemical composition and characteristics of the secondary effluent
COD/(mg·L−1) pH 温度/ ℃ 电导率/(μS·cm−1) PO43−/(mg·L−1) NO3−/(mg·L−1) TP/(mg·L−1) NH3-N/(mg·L−1) 5.4±1.3 7.32±0.26 15.1±2.9 895±315 0.04±0.005 16.3±3.9 0.1±0.05 0.01±0.004 Cl−/(mg·L−1) SO42−/(mg·L−1) Mg2+/(mg·L−1) Na+/(mg·L−1) K+/(mg·L−1) Ca2+/(mg·L−1) TN/(mg·L−1) 87.2±15.0 68.4±16.2 32.4±4.7 99.5±45.2 17.68±5.7 100.8±24 7.5±3.2 表 2 污泥基生物炭和SZCCO的基本性质
Table 2. Basic properties of sludge-based biochar and SZCCO
吸附剂 形貌 外观 BET比表面积/(m2·g−1) 孔径/nm 孔体积/(cm3·g−1) 粒径/μm 金属含量/(mg·g−1) 污泥基生物炭 粉末 黑色 69.07 10.66 0.24 91.56 — SZCCO 粉末 灰色 96.06 12.48 0.30 39.37 212.0 (Ce)
105.0 (Zr)表 3 SZCCO吸附等温线拟合参数
Table 3. Fitting parameters of SZCCO adsorption isotherm
Langmuir Freundlich qm/(mg·g−1) KL/(L·mg−1) RL2 KF/((mg·g−1)·(mg·L−1)−n) 1/n RF2 93.78 0.78 0.90 172.83 0.19 0.77 表 4 SZCCO吸附动力学拟合参数
Table 4. Fitting parameters of SZCCO adsorption kinetics
准一级动力学模型 准二级动力学模型 qe/(mg·g−1) k1/(min−1) R2 qe/(mg·g−1) k2/(g·(mg·h)−1) R2 93.86 6.18 0.97 99.50 0.50 0.99 Weber-Morris粒子内扩散模型 kp1/(mg·g−1·min0.5) R12 C1 kp2/(mg·g−1·min0.5) R22 C2 kp3/(mg·g−1·min0.5) R32 C3 0.44 0.80 26.33 0.41 0.98 73.85 0.0036 0.64 90.33 -
[1] 李小林, 王毅力. 载镧磁性水凝胶吸附剂对水中磷酸根的吸附性能研究, 2019中国环境科学学会科学技术年会论文集(第二卷)[C]. 中国环境科学学会, 西安, 2019. [2] CORDELL D, DRANGERT J, WHITE S. The story of phosphorus: Global food security and food for thought[J]. Global Environmental Change, 2009, 19(2): 292-305. doi: 10.1016/j.gloenvcha.2008.10.009 [3] 蒋松竹, 郭黎卿, 尹训飞, 等. 美国污水处理厂深度除磷技术分析[J]. 环境污染与防治, 2015, 37(3): 102-106,110. [4] LI Y, MA J, YU M, et al. Carbon felt (CF) acted as an “ionic capacitor” to enhance flow electrode capacitive deionization (FCDI) desalination performance[J]. Desalination, 2024, 575: 117341. doi: 10.1016/j.desal.2024.117341 [5] DI CAPUA F, DE SARIO S, FERRARO A, et al. Phosphorous removal and recovery from urban wastewater: Current practices and new directions[J]. Science of The Total Environment, 2022, 823: 153750. doi: 10.1016/j.scitotenv.2022.153750 [6] LOGANATHAN P, VIGNESWARAN S, KANDASAMY J, et al. Removal and Recovery of Phosphate From Water Using Sorption[J]. Critical Reviews in Environmental Science and Technology, 2014, 44(8): 847-907. doi: 10.1080/10643389.2012.741311 [7] LIN X, XIE Y, LU H, et al. Facile preparation of dual La-Zr modified magnetite adsorbents for efficient and selective phosphorus recovery[J]. Chemical Engineering Journal, (Lausanne, Switzerland : 1996). 2021, 413: 127530. [8] LIU H, SHAN J, CHEN Z, et al. Efficient recovery of phosphate from simulated urine by Mg/Fe bimetallic oxide modified biochar as a potential resource[J]. Science of The Total Environment, 2021, 784: 147546. doi: 10.1016/j.scitotenv.2021.147546 [9] SHENG X, CHEN S, ZHAO Z, et al. Metal element-based adsorbents for phosphorus capture: Chaperone effect, performance and mechanism[J]. Chemosphere, 2024, 352: 141350. doi: 10.1016/j.chemosphere.2024.141350 [10] SU Y, YANG W, SUN W, et al. Synthesis of mesoporous cerium–zirconium binary oxide nano adsorbents by a solvothermal process and their effective adsorption of phosphate from water[J]. Chemical Engineering Journal, 2015, 268: 270-279. doi: 10.1016/j.cej.2015.01.070 [11] YANG W, SHI X, DONG H, et al. Fabrication of a reusable polymer-based cerium hydroxide nanocomposite with high stability for preferable phosphate removal[J], Chemical Engineering Journal (Lausanne, Switzerland : 1996), 2021, 405: 126649. [12] HE J, XU Y, XIONG Z, et al. The enhanced removal of phosphate by structural defects and competitive fluoride adsorption on cerium-based adsorbent[J]. Chemosphere (Oxford), 2020, 256: 127056. doi: 10.1016/j.chemosphere.2020.127056 [13] KAJJUMBA G W, FISCHER D, RISSO L, et al. Application of cerium and lanthanum coagulants in wastewater treatment—A comparative assessment to magnesium, aluminum, and iron coagulants[J]. Chemical Engineering Journal (Lausanne, Switzerland : 1996), 2021, 426: 131268. [14] SHAN S, ZHANG T, WANG W, et al. Magnetite/hydrated cerium(III) carbonate for efficient phosphate elimination from aqueous solutions and the mechanistic investigation[J]. Chemical Engineering Journal (Lausanne, Switzerland : 1996), 2021, 425: 128894. [15] TANG Q, SHI C, SHI W, et al. Preferable phosphate removal by nano-La(III) hydroxides modified mesoporous rice husk biochars: Role of the host pore structure and point of zero charge[J]. Science of the Total Environment, 2019, 662: 511-520. doi: 10.1016/j.scitotenv.2019.01.159 [16] ZHANG C, LI Y, WANG F, et al. Performance of magnetic zirconium-iron oxide nanoparticle in the removal of phosphate from aqueous solution[J]. Applied Surface Science, 2017, 396: 1783-1792. doi: 10.1016/j.apsusc.2016.11.214 [17] LI X, WANG Y, DONG S, et al. Tuning the lanthanum hydrolysis induced assembly process using long linear chains with –N+(CH3)3 groups for efficient phosphate removal[J]. Chemical Engineering Journal, 2023, 451: 138713. doi: 10.1016/j.cej.2022.138713 [18] WANG Z, XING M, FANG W, et al. One-step synthesis of magnetite core/zirconia shell nanocomposite for high efficiency removal of phosphate from water[J]. Applied Surface Science, 2016, 366: 67-77. doi: 10.1016/j.apsusc.2016.01.059 [19] 刘晨阳, 王毅力, 李小林, 等. Fe3O4负载非晶态(碳酸)氧化锆复合材料对磷的吸附性能及机理[J]. 环境工程学报, 2022, 16(4): 1133-1144. doi: 10.12030/j.cjee.202112066 [20] 马锋锋, 赵保卫, 刁静茹, 等. 磁性生物炭对水体中对硝基苯酚的吸附特性[J]. 中国环境科学, 2019, 39(1): 170-178. doi: 10.3969/j.issn.1000-6923.2019.01.019 [21] 张妍. 镁改性污泥炭对水体中氮磷吸附性能研究[D]. 大连: 大连海事大学, 2023. [22] 李秀玲, 宾冰, 龚盈盈, 等. 铁锰改性桑枝生物炭的构筑及对水体磷的吸附[J]. 工业水处理, 2024. [23] DRENKOVA-TUHTAN A, SCHNEIDER M, FRANZREB M, et al. Pilot-scale removal and recovery of dissolved phosphate from secondary wastewater effluents with reusable ZnFeZr adsorbent @ Fe3O4/SiO2 particles with magnetic harvesting[J]. Water Research (Oxford), 2017, 109: 77-87. doi: 10.1016/j.watres.2016.11.039 [24] HUANG W, LI D, LIU Z, et al. Kinetics, isotherm, thermodynamic, and adsorption mechanism studies of La(OH)3-modified exfoliated vermiculites as highly efficient phosphate adsorbents[J]. Chemical Engineering Journal (Lausanne, Switzerland : 1996), 2014, 236: 191-201. [25] DONG S, WANG Y, ZHAO Y, et al. La3+/La(OH)3 loaded magnetic cationic hydrogel composites for phosphate removal: Effect of lanthanum species and mechanistic study[J]. Water Research, 2017, 126: 433-441. doi: 10.1016/j.watres.2017.09.050 [26] 马锋锋, 郑旭东, 张建, 等. 污泥生物炭对水体中磷的吸附[J]. 中国环境科学, 2024, 44(3): 1347-1356. doi: 10.3969/j.issn.1000-6923.2024.03.017 [27] LI X, WANG Y, LI J, et al. Rapid and selective harvest of low-concentration phosphate by La(OH)3 loaded magnetic cationic hydrogel from aqueous solution: Surface migration of phosphate from –N+(CH3)3 to La(OH)3[J]. Science of the Total Environment, 2021, 800: 149418. doi: 10.1016/j.scitotenv.2021.149418 [28] LI R, WANG J J, ZHOU B, et al. Enhancing phosphate adsorption by Mg/Al layered double hydroxide functionalized biochar with different Mg/Al ratios[J]. Science of the total environment, 2016, 559: 121-129. doi: 10.1016/j.scitotenv.2016.03.151 [29] KOILRAJ P, SASAKI K. Selective removal of phosphate using La-porous carbon composites from aqueous solutions: Batch and column studies[J]. Chemical Engineering Journal (Lausanne, Switzerland : 1996), 2017, 317: 1059-1068. [30] LÜRLING M, WAAJEN G, VAN OOSTERHOUT F. Humic substances interfere with phosphate removal by lanthanum modified clay in controlling eutrophication[J]. Water Research, 2014, 54: 78-88. doi: 10.1016/j.watres.2014.01.059 [31] QI Z, JOSHI T P, LIU R, et al. Synthesis of Ce(III)-doped Fe3O4 magnetic particles for efficient removal of antimony from aqueous solution[J]. Journal of Hazardous Materials, 2017, 329: 193-204. doi: 10.1016/j.jhazmat.2017.01.007 [32] QU J, AKINDOLIE M S, FENG Y, et al. One-pot hydrothermal synthesis of NaLa(CO3)2 decorated magnetic biochar for efficient phosphate removal from water: Kinetics, isotherms, thermodynamics, mechanisms and reusability exploration[J]. Chemical Engineering Journal (Lausanne, Switzerland : 1996), 2020, 394: 124915. [33] BANI-SALAMEH A A, AHMAD A A, ALSAAD A M, et al. Synthesis, Optical, Chemical and Thermal Characterizations of PMMA-PS/CeO2 Nanoparticles Thin Film[J]. Polymers, 2021, 13(7): 1158. doi: 10.3390/polym13071158 [34] SHANG Y, XU X, QI S, et al. Preferable uptake of phosphate by hydrous zirconium oxide nanoparticles embedded in quaternary-ammonium Chinese reed[J]. Journal of Colloid and Interface Science, 2017, 496: 118-129. doi: 10.1016/j.jcis.2017.02.019 [35] ZHANG X, SUN F, HE J, et al. Robust phosphate capture over inorganic adsorbents derived from lanthanum metal organic frameworks[J]. Chemical Engineering Journal (Lausanne, Switzerland : 1996), 2017, 326: 1086-1094. [36] XIE J, WANG Z, LU S, et al. Removal and recovery of phosphate from water by lanthanum hydroxide materials[J]. Chemical Engineering Journal (Lausanne, Switzerland : 1996), 2014, 254: 163-170. [37] FANG L, WU B, LO I M C. Fabrication of silica-free superparamagnetic ZrO2@Fe3O4 with enhanced phosphate recovery from sewage: Performance and adsorption mechanism[J]. Chemical Engineering Journal (Lausanne, Switzerland : 1996), 2017, 319: 258-267. -



 下载:
下载: