-
目前,农药的广泛使用造成农业面源污染组分的进一步多元化,严重威胁着水生态系统安全[1-2]。阿特拉津(atrazine,ATZ)是一种人工合成的化学除草剂,以其杀草谱广、持效期长被广泛用于农业种植过程中。ATZ易被雨水淋洗,会随着地面径流、干湿沉降、淋溶等方式进入水环境中[3]。许多研究[4-7]发现农业面源污染普遍存在ATZ。目前,针对农药的降解通常利用酶[8-9]、微生物[10]、光催化[11-12]等方法,但这些方法难以直接运用到农业面源污染的控制中。人工湿地作为一种构建及维护简单、生态友好的污水处理方法,常用于农业面源污染的拦截治理[13],其中又以水平潜流湿地(horizontal subsurface flow constructed wetland,HSSF)和表面流湿地(surface flow constructed wetland,SF)使用最为普遍。在前者中水以渗流方式在填料表面以下流动,在后者中水主要以连续流的方式在填料表面以上流动[14]。有研究[15-16]表明,HSSF和SF系统对ATZ、异丙隆、萘丙酰胺、双氟磺草胺等除草剂均有一定的去除效果,但哪种类型湿地受ATZ影响最小,目前还未见系统报道。
人工湿地去除ATZ主要通过水解、光解、沉降、基质吸附、微生物降解和植物吸附、吸收等[17]途径。其中,微生物降解是其主要途径。微生物降解ATZ的主要机制为矿化作用,其降解途径为脱烷基、水解和开环3个步骤[18]。但农业面源污染一般呈现为低碳氮比的水质特征[19-20]。在碳源不足的情况下,人工湿地中微生物的群落结构也会受到影响,此时,ATZ能否被去除值得探讨。另一方面,人工湿地内种植的植物在去除污染物过程中起到重要作用,人工湿地的植物主要通过吸收、富集以及根际分泌物的降解作用来达到去除污染物的目的[21]。但ATZ作为除草剂对植物的生长有抑制作用,ATZ对植物的抑制机理是通过干扰光合作用,破坏叶绿素,阻碍碳水化合物的合成、碳源的还原和细胞中CO2 的还原,最后导致植物死亡[22]。因此,面源污染中混合的ATZ,会对人工湿地系统污染去除能力造成一定的影响。但也有研究发现只要保持植物和除草剂浓度之间的平衡,就不会严重损害植物群落[23]。
鉴于此,本研究通过建造水平潜流及表面流人工湿地系统,对含有ATZ的低碳氮比农业面源污染水体开展实验,以探究:1)ATZ对不同类型人工湿地中美人蕉的影响;2)不同类型湿地对含有ATZ农业面源污染物的去除效果;3)受ATZ影响下人工湿地微生物的群落结构特征。
-
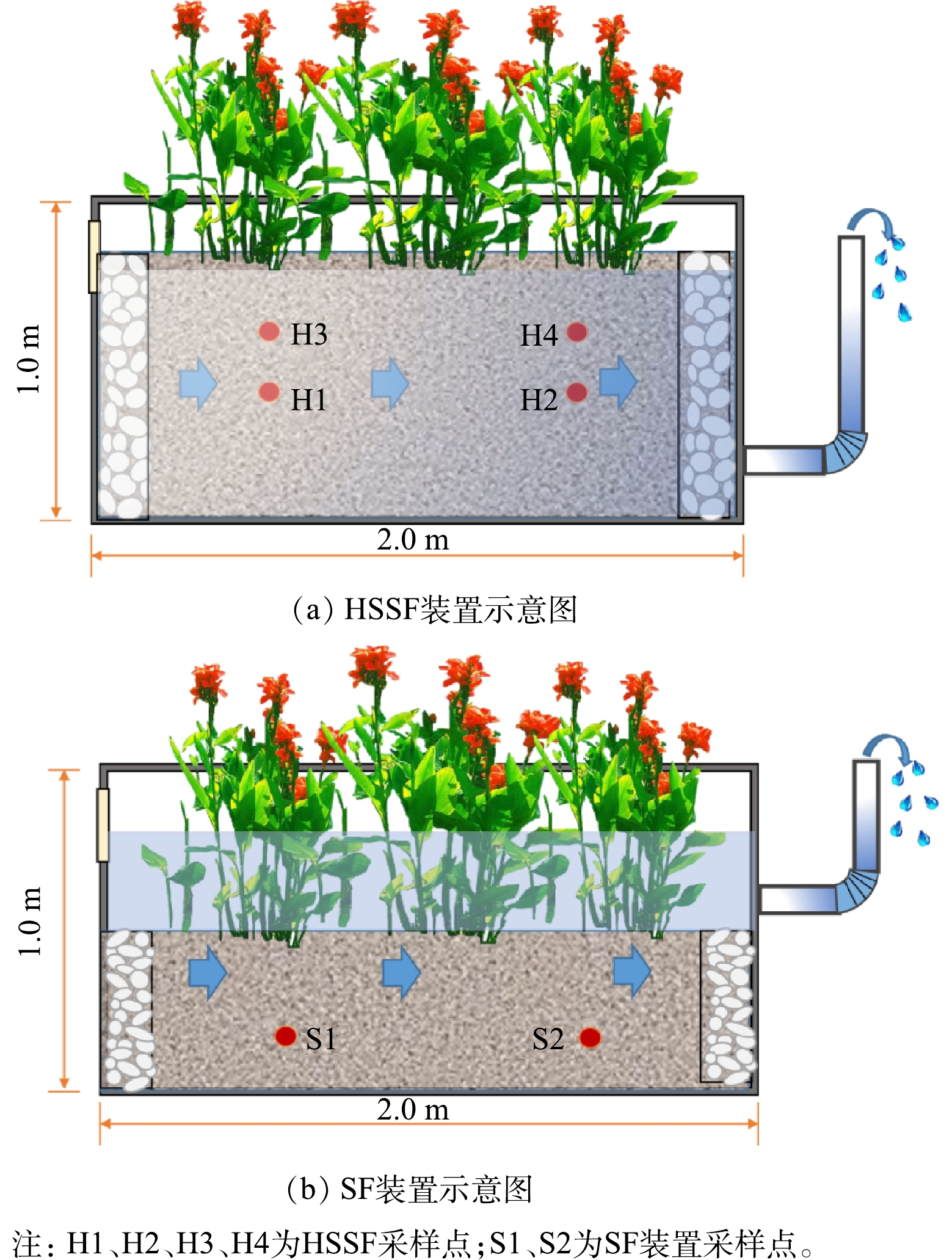
SF和HSSF对比人工湿地实验系统由玻璃钢材料制成,长方体箱型结构,二者尺寸相同,长×宽×高为2.0 m×1.2 m×1.0 m。主体填料为石英砂,粒径为8~10 mm,两端进水区及集水区分别填充粒径5~8 cm的鹅卵石,填充长度为20 cm。其中SF的填料厚度为40 cm,填料以上水深为35cm,总深度为75 cm;HSSF的填料厚度为75 cm。主体填料上种植美人蕉(Canna indica L.),种植密度相同,均为12株·m−2。实验装置位于桂林理工大学雁山校区污水处理站内,实验装置如图1所示。
-
实验装置在2020年2月建成,建成后以校园污水连续进水对系统进行启动,6个月后,系统运行稳定。符合农业面源污染水质特征[24-25]的低碳氮比校园污水,碳氮比为1.3∶1~2.6∶1,并加入0.1 mg·L−1ATZ开始实验。具体进水水质如表1所示。实验期间,对比实验系统水力负荷为0.048 m3·(m2·d)−1,停留时间为6 d,实验持续5个月,8—12月的月最高及最低气温分别为34~26、32~24、28~19、20~14、15~8 ℃。
-
采样点为两个对比实验系统的进出水,实验期间,每隔6 d取1次水样,用250 mL聚乙烯广口试剂瓶采水样,取满加入内盖,保存于4 ℃医用冷藏箱,两日内测完所有指标。
8—11月,每月4号取各反应器植物的新鲜叶片用去离子水擦拭干净,弱光下进行叶绿素测试分析。12月底收割植物,测量植物株高,湿质量和植物富集的ATZ含量。
实验结束后,采集2个对比实验系统床体填料,每个采样点取50 g湿地填料,用取样器抽取一定深度的填料,检出植物残渣,冷冻干燥48 h,待测。用于测微生物的填料,取出后立即用液氮保存并寄往北京奥维森基因科技有限公司进行高通量测序。
SF设置了2个采样点,分别命名为S1、S2 ,S1和S2位于池体宽度中线位置,位于填料表面以下35 cm深度处,距离进水口分别为40 cm和160 cm。
HSSF中设置4个取样点,分别命名为H1、H2、H3、H4。4个取样点位于池体宽体中线位置,H1、H3位于湿地床体前端,横向上距离进水口40 cm, H2、H4位于湿地后端,横向上距离进水口160 cm。H3和H4采样内容为床体表层填料,位于填料表面以下20 cm深度处;H1和H2集床体底层填料,位于填料表面以下35 cm深度处,以方便与SF湿地样品比较。
-
水质中常规污染物的指标化学需氧量(COD)、氨氮(NH4+-N)和总磷(TP)分别使用重铬酸钾法、纳氏试剂分光光度法和钼酸铵分光光度法。溶解氧(DO)、pH、温度以及浊度(NTU)等通过便携式多参数数字化分析仪和浊度计测得。叶绿素含量采用乙醇法测定。
水中ATZ的提取和检测参照王庆海[26]的方法,水中ATZ残留采用高效液相色谱仪(Agilent 1260,美国安捷伦科技有限公司)检测目标污染物浓度。采用液相色谱—质谱联用仪(LC-MS)检测ATZ降解过程中产生的中间产物[27]。
微生物分析方法使用16s扩增子测序,16S(V3~V4)扩增子测序流程具体如下,DNA基因组提取→PCR扩增、产物纯化→Miseq文库构建→Miseq上机测序。DNA提取方法参照DNA Kit(Omega Bio-tek, Norcross, GA, U.S.)试剂盒说明书。采用1%琼脂糖凝胶法测定DNA的质量和纯度。委托给北京奥维森基因科技有限公司进行高通量测序。
-
实验数据后期处理采用Microsoft Excel 2010、Origin 2022、IBM SPSS Statistics 25等软件进行统计与分析。同一样本的变异性采用标准偏差(SD)进行评估。不同处理间的差异显著性采用独立样本T检验进行分析。
-
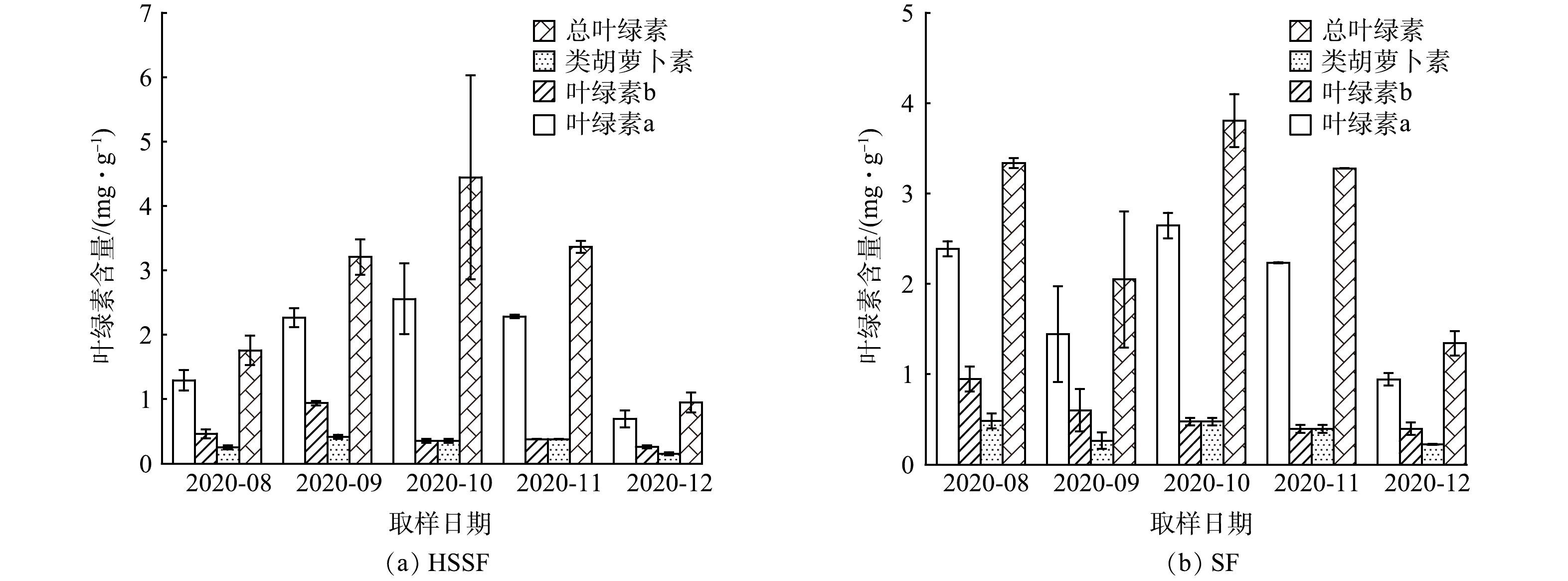
在8—12月,美人蕉在人工湿地系统中的叶绿素含量变化如图2所示。HSSF的总叶绿素含量平均值为2.74 mg·g−1,而在SF中,总叶绿素含量平均值为2.76 mg·g−1。HSSF的叶绿素a、叶绿素b和总叶绿素随着时间变化出现先上升后下降的趋势,类胡萝卜素含量相对稳定。相比之下,SF中的叶绿素a、叶绿素b、类胡萝卜素和总叶绿素含量则表现出先下降后上升再下降的趋势。特别是在8月SF中加入ATZ后,9月内美人蕉的叶绿素a、叶绿素b、类胡萝卜素和总叶绿素相较于8月分别下降了39%、36%、45%、38%,表明ATZ在一定程度上影响了SF中美人蕉的光合作用过程。
从2个系统的生物量来看,12月份收割后,SF总共收割了383棵美人蕉,茎和叶的湿质量分别为15.92 kg·m−2和11.14 kg·m−2;株高为21~236 cm,平均株高为129.31 cm。HSSF总共收割了195棵美人蕉,茎、叶的湿质量分别为8.15 kg·m−2、6.02 kg·m−2;株高为17~234.5 cm,平均株高为128 cm。由此可见,在相同种植密度情况下,SF中美人蕉新芽分蘖更为旺盛。SF中美人蕉的生物量是HSSF的2倍,植物根系上附着的生物膜以及植物吸收是人工湿地去除COD和氮磷等污染物的主要途径,因此,可以推测,在表面流人工湿地中,美人蕉以较大的生物量,使其通过植物摄取作用去除污染物的贡献比在潜流湿地中更大。
部分激发态的叶绿素a能够将光能转化为化学能,促进光合作用,叶绿素b则主要负责光能的收集,类胡萝卜素则起到了保护叶绿素的作用。由图2可知, ATZ的加入并未影响HSSF的叶绿素含量的变化。HSSF中美人蕉受到ATZ影响较小的原因在于,HSSF床体中填料较多,当ATZ随水体进入到填料后,填料吸附作用拦截了部分ATZ,为植物吸收提供了一定缓冲空间。此外,填料上附着生长的微生物也能够通过对ATZ的降解,减少其对植物光合作用的影响。在9月中,与HSSF不同,SF的美人蕉叶绿素含量降低,类胡萝卜素受到的影响最大。在SF中,植物根系会直接接触含有ATZ的污水。在ATZ胁迫下,植物根系的生长和功能会受到影响[28]。ATZ对根系的损害可能会限制植物对光合作用所需营养的吸收,导致叶绿素含量的降低。而10月后这种影响减弱,表明在ATZ的胁迫作用下,美人蕉的叶绿素含量短期内受到了影响,因为SF中美人蕉的根系会直接接触含有
ATZ的污染水源,但随着时间增长,美人蕉和根系附着的微生物会适应ATZ的存在,ATZ对美人蕉叶绿素含量的影响也随之减少。此结果与KNAUERT等[29]研究一致。
叶绿素浓度是植物抗阿特拉津胁迫的敏感生理指标[30]。植物在ATZ胁迫下,可以通过调整叶绿素含量,来提升光合作用能力[31]。SF系统中,叶绿素a与叶绿素b的比值在8月为2.52,9月降低了0.13,到10月比值提升了3.17,由此可以推测,植物在表面流人工湿地中通过提高叶绿素a的含量来增强光合作用,从而保障其正常生长。这表明该湿地的净化功能不会因低浓度ATZ的农业面源污水而受损。另外针对HSSF和SF中环境不同,美人蕉叶绿素含量可能不止受到了ATZ的影响。根据前人研究发现,与未受ATZ胁迫的植物相比,在ATZ胁迫下,植物的叶绿素含量会有所下降[32-33]。因为ATZ作为一种抑制光合作用的除草剂,主要通过干预光系统Ⅱ发挥作用。ATZ与叶绿体内的D1蛋白结合,阻断了光系统Ⅱ中的电子传递链,进而引发叶绿体分子的损伤,妨碍了光合作用的顺畅进行[34-35]。
-
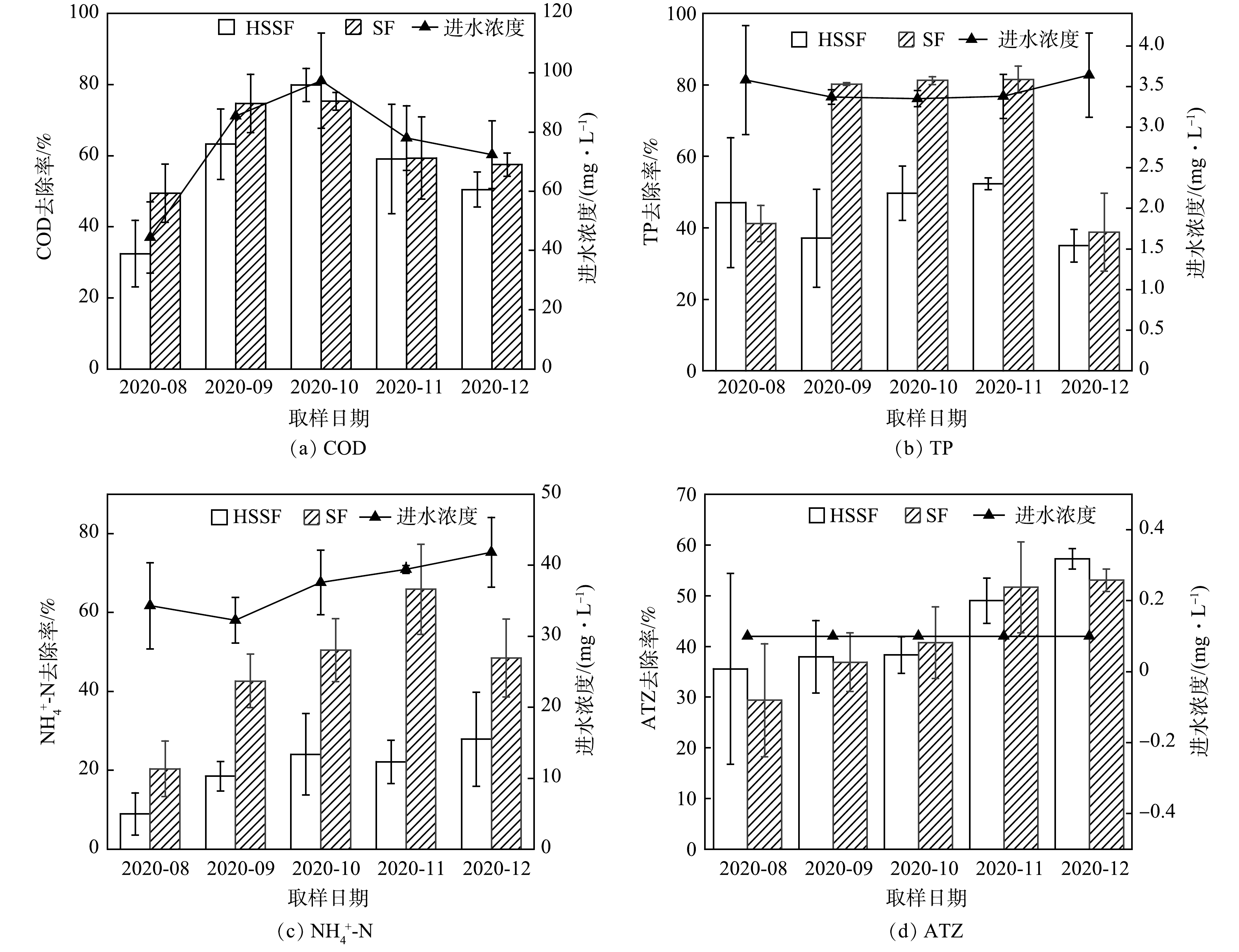
HSSF和SF在连续5个月的运行中对各污染物的去除效果如图3所示。HSSF对于COD、TP、NH4+-N、ATZ的去除率分别为32.4%~77.7%、35%~52.4%、13.3%~27.9%、34.3%~57.2%;SF对于COD、TP、NH4+-N、ATZ的去除率分别为49.4%~75.1%、36.8%~82.1%、20.2%~65.9%、29.8%~53%。SF对于COD、TP、NH4+-N和ATZ的平均去除率分别为63.25%±11.37%、64.55%±22.43%、45.56%±16.50%和42.33%±10.02%。HSSF中COD、TP、NH4+-N和ATZ的平均去除率分别为57.02%±17.42%、44.26%±7.75%、20.30%±7.21%和43.61%±9.23%。
SF对COD的平均去除率比HSSF高6.23%。尽管两者对径流水体中的有机物均有明显去除效果,但其去除率低于一般情况下人工湿地对生活污水中有机物的去除效果[36]。这主要是因为生活污水中有机物比较丰富,能够为微生物提供充足的碳源,从而在床体中形成复杂的微生物代谢网络,有机物为各类污染物的去除提供碳源,从而加速降解。而在本研究中,较低的碳氮比难以提供足够的碳源,影响了微生物的代谢功能。即便潜流湿地有较多的填料为微生物提供附着生长环境,但由于碳源的限制,其去除率略低于SF表面流湿地系统。原因在于,SF中填料以上水层的良好溶解氧环境更有利于低浓度径流水体中有机物的去除。
在TP去除方面,SF的效果更佳,2个湿地对TP的平均去除率相差20.29%。一方面,SF具有良好的静止沉淀条件,有利于磷的物理沉淀,增强了对P的拦截[37];另一方面,SF中美人蕉的生物量是HSSF的2倍,有研究[38]发现,植物对P的吸收可以达到20%,因此植物的摄取作用在农业面源污染的磷削减中不可忽视。
对于NH4+-N,2个湿地的平均去除率相差25.26%,SF的去除效果显著优于HSSF(P <0.05)。这是因为HSSF长期处于缺氧和厌氧的环境中,硝化能力不足[39],而在SF湿地中,表层水流具有较好的复氧条件,有助于硝化作用的完成。此外,SF湿地中美人蕉的数量较多,能有效摄取水中的氮,从而提高了系统对NH4+-N的去除率,这与MEUTIA等[40]实验结果一致。潘傲等[41]研究表明,种植美人蕉的表面流人工湿地对NH4+-N和TP的平均去除率分别为83.28%和55.77%,比未种植组的去除率分别提高了21.12%和18.68%,说明美人蕉能够强化人工湿地对N、P 的去除效果。
2个湿地对ATZ的去除效果差异并不显著(P>0.05)。推测其原因可能是,人工湿地对ATZ的去除途径主要包括基质吸附、微生物降解、植物吸收以及光解和好氧水解作用。SF中污水从基质上流过,属于好氧环境,主要通过微生物降解、植物吸收以及光解和好氧水解去除ATZ,因此基质吸附作用会受到限制。而HSSF的厌氧-缺氧环境无法进行光解和好氧水解作用,主要依赖基质吸附、微生物降解、植物吸收来去除ATZ[42]。因此,2个人工湿地虽然去除率相当,但去除的途径有所不同。
从时间上看,随着温度的变化,2个湿地中的TP和COD的去除率呈现先上升后下降的规律。在11月和12月,去除率明显下降,相比前3个月,SF和HSSF的TP、COD的去除率分别下降了42.7%、13.5%和17.6%、27.2%。这表明温度对于湿地去除TP和COD有一定的影响。通常,低温会影响微生物活性,导致ATZ的去除率降低,但本研究中ATZ的去除效果受温度影响并不明显。这主要是因为随着运行时间的增加,降解ATZ的微生物产生耐受性,其菌落的多样性增加,微生物的活性也有所增强[43]。因此,温度对于ATZ的去除影响不大。综合来看,本研究中SF对常规污染物的去除效果优于HSSF,而对ATZ的去除效果相当,因此SF更适合处理农业面源污染。
-
1)不同深度层微生物多样性。本实验通过高通量测序技术共检测出5 144个OTU,经过抽平处理后,剩余5 117个OUT。将不同湿地的同一水平高度层为分组单位(35、20 cm),共分成H1和H2、S1和S2、H3和H4三组。H1、H2、H3、H4、S1、S2检测到的OTU数目分别为3 206、3 009、2 596、2 773、2 575、2 587。其中可以发现,在HSSF系统中, HSSF下层(H1和H2)微生物丰度大于上表层(H3和H4),而SF系统的S1和S2层的OTU数目与HSSF的H3和H4相似。由表2可知,人工湿地不同位点微生物多样性不同,Chao:H1>H2>H4>H3>S1>S2;Shannon:H1>H4>H2>H3>S1>S2;Sobs:H1>H2>H4>H3>S2>S1。单个样品Simpson指数除了S2为0.99,其余都为1。微生物多样性指数和丰富度指数(Shannon、Simpson、Sobs和Chao)表明,HSSF湿地的H1和H2层具有最高的微生物多样性,而SF湿地的S1和S2层与HSSF的H3和H4相似,但低于HSSF的H1和H2。各组湿地微生物样本的文库覆盖率(coverage)均大于0.98,表明测序结果能较好地反映样品的真实微生物群落结构。
由图4中层次聚类分析结果可见,HSSF湿地表层和深层之间的微生物相对丰度存在差异,而进出水端之间相似。SF湿地的微生物在进出水端之间也表现出相似性。HSSF的深层微生物多样性和丰富度最高,其次是表层,而SF的微生丰度最低。这可能与HSSF湿地的深层具有更多的微生物栖息地和营养来源有关。在HSSF湿地中,出水端的微生物多样性和丰富度高于进水端,这一现象是由于植物根系分泌物为微生物提供了丰富的营养物质,从而促进了微生物的生长和多样性。相反,在SF湿地中,进水端的微生物丰富度和多样性高于出水端,这可能与SF湿地的水流特性和光照条件有关,这些因素影响了微生物群落的分布和活性。在低碳氮比的条件下,HSSF湿地对污染物的去除能力受到限制,但植物根系分泌物的作用可能在一定程度上促进了微生物的生长和污染物的去除。微生物多样性指数的分析结果进一步证实了HSSF湿地微生物群落结构的复杂性,这与其较高的微生物多样性和丰富度密切相关。
2)属水平微生物群落结构。表3为不同组的微生物相对丰度排在前20的属水平表。不同湿地的微生物主要优势属有较大差别。HSSF出水端的优势属主要包括Geobacter(1.79%~2.27%)、Lysobacter(0.83%~2.86%)和Arenimonas(1.65%~3.69%);进水端的优势菌属为12up(3.00%~4.25%)和Dyella(1.55%~4.33%)。Geobacter为一种外电微生物,针对在厌氧情况下氮的去除[44];Lysobacter是一种异养硝化菌[19];Arenimonas属于耐冷自养反硝化细菌,通过自养反硝化和阴极驱动的生物电化学反硝化去除硝酸盐[45]。12up为红环菌属(Rhodocyclus),是污水处理厂中的反硝化细菌[46]。Dyella菌属通常用于降解有机污染物[47]。微生物脱氮通过硝化菌将氨氮转化为硝酸盐,接着反硝化菌将硝酸盐转为氮气[48]。SF湿地系统优势属依次为Sphingomonas(2.73%~3.61%)、Bacillus(0.49%~2.33%)和Terrimonas(0.93%~2.83%)。Sphingomona是鞘脂单胞菌属,可以有效吸取氨氮并去除水中的亚硝酸盐[49]。Terrimonas是一种自养反硝化的细菌[50]。Bacillus是兼性厌氧菌,具有异养硝化-好氧反硝化的能力,在NH4+-N的去除中,Bacillus菌属表现出完整的硝化和反硝化途径[51]。2个人工湿地系统中,自养反硝化菌都占据优势地位。
HSSF和SF湿地中的优势属差异结果表明,不同湿地系统中微生物的生态功能可能存在差异。HSSF湿地中的优势菌属,如Geobacter和Lysobacter,可能在脱氮过程中发挥重要作用,而SF湿地中的优势菌属,如Sphingomonas和Bacillus,可能在氨氮的去除和反硝化过程中起到关键作用。ATZ的转化产物分析结果表明,在SF湿地中,光解和植物吸收可能起到辅助作用,而在HSSF湿地中,微生物降解对ATZ去除的贡献更大。HSSF湿地中硝化菌占比少,反硝化菌属占比高,可能是导致HSSF除氮效率低的因素之一。另外,自养反硝化菌在两个湿地系统中都有优势属,这表明在低碳氮比的污水处理中,由于碳源的匮乏,反硝化过程主要以自养反硝化为主导。
3) ATZ的去除机理分析。图5展示了HSSF和SF对ATZ的去除机理。通常来说,微生物降解是ATZ的主要去除方式。有研究[52]表明,微生物降解ATZ的途径主要分为脱烷基、水解和开环三种。通过Pseudomonas、Rhizobium、Nocardioides和Nocardia等菌属作用,ATZ被转化为乙基阿特拉津(DEA)、去异丙基阿特拉津(DIA)、羟基阿特拉津(HA),这些有机产物最终被矿化成CO2、NH3和小分子物质。
在HSSF湿地中,主要检测到的ATZ降解菌包括Bacillus、Rhizobium、Nocardia、Nocardioides、Flavobacterium和Sphingomonas等;而SF中主要检测到了Bacillus、Acinetobacter、Sphingomonas、Nocardioides和Pseudomonas等ATZ降解菌,样品丰度在0.05%~3.58%。本研究利用液相色谱—质谱联用仪(LC-MS)检测对ATZ的中间产物进行了定性分析,发现人工湿地处理阿特拉津的中间产物主要有:去乙基阿特拉津(DEA)、去异丙基阿特拉津(DIA)、羟基阿特拉津(HA)和去乙基去异丙基阿特拉津(DDA)等。根据检测出的中间产物以及ATZ降解菌属,推测ATZ的转化途径主要发生脱氯和脱烷基作用。ATZ降解菌通过脱氯羟基化和脱烷基化等将ATZ转化为DEA、DIA和HA等。
在SF中,ATZ降解菌在出水端S2的含量高于进水端S1,这表明SF基质上的微生物对ATZ的拦截降解能力较弱,导致ATZ随着水流方向聚集在出水端。因此,微生物降解并非SF去除ATZ的主要途径。在SF中,污水从湿地基质上流过,为光解反应提供了可能,于凡等[53]研究日光/氯降解 ATZ 的效果时发现,在日光辐射装置中,单独日光对ATZ的降解率达到了5.47%,可以通过光解作用来去除部分ATZ。因此,在本研究中,光解和植物吸收对于SF降解ATZ起到了主要作用。而在HSSF中,ATZ降解菌在进水口的含量远大于出水口,表明HSSF湿地基质及其附着的微生物对于ATZ的吸附拦截及降解能力更强,从而在HSSF中,微生物降解对ATZ去除贡献更大。
-
1)在本研究设计的表面流人工湿地和水平潜流人工湿地模拟实验装置中,表面流人工湿地对COD、TP、NH4+-N和ATZ的平均去除率为63.25%、64.55%、45.56%、42.33%;潜流人工湿地对COD、TP、NH4+-N和ATZ的平均去除率为57.02%、44.26%、20.30%、43.61%。表面流人工湿地对NH4+-N的去除能力高于潜流人工湿地,表面流人工湿地处理含有ATZ的农业面源污染效果更好。
2)短期内,ATZ会对表面流人工湿地中美人蕉叶绿素造成破坏,但随着时间的增长,美人蕉对于ATZ会产生抗性,美人蕉会通过提升叶绿素a与叶绿素b的比值来增强光合作用。因此,进水质量浓度为0.1 mg·L−1的ATZ不会影响人工湿地植物的生长。
3) 2个湿地中ATZ降解菌的丰度在0.05%~3.58%。HSSF中主要检测到了Bacillus、Rhizobium、Nocardia、Nocardioides、Flavobacterium和Sphingomonas等ATZ降解菌;SF中主要检测到了Bacillus、Acinetobacter、Sphingomonas、Nocardioides和Pseudomonas等ATZ降解菌。通过检测到的中间产物DEA、HA、DIA和DDA推测,微生物对ATZ的降解途径主要为脱氯和脱烷基。
人工湿地结构对农业面源污染中阿特拉津净化性能的影响
Effect of constructed wetland structure on atrazine removal performance for treating agricultural non-point source pollution
-
摘要: 除草剂阿特拉津(ATZ)通过农业面源污染汇入地表水体,其对植物光合作用的抑制效果会对人工湿地系统的净化效能构成潜在威胁。本研究旨在评估农业面源污染中ATZ在人工湿地系统中的去除效率,并探讨不同湿地结构对去除效果的影响。通过构建表面流人工湿地(SF)与潜流人工湿地(HSSF)对比实验装置,本研究系统地研究了2种结构人工湿地对COD、TP、NH4+-N和ATZ的去除效果差异,同时分析了植物叶绿素含量变化及微生物群落结构的变化。结果表明,SF对COD、TP和NH4+-N的去除率更高,较HSSF分别提高了6.23%、20.29%、25.26%;但二者对ATZ的去除能力差异不显著,其中SF的去除率略低于HSSF1.28%。在SF中,美人蕉(Canna indica L.)对污染物的净化作用显著,其生物量是HSSF中的2倍。ATZ短期内对SF中美人蕉叶绿素合成具有抑制作用,但美人蕉通过调节叶绿素来增强光合作用,从而减轻ATZ的胁迫效应。随着时间的推移,这种抑制作用逐渐减弱。相比之下,HSSF中微生物对净化性能的贡献更为显著,其微生物丰度和多样性均高于SF。2个人工湿地系统中主要检测到了Acinetobacter、Bacillus、Rhizobium、Nocardia、Nocardioides、Flavobacterium和Sphingomonas等ATZ降解菌。本研究为含除草剂的面源污染治理策略提供了科学依据,为优化人工湿地设计提供了技术支撑。Abstract: The herbicide atrazine (ATZ) is discharged into surface water through agricultural non-point source pollution. The purification performance of constructed wetlands (CWs) can be potentially affected by atrazine due to its inhibition of plant photosynthesis. The objectives of this study are to assess the removal rate of ATZ in agricultural non-point source pollution through CWs, and compare the effect of constructed wetland structure on ATZ removal performance for treating agricultural non-point source pollution. The differences of COD, TP, NH4+-N, and ATZ removal efficiencies were investigated by building two types of constructed wetland: surface flow constructed wetlands(SF) and horizontal subsurface flow constructed wetlands(HSSF), and the plant chlorophyll content and microbial community structure were analyzed simultaneously. The results indicated that SF achieved a higher removal effect on COD, TP, and NH4+-N than HSSF, and increased in removal rate by 6.23%, 20.29%, and 25.26%, respectively. There is no significant difference in ATZ removal ability between both CWs, of which the removal rate by SF was slightly lower(1.28%) than that of HSSF. In SF, Canna indica L. had a significant purification effect on pollutants, and its biomass was twice that of HSSF. In the short term, ATZ had an inhibitory effect on chlorophyll synthesis of Canna indica L. in SF, while Canna indica L. could enhance photosynthesis by adjusting the chlorophyll a/b ratio, thereby reducing the stress effect of ATZ, and this inhibitory effect gradually weakened over time. The contribution of microorganisms to purification performance in HSSF was more significant, with higher microbial abundance and diversity than in SF. In both CWs, ATZ degrading bacteria such as Acinetobacter, Bacillus, Rhizobium, Nocardia, Nocardioides, Flavobacterium and Sphingomonas were mainly detected. This study provides a scientific basis for the control and treatment strategy of non-point source pollution containing herbicides, and a technical support for optimizing CWs design.
-
Key words:
- constructed wetlands /
- agricultural non-point source pollution /
- atrazine /
- chlorophyll /
- structure
-

-
表 1 8—12月进水水质
Table 1. Inlet water quality from August to December
月份 COD/(mg·L−1) TP/(mg·L−1) NH4+-N/(mg·L−1) 8月 44.42±11.97 3.58±0.67 34.92±6.07 9月 85.36±0.11 3.37±0.09 32.24±3.20 10月 97.30±16.00 3.35±0.10 37.57±4.55 11月 77.93±10.95 3.38±0.27 39.41±0.55 12月 72.30±11.42 3.64±0.52 41.81±4.94 表 2 人工湿地微生物多样性和丰富度
Table 2. Microbial diversity and abundance in constructed wetlands
组别 多样性指数 丰富度指数 覆盖率 OTUs Shannon Simpson Sobs Chao H1 9.68 1.00 3 206 3 479.18 0.99 3 015 H2 9.50 1.00 3 009 3 463.75 0.98 2 997 H3 9.36 1.00 2 596 3 199.58 0.98 2 571 H4 9.52 1.00 2 773 3 369.97 0.98 2 775 S1 9.21 1.00 2 575 3 194.58 0.98 2 572 S2 9.10 0.99 2 587 3 035.49 0.99 2 587 表 3 人工湿地前20位细菌属的相对丰度
Table 3. Relative abundance of top 20 bacterial genera in constructed wetland (%)
微生物 H1 H2 H3 H4 S1 S2 Sphingomonas 3.59 2.73 1.27 1.57 0.67 0.52 Lysobacter 2.06 0.77 1.83 1.35 2.86 0.83 12up 0.58 0.18 4.25 3.00 0.32 0.54 Arenimonas 0.18 0.50 0.49 0.31 3.69 1.65 Geobacter 0.26 0.20 0.41 1.13 2.27 1.79 Dyella 0.02 0.01 4.33 1.55 0.01 0.07 Terrimonas 0.96 1.31 0.57 0.92 0.97 0.21 Denitratisoma 0.54 0.12 0.68 1.12 1.30 1.17 Bacillus 0.50 2.33 0.97 0.53 0.09 0.16 Nitrospira 0.10 0.42 1.01 1.61 1.09 0.32 Pseudarthrobacter 0.54 1.39 0.03 0.01 1.95 0.23 Thiobacillus 0.16 0.06 0.55 0.91 0.42 1.87 Marmoricola 2.03 0.15 0.34 0.63 0.07 0.56 groundwater 0.01 0.04 0.46 2.29 0.84 0.09 uncultured 1.33 0.67 0.56 0.33 0.26 0.53 Leptolinea 0.80 0.22 0.69 0.27 0.33 0.96 Sarcina 0.02 3.02 0.01 0.09 0.02 0.01 Opitutus 0.26 0.16 0.61 0.54 0.95 0.45 Nocardioides 1.18 0.39 0.31 0.55 0.26 0.27 Variibacter 0.48 0.72 0.42 0.59 0.44 0.16 -
[1] SUN B, ZHANG L, YANG L, et al. Agricultural non-point source pollution in China: Causes and mitigation measures[J]. Ambio, 2012, 41(4): 370-379. doi: 10.1007/s13280-012-0249-6 [2] WANG X Y. Management of agricultural nonpoint source pollution in China: Current status and challenges[J]. Water Science and Technology, 2006, 53(2): 1-9. doi: 10.2166/wst.2006.033 [3] 李清波, 黄国宏, 王颜红, 等. 阿特拉津生态风险及其检测和修复技术研究进展[J]. 应用生态学报, 2002, 13(5): 625-628. [4] 赵玲, 滕应, 骆永明. 中国农田土壤农药污染现状和防控对策[J]. 土壤, 2017, 49(3): 417-427. [5] MURPHY I J, COATS J R. The capacity of switchgrass (panicum virgatum) to degrade atrazine in a phytoremediation setting[J]. Environmental Toxicology and Chemistry, 2011, 30(3): 715-722. doi: 10.1002/etc.437 [6] 朱兆良, 孙波, 杨林章, 等. 我国农业面源污染的控制政策和措施[J]. 科技导报, 2005, 23(4): 47-51. [7] 崔键, 马友华, 赵艳萍, 等. 农业面源污染的特性及防治对策[J]. 中国农学通报, 2006, 22(1): 335-340. [8] 李霆, 李强强, 姜艳军, 等. 二氧化硅纳米花固定化酶及其有机磷农药降解性能[J]. 江苏农业科学, 2022, 50(10): 104-109. [9] 刘绍雄, 李建英, 刘春丽, 等. 平菇漆酶对农药六六六降解作用研究[J]. 中国食用菌, 2018, 37(5): 66-69. [10] HUANG Y, XIAO L, LI F, et al. Microbial degradation of pesticide residues and an emphasis on the degradation of cypermethrin and 3-phenoxy benzoic acid: A review[J]. Molecules, 2018, 23(9): 2313. doi: 10.3390/molecules23092313 [11] 梁春华. 铒掺杂二氧化钛光催化降解甲胺磷农药的研究[J]. 吉林农业大学学报, 2012, 34(5): 536-539. [12] SENTHILNATHAN J, PHILIP L. Removal of mixed pesticides from drinking water system by photodegradation using suspended and immobilized TiO2[J]. Journal Of Environmental Science And Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 2009, 44(3): 262-270. [13] MATAMOROS V, GARCÍA J, BAYONA J M. Organic micropollutant removal in a full-scale surface flow constructed wetland fed with secondary effluent[J]. Water Research, 2008, 42(3): 653-660. doi: 10.1016/j.watres.2007.08.016 [14] 吴晓磊. 人工湿地废水处理机理[J]. 环境科学, 1995(3): 83-86+96. doi: 10.3321/j.issn:0250-3301.1995.03.024 [15] LOCKE M A, WEAVER M A, ZABLOTOWICZ R M, et al. Constructed wetlands as a component of the agricultural landscape: Mitigation of herbicides in simulated runoff from upland drainage areas[J]. Chemosphere, 2011, 83(11): 1532-1538. doi: 10.1016/j.chemosphere.2011.01.034 [16] PASSEPORT E, TOURNEBIZE J, CHAUMONT C, et al. Pesticide contamination interception strategy and removal efficiency in forest buffer and artificial wetland in a tile-drained agricultural watershed[J]. Chemosphere, 2013, 91(9): 1289-1296. doi: 10.1016/j.chemosphere.2013.02.053 [17] MAILLARD E, PAYRAUDEAU S, FAIVRE E, et al. Removal of pesticide mixtures in a stormwater wetland collecting runoff from a vineyard catchment[J]. Science of the Total Environment, 2011, 409(11): 2317-2324. doi: 10.1016/j.scitotenv.2011.01.057 [18] 丁丽娜, 梁媛, 赵奔. 一株高效阿特拉津降解菌株的筛选及其降解能力和机理[J]. 环境化学, 2023, 42(5): 1623-1632. [19] BUCCI P, COPPOTELLI B, MORELLI I, et al. Micronutrients and COD/N ratio as factors influencing granular size and SND in aerobic granular sequencing batch reactors operated at low organic loading[J]. Journal of Water Process Engineering, 2022, 46: 102625. doi: 10.1016/j.jwpe.2022.102625 [20] YAO D, DAI N, HU X, et al. New insights into the effects of wetland plants on nitrogen removal pathways in constructed wetlands with low C/N ratio wastewater: Contribution of partial denitrification-anammox[J]. Water Research, 2023, 243: 120277. doi: 10.1016/j.watres.2023.120277 [21] 龚深, 巢传鑫, 邹冬生, 等. 人工湿地中植物对污染物去除机理研究进展[J]. 湿地科学, 2023, 21(6): 927-935. [22] 叶新强, 鲁岩, 张恒. 除草剂阿特拉津的使用与危害[J]. 环境科学与管理, 2006, 32(8): 95-97. [23] MOORE M T, BENNETT E R, COOPER C M, et al. Transport and fate of atrazine and lambda-cyhalothrin in an agricultural drainage ditch in the Mississippi Delta, USA[J]. Agriculture, Ecosystems & Environment, 2001, 87(3): 309-314. [24] 白献宇, 胡小贞, 庞燕. 洱海流域低污染水类型、污染负荷及分布[J]. 湖泊科学, 2015, 27(2): 200-207. [25] 王宇娜, 国晓春, 卢少勇, 等. 人工湿地对低污染水中氮去除的研究进展: 效果、机制和影响因素[J]. 农业资源与环境学报, 2021, 38(5): 722-734. [26] 王庆海, 夏凡, 李翠, 等. 黄菖蒲对水中阿特拉津污染的去除贡献研究[J]. 农业环境科学学报, 2020, 39(11): 2613-2620. doi: 10.11654/jaes.2020-0543 [27] 杨凯, DMITRY B, 李成云, 等. 固液萃取-高效液相色谱-串联质谱法同时测定土壤中阿特拉津及其降解产物[J]. 分析科学学报, 2017, 33(4): 478-482. [28] 武淑文, 侯磊, 刘云根, 等. 湿地植物香蒲根系抗氧化酶活性和根系分泌物对阿特拉津胁迫的响应[J]. 农业环境科学学报, 2021, 40(12): 2751-2760. doi: 10.11654/jaes.2021-0205 [29] KNAUERT S, SINGER H, HOLLENDER J, et al. Phytotoxicity of atrazine, isoproturon, and diuron to submersed macrophytes in outdoor mesocosms[J]. Environmental Pollution, 2010, 158(1): 167-174. doi: 10.1016/j.envpol.2009.07.023 [30] LYTLE J S, LYTLE T F. Atrazine effects on estuarine macrophytes Spartina alterniflora and Juncus roemerianus[J]. Environmental Toxicology and Chemistry, 1998, 17(10): 1972-1978. doi: 10.1002/etc.5620171012 [31] 王庆海, 李翠, 陈超, 等. 芦苇对阿特拉津胁迫的生理响应及其与耐受性的关系[J]. 农业环境科学学报, 2017, 36(10): 1968-1977. [32] LI Y, LU J, DONG C, et al. Physiological and biochemical characteristics and microbial responses of Medicago sativa (Fabales: Fabaceae) varieties with different resistance to atrazine stress[J]. Frontiers in Microbiology, 2024, 15: 1447348. doi: 10.3389/fmicb.2024.1447348 [33] 董静. AMF-美人蕉共生系统降解水中阿特拉津特性的研究[D]. 哈尔滨: 哈尔滨工业大学, 2017. [34] DONG J, WANG L, MA F, et al. Effects of funnelliformis mosseae inoculation on alleviating atrazine damage in canna indica l. Var. Flava roxb[J]. International Journal of Phytoremediation, 2017, 19(1): 46-55. doi: 10.1080/15226514.2016.1216079 [35] WANG Z, SUN X, RU S, et al. Effects of co-exposure of the triazine herbicides atrazine, prometryn and terbutryn on Phaeodactylum tricornutum photosynthesis and nutritional value[J]. Science of the Total Environment, 2022, 807: 150609. doi: 10.1016/j.scitotenv.2021.150609 [36] 符东, 付馨烈, 王成端, 等. 稳定表流-潜流组合人工湿地系统处理生活污水的研究[J]. 环境工程技术学报, 2020, 10(4): 598-605. [37] LAND M, GRANÉLI W, GRIMVALL A, et al. How effective are created or restored freshwater wetlands for nitrogen and phosphorus removal? A systematic review protocol[J]. Environmental Evidence, 2013, 2(1): 16. doi: 10.1186/2047-2382-2-16 [38] 李林锋, 年跃刚, 蒋高明. 植物吸收在人工湿地脱氮除磷中的贡献[J]. 环境科学研究, 2009, 22(3): 337-342. [39] 丁怡, 王玮, 王宇晖, 等. 溶解氧和碳源在人工湿地脱氮中的耦合关系分析[J]. 工业水处理, 2015, 35(1): 5-8. [40] MEUTIA A A. Treatment of laboratory wastewater in a tropical constructed wetland comparing surface and subsurface flow[J]. Water Science and Technology, 2001, 44(11/12): 499-506. [41] 潘傲, 张智, 孙磊, 等. 种植不同植物的表面流人工湿地净化效果和微生物群落差异分析[J]. 环境工程学报, 2019, 13(8): 1918-1929. doi: 10.12030/j.cjee.201812182 [42] VYMAZAL J, BFEZINOVA T. The use of constructed wetlands for removal of pesticides from agricultural runoff and drainage: A review[J]. Environment International, 2015, 75: 11-20. doi: 10.1016/j.envint.2014.10.026 [43] IMFELD G, LEFRANCQ M, MAILLARD E, et al. Transport and attenuation of dissolved glyphosate and AMPA in a stormwater wetland[J]. Chemosphere, 2013, 90(4): 1333-1339. doi: 10.1016/j.chemosphere.2012.04.054 [44] XIN X, XIE J, LI W, et al. New insights into microbial fuel cells for saline wastewater treatment: Bioelectrogenesis evaluation, microbial interactions and salinity resource reuse[J]. Process Safety and Environmental Protection, 2022, 168: 314-323. doi: 10.1016/j.psep.2022.09.077 [45] FANG Y, WANG H, HAN J, et al. Enhanced nitrogen removal of constructed wetlands by coupling with the bioelectrochemical system under low temperature: Performance and mechanism[J]. Journal of Cleaner Production, 2022, 350: 131365. doi: 10.1016/j.jclepro.2022.131365 [46] RAZA S, KANG K H, SHIN J, et al. Variations in antibiotic resistance genes and microbial community in sludges passing through biological nutrient removal and anaerobic digestion processes in municipal wastewater treatment plants[J]. Chemosphere, 2023, 313: 137362. doi: 10.1016/j.chemosphere.2022.137362 [47] YANG Z, LIU J, CAO J, et al. A comparative study of pilot-scale bio-trickling filters with counter- and cross-current flow patterns in the treatment of emissions from chemical fibre wastewater treatment plant[J]. Bioresource Technology, 2017, 243: 78-84. doi: 10.1016/j.biortech.2017.06.060 [48] XIE F, Thiri M, WANG H. Simultaneous heterotrophic nitrification and aerobic denitrification by a novel isolated Pseudomonas mendocina X49[J]. Bioresource Technology, 2021, 319: 124198. doi: 10.1016/j.biortech.2020.124198 [49] YUN L, YU Z, LI Y, et al. Ammonia nitrogen and nitrite removal by a heterotrophic Sphingomonas sp. strain LPN080 and its potential application in aquaculture[J]. Aquaculture, 2019, 500: 477-484. doi: 10.1016/j.aquaculture.2018.10.054 [50] LI Y, PAN Z, LIAO J, et al. Micro-aeration and low influent C/N are key environmental factors for achieving Anammox in livestock farming wastewater treatment plants[J]. Water Research, 2023: 120141. [51] QIAO Z, SUN R, WU Y, et al. Characteristics and metabolic pathway of the bacteria for heterotrophic nitrification and aerobic denitrification in aquatic ecosystems[J]. Environmental Research, 2020, 191: 110069. doi: 10.1016/j.envres.2020.110069 [52] 李娜, 吉莉, 张桂香. 除草剂阿特拉津生物降解研究进展[J]. 太原科技大学学报, 2020, 41(2): 158-164. [53] 于凡, 谭凤训, 罗从伟, 等. 日光/氯氧化体系降解阿特拉津的效能及机理研究[J]. 工业水处理, 2023, 43(5): 77-84. -



 下载:
下载: