-
目前,抗生素已被广泛应用于医疗、水产和畜禽养殖业等,在人类和动物疾病防治等方面发挥极大的作用,但进入各类水体中的抗生素污染物对水生生态系统和人体健康造成了严重威胁[1]。与其他类型的废水相比,抗生素废水具有毒性大、成分复杂、有机物浓度高以及可生化性差等特点,传统的废水处理方法效果不佳[2]。因此,亟需研发去除水中抗生素污染物的高效降解技术。
光催化作为一种绿色高效的技术已受到了广泛关注,近年来,Bi系半导体光催化剂被大量报道,如Bi2O3[3-4]、BiWO6[5]、BiVO4[6]、BiMoO6[7]、BiOX(X=Cl,Br,I)[8-10]。其中,Bi2O3已被证明是一种很有前途的可见光响应催化剂,其具有独特的性能,如有相对窄带隙(2.5~2.8 eV),深的价带(EVB=3.13 eV)、环境友好、稳定性能好等[11]。然而,Bi2O3仍存在一些局限性,如光生电子/空穴对的快速复合,其导带边缘的电位(ECB=0.33 eV)不足以激发电子还原氧分子,导致Bi2O3的光催化活性较低,从而在较大程度上限制了其在净化水中的实际应用[12]。金属离子掺杂或与其他半导体的耦合,常被用来提高Bi2O3的光催化活性,比如原子掺杂[13]、修饰形成壳核纳米结构[14]、异质结的构建[15-16]等。
过一硫酸盐(PMS)[17]是可代替H2O2的一种氧化剂,固体PMS稳定、方便运输和储存,其非对称结构容易被过渡金属离子、紫外光和热等活化[18-19]。其中,过渡金属催化过一硫酸盐氧化技术,由于成本低,活化能力强和较低的能耗被认为是有潜力的高级氧化技术[20]。Cu、Fe、Mn和Co已被证明能激活PMS[21]。CuO通过Cu2+/Cu+的氧化还原循环,可促进PMS持续有效地活化并提高污染物的氧化去除率[22-24]。过渡金属离子活化的均相体系操作简单方便,然而过渡金属离子(Fe2+等)易被氧化或沉淀,导致催化剂不能重复利用,不仅导致
${\rm{SO}}_4^{ - \cdot }$ 减少,而且出水铁离子浓度过高并产生大量含铁化学污泥[25]。本研究利用沉淀-浸渍法成功地制备了一种可见光响应的复合催化剂CuO/Bi2O3,并将光催化技术和过一硫酸盐氧化进行耦合,构建了CuO/Bi2O3+Vis+PMS催化氧化体系,以盐酸四环素(TC-HCl)为目标污染物,考察了不同催化体系对于TC-HCl降解的活性和影响因素,以及催化剂的稳定性,并探讨了可见光响应的复合催化剂CuO/Bi2O3催化降解TC-HCl的光催化活化PMS的反应机理。
全文HTML
-
实验试剂:过硫酸氢钾(KHSO5·0.5KHSO4·0.5K2SO4,PMS)购买自阿拉丁工业公司;五水合硝酸铋(Bi(NO3)3·5H2O)、甲醇(CH4O)、二水合氯化铜(CuCl2·2H2O)、叔丁醇(C4H10O)、硝酸(HNO3)、氢氧化钠(NaOH)、乙醇(C2H6O),乙二胺四乙酸二钠(C10H14N2Na2O8)均为分析纯,购自成都市科龙化学品有限公司;盐酸四环素(C22H25ClN2O8,TC-HCl)为生物技术级,购自上海麦克林生化有限公司;实验室用水为超纯水。
实验仪器:电子天平(AX224ZH,奥豪斯仪器(常州)有限公司);紫外可见分光光度计(UV-mini 1280,岛津仪器(苏州)有限公司);磁力搅拌器(color squid,德国IKA/艾卡);迷你马弗炉(MF-1100C-S,安徽贝意克设备技术有限公司);磁力加热搅拌器(MS-H-Pro+,大龙兴创实验仪器(北京)有限公司);实验室pH计(ST3100,奥豪斯仪器(常州)有限公司);电热恒温鼓风干燥箱(WGL-458,天津市泰斯特仪器有限公司);医用离心机(TQ16-WS,长沙湘仪离心机仪器有限公司);氙灯(CEL-HXUV300,北京中教金源科技有限公司);超声清洗器(KQ-500E,昆山市超声仪器有限公司);X射线衍射仪(X' Pert PRO MPD),荷兰帕纳科公司);紫外可见漫反射光谱仪(Lambda 750 S,美国PerkinElmer公司);X射线光电子能谱仪(ESCALAB 250 Xi,美国Thermo Fisher Scinentific公司);场发射扫描电子显微镜附加X-Max 50 X射线能谱仪(Field emission scanning electron microscope Zeiss Ultra Plus,德国蔡司);ICP-MS(PerkinElmer NexION 300X,美国PerkinElmer公司);纳米粒度及Zeta电位分析(马尔文ZS90,英国马尔文公司);TOC测定仪(TOC-VCPH,日本岛津);液质联用LCMS(安捷伦qtof6550)。
-
1) Bi2O3的制备。以五水合硝酸铋(Bi2(NO3)3·5H2O)为原料制备Bi2O3。制备方法如下:将10.0 g五水合硝酸铋溶解于30 mL硝酸(2 mol·L−1)的水溶液中,在磁力搅拌下,将1 mol·L−1的氢氧化钠溶液滴加到上述溶液中,调节溶液至pH>13,持续搅拌至白色悬浮物变成黄色悬浮物,然后在水浴80 ℃下搅拌加热2 h。待冷却后,用去离子水和乙醇离心洗涤数次来除去杂质离子,然后60 ℃干燥12 h。将以上所得材料在马弗炉中450 ℃煅烧5 h。
2) CuO/Bi2O3复合催化剂的制备。将上述制备的1.0 g Bi2O3和0.04 g二水合氯化铜(CuCl2·2H2O)混合加入到10 mL去离子水中,磁力搅拌下,将悬浮溶液水浴加热(90 ℃,1 h),冷却后用去离子水和乙醇洗涤数遍,然后烘箱60 ℃干燥过夜,收集得到CuO/Bi2O3。
-
通过降解TC-HCl测试催化剂的光催化活化PMS的活性,室温下(20±3) ℃,在250 mL的烧杯中将20 mg催化剂样品溶解在TC-HCl(100 mL,40 mg·L−1)溶液中。首先,在黑暗中磁力搅拌悬浮液30 min,达到吸附-解吸平衡,吸附达到饱和,然后,在溶液中加入PMS,打开灯(可见光源由氙灯提供λ>420 nm)。在一定的时间间隔内,提取3 mL的样品,并在样品中加入淬灭剂甲醇(MeOH)以消除自由基。接下来,对样品进行离心去除催化剂。然后,用紫外-可见分光光度计在TC-HCl的特征吸收波长357 nm处测定样品吸光度,并进而分析TC-HCl的浓度变化。TC-HCl溶液的降解率根据式(1)进行计算。
式中:μ为降解率;C和C0分别表示TC-HCl的降解浓度和初始浓度;mg·L−1。
为了研究PMS浓度的影响,在催化体系中分别加入2、5、10、20 mmol·L−1 PMS。为了研究催化剂投加量的影响,在体系中分别加入催化剂为0.05、0.1、0.2和0.3 g·L−1的CuO/Bi2O3。为研究酸碱性的变化对降解实验,用NaOH和HNO3调节pH分别为4、7、10和12,比较不调节时(pH=4.9)TC-HCl降解率的变化。为检测自由基,在反应器中加入自由基猝灭剂,其中叔丁醇(TBA)用于捕获·OH,而MeOH用于捕获·OH和
${\rm{SO}}_4^{ - \cdot }$ ,乙二胺四乙酸二钠(EDTA-2Na)用于抑制空穴(h+),N2用于抑制$ \cdot {\rm{O}}_2^ - $ 。对于CuO/Bi2O3的稳定性和可重复性实验,反应后离心样品,用蒸馏水和乙醇分别洗涤数次,60 ℃干燥回收后重复实验。
1.1. 试剂与仪器
1.2. 催化剂的制备
1.3. TC-HCl的催化降解实验
-
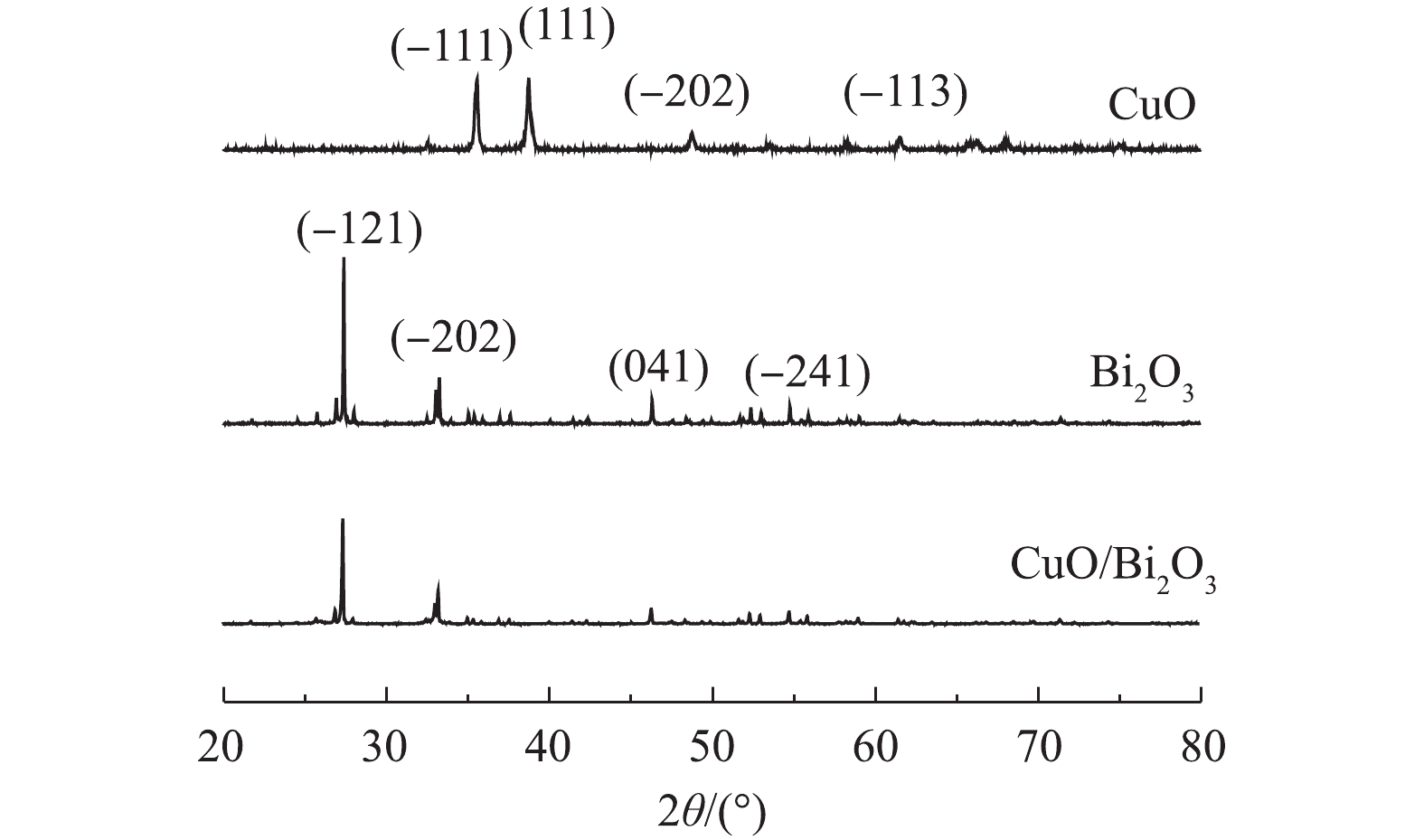
1)XRD分析。Bi2O3和CuO/Bi2O3复合催化剂的XRD谱图如图1所示。对于单独的Bi2O3,可观察到25.7°、27.4°、33.2°、35.0°、37.6°、44.3°、45.1°、46.3°、52.4°、54.8°、57.9°、59.1°的特征衍射峰,分别对应于Bi2O3的标准卡片(PDF-#71-2274)的(002)、(−121)、(−202)、(−212)、(−113)、(040)、(023)、(041)、(−322)、(−241)、(024)和(150)晶面。所有衍射峰均表现出良好的Bi2O3单斜晶相,窄而尖锐的衍射峰表现出Bi2O3有良好的结晶性。由图1可知,CuO/Bi2O3复合催化剂的XRD衍射峰与Bi2O3相似,表明复合CuO后并没有改变Bi2O3的结构;相比于Bi2O3,复合催化剂CuO/Bi2O3衍射峰变弱,但并未出现新的衍射峰,其原因可能是CuO复合量少。
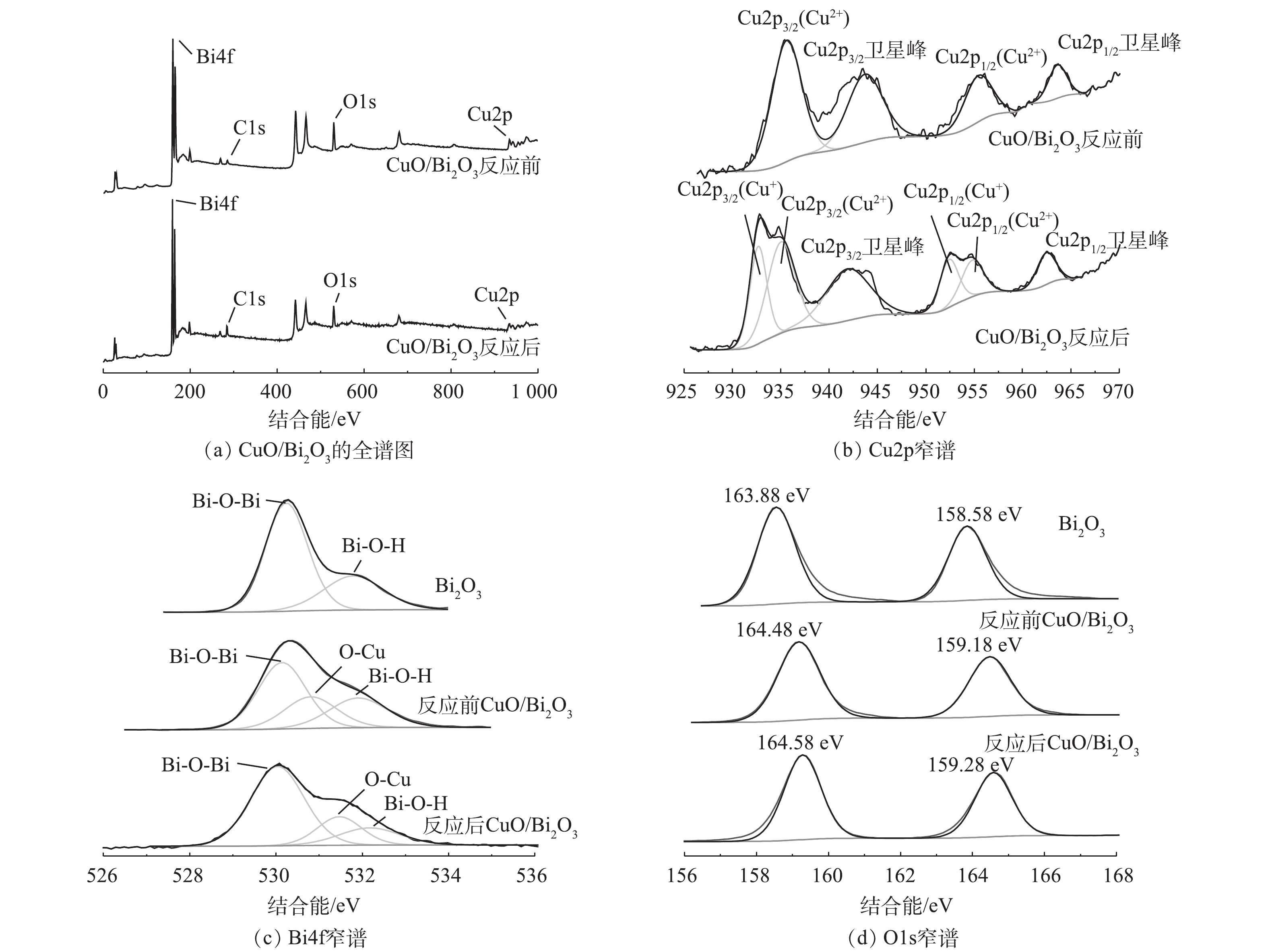
2)XPS光谱分析。由图2(a)可知,CuO/Bi2O3复合材料主要由Bi、O以及Cu元素组成。由图2(b)清晰地观察到,在Cu2p光谱中位于925.00~970.00 eV的峰,CuO/Bi2O3在935.70 eV和955.70 eV处观察到2个相对较强的峰分别对应Cu2p3/2和Cu2p1/2,以及由Cu外电子震荡过程所致的,在944.50 eV和963.20 eV处的Cu2p3/2和Cu2p1/2的伴随卫星峰,是Cu2+的特征峰[26]。反应后的催化剂,在941.88 eV和962.44 eV处的Cu2p的伴随卫星峰,以及在934.73 eV和954.72 eV为中心的优势峰可分别归因于复合材料中Cu2p3/2和Cu2p1/2,为Cu2+的特征;在932.55 eV和952.35 eV处的2个峰是由于在复合材料表面形成了Cu+[27-28],这是由于反应过程中Cu能激活PMS,发生了Cu2+与Cu+之间的电子转移所致(式(8)和式(9))。如图2(c)所示,在158.58 eV和163.88 eV处的可分别对应于Bi4f7/2和Bi4f5/2,这表明Bi元素是Bi3+[29]。在复合CuO以后,这2个峰同时右移,向高能量区转移,这可能是归因于CuO对Bi2O3的修饰效应。在图2(d)中,Bi2O3的高分辨O1s谱图在530.21 eV和531.78 eV处的峰对应于Bi2O3晶格氧(Bi—O—Bi)和表面氧(Bi—O—H),而CuO/Bi2O3复合催化剂的O1s谱图在530.14、530.79和531.89 eV处分为3个峰,在530.79 eV出现的新峰归属于CuO的晶格氧(O—Cu)[30];反应后O—Cu峰位右移,可能是产生了Cu+的所致。以上这些结果均表明,CuO已成功复合到催化剂中。
3)形貌分析。由图3(a)可知,Bi2O3是由许多微棒组成,长度为十几μm,直径约为1 μm,这一结果与之前研究中报道使用其他方法所制备的Bi2O3非常相似[12]。由图3(b)可见,CuO/Bi2O3复合催化剂是由许多纳米块状组成的微棒,且微棒的表面较为粗糙,无数的纳米片附着生长在微棒上,这表明CuO已均匀复合在Bi2O3上。
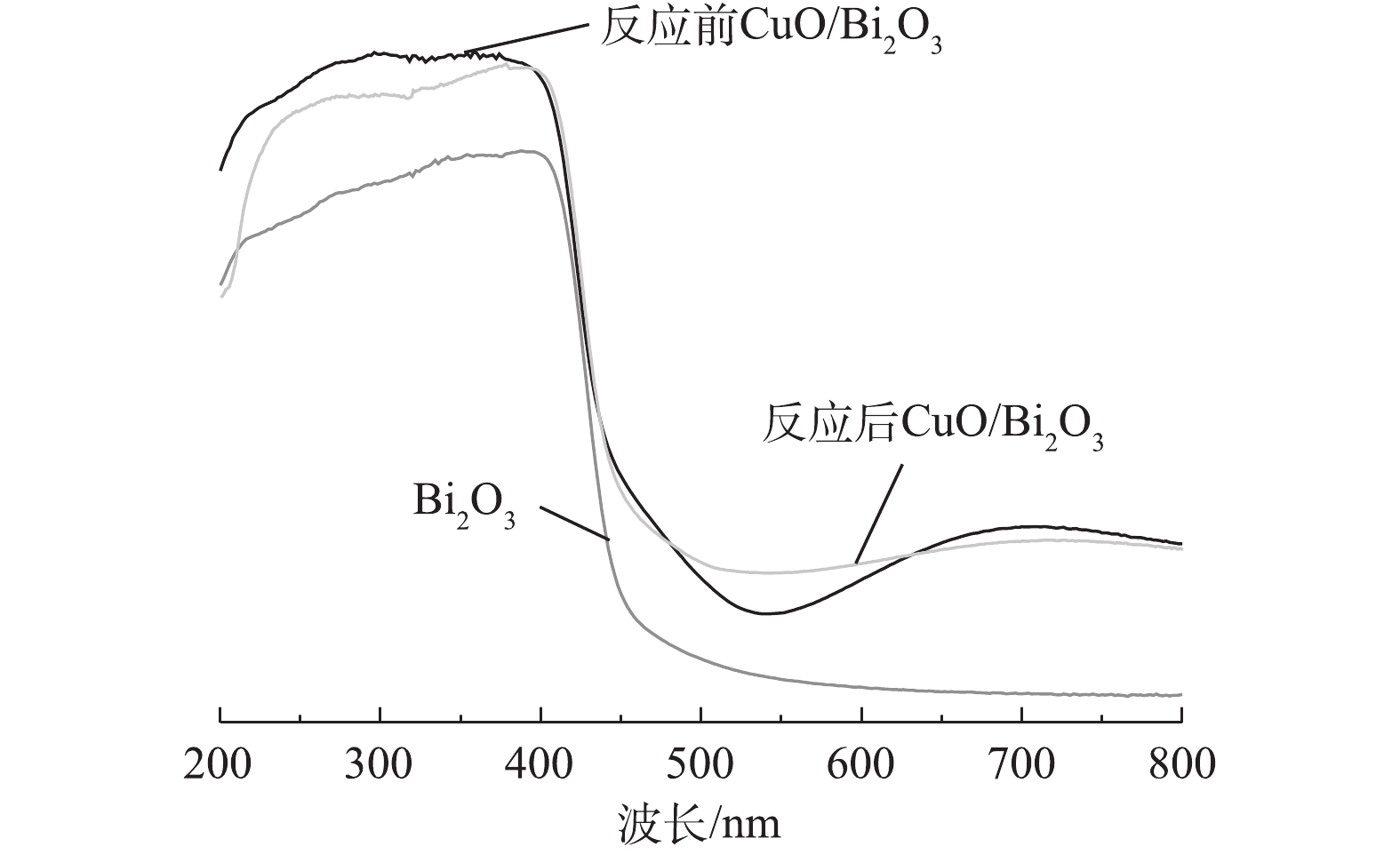
4)紫外-可见漫反射光谱分析。如图4所示,单独的Bi2O3在450 nm左右有较强的吸收,这是由于Bi2O3的本征带隙引起的。对于CuO/Bi2O3,吸收强度在420 nm开始增加,除了在420 nm处增强外,光谱还显示在450~530 nm和600~800 nm区域有较强的吸收带。这说明,经CuO修饰后可增强Bi2O3的可见光吸收强度。相比未使用的CuO/Bi2O3使用后的催化剂在500~600 nm处吸收强度增加,600~800 nm处稍有降低,结合图2(b)催化剂反应前后Cu2p窄谱的分析,反应后催化剂光谱强度变化的原因可归结为反应后的催化剂Cu2+有部分转化为Cu+[31-32]。
-
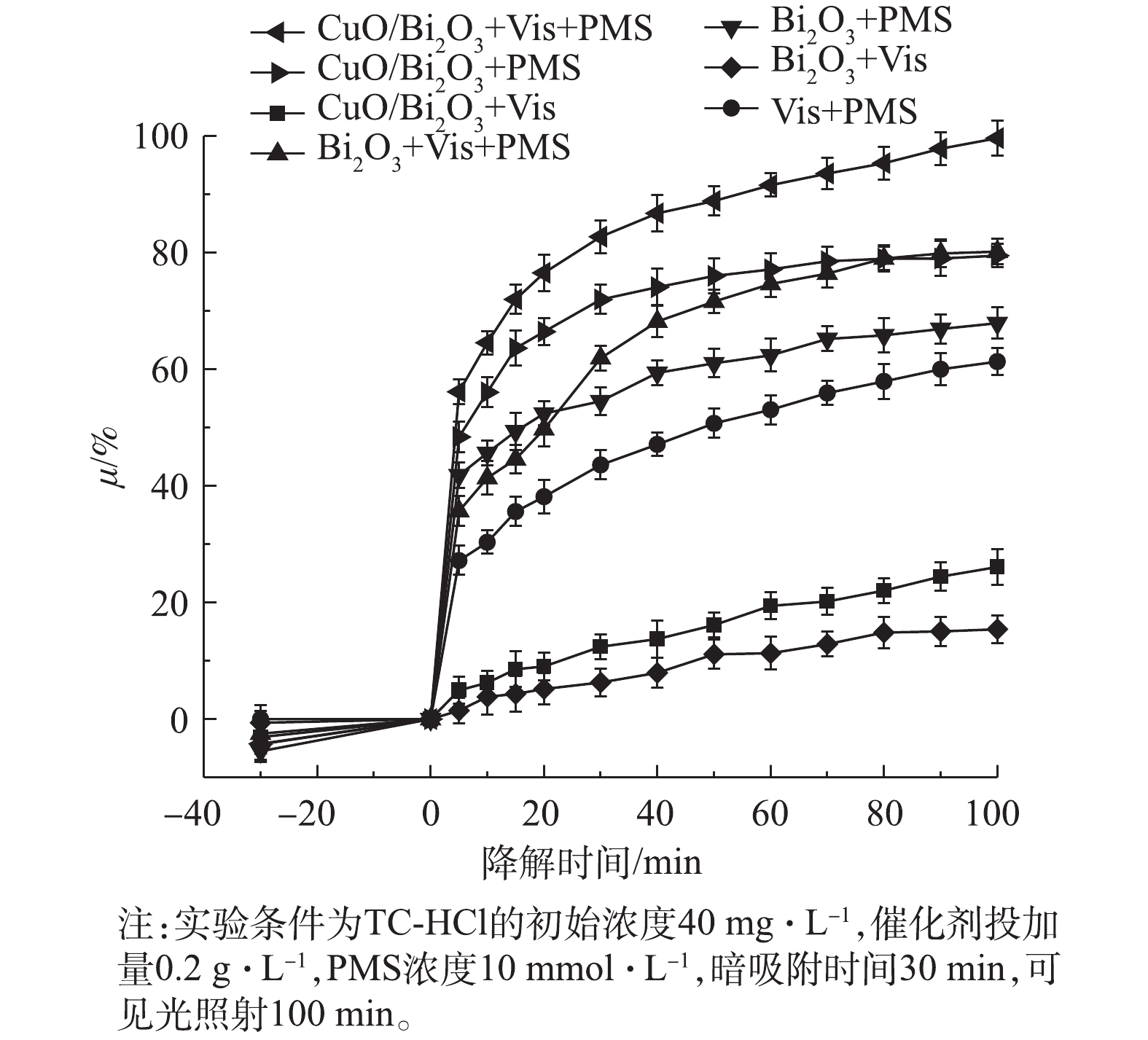
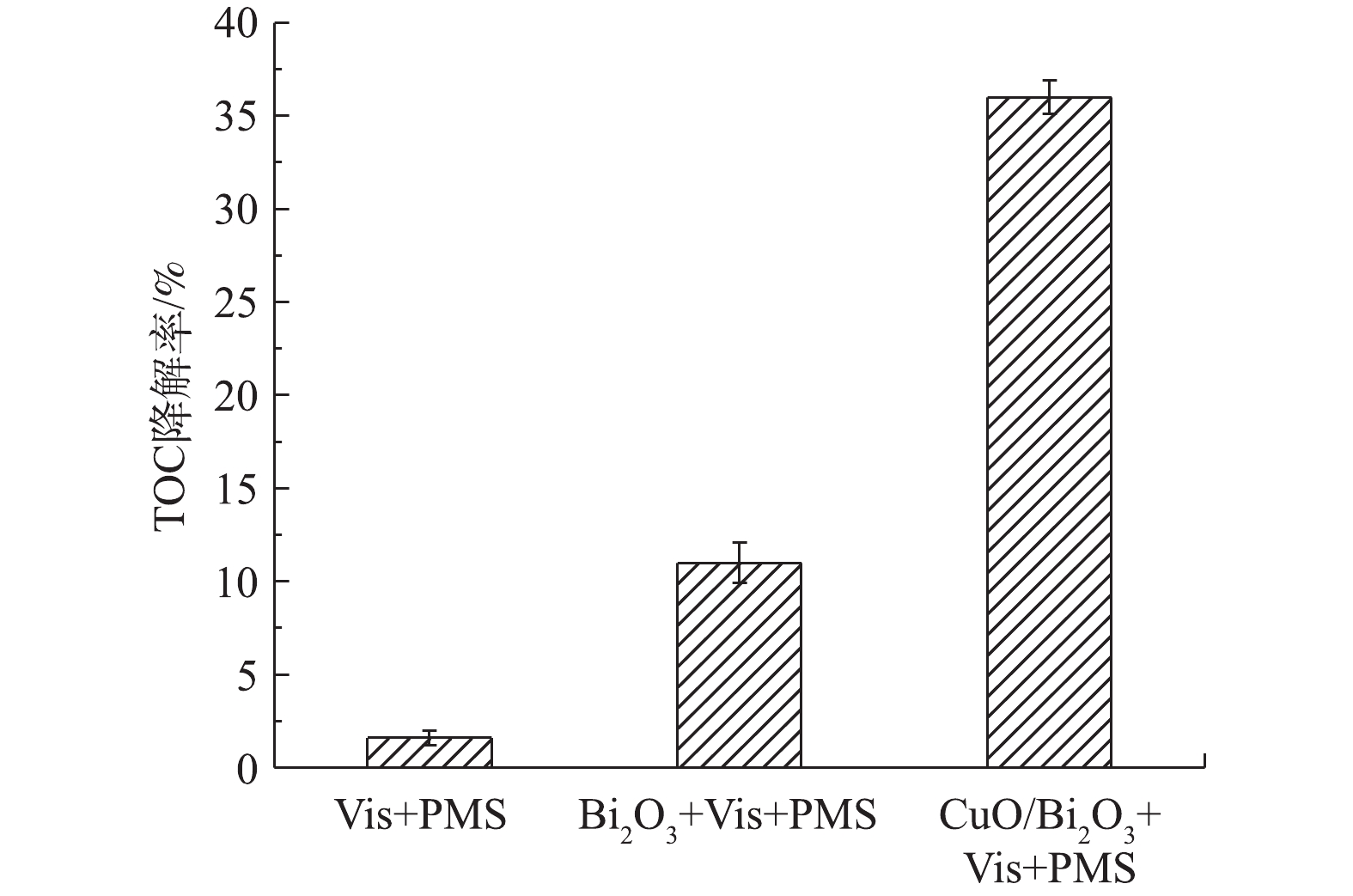
由图5可见,Bi2O3+Vis、CuO/Bi2O3+Vis、PMS+Vis、Bi2O3+PMS、CuO/Bi2O3+PMS、Bi2O3+ Vis+PMS和CuO/Bi2O3+Vis+PMS对TC-HCl的去除率分别为15.4%、26.1%、61.3%、67.8%、79.5%、80.1%和99.6%。在可见光照射下,于CuO/Bi2O3体系中加入PMS后,CuO/Bi2O3+Vis+PMS体系对TC-HCl的降解效果显著增强,且在100 min后降解率几乎可达100%。CuO/Bi2O3+Vis+PMS、Bi2O3+Vis+PMS、Vis+PMS 3种体系的TOC降解率分别为36.0%、11.5%、1.6%(图6),其中,CuO/Bi2O3+Vis+PMS体系是Bi2O3+Vis+PMS的3.1倍,是Vis+PMS的22.5倍。
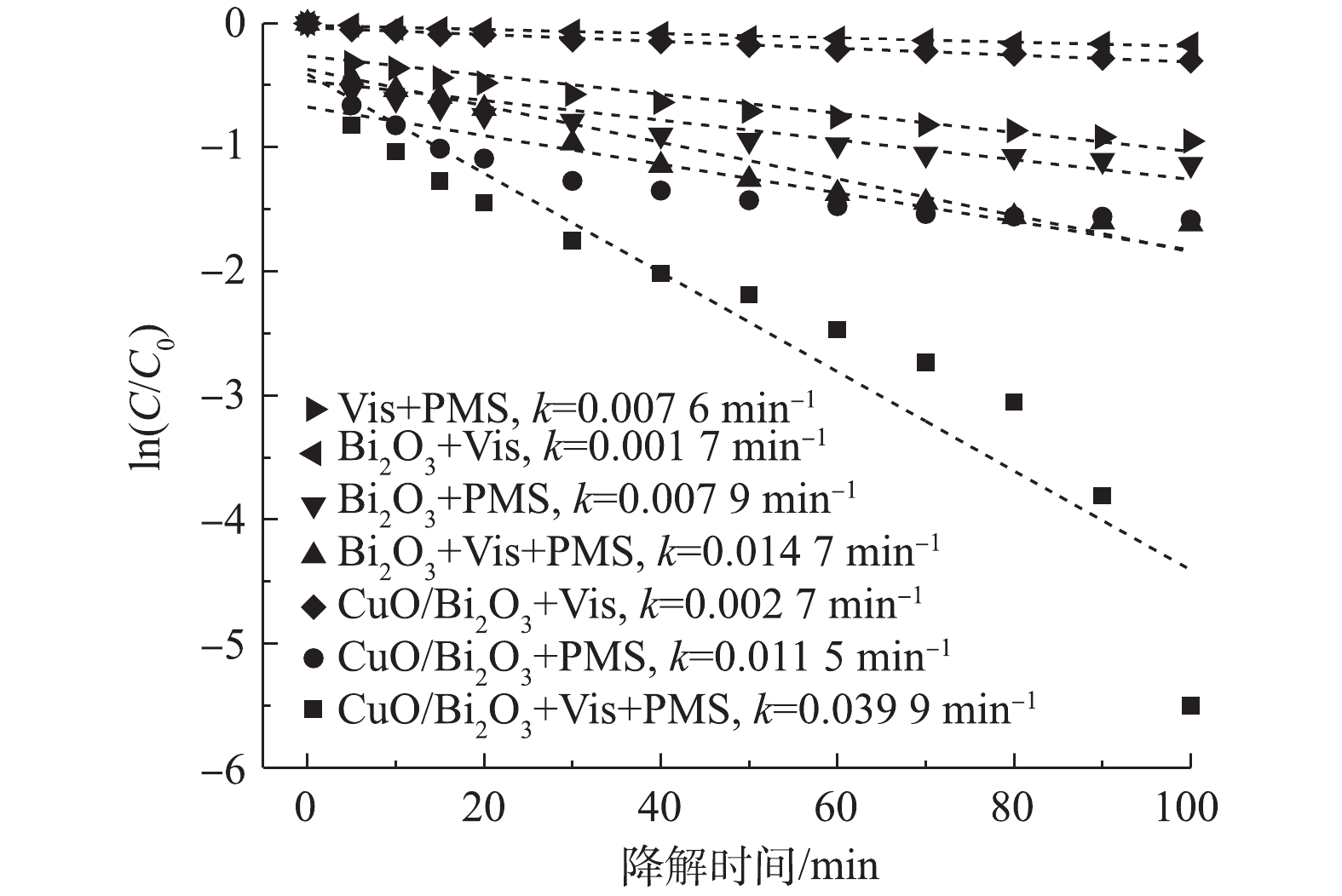
为了加深对降解过程的理解,引入了伪一级动力学模型来评价实验结果。动力学模型如式(2)所示。
式中:k为一级动力学常数,min−1;t为降解的时间,min。线性拟合结果见图7。CuO/Bi2O3+Vis+PMS体系的k值为0.039 9 min−1,是Bi2O3+Vis+PMS(0.012 8 min−1)体系的2.7倍,是Bi2O3+Vis(0.001 7 min−1)的23.5倍,是CuO/Bi2O3+Vis(0.002 7 min−1)的14.7倍,其中CuO/Bi2O3+Vis是Bi2O3+Vis的1.6倍。类似地,Bi2O3+PMS、CuO/Bi2O3+PMS体系对应的k值分别为0.007 9 min−1和0.011 5 min−1,CuO/Bi2O3+PMS体系对应的k值是Bi2O3+PMS的1.5倍。与Bi2O3催化剂相比,CuO的引入提高了复合催化剂CuO/Bi2O3的光催化活性,同时CuO也有助于活化PMS来提高整体催化剂的活性。
-
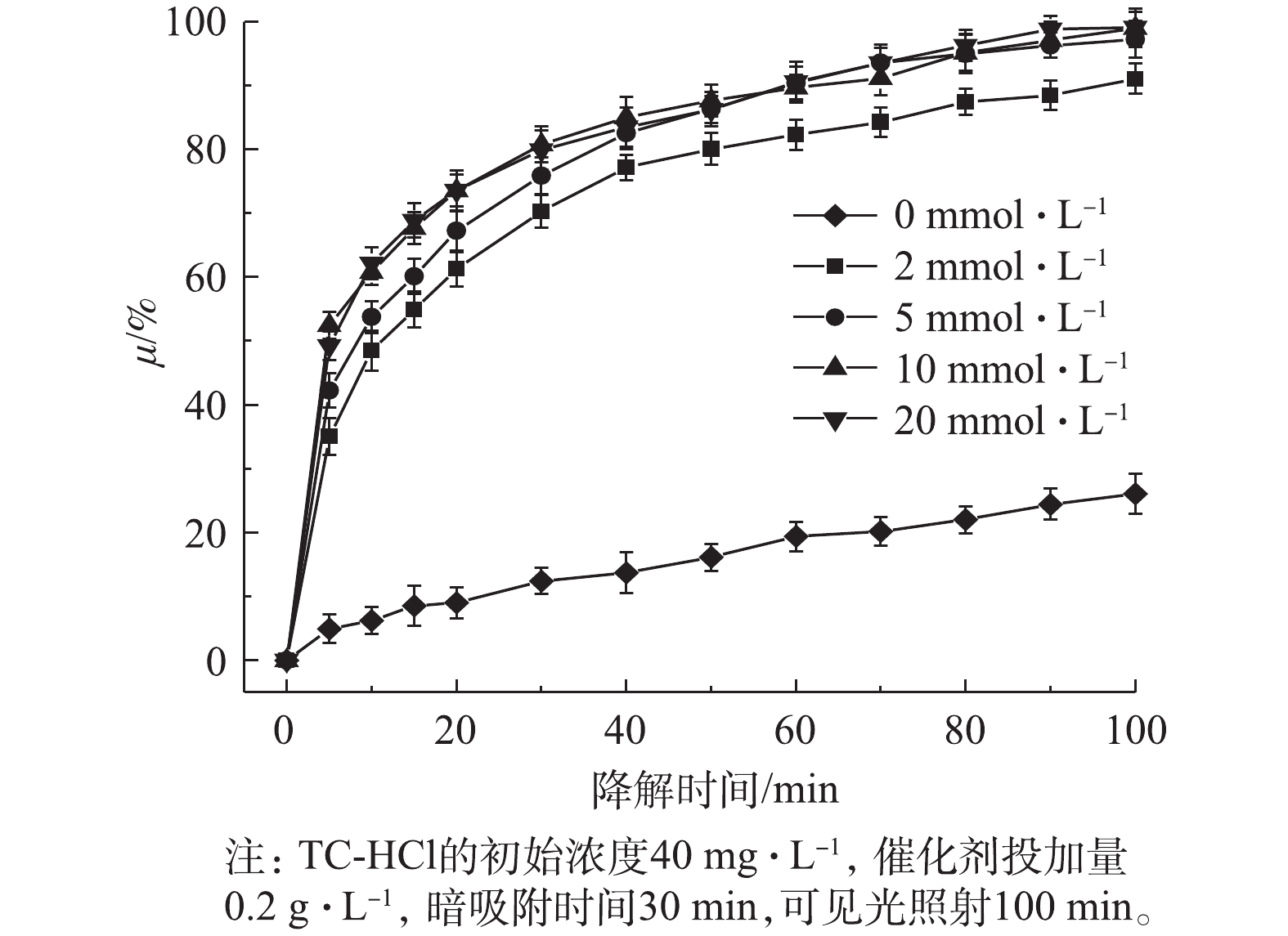
如图8所示,催化体系中加入2 mmol·L−1的PMS时,降解效率显著增加。当PMS的浓度增加到10 mmol·L−1时TC-HCl的催化降解速率可以达到100%,这表明较高浓度的PMS有助于产生更多的活性
${\rm{SO}}_4^{ - \cdot }$ 。然而,当PMS浓度进一步增加到20 mmol·L−1,TC-HCl的降解效率几乎不再增加,这是由于高浓度的PMS会发生自由基的淬灭,导致${\rm{SO}}_4^{ - \cdot }$ 自身反应生成${{\rm{S}}_2}{\rm{O}}_8^{2 - }$ 和${{\rm{S}}_2}{\rm{O}}_8^{ - \cdot }$ 。因此,本研究选用10 mmol·L−1的PMS作为TC-HCl催化降解的最佳浓度。 -
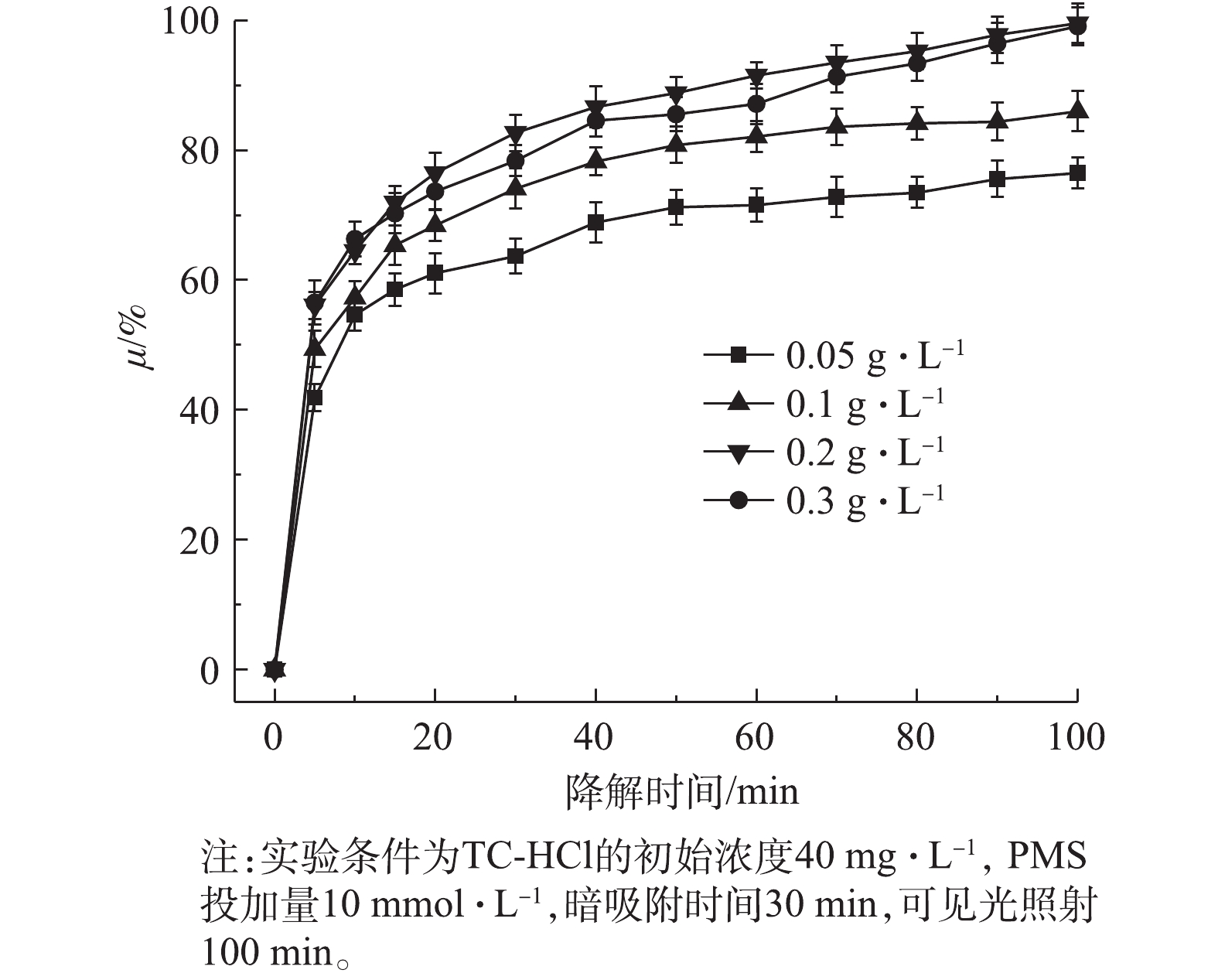
如图9所示,在可见光照射100 min内,当催化剂用量从0.05 g·L−1增加到0.2 g·L−1时,对TC-HCl的光催化去除率提高。进一步将光催化剂用量增加到0.3 g·L−1,TC-HCl的去除率并没有较大的变化。这是由于在较低的催化剂用量下没有足够的催化活性中心,催化活性较低[33]。此外,在催化剂用量过高的情况下,光催化剂颗粒的团聚和沉降所致,光穿透率降低,光散射效应发生,从而导致催化剂表面的活性中心数量减少,催化活性降低[34]。在催化剂用量为0.2 g·L−1和0.3 g·L−1时,在100 min时降解率几乎相同。考虑到材料成本,选择0.2 g·L−1的催化剂用量进行实验。
-
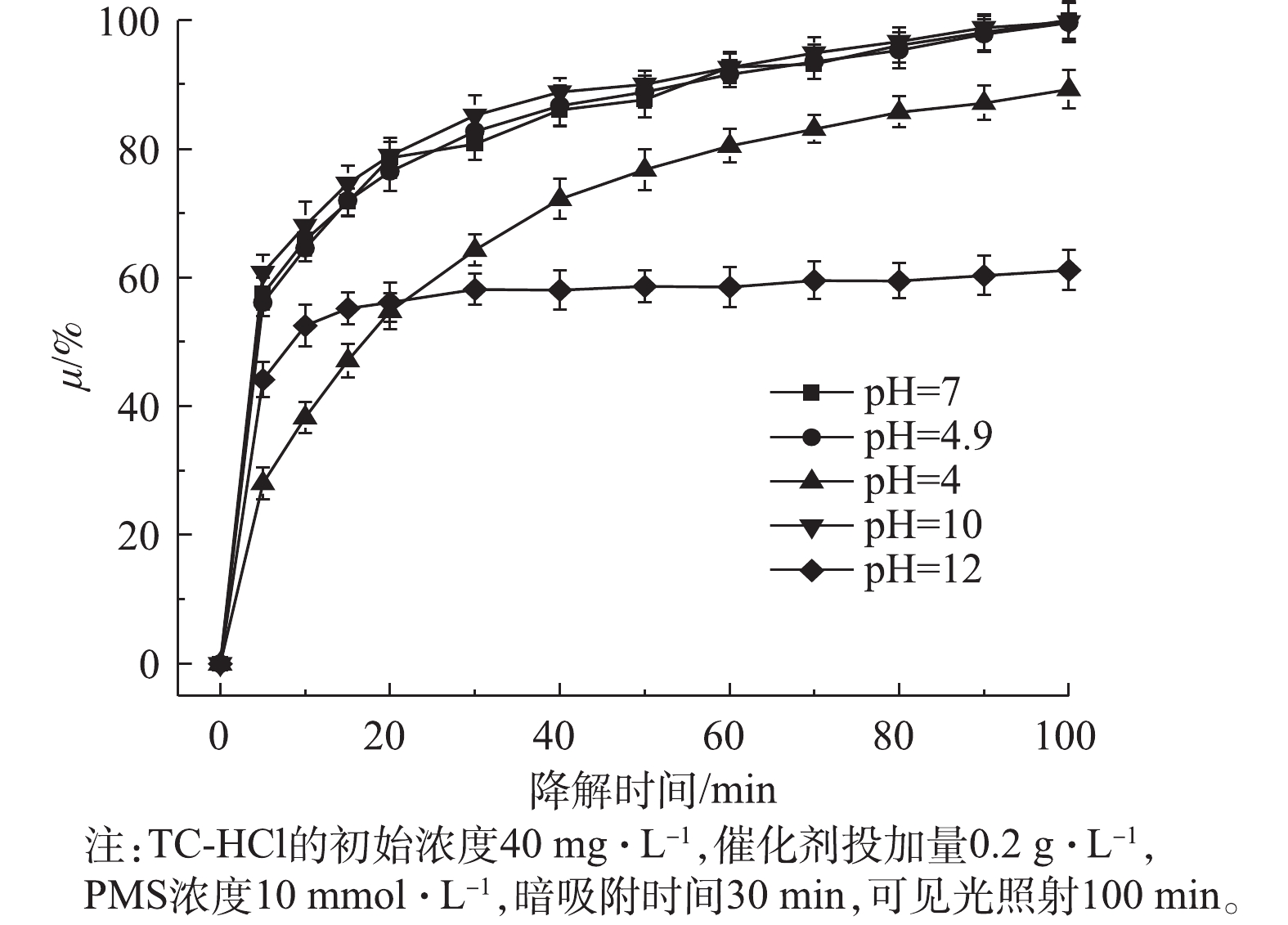
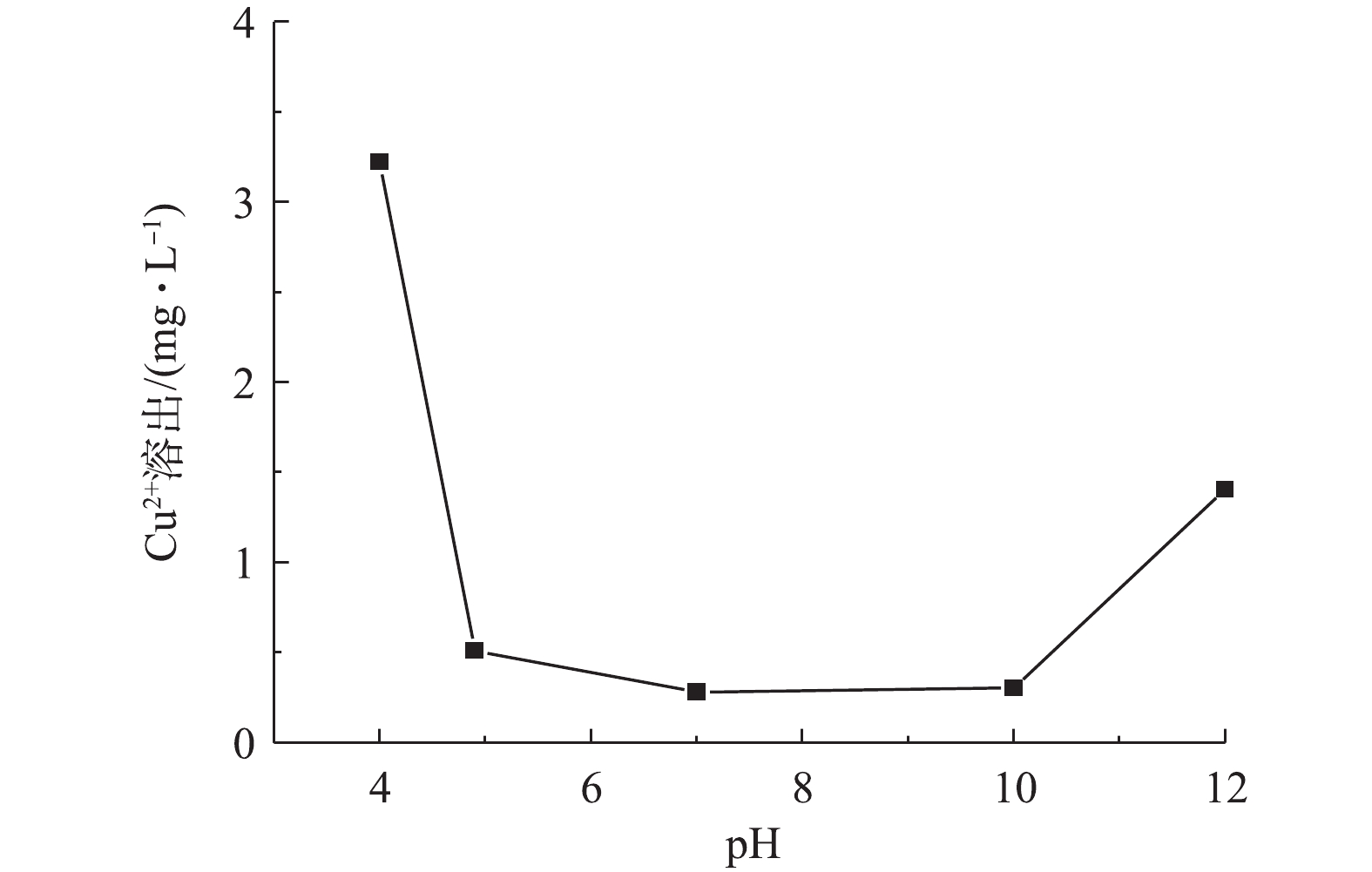
溶液pH影响催化剂的表面电荷和体系中自由基种类,进而影响TC-HCl的降解。因此,研究了不同溶液初始pH在CuO/Bi2O3+Vis+PMS体系中对TC-HCl降解的影响,结果如图10所示。未调节时悬浮溶液的初始pH为4.9,缓慢加入HCl或NaOH溶液调节溶液pH,分别调节pH为4、7、10和12。当pH为4时,TC-HCl的降解率为89.2%,随着pH增加,pH在4.9~10时,降解率基本没有变化。这一结果表明,在较宽的pH范围内,TC-HCl在催化体系中可以有效地降解,这比传统只有在强酸性条件下才能进行的Fenton反应具有明显的优势。当溶液酸性增强时,体系中的PMS主要以H2SO5的形式存在(式(3)),不利于催化剂与其反应生成
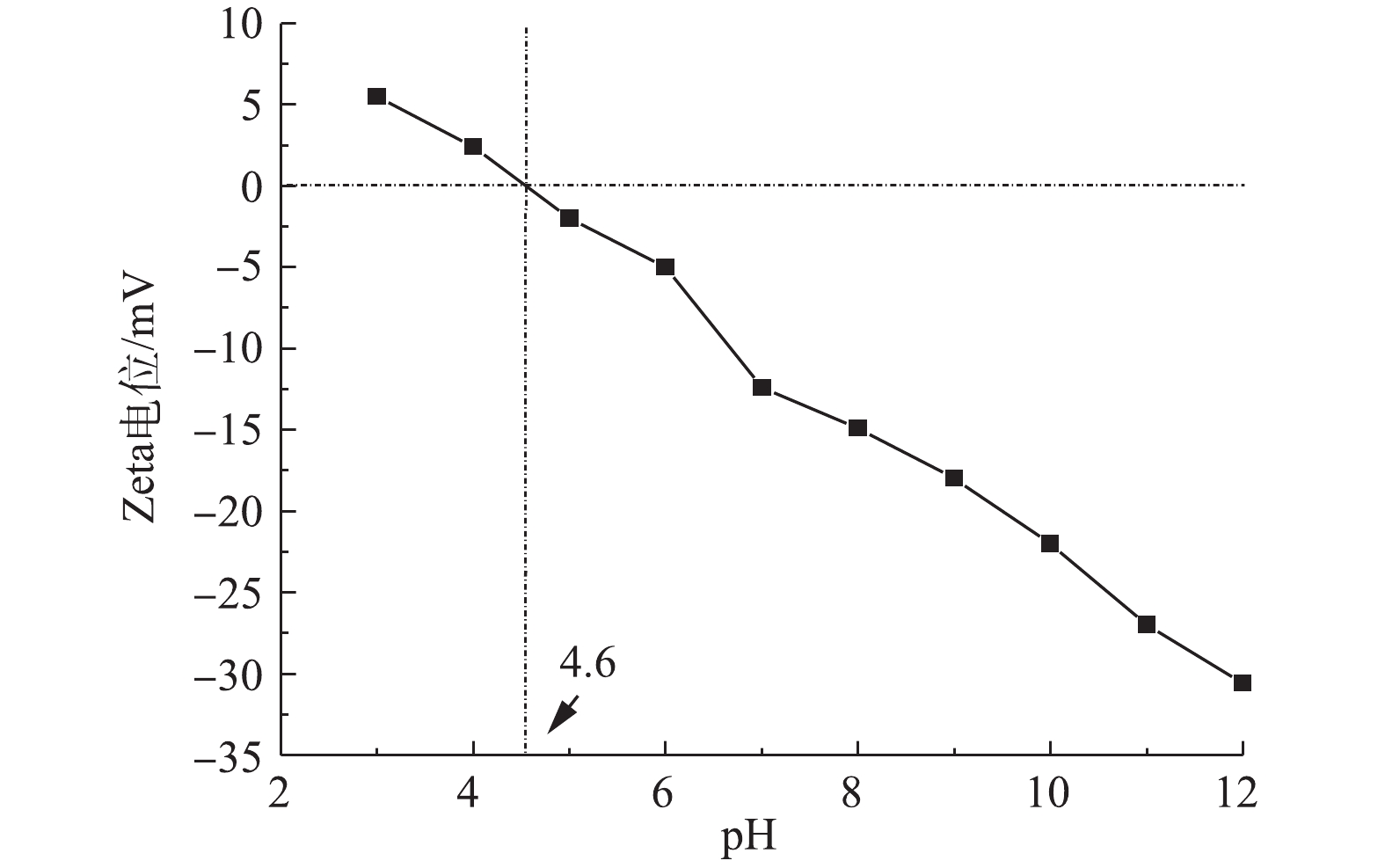
${\rm{SO}}_4^{ - \cdot }$ ,并且由Cu离子溶出情况看出,pH为4时,Cu2+溶出有很大的增加(图11),降低了催化剂的活性。碱性条件可以强化PMS生成强氧化自由基[35],但当pH为12时,降解率下降了40%。这一发现可以部分解释为,在强碱性条件下,产生的${\rm{SO}}_4^{ \cdot - }$ 自由基被转化为·OH(式(4)和式(5)),这不利于TC-HCl的降解,因为·OH(<1 μs)的寿命比${\rm{SO}}_4^{ \cdot - }$ (10~30 μs)短得多[36]。此外,金属氧化物催化剂的表面电荷依赖于其表面零电荷(pHpzc)和溶液pH。由图12可知,CuO/Bi2O3的pHpzc=4.6,当pH<4.6时,CuO/Bi2O3纳米粒子表面带正电荷,pH>4.6时,CuO/Bi2O3纳米粒子的表面带负电荷[37];当pH>10时,PMS主要以${\rm{SO}}_5^{2 - }$ 存在[38],此时催化剂表面和${\rm{SO}}_5^{2 - }$ 都是电负性,CuO/Bi2O3在pH=12时的劣化性能的可以部分解释为静电电荷的排斥力。而且,相比未调节pH时,Cu2+的溶出也所增加。根据以上实验结果,为了实验操作简单,现选择不调节pH。此外,为了进一步突出CuO/Bi2O3+Vis+PMS催化氧化体系在本研究中的优异性能,将本研究的结果与该领域其他报道关于Bi2O3复合其他物质的复合催化剂降解TC-HCl进行了比较,如表1所示。结果表明,这些报道中降解TC-HCl的最高降解速率为0.035 4 min−1(g-C3N4/Bi2O3),本研究降解速率为0.039 9 min−1(CuO/Bi2O3),并且本研究TC-HCl的初始浓度是g-C3N4/Bi2O3的4倍。通过上述对比表明,CuO/Bi2O3+Vis+PMS体系对TC-HCl具有很好的降解效果。
-
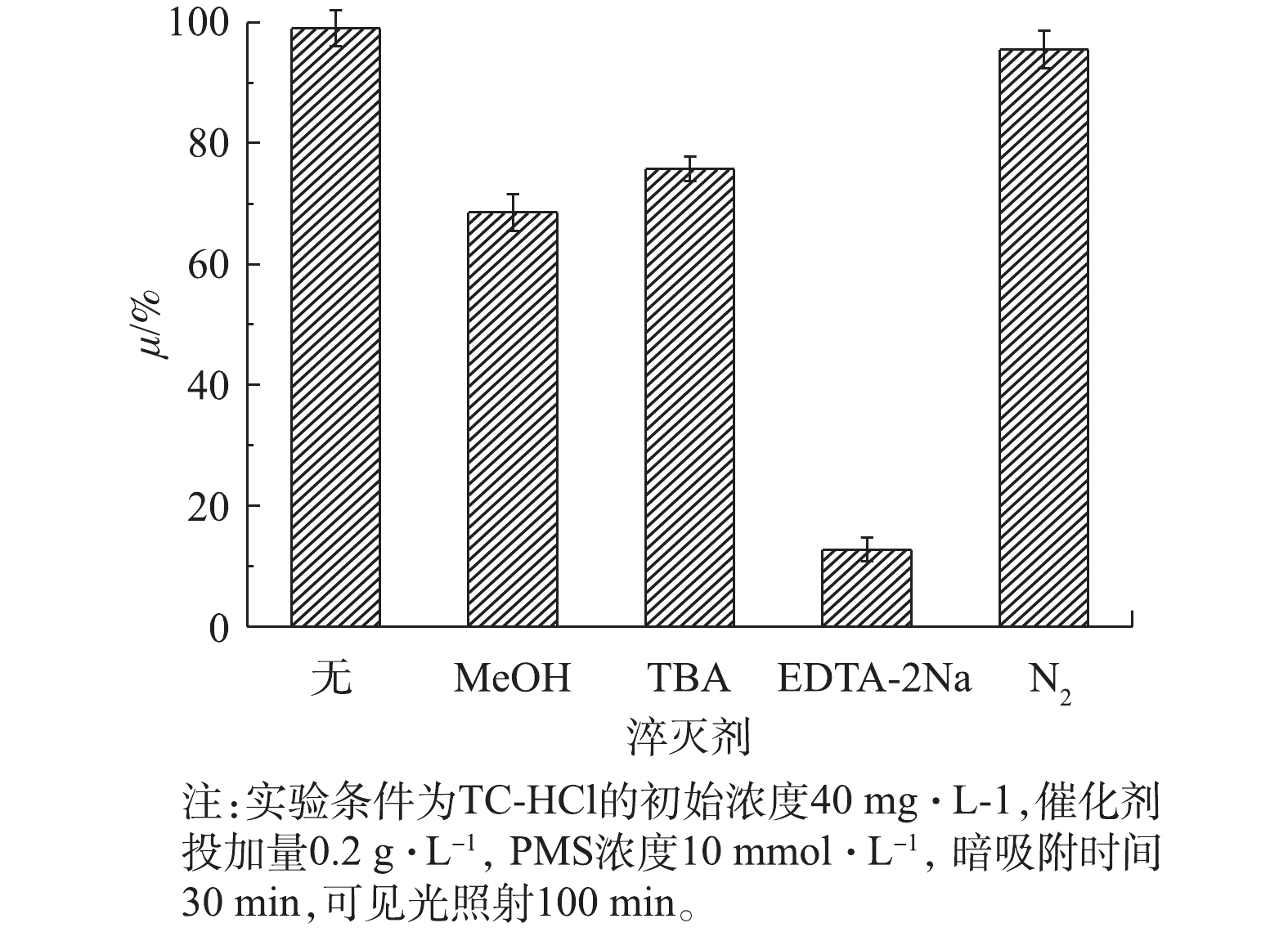
为了进一步探究氧化体系降解TC-HCl的反应机理,进行了自由基捕获实验(图13)。在CuO/Bi2O3+Vis+PMS系统中加入淬灭剂TBA后,TC-HCl降解率下降了25%,这表明·OH是导致TC-HCl降解的一个活性物种。当加入MeOH时,TC-HCl的降解率降低了32%,这表明
${\rm{SO}}_4^{ - \cdot }$ 在TC-HCl的降解中是主要的活性物种。在N2通入饱和下,TC-HCl的降解率降低了约4%,表明$ \cdot {\rm{O}}_2^ - $ 也参与了降解过程,但作用可忽略不计。当加入EDTA-2Na时,TC-HCl的降解率下降了85%,这是由于h+的强氧化能力所致。以上结果表明,在TC-HCl的降解过程中,主要的活性物种为·OH、${\rm{SO}}_4^{ - \cdot }$ 和h+。CuO/Bi2O3复合催化剂和TC-HCl溶液暗吸附30 min后达到吸附饱和,接着加入光和PMS进行催化降解,由于吸附饱和吸附率仅约7%,所以在暗吸附后主要作用是催化作用,因此,基于上述实验和讨论,阐述光催化耦合高级氧化过程降解TC-HCl的催化协同机制(图14)。首先,负载CuO后,Bi2O3价带上的电子被可见光激发到导带,通过界面转移过程转移到CuO上[43],激发电子将通过Cu2+与Cu+的循环消耗,从而延长Bi2O3的价空穴寿命,实现了电子和空穴的有效分离,使得CuO/Bi2O3复合催化剂的光催化活性增强。其次,加入PMS后,PMS捕获光生电子产生
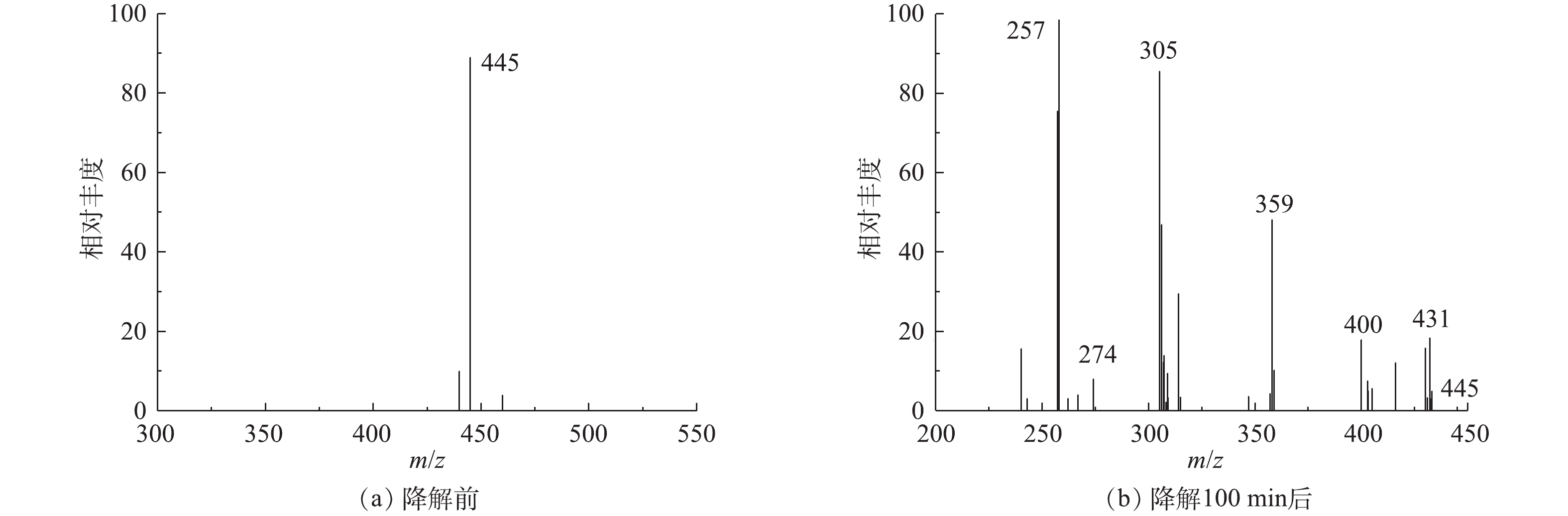
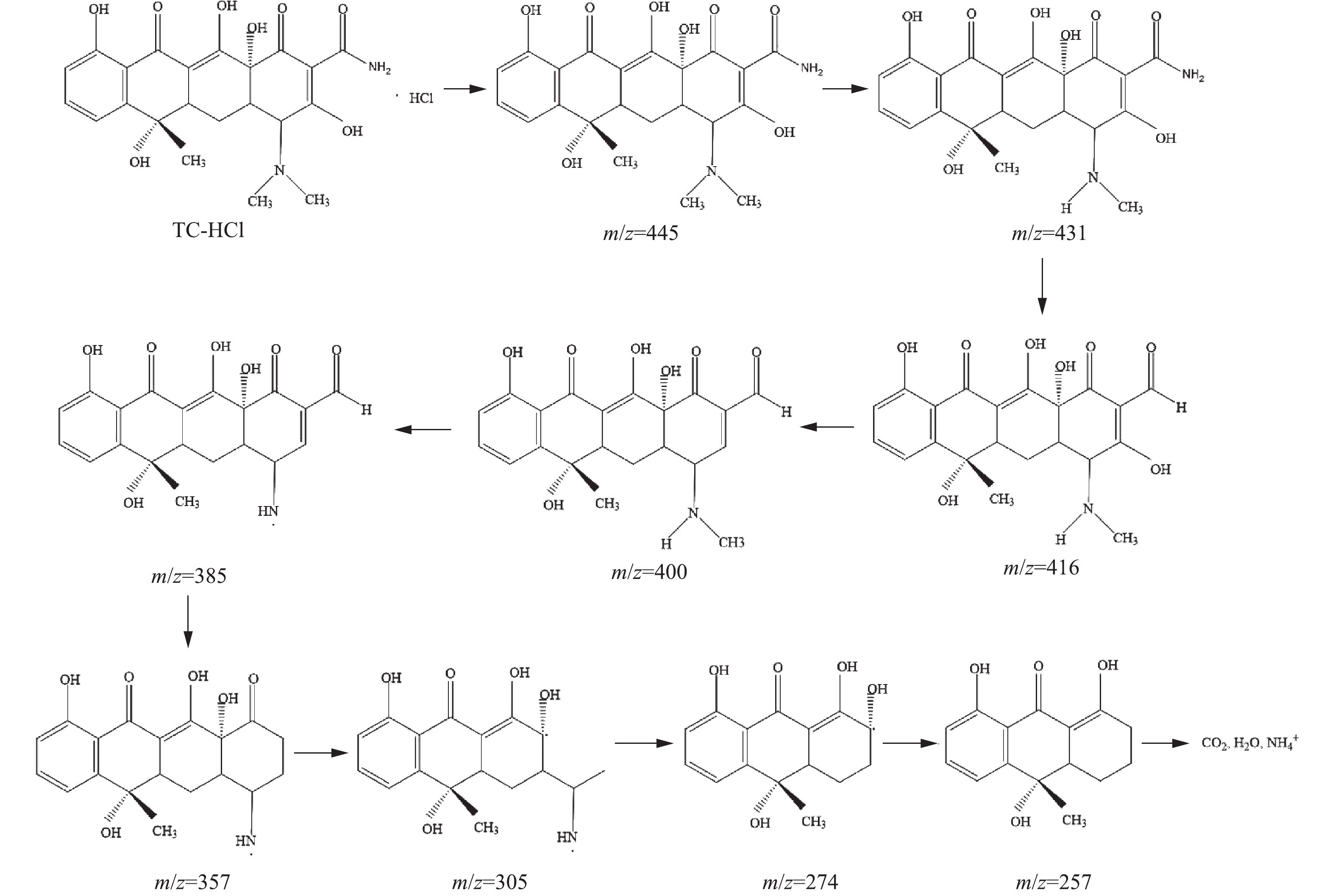
${\rm{SO}}_4^{ - \cdot }$ ,进一步抑制了电子/空穴对复合(式(6)~式(8));CuO/Bi2O3复合催化剂中的Cu能激活PMS生成${\rm{SO}}_4^{ - \cdot }$ 和${\rm{SO}}_5^{ - \cdot }$ ,Cu2+与Cu+的电子转移可以使Cu循环利用(式(9)和式(10)),反应前后复合催化剂XPS关于Cu2p的分析也印证了这一点。上述产生的${\rm{SO}}_4^{ - \cdot }$ 、·OH和h+的活性物种具有很强的氧化性能,能够快速氧化降解TC-HCl(式(11))。此外,用LCMS分析了TC-HCl降解的中间体,以便于更好地理解该光催化氧化降解过程的机理[44]。图15(a)、图15(b)分别为降解前后TC-HCl的质谱图。反应开始,随着氧化物种(
${\rm{SO}}_4^{ - \cdot }$ /·OH/h+)的产生,TC-HCl分子开环反应和化学键的断裂被破坏,降解到100 min后TC-HCl在质荷比m/z=445处的峰几乎消失,根据m/z,鉴定了6种可能的中间体,其m/z分别为431、400、359、305、257、274。图16给出了可能的降解路径。 -
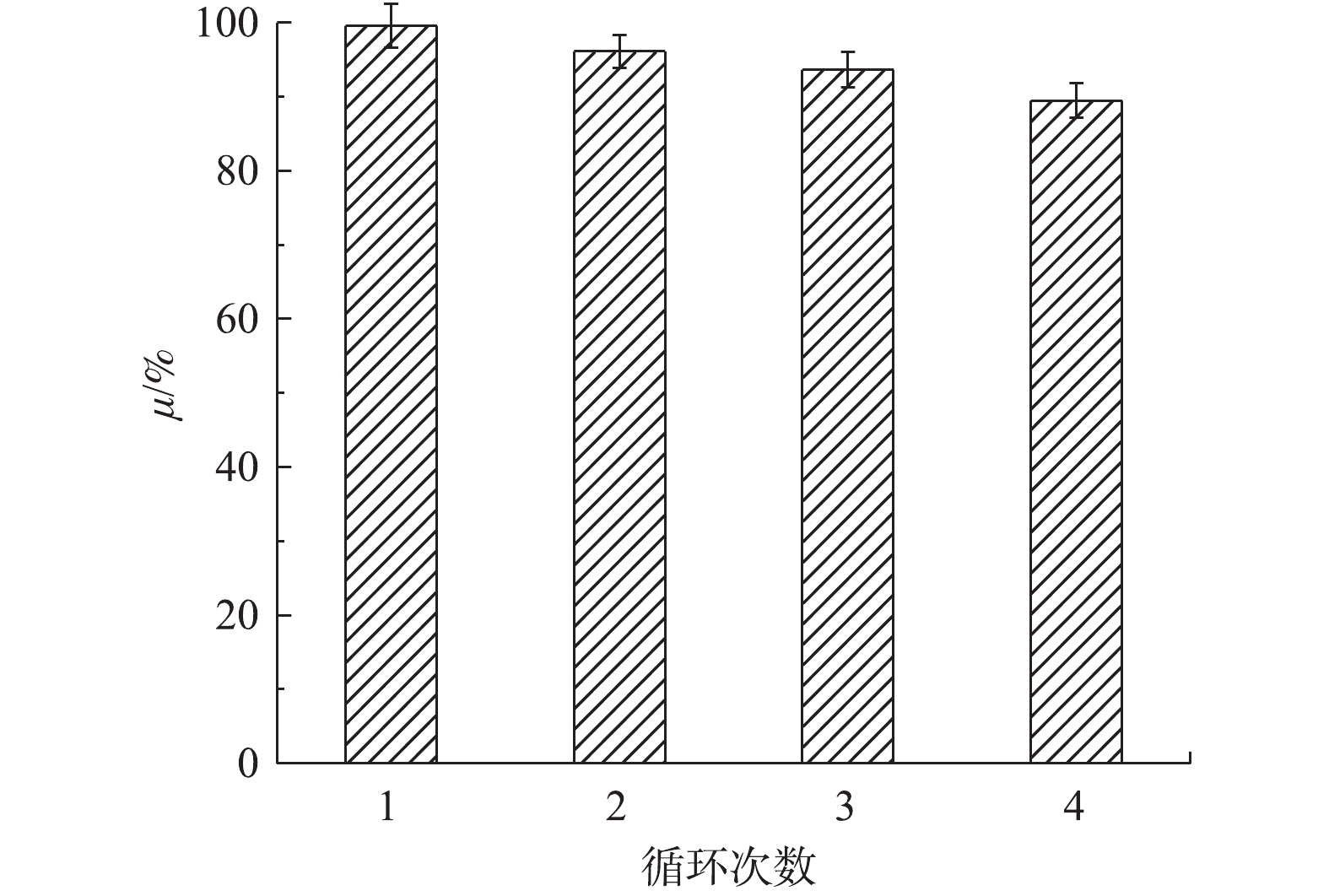
CuO/Bi2O3的稳定性和可重复性实验如图17所示。可以看出,催化剂CuO/Bi2O3经过4次循环实验,催化降解效果并没有很大的降低,第4次循环实验降解效率依然有89.5%。所以,CuO/Bi2O3有很好的循环使用性和稳定性能;从第1次到第4次降解率降低的原因很可能是离心获取时催化剂有所损失。
2.1. 催化剂的表征
2.2. 不同体系对TC-HCl的降解性能
2.3. PMS投加量对降解性能的影响
2.4. 催化剂投加量对降解性能的影响
2.5. 溶液初始pH对降解性能的影响
2.6. 光催化协同PMS氧化降解TC-HCl的机理
2.7. 催化剂的可重复使用性能
-
1)在催化剂用量为0.2 g·L−1、PMS浓度为10 mmol·L−1的最佳条件下,经过100 min可见光照射后,CuO/Bi2O3+Vis+PMS体系对TC-HCl降解率达到99.6%。这说明CuO/Bi2O3具备较好的光催化活化PMS的能力。
2) CuO/Bi2O3+Vis体系相比Bi2O3+Vis体系降解TC-HCl的效率增加了10.7%,CuO/Bi2O3+PMS体系相比Bi2O3+PMS体系降解TC-HCl的效率增加了11.7%。可见,CuO的掺杂抑制了光生电子/空穴对的复合,不仅增加了可见光催化活性,而且活化了PMS。
3) Bi2O3+Vis+PMS体系相比Bi2O3+Vis体系对TC-HCl的降解率增加了64.7%,CuO/Bi2O3+Vis+PMS体系相比CuO/Bi2O3+Vis体系对TC-HCl的降解率增加了73.5%。这说明光催化技术和过一硫酸盐氧化过程的耦合显著增加了TC-HCl的降解效率。
4) h+、
${\rm{SO}}_4^{ - \cdot }$ 和·OH是降解TC-HCl的主要活性物质,且该复合催化剂具有很好的稳定性。





 下载:
下载: