-
随着工业化和城市化的发展,中国的空气污染日益严重。我国目前的空气质量受到光化学烟雾和二次反应形成的细颗粒物的严重影响[1]。挥发性有机化合物(volatile organic compounds, VOCs)对臭氧(O3)和二次有机气溶胶(secondary organic aerosols, SOA)的形成有重要贡献,并对空气质量和人类健康产生重大负面影响[2]。作为一种典型的大气污染物,VOCs类型非常复杂,主要包括非甲烷碳氢化合物、含氧有机化合物、卤代烃、含氮化合物和含硫化合物等[3]。VOCs的来源包括人为源和天然源,而在人为来源中,工业排放是VOCs的主要来源。例如,焦化行业与高能耗和高污染有关,排放了大量的VOCs,而苯和甲苯是典型焦化工厂排放较多的主要污染物[4]。值得注意的是,工业排放物中通常不是单一组分,而是多组分VOCs共存。因此,开发多组分VOCs协同降解技术已成为目前的研究热点。
为了满足日益严格的VOCs排放标准,相关部门或科研团队已经提出了包括回收控制工艺(吸收、吸附、冷凝、膜分离)和销毁技术(等离子体、光催化、催化氧化、生物过滤等)相关的多种VOCs控制技术[5-6]。其中催化氧化是一种高效且经济可行的技术,可以有效的催化氧化挥发性有机物,产生CO2和H2O等产物[7-8]。目前,催化氧化已成为工业上的主流控制技术。因此,选择高性能催化剂成为VOCs催化氧化技术的最大挑战。
贵金属催化剂(如Pt、Pd等)在苯和甲苯的催化降解中显示出良好的催化性能[9-10]。然而,由于资源稀缺、成本高、抗中毒性能差,贵金属催化剂在实际中的应用受到严重限制。目前,需要探索具有高催化性能的非贵金属催化剂。类水滑石化合物(layered double hydrotalcites,简称LDHs)是阴离子型层状双金属或多金属氢氧化物黏土材料,其特定分子式为[M1−x2+Mx3+(OH)2] x+ (Ax/n) n−·mH2O,八面体MO6金属氧化物相互连接形成水滑石的主导层,金属占据八面体的中心位置,层间由电离平衡的阴离子构成[11-12]。类水滑石材料具有特殊的性质,如多种金属阳离子均匀分布,化学组成可调变,且可以在原子水平上进行控制等,因此通常作为前驱物用于制备催化材料[13]。类水滑石衍生复合氧化物是一种在一定温度下煅烧LDHs后稳定的金属氧化物,具有介孔结构、可控的表面酸碱位点,有利于活性组分的高度分散,广泛用于各类催化反应[14-16]。钴基氧化物催化材料具有丰富的活性氧、良好的氧化还原性能、可变的价态、低成本和易于获得,被认为是一种很有前途的替代贵金属催化剂的催化剂[17-18]。CHEN等[19]合成了Co3O4-LaCoO3尖晶石钙钛矿复合催化剂,该催化剂在甲苯催化氧化中表现出优异的活性,界面相互作用丰富了Co3O4-LaCoO3催化剂上的表面Co3+-O。锰基氧化物材料具有低温高活性的特点,因此,其常用作活性中心来提高催化剂的低温性能。有研究[20]表明,通过水热法合成的OMS-2催化剂,在甲苯的低温催化氧化中表现出良好的活性。WANG等[14]通过顺序沉淀法合成了类水滑石衍生Ni-LDO催化剂,用于CO2催化还原合成天然气,在573 K的温度和大气压下,性能得到了显著提高。合成的催化剂具有层状介孔结构,且Ni粒径的增加和中强碱性位点促进了反应性能的提高。
基于类水滑石衍生复合氧化物材料比表面积大,活性物种均匀分散,酸性可调控等优异性能,本研究旨在开发MgM2AlO ( M = Co, Mn, Ni, Mg ) 催化材料来实现苯和甲苯的协同去除。通过共沉淀法成功制备了MgM2Al-LDHs前驱物材料,焙烧后形成MgM2AlO材料。系统研究了系列催化材料的结构、化学性能和催化性能。通过一系列性能测试(苯和甲苯的催化氧化活性测试)和表征技术研究了催化剂的构效关系。此外,还讨论了苯与甲苯协同催化降解过程的相互作用关系。
-
过渡金属前驱物:硝酸镁Mg(NO3)2·6H2O,硝酸铝Al(NO3)3·9H2O,硝酸钴Co(NO3)3·6H2O,硝酸锰Mn(NO3)2·6H2O,硝酸镍Ni(NO3)2·6H2O,分析纯,均购于天津市天力化学试剂有限公司;碳酸钠Na2CO3,氢氧化钠NaOH,分析纯,购于国药集团化学试剂有限公司;去离子水,自制。
-
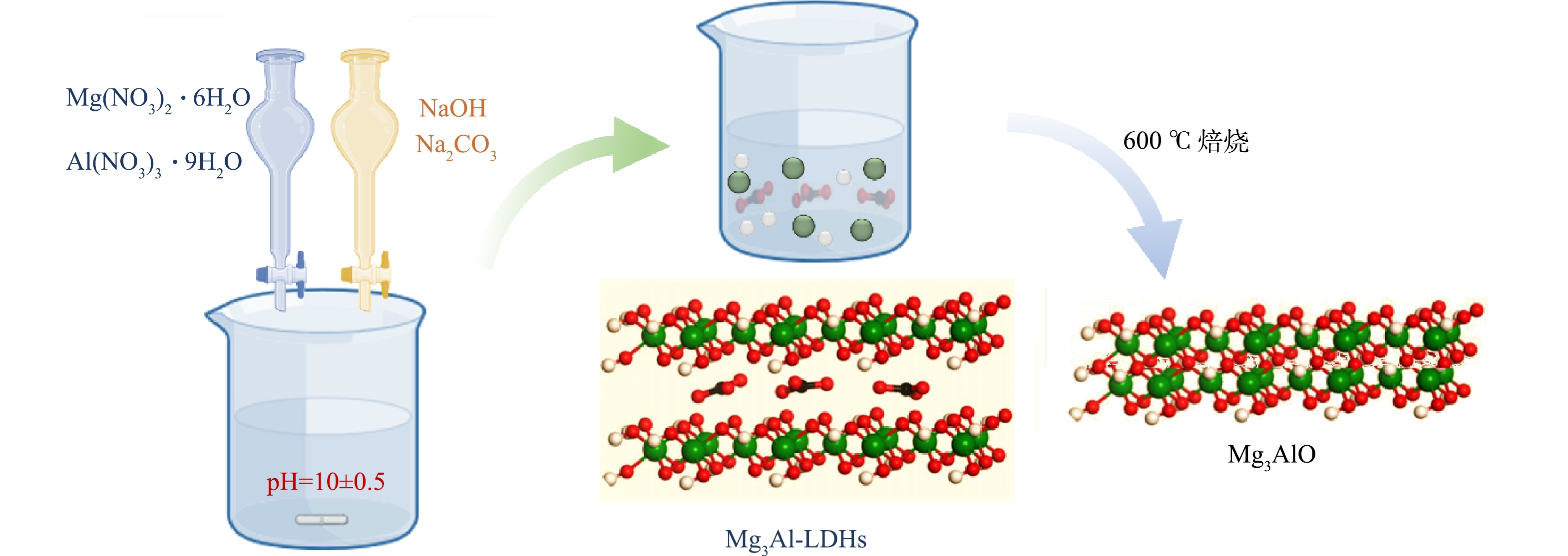
采用共沉淀法制备了类水滑石衍生复合氧化物催化剂MgM2AlO (M = Co、Mn、Ni、Mg )。以Mg3AlO的合成为例,具体的合成过程如下:取0.06 mol Mg(NO3)2·6H2O、0.02 mol Al(NO3)3·9H2O溶解在250 mL去离子水中,记为A溶液,将一定量的NaOH、Na2CO3配置成混合溶液,记为B溶液,室温下将溶液A和B同时缓慢滴入搅拌的100 mL去离子水中,通过控制溶液B的滴加速率保持pH在10±0.5,溶液滴加结束后,将上述前驱物室温老化24 h,用去离子水进行离心洗涤,置于鼓风干燥箱中,70 ℃干燥12 h,120 ℃干燥12 h得到MgAl-LDHs,随后将MgAl-LDHs在马弗炉中600 ℃烧焙4 h得到Mg3AlO。具体制备过程如图1。MgM2AlO ( M = Co, Mn, Ni )材料的制备过程与上相同。
-
催化剂的晶相结构通过X射线衍射技术(X-ray diffraction,XRD)表征,所用仪器为德国布鲁克D8 Advance,扫描速度为5°·min−1,扫描角度为10°~80°。
催化剂的织构性质(比表面积,孔分布等)通过N2吸脱附等温线来测定,所用仪器为Micromeritics ASAP 2020气体吸附分析仪。具体测试条件如下:称取一定量的样品进行脱气,样品需要在300 °C条件下脱气6 h,随后对样品进行测试。
采用日本日立公司Hitachi S - 4800型扫描电子显微镜(scanning electron microscopy, SEM)观察样品的形貌结构。采用日本电子JEM - F200型透射电镜(transmission electron microscopy, TEM,配能量色散X射线光谱(energy-dispersive X-ray spectroscopy, EDS))分析样品微观结构及金属元素分布。
H2程序升温还原(H2 temperature-programmed reduction, H2-TPR)是在Micromeritics Chemisorb 2920上测试的。首先称取50 mg催化剂,进行预处理,在惰性气氛下,以10 ℃·min−1的升温速率程序升温至300 ℃并保持1 h,随后冷却至室温。将气体切换为2%(体积分数)H2/He,流量为50 mL·min−1,升温速率为10 ℃·min−1,程序升温至800 ℃,尾气通过热导检测器(TCD)检测,计算机同步记录得到数据。
NH3的程序升温脱附(NH3 temperature-programmed desorption, NH3-TPD)常用来表征催化材料的酸性强弱,所用仪器为Micromeritics Chemisorb 2920化学吸附仪。具体测试条件如下:称取100 mg催化剂并装填入测试管中,以10 ℃·min−1的升温速率程序升温至300 ℃并保持1 h,随后自然冷却至室温。预处理结束后,室温下通入30 min的NH3,平衡气为He,流量为50 mL·min−1,用He进行吹扫,将管内多余的NH3吹扫干净后方可进行程序升温,程序升温以10 ℃·min−1的速率升温至700 ℃,用TCD检测器检测脱附气体。
X射线光电子能谱(X-ray photoelectron spectroscopy, XPS)通常用于分析催化剂表面的元素组成和化学价态,所用仪器为Axis Supra(600 W)X射线光电子能谱仪。
-
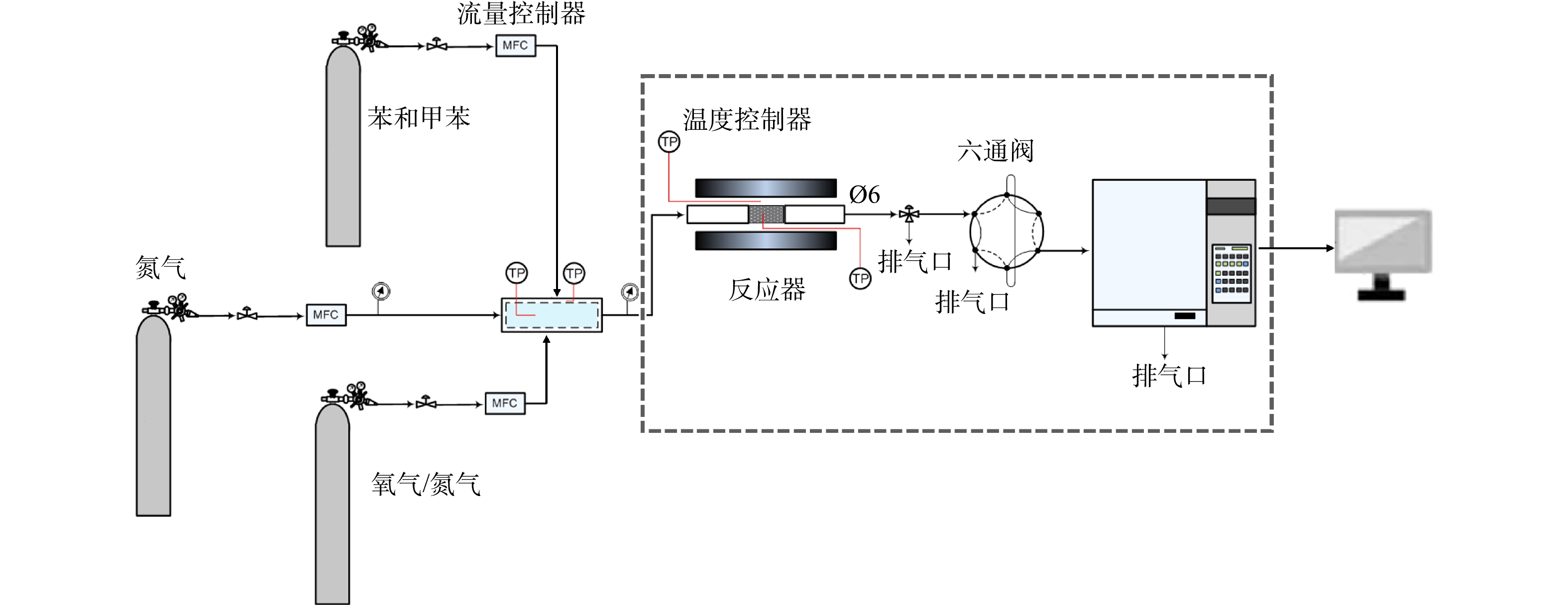
催化剂的催化性能测试是通过小型固定床连续流动反应装置进行的。固定床石英反应管的内径为6 mm,外径为8 mm。每次活性评价催化剂用量均为0.5 mL,压片过筛,控制催化材料颗粒为40~60目。单一污染物催化性能测试反应气为250 mg·L−1苯+5%(体积比) O2,N2为平衡气,或250 mg·L−1甲苯+5% O2,N2为平衡气;多组分催化性能测试反应气条件为:250 mg·L−1苯+250 mg·L−1甲苯+5% O2,N2为平衡气,总流量保持不变,为150 mL·min−1,对应的体积空速为18 000 h−1。反应气和尾气的分析由气相色谱(艾伦分析仪器有限公司GC
7960 plus)完成,气相色谱检测器为火焰离子化检测器(FID)用于检测苯或甲苯;另有转化炉用于配合FID检测器用于检测CO和CO2。具体反应装置流程图如图2所示。根据苯或甲苯的转化率和产物的选择性评价催化剂的催化性能,苯的转化率、甲苯的转化率、CO的选择性、CO2的选择性分别根据式(1)、式(2)、式(3)、式(4)进行计算。
式中:η1为苯的转化率,%;
$ {C}_{0} $ 为苯的初始浓度,mg·L−1;$ {C}_{1} $ 为苯的出口浓度,mg·L−1。式中:η2为甲苯的转化率,%;
$ {C}_{0}' $ 为甲苯的初始浓度,mg·L−1;$ {C}_{1}' $ 为甲苯的出口浓度,mg·L−1。式中:η3为CO的选择性,%;
$ {C}_{\mathrm{C}\mathrm{O}} $ 为产物CO浓度,mg·L−1;$ {C}_{\mathrm{总}} $ 为总产物中的碳浓度,mg·L−1。式中:η4为CO2的选择性,%;
$ {C}_{{\mathrm{C}\mathrm{O}}_{2}} $ 为产物CO2浓度,mg·L−1;$ {C}_{\mathrm{总}} $ 为总产物中的碳浓度,mg·L−1。 -
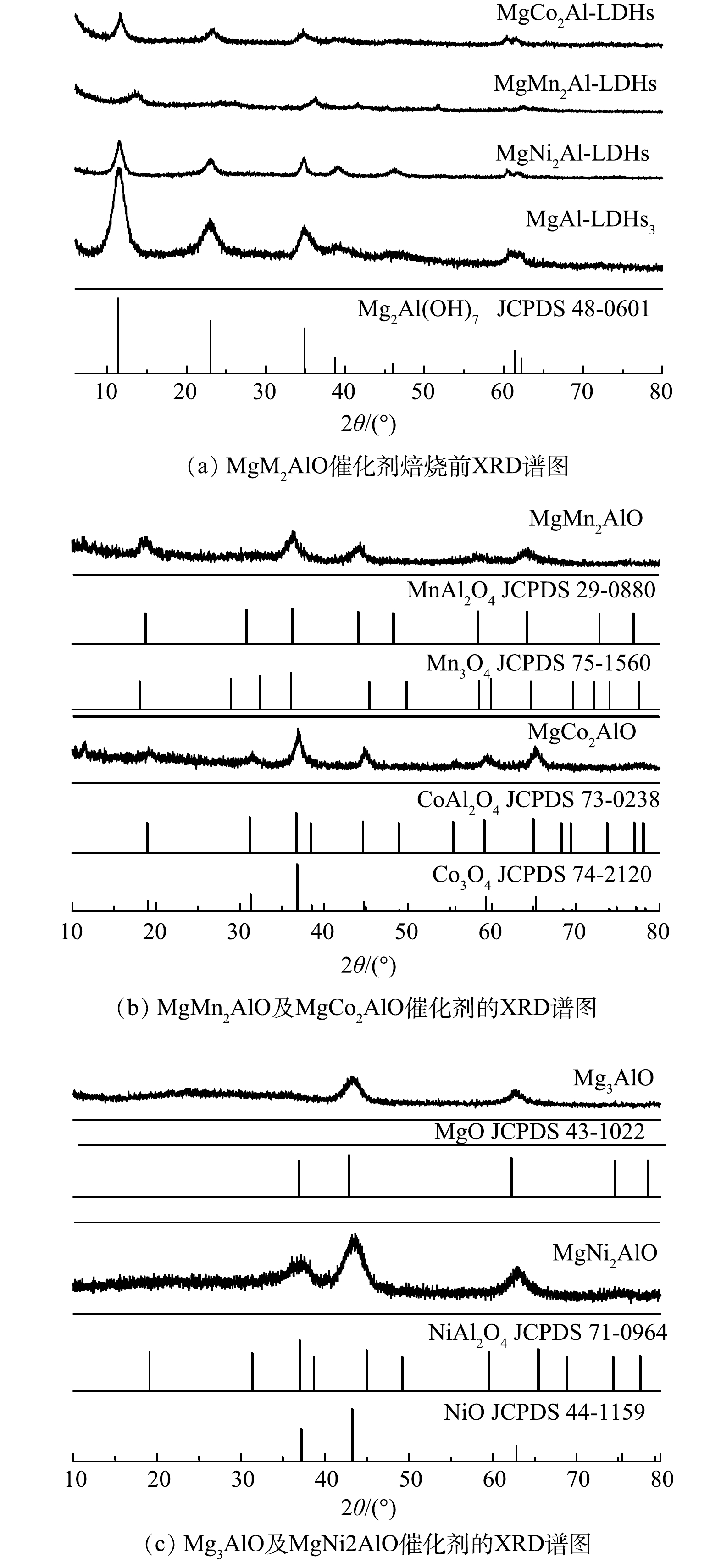
图3为MgM2AlO( M = Co, Mn, Ni, Mg )催化剂焙烧前后的XRD谱图。由图3(a)所见,焙烧前系列样品的XRD谱图表现出相似的特征峰,分别位于2θ=11.7°、23.6°、35.0°、39.7°、47.1°、60.9°和62.4°,归属于水滑石Mg3Al(OH)7(JCPDS 48-0601)的特征衍射峰(003)、(006)、(009)、(105)、(108)、(110)和(113)[21-22]。此外,除Mg3Al(OH)7相之外,没有其他相的特征峰出现,说明合成的材料为纯类水滑石结构,具有规则的层状结构。与Mg3Al-LDHs相比,MgNi2Al-LDHs,MgCo2Al-LDHs和MgMn2Al-LDHs样品的特征衍射峰的峰强度减弱,特征衍射峰的宽化可能是由于Mg、Co、Mn和Al成分的高分散性造成的[21-23]。图3(b)~(c)为MgM2Al-LDHs( M = Co, Mn, Ni, Mg )催化剂在600 °C焙烧后的XRD谱图。焙烧后样品的晶相结构有较大的变化,典型的类水滑石Mg3Al(OH)7特征峰消失,表明层状结构在焙烧后完全消失,材料由Mg3Al-CO3特征相转化为金属氧化物[24]。对于MgMn2Al-LDHs,焙烧后样品的特征峰分别位于2θ=28.8°、36.29°、44.4°、58.46°、64.25°,归属于MnAl2O4(JCPDS 29-0880)的(111)、(311)、(400)、(511)、(440)晶面。由于Mn3O4的特征衍射峰与MnAl2O4非常接近,不排除MgMn2AlO材料中存在Mn3O4相的可能性,后续表征也说明了Mn3O4相的存在(见H2-TPR,XPS)。对于MgCo2Al-LDHs,焙烧后所得样品特征峰分别位于2θ=19.3 °、31.47 °、37.05 °、44.98 °、59.6 °和65.4 °,分别归属于CoAl2O4(JCPDS 73-0238)的(111)、(220)、(311)、(400)、(511)、(440)晶面。与MgMn2AlO材料类似,推测MgCo2AlO材料同时存在CoAl2O4及Co3O4(JCPDS 74-
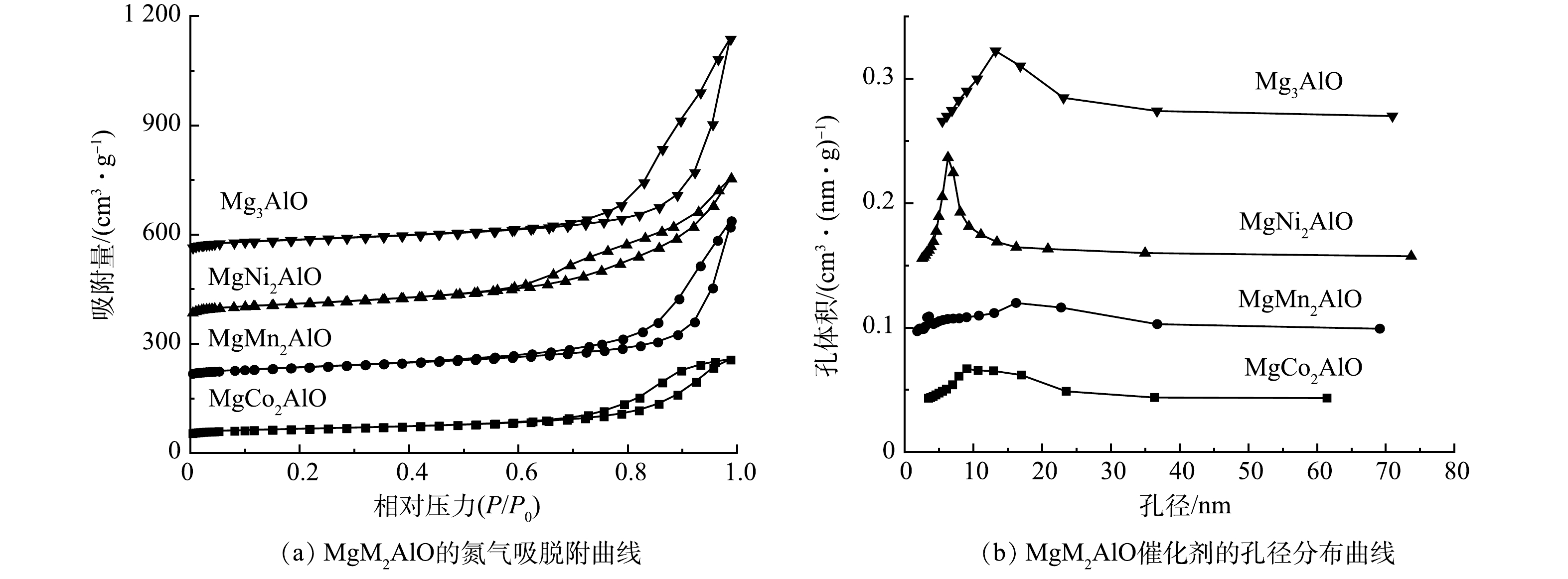
2120 )晶相结构。Mg3Al-LDHs样品在焙烧后,主要特征衍射峰分别位于2θ=37.1 °、43.3 °、62.8 °,归属于MgO(JCPDS 43-1022 )的特征峰。对于MgNi2AlO材料,位于2θ=37.1 °、43.5 °和63.03 °的特征衍射峰可归属于NiO(JCPDS 44-1159 )、NiAl2O4(JCPDS 71-0964)及MgO(JCPDS 43-1022 )结构。与其他研究[25]结果相似,MgNi2Al-LDHs焙烧后呈现典型的混合晶相结构。表1为MgM2AlO ( M = Co, Mn, Ni, Mg )催化剂的比表面积、孔容及孔径等数据,相应的N2吸附-脱附等温线和孔径分布曲线见图4。其中MgNi2AlO材料的比表面积最大,为175.48 m2·g−1,而MgCo2AlO材料的比表面积最小,为77.45 m2·g−1。系列MgM2AlO材料的孔径在10~17 nm,说明系列样品均属于典型的介孔材料(图3(b))。且MgNi2AlO的孔径最小,约为10.34 nm。与Mg3AlO相比,MgCo2AlO、MgMn2AlO和MgNi2AlO的孔体积和孔径都有一定的降低,可能归属于颗粒的烧结和孔道的堵塞[26]。由图4(a)可见,系列MgM2AlO ( M = Co, Mn, Ni, Mg )催化材料均表现出典型的IV型氮吸附-脱附等温线(根据IUPAC分类),在相对压力较高段有明显的迟滞环出现,说明材料存在明确的介孔结构。
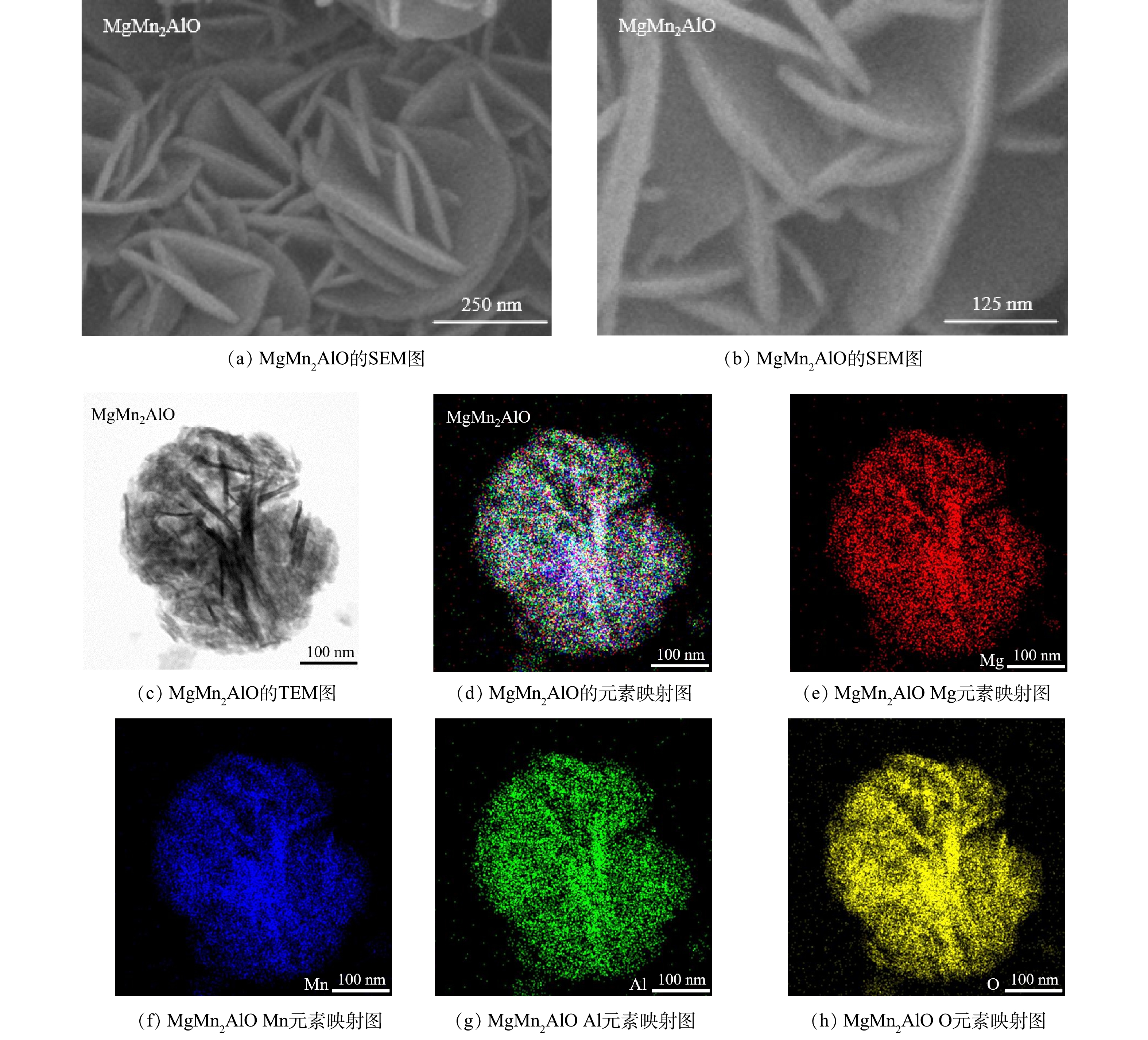
通过SEM和TEM-EDS表征对MgMn2AlO的形貌进行了研究。如图5(a-b)所示,MgMn2AlO材料表现出分层或片状的结构,带有一定的有序性。可以观察到片状或花瓣状的纳米结构相互堆积或交错排列,呈现出类似于纳米花的形貌,这是典型的LDH衍生的混合氧化物。此外,使用TEM-EDS详细观察了MgMn2AlO催化剂上不同元素的分布(图5(c-h))。MgMn2AlO的EDS图像清楚地显示了Mn、Mg、Al和O元素在混合金属氧化物表面的均匀分布。
-
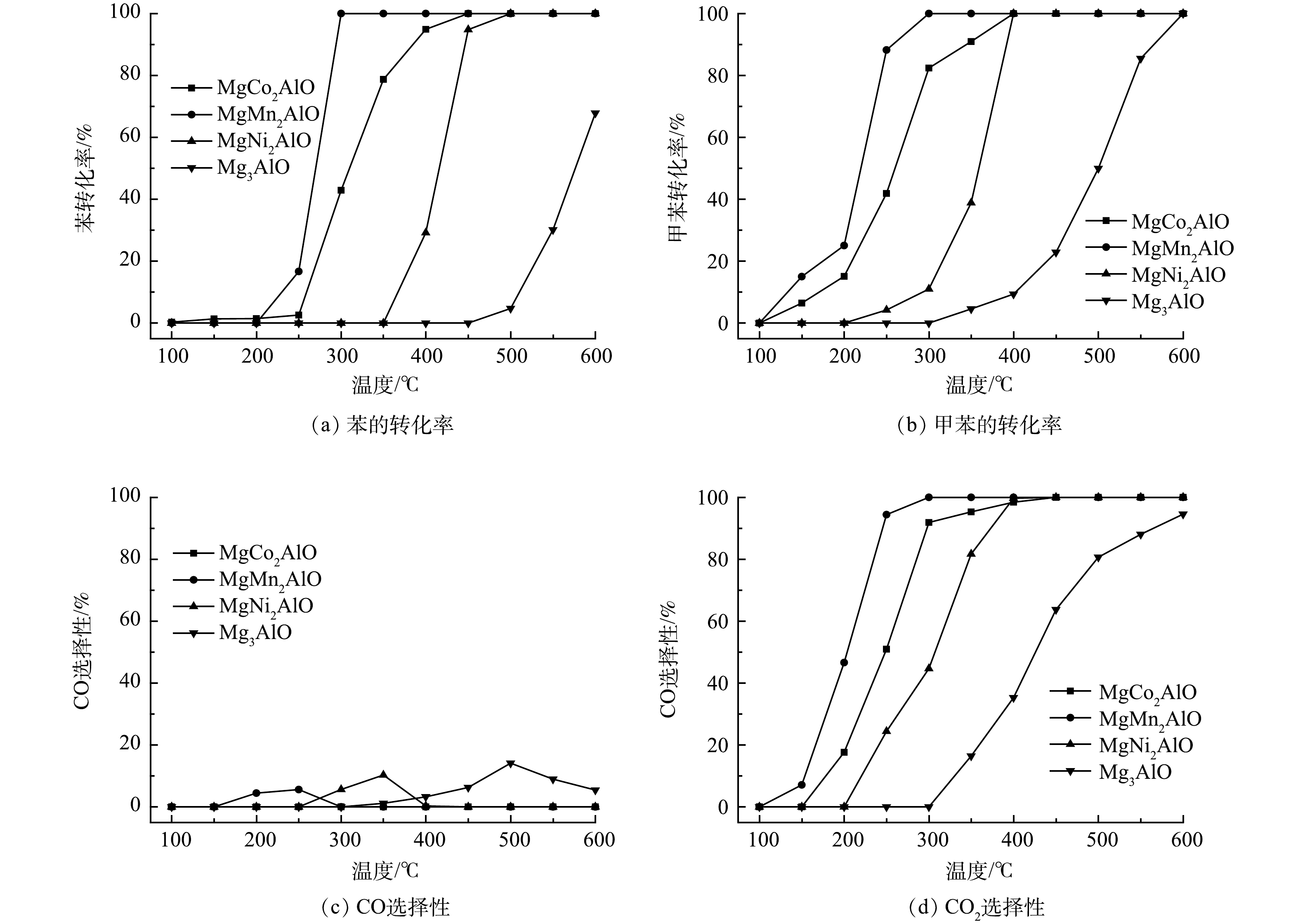
图6为苯-甲苯协同催化降解过程中材料催化性能随温度的变化曲线。同时,在苯-甲苯协同催化氧化过程中,苯和甲苯转化率的特征温度T50、T90和T100列于表2。图6(a)为苯转化率随温度的变化曲线,图6(b)为甲苯转化率随温度的变化曲线。由图6(a)可知,催化剂的转化率随着温度升高而增加,苯的初始转化温度相比甲苯初始转化温度较高,对于MgMn2AlO催化材料,200 ℃时苯还没有开始转化,而250 ℃时苯的转化率仅有16%,而甲苯在150 ℃时的转化率为18%,而250 ℃时甲苯的转化率接近90%。在苯-甲苯协同降解过程,系列催化材料对苯和甲苯的转化率高低呈现一致性,转化率从高到低的次序为:MgMn2AlO > MgCo2AlO > MgNi2AlO > Mg3AlO。由此可见,掺杂Co、Mn、Ni的催化剂上的苯的转化率和甲苯的转化率均优于Mg3AlO催化剂,表明过渡金属掺杂在苯-甲苯协同催化氧化过程中起着重要作用。MgMn2AlO催化剂具有最高的催化活性,在300 ℃时可以实现100%的苯转化率和甲苯转化率,而MgCo2AlO催化剂上苯和甲苯的全转化温度约450 ℃和400 ℃,MgNi2AlO催化剂上苯和甲苯的全转化温度约500 ℃和400 ℃。图6(c)为CO选择性随温度的变化曲线,其中,MgCo2AlO催化剂在整个温度范围内均未产生CO。MgMn2AlO,MgNi2AlO和Mg3AlO材料的CO选择性随着温度升高呈现先增加后降低的趋势,其峰值温度分别在250 ℃,350 ℃和500 ℃。图6(d)为CO2选择性随温度的变化曲线,系列MgM2AlO ( M = Co, Mn, Ni, Mg )催化材料的CO2选择性曲线与苯-甲苯转化率曲线趋势一致,CO2选择性随温度升高而增加,MgMn2AlO材料在300 ℃时CO2选择性达到100%,而MgCo2AlO和MgNi2AlO催化剂在450 ℃时CO2选择性达到100%。
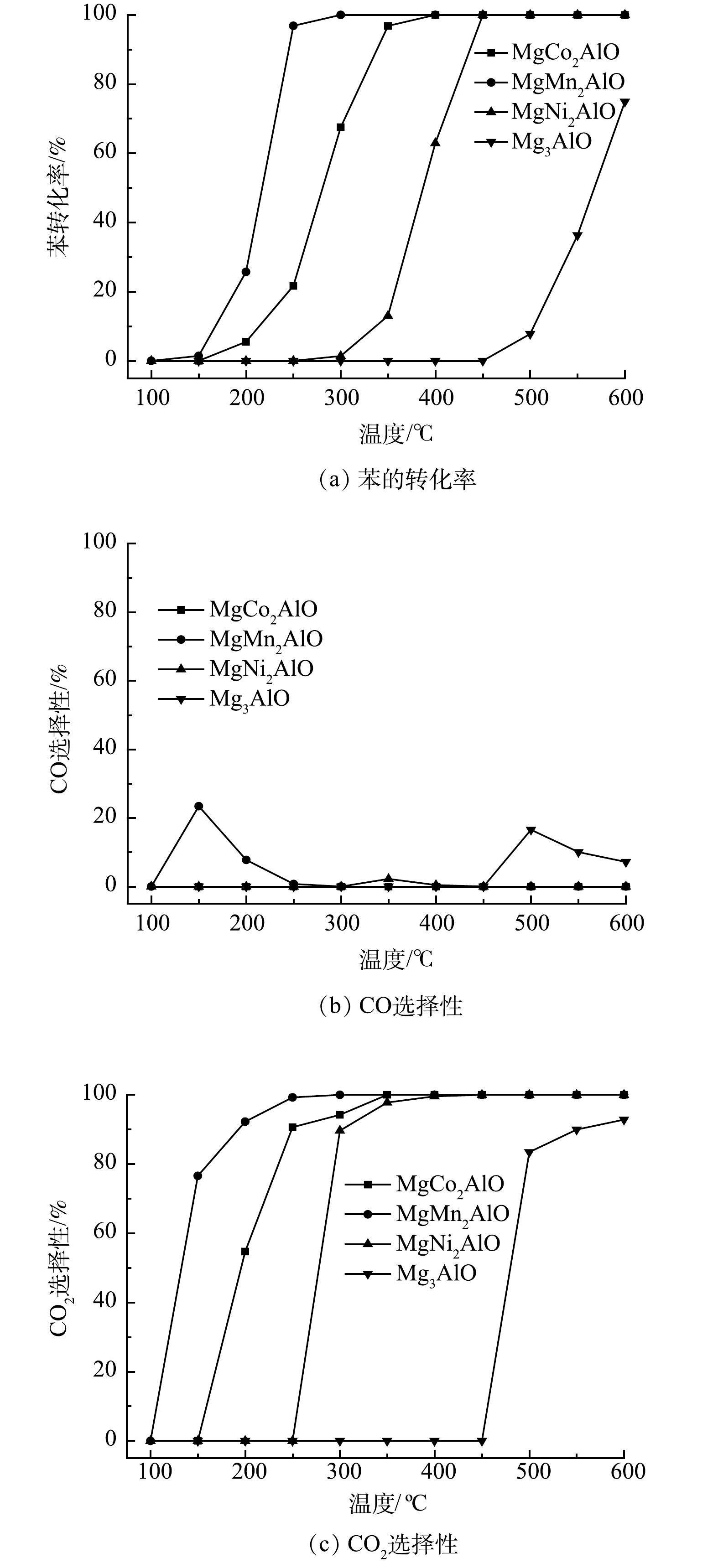
为了探究苯-甲苯协同催化氧化过程中苯和甲苯的相互影响,研究了系列MgM2AlO ( M = Co, Mn, Ni, Mg )在苯、甲苯单独催化氧化的性能。图7为苯催化降解过程中材料催化性能随温度的变化曲线。由图7可见,系列催化材料在催化氧化苯的转化率从高到低的次序为:MgMn2AlO>MgCo2AlO>MgNi2AlO>Mg3AlO。苯在MgMn2AlO材料上的初始转化温度为150 ℃,随着温度升高,转化率迅速增加,在300 ℃实现苯的完全转化。MgCo2AlO和MgNi2AlO材料分别在400 ℃和450 ℃时,苯转化率达到100%。Mg3AlO材料的转化率较差,600 ℃时苯的转化率约为75%。图7(b)~(c)为单独苯催化氧化过程中CO选择性和CO2选择性。由图可知,CO选择性随温度的升高呈现先增加后降低的趋势,与苯-甲苯协同催化过程类似,MgCo2AlO催化材料在整个温度范围内均未产生CO。CO2选择性随温度升高逐渐增加,MgMn2AlO、MgCo2AlO和MgNi2AlO材料的CO2选择性在温度为300 ℃、350 ℃和450 ℃时达到100%。
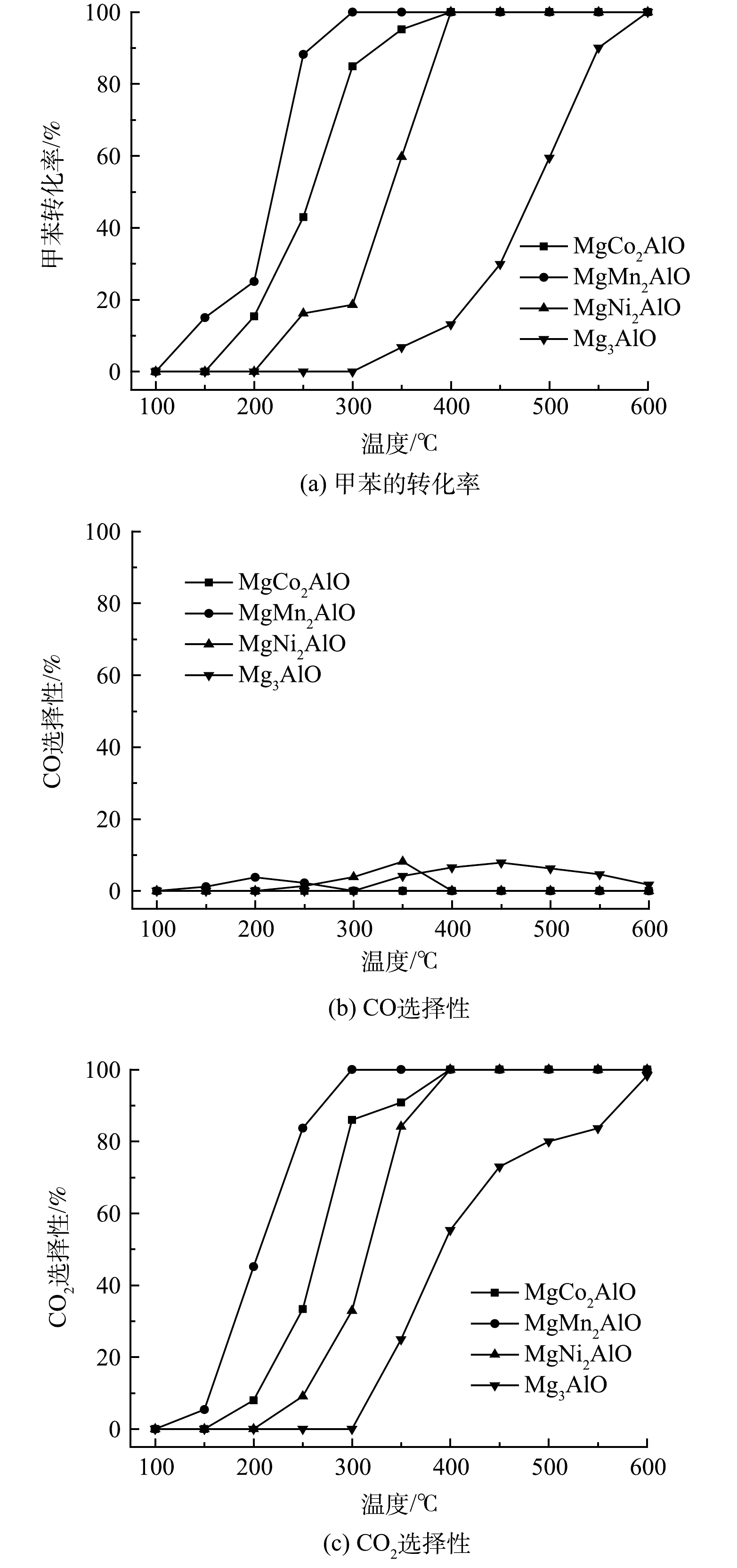
图8为甲苯催化降解过程中材料催化性能随温度的变化曲线。由图8(a)可知,系列催化材料在催化降解甲苯的性能的次序为MgMn2AlO>MgCo2AlO>MgNi2AlO>Mg3AlO。在MgMn2AlO材料上甲苯的初始转化温度为150 ℃,甲苯在300 ℃时实现完全转化。MgCo2AlO、MgNi2AlO和Mg3AlO材料上甲苯分别在200、250及300 ℃开始转化,全转化温度分别为400、400和600 ℃,Mg3AlO材料的催化性能较差。图8(b)~(c)为单独甲苯催化氧化过程中CO选择性和CO2选择性曲线。与苯-甲苯协同催化或单独苯催化氧化过程类似,MgCo2AlO催化材料在整个温度范围内均未产生CO。CO选择性随温度的升高呈现先增加后降低的趋势。对于CO2,其选择性随温度升高而增加,与甲苯转化率表现出相同的变化趋势。MgMn2AlO在甲苯催化氧化中,CO2的选择性在300 ℃时达到100%,而MgCo2AlO和MgNi2AlO的CO2选择性在温度为400 ℃时达到100%。
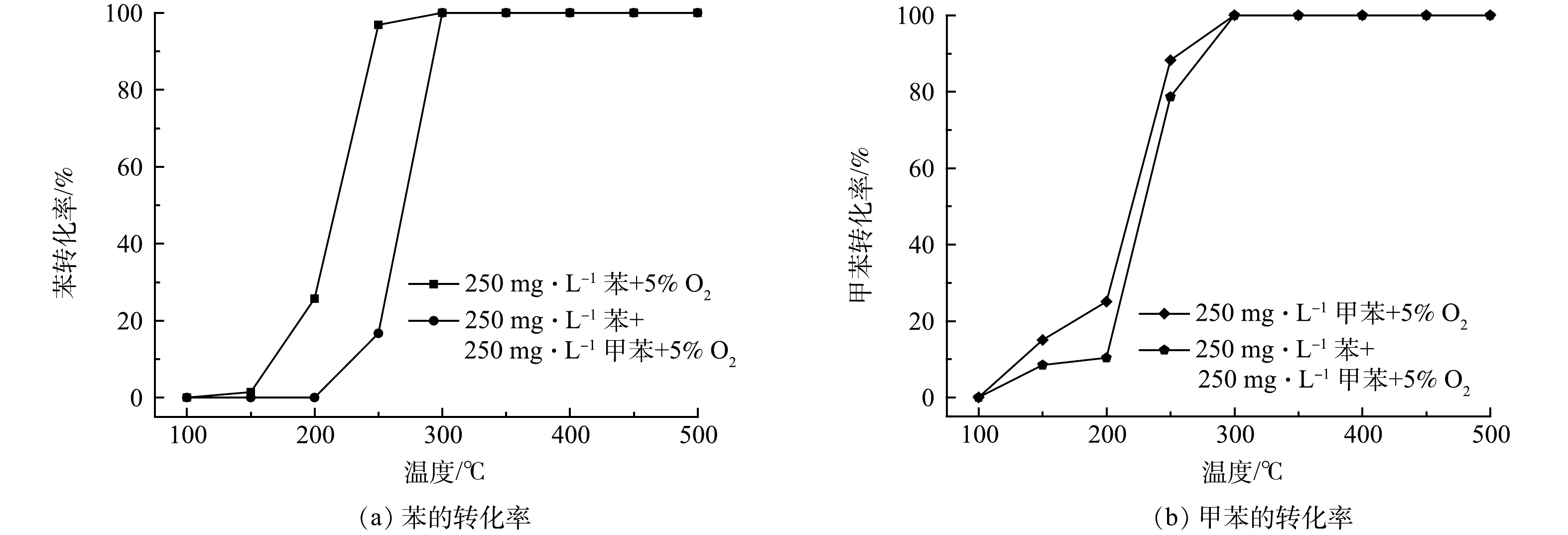
图9为MgMn2AlO材料上单一组分(苯或甲苯)及苯-甲苯混合气氛下苯或甲苯的转化率随温度的变化曲线。由图9可知,苯转化率和甲苯转化率无论是在单一组分下还是在混合气氛下都在温度约为300 ℃时达到100%。但是,混合气气氛(苯-甲苯)下,苯的转化率和甲苯的转化率均有所降低,如,单独苯的催化氧化,200 ℃时苯的转化率为25%,而混合气(苯-甲苯)气氛下,200 ℃时苯基本没有转化。同样的,单独甲苯在150 ℃时的转化率为15%,而混合气(苯-甲苯)气氛下,150 ℃苯的转化率为8%。说明甲苯的存在对苯的转化率有影响,降低了苯的转化率,同理,苯的存在对甲苯的转化率也有影响,在混合气气氛下甲苯的转化率也有所降低,这进一步说明,苯和甲苯之间存在相互抑制作用。
综上所述,在苯和甲苯的协同催化降解过程中,MgMn2AlO材料表现出最佳的催化性能,而在单独苯或单独甲苯的催化氧化过程中,MgMn2AlO对苯或甲苯的催化降解性能也优于其他催化材料,该材料的优异性能在不同的反应条件中体现出较好的一致性。此外,苯和甲苯在混合体系下的催化氧化过程中存在明显的相互抑制作用。
-
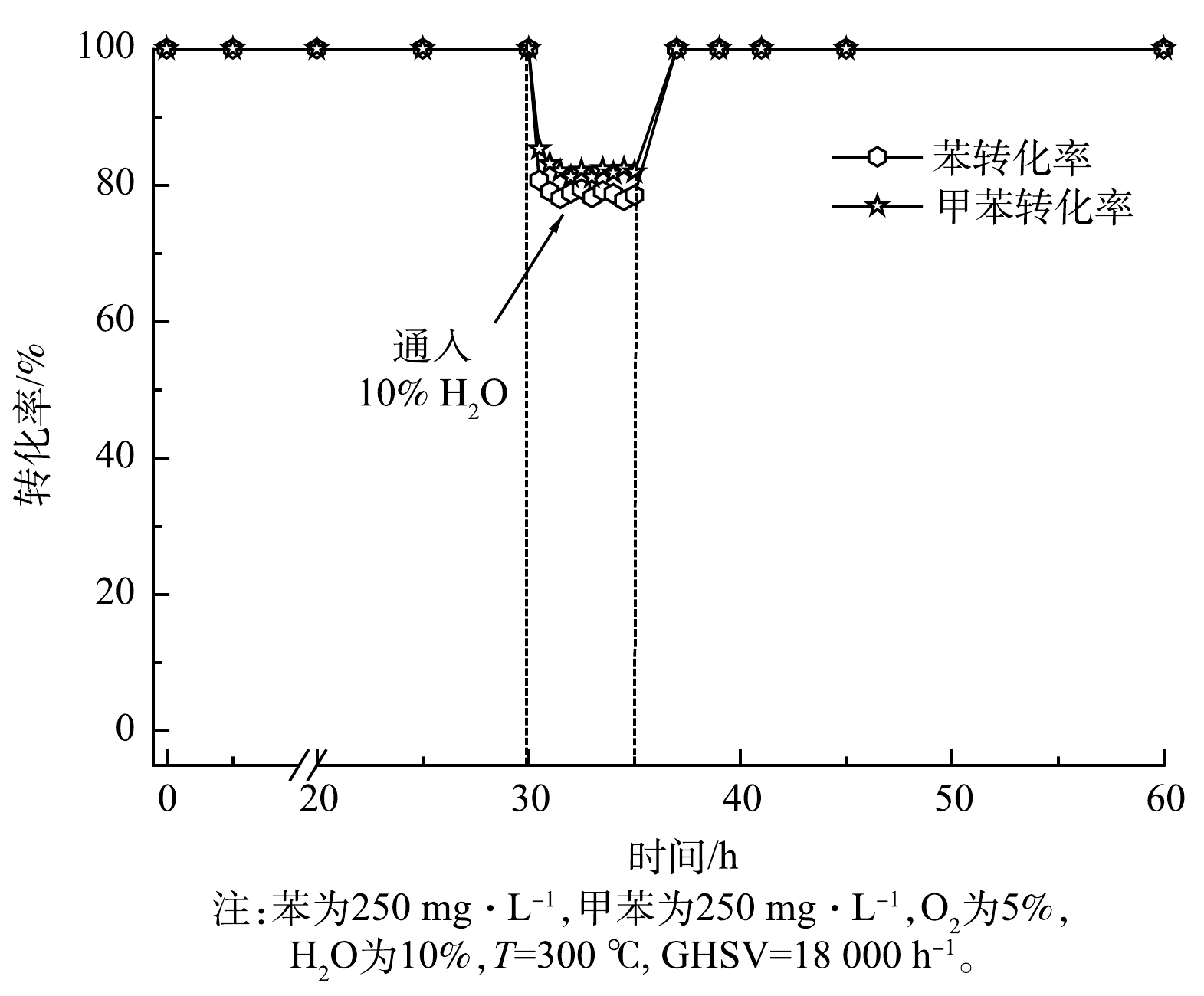
在实际应用中,含水蒸气的催化性能可能会导致催化剂失活。因此,研究H2O对MgMn2AlO催化稳定性的影响是非常有必要的。MgMn2AlO样品在300 °C下的稳定性如图10所示。可见,苯和甲苯的转化率在最佳反应条件下可以保持恒定在接近100%,反应连续进行30 h。此时,通过流量计控制10%的H2O进入反应体系。结果表明,在引入10%的水蒸气后,苯和甲苯的转化率迅速降低,苯和甲苯的转化率分别由100%降至约78%和82%。在切断水蒸气后,苯和甲苯的转化率恢复到100%。以上结果表明,水蒸气的存在会对反应性能产生负面影响,这可能是由于污染物分子和水分子在催化剂表面的竞争吸附导致的。
-
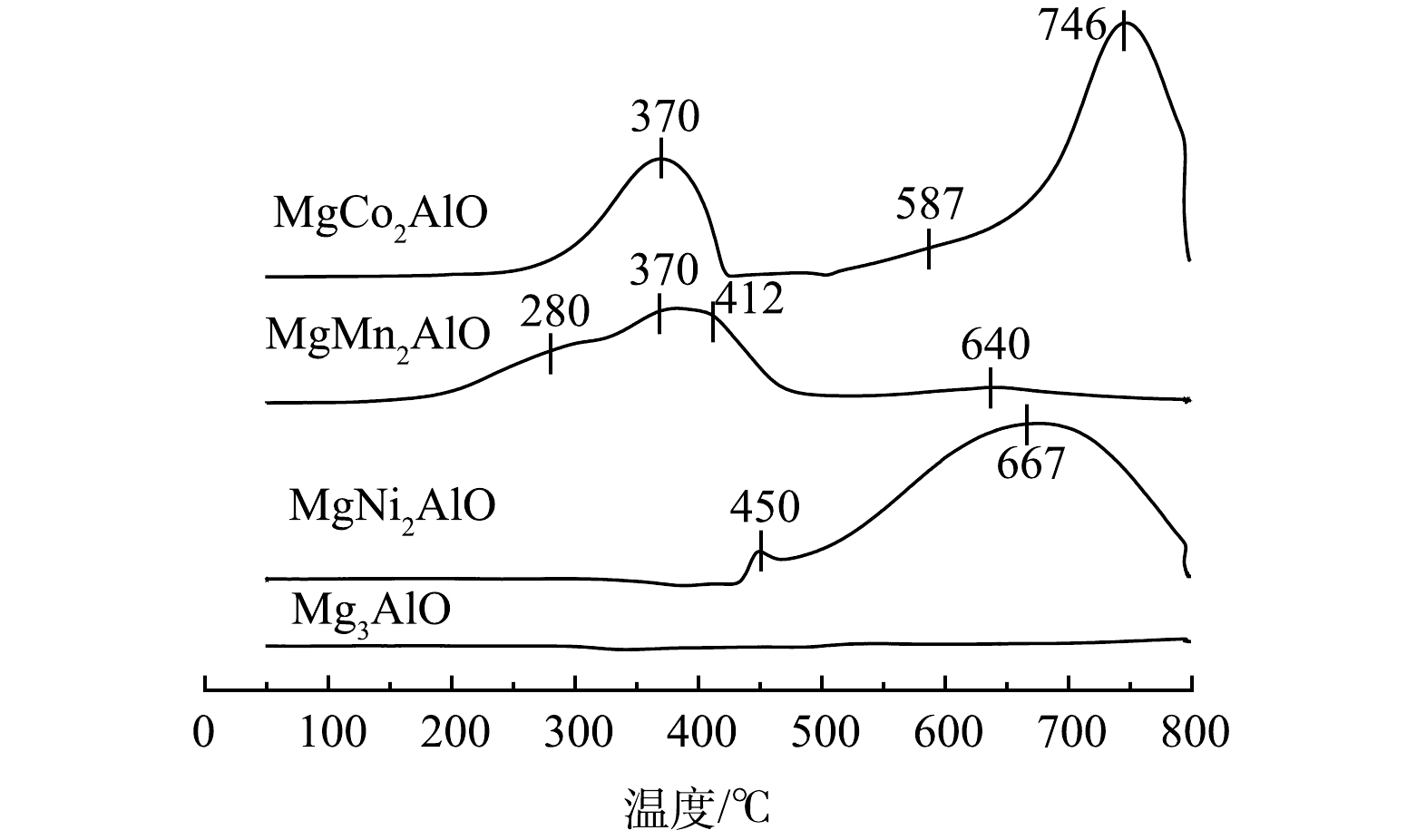
催化材料的氧化还原性质是影响催化性能的一个重要因素,一般用H2-TPR来表征催化剂的氧化还原性能。图11为MgM2AlO催化剂的H2-TPR谱图。对于Mg3AlO材料,该样品的H2-TPR谱图近似为一条直线,在整个温度范围内(50~800 ℃)均未出现特征H2还原峰,因温度较低,在该温度范围内Mg2+和Al3+均不能被还原。MgCo2AlO样品的H2-TPR谱图由3个特征峰组成,370 ℃的H2还原峰归属于Co3+→Co2+,500~800 ℃的H2还原峰归属于Co2+–Al3+尖晶石相或CoAl2O4物种的还原(Co2+→Co0),其中587 ℃的肩峰归属于表面Co2+的还原,746 ℃的还原峰归属于体相Co2+的还原[27-28]。对于MgMn2AlO样品,其H2-TPR谱图表现出4个典型的特征峰,其中280 ℃的还原峰归属于Mn4+→Mn3+的还原,370 ℃的还原峰为Mn2O3→Mn3O4物种的还原,412 ℃的还原峰为Mn3+→Mn2+的还原,640 ℃的还原峰归属于Mn2+–Al3+尖晶石相或MnAl2O4物种的还原,该结果与XRD结果对应[29-30]。MgNi2AlO样品的H2-TPR谱图由2个特征峰组成,位于450 ℃及667 ℃左右,分别归属于与Mg、Al氧化物具有强相互作用的高度分散的表面Ni物种的还原和部分嵌入的Ni物种(NiAl2O4)的还原[31]。由图11可知,除Mg3AlO外,MgMn2AlO、MgCo2AlO及 MgNi2AlO催化剂的H2-TPR还原峰可分为低温还原峰和高温还原峰两部分,其中MgMn2AlO材料的低温还原峰温度最低为280 ℃,MgCo2AlO的低温还原峰温度为370 ℃,而MgNi2AlO催化剂的低温还原峰温度为450 ℃。此外,H2还原峰的峰面积大小可表明耗氢量的多少,MgMn2AlO材料低温段的还原峰峰面积明显高于MgCo2AlO及MgNi2AlO催化材料的低温段还原峰峰面积。综合以上分析,MgMn2AlO材料H2-TPR还原峰温度较低且峰面积较大,均说明该材料有较好的氧化还原性能,同时其低温氧化性能也优于其他催化材料。结合活性数据,材料低温H2还原峰温度为MgMn2AlO<MgCo2AlO<MgNi2AlO,低温还原峰耗氢量为MgMn2AlO(17.068 mmol g−1) > MgCo2AlO(11.965 mmol g−1) > MgNi2AlO(0.395 mmol g−1)。H2-TPR表征结果与催化剂催化氧化苯-甲苯的性能结果一致,说明催化材料的氧化还原性能对苯-甲苯协同催化降解的催化活性有重要影响。
-
表面酸性位点影响反应物分子在材料表面的吸附,而吸附是进行表面反应的先决条件。因此,进行了NH3程序升温脱附(NH3-TPD)表征。如图12所示,所有样品均表现出3种类型的NH3脱附峰。其中,110 ℃左右的特征峰归属于材料表面的弱酸性位点,主要指弱Brønsted酸位点吸附的NH3的解吸;位于360~390 °C的峰归属于中等强度的酸性位吸附的NH3物种的脱附,包括中等强度的Brønsted酸性位点/Lewis酸性位点的NH3解吸;600 ℃左右的特征峰为材料强酸性位的NH3脱附峰[32-33]。由图12可知,强酸性位的NH3脱附峰峰面积较小,材料表面均有较为丰富的弱酸性位和中等强度的酸性位。与其他材料相比,MgMn2AlO材料的低温NH3脱附峰面积较大,表明存在丰富的表面弱酸性位点。推测MgMn2AlO材料的较多的弱酸性位点更有利于反应物分子的化学吸附和活化,产生更多吸附态苯或甲苯物种,从而有助于获得更高的催化降解性能,该结论与文献报道结果一致[34]。
-
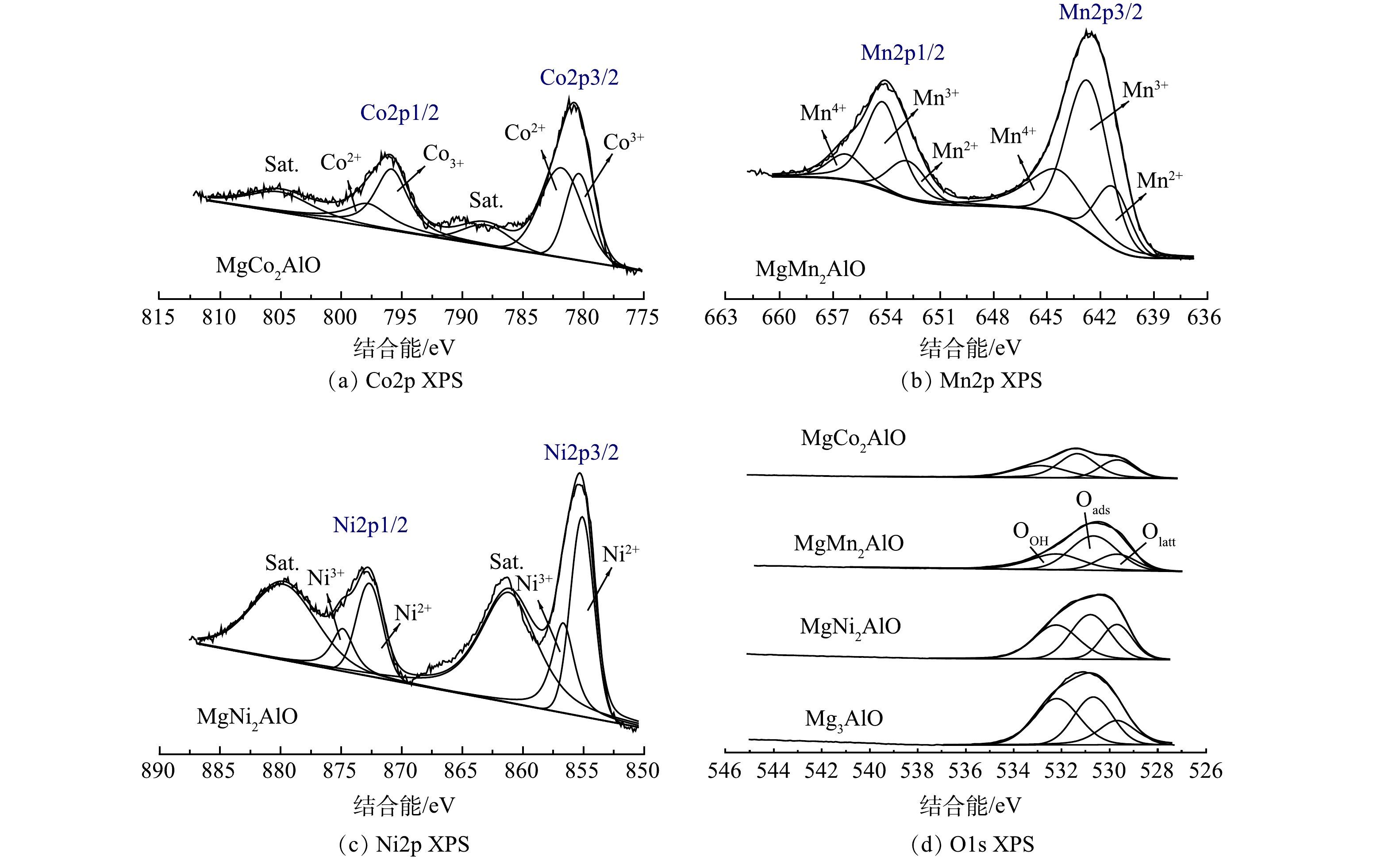
为了对催化材料的离子价态和氧物种进行分析,进行了X射线光电子能谱(XPS)表征,结果如图13所示。根据XPS相关数据计算了材料表面原子比,结果如表3所示。由图13(a)所见,MgCo2AlO样品的Co2p的XPS谱图可以分峰为6个峰,其中795.6 eV和780.4 eV对应于Co3+物种,而Co2+的特征峰中心位于为781 eV和796.9 eV,结合能为788 eV及803 eV的特征峰归属于Co3O4物种的特征卫星峰[35]。有研究[36]表明,八面体晶胞中从Co3+向Co2+的转变和Co—O键能的增加主要是由于高价态元素占据了原始Co2+位置,导致晶格畸变,使晶胞更加活跃,有利于提高催化反应的活性。图13(b)为MgMn2AlO的Mn2p谱图,2个主峰位于653.7 eV和642.6 eV左右,分别归属于Mn2p1/2和Mn2p3/2 [37]。在峰拟合去卷积之后,Mn2p的2个峰可以分峰为6个峰,分别归属于Mn2+(641.2 eV和652.4 eV)、Mn3+(642.6 eV和653.7 eV)和Mn4+(644.3 eV和656.2 eV)[38]。根据MgM2AlO样品的峰面积比可以计算Mn4+物种占全部Mn物种(Mn4++Mn3++Mn2+)的百分比为25.05%。有研究[29]表明,Mn4+物种为主要的活性物种,有利于反应物分子的完全氧化。对于MgNi2AlO,Ni 2p谱图(图13(c))包括两种类型的Ni物种(Ni2+和Ni3+),855.1 eV和872.8 eV处的特征峰可以归属于为Ni2+物种,856.5 eV和87.4.8 eV的峰归属为Ni3+物种,卫星峰位于861.6 eV和881.7 eV[39]。以上结果说明,在MgNi2AlO样品中同时存在Ni2+和Ni3+物种。
金属氧化物催化剂中的氧物种对催化性能有重要影响,O1s谱图常用于识别存在于氧化物催化剂中的氧物种。图13(d)显示了O1s的XPS谱图,且不同催化剂表面氧物种的比例可通过峰面积比例进行计算,结果如表3所示。在MgM2AlO( M=Co, Mn, Ni, Mg )系列材料的XPS O1s谱图中可明确观察到3个特征峰,归因于3种类型的氧物种:529.6 eV的特征峰归属于晶格氧(表示为Olatt),峰位置位于531.0 eV附近的特征峰归属于吸附氧(表示为Oads),以及在较高结合能处的特征峰(532.4 eV)归属于表面羟基氧(表示为OOH)[40-41]。一般来说,表面氧空位数量的增加有利于气相氧的吸附和活化,从而导致表面吸附氧含量的增加[42]。因此,根据峰面积,计算了表面吸附氧(Oads/Ototal)的比例,发现吸附氧比例的次序为MgMn2AlO>MgCo2AlO>MgNi2AlO>Mg3AlO,说明MgMn2AlO样品中有较多的表面吸附氧。结合活性数据,系列MgM2AlO材料催化降解苯-甲苯的性能从高到低的次序为MgMn2AlO>MgCo2AlO>MgNi2AlO>Mg3AlO,该次序与表面吸附氧所占比例完全吻合,推测表面吸附氧为系列材料的活性中心,MgMn2AlO材料表面有较多的表面吸附氧,同时存在高活性的Mn4+物种,有利于反应物分子在材料表面的吸附活化和进一步反应。
-
1)通过共沉淀法制备了系列类水滑石衍生复合氧化物MgM2AlO ( M=Co, Mn, Ni, Mg )催化材料,并研究了系列材料协同催化降解苯-甲苯的性能。
2)催化剂催化降解苯、甲苯的转化率的次序为MgMn2AlO>MgCo2AlO>MgNi2AlO>Mg3AlO。其中,MgMn2AlO的催化降解性能最佳,300 °C时可以实现苯和甲苯的完全转化,同时CO2选择性为100%。此外,发现苯-甲苯协同催化氧化过程中存在相互抑制作用。
3)采用多种表征技术研究了催化材料的构效关系。结果表明,MgMn2AlO催化剂优异的低温氧化还原特性及丰富的表面弱酸性位点,使其在吸附和活化苯系污染物催化氧化中表现出优异性能。同时,MgMn2AlO表面丰富的表面吸附氧及高活性的Mn4+物种,有利于苯和甲苯协同催化氧化反应的进行。
类水滑石衍生复合氧化物MgM2AlO材料上苯-甲苯协同催化氧化过程
The synergistically catalytic oxidation process of benzene and toluene on hydrotalcite- like derived composite oxides MgM2AlO
-
摘要: 挥发性有机化合物(volatile organic compounds,VOCs)作为大气复合污染的重要前体物广泛存在于工业废气中,因此,研究工业废气中多组分VOCs协同催化氧化过程与技术是推进大气污染防治攻坚战,打赢蓝天保卫战的关键举措。本研究采用共沉淀法成功制备了系列类水滑石衍生复合氧化物MgM2AlO ( M = Co, Mn, Ni, Mg ) 催化剂,以苯、甲苯为探针物分子研究了系列催化材料协同催化降解苯-甲苯的催化性能。MgMn2AlO材料的催化性能最优,在300 °C时苯-甲苯混合体系下,苯和甲苯转化率均为100%,CO2选择性为100%。通过单一反应物(苯或甲苯)与苯-甲苯协同催化氧化反应活性对比,发现苯-甲苯协同催化氧化过程中存在相互抑制作用。此外,采用XRD、N2吸脱附、SEM、TEM-EDS、NH3-TPD、H2-TPR和XPS表征技术研究了催化材料的构效关系。结果表明,催化剂的氧化还原性特性对苯-甲苯协同催化氧化活性影响至关重要,弱酸性位点有利于苯、甲苯的化学吸附和活化,且表面吸附氧的存在有利于苯-甲苯协同催化氧化生成CO2和H2O。
-
关键词:
- 苯 /
- 甲苯 /
- 协同催化氧化 /
- 类水滑石衍生复合氧化物 /
- 相互影响
Abstract: Volatile organic compounds (VOCs), as important precursors of atmospheric composite pollution, are widely present in industrial waste gas. Therefore, the study of the synergistically catalytic oxidation process and technology of multi-component VOCs in industrial waste gas is a key measure to advance the battle against air pollution and win the battle for blue sky defense. In this study, a series of catalysts of hydrotalcite derived composite oxides MgM2AlO (M=Co, Mn, Ni, Mg) were successfully prepared using the co-precipitation method. The catalytic performance of the series of catalytic materials for synergistic degradation of benzene and toluene was studied using benzene and toluene as probe molecules. MgMn2AlO had the optimal catalytic performance with the conversion rates of 100% for both benzene and toluene, as well as CO2 selectivity of 100%, in the benzene-toluene mixed system at 300 °C. By comparing the activity of a single reactant (benzene or toluene) with that of the synergistically catalytic oxidation of benzene and toluene, the mutual inhibition occurred in the latter process. In addition, XRD, N2 adsorption-desorption, NH3-TPD, H2-TPR, and XPS characterization techniques were used to study the structure-activity relationship of the catalytic materials. The characterization results indicated that the redox performance of the catalyst is key factor affecting the activity of synergistically catalytic oxidation of benzene and toluene. Weak acidic sites were conducive to the chemical adsorption and activation of benzene and toluene, and the presence of oxygen vacancies was beneficial for the synergistically catalytic oxidation of benzene and toluene to generate CO2 and H2O. -

-
表 1 MgM2AlO催化剂的比表面积、孔容及孔径
Table 1. Textual properties of MgM2AlO catalysts
样品 比表面积/(m2·g−1) 孔容/(cm3·g−1) 孔径/nm MgCo2AlO 77.45 0.33 12.03 MgMn2AlO 137.76 0.68 16.37 MgNi2AlO 175.48 0.61 10.34 Mg3AlO 149.26 0.92 16.86 表 2 MgM2AlO催化剂T50,T90和T100
Table 2. The catalytic activities of MgM2AlO catalysts
催化剂 苯 甲苯 T50/°C T90/°C T100/°C T50/°C T90/°C T100/°C MgCo2AlO 311 385 450 261 343 400 MgMn2AlO 271 294 300 221 259 300 MgNi2AlO 416 445 500 358 391 400 Mg3AlO 577 >600 >600 502 566 600 表 3 MgM2AlO的表面原子比
Table 3. Surface atomic ratio of MgM2AlO
催化剂 Mg/% M/% Al/% O/% Oads/ Ototal /% MgCo2AlO 7.68 Co 10.86 18.76 62.70 45.52 MgMn2AlO 4.25 Mn 18.72 12.23 64.80 50.27 MgNi2AlO 4.27 Ni 15.86 17.32 62.55 38.96 Mg3AlO 14.83 0 13.55 71.62 36.10 -
[1] CHEN Z W, TING Y C, HUANG C H, et al. Sources-oriented contributions to ozone and secondary organic aerosol formation potential based on initial VOCs in an urban area of Eastern Asia[J]. Science of the Total Environment, 2023, 892: 164392. doi: 10.1016/j.scitotenv.2023.164392 [2] 武婷, 崔焕文, 肖咸德等, 我国典型化工行业VOCs排放特征及其对臭氧生成潜势[J]. 环境科学, 2024, 45(5): 2613-2621. [3] HE C, CHENG J, ZHANG X, et al. Recent advances in the catalytic oxidation of volatile organic compounds: A review based on pollutant sorts and sources[J]. Chemical Reviews, 2019, 119(7): 4471-4568. doi: 10.1021/acs.chemrev.8b00408 [4] WANG H, HAO R, FANG L, et al. Study on emissions of volatile organic compounds from a typical coking chemical plant in China[J]. Science of the Total Environment, 2021, 752: 141927. doi: 10.1016/j.scitotenv.2020.141927 [5] 梁欣欣, 卜龙利, 刘嘉栋等, 分子筛负载型吸附剂对典型VOCs的吸附行为特性[J]. 环境工程学报, 2016, 10(6): 3152-3160. [6] LI X, ZHANG L, YANG Z, et al. Adsorption materials for volatile organic compounds (VOCs) and the key factors for VOCs adsorption process: A review[J]. Separation and Purification Technology, 2020, 235: 116213. doi: 10.1016/j.seppur.2019.116213 [7] RAO R, MA S, GAO, B, et al. Recent advances of metal-organic framework-based and derivative materials in the heterogeneous catalytic removal of volatile organic compounds[J]. Journal of Colloid and Interface Science, 2023, 636: 55-72. doi: 10.1016/j.jcis.2022.12.167 [8] GUO Y, WEN M, LI G, et al. Recent advances in VOC elimination by catalytic oxidation technology onto various nanoparticles catalysts: a critical review[J]. Applied Catalysis B: Environmental, 2021, 281: 119447. doi: 10.1016/j.apcatb.2020.119447 [9] LIU W, ZHU H, JIANG S, et al. Preparation of Au@Cu-MnO2 and its application in the catalytic oxidation of VOCs[J]. Materials Letters, 2023, 340: 134109. doi: 10.1016/j.matlet.2023.134109 [10] PENG R, SUN X, LI S, et al. Shape effect of Pt/CeO2 catalysts on the catalytic oxidation of toluene[J]. Chemical Engineering Journal, 2016, 306: 1234-1246. doi: 10.1016/j.cej.2016.08.056 [11] YE H, LIU S, YU D, et al. Regeneration mechanism, modification strategy, and environment application of layered double hydroxides: Insights based on memory effect[J]. Coordination Chemistry Reviews, 2022, 450: 214253. doi: 10.1016/j.ccr.2021.214253 [12] DAI C, WU X, WANG Q, et al. Layered double hydroxides for efficient treatment of heavy metals and organic pollutants: Recent progress and future perspectives[J]. Separation and Purification Technology, 2025, 352: 128277. doi: 10.1016/j.seppur.2024.128277 [13] CAO Y, ZHENG D, ZHANG F, et al. Layered double hydroxide (LDH) for multi-functionalized corrosion protection of metals: A review[J]. Journal of Materials Science & Technology, 2022, 102: 232-263. [14] WANG J, XIAO X, LI J, et al. Hydrotalcite-derived Ni-LDO catalysts via new approach for enhanced performances in CO2 catalytic reduction[J]. Fuel, 2022, 324: 124491. doi: 10.1016/j.fuel.2022.124491 [15] WANG H, CHEN W, JIN W, et al. Mn mixed oxide catalysts supported on Sn-doped CoAl-LDO for low-temperature NH3-SCR electronic supplementary information (ESI) available[J]. Catalysis Science & Technology, 2023, 13(10): 3147-3157. [16] XU Y, CHEN J, YE Z, et al. Design and optimization of CuCo-LDO catalysts via ZIF-67 sacrificial templates for enhanced toluene oxidation: A comprehensive study on morphology, structure, and catalytic activity[J]. Molecular Catalysis, 2024, 560: 114113. doi: 10.1016/j.mcat.2024.114113 [17] HAN D, MA X, YANG X, et al. Metal organic framework-templated fabrication of exposed surface defect-enriched Co3O4 catalysts for efficient toluene oxidation[J]. Journal of Colloid and Interface Science, 2021, 603: 695-705. doi: 10.1016/j.jcis.2021.06.139 [18] CHEN G, ZHANG J, WANG H, et al. Fast colloidal synthesis of SnSe2 nanosheets for flexible broad-band photodetection[J]. CrystEngComm, 2021, 23(10): 2034-2038. doi: 10.1039/D0CE01774D [19] CHEN J, ZENG Y, ZHANG S, et al. Strong interface interaction enriched surface Co3+ cations on Co3O4-LaCoO3 composite catalyst for highly efficient toluene oxidation[J]. Molecular Catalysis, 2023, 549. [20] SUN H, LIU Z, CHEN S, et al. The role of lattice oxygen on the activity and selectivity of the OMS-2 catalyst for the total oxidation of toluene[J]. Chemical Engineering Journal, 2015, 270: 58-65. doi: 10.1016/j.cej.2015.02.017 [21] HAN J, ZENG H Y, XU S, et al. Catalytic properties of CuMgAlO catalyst and degradation mechanism in CWPO of methyl orange[J]. Applied Catalysis A: General, 2016, 527: 72-80. doi: 10.1016/j.apcata.2016.08.015 [22] BRAVO J J, SUBRAMANIAM B, CHAUDHARI R V. Ultraviolet–visiblespectroscopy and temperature-programmed techniques as tools for structural characterization of Cu in CuMgAlO x mixed metal oxides[J]. The Journal of Physical Chemistry C, 2012, 116(34): 18207-18221. doi: 10.1021/jp303631v [23] YU J J, JIANG Z, KANG S F, et al. Influence of Cu- substituted hydrotalcite precursors and derived oxides[J]. Chinese Journal of Chemical Physics, 2005, 18(2): 251-256. [24] JIANG Z, HAO Z, YU J, et al. Catalytic combustion of methane on novel catalysts derived from Cu-Mg/Al-hydrotalcites[J]. Catalysis letters, 2005, 99(3-4): 157-163. doi: 10.1007/s10562-005-2108-6 [25] OBEID M, POUPIN C, LABAKI M, et al. CO2 methanation over LDH derived NiMgAl and NiMgAlFe oxides: Improving activity at lower temperatures via an ultrasound-assisted preparation[J]. Chemical Engineering Journal, 2023, 474: 145460. doi: 10.1016/j.cej.2023.145460 [26] LUCJAN P K, ALICJA R L, DORATA M. Roman dziembaj catalytic activity of Co-Mg-Al, Cu-Mg-Al and Cu-Co-Mg-Al mixed oxides derived from hydrotalcites in SCR of NO with ammonia[J]. Applied Catalysis B: Environmental, 2002, 35: 195-210. doi: 10.1016/S0926-3373(01)00254-5 [27] LI Q, MENG M, ZOU Z Q, et al. Simultaneous soot combustion and nitrogen oxides storage on potassium-promoted hydrotalcite-based CoMgAlO catalysts[J]. Journal of Hazardous Materials, 2009, 161(1): 366-372. doi: 10.1016/j.jhazmat.2008.03.103 [28] CHEN K, BAI S, LI H, et al. The Co3O4 catalyst derived from ZIF-67 and their catalytic performance of toluene[J]. Applied Catalysis A: General, 2020, 599. [29] WANGZ Y, GUO R T, SHI X, et al. The superior performance of CoMnOx catalyst with ball-flowerlike structure for low-temperature selective catalytic reduction of NOx by NH3[J]. Chemical Engineering Journal, 2020, 381. [30] SHI Y, YI H, GAO F, et al. Facile synthesis of hollow nanotube MnCoOx catalyst with superior resistance to SO2 and alkali metal poisons for NH3-SCR removal of NOx[J]. Separation and Purification Technology, 2021, 265. [31] WANG Z, YIN M, PANG J, et al. Active and stable Cu doped NiMgAlO catalysts for upgrading ethanol to n-butanol[J]. Journal of Energy Chemistry, 2022, 72: 306-317. doi: 10.1016/j.jechem.2022.04.049 [32] ZHANG Y, WANG R. Synthesis of polymetallic oxides hollow spheres with superior activity, resistance to SO2, H2O and metal poisons for low-temperature NH3-selective catalytic reduction of NOx[J]. Separation and Purification Technology, 2024, 336. [33] MA S, ZHAO X, LI Y, et al. Effect of W on the acidity and redox performance of the Cu0.02Fe0.2WaTiO x (a = 0.01, 0.02, 0.03) catalysts for NH3-SCR of NO[J]. Applied Catalysis B: Environmental, 2019, 248: 226-238. doi: 10.1016/j.apcatb.2019.02.015 [34] JIANG Y, CHENG G, YANG R, et al. Influence of preparation temperature and acid treatment on the catalytic activity of MnO2[J]. Journal of Solid State Chemistry, 2019, 272: 173-181. doi: 10.1016/j.jssc.2019.01.031 [35] WANG Z, XU K, RUAN S, et al. Mesoporous Co–Mn spinel oxides as efficient catalysts for low temperature propane oxidation[J]. Catalysis letters, 2021, 152(9): 2695-2704. [36] CHEN Y L, WANG X W, HE W X, et al. Fe and Cr doped porous Co3O4@C nanosheets with abundant oxygen vacancies for highly efficient oxygen evolution reaction[J]. Molecular Catalysis, 2023, 548. [37] ZHANG L, SHI L, HUANG L, et al. Rational design of high-performance DeNO x catalysts based on Mn xCo3– xO4 nanocages derived from metal–organic frameworks[J]. ACS Catalysis, 2014, 4(6): 1753-1763. doi: 10.1021/cs401185c [38] GUO R T, SUNX, LIU J, et al. Enhancement of the NH3-SCR catalytic activity of MnTiO x catalyst by the introduction of Sb[J]. Applied Catalysis A: General, 2018, 558: 1-8. doi: 10.1016/j.apcata.2018.03.028 [39] HUANG J, WANG W, LIU X, et al. Three-dimensional sandwich-structured NiMn2O4@reduced graphene oxide nanocomposites for highly reversible Li-ion battery anodes[J]. Journal of Power Sources, 2018, 378: 677-684. doi: 10.1016/j.jpowsour.2018.01.029 [40] HUANG W, YAO Z, ZHAO H, et al. Modulating adsorption-oxidation dual sites and confinement structure of interlayered MnO2/defective rGO nanoreactor for efficient and stable catalytic ozonation of CH3SH[J]. Separation and Purification Technology, 2025, 354: 128824. doi: 10.1016/j.seppur.2024.128824 [41] ZHAO J, LI C, LIU X, et al. Highly efficient catalytic oxidation of toluene by amorphous/microcrystalline mixed-phase MnO2[J]. Separation and Purification Technology, 2024, 345: 127348. doi: 10.1016/j.seppur.2024.127348 [42] WU S, LIU H, HUANG Z, et al. O-vacancy-rich porous MnO2 nanosheets as highly efficient catalysts for propane catalytic oxidation[J]. Applied Catalysis B: Environmental, 2022, 312: 121387. doi: 10.1016/j.apcatb.2022.121387 -



 下载:
下载: