-
现在人们每天80%~90%的时间都是在室内度过,室内空气质量的好坏直接影响着人体健康[1]。甲醛是室内主要空气污染物之一,具有污染普遍、影响范围广、持续时间长等特点[2]。国际癌症研究机构(IARC)已于2004年将甲醛列为第一类人类致癌物[3],欧盟委员会于2014年将甲醛列为1B类致癌物和致突变物[4]。人们长期接触低质量浓度的甲醛会出现头痛、咳嗽、恶心、眼炎、鼻炎等症状[5],长期接触高质量浓度的甲醛甚至会导致多种癌症[6]以及哮喘、记忆力减退、白血病、生殖缺陷等疾病[7]。室内甲醛的来源包括建筑材料和消费品,如家具和其他含有甲醛基树脂的木制品、绝缘材料、纺织品、电子设备、化妆品和清洁剂都会释放甲醛[7],此外,烹饪、吸烟、加热和蜡烛燃烧也会释放甲醛[8]。CHEN等[9]发现在住宅厨房中进行烹饪,平均每分钟可释放1.273 mg甲醛。YAMASHITA等[10]调查发现,学校和住宅楼的室内甲醛42%~79%来源于家具的释放。中国国家室内空气质量标准(GB/T
18883 -2022)[11]规定室内甲醛质量浓度限值为0.08 mg·m−3。HONG等[12]调研广西壮族自治区典型公共环境的甲醛污染水平发现,超过90%的家具市场甲醛质量浓度超标(>0.08 mg·m−3),测得的最高甲醛质量浓度为0.313 mg·m−3。熊萍萍等[13]对南昌市新装修的188个住宅房间的甲醛质量浓度进行检测发现,采集样本的甲醛质量浓度超标率(>0.08 mg·m−3)为70.2%,甲醛平均质量浓度为0.213 mg·m−3。在净化室内甲醛的众多方法之中,盆栽绿植因其经济、环保、美观等优势受到越来越多的关注[14-15]。目前现有研究虽已证实,在一定的甲醛质量浓度范围内,甲醛质量浓度与绿植净化率呈负相关[16-17]、与甲醛的吸收量呈正相关[18-19],但这些研究大多未涉及绿植净化率和吸收量随熏蒸时间的变化情况,结合甲醛净化微观机理进行分析的研究更是少之又少。虽然已有一些研究涉及绿植气孔指数随甲醛质量浓度的变化情况[20],但仍缺乏气孔指数和叶面积与熏蒸时间之间关系的研究。此外,关于绿植对甲醛的吸收量,现有研究往往是针对不同甲醛质量浓度下绿植单位叶面积甲醛吸收量[16],仍缺乏不同甲醛质量浓度下绿植每小时甲醛吸收量和甲醛累计吸收量的研究。通过文献调研还发现,很少有研究对实验装置内泄露的甲醛进行量化去除,净化室内甲醛的盆栽绿植种类亦有待补充。针对以上研究空白,本研究在排除实验装置内甲醛泄漏干扰的情况下,量化评估绿萝、金边吊兰、白鹤芋和虎尾兰4种室内盆栽绿植对甲醛的净化能力,分析各绿植的甲醛吸收量随时间和甲醛初始质量浓度的变化情况,观察各绿植在甲醛胁迫下的生存状态,探究绿植吸收甲醛的机理。
-
在现有关于盆栽绿植对甲醛吸收能力和耐受能力研究的基础上,筛选出绿萝、金边吊兰、白鹤芋、虎尾兰4种甲醛吸收效果较好、耐受力较强、市面常见且价格便宜的盆栽绿植(图1),各植株大小约为20 cm×20 cm×40 cm。为消除不同甲醛初始质量浓度在植株体内的残留影响以及减小植株之间的个体差异影响,每种绿植各选取9个大小相近的株体并随机分配用于3个不同甲醛初始质量浓度下的各3次独立重复实验,即共测试36株绿植(4种绿植×3个甲醛初始质量浓度×3次重复实验)。此外,为消除土壤因素带来的实验误差,各绿植均栽培于盛有400 g营养土的规格一致的塑料盆内,且受试前后均放置在环境参数适宜的无甲醛房间中进行统一养护。
实验前先使用LD-YMJ-B型叶面积仪(山东莱恩德智能科技有限公司)测量受试植株的叶面积;然后参照BIAN等[21]的方法,取新鲜叶片用指甲油印迹法制片,在叶片表面薄而均匀地刷一层透明指甲油,待指甲油风干后,用镊子撕取指甲油薄膜制成临时装片,置于CX40-3Channel-MRaman-Module型数码显微镜(上海如海光电科技有限公司)下观测叶片气孔,获得气孔密度(即每mm2叶面积的气孔个数);再基于绿植叶面积与气孔密度的乘积获得植株的气孔数量。
-
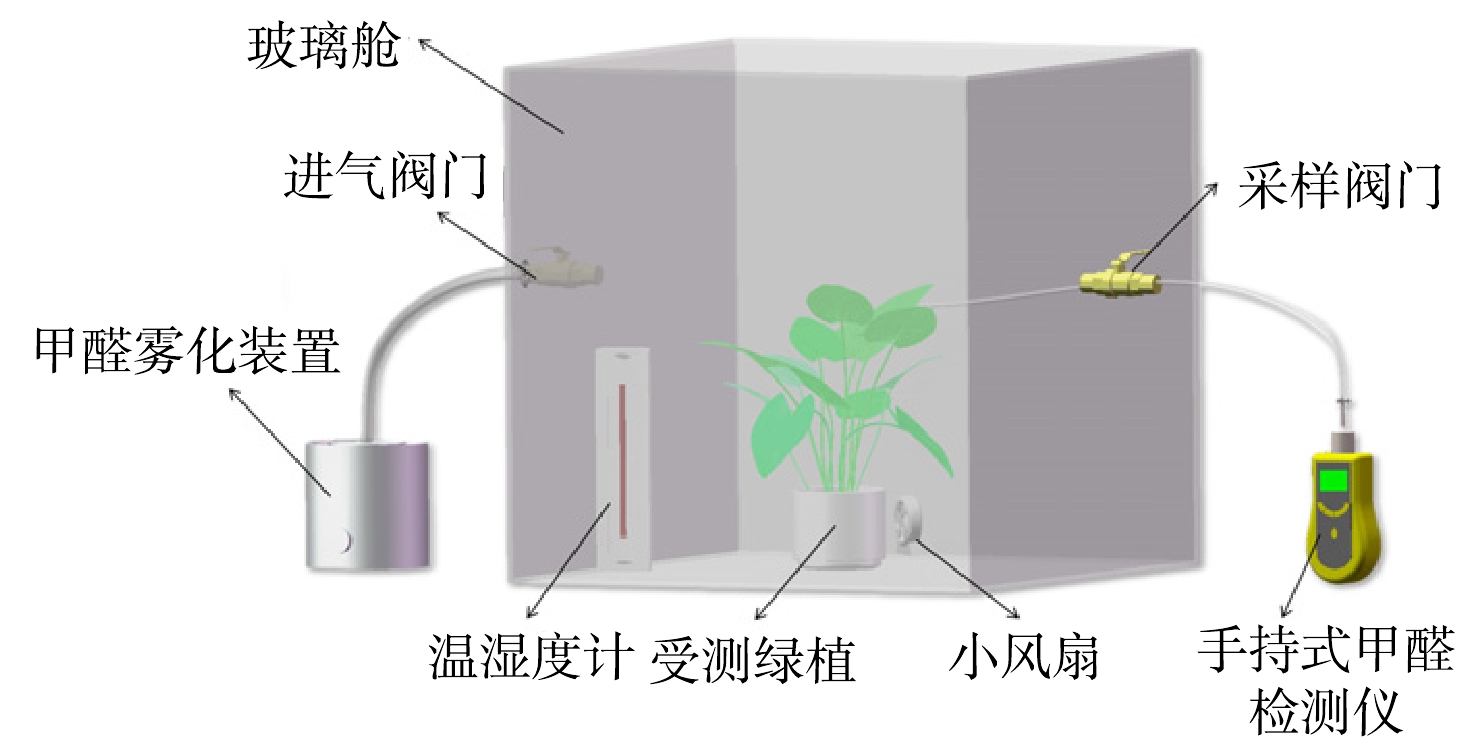
本研究所设计的实验系统如图2所示。参照WOLVERTON等[22]实验,制作尺寸为60 cm×60 cm×60 cm的玻璃舱,上方玻璃盖装有密封条,可启闭,以便于取放受测绿植。玻璃舱周壁两个相对的侧面各开有1个直径为2 cm的圆孔,并装上阀门,1个用于注入甲醛气体,另外1个用于检测舱内甲醛质量浓度。玻璃舱内部放置1个小风扇和1个温湿度计,小风扇用来加速甲醛在箱内的均匀挥发流动,温湿度计用来检测舱内温湿度变化。为了使结果更加接近室内环境,本实验使用日光灯提供照明,由于相较于低、高光照强度,室内绿植更喜欢中强度的光照,长时间的高强度光照可能会对绿植的生长不利[23],因此选定实验室内上午10:30的平均光照强度(约800 Lux)作为玻璃舱内的光照强度,持续48 h提供光照。实验过程中玻璃舱内温度为(15±3) ℃,相对湿度为50%~60%。
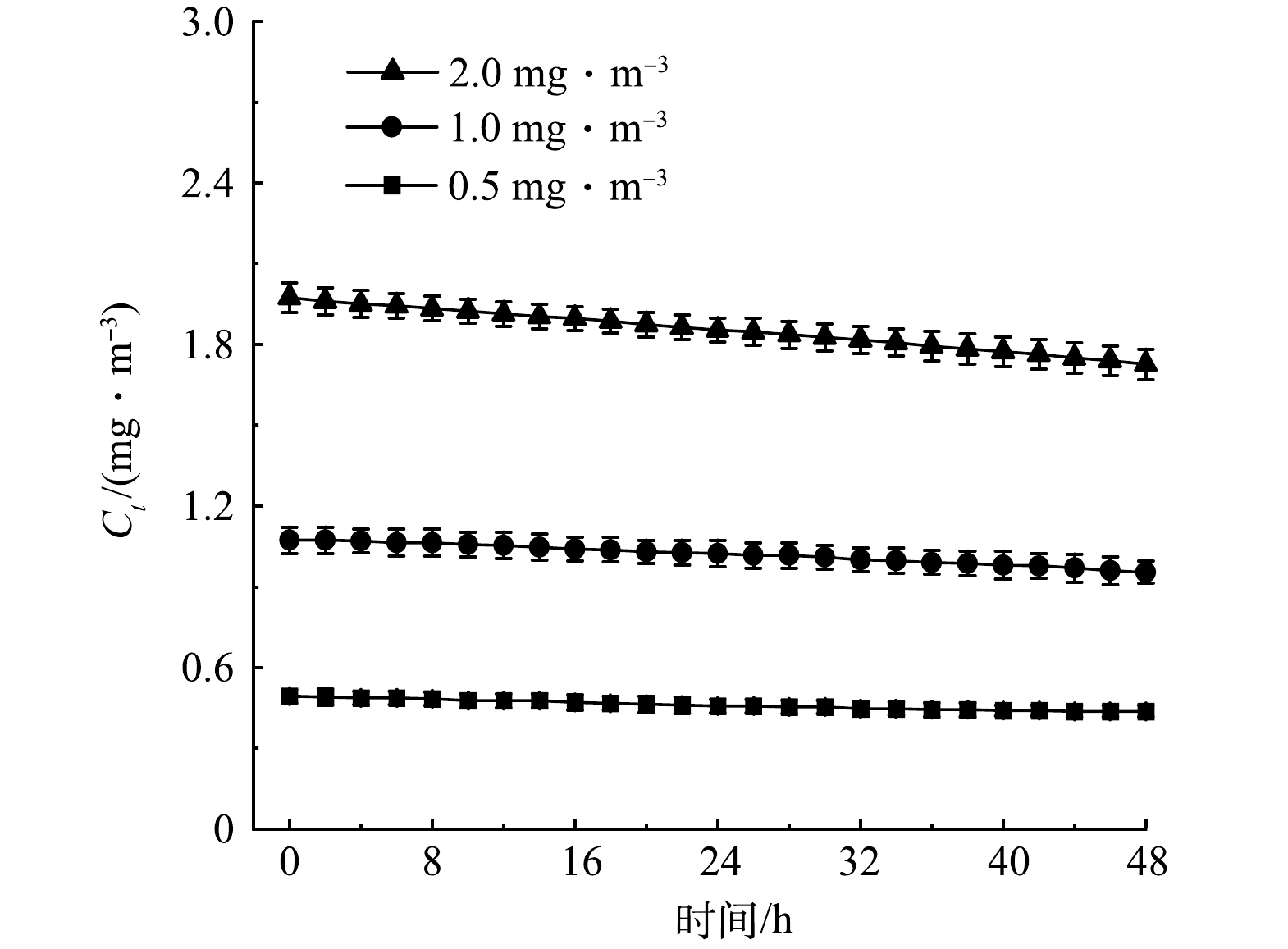
在空白玻璃舱(不放绿植)中注入甲醛,使其初始质量浓度分别为0.5、1.0和2.0 mg·m−3(每个初始质量浓度下开展3次重复实验),每隔2 h测1次数据,可得到不同甲醛初始质量浓度下空白舱内甲醛质量浓度随时间的变化,结果如图3所示。由图3可知,在各甲醛初始质量浓度下12次独立重复实验在48 h后分别降至为(0.06±0.01)、(0.12±0.01)和(0.25±0.01) mg·m−3。由实验结果可知,标准差较低,说明不同重复实验的密封条件是一致的,甲醛的泄漏较为稳定。由于实验过程中空白玻璃舱的密封方式、环境参数均与实验舱(放绿植)保持一致,可通过扣除对应质量浓度空白舱的泄漏甲醛质量浓度来排除实验舱内泄漏甲醛干扰、量化评估绿植对甲醛的净化能力。此外,由于实验用玻璃舱并非完全密闭,实验过程中盆栽绿植对舱内CO2和O2含量的影响可通过玻璃舱的相关泄漏孔/缝隙予以平衡,对玻璃舱内CO2和O2进行检测发现,48 h实验过程中玻璃舱内O2和CO2含量百分比分别处于20%~23%和0.02%~0.04%。
-
实验开展于2月10日至3月20日,将空白舱和实验舱放置在相同的环境中(光照、通风、温湿度均相同)。使用雾化装置将甲醛溶液(37%~40%)雾化,分别向空白舱和实验舱内注入相同剂量的甲醛,舱内的小风扇加速甲醛挥发扩散,待甲醛在舱内扩散均匀后,使用SKY2000型手持式甲醛检测仪(深圳元特科技有限公司)分别检测空白舱和实验舱内的甲醛质量浓度,以此作为0 h甲醛的初始质量浓度。本研究根据世界卫生组织明确规定室内甲醛质量浓度不得超过0.1 mg·m−3为基准,设置了0.5、1.0和2.0 mg·m−3 3个甲醛初始质量浓度,设定的质量浓度与新装修的室内甲醛质量浓度[24]接近。从0开始,每隔2 h对空白舱和实验舱分别进行甲醛质量浓度检测并记录数据,直至48 h时结束。48 h实验过程中不断观察并记录实验舱内绿植的叶片损伤情况(如是否出现叶片伤斑、叶尖坏死、叶缘黄化等)。实验结束后,将受测绿植放置在室内自然光照和正常温湿度的无甲醛室内培养7 d,观察绿植叶片是否有损伤变化并作记录。
-
1)绿植吸收作用下实验舱内t时刻甲醛质量浓度(Ct)。在不同的甲醛初始质量浓度下,计算t~(t+2) h空白舱内每2 h降低的甲醛质量浓度(Ctbl),并以t时刻空白舱内甲醛质量浓度(Ctb)为自变量根据式(1)可计算Ctbl。
式中:Ctb
$ {\mathrm{C}}_{\mathrm{t}\mathrm{b}} $ 为t时刻空白舱内甲醛质量浓度,mg·m−3;Ctbl为空白舱t~(t+2) h内降低的甲醛质量浓度,mg·m−3。以实验舱内t时刻甲醛质量浓度(Cte)代替
$ {\mathrm{C}}_{\mathrm{t}\mathrm{b}} $ Ctb、代入式(1)可得到实验舱t~(t+2) h内因泄漏而降低的甲醛质量浓度(Ctel),则可排除泄漏干扰,得到实验舱内单纯在绿植吸收作用下t时刻的甲醛质量浓度(Ct):式中:Ctel为实验舱内t~(t+2) h内因泄漏而降低的甲醛质量浓度,mg·m−3;Cte为实验舱内t时刻甲醛质量浓度,mg·m−3;Ct为排除泄漏干扰后、单纯在绿植吸收作用下实验舱内t时刻的甲醛质量浓度,mg·m−3。
2)绿植在不同时间段内甲醛净化率(η)根据式(3)计算,不同
$ {\mathrm{C}}_{\mathrm{t}} $ Ct质量浓度下绿植每小时甲醛吸收量(At)根据式(4)计算,绿植在不同时间段内甲醛累计吸收量(A)根据式(5)计算。式中:η为不同时间段内绿植的甲醛净化率,%;C0为实验舱内甲醛初始质量浓度,mg·m−3。
式中:At
$ {\mathrm{A}}_{\mathrm{t}} $ 为绿植在t h内甲醛吸收量,mg;V0为玻璃舱体积,m3。式中:A为不同时间段内绿植的甲醛累计吸收量,mg。
使用统计软件SPSS 22对Ct、η、At和A等实验数据进行方差分析、多重比较分析和相关性分析,考察不同实验组合条件下各变量间的显著性差异(显著性水平P<0.05)。
-
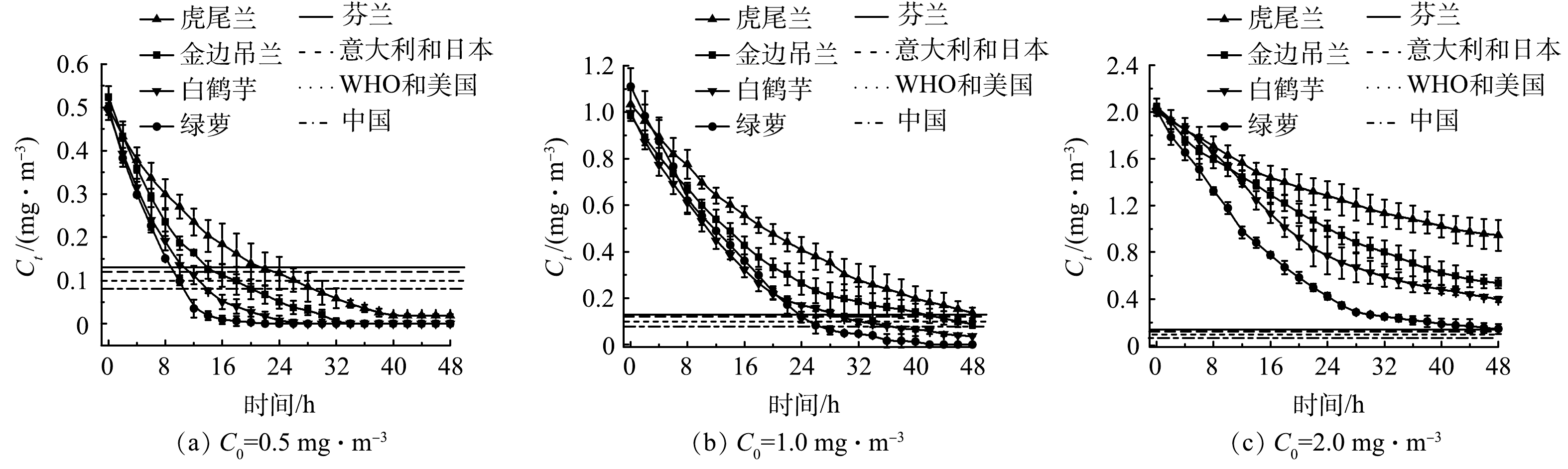
1)盆栽绿植吸收作用下甲醛质量浓度Ct随时间变化。由图4可知,在选定的4种绿植中,绿萝吸收甲醛的能力最强,其次是白鹤芋和金边吊兰,吸收效果最差的是虎尾兰,且随着C0的上升,4种绿植之间的甲醛吸收能力差异变大(P<0.05)。此外,当C0为0.5 mg·m−3时,所有绿植均在前16 h吸收量较大,绿萝和白鹤芋所在实验舱内Ct分别经22 h和26 h降至0;当C0为1.0 mg·m−3和2.0 mg·m−3时,所有绿植均在前24 h吸收量较大,后24 h虽然Ct持续降低但降幅变小。产生此现象的原因可能为:较高的甲醛质量浓度会对绿植形成污染胁迫,绿植为了缓解这种胁迫而调动过氧化物酶活性、渗透调节物质及气孔特征等自身快速反应机制将甲醛吸收代谢,当环境中的甲醛质量浓度降低到一定程度时,绿植株体感应到胁迫降低后放缓代谢速度[16,25];绿植净化甲醛不仅仅依靠叶片,土壤-根系净化也是绿植净化系统的一部分,与活性炭快速稳定的物理吸附方法类似,土壤的物理吸附作用可在短时间降低环境中较高质量浓度的甲醛[18]。
图4还标出了WHO(0.10 mg·m−3)、中国(0.08 mg·m−3)、美国(0.10 mg·m−3)、芬兰(0.13 mg·m−3)、意大利(0.12 mg·m−3)和日本(0.12 mg·m−3)关于室内甲醛质量浓度的指导限值[11,26-27],可以看出,4种绿植在一定时间内能将实验舱内Ct降低至部分国家和组织规定的室内甲醛质量浓度指导限值以下。
2)不同时间段内盆栽绿植对甲醛净化率η随甲醛初始质量浓度C0变化。如图5所示,4种绿植的η排序为:绿萝>白鹤芋>金边吊兰>虎尾兰。方差分析结果表明,随C0的升高,4种绿植在不同时间段内的η显著降低(P<0.05);随着净化时间的延长,各绿植的η显著升高(P<0.05)。当C0为0.5 mg·m−3时,在8 h内,绿萝、白鹤芋和金边吊兰能将舱内50%以上的甲醛净化干净;24 h内,绿萝和白鹤芋的η接近100%;48 h内,4种绿植的η均能达到100%。当C0为1.0 mg·m−3时,4种绿植8 h内的η均低于50%;48 h时,4种绿植的η均高于85%。当C0为2.0 mg·m−3时,绿萝8、24和48 h内的η分别为34%、79%和93%,前24 h吸收甲醛幅度大于后24 h;虎尾兰净化甲醛能力较低,48 h的η为54%。以上数据表明,高质量浓度甲醛胁迫对绿植的净化效果具有抑制作用,甲醛质量浓度越高,绿植净化效果越差。
-
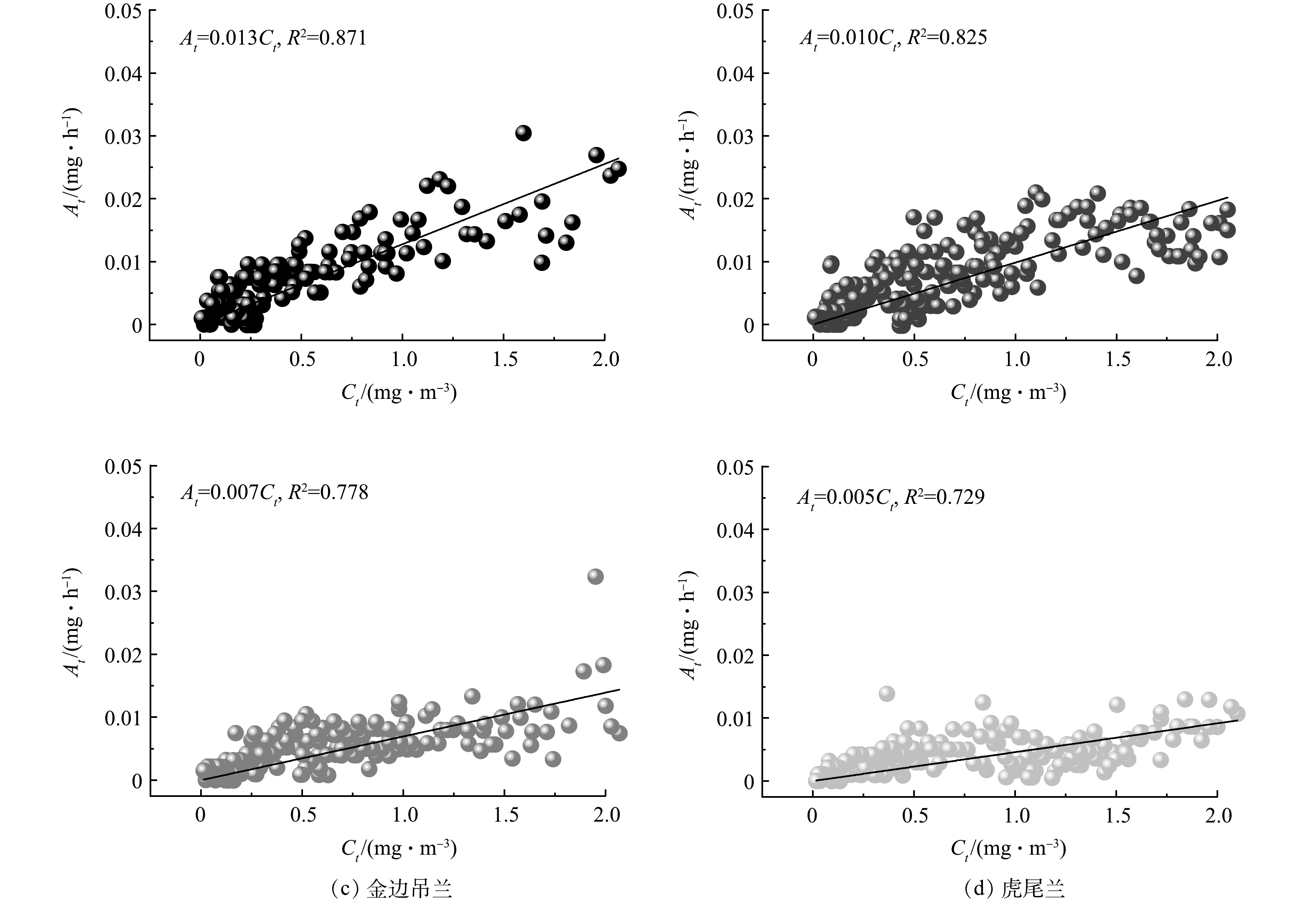
1)不同甲醛质量浓度Ct对盆栽绿植每小时甲醛吸收量At的影响。由图6可知,4种绿植的甲醛吸收量为:绿萝>白鹤芋>金边吊兰>虎尾兰,且随Ct的增加,各绿植的At均呈线性上升趋势,Ct每升高10 mg·m−3,绿萝、白鹤芋、金边吊兰、虎尾兰的At分别增加0.13、0.10、0.07、0.05 mg。当Ct≤2.0 mg·m−3时,绿萝、金边吊兰、白鹤芋和虎尾兰的At普遍不超过0.03、0.02、0.01和0.01 mg。Pearson相关分析结果表明,绿萝(r=0.861, P<0.01)、白鹤芋(r=0.803, P<0.01)、金边吊兰(r=0.714, P<0.01)和虎尾兰(r=0.618, P<0.01)的At均与Ct呈显著正相关。
2)不同甲醛初始质量浓度C0下不同时间段内盆栽绿植甲醛累计吸收量A的变化。由图7可以看出,4种绿植的A为:绿萝>金边吊兰>白鹤芋>虎尾兰。在同一甲醛初始质量浓度下各绿植的AT随着时间的延长而显著增加(P<0.05),在同一时间段内各绿植的A均随C0的升高而显著增加(P<0.05)。不难看出,当C0增加1倍时,相同时间间隔内的A并没有相应增加1倍,说明随着胁迫时间的增加,绿植吸收甲醛的能力在减弱。TOLLS等[28]在研究中指出植物叶片分为表面室和存储室,其中表面室具有快速吸收和清除污染物的动力学特性,而储存室具有相对缓慢的化学迁移能力。因此,当在一段时间内快速吸收甲醛并超过叶片表面室的清除能力时,就会导致绿植吸收甲醛速率有所下降。
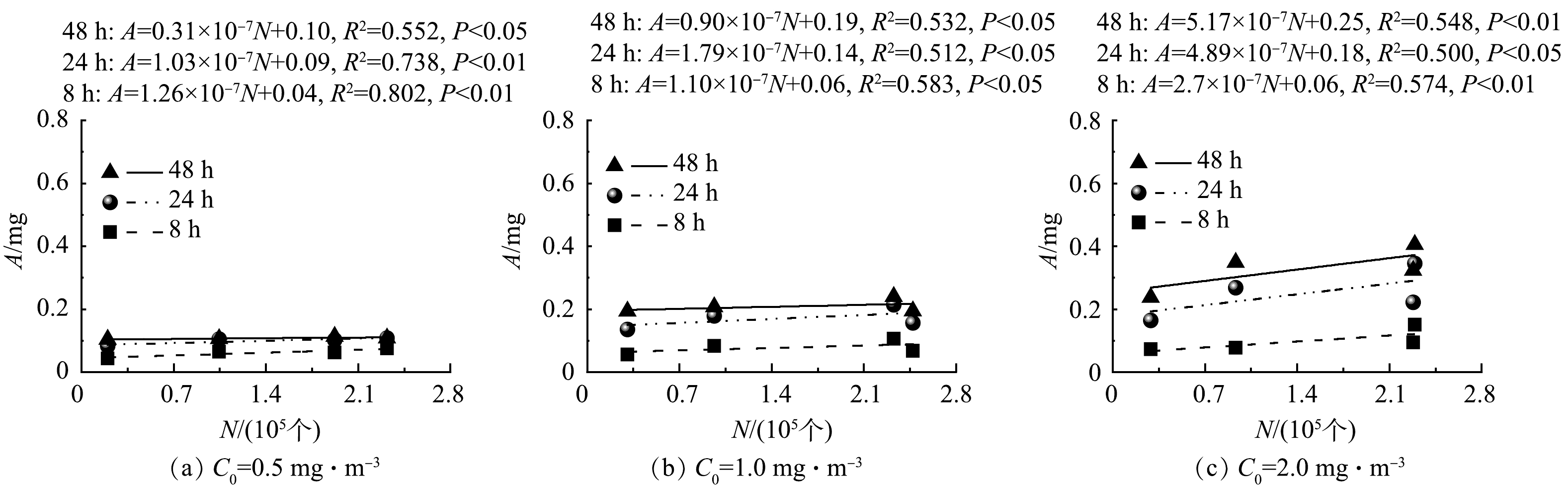
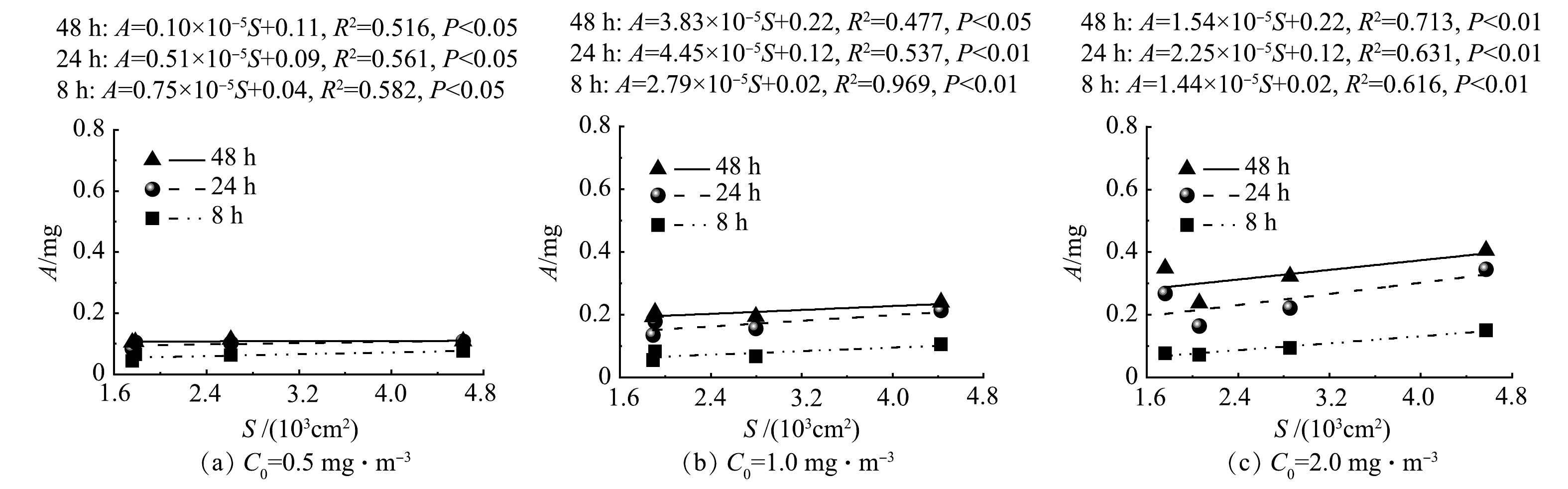
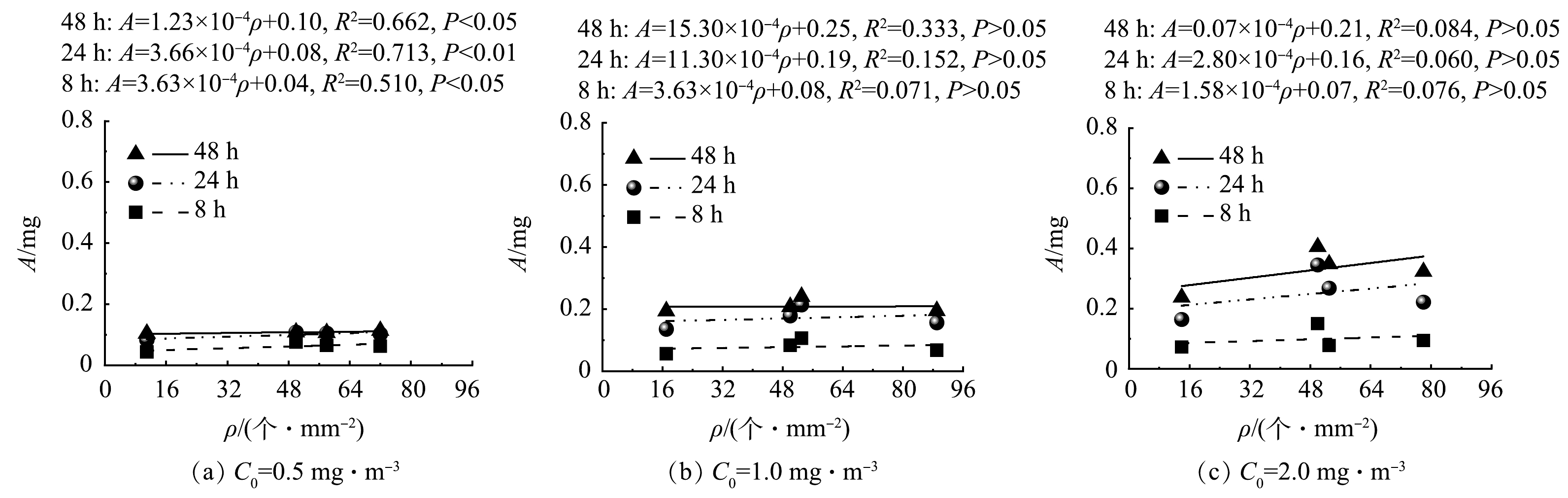
3)不同甲醛初始质量浓度C0下不同时间段内盆栽绿植对甲醛累计吸收量A随气孔数量N、气孔密度ρ和叶面积S的变化。4种绿植各9个株体的平均S、ρ和N如表1所示。对4种绿植的N、S和ρ与3个不同C0下8、24和48 h内绿植的A进行函数拟合,获得关系曲线分别如图8、9和10所示。Pearson相关分析结果显示,绿植的N、S分别与其在不同时间段内的A存在显著正相关关系(P<0.05),而ρ只与绿植在前8 h的A存在显著正相关关系(P<0.05)。由图8和图9可以看出,绿植在不同时间段内的A随其N和S的增加呈线性增加。
绿植主要通过茎叶的气孔吸收甲醛气体,再经过栅栏组织和海绵组织的扩散及维管系统的运输和分布,最终被绿植代谢和转化[29-30]。根据HODGSON等[31]的研究,金边吊兰可在短时间内通过卡尔文循环将甲醛转化为有机酸、糖和氨基酸等。有研究[32]表明,绿植的气孔密度和气孔长度随甲醛胁迫时间的延长会呈现下降的趋势(48 h内),这也会导致绿植吸收甲醛的能力变弱。本研究发现,绿植吸收甲醛的能力与其气孔数量和叶面积有关,叶面积越大,气孔数量越多,绿植吸收甲醛能力越强。
-
由表2可知,虎尾兰始终未观察到叶片损伤。当甲醛质量浓度为0.5 mg·m−3时,白鹤芋没有表现出损伤症状;绿萝叶片发黄,叶片受损53.9 cm2,占植株总叶面积1.2%;金边吊兰叶尖焦黄,叶片受损16.2 cm2,占植株总叶面积0.6%。当甲醛质量浓度为1.0 mg·m−3时,白鹤芋出现叶片萎蔫的状态,叶片受损42.1 cm2,占植株总叶面积2.3%;绿萝叶片发黄、甚至变焦,叶片受损139.0 cm2,占植株总叶面积3.1%;金边吊兰叶片边缘开始变黄、发焦并逐渐扩大,叶片受损60.1 cm2,占植株总叶面积2.2%。当甲醛质量浓度为2.0 mg·m−3时,绿萝叶片发黄、变焦,出现叶片脱落,叶片受损229.3 cm2,占植株总叶面积5.1%;金边吊兰叶片边缘发焦,叶片受损95.7 cm2,占植株总叶面积3.5%;白鹤芋叶片萎蔫、叶尖发黄,叶片受损102.9 cm2,占植株总叶面积5.7%。
综上可知,在本研究中,虽然在甲醛初始质量浓度0.5~2.0 mg·m−3的环境中培养48 h后,受测绿萝、金边吊兰和白鹤芋的叶片相继出现受损状态,但只有0.6%~5.7%的叶片出现损伤,各盆栽绿植的植株整体依旧存活。虎尾兰在甲醛胁迫环境下叶片生长状况良好,这是由于虎尾兰叶片具有较厚的革质层,叶面及叶缘较为光滑,能在污染环境中保护自身生长[33]。叶片损伤情况分析原因认为:在一般情况下,绿植能通过其新陈代谢来抵御外部环境中甲醛的胁迫,但如果受甲醛污染胁迫持续时间较长或质量浓度较高时,会导致绿植体内代谢紊乱,使其生理指标发生相应变化[16,34]。在甲醛毒害的作用下,叶绿体结构遭到破坏,从而影响叶绿素的合成,绿植叶片会呈现变黄、变焦、色斑等损伤状态[33]。由此可知,尽管绿植能吸收一定量的甲醛,但甲醛对绿植本身的损害却随质量浓度的升高而越来越严重。
-
1) 4种盆栽绿植都能有效地净化环境中的甲醛,净化能力排序为绿萝>白鹤芋>金边吊兰>虎尾兰;各绿植能在一段时间内可将甲醛质量浓度降低到WHO(0.10 mg·m−3)、中国(0.08 mg·m−3)、美国(0.10 mg·m−3)、芬兰(0.13 mg·m−3)、意大利(0.12 mg·m−3)和日本(0.12 mg·m−3)规定的允许暴露限值以下。
2) 4种盆栽绿植在48 h内可将初始质量浓度为0.5 mg·m−3的甲醛100%吸收净化,对初始质量浓度为1.0 mg·m−3甲醛的净化率均超85%,对初始质量浓度为2.0 mg·m−3甲醛的净化率均超50%。各盆栽绿植对甲醛的净化率随甲醛质量浓度的升高而不断降低,随净化时间的延长而显著升高(P<0.05)。
3)各盆栽绿植每小时的甲醛吸收量随甲醛质量浓度的升高而线性增加;甲醛质量浓度每升高10 mg·m−3,绿萝、白鹤芋、金边吊兰、虎尾兰的每小时甲醛吸收量分别增加0.13、0.10、0.07、0.05 mg。
4)各盆栽绿植的累计甲醛吸收量随净化时间的延长或甲醛质量浓度的升高而显著增加(P<0.05)。随甲醛胁迫时间的延长,绿植吸收甲醛的效率被不断削弱。绿植的气孔数量、叶面积分别与甲醛累计吸收量显著正相关(P<0.05),气孔密度与甲醛累计吸收量无显著相关性(P>0.05)。
5)在甲醛初始质量浓度≤2.0 mg·m−3的48 h实验后的1周内,虎尾兰均未观察到叶片损伤,绿萝、金边吊兰和白鹤芋的叶片相继出现萎蔫、焦黄、脱落等受损症状,且叶片损伤症状和受损叶面积占比(0.6%~5.7%)均随甲醛质量浓度的升高而加大,以绿萝叶片受损最严重,但各盆栽绿植整体仍能存活。
盆栽绿植对室内空气中甲醛的净化能力
Purification capacity of potted plants on formaldehyde in indoor air
-
摘要: 针对室内空气中甲醛危害大的问题,盆栽绿植可作为长期净化室内甲醛的潜在手段。实验选取绿萝、白鹤芋、金边吊兰、虎尾兰4种常见的盆栽绿植,分别在甲醛初始质量浓度为0.5、1.0和2.0 mg·m−3的环境中探究了各绿植对甲醛的净化能力及在甲醛胁迫下各绿植的生存状态。结果表明:1)4种盆栽绿植对甲醛的净化能力排序为:绿萝>白鹤芋>金边吊兰>虎尾兰。2)各绿植在一段时间内能将甲醛质量浓度降低至WHO(0.10 mg·m−3)、中国(0.08 mg·m−3)、美国(0.10 mg·m−3)、芬兰(0.13 mg·m−3)、意大利(0.12 mg·m−3)和日本(0.12 mg·m−3)规定的质量浓度限值以下。3)各绿植对甲醛的净化率随甲醛质量浓度的增加不断降低;各绿植在48 h内对初始质量浓度为0.5 mg·m−3甲醛的净化率均可达100%,对初始质量浓度为1.0 mg·m−3甲醛的净化率均超85%,对初始质量浓度为2.0 mg·m−3甲醛的净化率均超50%。4)各绿植每小时的甲醛吸收量随甲醛质量浓度的升高而线性增加。5)植株的气孔数量、叶面积均与其在一段时间内的累计甲醛吸收量呈显著正相关。6)在甲醛初始质量浓度≤2.0 mg·m−3的48 h暴露实验后的1周内,绿萝、金边吊兰和白鹤芋的叶片相继受损,绿萝受损叶面积最大(受损占比>5%),且受损的叶面积随甲醛质量浓度的升高而增加,但各盆栽绿植整体仍能存活。该研究结果可为科学选取净化室内甲醛的盆栽绿植提供参考。Abstract: In view of the harmful problem of formaldehyde in indoor air, potted plants can be a potential way to purify the formaldehyde-polluted indoor air in the long term. Four common species of potted plants, namely, Epipremnum aureum (Linden ex André) G.S.Bunting, Chlorophytum comosum (Thunb.) Jacques, Spathiphyllum kochii Engl. & K.Krause, and Sansevieria trifasciata Hort. ex Prain, were selected in the experiment to investigate their purification capacity and survival status under stress at the initial formaldehyde mass concentrations of 0.5, 1.0, and 2.0 mg·m−3, respectively. Results show that: 1) The purification capacity of four species of potted plants on formaldehyde was ranked as: Epipremnum aureum > Spathiphyllum kochii > Chlorophytum comosum > Sansevieria trifasciata. 2) Within a period of time, each species of potted plants could reduce the formaldehyde mass concentration below the exposure limits set by WHO (0.10 mg·m−3), China (0.08 mg·m−3), USA (0.10 mg·m−3), Finland (0.13 mg·m−3), Italy (0.12 mg·m−3), and Japan (0.12 mg·m−3). 3) The formaldehyde purification efficiency by each potted plant continuously decreased with the increase of formaldehyde mass concentration; within 48 h, the purification efficiency of each potted plant on formaldehyde with initial mass concentration of 0.5 mg·m−3 could reach 100%, over 85% for the formaldehyde with initial mass concentration of 1.0 mg·m−3, and over 50% for the formaldehyde with initial mass concentration of 2.0 mg·m−3. 4) The hourly absorbed formaldehyde by each potted plant linearly increased with increasing formaldehyde mass concentration. 5) The stomata number and leaf area of each potted plant showed a significant positive correlation with its cumulative absorbed formaldehyde over a period of time.6) Within one week after the 48-h exposure experiment at the initial formaldehyde mass concentration ≤ 2.0 mg·m−3, the leaves of Epipremnum aureum, Chlorophytum comosum, and Spathiphyllum kochii were found with damage, the largest damaged leaf area occurred for Epipremnum aureum presenting (damage proportion >5%), and the damaged leaf area increased with the increase of the formaldehyde mass concentration, but the potted plants as a whole could still survive. The results of this study can provide a reference for the scientific selection of potted plants for indoor formaldehyde purification.
-
Key words:
- indoor air /
- formaldehyde /
- potted plants /
- absorption and purification
-

-
表 1 受测4种绿植的平均S、ρ和N
Table 1. Average S, ρ and N of the four tested species of potted plants
绿植名称 叶面积 /103cm2 气孔密度/(个·mm−2) 气孔数量/104个 绿萝 4.540±0.184 51±8 23.1±3.9 金边吊兰 2.754±0.326 80±16 22.3±6.0 白鹤芋 1.819±0.126 54±7 9.8±1.7 虎尾兰 1.903±0.183 14±6 2.6±1.0 表 2 实验结束1周内各绿植叶片损伤情况
Table 2. Leaf damage status of each species of potted plants within one week after the experiment
初始甲醛
质量浓度/
(mg·m−3)受测植物 叶片损伤情况 受损叶
面积/cm2受损叶面
积占比/%0 绿萝 叶片黄斑 28.6 0.5 金边吊兰 无 0 0 白鹤芋 无 0 0 虎尾兰 无 0 0 0.5 绿萝 叶片发黄 53.9 1.2 金边吊兰 叶尖焦黄 16.2 0.6 白鹤芋 无 0 0 虎尾兰 无 0 0 1.0 绿萝 叶片发黄、变焦 139.0 3.1 金边吊兰 叶片边缘发焦 60.1 2.2 白鹤芋 叶片萎蔫 42.1 2.3 虎尾兰 无 0 0 2.0 绿萝 叶片发黄、变焦、叶片脱落 229.3 5.1 金边吊兰 叶片边缘发焦 95.7 3.5 白鹤芋 叶片萎蔫、叶尖发黄 102.9 5.7 虎尾兰 无 0 0 -
[1] SPIRU P, SIMONA P L. A review on interactions between energy performance of the buildings, outdoor air pollution and the indoor air quality[J]. Energy Procedia, 2017, 128: 179-186. doi: 10.1016/j.egypro.2017.09.039 [2] HU D W, TOBON Y, AGOSTINI A, et al. Diurnal variation and potential sources of indoor formaldehyde at elementary school, high school and university in the Centre Val de Loire region of France[J]. Science of the Total environment, 2022, 811: 152271. doi: 10.1016/j.scitotenv.2021.152271 [3] IARC Monographs on the evaluation of carcinogenic risks to humans. Volume 88. Formaldehyde, 2-Butoxyethanol and 1-tert-Butoxypropan-2-ol[M]. Lyon: International Agency for Research on Cancer, 2006. [4] SALTHAMMER T. The formaldehyde dilemma[J]. International Journal of Hygiene and Environmental Health, 2015, 218(4): 433-436. doi: 10.1016/j.ijheh.2015.02.005 [5] TANG X J, BAI Y, DUONG A et al. Formaldehyde in China: Production, consumption, exposure levels, and health effects[J]. Environment International, 2009, 35(8): 1210-1224. doi: 10.1016/j.envint.2009.06.002 [6] KWON S C, KIM I, SONG J, et al. Does formaldehyde have a causal association with nasopharyngeal cancer and leukaemia?[J]. Annals of Occupational and Environmental Medicine, 2018, 30(1). [7] GAO F, YUE X H, YANG H Q, et al. Health damage and repair mechanism related to formaldehyde released from wood-based panels[J]. BioResources, 2023, 18(1): 2426-2439. [8] HUANG H L, LEE W M G, WU F S. Emissions of air pollutants from indoor charcoal barbecue[J]. Journal of Hazardous Materials, 2015, 302: 198-207. [9] CHEN C, ZHAO Y J, ZHAO B. Emission rates of multiple air pollutants generated from Chinese residential cooking[J]. Environmental Science & Technology, 2018, 52(3): 1081-1087. [10] YAMASHITA S, KUME K, HORIIKE T, et al. Emission sources and their contribution to indoor air pollution by carbonyl compounds in a school and a residential building in Shizuoka, Japan[J]. Indoor and Built Environment, 2012, 21(3): 392-402. doi: 10.1177/1420326X11412631 [11] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 室内空气质量标准: GB/T 18883-2022[S]. 北京: 中国环境科学出版社, 2022. [12] HONG W, MENG M W, XIE J L, et al. Investigation of the pollution level and affecting factors of formaldehyde in typical public places in Guangxi, China[J]. Aerosol and Air Quality Research, 2017, 17(11): 2816-2828. doi: 10.4209/aaqr.2017.08.0272 [13] 熊萍萍, 汤昌海, 赖云, 等. 南昌市新居甲醛浓度及其影响因素调查[J]. 职业与健康, 2023, 39(17): 2385-2388. [14] 李俊霖, 李鹏, 王恒蓉, 等. 特殊植物类群空气凤梨对大气污染物甲醛的净化[J]. 环境工程学报, 2013, 7(4): 1451-1458. [15] QIAO S, SONG L L, LI S Y, et al. Overexpression of CcFALDH from spider plant (Chlorophytum comosum) enhances the formaldehyde removing capacity of transgenic gloxinia (Sinningia speciosa)[J]. Environmental Research, 2023, 223. [16] 王晗. 室内芳香植物对甲醛污染的净化修复机制研究[D]. 济南: 山东建筑大学, 2023. [17] 王兵, 王丹, 任宏洋, 等. 不同植物和吸附剂对室内甲醛的去除效果[J]. 环境工程学报, 2015, 9(3): 1343-1348. doi: 10.12030/j.cjee.20150359 [18] TEIRI H, POURZAMANI H, HAJIZADEH Y. Phytoremediation of VOCs from indoor air by ornamental potted plants: a pilot study using a palm species under the controlled environment[J]. Chemosphere, 2018, 197: 375-381. doi: 10.1016/j.chemosphere.2018.01.078 [19] 皮东恒, 徐仲均, 王京刚, 等. 盆栽吊兰净化空气中的甲醛研究[J]. 环境工程学报, 2011, 5(2): 383-386. [20] 孙慧群, 周升恩, 吴怀胜, 等. 气体甲醛胁迫对蚕豆保卫细胞中过氧化氢的积累和气孔导度及开度的影响[J]. 植物生理学报, 2015, 51(2): 246-252. [21] BIAN Z H, ZHANG X Y, WANG Y, et al. Improving drought tolerance by altering the photosynthetic rate and stomatal aperture via green light in tomato (Solanum lycopersicum L. ) seedlings under drought conditions[J]. Environmental and Experimental Botany, 2019, 167: 103844. doi: 10.1016/j.envexpbot.2019.103844 [22] WOLVERTON B C, MCDONALD R C, MESICK H H. Foliage plants for indoor removal of the primary combustion gases carbon monoxide and nitrogen dioxide[J]. Journal of the Mississippi Academy of Sciences, 1985, 30: 1-8. [23] REHMAN M, ULLAH S, BAO Y, et al. Light-emitting diodes: Whether an efficient source of light for indoor plants?[J]. Environmental Science and Pollution Research, 2017, 24(32): 24743-24752. doi: 10.1007/s11356-017-0333-3 [24] CHANG T, REN D X, SHEN Z X, et al. Indoor air pollution levels in decorated residences and public places over Xi’an, China[J]. Aerosol and Air Quality Research, 2017, 17(9): 2197-2205. doi: 10.4209/aaqr.2016.12.0542 [25] KHALIFA A A, ALALAIWAT D, KHAN E. Phytoremediation of formaldehyde by three selected non-native indoor plant species[J]. International Journal of Phytoremediation, 2024, 1-13. [26] World Health Organization, WHO global air quality guidelines: Particulate matter (PM2.5 and PM10), ozone, nitrogen dioxide, sulfur dioxide and carbon monoxide[S]. Bonn: WHO European Centre for Environment and Health, 2021. [27] 李连山, 马春莲, 陈寒玉. 室内甲醛污染的分析调查[J]. 环境科学与技术, 2002, 25(3): 44-45. doi: 10.3969/j.issn.1003-6504.2002.03.017 [28] TOLLS J, MCLACHLAN M S. Partitioning of semivolatile organic compounds between air and Lolium multiflorum (Welsh ray grass)[J]. Environmental Science & Technology, 1994, 28(1): 159-166. [29] 李明军. 植物与植物生理[M]. 重庆: 重庆大学出版社, 2015. [30] 熊燕飞, 陈跃锋, 毛志强, 等. 空气甲醛污染的植物修复机制[J]. 南京林业大学学报(自然科学版), 2023, 47(4): 1-12. [31] HODGSON G W, BAKER B L. Porphyrin abiogenesis from pyrrole and formaldehyde under simulated geochemical conditions[J]. Nature, 1967, 216(5110): 29-32. doi: 10.1038/216029a0 [32] 孟国忠. 几种室内植物对苯和甲醛复合污染响应的研究[D]. 南京: 南京林业大学, 2014. [33] 谭蕾. 3种室内植物对甲醛和苯复合污染的抗性能力与机理研究[D]. 济南: 山东建筑大学, 2022. [34] 高志慧. 3种蕨类植物对甲醛的净化能力[J]. 环境工程学报, 2017, 11(6): 3722-3725. doi: 10.12030/j.cjee.201603052 -




 下载:
下载: