-
超氧自由基 (superoxide radical) 是一种带有单个未配对电子的高度活跃氧自由基,广泛存在于天然水体中,对于理解和评估环境变化以及生态系统的健康状况具有重要意义[1-2]。超氧自由基的产生源自氧气分子的单电子还原,是水体中重金属等元素的生物地球化学循环和污染物降解的重要途径[3-4]。之前的研究普遍认为水体中超氧自由基的产生是天然有机物非生物光化学反应的结果,如光照作用、离子辐射等[5]。而越来越多的研究证实,生物源超氧自由基也是天然水体中活性氧的重要来源[6]。异养细菌、藻类、植物等生物均可以产生胞外超氧自由基[7-8]。因此,深入研究天然水体中生物源超氧自由基对于理解生态环境系统的物质循环和能量转化具有重要意义[9]。
在生态学和生物地球化学中,菌藻共生扮演着举足轻重的角色,特别是在碳和氮循环方面。这种独特的共生关系构建了一个互惠互利的微型生态系统——藻际微环境[10],藻类通过光合作用固定碳元素,为共生体系提供能量和物质基础,而微生物则提供藻类所需的营养物质,如氮、磷等,此外,细菌还能产生抗生素,帮助藻类抵御其他微生物的侵袭[11-12]。这种共生关系在自然界中十分普遍,是理解水生生态系统中藻类与其周边环境相互作用的关键,是微生物交互作用的核心舞台,然而近些年对菌藻共生的研究主要集中在菌藻共生体系用于污水处理[13]。因此,深入研究菌藻共生系统不仅有助于我们更好地理解生物多样性和生态系统功能,同时对于探索生物能源、环境修复以及应对气候变化等方面也具有重要的潜在应用价值。
最新研究发现,天然水体中的死微藻可以作为微生物光敏剂驱动还原过程,通过细胞色素或电子穿梭体将电子传递给具有胞外电子转移能力的细菌[14],该研究证实了死微藻与活菌之间的电子传递过程及其对生物地球化学循环和水体自净过程的潜在影响,因此,有必要关注基于菌藻共生种间电子传递在天然水环境中的影响。基于此,本研究分别选择了在水华过程中常见的铜绿微囊藻以及在天然水体中广泛存在的假单胞菌作为研究对象,考察了在天然水体基于藻际微环境中菌藻种间电子传递对天然水体中胞外超氧自由基的影响,并进一步深入探究了藻促菌产胞外超氧自由基的机制。
-
实验所用铜绿微囊藻 (Microcystis aeruginosa) 是一种常见的淡水藻类,属于微囊藻属,也是许多水华爆发时的优势藻种。该藻来自于中科院武汉水生生物所,保藏编号为:FACHB905,在实验室经过扩大培养后使用,藻细胞的形态为分散球状,直径约为5 μm。
实验选用的菌种假单胞菌是一种常见的革兰氏阴性菌,属于假单胞菌属,在天然水环境中广泛存在。该细菌来自于中国工业微生物保藏中心,保藏编号为CICC
20574 ,初始编号为E3P13。 -
1) 水体的选择及依据
本实验选择太湖作为研究对象。太湖是中国第三大淡水湖,对于区域水资源供应、生态保护和经济发展具有重要意义。且近年来频繁发生藻类水华,尤其是蓝藻水华,对水质造成严重影响,研究藻类与菌类的相互作用有助于理解水华形成机制和控制策略。
2) 藻促菌产胞外超氧自由基实验方法
取在富营养种子培养基中培养48 h的细菌,离心后重悬在等体积经高温灭菌的BG-11培养基中备用,向250 mL锥形瓶中加入上述重悬液及BG-11,使得总体积为150 mL (菌密度和藻密度均使用流式细胞分析系统进行计数)。分别设置菌藻组、纯菌组和纯藻组,每组三个平行,将锥形瓶置于光照培养箱中 (30 ℃,500 lx),每隔12 h取样,测定超氧自由基信号。
3) 超氧自由基的检测方法
化学发光试剂MCLA与超氧自由基发生特异性的化学发光反应,在波长460 nm处形成化学发光,不与H2O2、单线态氧、羟基自由基反应,具有专一性,有效避免了其他活性氧的干扰。测定方法为向酶标板 (Thermo C8 Lockwell Lumi White Maxisorp,
463201 ) 中加入190 μL菌液,5 μL MCLA (Tokyo Chemical Industry,TCI购自上海吉至生化科技有限公司) (MCLA溶液初始浓度为1 156.25 μmol·L−1,终浓度为3.125 μmol·L−1) ,连续测定30 min,取超氧信号稳定阶段的20个值的平均值即为细菌产胞外超氧自由基的化学发光信号值,随后加入5 μL SOD (超氧化物歧化酶SOD,购自北京兰博利德商贸有限公司,LABLED) (终浓度为120 kU·L−1) 连续测定10 min,取超氧信号稳定阶段的10个值作为此时的化学发光信号值,用第一个阶段的值减去第二个阶段的值,即为超氧自由基信号强度。4) 菌密度及藻密度的测定方法
通过Novocyte流式细胞仪测定细胞密度,使用NovoExpress软件根据细胞大小和颗粒度差异区分藻细胞和细菌细胞,并进行分别计数,得到各个体系中藻菌的生长曲线。根据生长曲线和胞外超氧自由基信号,明确藻菌互作促进产生胞外超氧自由基的关键阶段。
-
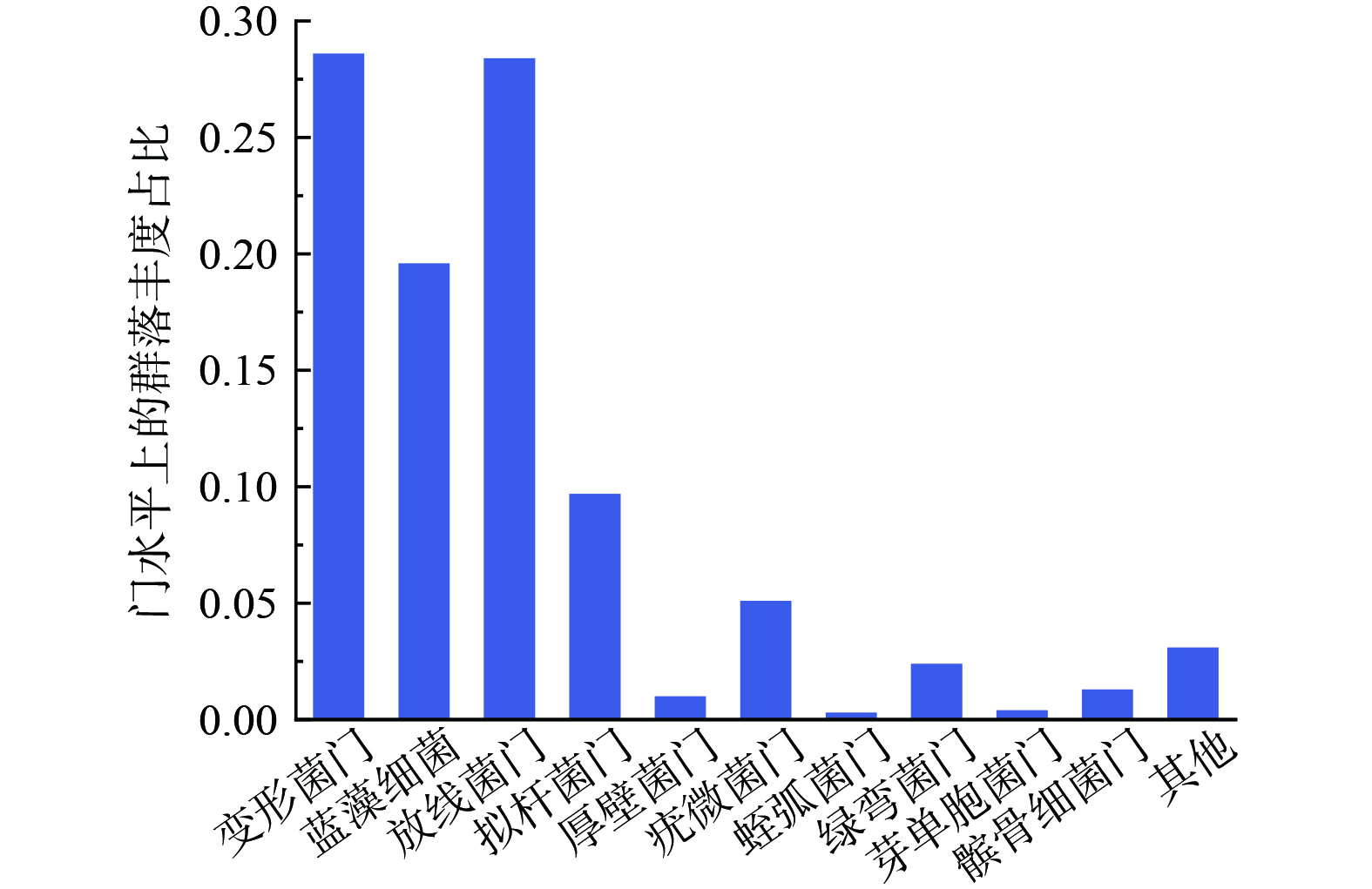
为研究天然淡水生态系统中生物产生胞外超氧自由基的能力,选取正处于藻华期的太湖作为本次研究对象。太湖,作为中国著名的淡水湖泊之一,其水质的变化及生态平衡问题一直备受关注[15]。尤其是在藻华期,太湖的水质及生态状况会发生显著变化,这为我们研究生物产胞外超氧自由基的能力提供了得天独厚的条件。为了确保研究的准确性,我们首先进行了藻种镜检和16S rRNA基因序列分析,确定了太湖藻华期的优势藻种和菌种。如图1所示,太湖在藻华期的优势藻种主要为微囊藻 (Microcystis) ,而优势菌种则属于变形菌门 (Proteobacteria) 。这一发现与国内外其他研究者的观察结果相吻合,进一步验证了我们的研究方法和结论的可靠性[16]。值得一提的是,微囊藻作为一种在全球范围内常见的优势藻种,其在太湖中的大量繁殖往往会导致水华事件的发生,进而引发一系列水生态问题,如水质恶化、水生生物死亡等[17]。而变形菌门中的假单胞菌,作为太湖藻华期伴生在藻际微环境中的优势菌种,其在水体中的存在对物质循环和能量流动起着至关重要的作用。假单胞菌具有强大的代谢能力,能够有效降解多种有机物质和污染物,对于维护水体的生态平衡和净化水质具有不可忽视的作用[18]。基于上述分析,我们选择铜绿微囊藻和假单胞菌作为研究对象。通过对这两种生物产胞外超氧自由基能力进行研究,能够在微观生物层面理解藻华过程中菌藻共存条件下生物胞外超氧自由基的产生及其生物机制。
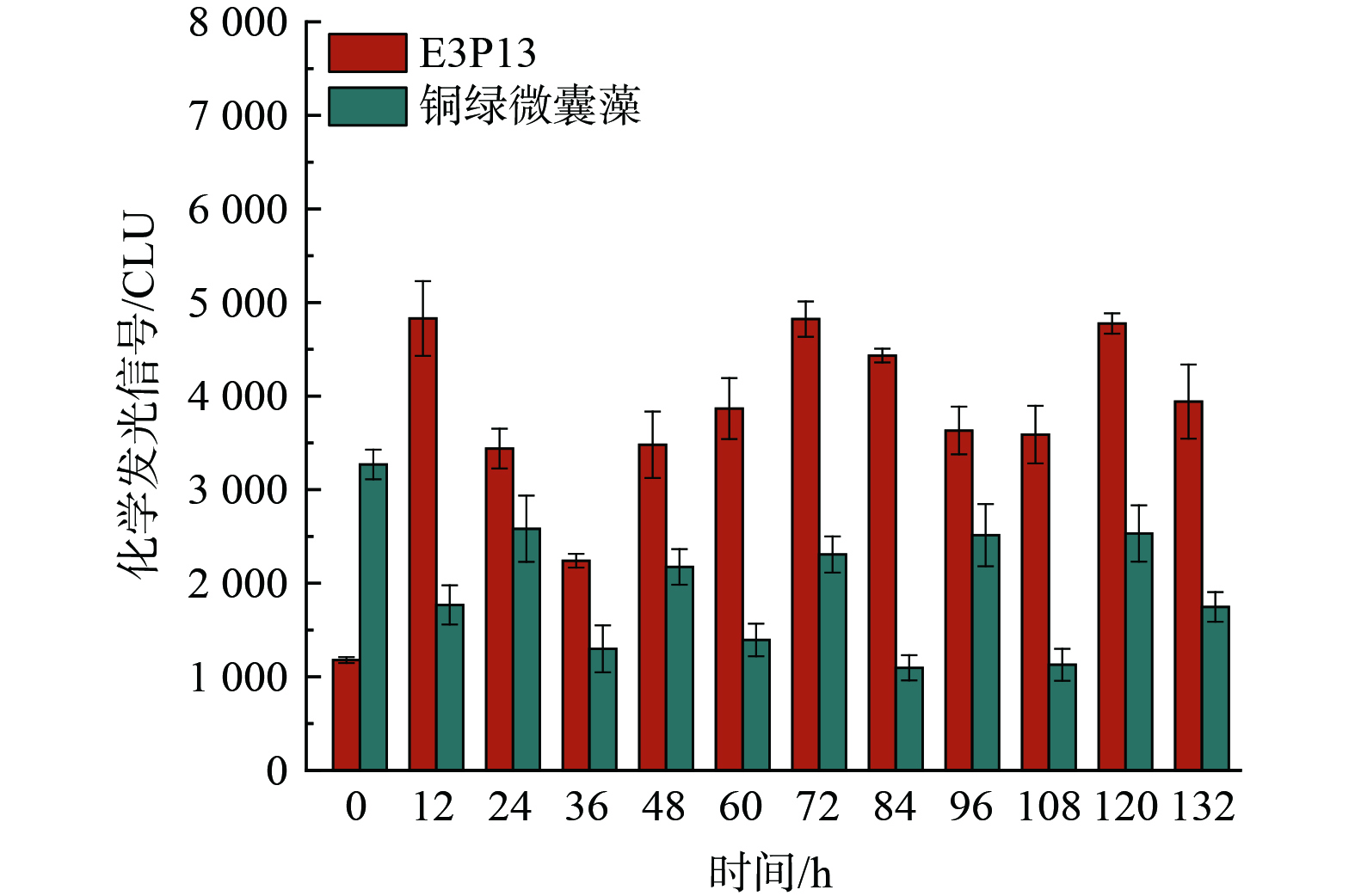
为验证铜绿微囊藻和假单胞菌是否具备产生胞外超氧自由基的能力,选择培养至稳定期的铜绿微囊藻和假单胞菌,该阶段的藻和菌具有较为稳定的生理状态,能够更准确地反映它们的代谢特性。将菌藻分别重悬于经0.22 μm滤膜过滤的太湖水中。培养条件为12 h光照,12 h黑暗交替,培养温度为30 ℃恒温。在培养过程中,每隔12 h测定一次胞外超氧自由基的产生情况,连续测定144 h。结果如图2所示,铜绿微囊藻胞外超氧自由基产生量受昼夜交替的影响明显,白天产生量增加,夜晚则降低。这可能是由于白天铜绿微囊藻受到光照刺激,通过光合作用产生氧气,氧气作为一个良好的电子受体,促使超氧自由基产生量上升。因此,白天超氧自由基的产生量增加,而夜晚由于缺乏光照,光合作用减弱,导致超氧自由基产生量降低。相比之下,假单胞菌E3P13胞外超氧自由基产生量明显高于铜绿微囊藻,然而,与铜绿微囊藻不同的是E3P13胞外超氧自由基产生量并未表现出随昼夜交替而变化的特性。这一结果表明,E3P13产生胞外超氧自由基的机制与光合作用无关,可能涉及其他更为复杂的代谢途径,且在后续实验中,无需考虑光照对细菌E3P13产胞外超氧自由基的影响。
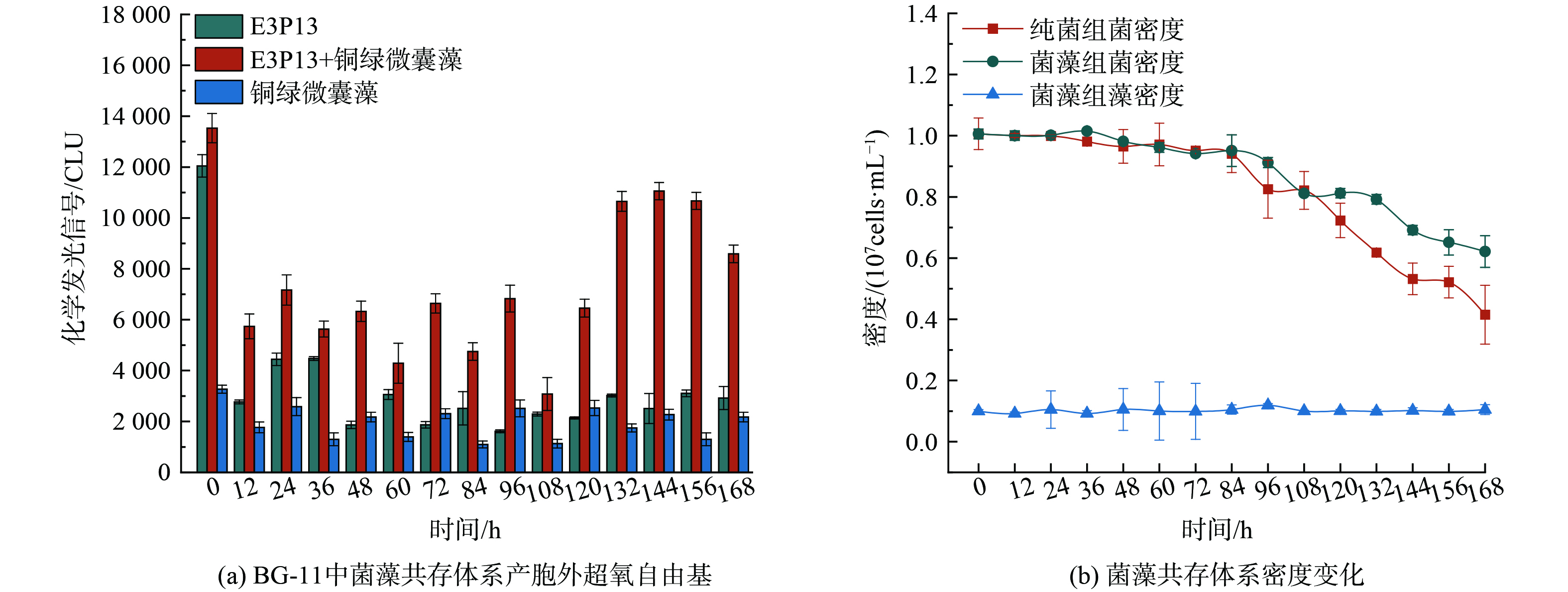
为研究菌藻共存体系中胞外超氧自由基产生情况,选择培养至稳定期的铜绿微囊藻和假单胞菌,离心重悬至经0.22 μm滤膜过滤的太湖水中,模拟藻华期太湖的菌藻密度环境,藻密度为1×106 cells·mL−1,菌密度为1×108 cells·mL−1,这样的密度设置既保证了微生物的活性,适合观察到菌藻共存的显著特性,又符合自然环境藻华期的实际情况[19]。在连续的培养过程中,每隔12 h测定一次胞外超氧自由基的产生量。如图3所示,在菌藻共存体系中,胞外超氧自由基的产生量明显高于单一体系,这可能是由于它们之间的代谢活动和物质交换可能会引发更为复杂的生化反应,从而产生更多的胞外超氧自由基(图3)。特别是在94~132 h之间,胞外超氧自由基产生量出现了明显的上升趋势。推测有以下几点原因,首先,可能是该阶段微生物的生长和代谢活动达到了一个高峰,导致胞外超氧自由基的产生量也相应增加[20]。其次,也有可能是体系内碳源减少,细菌进入衰亡期,从而出现氧化应激效应,导致胞外超氧自由基生成量上升[21]。此外,胞外超氧自由基产生量还表现出昼夜交替节律变化的特征,即在白天产生量上升,而在夜晚则下降,这一现象与光照条件下藻类的光合作用增强有关。在光照条件下,藻类的光合作用活跃,可能促进了胞外超氧自由基的产生。而在夜晚,由于光照的消失,藻类的光合作用减弱,胞外超氧自由基的产生量也随之下降[22]。这一现象进一步证明了光照条件对菌藻共存体系中胞外超氧自由基产生的重要影响。
由于实验用水为太湖水,天然水体中存在的本底物质,可能与生物产胞外超氧自由基之间存在一定关系。天然水体中丰富的钙、镁、钠、钾等矿物质不仅参与生物体的多种生理过程,还可能通过影响细胞内的离子平衡和酶活性,间接影响超氧自由基的产生[23]。此外,天然水体中的微量元素,如铁、锌、铜等在生物体内通常作为酶的组成部分或辅因子,参与电子传递链等关键代谢过程[24]。需要注意的是天然水体中的腐殖质包含了大量的芳香族化合物、酚类、醌类以及含氮、硫的杂环化合物等。这些化合物中很多都具有还原性,能够参与水体中的氧化还原反应。当腐殖质与水体中的微生物或其他生物体相互作用时,可能通过一系列的生物化学过程产生超氧自由基[25]。这些过程可能包括腐殖质的氧化降解、微生物的代谢活动以及酶促反应等[26]。在这个过程中,腐殖质作为电子供体,可能通过氧化反应释放电子,这些电子进一步与氧气或其他氧化剂反应,生成超氧自由基。此外,腐殖质还可能影响水体中的氧化还原电位和溶解氧水平,这些因素的变化也可能间接影响生物产胞外超氧自由基的能力。
-
为验证菌藻共存体系中胞外超氧自由基产生量高于单一菌藻体系的原因,排除天然水体本底值影响,进一步在BG-11培养基中进行实验。如图4所示,菌藻体系中胞外超氧自由基产生量在133 h时也出现明显上升,且与在太湖水中表现出相同变化趋势。通过持续对藻密度和菌密度的测定发现,随着时间的延长,菌密度和藻密度并未出现明显上升,这一发现进一步验证了我们之前的假设,即菌藻共存体系中的胞外超氧自由基产生量确实高于单一菌藻体系,且这种现象并非由天然水体中本底物质引起。为了探究这一现象背后的原因,持续对藻密度和菌密度进行了测定。实验结果表明,随着培养时间的延长,藻密度始终维持在相对稳定的水平,而菌密度在胞外超氧自由基产生量上升期间,反而发生了一定程度的下降。这一发现排除了菌藻密度上升作为胞外超氧自由基产生量增加的原因。值得注意的是,纯菌组的菌密度下降更显著,这是由于菌藻组由于菌藻之间的物质交换,藻类为细菌提供碳源,减缓菌藻共存体系中细菌衰亡。而纯菌组没有藻类从外部提供碳源,因而较菌藻组,菌密度更早出现下降且下降率也远高于菌藻组。这说明菌藻体系中胞外超氧自由基产生量上升的驱动因素并非天然水体中本底物质,也不是由于藻密度和菌密度的上升,而是由菌藻之间特殊物质交换或信息交流引起。
为进一步验证胞外超氧自由基产生量上升原因,通过扫描电镜对菌藻胞外超氧自由基生成量上升前后形态进行表征。如图5所示,通过扫描电镜观察在胞外超氧自由基产生量发生明显上升后菌藻形态变化。发现在菌藻体系胞外超氧自由基产生量发生明显上升后,细菌表面形态出现皱缩。这一皱缩现象可以从多个角度进行解释。首先,超氧自由基作为一种活性氧物种,具有强烈的氧化性。随着培养时间的延长,超氧自由基逐渐增多,进而对细胞膜造成氧化损伤[27]。细胞膜是细胞的生命线,负责维持细胞的完整性和稳定性,一旦受到损伤,就会导致细胞表面出现皱缩现象,进一步进入程序性死亡过程[28]。此外,过量的超氧自由基还会干扰细胞内的电子传递链。电子传递链是细胞呼吸作用的关键环节,它负责将电子从低能级传递到高能级,从而产生能量。当超氧自由基过量时,超氧自由基会氧化损伤电子传递链中的成分,干扰电子的正常传递,进而影响细胞的呼吸作用和能量产生。由于能量不足,细胞的结构和功能都会受到影响,甚至可能导致细菌的衰亡。
综上所示,菌藻共存体系胞外超氧自由基生成量上升导致了细菌细胞膜损伤,且这种损伤是不可逆的,而藻类未出现明显受损。基于此,猜测体系内过量胞外超氧自由基主要由细菌产生,且由于超氧自由基能在几毫秒内淬灭且无法跨膜传输的特性,推测该过程发生在细菌胞外。此外,在铜绿微囊藻代谢过程中会产生一系列代谢产物,包括一些小分子化合物和活性物质。值得注意的是,铜绿微囊藻在生长过程中会分泌藻毒素,这是一种次级代谢产物,藻毒素通常对水生生物具有毒性[29],这也从另一个方面解释了在随着培养时间延长,尽管藻类可以为细菌提供碳源,但菌藻共存体系中细菌结构仍旧出现受损且密度下降的原因。
-
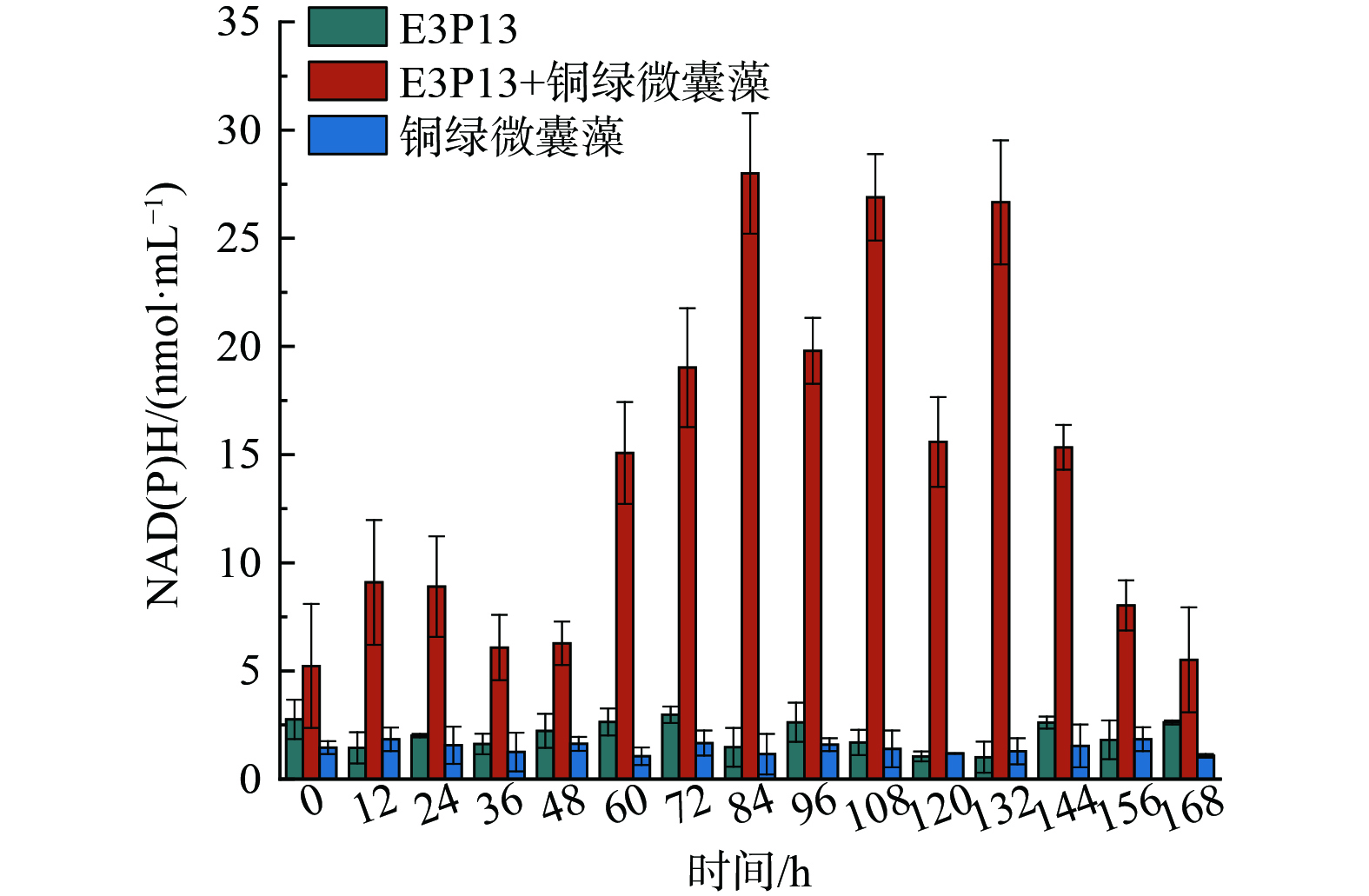
已有研究表明,细菌胞外超氧自由基的产生与呼吸链上NAD(P)H脱氢相关[30],为进一步考察菌藻共存体系中胞外超氧自由基上升机制,对菌藻共存体系中NAD(P)H的变化情况进行了分析。如图6所示,随着体系中胞外超氧自由基产生量的上升,NAD(P)H的浓度也发生了显著上升。NAD(P)H与细菌胞外电子传递之间的关系是微生物代谢与环境相互作用的关键环节。NAD(P)H是细胞内主要的还原力载体之一,它在细菌的代谢过程中扮演着核心角色,特别是在能量的产生和电子传递链中[31]。此外,细菌中的NAD(P)H产生主要来源于糖酵解过程、柠檬酸循环或其他代谢途径。这些过程中产生的NAD(P)H可通过多种机制参与细菌胞外电子传递,主要分为直接和间接两种方式,直接电子传递是细菌通过与电子受体 (如电极或某些金属氧化物) 的直接接触,将NAD(P)H中的电子直接转移[32]。这通常涉及到细菌细胞表面的特定蛋白质,如细胞色素 (如c型细胞色素) 或导电纳米线 (比如由地衣芽孢杆菌等产生的纳米线) ,这些蛋白质可以将电子从细胞内部传递到外部环境[33]。间接电子传递是细菌利用溶解性的电子穿梭体 (如黄素、醌类等小分子) 来传递电子。这些小分子可以从细胞内部接受电子 (通常是从NAD(P)H获取) 并将电子传递给细胞外部的电子受体,实现电子的间接转移[34]。在细菌胞外电子传递过程中,NAD(P)H的作用不仅限于作为还原剂来源,还涉及到维持细胞内外电子平衡,以及参与调控细菌对环境变化的响应。
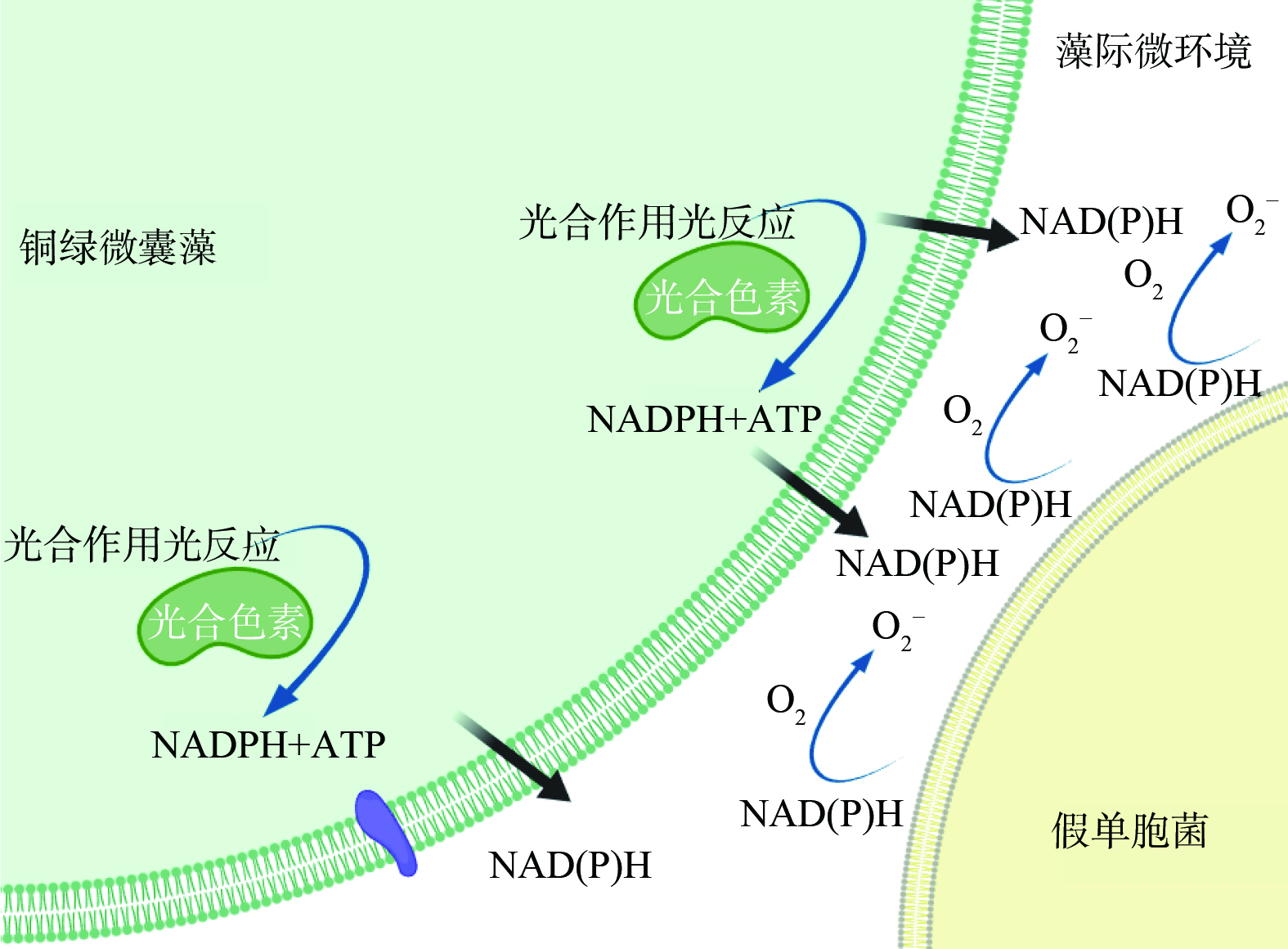
如图7所示,NAD(P)H作为电子供体,在细菌细胞膜的呼吸链中起着至关重要的作用。它通过向呼吸链复合物I (NADH脱氢酶) 供应电子,启动电子传递过程。当藻类提供额外的NAD(P)H时,会增加细菌细胞膜上复合物I的电子饱和度,从而增加电子传递速率[33]。在正常情况下,电子会沿着呼吸链复合物I、III和IV的顺序传递,最终将电子传递给氧气,生成水,完成一个完整的呼吸循环。然而,当复合物I和III的电子传递能力受到抑制时,电子无法有效地继续向下游传递。这时,电子会从呼吸链中泄漏出来,与氧气发生反应,形成胞外超氧自由基。这一反应过程主要发生在细菌细胞膜的外侧。由于电子传递受阻,泄漏的电子与氧分子结合,进而形成超氧自由基。这些超氧自由基在细胞膜外侧积累,最终导致了我们观察到的胞外超氧自由基产生量的增加。这一发现为我们理解菌藻共存体系中超氧自由基的生成机制提供了新的视角,也为后续研究提供了重要的理论依据。
-
本研究通过对天然水体中微囊藻和假单胞菌共存体系中胞外超氧自由基产生量上升现象进行分析,发现菌藻共存体系中胞外超氧自由基的上升随光照节律变化而变化,这是可能是由于随着光照强度变化,微囊藻通过光合作用产生氧气,使得体系内氧气含量上升,进一步导致胞外超氧自由基生成量上升。进一步研究发现胞外超氧自由基产生量上升并非由于天然水体中存在的金属离子或腐殖质引起,也不是由于菌藻密度上升引起,而是由菌藻之间的物质交换引起。藻类通过光合作用产生的NAD(P)H可以影响细菌的电子传递链,导致电子传递的中断和超氧自由基的产生。NAD(P)H的增加还会影响细菌的抗氧化系统,降低细菌对超氧自由基的清除能力,从而导致超氧自由基在细菌体外的积累。菌藻共存体系中胞外超氧自由基的大量生成造成细菌外部氧化压力急剧上升,使得细菌出现表面皱缩,进入衰亡阶段。这一发现揭示了一种新的菌藻互作机制,对理解环境微生态平衡和污染物降解具有重要意义。
微囊藻强化假单胞菌产胞外超氧自由基及其机制
Microcystis enhanced production of extracellular superoxide radicals by Pseudomonas and its mechanism
-
摘要: 生物源超氧自由基是天然水体中活性氧的重要来源,以天然水体中广泛存在的微囊藻和假单胞菌为研究对象,考察种间电子传递对天然水体中生物源超氧自由基生成的影响及机制。研究发现在天然水体中藻的存在可显著提升假单胞菌产生胞外超氧自由基的生成量,且这种上升趋势伴随着光照节律而变化,但该现象并非由菌藻密度及水体本底物质变化引起,而是由于细菌与藻类之间物质交换造成的。此外,随着培养时间的延长,胞外超氧自由基的产生量上升导致细菌密度降低,这是由于超氧自由基的大量生成造成细菌外部氧化压力急剧上升,使得细菌出现表面皱缩,进入衰亡阶段。为进一步探究微囊藻强化假单胞菌产生胞外超氧自由基的机制,对与超氧自由基生成直接相关的还原性辅酶I (NADH)和还原性辅酶II (NADPH)进行分析,发现在菌藻共存体系中NAD(P)H含量在胞外超氧自由基上升阶段显著上升,说明藻类通过光合作用产生的NAD(P)H可外泌到胞外进而影响细菌的电子传递,导致超氧自由基的产生。此外,NAD(P)H的增加还会影响细菌的抗氧化系统,降低细菌对超氧自由基的清除能力,从而导致超氧自由基在细菌体外的积累。这一发现揭示了一种新的菌藻互作机制,对理解环境微生态平衡和污染物降解具有重要意义。Abstract: The production of biogenic superoxide radical, a critical group of reactive oxygen species in natural waters, was explored in this study by examining interspecies electron transfer involving M.aeruginosa and Pseudomonas, both prevalent in aquatic environments. The results showed that algal presence significantly augmented the generation of extracellular superoxide radical by Pseudomonas, a process notably influenced by diurnal light cycles. Crucially, this enhancement was not attributable to variations in microbial densities or background constituents of the water bodies; rather, it stemmed from substance exchanges between the bacteria and algae. Furthermore, as the incubation period extended, an increase in extracellular superoxide radical production was correlated with a reduction in bacterial density. This trend was likely due to elevated external oxidative stress from the abundant superoxide radicals, leading to morphological changes such as surface crumpling and subsequent cellular decay in the bacteria. To elucidate the mechanisms behind the enhanced generation of superoxide radicals by M. aeruginosa-stimulated Pseudomonas, the roles of reducing coenzymes I (NADH) and II (NADPH) were analyzed, which were intimately linked to the generation of these radicals. This finding revealed a significant uptick in NAD(P)H levels within the bacterial-algal coexistence system concurrent with the increase in superoxide radical production. This suggested that NAD(P)H generated by the algae via photosynthesis can be exocytosed into the extracellular environment, thereby influencing bacterial electron transfer and facilitating superoxide radical production. Additionally, the elevation in NAD(P)H levels also appeared to impair the bacterial antioxidant system, diminishing the bacterial capacity to scavenge superoxide radicals, thus fostering their accumulation. These insights unveiled a novel aspect of bacterial-algal interactions and were pivotal for comprehending the microecological dynamics in natural waters, with implications for environmental pollutant degradation and ecological balance.
-

-
-
[1] HAYYAN M, HASHIM M A, ALNASHEF I M. Superoxide ion: generation and chemical implications[J]. Chemical Review, 2016, 116(5): 3029-3085. doi: 10.1021/acs.chemrev.5b00407 [2] GUEMOURI L, ARTUR Y, HERBETH B, et al. Biological variability of superoxide dismutase, glutathione peroxidase, and catalase in blood[J]. Clinical Chemistry, 1991, 37(11): 1932-1937. doi: 10.1093/clinchem/37.11.1932 [3] CHEN X, WANG J, WU H, et al. Trade-off effect of dissolved organic matter on degradation and transformation of micropollutants: A review in water decontamination[J]. Journal of Hazardous Materials, 2023, 450: 130996. doi: 10.1016/j.jhazmat.2023.130996 [4] SHENG G P, YU H Q, LI X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: a review[J]. Biotechnology Advances, 2010, 28(6): 882-894. doi: 10.1016/j.biotechadv.2010.08.001 [5] RZYMSKI P, KLIMASZYK P, JURCZAK T, et al. Oxidative stress, programmed cell death and Microcystin release in Microcystis aeruginosain response to daphnia grazers[J]. Frontiers in Microbiology, 2020, 11: 01201. doi: 10.3389/fmicb.2020.01201 [6] DIAZ J M, PLUMMER S. Production of extracellular reactive oxygen species by phytoplankton: past and future directions[J]. Journal of Plankton Research, 2018, 40(6): 655-666. [7] 秦兵维, 聂麦茜, 郭永华, 等. 预水解发酵碳源对铜绿假单胞菌NY3产鼠李糖脂特性及应用效能的影响研究[J]. 微生物学杂志, 2019, 39(2): 25-30. doi: 10.3969/j.issn.1005-7021.2019.02.004 [8] 李泽, 梁金松, 王爱杰. 新型锰氧化菌株Pseudoxanthomonas mexicana S5-3_5X的分离及锰氧化机理研究[J]. 环境科学学报, 2022, 42(8): 127-136. [9] HANSEL C M, DIAZ J M. Production of extracellular reactive oxygen species by marine biota[J]. Annual Review of Marine Science, 2021, 13: 177-200. doi: 10.1146/annurev-marine-041320-102550 [10] 李芸, 刘发龙, 王巧晗, 等. 藻际微环境中藻体与微生物相互作用[J]. 河北渔业, 2019(3): 43-48. doi: 10.3969/j.issn.1004-6755.2019.03.012 [11] RAMANAN R, KIM B-H, CHO D-H, et al. Algae–bacteria interactions: evolution, ecology and emerging applications[J]. Biotechnology Advances, 2016, 34(1): 14-29. doi: 10.1016/j.biotechadv.2015.12.003 [12] GUO Z, TONG Y W. The interactions between Chlorella vulgaris and algal symbiotic bacteria under photoautotrophic and photoheterotrophic conditions[J]. Journal of Applied Phycology, 2014, 26(3): 1483-1492. doi: 10.1007/s10811-013-0186-1 [13] 徐佳杰, 谢周云, 俞楠, 杨国靖. 基于文献计量的菌藻共生技术研究现状及发展趋势[J]. 环境科学学报, 2023, 43(7): 401-412. [14] CHEN S, CHEN J, ZHANG L, et al. Biophotoelectrochemical process co-driven by dead microalgae and live bacteria[J]. The ISME Journal, 2023, 17(5): 712-719. doi: 10.1038/s41396-023-01383-3 [15] 刘雪萍, 张绍勇, 陈瑶瑶, 等. 南太湖沉积物中可培养放线菌的分离、鉴定及其抑菌活性[J]. 中国饲料, 2024(7): 11-19. [16] LI C C, WU W L. Analysis of the driving mechanism of water environment evolution and algal bloom warning signals in Tai Lake[J]. Water, 2023, 15(6). LI C C, WU W L. Analysis of the driving mechanism of water environment evolution and algal bloom warning signals in Tai Lake[J]. Water, 2023, 15(6).
[17] VAN LE V, SRIVASTAVA A, KO S-R, et al. Microcystis colony formation: Extracellular polymeric substance, associated microorganisms, and its application[J]. Bioresource Technology, 2022, 360: 127610. doi: 10.1016/j.biortech.2022.127610 [18] 刘明. 基于光合细菌红假单胞菌的废水处理与协同固碳作用研究[J]. 生物质化学工程, 2024, 58(2): 47-54. doi: 10.3969/j.issn.1673-5854.2024.02.006 [19] 李颖, 张榆霞, 等. 关于用藻密度对蓝藻水华程度进行分级评价的方法和运用[J]. 环境与可持续发展, 2014, 39(2): 67-68. doi: 10.3969/j.issn.1673-288X.2014.02.020 [20] HE Z F, LI Q Q, XU Y, et al. Production of extracellular superoxide radical in microorganisms and its environmental implications: A review[J]. Environmental Pollution, 2023, 338: 122563. doi: 10.1016/j.envpol.2023.122563 [21] 宋晓辰, 李凤梅, 等. 植物乳杆菌NDC75017抗氧化活性研究[J]. 食品科学, 2014, 35(21): 106-112. doi: 10.7506/spkx1002-6630-201421021 [22] FRENKEL A, GAFFRON H, BATTLEY E H. Photosynthesis and photoreduction buy a species of blue-green algae[J]. Biological Bulletin, 1949, 97(2): 269. [23] 辛波, 夏秋瑜, 等. 金属离子对椰花汁清除超氧阴离子能力的影响[J]. 热带作物学报, 2009, 30(8): 1069-1074. doi: 10.3969/j.issn.1000-2561.2009.08.004 [24] GAO Q, LIU Z H, WU J L, et al. Foliar application is an effective method for incorporating selenium into peanut leaf proteins with antioxidant activities[J]. Food Research International, 2019, 126: 108617. doi: 10.1016/j.foodres.2019.108617 [25] OZFIDAN-KONAKCI C, YILDIZTUGAY E, BAHTIYAR M, et al. The humic acid-induced changes in the water status, chlorophyll fluorescence and antioxidant defense systems of wheat leaves with cadmium stress[J]. Ecotoxicology and Environmental Safety, 2018, 155: 66-75. doi: 10.1016/j.ecoenv.2018.02.071 [26] 宋鸽. 腐殖质参与植物非生物胁迫应答作用机制的研究进展[J]. 中国农学通报, 2023, 39(15): 59-68. doi: 10.11924/j.issn.1000-6850.casb2022-0324 [27] MEHTA D, SHARMA P, SINGH S. ATP-triggered, selective superoxide radical generating oxidase-mimetic cerium oxide nanozyme exhibiting efficient antibacterial activity at physiological pH[J]. Colloids and Surfaces B: Biointerfaces, 2023, 231: 113531. doi: 10.1016/j.colsurfb.2023.113531 [28] PEETERS S H, DE JONGE M I. For the greater good: Programmed cell death in bacterial communities[J]. Microbiological Research, 2018, 207: 161-169. doi: 10.1016/j.micres.2017.11.016 [29] WANG J, LI R, LIU B, et al. Occurrence and distribution of lipophilic marine algal toxins in the coastal seawater of Southeast China and the South China Sea[J]. Marine Pollution Bulletin, 2023, 187: 114584. doi: 10.1016/j.marpolbul.2023.114584 [30] FUJITA T, YAMAMOTO Y, YAMAGATA Y, et al. Elimination of inhibitor for NADH activities[J]. Journal of the American Heart Association, 2014, 3(1). FUJITA T, YAMAMOTO Y, YAMAGATA Y, et al. Elimination of inhibitor for NADH activities[J]. Journal of the American Heart Association, 2014, 3(1).
[31] BORDBAR Z, KAVOOSI G, BALOTF S, et al. Differential expression of NADH oxidase, superoxide dismutase, and catalase in wheat seedling in response to Zataria multiflora essential oil incorporated into polyvinyl alcohol dispersion[J]. Journal of Agricultural Sience and Technology, 2017, 19(1): 145-155. [32] OLEK R A, ANTOSIEWICZ J, CAULINI G C, et al. Effect of NADH on the redox state of human hemoglobin[J]. Clinica Chimica Acta, 2002, 324(1-2): 129-134. doi: 10.1016/S0009-8981(02)00242-5 [33] ANDERSON A, LAOHAVISIT A, BLABY I K, et al. Exploiting algal NADPH oxidase for biophotovoltaic energy[J]. Plant Biotechnology Journal, 2015, 14(1): 22-28. [34] CHEN Y, SHI J, WU Y, et al. NADH photosynthesis system with affordable electron supply and inhibited NADH oxidation[J]. Angewandte Chemie-internatioanl Edition, 2023, 62(42). CHEN Y, SHI J, WU Y, et al. NADH photosynthesis system with affordable electron supply and inhibited NADH oxidation[J]. Angewandte Chemie-internatioanl Edition, 2023, 62(42).
-



 下载:
下载: