-
全球性水体富营养化导致饮用水源的藻华污染问题普遍存在,对饮用水供水安全造成严重威胁。藻细胞在生长代谢和死亡后向水中释放大量的藻源有机质(algal organic matter, AOM),其主要组分为蛋白质、多肽、氨基酸、糖类、脂类和脂多糖等生物质,在饮用水处理的预氯化和氯化消毒阶段极易与氯反应生成高毒性消毒副产物(disinfection by-products, DBPs),包括三氯甲烷(trichloromethane, TCM)、卤乙酸(haloacetic acid, HAA)等常规含碳DBPs[1]。并且,AOM中高分子质量(>100 kDa)的蛋白类有机氮组分在氯化过程中极易生成高毒性含氮DBPs,包括二氯乙腈(dichloroacetonitrile, DCAN)、三氯乙腈(trichloroacetonitrile, TCAN)和三氯硝基甲烷(trichloronitromethane, TCNM)等[2]。由于消毒副产物对人体具有致癌、致畸和致突变的严重危害,高藻水源中AOM导致的高毒性DBPs生成问题值得重点关注。
为应对藻类污染物导致的供水安全隐患,一些水厂逐步采用紫外高级氧化(ultraviolet based-advanced oxidation, UV-AOP)作为深度处理工艺。其中,紫外/氯(ultraviolet/chlorine, UV/Cl2)高级氧化因其对污染物降解效率高、氧化剂利用率高、兼具强化消毒等优点而备受关注[3-5]。UV/Cl2的基本原理是紫外光解次氯酸(HOCl)或次氯酸根离子(OCl−)产生羟基自由基(hydroxyl radical, HO•)和含氯自由基(reactive chlorine species, RCS),其中RCS包括Cl•,Cl2•−和ClO•,如式(1)~(6)所示,其主要反应机制为亲电加成、抽氢、氯取代和电子转移[3]。已有研究证明了UV/Cl2体系对含藻饮用水源的处理优势。例如,UV/Cl2体系对藻源污染物(藻毒素和嗅味物质等)具有优异的降解效果[3]。ZHANG等[4]采用UV/Cl2体系处理含硅藻原水,通过体系中产生的活性自由基弱化硅藻细胞表面电负性并降低藻细胞位阻效应,显著提高了含藻絮体的体积和致密程度进而强化了含藻絮体的沉降去除效能。CHEN等[5]研究表明UV/Cl2体系能有效灭活铜绿微囊藻。但由于自由基的参与,UV/Cl2体系中DBPs生成规律与单独氯化存在明显差异。自由基既可以矿化部分DBPs前体物从而降低DBPs产率;自由基也会诱导AOM的分子结构和化学特性发生改变使得DBPs生产量有所增加。有研究[6]表明, UV/Cl2处理AOM后DBPs的生成量高于单独氯化,但后氯化23 h后的DBPs生产量有所降低。不同的AOM组分和结构性质、不同的反应条件(UV辐射强度、氯投加量和pH等)均会导致DBPs的生成种类和生成量差异。ZHAI等[7]研究表明4种不同类型藻类的AOM在氯化反应后的DBPs生成量和生成规律存在显著差异。同时,除了已经纳入水质标准的DBPs外,仍有大量未知DBPs产生并对人体健康造成严重威胁。如含氮DBPs毒性高于含碳DBPs,芳香族DBPs毒性比脂肪族DBPs更大[8]。
然而,目前UV/Cl2处理中AOM转化生成DBPs的研究较少且缺乏系统性。为了深入研究AOM中极为重要的蛋白组分在UV/Cl2体系中的DBPs生成势和转化机制,我们选取了藻蓝蛋白为代表物质开展研究。藻蓝蛋白在多数藻类中普遍存在,且与藻类生长和繁殖相关,具有一定的代表性[9-10]。研究显示藻蓝蛋白与氯消毒剂反应后会生成TCM、DCAN、TCAN、TCNM等多种DBPs[11-12],但UV/Cl2作用下藻蓝蛋白生成DBPs的研究尚未见报道。在分子层面上,利用傅里叶变换离子回旋共振质谱(FT-ICR MS)探索自由基诱导下藻蓝蛋白的演变规律和转化机制,通过非靶向筛选和鉴定关键DBPs前体物的分子结构。研究结果将有助于我们深刻认识在UV/Cl2高级氧化体系中自由基介导下AOM典型组分的演变规律,厘清AOM分子特征与未知DBPs生成的内在关联,为高藻水源的DBPs控制提供依据。
-
采用水华优势藻铜绿微囊藻(M. aeruginosa, FACHB-905)以冻融法提取AOM。具体流程为取稳定期藻液在4 ℃以转速8 000 r·min−1离心10 min,分离得到的藻细胞沉淀物洗涤后用超纯水稀释至重新悬浮,经冻融3次后离心取上清液用0.45 μm醋酸纤维膜过滤,得到的AOM提取液在4 ℃下避光保存待用[13]。藻蓝蛋白为分析纯,采购于麦克林药剂公司;次氯酸钠为纯度5%,购于西格玛药剂公司。磷酸氢钠、磷酸氢二钠、亚硫酸钠、苯甲酸(BA)和硝基苯(NB)等其他药剂均为分析纯,购于阿拉丁药剂公司。实验用水为超纯水。
-
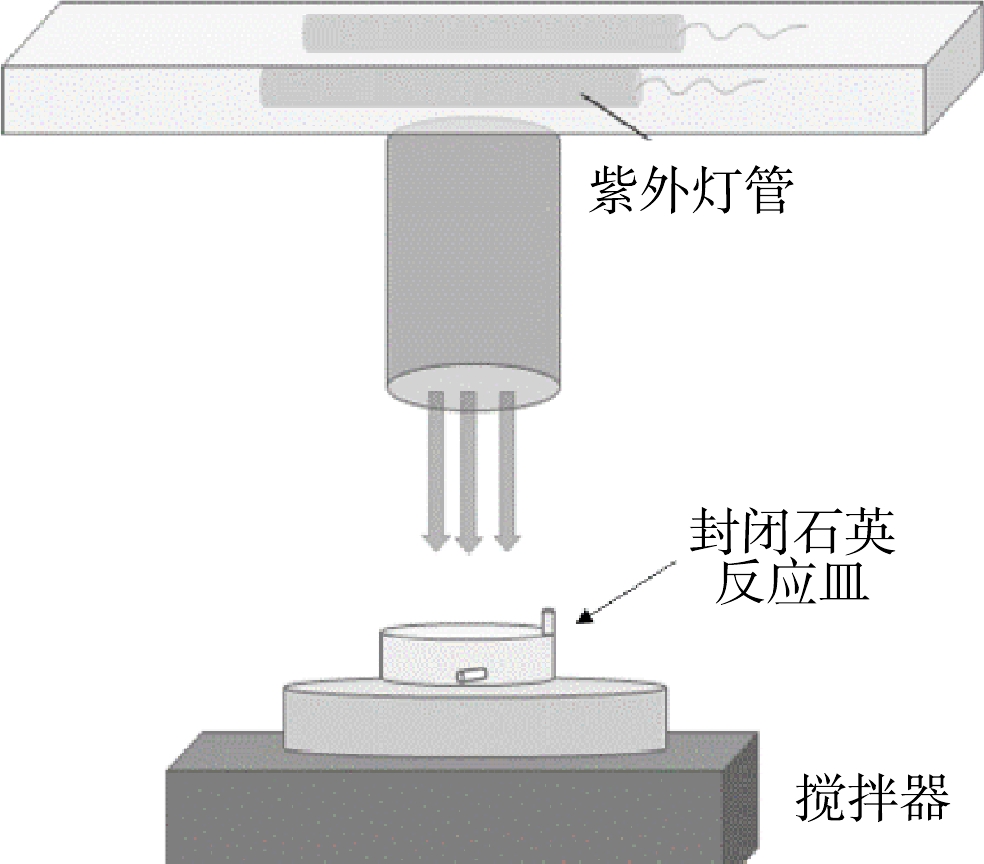
如图1所示,UV/Cl2实验装置的光源由3根10 W的低压汞灯(最大发射波长254 nm,飞利浦)组成,并配有温度控制装置。反应在直径为7.5 cm的圆柱形石英皿中进行,光源发射准直光束,石英皿置于光源正下方,通过磁力搅拌器混合溶液。采用碘化物-碘酸盐光度法测得紫外灯在溶液中的光强为0.156 mW·cm-2。
AOM和藻蓝蛋白溶液的初始质量浓度为4 mg·L−1,并加入5 mmol·L−1磷酸盐缓冲液稳定pH,总体积为 60 mL。以溶液中投加次氯酸钠并将石英皿置于UV辐照为反应起始点。除特殊说明外,次氯酸钠投加的质量浓度为3 mg·L−1(以Cl2浓度计),pH为7.0,紫外反应时间30 min。UV/Cl2处理后采集10 mL样品采用亚硫酸钠淬灭余氯用于FT-ICR MS检测;另取50 mL样品进行后氯化处理(投加氯的质量浓度为10 mg·L−1并避光放置24 h),反应后采用亚硫酸钠淬灭余氯并测定DBPs生成势。对照组为不经过UV/Cl2处理直接进行后氯化处理。在影响因素研究中变化单个实验条件变化且其他条件均固定为上述反应条件。
-
DBPs (THM、DCAN、TCAN、TCNM)的测定采用气相色谱质谱联用仪(GC-MS, 7890A, Agilent)并配备Agilent DB-5(30 m×0.25 mm×0.25 μm)分离柱,载气为氮气,检测限为0.2 μg·L−1。自由氯浓度使用DPD分光光度法,采用哈希便携式分光光度计(DR2800)测定。pH采用pH计(S400,Mettler Toledo)测定。在自由基检测中,自由基探针BA和NB采用高效液相色谱(HPLC,Dionex Ultimate
3000 )配置C18反相柱(4.6×250 mm, 5 μm)测定,紫外检测器(Thermo U3000),NB检测波长265 nm,BA检测波长227nm。 -
FT-ICR MS(Bruker, Germany)配备9.4 T超导磁体的Apollo II电喷雾离子源,进样速度为每小时250 μL,负离子模式,离子化电压为3.5 kV,毛细管入口前端电压4.0 kV,毛细管出口端的电压-320 V。通过四极杆的所有离子在填充了氩气的六极杆碰撞池中累积并停留1 s。随后,设定离子通过静电透镜系统聚焦并从碰撞池传输至离子回旋(ICR)分析池中的时间为1.0 ms。质荷比(m/z)设置在200~800。数据采集大小为4 MB,每个样本数据会重复测量128次,以确保结果的准确性和稳定性。FT-ICR MS数据首先采用Molecular Formula Calc version 1.0 ©NHMFL软件解析,以获得对应分子的分子式。分子式基于CHO和CHON元素组合,并符合信噪比大于6的要求。当一个m/z出现多种匹配值时,将根据元素规则、官能团关系等条件进一步匹配正确的分子式。
-
铜绿微囊藻AOM在UV/Cl2体系中的DBPs生成情况如图2所示。结果表明,UV/Cl2处理AOM后的TCM、DCAN和TCNM生成量有所增加,TCAN生成量保持稳定。并且,在UV/Cl2体系中的TCM、DCAN和TCNM生成量随着投氯量的增加而逐渐增大。相比于AOM未经紫外/氯处理(简称为对照组)且直接测定其DBPs生成势,在UV/Cl2体系中氯投加量为3 mg·L−1和6 mg·L−1时,TCM生成量分别增加了25.9%和59.3%,DCAN生成量分别增加了96.1%和160.7%,TCNM生成量则分别增加了123.8%和143.6%。在氯投加量为6 mg·L−1时,UV/Cl2体系中TCM、DCAN、TCAN和TCNM的生成量分别为84.0、13.2、1.1和2.6 μg·L−1。此研究结果与前期以天然有机物(NOM)为DBPs前体物的研究结果相一致。WANG等研究表明,相比于单独氯化处理,经UV/Cl2体系处理的天然有机质的TCNM生成量增加了3倍,而TCM和DCAN的生成量增加了10%~50%[14]。与氯化相比,UV/Cl2体系中生成了HO·和RCS,这些自由基与AOM反应活性更高中蛋白质、多肽、氨基酸、糖类、脂类和脂多糖等组分具有较高的反应活性[15],促进了更多的DBPs生成。
-
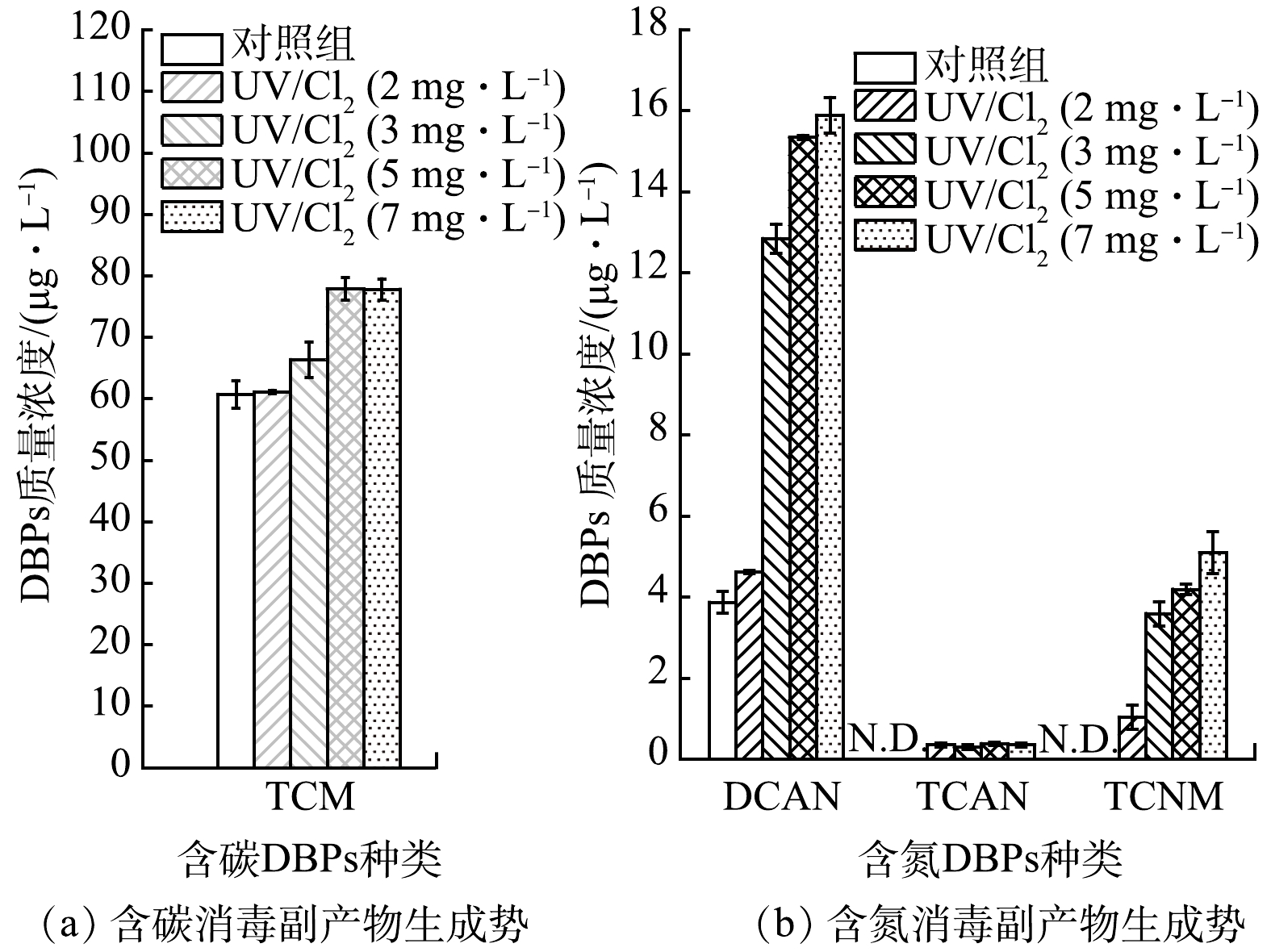
1)氯投加量的影响。AOM成分中包括蛋白质、氨基酸和多肽等物质,其中蛋白类物质被认为是溶解性有机氮的重要贡献者,也是重要的高毒性含氮DBPs的前驱体。因此,本文系统性探究代表性藻类蛋白(即藻蓝蛋白)在UV/Cl2体系中的DBPs生成规律。由图3可知,投氯量增加促进了UV/Cl2体系中藻蓝蛋白向DBPs前体物的转化,与AOM转化生成DBPs的规律基本一致。对照组为藻蓝蛋白直接进行后氯化处理,TCM和DCAN的生成量分别为60.7 μg·L−1和3.9 μg·L−1,TCAN和TCNM浓度低于检出限(0.2 μg·L−1)。随着氯投加量质量浓度从2 mg·L−1提高到7 mg·L−1,THM生成量从61.1 μg·L−1提高到77.8 μg·L−1;DCAN生成量从4.6 μg·L−1提高到15.9 μg·L−1。与对照组相比,氯投加量质量浓度7 mg·L−1时的UV/Cl2体系中藻蓝蛋白转化生成TCM和DCAN的生成势分别增加了28.1%和310.8%。藻蓝蛋白直接后氯化 (对照组) 不生成TCNM。而UV/Cl2体系中,随氯投加量质量浓度从2 mg·L−1到7mg·L−1,TCNM的生成量逐步从1.0 μg·L−1增高至5.1 μg·L−1。HO·和RCS将藻蓝蛋白中的胺基基团转化为硝基基团,在经过氯取代、水解断键等过程转化生成TCNM[16]。UV/Cl2处理对藻蓝蛋白转化生成的含氮DBPs的影响不容忽视。
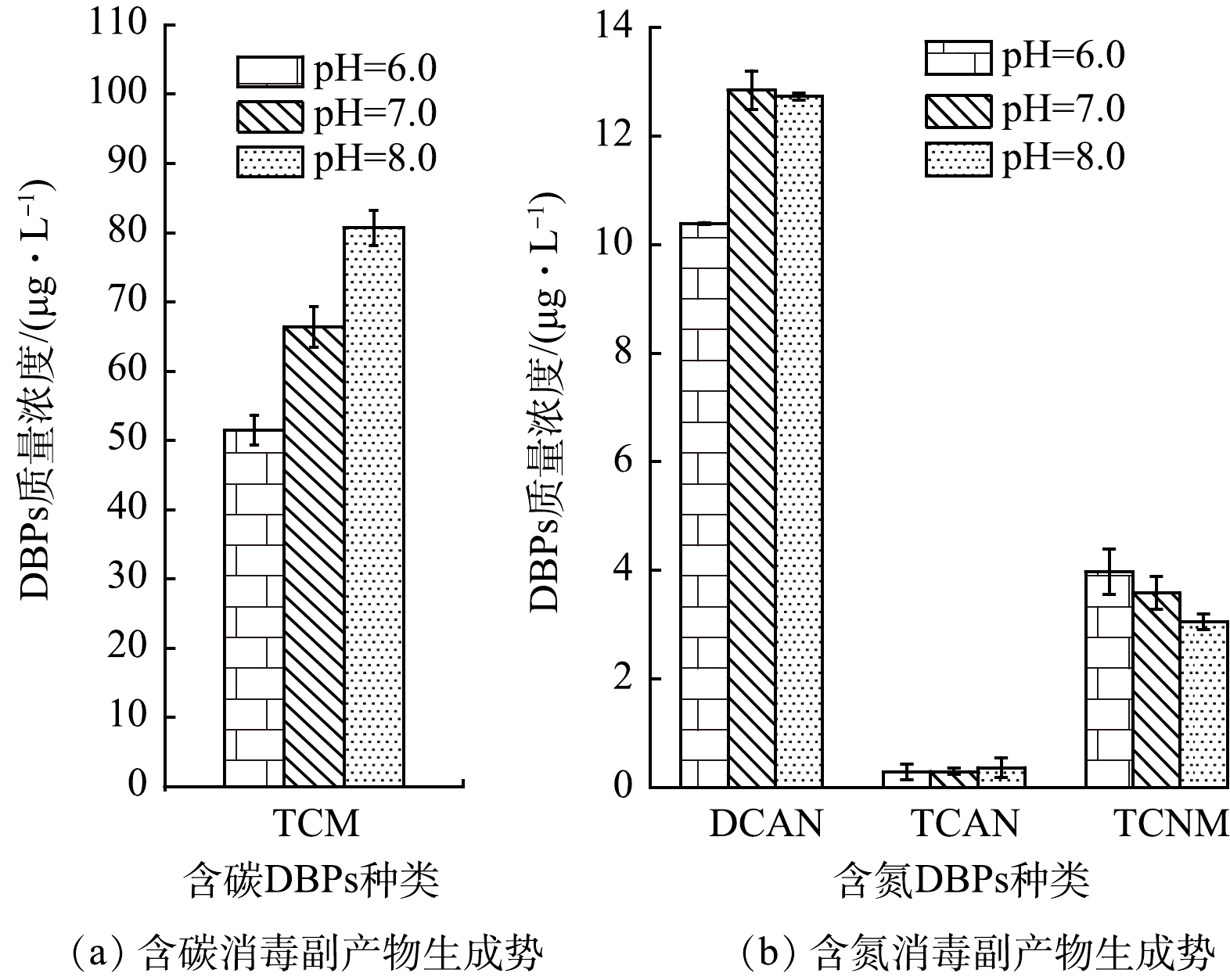
2) pH的影响。由图4所示,不同pH对不同种类DBPs生成势的影响有所不同。随着pH的升高,TCM生成势呈现出明显的增加趋势。TCM生成势与pH之间存在显著正相关性(P<0.05)。在pH=6.0条件下的TCM生成势为51.5 μg·L−1,而在pH=8.0条件下,TCM生成势增至80.7 μg·L−1,增长率为56.7%。碱性环境促进TCM生成的现象在前期研究中也有报道[17-19]。R-CO-CCl3结构物质是TCM的前体物,碱性环境下R-CO-CCl3的碱催化水解导致了更多的TCM生成[19]。碱性条件下卤代乙酸、卤代酮和卤代醛等物质也能水解生成TCM [17, 19]。同时,pH也影响HOCl和OCl−的分布比例,从而改变体系中自由基浓度水平。酸性环境下HOCl占优势并光解生成更多的活性自由基,使藻蓝蛋白降解并矿化;碱性环境中以OCl-为主,OCl-对HO·的淬灭作用远高于HOCl,使得UV/Cl2体系中自由基浓度水平下降,藻蓝蛋白降解不充分生成更多的DBPs前体物。由图4所示,DCAN生成势由pH=6.0条件下的10.4 μg·L−1小幅提升至pH=7.0条件下的12.8 μg·L−1,进一步提高pH至8.0并没有促进DCAN生成。相较于DCAN,TCAN生成势处于很低水平((0.3±0.05 )μg·L−1),且不随pH变化而变化。TCNM生成势,随pH升高而降低。pH=8.0时TCNM生成势相比pH=6.0时降低了23.2%。pH提升抑制TCNM生成的主要原因为碱性环境下自由基产率降低以及TCNM水解作用增强[20]。
3)紫外/氯反应时间的影响。图5反映了在UV/Cl2体系中不同处理时间对藻蓝蛋白生成DBPs的影响。当次氯酸钠投加的质量浓度为3 mg·L−1(以Cl2计),pH为7.0时,4种DBPs生成量均随着反应时间的延长而增大。随着处理时间从10 min延长至45 min,TCM生成量由62.2 μg·L−1升高至72.9 μg·L−1;DCAN生成量由10.9 μg·L−1升高至13.8 μg·L−1;TCAN生成量由0.3 μg·L−1升高至0.7 μg·L−1;TCNM生成量由2.6 μg·L−1升高至5.7 μg·L−1。上述结果说明,延长自由基与藻蓝蛋白的反应时间可促进4种DBPs前体物的产生,这表明自由基在DBPs生成中的重要地位。尤其是自由基诱导含氮DBPs的生成更为明显。
利用自由基探针,分别测定了UV/Cl2体系中HO•和Cl•稳态浓度。分子探针NB仅与HO•反应(二级反应速率常数为3.9×109 L·(mol·s)−1),不与Cl•反应。BA即与HO•反应(5.9×109 L·(mol·s)−1),又与Cl•反应(1.8×1010 L·(mol·s)−1)。NB和BA初始浓度为0.5 μmol·L−1,其在UV/Cl2体系中的降解情况如图6所示。计算得到体系中HO•和Cl•稳态浓度分别为6.3×10−13 mol·L−1和2.9×10−13 mol·L−1,HO•的稳态浓度是Cl•的2倍。此结果表明UV/Cl2体系中HO•和Cl•参与并诱导了藻蓝蛋白向DBPs前体物的转化。虽然HO•和Cl•均为亲电自由基,但其与有机质的反应方式不同。HO•主要通过自由基加成和抽氢的反应途径,而Cl•可以通过单电子转移、加成、抽氢多途径共存的方式反应[21],使得自由基诱导的AOM转化相比单独氯化更为复杂。
-
在分子层面上进一步解析UV/Cl2体系中的藻蓝蛋白的具体分子式及元素组成,以探明藻蓝蛋白的分子转化机制。采用Van Krevelen图对数据进行解析,图7中横轴的氧碳原子比(O/C)用来反映藻蓝蛋白分子的氧化程度,纵轴的氢碳原子比(H/C)反映藻蓝蛋白分子的饱和程度。根据不同的O/C和H/C比,可以将藻蓝蛋白组分划分为7个类别,分别为脂类、脂肪族/肽类、碳水化合物、不饱和碳氢化合物、木质素类化合物、单宁酸类物质和芳香结构化合物,分区范围如表1所示。
图7所示为FT-ICR MS测试得到的氯化和UV/Cl2处理后藻蓝蛋白化学分子多样性演变特征。未经处理的藻蓝蛋白中共检出3 914个分子,含CHO元素的分子式2 203个和CHON元素的分子式1 562个。其中,CHO类化合物主要为脂质结构(分子数为1 170个);CHON类化合物主要为木质素结构(分子数为1 148个)。从化学结构上看,脂质是一类含氧量低且饱和度高的化合物,而木质素类可分为高不饱和化合物和脂肪族化合物[15]。与天然有机质(NOM)显著不同,藻蓝蛋白中芳香基团(芳香结构类和单宁酸类)极少。
如图7所示,经过氯化反应和UV/Cl2处理后,CHO类分子式的丰度分别降至1 842个和1 767个,与对照组相比分别下降了12.8%和20.4%。说明UV/Cl2体系中自由基的强氧化作用促进了脂肪族化合物的降解。反之,CHON类分子数量则分别上升至2 087个和2 139个,比对照组分别提高了35.3%和38.2%。上述结果说明UV/Cl2体系中自由基(主要为HO•)诱导大分子CHON化合物裂解为小分子CHON化合物。并且CHON的O/C比增大,说明UV/Cl2体系促进了氧化反应的发生使得氧化态分子增加。结合2.2节中UV/Cl2体系促进含氮DBPs(DCAN和TCNM)生成,生成的小分子CHON化合物极有可能为含氮DBPs前体物。上述结果说明,藻蓝蛋白在氯化和UV/Cl2处理中的主要反应组分为CHO类化合物中脂质结构和CHON类化合物中木质素结构,且UV/Cl2处理对CHO元素和CHON元素化合物转化的影响强于单独氯化。
藻蓝蛋白经过氯化和UV/Cl2反应后产生了大分子氯代DBPs(CHOCl和CHONCl类物质)。由图8可见,经氯化反应和UV/Cl2处理后,CHOCl类物质的分子个数分别为93个和106个,CHONCl类物质的分子个数分别为100个和102个。图8也反映了藻蓝蛋白中与氯反应的活性组分结构。其中,CHOCl主要通过氯与不饱和碳氢类和脂质类反应生成。CHONCl则通过氯与不饱和碳氢类和木质素类反应生成。经UV/Cl2处理后2类含氯化合物的相对强度比均比单独氯化处理高出1.2倍,说明UV/Cl2处理相比单独氯化处理生成了更多的氯代副产物。UV/Cl2处理中RCS诱导促进了藻蓝蛋白氯代反应的发生,主要活性组分为不饱和碳氢类化合物。前期研究[22-23]结果也表明AOM中的木质素类和不饱和碳氢类化合物的转化在有机氯胺的生成中发挥了重要作用。基于识别得到的关键组分,可以利用二氧化氯或高锰酸钾适度预氧化降低AOM不饱和碳氢类组分含量是控制DBPs的可行途径。
-
1) UV/Cl2体系促进了AOM转化生成DBPs,尤其是高毒性含氮DBPs生成量增大应引起重视。相比氯化处理,UV/Cl2体系在紫外剂量为280 mJ·cm−2、氯质量浓度6 mg·L−1时,由AOM转化生成的TCM、DCAN和TCNM分别增加了59.3%、160.7%和143.6%。
2)优化投氯量和缩短反应时间是控制DBPs的可行途径。相较于pH=6.0,碱性环境(pH=8.0)有利于提高TCM和DCAN生成势,却可以抑制TCNM生成势。
3)紫外/氯体系中生成的HO•和Cl•对DBPs增加具有重要贡献。
4) FT-ICR MS检测数据表明,自由基诱导了藻蓝蛋白中脂质类结构和木质素类结构的转化,不饱和碳氢类化合物和脂质化合物更倾向于与氯和RCS反应生成氯代有机物。
典型藻源有机质在紫外/氯体系中的转化及消毒副产物的生成
Algal organic matters transformation in UV/chlorine process and disinfection byproducts formation
-
摘要: 含藻水源中藻源有机质(AOM)导致消毒副产物(DBPs)的生成严重威胁供水安全。为此,该研究系统考察了AOM及其代表性蛋白类组分藻蓝蛋白在紫外/氯(UV/Cl2)体系中的DBPs生成规律,并进一步解析了自由基诱导的藻蓝蛋白转化路径。结果表明,相比单独氯化处理,在紫外剂量为280 mJ·cm−2和投氯量为6 mg·L−1的条件下,在UV/Cl2体系中,由AOM转化生成三氯甲烷(TCM)、二氯乙腈(DCAN)和三氯硝基甲烷(TCNM)的浓度分别增加了59.3%、160.7%和143.6%。UV/Cl2体系对藻蓝蛋白也同样表现出DBPs生成的促进效应,且DBPs生成量与氯投加量和反应时间正相关。相比pH=6.0,在pH=8.0时TCM和DCAN生成势有所增加。傅里叶变换磁回旋共振质谱(FT-ICR-MS)表征结果表明,藻蓝蛋白中脂质类结构和木质素类结构占主导地位并在紫外/氯体系中变化最为显著。相比单独氯化,紫外/氯体系中生成了更多的氯代副产物,脂质和不饱和碳氢类化合物是氯代副产物的重要前体结构。
-
关键词:
- 藻源有机质 /
- 紫外/氯 /
- 消毒副产物 /
- 傅里叶变换磁回旋共振质谱
Abstract: The formation of disinfection by-products (DBPs) from the algal organic matter (AOM) in algae-containing water sources seriously threatens the safety of water supply. In this study, the formation potential of DBPs from typical AOM and representative protein component phycocyanin in the UV/chlorine treatment was systematically investigated, and the radical-mediated transformation pathway of phycocyanin was further analyzed. The results indicate that in comparison with chlorine alone treatment, the UV/chlorine treatment with 280 mJ·cm−2 UV dose and 6 mg·L−1 Cl2 dosage could significantly increase chloroform (TCM), dichloroacetonitrile (DCAN) and trichloronitromethane (TCNM) by 59.3%、160.7% and 143.6%, respectively, the same promotion effect also occurred for DBPs formation from phycocyanin, and DBPs formation was positively correlated with chlorine dosage and UV/chlorine reaction time. Compared with pH 6.0, the formation potentials of TCM and DCAN increased at pH 8.0. FT-ICR-MS data showed that lipids and lignins were dominant in phycocyanin and the most significant changes occurred in UV/chlorine treatment. Compared with chlorination alone, more chlorinated by-products were produced in the UV/chlorine treatment. Lipids and unsaturated hydrocarbons were important precursor structures of chlorination by-products.-
Key words:
- algal organic matter /
- UV/chlorine /
- disinfection by-products /
- FT-ICR-MS
-

-
表 1 Van-Krevelen分类
Table 1. Stoichiometric ranges of the classifications for Van-Krevelen diagrams
类别 O/C H/C 脂质类 0≤O/C≤0.3 1.5<H/C≤2.0 脂肪族/肽类 0.3<O/C≤0.67 1.5<H/C≤2.2 碳水化合物类 0.67≤O/C<1.2 1.5<H/C≤2.4 不饱和碳氢类 O/C<0.1 0.7<H/C≤1.5 木质素类 0.1 <O/C<0.67 0.7<H/C≤1.5 单宁酸类 0.67<O/C<1.0 0.6≤H/C≤1.5 芳香结构类 O/C≤0.67 0.2<H/C≤0.7 -
[1] TOMLINSON A, DRIKAS M, BROOKES J D. The role of phytoplankton as pre-cursors for disinfection by-product formation upon chlorination[J]. Water Research, 2016, 102: 229-240. doi: 10.1016/j.watres.2016.06.024 [2] LIU Y, LIU K, PLEWA M J, et al. Formation of regulated and unregulated disinfection byproducts during chlorination and chloramination: Roles of dissolved organic matter type, bromide, and iodide[J]. Journal of Environmental Sciences, 2022, 117: 151-160. doi: 10.1016/j.jes.2022.04.014 [3] ZHANG X, HE J, XIAO S, et al. Elimination kinetics and detoxification mechanisms of microcystin-LR during UV/Chlorine process[J]. Chemosphere, 2019, 214: 702-709. doi: 10.1016/j.chemosphere.2018.09.162 [4] ZHANG X, XU W, REN P, et al. Effective removal of diatoms (Synedra sp. ) by pilot-scale UV/chlorine-flocculation process[J]. Separation and Purification Technology, 2022, 302: 122117. doi: 10.1016/j.seppur.2022.122117 [5] CHEN Y, BAI F, LI Z, et al. UV-assisted chlorination of algae-laden water: Cell lysis and disinfection byproducts formation[J]. Chemical Engineering Journal, 2020, 383: 123165. doi: 10.1016/j.cej.2019.123165 [6] RAO N R H, LINGE K L, LI X, et al. Relating algal-derived extracellular and intracellular dissolved organic nitrogen with nitrogenous disinfection by-product formation[J]. Water Research, 2023, 233: 119695. doi: 10.1016/j.watres.2023.119695 [7] ZHAI H, CHENG S, ZHANG L, et al. Formation characteristics of disinfection byproducts from four different algal organic matter during chlorination and chloramination[J]. Chemosphere, 2022, 308: 136171. doi: 10.1016/j.chemosphere.2022.136171 [8] LIU C, ERSAN M S, WAGNER E, et al. Toxicity of chlorinated algal-impacted waters: Formation of disinfection byproducts vs. reduction of cyanotoxins[J]. Water Research, 2020, 184: 116145. doi: 10.1016/j.watres.2020.116145 [9] 沈强, 沈银武, 刘永定, 等. 滇池水华蓝藻藻蓝蛋白的分离纯化与毒性研究[J]. 环境化学, 2009, 28(4): 497-501. doi: 10.3321/j.issn:0254-6108.2009.04.006 [10] 张昆. 蓝隐藻藻蓝蛋白的存在状态研究[D]. 烟台: 烟台大学, 2023. [11] HAO S, LI F, LIU Y, et al. Phycocyanin diminishes the viability of non-small cell lung cancer cells via induction of autophagy[J]. Journal of Functional Foods, 2022, 94: 105145. doi: 10.1016/j.jff.2022.105145 [12] LI Y. The bioactivities of phycocyanobilin from spirulina[J]. Journal of Immunology Research, 2022: 122111. [13] ZUO Y-T, WU J, CHENG S, et al. Identification of pterins as characteristic humic-like fluorophores released from cyanobacteria and their behavior and fate in natural and engineered water systems[J]. Chemical Engineering Journal, 2022, 428: 131154. doi: 10.1016/j.cej.2021.131154 [14] WANG D, HUA Z, CUI Y, et al. Probing into the mechanisms of disinfection by-product formation from natural organic matter and model compounds after UV/chlorine treatment[J]. Environmental Science: Water Research & Technology, 2023, 9(6): 1587-1598. [15] HUA L C, LAI C H, WANG G S, et al. Algogenic organic matter derived DBPs: Precursor characterization, formation, and future perspectives: A review[J]. Critical Reviews in Environmental Science and Technology, 2019, 49(19): 1803-1834. doi: 10.1080/10643389.2019.1586057 [16] HUA Z, LI D, WU Z, et al. DBP formation and toxicity alteration during UV/chlorine treatment of wastewater and the effects of ammonia and bromide[J]. Water Research, 2021, 188: 116549. doi: 10.1016/j.watres.2020.116549 [17] LEITE L D, DOS SANTOS D V, PASCHOALATO C F, et al. Disinfection by-products dormation from xhlor(am)ination of algal organic matter of chlorella sorokiniana[J]. Toxics, 2023, 11(8): 690-703. doi: 10.3390/toxics11080690 [18] GAO Y-Q, ZHOU J-Q, ZHANG J, et al. Factors affecting UV/persulfate treatment of phenacetin and its disinfection byproduct formation potential[J]. Separation and Purification Technology, 2021, 256: 117819. doi: 10.1016/j.seppur.2020.117819 [19] LIANG L, SINGER P C. Factors influencing the formation and relative distribution of haloacetic acids and tihalomethanes in drinking water[J]. Environmental Science & Technology, 2003, 37(13): 2920-2928. [20] RUAN X, ZHANG X, LEI Y, et al. UV254 irradiation of N-chloro-alpha-amino acids: Kinetics, mechanisms, and N-DBP formation potentials[J]. Water Research, 2021, 199: 117204. doi: 10.1016/j.watres.2021.117204 [21] MA Y, LI M, HUO Y, et al. Differences in the degradation behavior of disinfection by-products in UV/PDS and UV/H2O2 processes and the effect of their chemical properties[J]. Chemosphere, 2023, 345: 140457. doi: 10.1016/j.chemosphere.2023.140457 [22] SHENG D, BU L, ZHU S, et al. Organic chloramines formation from algal organic matters: Insights from Fourier transform-ion cyclotron resonance mass spectrometry[J]. Water Research, 2021, 206: 117746. doi: 10.1016/j.watres.2021.117746 [23] SHENG D, BU L, ZHU S, et al. Novel insights into formation mechanism of organic chloramines from pre-oxidized algae-laden water: Multiple roles of dissolved organic nitrogen[J]. Science of the Total Environment, 2022, 838: 155894. doi: 10.1016/j.scitotenv.2022.155894 -



 下载:
下载: