-
水是江南园林的重要组成部分,素有“无水不成景、无水不成园”的说法[1]。水体水质好坏会在很大程度上影响到园林景观,但大多数园林水体的流动性较差、水域面积较小、自净能力偏弱,容易受到降雨径流等外源污染的冲击[2-3]。为提高水体自净效果,一般需要采取人工曝气、旁路过滤和生态浮床等强化措施。但这些方法普遍存在施工量较大、运行维护要求较高和对周边景观影响较大等问题[4–6]。
固定化生物膜技术是一种将微生物固定在一定载体上,通过增加单位水体生物量的方式,提高功能菌对污染物的降解效能的技术。该技术已被广泛应用于河湖水体的水质净化工程。WEN等[7]以玉米芯、麦秆和花生壳等为代表的生物质碳源作为固定化载体,形成的生物膜能释放有机物和氮磷等基质,促进微生物在其表面附着生长,但生物质碳源中有机物的释放速率呈现先快后慢的特点,不利于水体水质的长效治理[8];NI等[9]在纤维生物滤池 (Fiber Biofilter) 中将聚合物填料作为微生物的固定化载体,并将形成的生物膜用于水产养殖中将有机物降解,以及将氨氮转化为硝酸盐;TABASSUM等[10]以粉末状活性炭和水性聚氨酯凝胶包裹的硝化细菌作为固定化载体 (Mass Bio System) ,形成生物膜被用于快速提升水体硝化活性。
近年来,有研究者提出了一种将具有很高的生物亲和性,能以相对恒定的速率向水体释放碳源的新型生物蜡作为微生物固定化载体的技术。该生物蜡可促进生物膜的形成,适合用于治理微污染水体[11]。目前,将生物蜡技术用于封闭园林水体水质改善与长效保持的研究仍鲜有报道,生物膜的主要功能尚不清楚。为此,本研究选取典型的江南园林水体,通过对比投放生物蜡模块前后主要水质指标的统计学变化,从工程应用的角度论证新型固定化生物膜技术对小型半封闭水体的水质净化效能,并采用高通量测序技术,对水体、沉积物和生物膜中的菌群结构功能进行分析,系统阐述利用生物蜡技术实现水质净化的关键反应机制,以期为江南园林水体的原位净化与长效保持提供参考。
-
实验地点选取典型的江南园林水体——苏州科技大学石湖校区九曲桥 (31°15′17.88″N,120°34′56.30″E),水域面积约为1 200 m2,平均水深0.6~0.7 m,池底无水生植物,周边有茂密的陆生植被,定期与外部河道进行换水操作,如图1所示。该水体在春夏季受河道进水、降雨径流和内源污染等影响,容易发生局部水华现象。
研究于2021年2月—6月开展,对水体本底值进行监测,并于当年10月份投放生物蜡模块。待生物蜡挂膜成功后,于次年2—6月开展水质常规监测,以评估水体水质变化,监测频次均为每周2次。据调查,2021年苏州市平均气温 18.3 ℃,降水量1 318.6 mm,2022年平均气温 18.1 ℃,降水量1 004.2 mm。2021年和2022年苏州春夏季降雨量、平均气温相差不大,降雨形成的地表径流和树木落叶是潜在的外源污染。水体换水周期为每季度3~4次,每次换水耗时约1~2 d,其余时间水体基本处于静止状态。
-
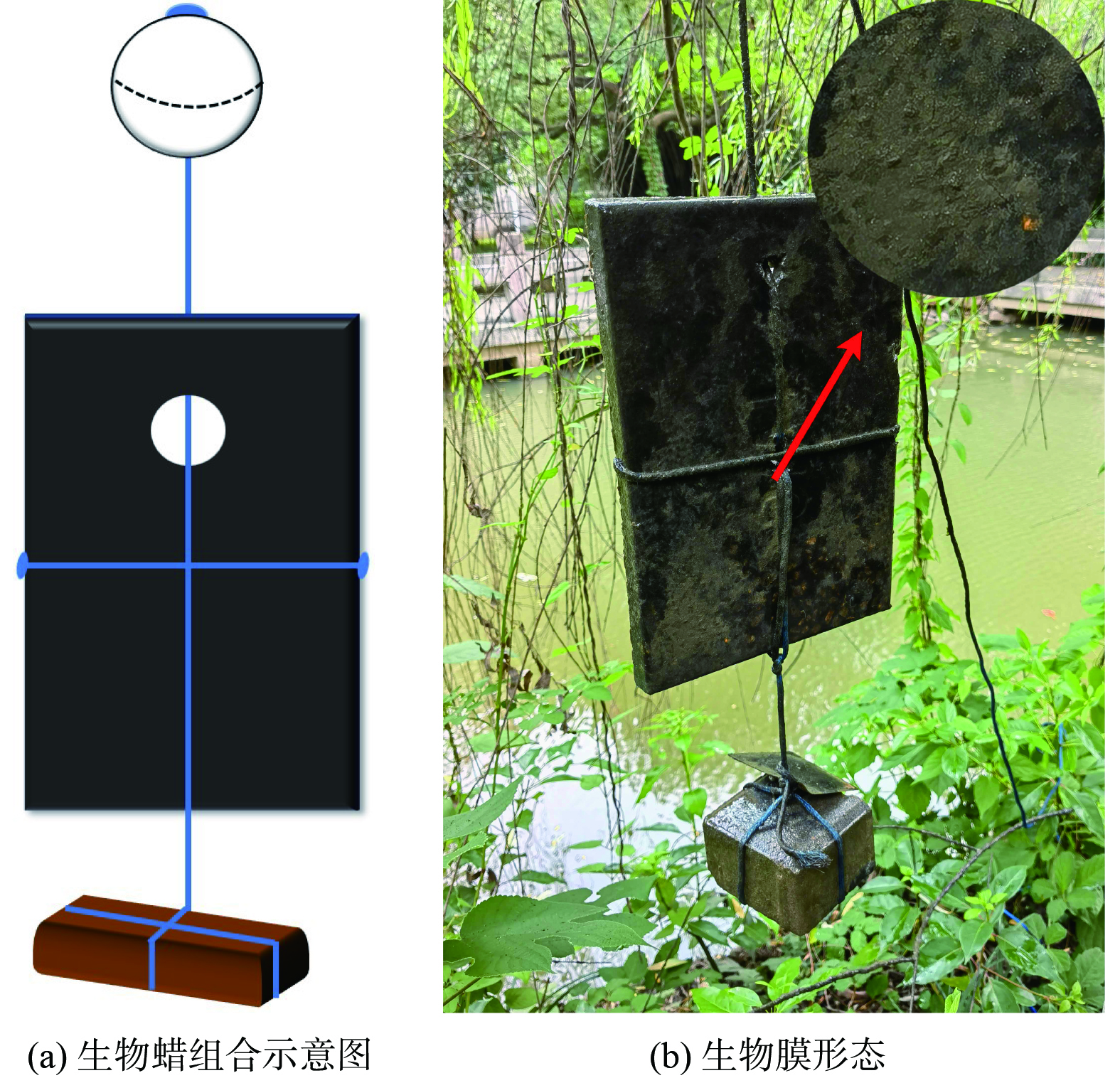
生物蜡是一种采用微晶蜡固定脂肪酸 (碳源0.5%,微量元素0.1%,其他为石蜡 (标号56#) ) 的块状基质,整体呈黑色[12-13]。在水体中设置有12个投放点,平均每100 m2水面投放1块0.317 m×0.220 m×0.025 m,重1.25 kg的生物蜡。利用浮漂和配重将生物蜡模块直立悬浮在水中,如图2 (a) 所示。在水流和微生物作用下,生物蜡缓慢释放营养物质,有效促进土著微生物在其表面生成稳定的生物膜结构,期间不投加任何菌种。生物蜡挂膜周期约3个月,成熟的生物膜形态如图2 (b) 所示。
-
使用EXO水质分析仪 (YSI,USA) 现场测定了叶绿素a的浓度,使用赛氏盘现场测定了透明度。使用国标法测定水样的氨氮 ([NH4+-N]) 、总氮 (TN) 、总磷 (TP) ,使用重铬酸盐法测定水样COD。
-
2022年7月,分别采集水体中水样 (Water) 、沉积物 (Sediment) 和生物蜡表面生物膜 (Biofilm) 样品。水样经0.22 μm孔径滤膜过滤后,与其他固态样品一同-80 ℃条件下保存。使用试剂盒 (Fast DNA Spin kit for soil,M.P。Company,U.S.) 对各组样品进行DNA提取,每组设置3个平行样。使用引物338F ( 5'-ACTCCTACGGGAGGCAGCA-3') 和806R ( 5'-GGACTACHVGGGTWTCTAAT-3') ,进行16S rRNAV3-V4区基因扩增。PCR扩增完成后,用AxyPrepTM DNA凝胶提取试剂盒 (Axygen Biosciences,Union City,U.S.) 对产物进行纯化。将处理完成后的样品送往Illumina MiSeq 测序平台进行高通量测序。
-
使用Usearch (version 11) 以97 %的相似性对OTU代表序列进行分类学分析。基于抽平后的OTU数据集,使用Uparse (version 11) 计算了α多样性指数 (Chao1和Shannon指数) ,并进行 (PCoA) 主坐标分析。在门和属水平上,比较了不同介质菌群结构的差异性。采用Kruskal-Wallis 秩和检验方法检验对多组样本进行物种组间差异显著性检验。使用Gephi (version 0.10.1) 分析不同介质细菌在属水平上的共现性网络。使用Faprotax预测不同介质细菌的潜在代谢功能。
-
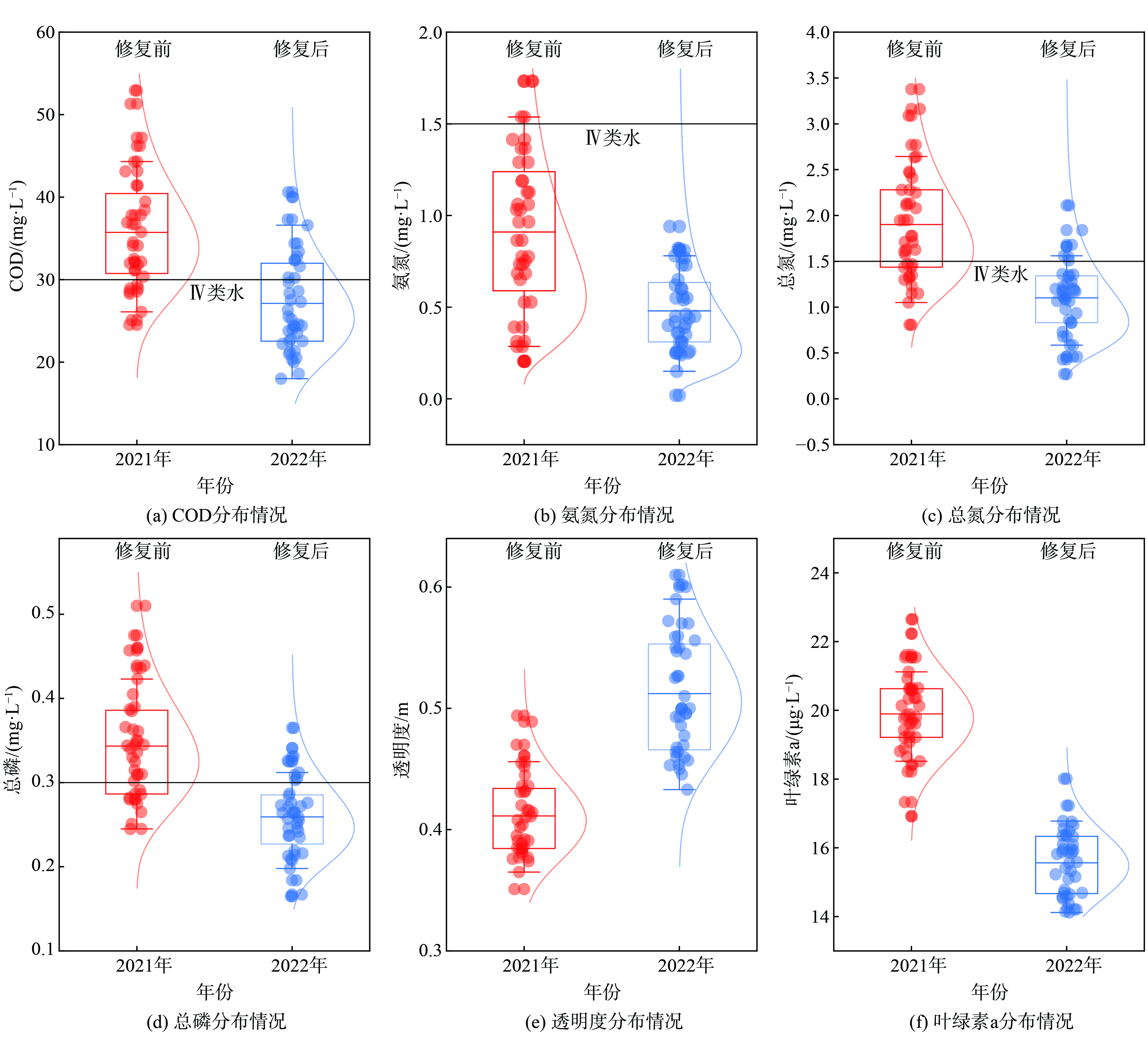
图3所示为投放生物蜡前后水体的各项监测数据,修复前为红色,修复后为蓝色。2021年2—6月:水体的COD、氨氮、总氮和总磷服从正态分布,均值分别为 (35.74±7.01) mg·L−1、 (0.91±0.43) mg·L−1、 (1.90±0.61) mg·L−1、和 (0.34±0.07) mg·L−1,离散系数分别为0.20、0.47、0.32和0.21;池体平均透明度为 (0.41±0.03) m,低于苏州水体均值0.51 m[14];叶绿素a的平均质量浓度为 (19.90±1.20) μg·L−1,高于苏州河道春夏季均值15.36 μg·L−1,这表明该水体属于轻度富营养化程度[15-16]。2022年2—6月:水体的COD、氨氮、总氮和总磷平均值分别为 (27.12±4.88) mg·L−1、 (0.48±0.21) mg·L−1、 (1.10±0.32) mg·L−1和 (0.26±0.05) mg·L−1,较2021年同期分别下降24.12 %、47.25 %、42.11 %和23.53 %,各项指标的离散系数降至0.18、0.44、0.29和0.19;水体透明度平均值升高至 (0.53±0.05) m;叶绿素a平均质量浓度降至 (15.96±0.96) μg·L−1,这表明该水体富营养化程度有所改善。与生物蜡的多种修复功能相比,传统的硅藻土和多孔黏土材料等生物膜载体仅能用于提高水体的生物量,改善部分指标[17-18]。
按照监测次数计算,2021年2—6月,COD、总氮、氨氮和总磷达到《地表水环境质量标准》 (GB3838-2002) Ⅳ 类标准的百分比分别为22.5 %、90.0 %、32.5 %和30.0 %。除受外河水质影响外,九曲桥周边分布有大量落叶乔木和灌木,落叶等凋落物是造成水体氮磷超标的重要源头之一[19]。2022年2—6月,水体COD、总氮、氨氮和总磷的Ⅳ类水达标率分别较2021年同期提高了3.0倍、1.1倍、2.1倍和2.3倍,九曲桥春夏季的水质得到明显改善 (图4) 。
-
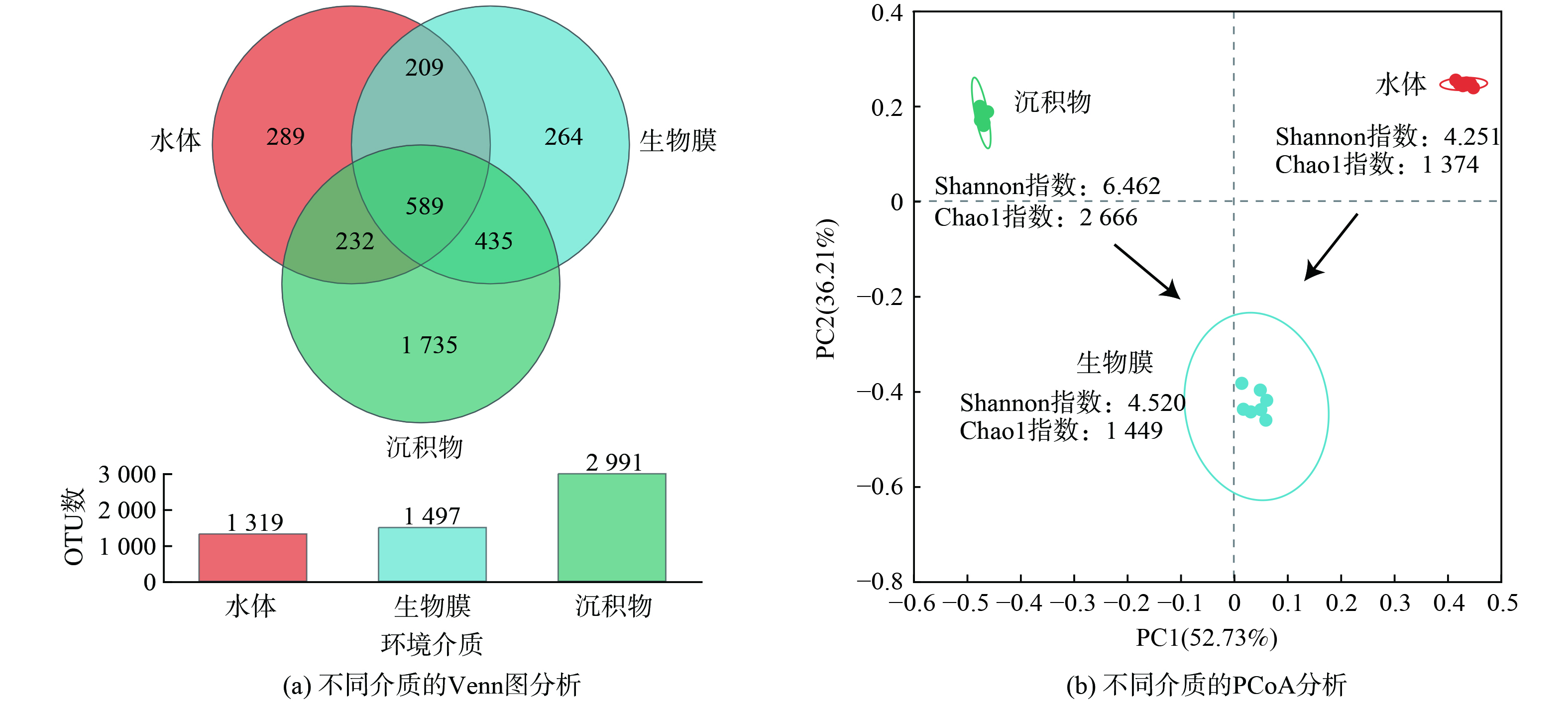
图5 (a) 表明,生物蜡表面生物膜的微生物丰度 (Chao1指数) 和多样性指数 (Shannon指数) 与水体接近,均明显低于沉积物的水平。这可能是由于在水流扰动作用下,沉积物-水体界面更容易形成基质梯度 (如溶解氧) ,进而形成显著的生态位分化,有利于不同功能菌群的协同生长[20-21]。
基于Bray-Curtis距离法的PCoA分析结果表明 (图5 (b) ) ,生物膜在PC1维度 (解释度52.73%) 上介于水体和沉积物之间,在PC2维度 (解释度36.21%) 上与水体和沉积物均存在很大差异。生物膜和水体、生物膜和沉积物共有的OTU数量分别为798个和1 024个,分别占生物膜OTU总数的53.3%和68.4%。相比之下,生物膜中特有的OTU数量为264个,仅占到总数的17.6%。这说明生物膜主要由水体的土著微生物构成,悬浮的生物蜡模块不仅提高了水体中的微生物总量,还改变了微生物的空间分布形态,为降解水中污染物创造了有利条件。
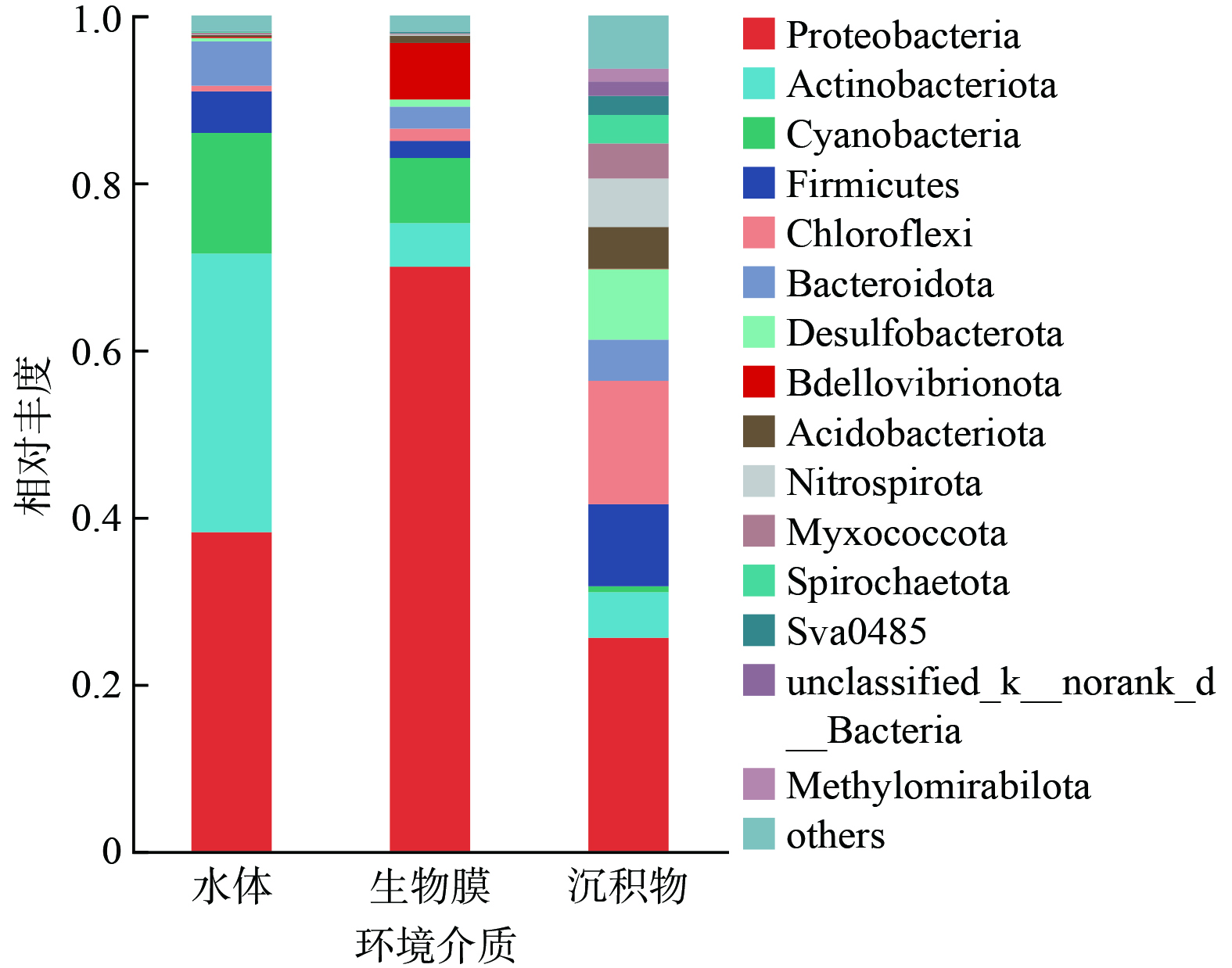
如图6所示,水体样品中的优势菌门分别为变形菌门 (Proteobacteria,相对丰度38.42 %) 、放线菌门 (Actinobacteriota,33.30 %) 、蓝藻门 (Cyanobacteria,14.44%) 、拟杆菌门 (Bacteroidota,5.32 %) 和厚壁菌门 (Firmicutes,4.97 %) 。变形菌门、拟杆菌门、放线菌门和蓝藻门在水体中的富集与其轻度富营养化状况是一致的[22-23]。在沉积物中,丰度前5的菌门包括变形菌门 (Proteobacteria,25.65 %),绿弯菌门 (Chloroflexi,14.78 %)、厚壁菌门 (Firmicutes,9.47 %) 、脱硫菌门 (Desulfobacterota,8.43 %) 和硝化螺旋杆菌门 (Nitrospirota,5.80 %) 。其中,绿弯菌门和厚壁菌门的富集与沉积物中典型的缺氧环境密切相关[24]。相比之下,生物膜中变形菌门的相对丰度最高,达到69.36 %,随后为蓝藻门 (Cyanobacteria,7.79%)、蛭弧菌门 (Bdellovibrionota,6.67%)、放线菌门 (Actinobacteriota,5.22 %) 和拟杆菌门 (Bacteroidota,2.64 %) 。通常认为,变形菌门具有较强的有机物和营养盐代谢潜力,同时,其能够分泌大量胞外聚合物 (EPS) ,为生物膜的形成提供了重要的结构性物质[25-26]。此外,蛭弧菌门在生物膜中的相对丰度分别为水和沉积物中的43.47 倍和159.38 倍。作为典型的掠食性细菌,蛭弧菌门的生长说明生物膜中形成了更长的食物链和更强的淘汰压,有利于形成特定功能化的菌群结构[27]。
如图7所示,通过在属水平上比较不同介质的细菌群落组合,可获得更详细的生态位信息。LEfSe (LDA Effect Size) 分析 (LDA>4) 表明水体中有Acinetobacter (变形菌门,3.63 %) 、 Aurantimicrobium (放线菌门,2.73 %) 、CL500-29_marine_group (放线菌门,3.40 %) 等12个属与其他介质存在显著差异,其中,Acinetobacter、Limnohabitans、CL500-29_marine_group和Polymucleobacter分别在硝化[28]、硝酸盐还原[29]、反硝化[30]和溶解性有机物降解[31]等碳氮循环的过程中发挥作用。具有溶磷能力的Exiguobacterium含量相对较少,这可能是水体磷元素去除率低的原因。沉积物中有norank_f_norank_o__SBR1031 (绿弯菌门,3.00 %) 、Sva0485 (Sva0485门,2.27 %) 、Anaeromyxobacter (黏球菌门,3.18 %) 等5个属与其他介质存在显著差异,其中norank_f_norank_o__SBR1031可利用多种有机物进行发酵生长,在清除微量有机物方面有积极作用[32]。生物膜中有Aquabacterium (变形菌门,16.25 %) 、Hydrogenophaga (变形菌门,7.23 %) 、Caulobacter (变形菌门,3.14 %) 等7个属与其他介质存在显著差异。同时生物蜡表面的生物膜上存在厌氧或厌氧兼性的反硝化细菌[33] (如Hydrogenophaga和Caulobacter) 和异养硝化-好氧反硝化细菌[34] (如Novosphingobium和Sulfuritalea) ,这些细菌为水体氨氮的高去除率和高达标率提供了前提条件。水环境中活性有机物降解菌和反硝化菌的明显增加,可有效减少耗氧污染物,提高水体的承载能力,有利于水质的改善。与玉米芯等生物质碳源作为固定化生物膜载体类似,投加生物蜡选择性地促进了具有固氮和反硝化能力的氮循环微生物的生长[35]。
-
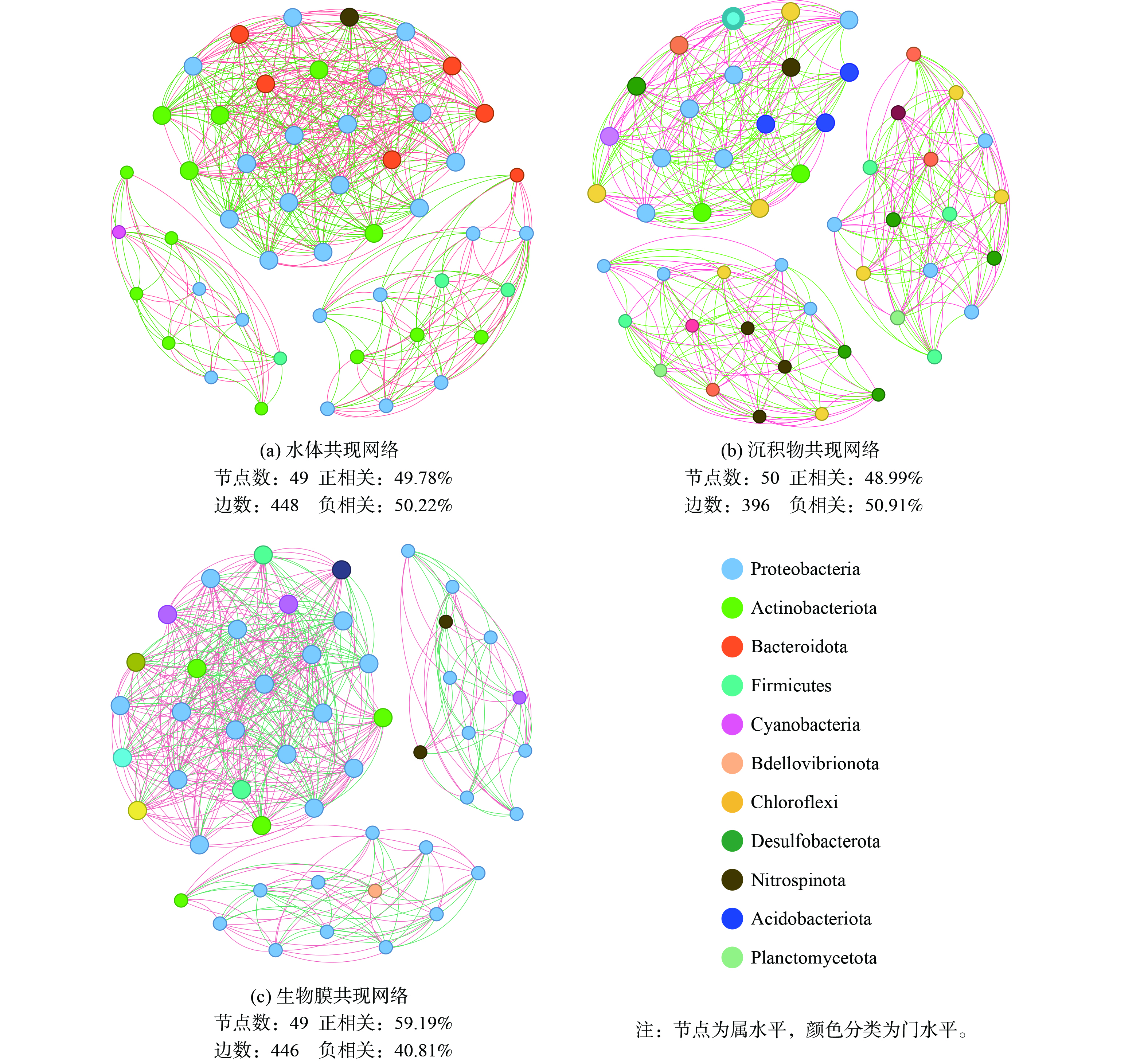
如图8所示,尽管沉积物中的微生物多样性远高于水和生物膜,但生物膜上形成了更为复杂的微生物关联关系。水体、沉积物和生物膜中丰度前50的菌属之间边数分别为448条边、396条边和446条边。从共现网络发现,水体和生物蜡表面微生物的相互作用主要以变形菌门、放线菌门和拟杆菌门为主,而沉积物中相互作用的微生物具有很高的均质性,以变形菌门、绿弯菌门和脱硫菌门为主。生物膜网络中的正相关性最高,而天然环境中的网络正负相似。这表明在生物膜上微生物之间发生了更紧密的共生关系,互利的共生关系可能涉及代谢物的交换、基因和电子的转移以及信号分子的传输[36], 生物蜡持续释放微生物生长基质有利于在生物膜中形成复杂的关联网络。目前,生物蜡对不同种土著微生物的选择性富集机理尚不清楚,有待后续探究。
共现网络的关键物种对潜在的微生物功能很重要,是细菌群落结构和生态系统稳定性的驱动力,与不同介质的代谢循环密切相关[37]。作为水体的关键物种,拟杆菌门的pseudarcicella利用藻类分解物中的多种物质 (碳水化合物,氨基酸,丙酮酸) 作为其碳源,且更适宜在贫营养低浊度环境下生存[38],hgc I_clade、Flavobacterium等具有溶藻能力的细菌[39],能与pseudarcicella形成“微循环”,增强水体的藻类分解和有机物去除能力。沉积物中脱硫菌门的Syntrophus 可能与硫酸盐还原有关,能在厌氧条件下以硫化物、元素硫、硫代硫酸盐和氢为电子供体,以硝酸盐为电子受体进行硫代谢[40]。生物膜上的关键物种是来自变形菌门的Limnohabitans,其在水体中含量更高,但在生物膜上与其他微生物具有更强的联系, Limnohabitans自身参与氮素营养盐还原[41],可为好氧反硝化细菌如Hydrogenophaga、Aquabacterium和Rhodobacter等提供电子受体[42],进一步稳定生物膜的菌间关系,强化水环境的氮循环能力。
图9所示的Faprotax预测常用于描述菌群的代谢功能和生态位信息。水体中碳氮代谢的功能基因丰度较高,包括methanotrophy、methylotrophy、methanol_oxidation、nitrate_ammonification、nitrite_ammonification和nitrogen_fixation等,同时,也存在一定的致病风险 (如human_gut、manmal_gut) 。在沉积物中,sulfur_respiration、sulfite_respiration等硫循环功能基因占据主导。相比之下,生物膜中chemoheterotrophy、photoautotrophy和phototrophy等碳循环和nitrate_reduction、nitrogen_respiration、nitrate_respiration等氮循环功能基因丰度明显提高。尽管部分致病基因也得到了富集,但生物膜中未检出chloroplasts等藻类代谢基因,具有较高的功能化特征。
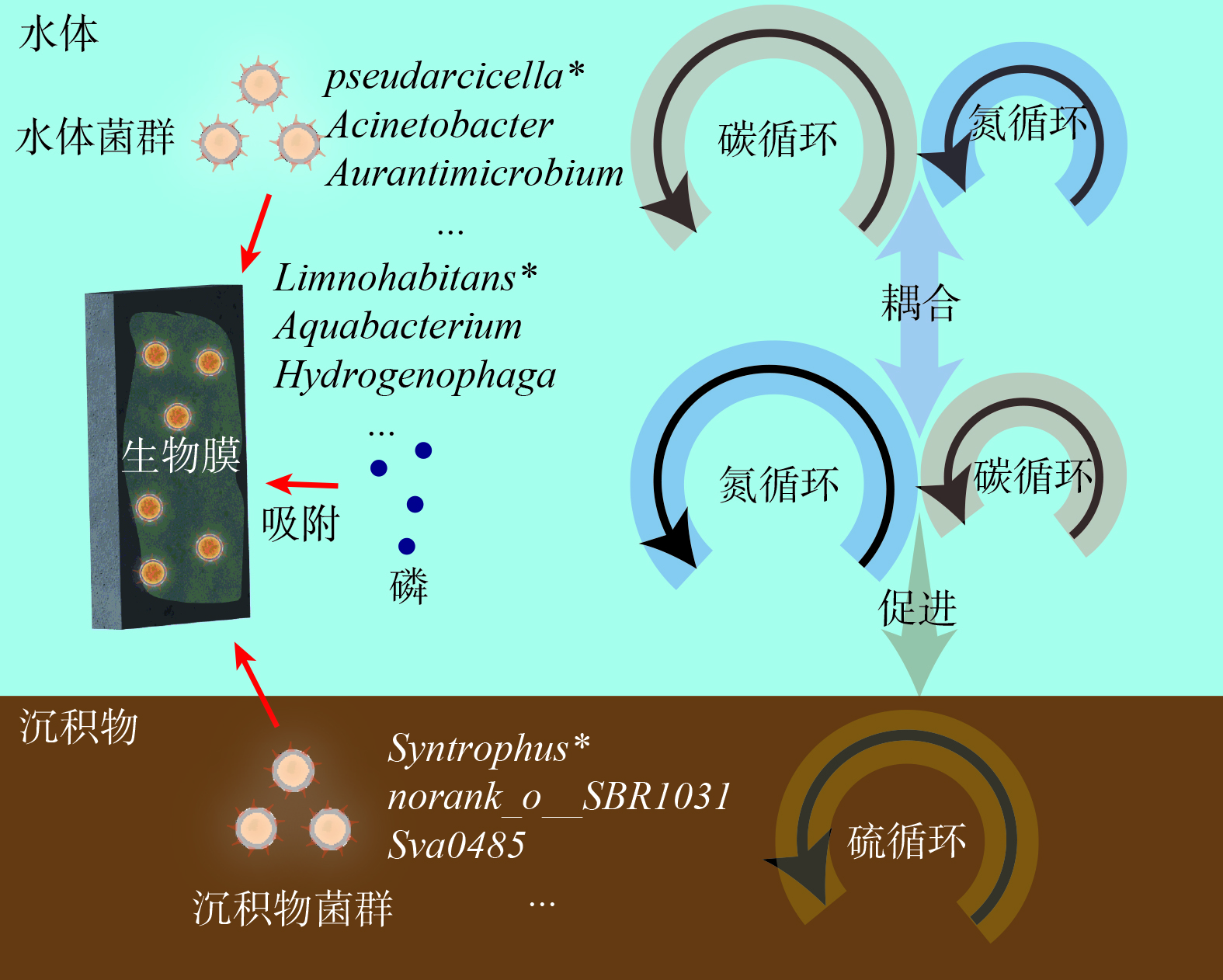
生物蜡技术的微生物反应机制如图10所示。生物蜡能富集水体和沉积物的土著菌种,与上述关键物种功能研究一致,各个介质的关键物种介导了各个介质的核心功能,且水体中主要存在的厌氧消化相关碳循环功能和生物膜上的硝态氮还原相关氮循环功能可进行耦合,进行碳和氮的同时去除[43]。沉积物中硫循环基因的主要代谢过程是将水环境中的硫元素转化为H2S,此过程更容易在厌氧或缺氧环境下进行[44],生物膜的关键物种 Limnohabitans可能会为此过程提供电子受体以促进沉积物硫代谢。功能预测结果表明,生物膜缺少典型的磷循环功能基因,考虑到修复后池体透明度得到改善,推测磷的去除途径主要是生物膜的吸附和含磷颗粒物的沉降,具体磷的去除路径需要在后续研究中进一步阐述。建议种植苦草等水生植物来协同磷元素的去除[45]。研究表明,在园林水体中不同环境介质上微生物功能存在显著的差异性,但水动力、季节更替等自然条件对生物膜功能的影响尚不明确,还需要后续进行研究。
-
投放生物蜡使水体的COD、氨氮、总氮和总磷分别降低了24.12 %、42.11 %、47.25 %和23.53 %,而且可长期保持在较低水平。同时发现:1) 生物蜡表面生物膜中82.4%的OTU都来源于水体和沉积物,以变形菌门为主,占69.36%,其中以Aquabacterium (变形菌门) 和Hydrogenophaga (变形菌门) 为主要的属。相关性分析筛选出水体的pseudarcicella属 (拟杆菌门) 、生物膜的Limnohabitans属 (变形菌门) 、沉积物的Syntrophus属 (脱硫菌门) 是各个介质的关键物种;2) 生物膜上的光能自养、化能异养和亚硝酸盐去除等核心功能呼吸加强了水环境中有机物的降解和氮化合物间的转化,实现了水体的碳氮耦合,能够增强沉积物的硫代谢能力,提高水环境的污染物降解能力。
生物蜡在促进微生物生长的同时可有效截留生物量,显著提高水体透明度和抑制藻类生长。与颗粒物对磷酸盐的吸附作用类似,生物吸附可能是导致水体总磷浓度降低的重要原因。在后续治理中,建议在池底分区种植能与生物蜡协同的苦草、狐尾藻和轮叶黑藻等水生植物,进一步提高水体除磷效能,同时,采取打捞池中落叶和池底淤泥等管理措施,有效削减内外源强,实现水质长效保持目标。
生物蜡技术用于江南园林水体水质净化的微生物反应机制
Study on the microbial reaction mechanism of bio-wax technology in purifying water bodies in Jiangnan gardens
-
摘要: 生物蜡是一种新型固定化生物膜技术,其能够通过富集水体土著微生物,有效提高水体自净能力。系统地考察了生物蜡对典型江南园林水体春夏季水质的净化效能。结果表明,每100 m2水面投放1块生物蜡,能够使水体在春夏季的COD、氨氮、总氮、总磷和叶绿素a均值分别降低24.12 %、42.11 %、47.25 %、23.53 %和17.90 %,透明度提高24.39 %,COD、总氮、氨氮和总磷的Ⅳ类水达标率分别提高154.55 %、71.43 %、11.11%和93.75 %。通过采用高通量测序和功能基因预测技术对水体净化的微生物反应机制进行分析,发现生物蜡表面生物膜中约82.4%的OTU来自于水体和沉积物中的土著微生物,尽管生物膜的微生物丰度和多样性指数均低于沉积物,但具备有机物和氮素降解能力的变形菌门 (Proteobacteria,相对丰度69.36 %) 占据主导地位,并形成了复杂的微生物共现网络,增强了光能自养、化能异养和亚硝酸盐去除等代谢功能。该研究结果表明,生物蜡技术为土著功能菌群的选择性富集提供了良好载体,在园林水体原位净化领域具有广阔的应用前景。Abstract: Bio-wax is a novel immobilized biofilm technology, which can effectively improve the self-purification ability of water bodies by enriching indigenous microorganisms. This study systematically investigated the purification effect of bio-wax on spring and summer water quality in typical Jiangnan garden water bodies. The results showed that adding one piece of bio-wax in 100 m2 water surface area can reduce the mean concentration of COD, ammonia nitrogen, total nitrogen, total phosphorus and chlorophyll a by 24.12 %,42.11 %, 47.25 %, and 17.90 %, respectively. It can also increase the transparency of water body by 24.39 % and increase the Class IV water compliance rate of COD, total nitrogen, ammonia nitrogen and total phosphorus by 154.55 %, 71.43 %, 11.11% and 93.75 %, respectively. By using high-throughput sequencing and functional gene prediction techniques, this study found that about 82.4 % OTUs in the surface biofilm of the bio-wax were derived from indigenous microorganisms in water bodies and sediments. It is also found that although the microbial abundance and diversity indices of the biofilm were lower than those of the sediments, Proteobacteria (relative abundance 69.36 %), which have the ability of organic matter and nitrogen degradation, dominated the biofilm, and formed a complex microbial co-occurrence network with significantly enhanced metabolic functions of photoenergetic autotrophs, chemoenergetic heterotrophs, and nitrate nitrogen respiration. In conclusion, the bio-wax technology provides a good carrier for the selective enrichment of indigenous functional flora, and has a broad application prospect in the field of in situ purification of garden water.
-

-
-
[1] YU C, LI Z, XU Z, et al. Lake recovery from eutrophication: Quantitative response of trophic states to anthropogenic influences[J]. Ecological Engineering, 2020, 143: 105697. doi: 10.1016/j.ecoleng.2019.105697 [2] 许铭宇, 刘雯, 谭广文, 等. 生态净水系统对富营养化园林水体的净化效应研究[J]. 长江科学院院报, 2019, 36(4): 27-31. [3] 吴香香, 李大鹏, 贾海峰, 等. 江南地区缓流水体中微塑料的表现规律[J]. 中国给水排水, 2022, 38(3): 62-66. [4] 伍燕南, 王跃, 陈德超. 苏州园林水体生态化治理之路探讨[J]. 环境与可持续发展, 2012, 37(5): 87-91. [5] 王桢桢, 潘杨, 翟笑伟. 封闭景观水体的表观污染机制研究[J]. 环境工程, 2015, 33(4): 9-13. [6] 李飞鹏, 张海平, 陈玲. 小型封闭水体环境因子与叶绿素a的时空分布及相关性研究[J]. 环境科学, 2013, 34(10): 3854-3861. [7] WEN Y, CHEN Y, ZHENG N, et al. Effects of plant biomass on nitrate removal and transformation of carbon sources in subsurface-flow constructed wetlands[J]. Bioresource Technology, 2010, 101(19): 7286-7292. doi: 10.1016/j.biortech.2010.04.068 [8] 赵联芳, 朱伟, 高青. 补充植物碳源提高人工湿地脱氮效率[J]. 解放军理工大学学报(自然科学版), 2009, 10(6): 644-649. [9] NI Z, WU X, LI L, et al. Pollution control and in situ bioremediation for lake aquaculture using an ecological dam[J]. Journal of Cleaner Production, 2018, 172: 2256-2265. doi: 10.1016/j.jclepro.2017.11.185 [10] TABASSUM S, LI Y, CHI L, et al. Efficient nitrification treatment of comprehensive industrial wastewater by using Novel Mass Bio System[J]. Journal of Cleaner Production, 2018, 172: 368-384. doi: 10.1016/j.jclepro.2017.10.022 [11] RUIZ P, VIDAL J M, SEPÚLVEDA D, et al. Overview and future perspectives of nitrifying bacteria on biofilters for recirculating aquaculture systems[J]. Reviews in Aquaculture, 2020, 12(3): 1478-1494. doi: 10.1111/raq.12392 [12] 周朋. 蜡基多孔材料的制备及其微生物污水处理性能研究[D]. 长春: 长春工业大学, 2022. [13] WANG Y, ZHAO Y, JI M, et al. Nitrification recovery behavior by bio-accelerators in copper-inhibited activated sludge system[J]. Bioresource Technology, 2015, 192: 748-755. doi: 10.1016/j.biortech.2015.06.015 [14] 张睿婷, 胡昕欣, 金睿, 等. 2019年苏州市10处湿地中水体的透明度及其影响因素研究[J]. 湿地科学, 2021, 19(3): 331-341. [15] 昂安坤. 河道水感官品质分析与提升技术研究[D]. 上海: 上海交通大学, 2020. [16] 庄媛, 高宇, 姜财起, 等. 城市小型景观水体水环境质量评价[J]. 中国城市林业, 2023, 21(3): 133-138. [17] 吕晓冰, 李茹莹. 固定化微生物对低温河水脱氮效果的中试研究[J]. 环境科学学报, 2022, 42(7): 159-169. [18] JIANG B, LI Y, WANG H, et al. Application of a new type of Si–Al porous clay material as a solid phase support for immobilizing Acidovorax sp. PM3 to treat domestic sewage[J]. Adsorption Science & Technology, 2019, 37(9-10): 729-744. [19] 方玲, 陈敏, 林玉虎, 等. 十种常见园林树种凋落物分解特性[J]. 北方园艺, 2022(5): 75-82. [20] MEZITI A, TSEMENTZI D, KORMAS K Ar, et al. Anthropogenic effects on bacterial diversity and function along a river-to-estuary gradient in Northwest Greece revealed by metagenomics[J]. Environmental Microbiology, 2016, 18(12): 4640-4652. doi: 10.1111/1462-2920.13303 [21] CRUMP B C, PETERSON B J, RAYMOND P A, et al. Circumpolar synchrony in big river bacterioplankton[J]. Proceedings of the National Academy of Sciences, 2009, 106(50): 21208-21212. doi: 10.1073/pnas.0906149106 [22] 徐超, 张军毅, 朱冰川, 等. 夏季太湖梅梁湾水体中细菌的群落结构[J]. 环境监控与预警, 2015, 7(1): 37-40. [23] WANG P, ZHAO J, XIAO H, et al. Bacterial community composition shaped by water chemistry and geographic distance in an anthropogenically disturbed river[J]. Science of The Total Environment, 2019, 655: 61-69. doi: 10.1016/j.scitotenv.2018.11.234 [24] MAYER F, MÜLLER V. Adaptations of anaerobic archaea to life under extreme energy limitation[J]. FEMS Microbiology Reviews, 2014, 38(3): 449-472. doi: 10.1111/1574-6976.12043 [25] 薛银刚, 刘菲, 周璐璐, 等. 基于高通量测序的工业园区地下水和土壤细菌群落结构比较研究[J]. 生态毒理学报, 2017, 12(6): 107-115. [26] POWELL L C, PRITCHARD M F, FERGUSON E L, et al. Targeted disruption of the extracellular polymeric network of Pseudomonas aeruginosa biofilms by alginate oligosaccharides[J]. npj Biofilms and Microbiomes, 2018, 4(1): 1-10. doi: 10.1038/s41522-017-0044-z [27] ZHANG L, HUANG X, ZHOU J, et al. Active predation, phylogenetic diversity, and global prevalence of myxobacteria in wastewater treatment plants[J]. The ISME Journal, 2023, 17(5): 671-681. doi: 10.1038/s41396-023-01378-0 [28] LIU M, CHEN Y, WU Y, et al. Synergistic Action of Plants and Microorganism in Integrated Floating Bed on Eutrophic Brackish Water Purification in Coastal Estuary Areas[J]. Frontiers in Marine Science, 2021, 8. [29] LINDH M V, LEFÉBURE R, DEGERMAN R, et al. Consequences of increased terrestrial dissolved organic matter and temperature on bacterioplankton community composition during a Baltic Sea mesocosm experiment[J]. AMBIO, 2015, 44(3): 402-412. [30] 王慎, 张思思, 许尤, 等. 不同水温分层水库沉积物间隙水营养盐垂向分布与细菌群落结构的关系[J]. 环境科学, 2019, 40(6): 2753-2763. [31] 张菲, 田伟, 孙峰, 等. 丹江口库区表层浮游细菌群落组成与PICRUSt功能预测分析[J]. 环境科学, 2019, 40(3): 1252-1260. [32] ZHANG Q, FU J J, WU Q Y, et al. Build the expressway for the salt-tolerant anammox process: Acclimation strategy tells the story[J]. Journal of Cleaner Production, 2021, 278: 123921. doi: 10.1016/j.jclepro.2020.123921 [33] 鲁翠翠, 蔡文倩, 张翠霞, 等. 植物与微生物协同净化黑臭水体的脱氮性能[J]. 环境科学与技术, 2022, 45(12): 78-88. [34] 李娜英, 韩智勇, 王双超, 等. 多污染源作用下填埋场地下水微生物群落分析[J]. 中国环境科学, 2020, 40(11): 4900-4910. [35] YANG B, WANG Y, LU Y, et al. Effects of simultaneous denitrification and desulfurization and changes of microbial community structure with corncob solid slow-release carbon source under different S/N ratios[J]. Journal of Water Process Engineering, 2022, 47: 102737. doi: 10.1016/j.jwpe.2022.102737 [36] YUAN M M, GUO X, WU L, et al. Climate warming enhances microbial network complexity and stability[J]. Nature Climate Change, 2021, 11(4): 343-348. doi: 10.1038/s41558-021-00989-9 [37] BANERJEE S, SCHLAEPPI K, HEIJDEN M G A van der. Keystone taxa as drivers of microbiome structure and functioning[J]. Nature Reviews Microbiology, 2018, 16(9): 567-576. doi: 10.1038/s41579-018-0024-1 [38] SHAO Q, LIN Z, ZHOU C, et al. Succession of bacterioplankton communities over complete Gymnodinium-diatom bloom cycles[J]. Science of The Total Environment, 2020, 709: 135951. doi: 10.1016/j.scitotenv.2019.135951 [39] 张雅洁, 李珂, 朱浩然, 等. 北海湖微生物群落结构随季节变化特征[J]. 环境科学, 2017, 38(8): 3319-3329. [40] KESHRI J, PRADEEP RAM A S, SIME-NGANDO T. Distinctive patterns in the taxonomical resolution of bacterioplankton in the sediment and pore waters of contrasted freshwater lakes[J]. Microbial Ecology, 2018, 75(3): 662-673. doi: 10.1007/s00248-017-1074-z [41] 朱金山, 秦海兰, 孙启耀, 等. 冬季小流域水体微生物多样性及影响因素[J]. 环境科学, 2020, 41(11): 5016-5026. [42] 杨艳, 王浩, 李凯航, 等. 长江三峡上游水域细菌群落结构与功能预测[J]. 微生物学报, 2022, 62(4): 1401-1415. [43] ZHANG M, LI Y, SUN Q, et al. Correlations of functional genes involved in methane, nitrogen and sulfur cycling in river sediments[J]. Ecological Indicators, 2020, 115: 106411. doi: 10.1016/j.ecolind.2020.106411 [44] FERNANDES S, MAZUMDAR A, BHATTACHARYA S, et al. Enhanced carbon-sulfur cycling in the sediments of Arabian Sea oxygen minimum zone center[J]. Scientific Reports, 2018, 8(1): 8665. doi: 10.1038/s41598-018-27002-2 [45] 杨婉静, 潘杨, 陈越, 等. 胞外聚合物在生物膜同步去除/富集磷酸盐系统中的作用[J]. 环境科学学报, 2021, 41(9): 3437-3445. doi: 10.13671/j.hjkxxb.2021.0086 -




 下载:
下载: