-
有机卤代物包含有机氟化物、氯化物、溴化物和碘化物等,是有机化合物中的某一个或某几个官能团被卤素原子取代而形成的有机物。有机卤代污染物广泛存在于水体、土壤和大气环境中。由于有机卤代物具有脂溶性,在生物体内代谢缓慢,能通过食物链富集,其在生物体内易与酶结合,能够对生物体造成长期的毒性效应,难降解卤代有机污染物的环境危害因此引起世界范围的广泛关注[1-6]。这类有机物污染物种类繁多,例如卤代烃、卤代酚或多氯/溴联苯醚及多氯/多溴联苯等。卤代烃污染物主要包含氟利昂-11(CCl3F)、氟利昂-12(CCl2F2)等。卤代酚类化合物又可分为氯代酚类和溴代酚类污染物。其中,氯代酚类具有较高的毒性、难降解性和生物累积性,是一类广受关注的污染物 [7-9]。2-氯酚(2-CP)、2,4二氯酚(2,4-diCP)、 2,4,6-三氯酚(2,4,6-TCP)和五氯酚(PCP)等则被列入环境优先控制污染物(美国规定包含129种,中国规定包含68种)[10]。由于氯酚本身的苯环结构和氯原子的存在,氯原子的p轨道电子和苯环上π电子形成了稳定的共轭体系,因此氯酚属持久难降解污染物,难以通过常规水处理方法去除。溴代苯酚类化合物常被用作阻燃剂添加在塑料制品中,常见的有2,4,6-三溴酚(2,4,6-TBP)、2,4-二溴酚(2,4-DBP)等。近几十年,溴代苯酚类化合物的大量使用,导致它们广泛地存在于环境介质中,同时也被发现其存在于哺乳动物甚至人体内。而多氯联苯醚、多溴联苯醚、多氯联苯和多溴联苯等污染物在环境中也被广泛地检测到,并且,它们可能转化为毒性更强的卤代二噁英类物质 [11]。因此,有机卤代污染物的危害问题亟待解决。难降解卤代有机污染物的降解去除方法是当前环境领域研究的热点。生物还原脱卤方法是当前研究比较广泛的方法,然而存在不能彻底脱卤,从而产生具有较高毒性的含卤中间产物的问题 [12-14]。因此,卤代有机污染物的深度脱卤具有重要的环境意义[15]。
光催化能够以太阳能为能量来源,以O2或 H2O2等做为“绿色”氧化剂,通过产生·OH、O2−· 等含氧活性物种,引发有机污染物分子的降解[16]。其中,·OH具有极高的氧化能力(2.73V vs. NHE),几乎能够氧化所有难降解的有机污染物,并将其最终矿化为CO2和H2O;·OH 与有机物的反应快速,多数有机物在此过程的反应速率常数高达109 ms−1 [17-18]。同时,光催化剂的导带电子具有良好的还原性质,能够通过电子转移的方式对有机污染物进行还原转化。 GHOSH et al[19]在2014年报导了PDI(N, N'-bis(2,6-diisopropylphenyl)-3,4,9,10-perylenetetracarboxylic diimide)通过双光子激发之后具有了强还原性能,能够实现多种稳定卤代物的转化。LU et al[20]用芘衍生物在光激发条件下实现多氟取代烃加氢脱氟反应。金属氧化物半导体光催化也是一种有效的还原脱卤方法,通过醇类等作为电子和质子供体,多种含卤有机污染物能够实现不同程度的脱卤反应[21]。在众多的半导体光催化剂中,锐钛矿TiO2具有价廉、无毒和光催化活性高等诸多优势,是当前最有应用前景的光催化剂之一[22]。通过对TiO2催化剂进行贵金属纳米颗粒负载,有效提高光生电荷分离效率[23]。与此同时,利用贵金属表面的催化作用,进一步降低卤代有机污染物分子的碳-卤健断裂反应能垒[24-25]。基于此,本文设计了负载Au、Ag、Pt和Pd等贵金属纳米颗粒的TiO2复合光催化材料,分析了多种卤代有机污染物的降解行为,并对反应机理进行了阐释。
-
卤代有机化合物(北京百灵威化学品公司),光催化剂P25(80%锐钛矿、20%金红石;表面积:50 m2/g)(Degussa公司),甲醇,HPLC级(Dikma, USA)。以上试剂均直接使用,没有进一步纯化。实验用水为二次蒸馏的去离子水。
-
实验所用光源为自制100 W汞灯,用滤光片滤去波长<360 nm的紫外光。反应瓶为50 mL圆柱形玻璃瓶。TiO2钛表面贵金属纳米颗粒的负载采用之前报道的光还原沉积的方法[25]。本实验中,首先配制1 mmol/L有机卤代物的甲醇溶液,然后用甲醇/H2O的混合液(V=1∶3)稀释至100 μmol/L。将0.2 g/L的Pd-TiO2或TiO2颗粒加入到盛有25 mL有机卤代物甲醇/水溶液的反应瓶中,形成有机卤代物/Pd-TiO2和有机卤代物/TiO2的悬浮液。用橡胶塞、铝盖密封,在水中超声2 min,使悬浮液分散均匀。光照前需向反应瓶中通入氩气30 min。除氧之后,反应液在暗处静置搅拌1 h达到吸附平衡。光照反应过程中,每隔一定的时间从反应液中抽取1 mL的样品,过滤去除催化剂,清液通过HPLC和GC-μECD进行有机污染物的定量分析。HPLC仪器参数:20 μL定量环、Dionex P580泵、UVD 340s二极管阵列检测器、Inertsil ODS-3 5 μm column (250 mm× 4.6 mm) C-18反向柱。
-
以Pt-TiO2、Ag-TiO2、Pt-TiO2和Au-TiO2为光催化剂,测试了其在一系列有机卤代物,如卤代烃类、芳香卤代物等代表卤代有机污染物的催化降解性能。各催化剂对于多种有机卤代物在10 min内的降解率,见表1。
在所有的催化剂中,以Pd-TiO2的催化性能最高,所选的卤代有机污染物在10 min内都可以降解。Ag-TiO2能够对一溴代苯和五氯代苯实现快速降解,其性能接近Pd/TiO2催化剂的催化性能,同时对五溴代酚和溴苯具有很高的活性,10 min内可完全去除有机污染物。Pt-TiO2仅能够实现溴苯的快速降解。Au-TiO2和TiO2在10 min内不能降解任何一种有机卤代污染物。Pd-TiO2所具有相对广泛的底物适应性,在接下来的机理研究中采用Pd-TiO2作为光催化剂。
-
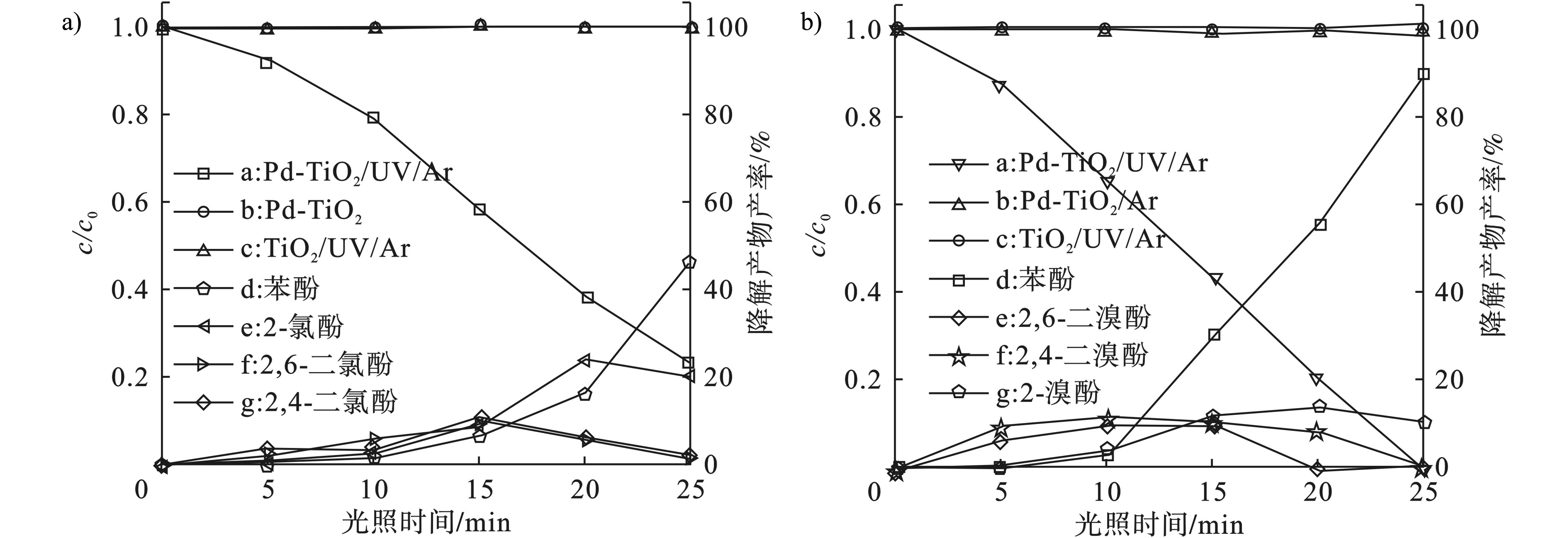
2,4,6-TCP和2,4,6-TBP的降解曲线,见图1。
图1a中的曲线b可知,在暗反应条件下,2, 4, 6-TCP不发生任何降解;图1a中的曲线c可知,只有TiO2也不能将2, 4, 6-TCP脱氯,这说明催化反应体系中光和Pd纳米颗粒的关键作用。图1a中的曲线a可知,2, 4, 6-TCP在Pd-TiO2的催化作用下,无氧条件下光照25 min,降解率达80%。同时,对污染物降解过程中的中间产物进行了分析发现,在反应5 min时,体系中2, 4-二氯酚和2, 6-二氯酚同步产生,即邻位和对位的氯原子容易被还原脱除。随着光照时间的延长,这两种物质的量逐渐增加,但到7.5 min时,反应体系中2-氯酚和苯酚开始产生。反应到20 min时,2-氯酚会逐渐脱除氯原子而转变为苯酚。整个反应中过程中,苯酚为还原脱卤的最终产物。
图1b为2, 4, 6-TBP的降解曲线,它的降解情况与2, 4, 6-TCP相似,但它的反应速率比2, 4, 6-TCP快。图1b中曲线a可知,25 min时,2, 4, 6-TBP完全转化,生成2, 6-二溴酚、2, 4-二溴酚和2-溴酚或苯酚。图1b中曲线d、 e、 f和g分别为苯酚、2, 6-二溴酚、2, 4-二溴酚和2−溴酚的产率变化曲线,它们的变化趋势与2, 4, 6-TCP的产物变化趋势相同。
以上结果表明,对于三氯或三溴苯酚,它们都可以在Pd-TiO2光催化过程中完全降解,并且脱除卤原子无选择性,这与Pd-TiO2降解多溴联苯醚(PBDEs)时所表现的低选择性一致。
-
4-氯酚和4-溴酚降解随光照时间变化趋势,见图2。
在Pd-TiO2体系中,4-氯酚在光照10 min后降解约50%。同时,图2a中曲线c为降解过程中所生成的苯酚产物的产率变化曲线,可以看出,随着反应时间的延长,4-氯酚的量逐渐减少,苯酚的量逐渐增多。图2a中曲线b为相同条件下利用TiO2降解还原4-氯酚,不发生任何反应。图2b为4-溴酚的降解曲线,溴酚的降解速率比氯酚快,溴酚在10 min时降解率达90%,见图2b曲线a。降解过程产生苯酚,见图2b曲线c。TiO2光催化条件下不能实现4-溴酚光还原脱溴,见图2b曲线b。
以上这些实验研究表明,对于卤代酚类污染物而言,氯代酚类要比溴代酚类难降解,但再Pd-TiO2光催化条件下,卤代酚类污染物均可在短时间发生还原脱卤。
-
为进一步验证Pd-TiO2对于有机卤代污染物降解的通用性,本研究进一步研究了卤代苯类污染物的降解性能,见图3。
4-氯苯在降解初期,脱氯速率较慢,而光照1.5 min后,降解速率加快,6 min后降解达70%以上,见图3a曲线a。4-溴苯在经过6 min光照后,降解了90%左右,比4-氯苯稍快,见图3b曲线a。在4-氯苯和4-溴苯降解的过程中,同样产生了苯,且苯的量随着反应的进行不断增加。
-
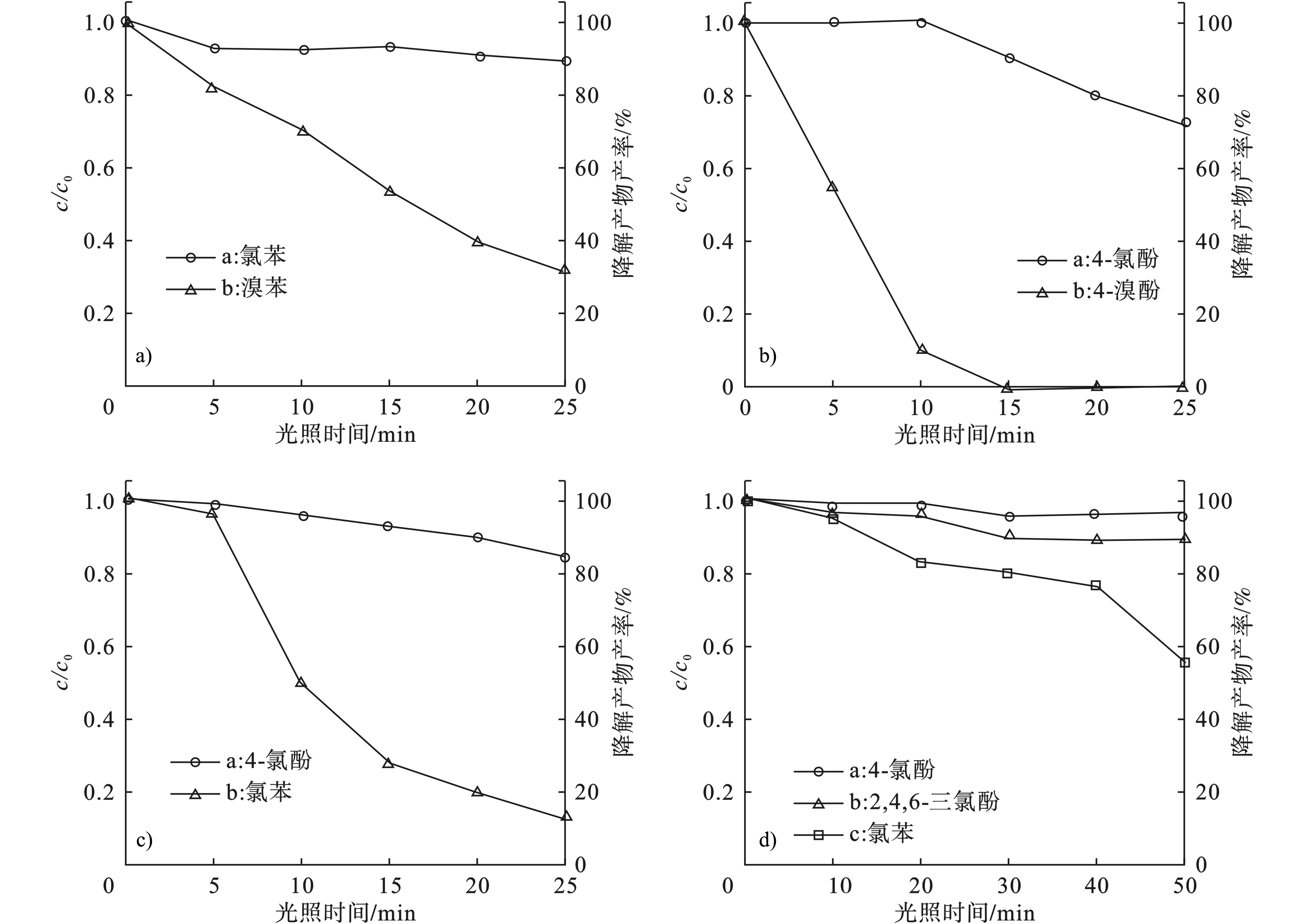
在Pd-TiO2光催化作用下,氯代有机污染物的降解速率均比溴代有机物污染物慢。为了进一步分析了在多种有机污染物同时存在的条件下,各种污染物分子的降解差异,本研究选择了几种有机卤代污染物,将它们按照1:1的摩尔比进行混合,然后进行了Pd-TiO2催化剂选择性的降解研究。其中,本研究选择了4个混合体系,分别是氯苯和溴苯、对氯酚和对溴酚、对氯酚和氯苯以及对氯酚、2,4,6-三氯酚和氯酚混合底物,其降解曲线,见图4。
图4a可知,在同一体系中,当光照25 min时,溴苯降解了70%,而氯苯在光照5 min时降解了10%,但随着光照时间的延长,氯苯基本不再进一步降解。由此可见,当氯苯和溴苯混合在一起时,Pd-TiO2催化剂会优先降解溴苯,且溴苯的脱溴过程在一定程度上抑制了氯苯的进一步降解。图4b为对氯酚和对溴酚共存的降解曲线。与氯苯和溴苯体系相比,同一体系中对氯酚和对溴酚的降解行为具有更大的差异。如图4b所示,15 min时,对溴酚已经完全降解,而对氯酚只降解了10%。且降解初期,对氯酚降解速率极为缓慢。溴代有机物优先降解的现象可能是由于C—Br的键能要比C—Cl小,更容易断裂。图4c为对氯酚和氯苯混合体系的降解曲线。与前两种体系不同,该体系不存在Cl或Br的选择性。结果表明,Pd-TiO2会优先降解氯苯。当光照25 min时,氯苯降解了90%左右,而对氯酚只降解了10%左右。但反应初期存在诱导期,氯苯降解得很慢,而在5 min之后降解速率加快。氯苯和对氯酚的降解曲线差异可能是由于两种不同的结构类型导致的。对氯酚结构中,Cl的对位存在羟基基团,而它较容易吸附在TiO2的表面,从而使对位的氯原子远离催化剂表面,因而不利于脱氯反应。图4d为3种底物,即4-氯酚、2, 4, 6-三氯酚以及氯苯的混合物。3种底物的降解速率顺序为氯苯>2, 4, 6-三氯酚> 4-氯酚,但是速率相差不大,即使降解最快的氯苯,在50 min时也只降解了50%左右,这要比2种底物体系的降解速率慢很多,可能是由于底物越多,它们之间的竞争吸附越明显,不利于每种底物的降解。但其中氯苯和对氯酚的降解快慢与双底物体系中的趋势相同。而对于2, 4, 6-三氯酚,由于它所带的氯原子较多,因此与对氯酚相比,它与催化剂表面接触的可能性更大,因此它的降解速率相比对氯酚较快,但由于羟基的影响,又使得它的脱氯速率慢于氯苯。
通过对以上多种共存卤代污染物体系的降解过程研究可以看出,在此体系中,Pd-TiO2光催化剂不会同步快速降解几种卤代物,而是选择性地优先降解其中的一种。
-
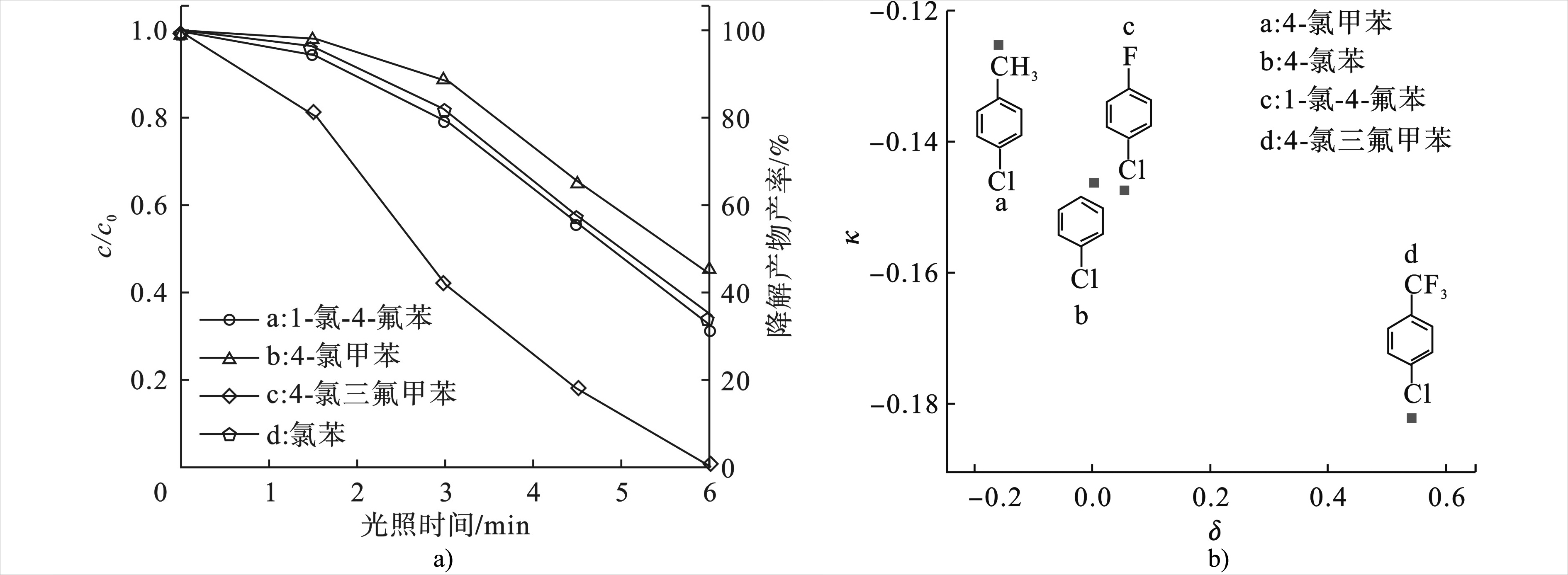
为了进一步分析芳环电子结构对于脱卤反应的影响,本研究采用哈密特曲线来进行反应机理分析。选取了4种底物作为研究对象,为避免某些基团在催化剂表面的吸附效应,例如羟基基团等,本研究所选的几种底物均不含有亲水性的基团,为1-氯-4氟苯、4-氯甲苯、4-氯三氟甲苯和氯苯。4种底物在Pd-TiO2作用下的降解曲线,见图5。
图5a可知,4种底物的降解顺序为4-氯三氟甲苯>1-氯-4氟苯>氯苯> 4-氯甲苯,这与氯原子对位基团的电负性相关。其中,—CF3、—F均为吸电子基团,—CH3为供电子基团,因吸电子基团有利于脱卤反应的进行,所以得到以上降解顺序。此外,图中几条降解曲线都存在诱导期的阶段,故在拟合曲线时,统一选择降解过程中得后4个点。所有曲线都可以用一级反应动力学进行拟合,拟合曲线的斜率即为4种底物的反应速率常数k。而4种底物的δ值(取代基常数)分别为4-氯三氟甲苯0.17、1-氯-4氟苯0.06、氯苯0、4-氯甲苯0.54。图5b即为4种底物的δ值与它们的反应速率常数k之间的关系图,这说明C—X键的裂解是Pd-TiO2体系降解有机卤代物的决速步骤。
-
有机卤代物具有严重的环境危害。Pd-TiO2、Pt-TiO2和Ag-TiO2等光催化剂在有机卤代污染物降解过程中表现出不同的催化活性。其中,Pd-TiO2具有最好的光催化活性和广泛的污染物适应性。机理研究表明,污染物芳环电子密度与取代基的性质对于其光催化降解性能具有直接的影响。给电子取代基对于脱卤反应有利。多种卤代物在同一体系中进行降解,Pd-TiO2会选择性地优先降解其中的一种最易脱卤的污染物,通常溴代物要比氯代物更容易降解。
Pd-TiO2光催化高效降解有机卤代污染物
Highly efficient degradation of organohalides pollutants by Pd/TiO2 photocatalyst
-
摘要: 环境中有机卤代污染物具有浓度低、难降解、高毒性和生物富集性等特点,因此对有机卤代污染物的环境行为的理解和去除技术的研究具有非常重要的意义。Pd/TiO2光催化剂在卤代有机污染物的降解过程中表现出高效的催化活性。研究表明,光催化降解活性同芳环电子密度及其取代基性质有密切的联系;给电子基团对于光催化还原脱卤反应有利;相同条件下,脱溴反应速率高于脱氯反应速率。Abstract: The recalcitrant organohalides pollutants in the environment have the characteristics of low concentration, hardly degradation, extremely toxic and accumulation in the biosphere. The research of the environmental behaviors of the organohalides and the degradation techniques is necessary. Pd/TiO2 photocatalyst is highly active for the organohalides pollutants degradation. Present study shows the degradation performance is dependent on the electron density of the aromatic ring as well as the properties of the substation groups. The electron-donating groups on the aromatic ring contribute positively to the cleavage of the carbon-halogen bond. Meanwhile, the debromination reaction rate is greater than that of dechloridation under the same condition.
-
Key words:
- organohalide /
- degradation /
- photocatalysis /
- reaction mechanism /
- titanium dioxide
-

-
表 1 各种催化剂对于多种有机卤代污染物的降解性能对比
污染物 降解率/% TiO2 Pd-TiO2 Ag-TiO2 Pt-TiO2 Au-TiO2 2,4,6-三氯酚 0 21.6 0 0 0 4-氯酚 0 19.9 0 0 0 五氯酚 0 58.7 0 0 0 氯苯 0 100.0 0 0 0 三氯乙烯 0 42.0 0 0 0 三氯乙酸 0 12.0 0 0 0 五氯苯 0 59.8 57.1 0 0 2,4,6-三溴酚 0 36.8 0 0 0 2-溴-4-氯酚 0 12.0 0 0 0 4-溴酚 0 88.6 0 0 0 五溴酚 0 43.4 100.0 0 0 4-溴苯 0 100.0 100.0 100.0 0 三溴乙酸 0 73.6 74.5 0 0 2,4,6-三溴苯 0 51.1 4.6 0 0 注:反应条件:有机卤代物100 μmol/L;溶剂,V (H2O)/V (CH3OH) =3:1;波长>360 nm;反应10 min,无氧条件。 -
[1] 戴树桂. 环境化学[M]. 北京: 高等教育出版社, 2002. [2] KHALIL M, RASMUSSEN R A. Atmospheric methyl chloride[J]. Atmospheric Environment, 1999, 33(8): 1305 − 1321. doi: 10.1016/S1352-2310(98)00234-9 [3] 朱虹, 孙杰, 李剑超. 印染废水处理技术[M]. 北京: 中国纺织出版社, 2004. [4] WANG W, WU Y. Sequential coupling of bio-augmented permeable reactive barriers for remediation of 1, 1, 1-trichloroethane contaminated groundwater[J]. Environmental Science and Pollution Research, 2019, 26: 12042 − 12054. doi: 10.1007/s11356-019-04676-3 [5] SAMANIPOUR S, DIMITRIOU-CHRISTIDIS P, NABI D, et al. Elevated concentrations of 4-bromobiphenyl and 1, 3, 5-Tribromobenzene found in deep water of Lake Geneva based on GC×GC-ENCI-TOFMS and GC×GC-μECD[J]. ACS Omega, 2017, 2(2): 641 − 652. doi: 10.1021/acsomega.6b00440 [6] ZHOU C, PAGANO J, MCGOLDRICK D J, et al. Legacy polybrominated diphenyl ethers (PBDEs) trends in top predator fish of the Laurentian Great Lakes (GL) from 1979 to 2016: Will concentrations continue to decrease?[J]. Environmental Science & Technology, 2019, 53(12): 6650 − 6659. [7] ASPLUND G, GRIMVALL A. Organohalogens in nature[J]. Environmental Science & Technology, 1991, 25(8): 1346 − 1350. [8] MAJEWSKI M S , CAPEL P D. Pesticides in the atmosphere: Distribution, trends, and governing factors[M]. Ann Arbor Press, Chelsea, Michigan, 1995. [9] SIMONICH S L, HITES R A. Global distribution of persistent organochlorine compounds[J]. Science, 1995, 269(5232): 1851 − 1854. doi: 10.1126/science.7569923 [10] 王昭, 石建省, 张兆吉, 等. 我国“水中优先控制有机物”对地下水污染的预警性研究[J]. 水资源保护, 2009(1): 90. doi: 10.3969/j.issn.1004-6933.2009.01.024 [11] STRINGER R , JOHNSTON P . Chlorine and the environment: An overview of the chlorine industry [M]. Kluwer Academic Publishers, Dordrecht, 2001. [12] AMOS B K, SUCHOMEL E J, PENNELL K D, et al. Microbial activity and distribution during enhanced contaminant dissolution from a NAPL source zone[J]. Water Research, 2008, 42(12): 2963-2974. doi: 10.1016/j.watres.2008.03.015 [13] AMOS B K, SUCHOMEL E J, NELL K D P, et al. Spatial and temporal distributions of geobacter lovleyi and dehalococcoides spp. during bioenhanced PCE-NAPL dissolution[J]. Environmental Science & Technology, 2009, 43(6): 1977-1985. [14] LOHNER S T, TIEHM A. Application of electrolysis to stimulate microbial reductive PCE dechlorination and oxidative VC biodegradation[J]. Environmental Science & Technology, 2009, 43(18): 7098-7104. [15] WANG Y, WEI Y, SONG W, et al. Photocatalytic hydrodehalogenation for the removal of halogenated aromatic contaminants[J]. ChemCatChem, 2019, 11: 258-268. doi: 10.1002/cctc.201801222 [16] SCHNEIDER J, MATSUOKA M, TAKEUCHI M, et al. Understanding TiO2 photocatalysis: mechanisms and materials[J]. Chemical Reviews, 2014, 114(19): 9919-9986. doi: 10.1021/cr5001892 [17] CHOI W. Pure and modified TiO2 photocatalysts and their environmental applications[J]. Catalysis Surveys from Asia, 2006, 10: 16-28. doi: 10.1007/s10563-006-9000-2 [18] ROSS A B , FARHATAZIZ A. Selective specific rates of reactions of transients in water and aqueous solutions. Part III. Hydroxyl radical and perhydroxyl radical and their radical ions[M]. National Standard Reference Data Series, National Bureau of Standards, 1977. [19] GHOSH I, GHOSH T, et al. Reduction of aryl halides by consecutive visible light-induced electron transfer processes[J]. Science, 2014, 346(6210): 725-728. doi: 10.1126/science.1258232 [20] LU J Z, KHETRAPAL N S, JOHNSON J A. et al. "π-Hole–π" Interaction promoted photocatalytic hydrodefluorination via inner-sphere electron transfer[J]. Journal of the American Chemical Society, 2016, 138: 15805-15808. doi: 10.1021/jacs.6b08620 [21] CHEN C, MA W, ZHAO J. Semiconductor-Mediated photodegradation of pollutants under visible-light irradiation[J]. Chemical Society Reviews, 2011, 39: 4206-4219. [22] FRANK S N, BARD A J. Heterogeneous photocatalytic oxidation of cyanide ion in aqueous solutions at titanium dioxide powder[J]. Journal of the American Chemical Society, 1977, 99: 303-304. doi: 10.1021/ja00443a081 [23] GEIGER C L , CARVALHO-KNIGHTON K , NOVAES-CARD S , et al. A review of environmental applications of nanoscale and microscale reactive metal particles[M]. ACS Symposium Series, American Chemical Society: Washington, DC, 2010. [24] ZHANG Z, YU Y, WANG P. Hierarchical top-porous/bottom-tubular TiO2 nanostructures decorated with Pd nanoparticles for efficient photoelectrocatalytic decomposition of synergistic pollutants[J]. ACS Appl Materials and Interfaces, 2012, 4(2): 990-996. doi: 10.1021/am201630s [25] LI L, CHANG W, WANG Y. et al. Rapid photocatalytic deep-debromination of polybrominated diphenyl ethers on Pd-TiO2: intermediates and pathways[J]. Chemistry:A European Journal, 2014(20): 11163-11170. -



 下载:
下载: