-
N-(1,3-二甲基丁基)-N'-苯基-对苯二胺(防老剂6PPD)是橡胶制品加工过程中一种常见的高效防老剂,具有防止热氧老化、延长使用寿命的功效[1]. 6PPD在苯二胺类防老剂中使用量占比高达60%—70%[2]. 然而随着轮胎磨损,防老剂6PPD从轮胎碎屑(tire wear particles,TWP)中释放并扩散到环境中,造成潜在的环境污染. 2021年,Science期刊首次报导了6PPD的主要转化产物6PPD-醌(6PPD-Q)对太平洋银鲑造成急性死亡,这一现象被命名为“城市径流死亡综合症”[3]. 6PPD-Q还对其他水生生物,包括虹鳟鱼、溪鳟鱼、斑马鱼幼虫等也显示出明显的生物毒性[4]. 还有研究发现,6PPD-Q对幼年银鲑的中位致死浓度LC50仅为95 ng∙L−1,比6PPD的LC50(250 mg∙L−1)低3个数量级以上[5]. 且6PPD-Q在水环境中的半衰期是6PPD半衰期的至少5倍,这表明6PPD-Q不仅毒性更强,而且具有更高的环境持久性[6]. 鉴于6PPD-Q的这些特性,人们自然关注6PPD在环境中可能产生的其他转化产物(transformation products,6PPD-TPs)以及他们的潜在毒性.
目前,研究人员发现6PPD及其转化产物不仅存在于城市径流和邻近水域[7],还广泛分布于空气颗粒物[8 − 9]和土壤[10]中. 通过对环境样品、食物样品和人体尿液进行前处理,分析6PPD及其转化产物6PPD-TPs,进一步明确它们在环境中的分布范围、暴露水平以及迁移和转化机制,对于理解这些化合物在复杂环境介质中对生物行为的影响,以及它们与环境污染和人类健康之间的关系至关重要. 此外,德国联邦风险研究所在2022年10月发布了针对6PPD迁移的实验标准,明确规定食品或食品模拟物中的6PPD迁移量不得超过0.3 mg∙L−1. 相比之下,国内在这一领域尚未建立相应的标准. 鉴于上述情况,建立全面而综合的仪器分析方法,用于分析防老剂6PPD及其转化产物6PPD-TPs,对于形成相关标准体系、维护生态环境和保障食品质量安全至关重要[11].
本文综合评述了水域/土壤/大气粉尘等环境介质、食物样品和人体尿液中6PPD及6PPD-TPs提取的前处理技术,以及主要的检测方法[12],如质谱、色谱、色谱-质谱联用技术以及电子自旋共振等;同时探讨了6PPD及6PPD-TPs检测技术的未来发展方向.
-
鉴于6PPD及其转化产物6PPD-TPs(6PPD-Q、N-甲酰基-6PPD、N-(1,3-二甲基丁基)-N'-苯基对醌二亚胺等)的潜在毒性和分析检测需求,本部分综述了橡胶、空气粉尘和土壤等样品的前处理技术,在萃取溶剂类型、操作成本、处理繁简性、方法准确度等方面进行讨论,为后续的仪器测定奠定基础.
-
橡胶样品中6PPD的前处理方法中最常用的是有机溶剂萃取法. 单独使用乙腈作为溶剂时,信号响应程度一般;而采用二氯甲烷进行萃取时,提取液的浑浊性增加了过滤难度. 为了解决这些问题,研究者将乙腈和二氯甲烷以6 : 1(V:V)混合使用,既提高了6PPD的萃取效率,又保持了提取液的清晰度,达到了最佳的提取效果[13]. 随后原晓喻等在此基础上进一步优化了前处理方法,通过常温浸泡过夜和恒温超声辅助,有效减少了6PPD在萃取过程的挥发和化学转化,获得了更为准确和高效的提取结果[12].
-
在空气粉尘样品中采集6PPD时,通常采用直接取样法[14]. 室外样本使用25 μm孔径的尼龙采气袋或真空吸尘器作为采集工具,室内样本用毛刷将粉尘样本集中扫至铝箔上,再密封运输[15]. 为避免污染,预先用无水乙醇对采集器进行彻底清洗[16]. 采集后的样品通过不锈钢网筛分,随后储存于-20 ℃条件下以备后续使用[17]. Huang等[14]在筛分后的粉尘样品中加入内标物(6PPD添加二苯甲酮-d10,6PPD-Q添加13C6-6PPD-Q),以确保检测方法的准确性和稳定性. 依次使用乙腈、丙酮/己烷混合溶剂(1:1,V:V)对样品进行超声提取,随后通过离心和氮气吹扫浓缩至1 mL以下. 将浓缩后的样品用去离子水复溶,过滤后上机备用.
浸出实验是另一种有效的前处理方法,被Furumai等应用于粉尘样品的分析中. 步骤为:将粉尘样品置于棕色玻璃瓶中,加入适量去离子水,调整样品的最终浓度为
1000 mg∙L−1. 在室温下,使用反向搅拌器充分振荡,确保样品均匀浸出. 需要指出的是,实验室所用样本浓度比城市径流样本中浓度高1—2个数量级,以提高分析方法的灵敏度[18]. -
降雨事件可能加剧道路邻近土壤的6PPD污染问题. 为减少降雨前扬尘的潜在干扰,土壤采样通常在距离主干道10 m处的路面进行. 采样后的土壤样品中添加内标物二苯胺-d10,并依次用二氯甲烷、乙腈为溶剂,通过超声辅助萃取法提取土壤中的6PPD. 将两种溶剂的萃取液合并,并使用氮气流吹扫浓缩至干燥状态. 最后,将干燥后的提取物用乙腈重新溶解,通过过滤去除杂质,准备上机[10].
-
鱼肉和蜂蜜富含碳水化合物、蛋白质、氨基酸和多不饱和脂肪酸等重要的营养成分,对维持健康均衡的饮食起着重要作用,通常被用作分析环境污染物的“哨兵”[19],以评估污染物通过食物链对人类造成的生物积累风险[20]. 目前,QuEChERS(Quick,Easy,Cheap,Effective,Rugged和Safe)前处理技术已被广泛应用于鱼肉和蜂蜜样品中有害物质的提取[21],为环境污染物的检测提供了一种有效的样品前处理方法.
-
样品匀浆后,与乙腈按1:10(V:V)混合. 乙腈作为萃取溶剂,用于纯化蛋白;随后向混合物中加入NaCl和无水MgSO4,通过振荡充分混匀、离心、取上清液. 将上清液依次通过固相萃取柱C18、PSA(乙二胺基-N-丙基)、以及无水MgSO4进行净化处理. 经过混匀和离心后,收集上清液,浓缩、定容后储存备用[22].
-
将样品和乙腈按1:2(V:V)混合,并加入适量的NaCl和去离子水,以促进蛋白质沉淀. 接着通过振荡混匀、离心、取上清液等操作. 并依次用PSA和无水MgSO4进行固相萃取,剩余步骤与鱼肉样品的前处理方法相同.
-
Yuan等选用了固相萃取柱(Captiva EMR-Lipid,安捷伦)对牛奶样品中6PPD和6PPD-Q进行提取和纯化. 首先将牛奶和含5%甲酸的乙腈按1: 2(V:V)进行混合,并通过离心分离、获取上清液. 随后利用固相萃取小柱对上清液富集,收集并纯化目标化合物,为后续分析步骤做准备[12].
-
对人体尿液中6PPD及6PPD-Q的暴露量和代谢情况进行考察,旨在为评估它们对人类健康的影响奠定基础[23 − 24]. Du等在2022年首次对人类尿液中的6PPD及6PPD-Q进行了监测,研究涉及中国南方的三类不同人群:普通成年人、儿童和孕妇,其尿液样本均在清晨采集,并迅速冷冻于-40 ℃以保持样本的完整性. 为控制潜在的采样污染,还设置了空白对照组. 尿液样本的前处理采用了液-液萃取法,在此过程中加入了内标物13C6-6PPD-Q、抑制剂谷胱甘肽溶液和NaCl. 样本经过涡旋混匀、超声提取、离心后,收集上清液,并通过氮吹浓缩和过滤等步骤,为后续的分析工作做好准备[25].
-
在环境科学研究中,质谱(MS)技术以其卓越的灵敏度和分辨率,为获取全面准确的环境信息提供了重要支持,在环境污染物监测领域发挥了关键作用[26 − 27]. 质谱仪作为该技术的核心工具,其性能在很大程度上取决于离子源和质量分析器这两个关键部件. MS技术以分子离子的质荷比(m/z)为检测对象,辅以不同离子源产生的特异性碎片离子,这些离子为后续的分子质量和分子结构提供了关键信息. 质量分析器将离子源产生的离子按m/z顺序分开并排列成质谱图.
Monaghan等开创性地提出了一种与串联质谱法相结合的直接膜采样策略[28],该策略实现了对城市地表水和雨水中6PPD-Q的高通量检测,极大简化了样品前处理操作和分离流程. 该方法核心在于半透性中空纤维膜,它能有效地将样品中的有机物与干扰基质(如盐和颗粒物等)直接分离. 通过这种方式,有机物连续不断地通过中空纤维膜传输至离子源,实现实时、高效地检测. 所有定量工作均使用ESI三重四极杆质谱仪(珀金埃尔默Q-Sight 220),雾化气体压力为120 psi,HSID源温度为320 ℃,毛细管电压为4 kV. 6PPD和6PPD-Q标准品以甲醇做溶剂,直接注入MS/MS,驻留时间为
1000 ms. 定性分析则采用赛默飞Orbitrap Exploris 120质谱仪,辅以电喷雾软电离(electrospray ionization, ESI)和高分辨率精确质量(high-resolution accurate mass, HRAM)技术进行鉴定. 采用特定的定性离子对(m/z 299→243、256、100)和定量离子对(m/z 299→215)迅速且准确地对复杂样品中ng∙L−1级别的6PPD-Q进行定性和定量分析. 该技术结合“溶解/吸附实时监控”策略,为传统的PPDs分析方法注入了新的活力,提供了强有力的技术支持. 这一创新策略不仅提高了检测效率,还保证了数据的准确性和可靠性,为环境监测和污染控制等领域的研究和应用带来了显著的便利和优势. 除此之外,质谱技术在探究人体内6PPD及6PPD-Q的毒理学影响方面同样展现出独特的价值. MS技术可以精确地鉴定6PPD/6PPD-Q与DNA或蛋白质之间形成的加合产物,对深入研究6PPD、6PPD-Q的生物毒性机制具有十分重要的意义[29]. -
橡胶工业中,6PPD的添加量对于橡胶的性能和轮胎的耐久性具有至关重要的影响[30]. 当6PPD的添加量超过其在橡胶中的溶解度时,极易引发喷霜现象[31];若6PPD的添加量低于某一特定限值,橡胶的抗氧化性能将受到削弱,导致轮胎在使用过程中更易受到氧化降解的影响,从而缩短其使用寿命. 轮胎磨损过程释放出6PPD,若未经妥善处理将对空气、水域和土壤造成潜在污染,对生态环境构成威胁. 因此,通过色谱分析手段,了解6PPD在橡胶中的分布和变化,探究6PPD含量变化与轮胎耐久性之间的关系,为橡胶工业提供科学的配方依据,对提高轮胎性能具有重要的现实意义[32].
气相色谱-氢火焰离子化法(GC-FID)是GB/T21841—2008《防老剂6PPD》中的唯一方法. 相关参数如下:SE-54毛细管色谱柱(含5%苯基的甲基硅氧烷);载气:氢气;流速:1.9 mL∙min−1;检测器温度:300 ℃;程序升温:初始温度90 ℃,9 ℃·min−1速率升至280 ℃,保持10 min. 采用面积归一法进行定量分析.
高效液相色谱法(HPLC)以其准确性高、稳定性强的特点,在工业生产中得到了广泛应用,比如监测橡胶中防老剂6PPD的含量. 王志伟等采用高效液相色谱-二极管阵列检测器(HPLC-DAD)技术,实现了橡胶中防老剂6PPD残留量的精确测定. 当流动相选择乙腈/无水乙酸钠溶液(6:4,V:V)时,显著提升了6PPD与橡胶中其他杂质的分离效果. 该法弥补了防老剂6PPD现有检测方法的不足,同时具备前处理简便、检测周期短、灵敏度高的优势. 其检出限和定量限显著降低,使得快速、准确的定量检测成为可能[33],为橡胶工业的质量控制与产品研发提供了强有力的技术支持. 此外,在原晓喻等的研究中,针对食品接触用橡胶奶管中防老剂6PPD的迁移行为,建立了气相色谱(GC)、高效液相色谱法(HPLC)和紫外分光光度法(UV-Vis)在内的3种检测方法,并深入探讨了这些方法的适用性和有效性. 通过这一综合性的研究,他们为食品接触材料的安全评估提供了重要的技术支持和实验依据[34].
-
色谱分离法具有减少“离子抑制”并消除基质效应的优点. MS技术可在较大质量范围内实现高灵敏鉴别,采用一级质谱(MS1)及二级质谱(MS2)对碎片离子进行扫描,实现对目标化合物的高效识别,进一步提高了检测的信噪比[35]. 新型电离技术的发展以及离子源条件的优化有望提高电离效率和目标物检测的灵敏度. 因此,色谱-质谱联用技术已成为研究环境基质中新兴污染物分布、含量以及初步探究其生态毒性的重要工具[36 − 37];这些技术不仅能够在复杂水平上对6PPD及其转化产物(6PPD-TPs)进行精确识别、量化与追踪,还能为公众和政府监管机构提供关于污染物环境危害的宝贵信息,对于控制污染物、减轻环境风险具有重要意义[38].
-
气相色谱法-质谱联用法(GC-MS)是一种高效且精确的分析技术,它结合了气相色谱的高分离能力和质谱的高鉴定能力. 其中,气相色谱可避免样品中其他成分对待测样品的干扰,具有高灵敏度、检测速度快、高准确度的优点,并实现挥发性物质的快速鉴定. 基于待分离样品的性质,优化气相色谱的气化室温度、进样模式、柱温、载气流速等分离条件.
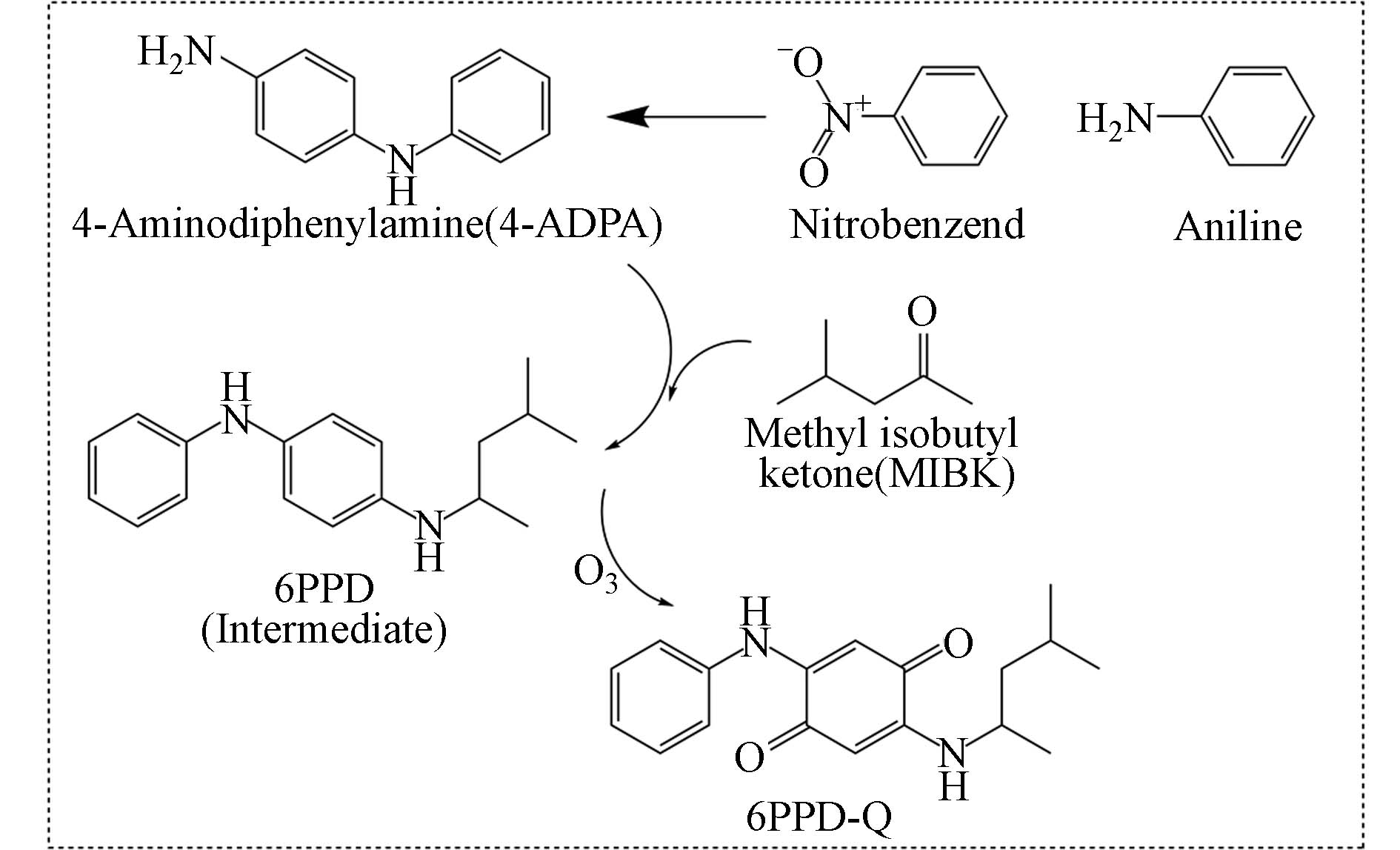
苯胺和甲基异丁基酮是制备6PPD的两种主要原料,均为高毒性物质,不利于人体健康. 张清智等建立了顶空气相色谱串联质谱法(HS-GC/MS)测定防老剂6PPD中甲基异丁基酮和苯胺的方法,并分析防老剂6PPD在特定温度下的挥发物. 使用安捷伦7000C型GC-MS联用仪,配备7697A型顶空自动进样器和DB-5毛细管柱(60 m × 0.25 mm,2.5 μm). 升温程序为:初始温度50 ℃,保持3 min,以12 ℃·min−1速率加热到280 ℃,恒温保持10 min. 采用电子电离源(electron ionization,EI),离子源温度:230 ℃,离子传输管温度:280 ℃,扫描范围30—450 amu. 此方法测得的甲基异丁基酮和苯胺的回收率为90%—110%,相对标准偏差为4.4%—8.0%,方法检出限为1 µg∙g−1,该方法的检出限较低,回收率、灵敏度和精密度较高,对绿色环保轮胎的生产加工提供了方法支持[39].
此外,GC-MS法还可对防老剂6PPD进行微观分析. 王浩等设置了热氧、臭氧和紫外线3种老化条件,观察老化条件对6PPD纯度或含量的影响. 将实验得到的防老剂6PPD的GC-MS图谱与质谱谱库对比. 发现3种老化条件处理后,防老剂6PPD纯度依然达98%以上. 由结果可推测,热氧、臭氧和紫外线老化条件下,6PPD性能稳定、主成分无明显变化[40].
-
液相色谱-质谱法(LC-MS)凭借出色的分离能力和高灵敏度的优势,是目前最常用的6PPD和6PPD-TPs的痕量分析手段[13]. 科学家们采用LC-MS技术和GC-MS技术,深入研究了6PPD及其主要转化产物6PPD-Q对特定水生物种的剧毒效应[41 − 43].
(1)水生生物毒性检测
Tian等首次筛选了TWP渗滤液中诱导幼年银鲑急性死亡的主要有毒物质[3]. 采取的研究策略为:对TWP渗滤液进行混合毒性鉴定评估和效果导向分析,通过分馏研究法对有毒化学物质进行迭代探索,以获得单个有毒馏分. 主要步骤为:a)用双极性阳离子分离柱(XAD-2树脂和硅胶)和反相HPLC(含半制备型C18柱、五氟苯基PFP柱、和苯基柱)对TWP混合物进行平行分馏(分为10个组段:F1-F10),发现只有C18-F6组段(保留时间10—11 min,225 ESI+和70 ESI-)、PFP-F6组段(保留时间10—11 min,204 ESI+和60 ESI-)、苯基-F4组段(保留时间8—9 min,237 ESI+和75 ESI-)有毒,其他组段无毒. 其中,只有4个ESI+HRMS和3个ESI-HRMS特征谱同时出现在这3个有毒组段. 采用UPLC-QTOF-MS/MS技术(表1)检测到一种未知化合物(m/z
299.1752 ,C18H22N2O2),其峰面积占主导地位,ESI+/-强度高出其他物质10倍. 为了进一步确定潜在有毒物质,进一步采取串联分馏的方法,即TWP混合物依次通过C18柱、PFP柱、和苯基柱(C18-F6→PFP-F6→苯基-F4),离心后去除溶剂,纯化后得到成分简单且高度致死的物质(以C18H22N2O2为主的粉红色沉淀). b)采用超高效液相色谱-Orbitrap质谱仪(UPLC-Orbitrap-MSn,见表1)对C18H22N2O2结构进行了分析,基于MS2、MS3和MS4碎片化数据,提出了C18H22N2O2的碎片化树及可能的碎片结构. 然而,无论是已发表的文献还是数据库中,都未能观察到与实验匹配的片段,大胆推测这可能是一种从未报道过的有毒物质. c)根据美国环境保护署关于防老剂6PPD(C18H22N2)的报告,6PPD广泛存在于橡胶轮胎的配方中. GC-QTOF-HRMS分析发现(表1),防老剂6PPD与分馏C18H22N2O2的GC-EI-QTOF谱图中性损失相似,且两者预测lgKow(Kow正辛醇-水分配系数)接近,合理假设C18H22N2O2是防老剂6PPD氧化产物. d)采用工业化6PPD(纯度96%)进行气相臭氧化,生成了C18H22N2O2,呈紫色沉淀. 通过UPLC-QTOF-MS/MS(ESI+)方法(表1)证实,合成的C18H22N2O2与TWP渗滤液分馏所得C18H22N2O2之间的保留时间(11.0 min)和MS/MS 谱图完全匹配. 1H NMR分析证实了分馏的C18H22N2O2与合成的C18H22N2O2结构相同. 二维NMR谱和相关模拟揭示了孤立的叔碳和羰基,表明C18H22N2O2属于醌结构,即6PPD-Q. 通过急性毒性实验,测得6PPD-Q对幼年银鲑的LC50值为0.79 mg∙L−1. 本研究首次报导了6PPD-Q对银鲑的致死影响[3].出现商业化的6PPD-Q标准品后,LC50修订值低至95 ng∙L-1[44],这是一项具有里程碑意义的研究. 随后,Brinkmann等[45]采用UHPLC串联Q-Exactive™组合型四极杆Orbitrap™质谱仪,辅以正离子加热电喷雾离子源(heated electrospray ionization,HESI)技术(表1)对样品进行分析,使用6PPD-Q-d5的同位素稀释策略进行定量,研究6PPD-Q对虹鳟鱼、溪鳟鱼、北极红点鲑和白鲟的生物毒性. 6PPD-Q分别以离子对m/z
299.1754 →215.0819 和m/z299.1754 →187.0869 ,243.1132 进行定量和定性分析;6PPD-Q-d5以离子对m/z304.2068 →220.1126 和m/z304.2068 →192.1177 ,248.1140 进行定量和定性分析. 在校准浓度范围内(0.05—100 µg∙L−1)设置6PPD-Q-d5的8个梯度点,采用线性函数和1/x加权的校准曲线. 结合24 h急性毒性实验,确定溪鳟鱼和虹鳟鱼的LC50 值分别为0.59 mg∙L−1和1.96 mg∙L−1. 此外,还有其他色谱质谱联用方法也可用于筛选6PPD-Q对其他水生生物的潜在毒性[5].McIntyre等[46]建立了UPLC-QTOF-HRMS方法(表1),对TWP渗滤液中6PPD-Q进行定性和定量分析,并探究环境相关的TWP暴露对水生生物的毒理学影响. 质量分析器在全扫描模式(m/z 100—
1700 )和数据依赖型扫描模式(m/z 50—1700 )下监测,可以同时得到分析物的高分辨质谱图(high resolution mass spectrum,HRMS)和串联质谱图(MS/MS),通过数据缩减和工作分析流程最大程度地减少假阴性. 结果发现轮胎磨损颗粒浸出液中6PPD-Q浓度高达1.3—2.4 mg∙L−1,远超6PPD-Q对幼年银鲑的致死浓度(95 ng∙L−1). Masset等[47]采用UHPLC-MS/MS和GC-MS/MS技术(表1),分析与轮胎相关的有机物及其4种降解产物(包括6PPD和6PPD-Q),探究它们从低温研磨轮胎胎面到鱼消化液中的溶解度和生物可及性. 研究发现,6PPD-Q进入鱼体后血细胞比容、血浆Na含量和血浆pH水平发生显著变化,造成了鱼类稳态失衡,这为后续研究它们通过上皮细胞时的生物蓄积和毒理学作用奠定基础. Johannessen等[48]采集了加拿大多伦多地区高交通量附近的两条河流的地表水样本,检测与TWP相关的化学物质. 采用UHPLC-Orbitrap-HRMS方法(表1),选用HESI-Ⅱ离子源的正模式、平行反应监测(parallel reaction monitoring,PRM)模式. 结果发现,加拿大和美国地表水中6PPD-Q暴露水平低于溪鳟鱼和虹鳟鱼的LC50值,不会造成生物危害. Ji等[49]采用HPLC-MS/MS的离子源ESI+模式和多反应检测(multiple response monitoring,MRM)模式,以去离子水和甲醇为流动相,分析6PPD、6PPD-Q和4-羟基二苯胺对斑马鱼的异常行为的影响. 结果发现,斑马鱼的中枢神经递质通路中γ-氨基丁酸、乙酰胆碱与6PPD及代谢物呈显著的正相关,这可以解释斑马鱼的运动迟缓、失衡和焦虑等行为,并表现出与亨廷顿病相似的症状. 通过神经递质变化揭示6PPD及代谢物的生物毒性. Hiki等[50]采用LC-MS/MS法,通过ESI+模式分析和MRM模式检测,以m/z 269→185作为6PPD的定量离子对,以m/z 299→241和m/z 299→187,215分别作为6PPD-Q的定量和定性离子对. 得到6PPD的检出限和定量限分别为0.5 µg∙L−1和1.8 µg∙L−1,6PPD-Q的检出限和定量限分别为0.05 µg∙L−1和0.17 µg∙L−1. 通过48—96 h急性毒性实验,发现它们对4种水生物种具有毒性差异,检测方法参数详见表1.(2)空气、土壤样品检测
除了水生生物,PPDs对空气和土壤环境的不利影响也逐渐引起重视,研究人员采用液质联用法研究了PM2.5与PPD-Qs结合物的污染特征,并对其潜在健康风险进行了系统研究[51].
评估PPD-Qs对中国城市PM2.5总氧化电位(OP)的影响. Wang等[8]收集了广州、杭州、上海、太原、郑州5座城市的空气样品,使用脱细胞二硫苏糖醇(DTT)法测定PM2.5中5种PPD-Qs(DTPD-Q、6PPD-Q、DPPD-Q、CPPD-Q和IPPD-Q)的OP值. 采用UPLC-ESI-MS/MS技术和MRM检测模式(表2),在校准浓度范围(0.01—100 μg∙L−1)内,设置8个浓度水平的标准溶液进行线性拟合,以外标法定量计算. 检测结果发现,大气颗粒中的PPD-Qs显著提升了环境的总OP值,这为空气中PM2.5毒性提供了新的解释.
研究TWP尺寸与BTHs、PPDs分布情况之间的关系. Deng等[17]采集了广州市区开放道路和室内停车场的粉尘样品. 采用0.1%甲酸水溶液和甲醇为流动相,利用HPLC-MS/MS技术(表2),选用ESI+离子源、MRM模式对粉尘中的BTHs和PPDs进行测定. 结果发现大部分BTHs、PPDs富集在粒径小于250 μm的粉尘上. 因此,尺寸分级对于评估通过粉尘接触BTHs和PPDs的风险是十分必要的,研究粉尘毒性时应选择250 μm以下的粒径.
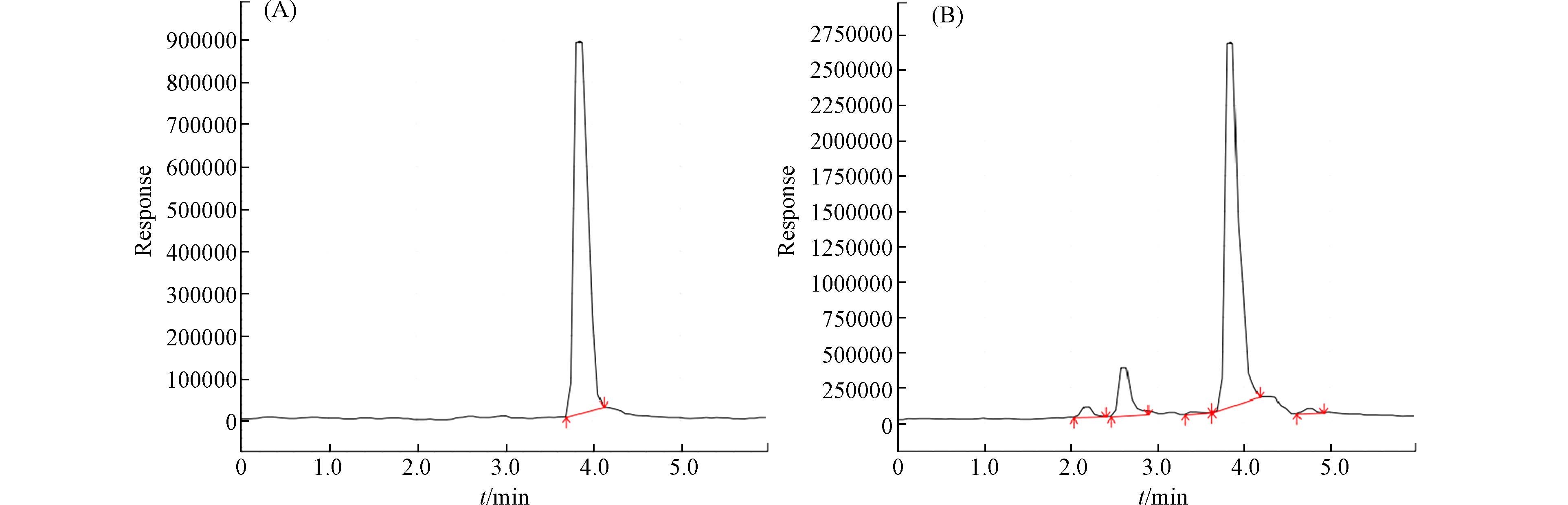
探究不同环境基质中PPDs的分布水平. Huang等[14]收集了道路、地下停车场、车辆和房屋等环境基质的灰尘颗粒. 采用ESI+离子源模式和MRM检测模式下的HPLC-Q-Trap-MS/MS筛查尘埃中苯二胺抗氧化剂PPDs(77PD、IPPD、CPPD、6PPD、DPPD、DNPD),并用HPLC-TOF-MS/MS筛查6PPD-Q[3](表2). 结果发现,PPDs在环境中普遍存在,且中位数浓度在停车场灰尘(232 ng∙g−1)和道路灰尘(226 ng∙g−1)高于车辆内灰尘(156 ng∙g−1)和室内灰尘(156 ng∙g−1). 而且环境粉尘中6PPD-Q的浓度范围也在32.2—80.9 ng∙g−1范围内,与6PPD含量相当. 本研究可引起人们对PPDs和6PPD-Q的环境命运及相关的人类健康风险的关注. 此外,Hiki等[50]收集了日本东京的主干道和住宅道路灰尘样本,并用液相色谱-三重四极杆串联质谱仪器(日本岛津LCMS-8060NX)分析测定样品中6PPD及 6PPD-Q浓度,探究道路灰尘中6PPD和6PPD-Q的环境发生和归宿. LC-QqQ-MS/MS系统配备了Shim-pack VP ODS柱(内径:150 mm×2.0 mm,二氧化硅基C18定相),采用微酸性的流动相——0.1%乙酸铵(pH=5)和甲醇(1:8,V:V),流速为0.18 mL∙min−1. 所有待测物质均以ESI+模式分析和MRM模式检测. 部分样品中的6PPD表现为质子化和中性两种形式,其在不同的保留时间呈现两个峰(图1),则采用两个峰面积之和进行定量计算. 但是该仪器检测方法6PPD和6PPD-Q的定量限分别为0.63 µg∙L−1和0.18 µg∙L−1,其准确性和精度需要进一步提高.
(3)食物安全检测
6PPD和6PPD-TPs广泛分布于各种环境介质中,如城市径流、道路旁的土壤以及空气中的颗粒物等,这些物质通过复杂的食物链,对人类健康构成了不容忽视的潜在威胁.
采用液质联用法筛查食物样品中6PPD和6PPD-TPs的暴露情况. 鉴于鱼肉和蜂蜜作为营养丰富且对环境污染敏感的“哨兵”食品,这两类食品常被特别关注[20]. 通过QuEChERS前处理技术与高效液相色谱串联质谱(HPLC/MS-MS)技术相结合,Ji等成功检测了鱼肉和蜂蜜样品中的6PPD和6PPD-Q[53]. 该方法建立以后,表现出良好的分析性能:定量限(LOQ)在
0.00043 —0.001 mg∙kg−1之间,决定系数R2 > 0.99、确保了方法的准确性和可靠性. 此外,回收率范围为73.3%—108.3%,基质效应70.4%—95.6%,重复性用相对标准偏差(RSD)表示,RSD<8.4%. 这些指标均表明该方法的稳定性和适用性. 检测结果显示,在检测的鱼肉样品(包括黑鱼、鲈鱼、西班牙鲭鱼)中发现了6PPD和6PPD-Q的存在,而在蜂蜜样品中未检测到这两种物质. 这一研究结果提示我们,鱼肉等水产品可能更容易受到环境污染中6PPD及其转化产物的影响,因此对其来源和归宿应给予进一步的关注和评估.采用液质联用法可研究食品接触材料中6PPD向食品的迁移规律,评估食品安全性. Yuan等建立了一种高效的HPLC-DAD法,用于研究食品接触用橡胶奶管和奶衬在实际使用工况下的安全性[12]. 该方法表现出极高的检测性能,其检出限为3—18.8 µg∙L−1,定量限为10—50 µg∙L−1,相关系数r > 0.999,表明该检测方法具有良好的线性关系,能够精确量化6PPD的浓度. 加标回收率97.73%—115.04%,相对标准偏差0.11%—7.60%,进一步证明了方法的可靠性. 应用该方法进行实际检测时,研究人员发现,6PPD主要存在于食品模拟物中,其浓度分布呈现明显的趋势:95%乙醇>50%乙醇>10%乙醇. 然而,在真实食品牛奶中,并未检测到6PPD的存在. 这一发现为评估6PPD迁移对乳制品的安全性影响提供了重要的数据支持. 本研究不仅建立了一种新颖而有效的检测方法,用于评估食品接触材料中6PPD的迁移规律及其对食品安全性的影响,而且通过实际检测揭示了6PPD在真实食品中的迁移情况,为食品安全领域的研究提供了宝贵的参考.
(4)转化路径探索
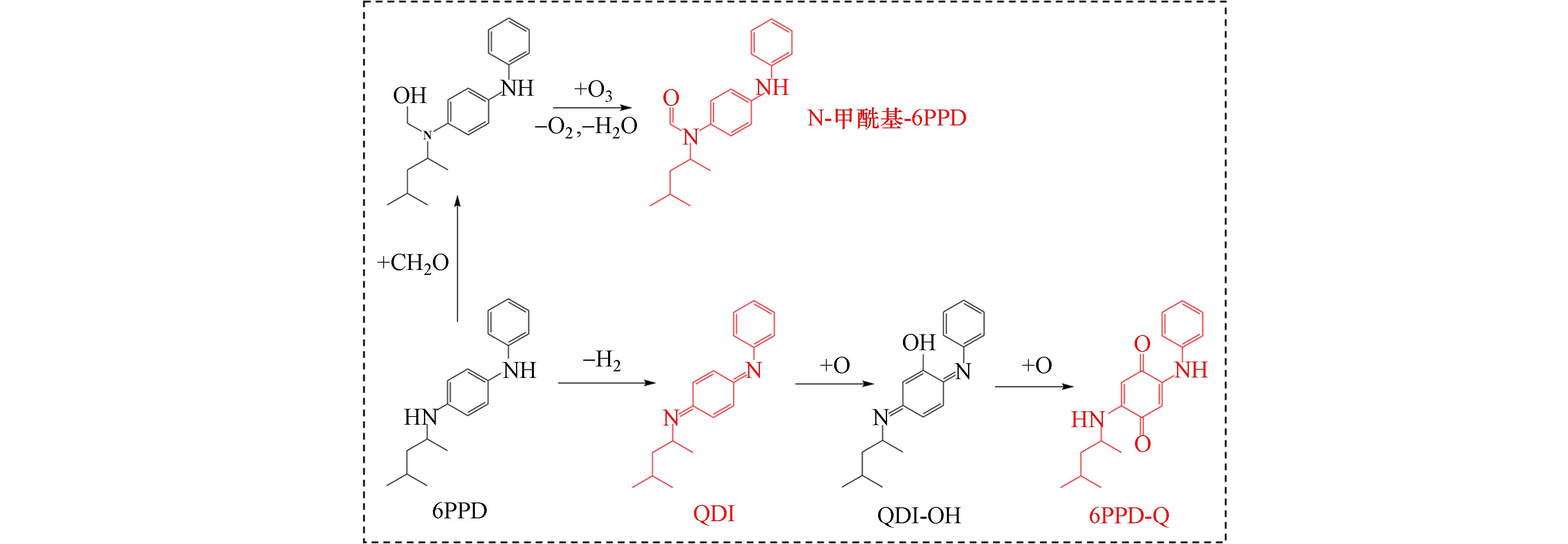
采用高分辨液质联用法探索6PPD转化路径,对环境中有害物质进行风险评估具有重要意义. 将高效液相色谱技术与高分辨率质谱结合,能够准确地定性和定量环境基质中的6PPD及其转化产物6PPD-TPs[41]. 6PPD工艺合成和O3引发的醌的形成[54],如图2所示. 在O3作用下,6PPD经历一个复杂的转化过程最终生成6PPD-Q,这一转化过程可分解为3个主要步骤:胺氧化、侧链氧化和氮氧化物自由基形成[55],这都可以借助高分辨液质联用法进行机理探索[56].
Hu等采用超高效液相色谱-四极杆飞行时间质谱-高分辨率质谱(UPLC-QTOF-HRMS)技术,深入分析了轮胎表面磨损颗粒中的6PPD-TPs种类[57]. 在数据处理过程中,使用MS-DIAL(v3.46)软件提取谱图的化学特征等关键信息,并通过Python(v3.7.4)进行数据缩减、特征优先级排序和注释等. 结果表明,高达81%(W:W)的6PPD在短短6 h内就能发生臭氧化反应,进而生成6PPD-Q. 此外,6PPD纯品和轮胎磨损颗粒中的6PPD的摩尔产率分别为9.7%和0.95%. 通过高分辨质谱分析,在臭氧化条件下可筛查出19种6PPD-TPs,且在环境中实际检测到其中9种. 这些结果表明,轮胎磨损颗粒中的6PPD及其转化产物有可能释放到周围环境中,对人类健康造成潜在的危害.
环境中交通排放的TWP测量困难、数据很少[58]. Klöckner等收集了德国莱比锡的道路粉尘,通过非靶向筛查和液相-高分辨质谱(LC-HRMS,ESI±分析模式)鉴定的分层策略,对转化产物6PPD-TPs进行分析,筛选出合适的TWP定量标记物[55]. 创新性地采用数据采集模式MSE,这是一种数据非依赖型技术,能够在单次分析中无缝切换母离子和碎片离子采集,更加准确且全面收集信息(分子质量和MS/MS碎片等). 可通过在两个功能通道之间快速切换来实现,即第一个功能通道在低碰撞能量(4 eV)下采集数据,提供母离子的准确质量数,第二个通道在较高碰撞能量(梯度,10—40 eV)下采集数据,提供碎片离子的准确质量数. 综合考量潜在标记物在6PPD-TPs中的含量占比、在环境中的稳定性、在标准添加实验中的分析响应等指标,确定了3个最合适的TWP标记物,分别为:6PPD-Q、N-甲酰基-6PPD、N-(1,3-二甲基丁基)-N'-苯基对醌二亚胺(QDI),如图3所示. 此外,Hiki等在灰尘样本中还检测到了N-(1,3-二甲基丁基)-对苯醌,这一发现引发了关于6PPD转化路径的新思考,他们推测6PPD-Q可能并非6PPD的终端转化产物. 然而,该醌的生成机制是6PPD-Q的苯胺裂解产生的,还是6PPD可能的水解产物1,3-二甲基丁基苯在环境中直接臭氧化生成的,目前仍缺乏相关证据支持[52]. 为了更系统、全面地评估6PPD的环境风险,利用现代化的高灵敏检测技术,如UPLC-QTOF-HRMS和UPLC-QTOF-MS/MS等深入探索6PPD的可能转化产物及其转化路径尤为重要. 这些技术能够提供关于6PPD及其潜在代谢产物的详细信息,从而帮助科学家更好地理解其在环境中的行为,并为制定有效的风险管理策略提供科学依据.
-
与传统色谱法相比,超临界流体色谱-质谱联用法(supercritical fluid chromatography-tandem mass spectrometry,SFC-MS/MS)在环境化学分析领域展现出显著优势. SFC-MS/MS具有耗时短、分离度高、有机溶剂消耗低等优点[59],可应用于农药对映体分析[60]、微生物菌落提取[61]、污染物生物富集检测[62]、药物成分的提取[63]和筛查[64]等多个领域. 针对手性化合物6PPD和6PPD-Q的环境风险评估,SFC-MS/MS技术发挥了重要作用. Di等通过超手性R-OJ柱和RIJ柱成功制备、鉴定并分离了6PPD和6PPD-Q的4种对映体(R-6PPD、S-6PPD、R-6PPD-Q、S-6PPD-Q)[65]. 利用计算的电子圆二色性(ECD)光谱和测量的圆二色性(CD)光谱确认了这些对映体的绝对构型,并建立了SFC-MS/MS法来分离这些对映体. 在毒性评估方面,研究发现混合消旋6PPD、S-6PPD和R-6PPD对我国稀有鮈鲫具有较高的毒性,且S-6PPD和R-6PPD的毒性相似. 而6PPD-Q对虹鳟鱼的毒性极高,且S-6PPD-Q的毒性是R-6PPD-Q的2.6倍. 这些发现为6PPD和6PPD-Q的环境风险评估提供了重要的对映体层面信息. SFC-MS/MS检测方法的高效性、高分辨率和低溶剂消耗使其在对映体分析领域具有独特优势,为环境风险评估提供了更为精确和全面的数据支持. 这一技术的进一步应用将有助于我们更深入地了解手性化合物在环境中的行为和影响,从而制定更有效的风险管理策略.
-
电子自旋共振法(electron spin resonance,ESR)是一种高灵敏自由基检测技术[66],已广泛应用于监测6PPD的自由基氧化过程,以深入探究其臭氧化反应机理. 自由基链式反应通常包含链引发、链传递、链终止3个关键阶段[67]. 在氧化过程中,产生的大多数自由基因其不稳定性而难以通过常规方法检测[68],但ESR技术却能有效捕捉这些短暂存在的自由基.
臭氧浓度升高对环境和人类健康构成威胁[69],苯二胺(PPDs)作为常见的臭氧保护剂,其臭氧化反应过程成为研究热点. ESR技术凭借其卓越的自由基检测能力,揭示了PPDs与臭氧反应过程中的关键步骤:电子从PPDs转移到臭氧,形成PPDs自由基阳离子,同时臭氧被还原为自由基阴离子,这些不稳定的中间体进一步反应生成硝基自由基[70],即使在室温下也能被ESR技术检测到[71]. 此外,研究还发现,经过酸处理的PPD硝基自由基可以通过不同的路径分解,既可以回到自由基阳离子状态,也可以与另一个PPD反应生成PPD羟胺和PPD自由基阳离子[72]. 这一过程中,ESR信号表现出更大的强度和稳定性,提供了研究O3/PPD反应机制的独特视角.
基于现有的理论基础,进一步通过实验,利用ESR技术深入分析了O3/PP反应过程中的自由基特征和信号强度. 通过这些数据,成功表征了反应中电子传递、转移、对抗、结合等关键行为. 实验结果表明,单个PPD分子能够清除至少4个臭氧分子,展现了卓越的抗氧化性能[67]. 同时,自由基阳离子和硝基自由基的形成与稳定性受到溶解介质的影响,尽管低介电常数三氯甲烷CHCl3常被用作实验溶剂,但在实际环境中通常不能满足相关条件. 因此,Cataldo等以角鲨烯作为模拟溶剂介质,通过ESR技术检测硝基自由基,并详细分析了其各向同性和各向异性超精细相互作用常数[73]. 这项研究结果表明,角鲨烯作为溶剂介质非常适合模拟聚异戊二烯或天然橡胶中的环境,为PPDs作为抗臭氧剂或二次芳香胺抗氧化剂的研究提供了理想的介质[71]. 这一发现提供了新的研究方向,即利用ESR技术进一步探索更多适用于橡胶材料的模型化合物,以更好地理解其抗氧化机制并推动新型抗氧化剂的研发.
-
橡胶制品中广泛使用的防老剂6PPD及其转化产物6PPD-TPs,在环境(空气、水域和土壤)介质中的扩散行为和向食品的潜在迁移行为,构成了不容忽视的生态风险和食品污染问题. 为了从源头上控制和减少这些污染物的释放,准确鉴定和量化6PPD及其有害转化产物尤为重要. 本文综述了当前针对这些污染物的前处理方法和分析检测技术,并深入探讨了各种方法的优势和局限. 面对未来,关于6PPD及其相关转化物的检测技术发展和应用,还可以继续深入研究:
(1)检测技术的创新与优化:从单纯的定量检测向更复杂的样本间反应及产物分析转变,开发更为灵敏、准确且高效的分析方法. 例如,通过优化电离技术和开发新的即时测量技术(如ESI-MS、DART-MS),以应对复杂环境因素(如天气、交通状况等)对采样和检测的影响.
(2)转化产物的系统筛查与风险评估:对6PPD的转化产物进行更全面的筛查,并深入评估其潜在的环境和健康风险. 这将有助于我们更准确地理解这些污染物的环境行为和毒性机制.
(3)老化机制的探索与防老剂的创新:通过深入研究6PPD的老化机制,可以设计出更为稳定、环保的新型防老剂. 这不仅将改善橡胶制品的性能,还能显著降低环境污染和食品安全风险.
(4)生产工艺的优化与法规的完善:结合新型防老剂的开发,优化橡胶制品的生产工艺,减少污染物的产生和排放. 同时,建立健全的法规体系,为政府监管提供支持,确保橡胶制品行业的可持续发展.
环境中橡胶防老剂6PPD及其转化物检测方法
Detection technologies of rubber anti-aging 6PPD and its transformation products in environmental segments
-
摘要: 防老剂N-(1,3-二甲基丁基)-N'-苯基-对苯二胺(防老剂6PPD)广泛应用于橡胶制品的加工过程,以防止橡胶因臭氧化和磨损等造成的皲裂现象. 轮胎磨损后6PPD从橡胶碎屑向邻近的空气、土壤和水域的扩散;此外,在实际使用工况下,6PPD还会从食品接触用橡胶制品向食品中迁移. 6PPD理化性质不稳定,易生成其他有毒的转化产物,这将造成潜在的环境污染或食品安全问题,不利于人类健康. 本文针对新发安全因子6PPD的检测方法,综述了其在橡胶、空气粉尘、土壤颗粒、食物、尿液等不同基质样品中的前处理方法,以及采用的高灵敏检测技术,如质谱法、色谱法、色谱-质谱联用法、电子自旋共振法等. 本文为筛查6PPD及其有害转化产物,评估其在环境或食物链中的风险暴露程度,探索6PPD转化机理提供科学依据.Abstract: N-(1,3-dimethylbutyl)-N'-phenyl-p-phenylenediamine (6PPD) is widely used during the process of rubber products in order to prevent the rubber crack caused by ozonation and wear. 6PPD can release from tire wear particles to adjacent air, soil and water, or migrate from the food-contact rubber products to food. With unstable characteristic, 6PPD is more prone to obtaining other toxic transformation products (6PPD-TPs). They may adversely affect the living environment and food safety, and cause potential health risks. This article summarizes the pretreatment methods of 6PPD and 6PPD-TPs extracted from different matrix samples, such as rubber samples, air dust, soil particles, food and urine sample. High-sensitive detection technologies are also outlined including mass spectrometry, chromatography, chromatography-mass spectrometry, electronic optional resonance method. This study provides technical support for screening 6PPD and 6PPD-TPs, assessing their risk levels of 6PPD and 6PPD-TPs in the environment or food chain, exploring the transformation pathway of 6PPD.
-
Key words:
- rubber products /
- 6PPD /
- 6PPD-TPs /
- pretreatment method /
- detection technology.
-

-
表 1 水生生物毒性研究中对6PPD及其转化产物检测所用的液质联用技术及其参数
Table 1. LC-MS technology and its parameters for 6PPD and 6PPD-TPs analysis in the field of aquatic organism toxicity research
检测方法
Detection methods色谱参数
Chromatographic parameters质谱参数
Mass spectrometric parameters参考文献
ReferenceUPLC-QTOF-MS/MS 仪器:UPLC(安捷伦 1290 )
色谱柱:反相C18分析柱(Agilent ZORBAX Eclipse Plus 2.1 mm×100 mm,
1.8 µm)、C18保护柱(2.1 mm×5 mm,1.8 µm)
进样:45 ℃,5 µL;流速:0.4 mL∙min−1
浓度梯度:0—1 min,5%B;4 min,50%B;17-20 min,100%B;20.1 min,5%B;
停止时间22.5 min;后运行时间2 min
流动相(ESI+):含0.1%甲酸的水(A)和甲醇(B)组成
流动相(ESI-):含1 mM氟化铵的水(A)和甲醇(B)组成仪器:QTOF HRMS(安捷伦 6530 )
电离源:ESI+/-
扫描模式:数据依赖型(m/z 50—1700 ,碰撞诱导解离能量为10、20、
40 eV)[44] UPLC-Orbitrap-MSn 仪器:赛默飞Vanquish超高效液相色谱仪
色谱柱:安捷伦120 EC-C18色谱柱(2.1 mm × 100 mm,1.9 μm)
进样:45 ℃,5 µL;流速:0.3 mL∙min−1
浓度梯度:0—0.5 min,5%B;1.5 min,50%B;10—15 min,100%B;15.5—
20 min,5%B
流动相(ESI+):含0.1%甲酸的水(A)和含0.1%甲酸的甲醇(B)组成仪器:Q Exactive Orbitrap质谱仪(赛默飞)
电离源:ESI+[44] GC-QTOF-HRMS 仪器:GC(安捷伦 7890 )
色谱柱:安捷伦HP-5MS Ultra色谱柱(30 m× 0.25 mm, 0.25 μm)
载气:氦气
进样:280 ℃(进样口);1 µL(进样量);流速:1.0 mL∙min-1
程序升温:60 ℃,保持1 min;60—170 ℃,40 ℃∙min-1;170—325 ℃,
10 ℃∙min-1,保持2.75 min仪器:QTOF HRMS(安捷伦7200B)
电离源:EI(250 ℃)
采集范围:m/z 45-550
采集速率:200 spectra∙s−1[44] UPLC-Q-Exactive HF Quadrupole Orbitrap hybrid MS 仪器:Vanquish UPLC(赛默飞)
色谱柱:Kinetex® 1.7 µm XB-C18色谱柱;Phenomenex SecurityGuard™ C18
保护柱
流动相(ESI+):含0.1%甲酸的水(A)和含0.1%甲酸的甲醇(B)组成仪器:Q Exactive™组合型四极杆 Orbitrap™质谱仪(赛默飞)
电离源:HESI+[45] UPLC-QTOF-HRMS 仪器:UPLC(安捷伦 1290 )
色谱柱:安捷伦ZORBAX Eclipse Plus 2.1 mm×100 mm色谱柱;2.1 mm×
5 mm×1.8 µm保护柱
进样:45 ℃, 5 µL;流速:0.4 mL∙min−1
流动相:含5 mM乙酸铵的去离子水(A)和含0.1%乙酸的甲醇(B)组成仪器:QTOF HRMS
(安捷伦6530 )
采集范围:m/z 100—1700 [46] UPLC-MS/MS 仪器:Acquity UPLC(沃特世)
色谱柱:沃特世Acquity UPLC HSS T3色谱柱(100 mm × 2.1 mm, 1.8 μm)
进样:30 ℃,5 µL;流速:0.4 mL∙min−1
流动相:(A)含0.1%甲酸的乙腈水溶液(95%水和5%乙腈);(B)含0.1%甲酸的乙腈水溶液(95%乙腈和5%水)仪器:Xevo TQ质谱仪
(沃特世)
离子源:ESI+(150 ℃)[47] GC-MS/MS 仪器:GC-MS/MS(赛默飞)
色谱柱:ZB-ms色谱柱(60 m×0.25 mm×0.25 µm)
程序升温:50—170 ℃, 50 ℃/min; 170—320 ℃, 5 ℃∙min−1, 保持12 min仪器:TSQ Quantum XLS Ultra质谱仪(赛默飞)
离子源:EI(250 ℃)
扫描模式:SIM[47] UHPLC-Orbitrap-HRMS 仪器:UPLC(安捷伦Ultimate 3000 )
色谱柱:飞诺美Kinetex C18色谱柱(50 mm×4.6 mm×2.6 µm)
进样:25 µL;流速:0.5 mL∙min−1
流动相:含0.1%甲酸的水相(A)和含0.1%甲酸的甲醇(B)仪器:Q Exactive Orbitrap HRMS(赛默飞)
离子源:HESI+
监测模式:PRM[48] LC-MS/MS 仪器:LCMS-8060NX(岛津)
色谱柱:岛津Shim-pack VP ODS色谱柱(150 mm×2.0 mm,C18)
进样:5 µL;流速:0.18 mL∙min−1
流动相:含0.1%乙酸铵(pH=5)(A)和甲醇(B)仪器:LCMS-8060NX
(岛津)
监测模式:MRM[50] 表 2 空气、土壤样品对6PPD及其转化产物检测所用的液质联用技术及其参数
Table 2. LC-MS technology and its parameters for 6PPD and 6PPD-TPs analysis in air and soil samples
检测方法
Detection methods色谱参数
Chromatographic parameters质谱参数
Mass spectrometric parameters参考文献
ReferenceUPLC-MS/MS 仪器:Vanquish MD超高效液相色谱仪UPLC(安捷伦 1290 )
色谱柱:Acquity HSS T3色谱柱(沃特世,2.1 mm×100 mm,1.8 µm)
进样:35 ℃,2 µL;流速:0.3 mL∙min−1
浓度梯度:0—1 min,2%B;1—19 min,2%B→100%B;19—22 min,100%B; 22—22.1 min,100%B→2%B;22.1—27 min,2%B
流动相:含0.1%甲酸的水(A)和含0.1%甲酸的乙腈(B)组成仪器:三重四极杆质谱(赛默飞TSQ Altis MS)
电离源:ESI+(350 ℃)
扫描模式:MRM[8] HPLC-MS/MS 仪器:HPLC系统(岛津LC-20A)
色谱柱:飞诺美Kinetex C18色谱柱(100 mm×2.1 mm,2.6 µm)
进样:40 ℃,5 µL
流速:0.3 mL∙min−1
浓度梯度:0—2 min, 10%B;2—4 min, 10%B→70%B; 4—10 min, 70%B→100%B;10—13 min,100%B;13—14 min,100%B→10%B;
14—17 min,10%B
流动相:含0.1%甲酸的去离子水(A)和含0.1%甲酸的甲醇(B)组成仪器:三重四极杆质谱(AB Sciex 5500 Q Trap)
电离源:ESI+(550 ℃)
扫描模式:MRM[17] HPLC-Q-Trap-MS/MS 仪器:HPLC系统(岛津LC-20A)
色谱柱:飞诺美C18色谱柱(100 mm×2 mm,3 µm)
进样:35℃;流速:0.2 mL∙min−1
程序升温:10%B, 保持1 min;10 min内,10%B→100%B;100%B,保持10 min;
3 min内,100%B→10%B;10%B,保持5 min
流动相:含0.3 g∙L−1乙酸铵的去离子水(A)和甲醇(B)仪器:三重四极杆质谱(AB Sciex 5500 Q Trap)
电离源:ESI+(500 ℃)
扫描模式:MRM[14] HPLC-TOF-MS/MS 仪器:HPLC系统(岛津LC-20A)
色谱柱:飞诺美C18色谱柱(100 mm×2 mm,3 µm)
进样:35℃;流速:0.2 mL∙min−1
程序升温:10%B,保持1 min;10 min内,10%B→100%B;100%B,保持10 min;
3 min内,100%B→10%B;10%B,保持5 min
流动相:离子水(A)和甲醇(B)仪器:AB Sciex Triple TOF 5600 + 质谱仪
电离源:ESI+(500 ℃)
扫描模式:全扫描
扫描范围:50—1000 [14] -
[1] HUNTINK N M, DATTA R N, NOORDERMEER J W M. Addressing durability of rubber compounds[J]. Rubber Chemistry and Technology, 2004, 77(3): 476-511. doi: 10.5254/1.3547833 [2] MAHONEY H, Da SILVA F C Jr, ROBERTS C, et al. Exposure to the tire rubber-derived contaminant 6PPD-quinone causes mitochondrial dysfunction in vitro[J]. Environmental Science & Technology Letters, 2022, 9(9): 765-771. [3] TIAN Z Y, ZHAO H Q, PETER K T, et al. A ubiquitous tire rubber-derived chemical induces acute mortality in coho salmon[J]. Science, 2021, 371(6525): 185-189. doi: 10.1126/science.abd6951 [4] VARSHNEY S, GORA A H, SIRIYAPPAGOUDER P, et al. Toxicological effects of 6PPD and 6PPD quinone in zebrafish larvae[J]. Journal of Hazardous Materials, 2022, 424: 127623. doi: 10.1016/j.jhazmat.2021.127623 [5] BLAIR S I, BARLOW C H, McINTYRE J K. Acute cerebrovascular effects in juvenile coho salmon exposed to roadway runoff[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2021, 78(2): 103-109. doi: 10.1139/cjfas-2020-0240 [6] LIU Q F, LI L, ZHANG X M, et al. Uncovering global-scale risks from commercial chemicals in air[J]. Nature, 2021, 600(7889): 456-461. doi: 10.1038/s41586-021-04134-6 [7] ZHU J Q, GUO R Y, REN F F, et al. Occurrence and partitioning of p-phenylenediamine antioxidants and their quinone derivatives in water and sediment[J]. Science of the Total Environment, 2024, 914: 170046. doi: 10.1016/j.scitotenv.2024.170046 [8] WANG W, CAO G D, ZHANG J, et al. p-phenylenediamine-derived quinones as new contributors to the oxidative potential of fine particulate matter[J]. Environmental Science & Technology Letters, 2022, 9(9): 712-717. [9] ZHANG X, PENG Z F, HOU S J, et al. Ubiquitous occurrence of p-Phenylenediamine (PPD) antioxidants and PPD-quinones in fresh atmospheric snow and their amplification effects on associated aqueous contamination[J]. Journal of Hazardous Materials, 2024, 465: 133409. doi: 10.1016/j.jhazmat.2023.133409 [10] CAO G D, WANG W, ZHANG J, et al. New evidence of rubber-derived quinones in water, air, and soil[J]. Environmental Science & Technology, 2022, 56(7): 4142-4150. [11] WANG H M, LUO Z X, DAI A T, et al. Ascertaining appropriate measuring methods to determine tire wear particle pollution on driving school grounds in China[J]. Journal of Hazardous Materials, 2024, 466: 133657. doi: 10.1016/j.jhazmat.2024.133657 [12] YUAN X Y, HU C Y, WANG Z W. The migration and degradation of N-(1, 3-dimethylbutyl)-N'-phenyl-p-phenylenediamine from rubber hoses in milk lines[J]. International Journal of Dairy Technology, 2023, 76(2): 329-338. doi: 10.1111/1471-0307.12923 [13] 高明, 徐艳林, 盛翔, 等. 超高效液相色谱法测定橡胶中6种橡胶助剂的含量[J]. 理化检验-化学分册, 2020, 56(1): 66-70. doi: 10.11973/lhjy-hx202001011 GAO M, XU Y L, SHENG X, et al. Determination of 6 rubber additives in rubber by UPLC[J]. Physical Testing and Chemical Analysis (Part B (Chemical Analysis), 2020, 56(1): 66-70 (in Chinese). doi: 10.11973/lhjy-hx202001011
[14] HUANG W, SHI Y M, HUANG J L, et al. Occurrence of substituted p-phenylenediamine antioxidants in dusts[J]. Environmental Science & Technology Letters, 2021, 8(5): 381-385. [15] LIU R Z, LI Y L, LIN Y F, et al. Emerging aromatic secondary amine contaminants and related derivatives in various dust matrices in China[J]. Ecotoxicology and Environmental Safety, 2019, 170: 657-663. doi: 10.1016/j.ecoenv.2018.12.036 [16] WU Y, VENIER M, HITES R A. Broad exposure of the North American environment to phenolic and amino antioxidants and to ultraviolet filters[J]. Environmental Science & Technology, 2020, 54(15): 9345-9355. [17] DENG C L, HUANG J L, QI Y Q, et al. Distribution patterns of rubber tire-related chemicals with particle size in road and indoor parking lot dust[J]. Science of the Total Environment, 2022, 844: 157144. doi: 10.1016/j.scitotenv.2022.157144 [18] FURUMAI H, JINADASA H K P K, MURAKAMI M, et al. Model description of storage and infiltration functions of infiltration facilities for urban runoff analysis by a distributed model[J]. Water Science and Technology, 2005, 52(5): 53-60. doi: 10.2166/wst.2005.0108 [19] EREJUWA O O, SULAIMAN S A, WAHAB M S. Honey: A novel antidiabetic agent[J]. International Journal of Biological Sciences, 2012, 8(6): 913-934. doi: 10.7150/ijbs.3697 [20] BOMMURAJ V, CHEN Y, KLEIN H, et al. Pesticide and trace element residues in honey and beeswax combs from Israel in association with human risk assessment and honey adulteration[J]. Food Chemistry, 2019, 299: 125123. doi: 10.1016/j.foodchem.2019.125123 [21] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction”for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2): 412-431. doi: 10.1093/jaoac/86.2.412 [22] CHAMKASEM N, OLLIS L W, HARMON T, et al. Analysis of 136 pesticides in avocado using a modified QuEChERS method with LC-MS/MS and GC-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2013, 61(10): 2315-2329. doi: 10.1021/jf304191c [23] MAO W L, JIN H B, GUO R Y, et al. Occurrence of p-phenylenediamine antioxidants in human urine[J]. Science of the Total Environment, 2024, 914: 170045. doi: 10.1016/j.scitotenv.2024.170045 [24] PLASSMANN M M, BRACK W, KRAUSS M. Extending analysis of environmental pollutants in human urine towards screening for suspected compounds[J]. Journal of Chromatography A, 2015, 1394: 18-25. [25] DU B B, LIANG B W, LI Y, et al. First report on the occurrence of N-(1, 3-dimethylbutyl)-N' -phenyl-p-phenylenediamine (6PPD) and 6PPD-quinone as pervasive pollutants in human urine from South China[J]. Environmental Science & Technology Letters, 2022, 9(12): 1056-1062. [26] SU H, HUANG Y J, HUANG M Z, et al. Using ambient mass spectrometry to explore the origins of phthalate contamination in a mass spectrometry laboratory[J]. Analytica Chimica Acta, 2020, 1105: 128-138. doi: 10.1016/j.aca.2020.01.031 [27] GROSS J H. Direct analysis in real time mass spectrometry: Principles and practices of DART-MS[J]. Analytical and Bioanalytical Chemistry, 2018, 410(27): 6975-6976. doi: 10.1007/s00216-018-1221-5 [28] MONAGHAN J, JAEGER A, AGUA A R, et al. A direct mass spectrometry method for the rapid analysis of ubiquitous tire-derived toxin N-(1, 3-dimethylbutyl)- N' -phenyl- p-phenylenediamine quinone (6-PPD-Q)[J]. Environmental Science & Technology Letters, 2021, 8(12): 1051-1056. [29] WANG X X, CAO G D, YANG Z Y, et al. DNA and RNA adducts formation from 3, 4-quinone metabolites of bisphenol F[J]. Environmental Science & Technology Letters, 2021, 8(11): 1009-1014. [30] 王海林, 辛国兴, 朱立敏, 等. 典型橡胶制品业VOCs排放特征及对周边环境影响[J]. 环境科学, 2021, 42(11): 5193-5200. WANG H L, XIN G X, ZHU L M, et al. Emission characteristics and environment impacts of VOCs from typical rubber manufacture[J]. Environmental Science, 2021, 42(11): 5193-5200 (in Chinese).
[31] 赵光贤. 胶鞋喷霜的产生原因及预防措施[J]. 橡胶工业, 2004, 51(12): 753-754. doi: 10.3969/j.issn.1000-890X.2004.12.013 ZHAO G X. Causes for blooming of rubber shoes and their precautions[J]. China Rubber Industry, 2004, 51(12): 753-754 (in Chinese). doi: 10.3969/j.issn.1000-890X.2004.12.013
[32] 李威, 闫福江, 周忠伟. 高效液相色谱法监控胎侧胶中防老剂6PPD的含量[J]. 轮胎工业, 2018, 38(8): 507-510. doi: 10.3969/j.issn.1006-8171.2018.08.015 LI W, YAN F J, ZHOU Z W. Content monitoring of anti-aging agent 6PPD in sidewall by high efficiency liquid chromatography[J]. Tire Industry, 2018, 38(8): 507-510 (in Chinese). doi: 10.3969/j.issn.1006-8171.2018.08.015
[33] 王志伟, 原晓喻, 胡长鹰. 一种高效液相色谱-DAD法测定橡胶中防老剂4020的残留量的方法CN113567591A [P]. 2021-10-29 WANG Z W, YUAN X Y, HU C Y. A method for the determination of antioxidant 4020 residue in rubber by high performance liquid chromatography-DAD method[P]. 2021-10-29 (in Chinese).
[34] 原晓喻, 刘沁芳, 李熠晨, 等. 食品接触用橡胶中防老剂6PPD检测方法建立及适用性[J]. 化学研究与应用, 2024, 36(4): 892-897. doi: 10.3969/j.issn.1004-1656.2024.04.026 YUAN X Y, LIU Q F, LI Y C, et al. Establishment and applicability of detection methods for antioxidant 6PPD in food-contact rubber hoses[J]. Chemical Research and Application, 2024, 36(4): 892-897 (in Chinese). doi: 10.3969/j.issn.1004-1656.2024.04.026
[35] 程畅. 食品接触用橡胶密封垫圈中抗氧化剂的检测与迁移研究[D]. 无锡: 江南大学, 2021. CHENG C. Study on the detection and migration of antioxidants in rubber gaskets for food contact[D]. Wuxi: Jiangnan University, 2021 (in Chinese).
[36] 钱慧敏, 刘艳娜, 姚林林, 等. 非靶标技术在新污染物识别中的应用[J]. 环境化学, 2024, 43(2): 363-376. doi: 10.7524/j.issn.0254-6108.2023021603 QIAN H M, LIU Y N, YAO L L, et al. Recent advances in nontarget discovery of emerging pollutants in the environment[J]. Environmental Chemistry, 2024, 43(2): 363-376 (in Chinese). doi: 10.7524/j.issn.0254-6108.2023021603
[37] 柴佳楦, 王学兵, 于南洋, 等. 基于质谱的高覆盖代谢组学数据采集策略研究进展及在环境毒理学的应用[J]. 环境化学, 2023, 42(8): 2549-2562. doi: 10.7524/j.issn.0254-6108.2022030802 CHAI J X, WANG X B, YU N Y, et al. Research progress of data acquisition strategies for mass spectrometry-based high-coverage metabolomics and its application in environmental toxicology[J]. Environmental Chemistry, 2023, 42(8): 2549-2562 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022030802
[38] CAO G D, ZHANG J, WANG W, et al. Mass spectrometry analysis of a ubiquitous tire rubber-derived quinone in the environment[J]. TrAC Trends in Analytical Chemistry, 2022, 157: 116756. doi: 10.1016/j.trac.2022.116756 [39] 张清智, 吕延延, 黄艳军, 等. 顶空气相色谱-质谱法测定橡胶防老剂4020中的甲基异丁基酮和苯胺[J]. 橡胶科技, 2019, 17(5): 269-272. ZHANG Q Z, LYU Y Y, HUANG Y J, et al. Determination of methyl isobutyl ketone and aniline in antioxidant 4020 by head space gas chromatography-mass spectrometry[J]. Rubber Science and Technology, 2019, 17(5): 269-272 (in Chinese).
[40] 王浩, 李梁, 高杨. 不同老化条件对防老剂6PPD及其应用性能的影响[J]. 轮胎工业, 2022, 42(8): 502-506. WANG H, LI L, GAO Y. Effects of different aging conditions on antioxidant 6PPD and its application performance[J]. Tire Industry, 2022, 42(8): 502-506 (in Chinese).
[41] 彭未娟. 6PPD和IPPD对斑马鱼胚胎的发育毒性效应及机制研究[D]. 武汉: 华中农业大学, 2022. PENG W J. Toxic effects and mechanisms of 6PPD or IPPD on zebrafish (Danio rerio) embryonic development[D]. Wuhan: Huazhong Agricultural University, 2022 (in Chinese).
[42] BOHARA K, TIMILSINA A, ADHIKARI K, et al. A mini review on 6PPD quinone: A new threat to aquaculture and fisheries[J]. Environmental Pollution, 2024, 340: 122828. doi: 10.1016/j.envpol.2023.122828 [43] ZOROUFCHI BENIS K, BEHNAMI A, MINAEI S, et al. Environmental occurrence and toxicity of 6PPD quinone, an emerging tire rubber-derived chemical: A review[J]. Environmental Science & Technology Letters, 2023, 10(10): 815-823. [44] TIAN Z Y, GONZALEZ M, RIDEOUT C A, et al. 6PPD-quinone: Revised toxicity assessment and quantification with a commercial standard[J]. Environmental Science & Technology Letters, 2022, 9(2): 140-146. [45] BRINKMANN M, MONTGOMERY D, SELINGER S, et al. Acute toxicity of the tire rubber-derived chemical 6PPD-quinone to four fishes of commercial, cultural, and ecological importance[J]. Environmental Science & Technology Letters, 2022, 9(4): 333-338. [46] McINTYRE J K, PRAT J, CAMERON J, et al. Treading water: Tire wear particle leachate recreates an urban runoff mortality syndrome in coho but not chum salmon[J]. Environmental Science & Technology, 2021, 55(17): 11767-11774. [47] MASSET T, FERRARI B J D, DUDEFOI W, et al. Bioaccessibility of organic compounds associated with tire particles using a fish in vitro digestive model: Solubilization kinetics and effects of food coingestion[J]. Environmental Science & Technology, 2022, 56(22): 15607-15616. [48] JOHANNESSEN C, HELM P, METCALFE C D. Detection of selected tire wear compounds in urban receiving waters[J]. Environmental Pollution, 2021, 287: 117659. doi: 10.1016/j.envpol.2021.117659 [49] JI J W, HUANG J Z, CAO N N, et al. Multiview behavior and neurotransmitter analysis of zebrafish dyskinesia induced by 6PPD and its metabolites[J]. Science of the Total Environment, 2022, 838: 156013. doi: 10.1016/j.scitotenv.2022.156013 [50] HIKI K, YAMAMOTO H. The tire-derived chemical 6PPD-quinone is lethally toxic to the white-spotted char Salvelinus leucomaenis pluvius but not to two other salmonid species[J]. Environmental Science & Technology Letters, 2022, 9(12): 1050-1055. [51] ZHANG Y H, XU C H, ZHANG W F, et al. p-phenylenediamine antioxidants in PM2.5: The underestimated urban air pollutants[J]. Environmental Science & Technology, 2022, 56(11): 6914-6921. [52] HIKI K, YAMAMOTO H. Concentration and leachability of N-(1, 3-dimethylbutyl)-N'-phenyl-p-phenylenediamine (6PPD) and its quinone transformation product (6PPD-Q) in road dust collected in Tokyo, Japan[J]. Environmental Pollution (Barking, Essex, 2022, 302: 119082. doi: 10.1016/j.envpol.2022.119082 [53] JI J W, LI C S, ZHANG B J, et al. Exploration of emerging environmental pollutants 6PPD and 6PPDQ in honey and fish samples[J]. Food Chemistry, 2022, 396: 133640. doi: 10.1016/j.foodchem.2022.133640 [54] ZHANG Y J, XU T T, YE D M, et al. Widespread N-(1,3-dimethylbutyl)-N' -phenyl-p-phenylenediamine quinone in size-fractioned atmospheric particles and dust of different indoor environments[J]. Environmental Science & Technology Letters, 2022, 9(5): 420-425. [55] KLÖCKNER P, SEIWERT B, WAGNER S, et al. Organic markers of tire and road wear particles in sediments and soils: Transformation products of major antiozonants as promising candidates[J]. Environmental Science & Technology, 2021, 55(17): 11723-11732. [56] LI X X, CHEN X Y, CHEN B, et al. Tire additives: Evaluation of joint toxicity, design of new derivatives and mechanism analysis of free radical oxidation[J]. Journal of Hazardous Materials, 2024, 465: 133220. doi: 10.1016/j.jhazmat.2023.133220 [57] HU X M, ZHAO H N, TIAN Z Y, et al. Transformation product formation upon heterogeneous ozonation of the tire rubber antioxidant 6PPD (N-(1, 3-dimethylbutyl)-N'-phenyl-p-phenylenediamine)[J]. Environmental Science & Technology Letters, 2022, 9(5): 413-419. [58] 张泰硕, 商静静, 刘海勇, 等. 不同环境介质轮胎微塑料老化及小粒径微粒释放特征[J]. 环境科学, 2024, 45(6): 3700-3707. ZHANG T S, SHANG J J, LIU H Y, et al. Aging and small-sized particles release characteristics of tire microplastics in various environmental media[J]. Environmental Science, 2024, 45(6): 3700-3707 (in Chinese).
[59] SCHULZE S, PASCHKE H, MEIER T, et al. A rapid method for quantification of persistent and mobile organic substances in water using supercritical fluid chromatography coupled to high-resolution mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2020, 412(20): 4941-4952. doi: 10.1007/s00216-020-02722-5 [60] YANG F, CHEN Y S, LIU J, et al. Evaluation of matrix effect in determination of mevinphos stereoisomers in tobacco by supercritical fluid chromatography tandem mass spectrometry[J]. Microchemical Journal, 2022, 175: 107174. doi: 10.1016/j.microc.2022.107174 [61] TAKEKANA M, YOSHIDA T, YOSHIDA E, et al. Online SFE-SFC-MS/MS colony screening: A high-throughput approach for optimizing (-)-limonene production[J]. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences, 2023, 1215: 123588. doi: 10.1016/j.jchromb.2022.123588 [62] 田璐, 马英歌, 谭皓新, 等. 超临界流体萃取技术应用于植物叶片中多环芳烃含量测定[J]. 环境化学, 2020, 39(9): 2450-2458. doi: 10.7524/j.issn.0254-6108.2019062304 TIAN L, MA Y G, TAN H X, et al. Application of supercritical fluid extraction in determination of polycyclic aromatic hydrocarbons content in plant leaves[J]. Environmental Chemistry, 2020, 39(9): 2450-2458 (in Chinese). doi: 10.7524/j.issn.0254-6108.2019062304
[63] 张丹阳. 超临界流体色谱串联质谱技术在植物源食品农药多残留检测中的应用研究[D]. 北京: 中国农业科学院, 2021. ZHANG D Y. Application supercritical fluid chromatography-tandem mass spectrometry in the determination of pesticide residues in plant foods[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021(in Chinese).
[64] 董琨, 宫晓平, 李晓东, 等. 在线超临界流体萃取-超临界流体色谱-串联质谱法快速筛查降糖类中成药及保健品中非法添加五种化学药的方法[J]. 企业科技与发展, 2022(7): 56-59. DONG K, GONG X P, LI X D, et al. On-line supercritical fluid extraction-supercritical fluid chromatography-tandem mass spectrometry rapid screening method for illegally adding five chemicals in hypoglycemic Chinese patent medicines and health care products[J]. Sci-Tech & Development of Enterprise, 2022(7): 56-59 (in Chinese).
[65] DI S S, LIU Z Z, ZHAO H Y, et al. Chiral perspective evaluations: Enantioselective hydrolysis of 6PPD and 6PPD-quinone in water and enantioselective toxicity to Gobiocypris rarus and Oncorhynchus mykiss[J]. Environment International, 2022, 166: 107374. doi: 10.1016/j.envint.2022.107374 [66] Electron Spin Resonance (ESR) Spectroscopy 7.1 Introduction[R]. [67] SAEED S, GILLIES D, WAGNER G, et al. ESR and NMR spectroscopy studies on protein oxidation and formation of dityrosine in emulsions containing oxidised methyl linoleate[J]. Food and Chemical Toxicology, 2006, 44(8): 1385-1392. doi: 10.1016/j.fct.2006.03.005 [68] 林炳丞, 王枭, 王健, 等. 工业热过程中无意生成持久性有机污染物的自由基转化机制[J]. 环境化学, 2024, 43(11): 3665-3677. LIN B C, WANG X, WANG J, et al. Free-radical mediated formation mechanisms of unintentionally produced persistent organic pollutants in industrial thermal processes[J]. Environmental Chemistry, 2024, 43(11): 3665-3677(in Chinese).
[69] CATALDO F. Early stages of p-phenylenediamine antiozonants reaction with ozone: Radical cation and nitroxyl radical formation[J]. Polymer Degradation and Stability, 2018, 147: 132-141. doi: 10.1016/j.polymdegradstab.2017.11.020 [70] CATALDO F. Protection mechanism of rubbers from ozone attack[J]. Ozone: Science & Engineering, 2019, 41(4): 358-368. [71] CATALDO F. Aminoxyl (nitroxyl or nitroxide) radical formation by the action of ozone on squalene containing secondary aromatic amine antioxidants[J]. Journal of Vinyl and Additive Technology, 2022, 28(2): 379-389. doi: 10.1002/vnl.21862 [72] CATALDO F, FAUCETTE B, HUANG S, et al. On the early reaction stages of ozone with N, N'-substituted p-phenylenediamines (6PPD, 77PD) and N, N', N''-substituted-1, 3, 5-triazine “Durazone®” : An electron spin resonance (ESR) and electronic absorption spectroscopy study[J]. Polymer Degradation and Stability, 2015, 111: 223-231. [73] CATALDO F. A study on the reaction between N-substituted p-phenylenediamines and ozone: Experimental results and theoretical aspects in relation to their antiozonant activity[J]. European Polymer Journal, 2002, 38(5): 885-893. doi: 10.1016/S0014-3057(01)00248-8 -



 下载:
下载: