-
1929年英国细菌学家弗莱明对青霉素的发现被视为人类历史上最伟大的发现之一,随着科技的进步,抗生素的种类及应用相继拓展. 抗生素是指一些真菌、细菌、放线菌等微生物的次级代谢产物,或是人工合成、半合成的具有抑菌特性的化合物. 其可选择性杀灭各种病原菌性的微生物,按照其化学结构的不同,抗生素可分为:氨基糖苷类、β-内酰胺类、大环内酯类、四环素类、多肽类、磺胺类、喹诺酮类等[1]. 抗生素是对抗细菌感染的有效药物,在治疗人类传染病领域广泛应用,同时对畜牧业和水产养殖业中动物疾病预防和催熟保产亦有重要作用[2]. 然而,相关研究表明,过量抗生素会对身体器官产生毒副作用,例如过量使用β-内酰胺类、大环内酯类抗生素会对中枢神经系统造成伤害[3]. 抗生素在人体及养殖动物体内不能被完全吸收,30%—75%会进入环境,对水体、土壤和其他环境介质等造成污染[4],并会通过施肥、灌溉、饮用等方式由环境进入动物、农作物中,不但会对农作物、畜牧动物生长造成影响,甚至是农畜产品及水产产品(牛奶、肉类和鱼类等)中也会含有抗生素[5 − 6],另外还会通过食物链进入人体,造成过敏反应和胃肠道紊乱等危害[7]. 另外,抗生素滥用诱发细菌耐药性问题日益严重. 目前,全球因感染多重耐药性的“超级细菌”而导致临床药物失效的公共卫生事件频发. 据世界卫生组织统计,每年超70万人死于抗生素耐药细菌感染,预计到2050年,死亡人数或超千万,经济损失达百万亿美元[8]. 2022年,我国颁布的《新污染物治理行动方案》,已将抗生素列为新的重点管控污染物之一,并规范其使用管理,以减少抗生素用量及细菌耐药性的危害. 可见,建立准确、快捷的抗生素检测方法是监测其污染的首要前提,具有重要实践意义.
随着人们对抗生素污染物的高度关注,开发了多种检测方法,主要包括高效液相色谱法[9]、毛细管电泳法[10]、电化学分析法等. 抗生素在环境中分布种类多、含量低,检测需大量样品富集且难实现实时监测. 而传统的检测方法样品前处理步骤复杂繁琐、耗时长且费用昂贵,无法满足对抗生素残留浓度大范围监测的需求. 相比之下,基于光学原理的光学分析法灵敏度高、操作简单、成本低、通量大、速度快,可通过传感分子/材料自身与抗生素分子结合前后的光学信号(荧光、可见光等)变化,快速、精准实现抗生素污染物的定性和定量分析. 据文献报道,化学发光法[11]、比色法[12]、荧光法[13]、表面等离子共振法[14]、表面增强拉曼散射法[14]等光学分析法被设计和开发用于抗生素检测,是未来实现构建时空分辨的抗生素大数据网络平台的不二之选.
本文旨在对现有基于光学原理的抗生素检测方法进行综述,梳理各种方法的检测原理及应用,归纳优缺点,为未来基于光学原理的新型抗生素检测技术开发提供新思路. 本文主要分为3个部分:第一部分简介常见抗生素的化学性质、应用及危害;第二部分着重阐述现有光学分析法在检测抗生素应用中的优缺点;第三部分为基于光学分析法的抗生素检测技术开发的总结和展望.
-
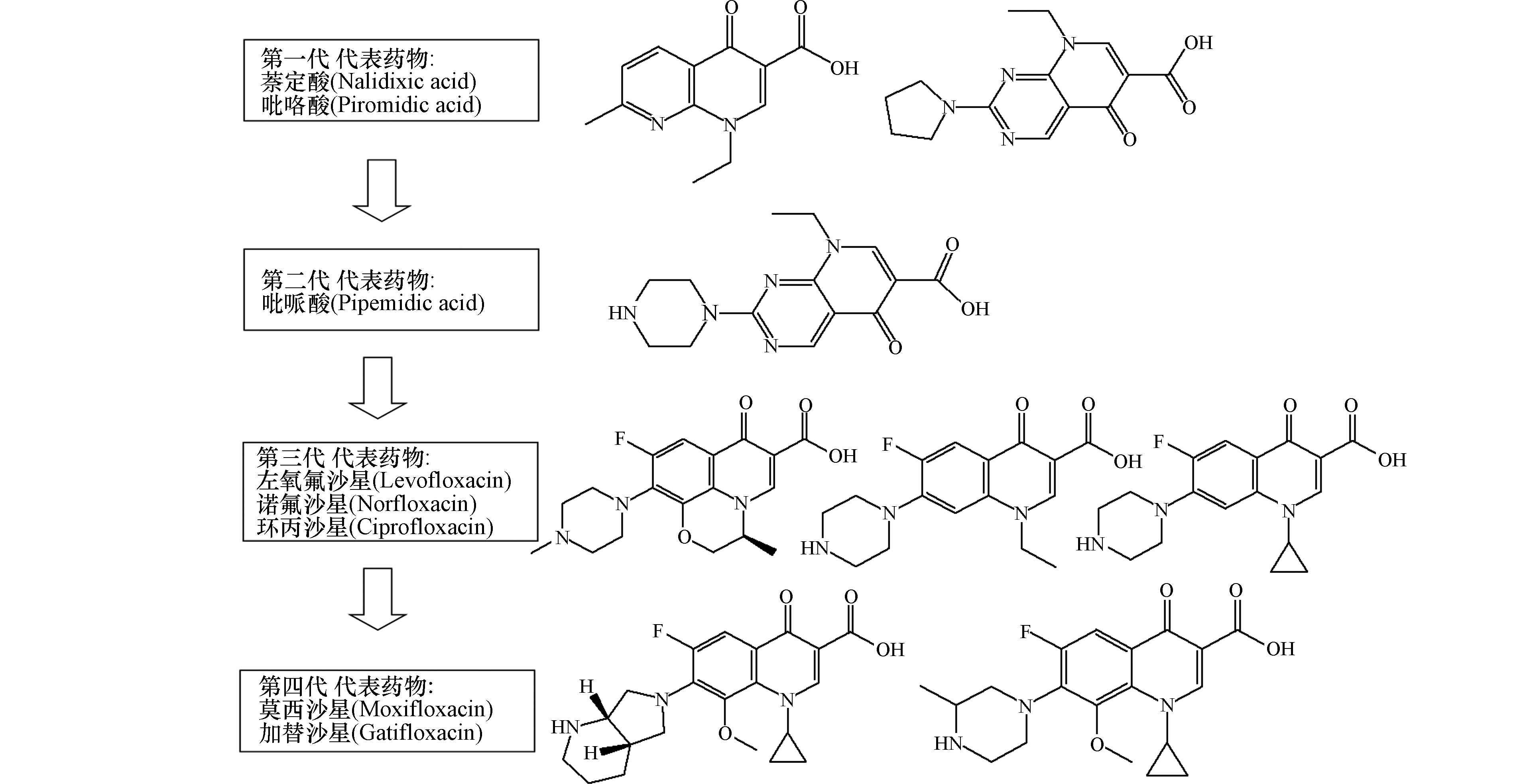
喹诺酮类抗生素是治疗人类多种病原体感染的有效药物,也被用于陆生和水生可食用动物以及兽医诊所等领域[15]。喹诺酮类抗生素主要源于人工合成,是一种真正的合成抗菌剂. 按发明先后及其抗菌性能差异,划分为一至四代,如图1所示.
喹诺酮类药物所带来的环境污染问题不可忽视,目前,在世界各国的地表水、医院急诊室排出物、农场周围土壤中大量的喹诺酮类药物被检出[12]. 有研究表明,环境中大量喹诺酮类抗生素的残留,不仅会诱导相应耐药基因的产生,还能够通过微生物基因水平转移而持续传播,加速“超级细菌”的出现和增殖,危及生态安全和生物健康,并会诱发过敏、免疫疾病和生殖障碍等人体疾病[4].
-
四环素类抗生素是一种广谱抗菌素,是一种两性物质,较早应用于临床,结构如图2所示,对革兰氏阴性菌、革兰氏阳性菌、螺旋体、放线菌等具有较强抑制作用. 四环素类药物常被用于胃、膀胱、口腔黏膜和肺部恶性肿瘤的诊断和治疗,但其仅有一小部分能被机体代谢或吸收,通常高达75%以活性物质的形式从排泄物中释放出来,从而在地表水、地下水、饮用水、废水、沉积物中等积累. 畜禽中四环素类残留药物可通过动物性食品进入人体,会对人体肠道、胃、肾和肝脏造成损害[16 − 18]. 若在牙齿发育期间服用此类药物,其成分进入牙釉质,会导致牙齿发黄、牙釉质发育不良等牙齿问题;对伴有肾功能问题的患者,此药物可能会使原有肾疾病症状加重.
-
磺胺类抗生素是一类重要的广谱抗生素,结构如图3所示. 该类抗生素性质较稳定、不易变质且价格低廉,对常见细菌感染具有良好的抗菌活性[19],其可口服,吸收较迅速,在医药、畜牧业、水产养殖等领域广泛应用. 此类抗生素在大多数欧洲国家被广泛用作饲料添加剂,因此在动物食品中可能存在磺胺类药物残留,特别是牛奶和其他乳制品中[20]. 长期过度使用此类药物导致每年有超过2万吨的磺胺类抗生素排放到环境中,磺胺类抗生素有很高的毒性,即使在ng·L−1浓度下,也会严重影响环境和生物体健康[21]. 此类药物的持续使用可能会导致靶向病原菌产生耐药性[22],其易引起血小板减少及再生障碍性贫血,肝功能衰退,甚至会导致肝坏死.
-
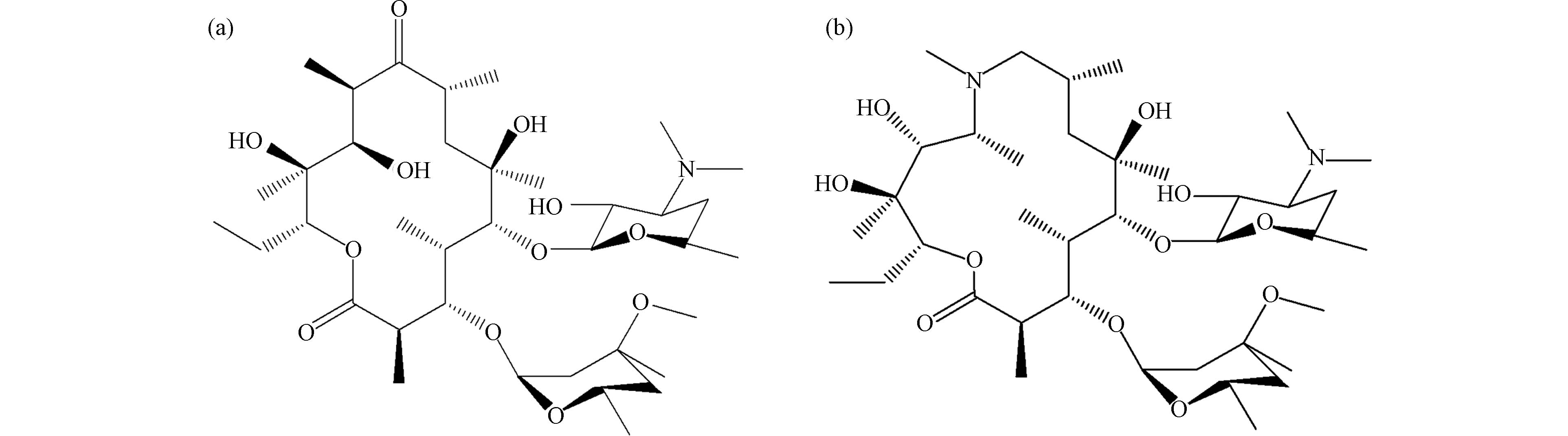
大环内酯类抗生素由链霉菌产生,是一类非常重要的亲脂性抗生素,其中,红霉素、阿奇霉素结构如图4所示. 大环内酯类抗生素对大部分革兰氏阳性菌、部分革兰氏阴性菌、部分厌氧菌等均有较强的抗菌活性. 由于其价格低廉有效,常用于预防和治疗各种疾病. 然而,因为过量或不正确地使用可能导致大环内酯类药物残留在动物源性食品中,如蜂蜜、乳制品和肉类等食品. 30%—90%的大环内酯类抗生素会以其原始形态通过粪便和尿液排出体外,且进入环境的速度超过其降解速度,因此可通过食物链积累转移到人体,并可能引起胃肠道功能障碍、耳蜗神经损伤等不良反应[23].
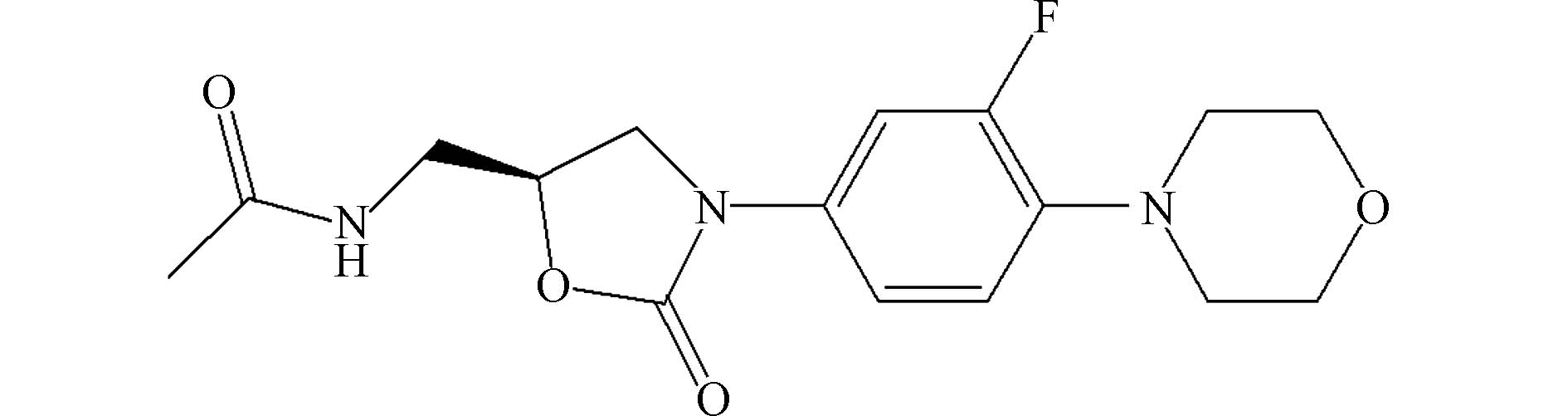
恶唑烷酮类抗生素是一类新近合成的抗生素,对革兰氏阳性菌具有活性. 在恶唑烷酮类药物中,利奈唑胺被广泛应用于治疗革兰氏阳性菌感染[24],其结构如图5所示. 利奈唑胺是一种相对安全的药物,不限年龄使用,然而,约30%的药物会以原始药物的形式随尿液排泄,并且长期使用此药物可能会造成神经损伤[25].
-
光学分析法具有灵敏度高、操作简单、成本低、检测耗时短等技术优势. 下面将分别阐述化学发光法、比色法、荧光法的原理及其在抗生素检测领域的应用.
-
在不使用任何外部激发源(例如光、声音、加热甚至机械力)的情况下从化学反应中引发电磁辐射,反应能量以光的形式发射,此现象称为化学发光(Chemiluminescence,CL)[26]. 化学发光法利用化学发光强度与被测物浓度之间的关系从而实现物质浓度的测定,它不需要任何光源,并且可通过一种简单且具有成本效益的装置轻松实现[27]. 化学发光与其它发光分析的本质区别在于体系产生发光(光辐射)所吸收的能量来源不同,体系产生化学发光,必须具有一个产生可检信号的光辐射反应和一个可一次提供足够能量导致发光现象的单独反应步骤的化学反应[28]. 化学发光法可通过抗生素和氧化剂反应产生的化学发光来实现对抗生素的检测,也可利用抗生素或其降解物对化学发光体系的增强或抑制作用来进行测定;另外,还可根据化学发光反应构建化学发光传感器并与其他技术联用,从而对检测灵敏度、选择性等进行优化[11]. 下面将简要介绍部分常用于抗生素检测的化学发光体系.
-
鲁米诺是一种化学荧光分子,具有结构简单、化学性质稳定且易于合成等优点. 其在H2O2存在的条件下可以转变成激发态氨基邻苯二甲酸,从激发态回到基态,会发出425 nm的蓝光. 鲁米诺-H2O2体系是应用较早、较广泛化学发光体系,但鲁米诺与H2O2的化学发光反应速度相当缓慢,需借助催化剂来提高其反应速度,另外选择性差和发射强度相对较低是阻碍其进一步扩展的两个主要缺点. 纳米粒子可以作为化学发光反应中的增强剂、生物分子载体和分离工具,包括金、银和氧化铜等具有氧化还原催化特性的纳米粒子可结合到化学发光检测系统中以优化选择性,提高灵敏度[26]. Iranifam等[26]开发了一种简单、灵敏的氧化铜纳米粒子(CuO NPs)增强化学发光方法,用于检测β-内酰胺类抗生素阿莫西林和头孢唑啉钠. 该方法基于β-内酰胺类抗生素对CuO NPs-鲁米诺-H2O2化学发光反应的抑制作用. 阿莫西林和头孢唑啉钠的检测限分别为7.9 × 10–7 mol·L−1、1.8 ×10–5 mol·L−1.
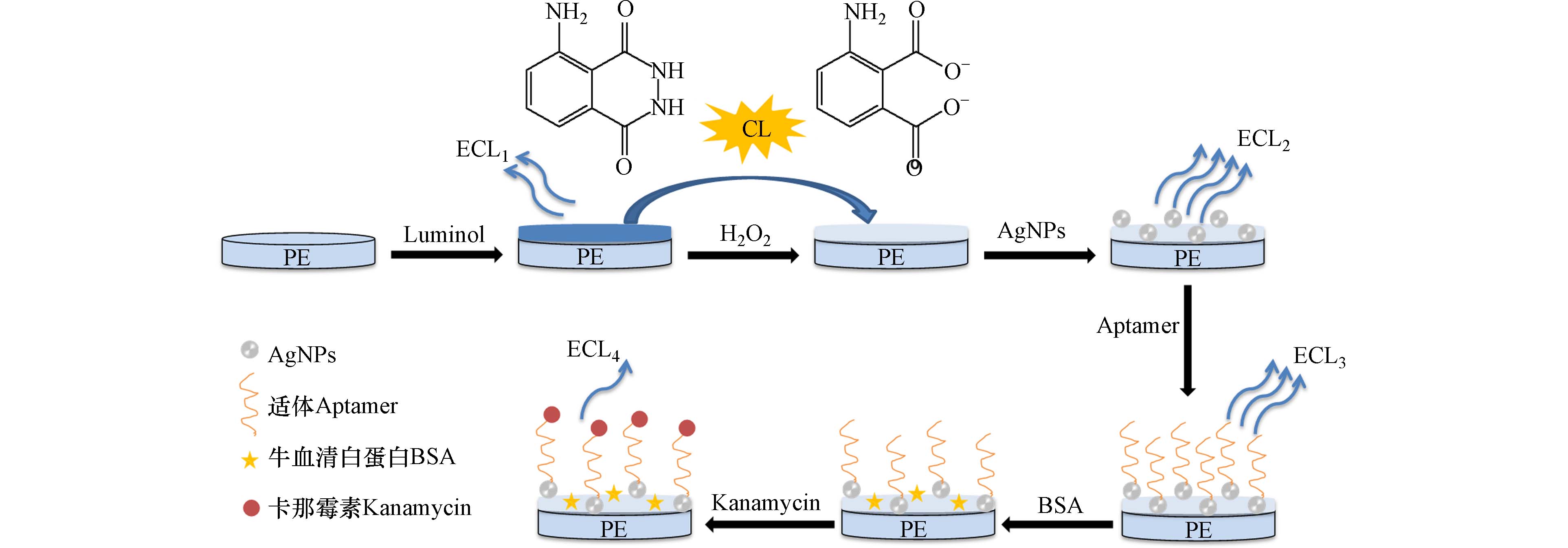
另有通过电化学发光来提高化学发光体系选择性. 电化学发光是通过电极施加电压进行电化学反应,反应所产生的电化学中间体而引发的发光现象,其结合了电化学和化学发光优点,具有较高的灵敏度和选择性. Cheng等[29]构建了用于检测卡那霉素的超灵敏电化学发光适体传感器,其检测原理如图6所示. 在体系中加入银纳米粒子(AgNPs)增强鲁米诺-H2O2系统化学发光强度,并采用0.5%牛血清白蛋白(BSA)溶液以封闭非特异性位点. 当目标卡那霉素存在时,与适体之间的特异性相互作用使电化学发光信号明显减弱,因此,卡那霉素的浓度可以根据电化学发光的强度来确定,检测限为0.060 ng·mL−1.
-
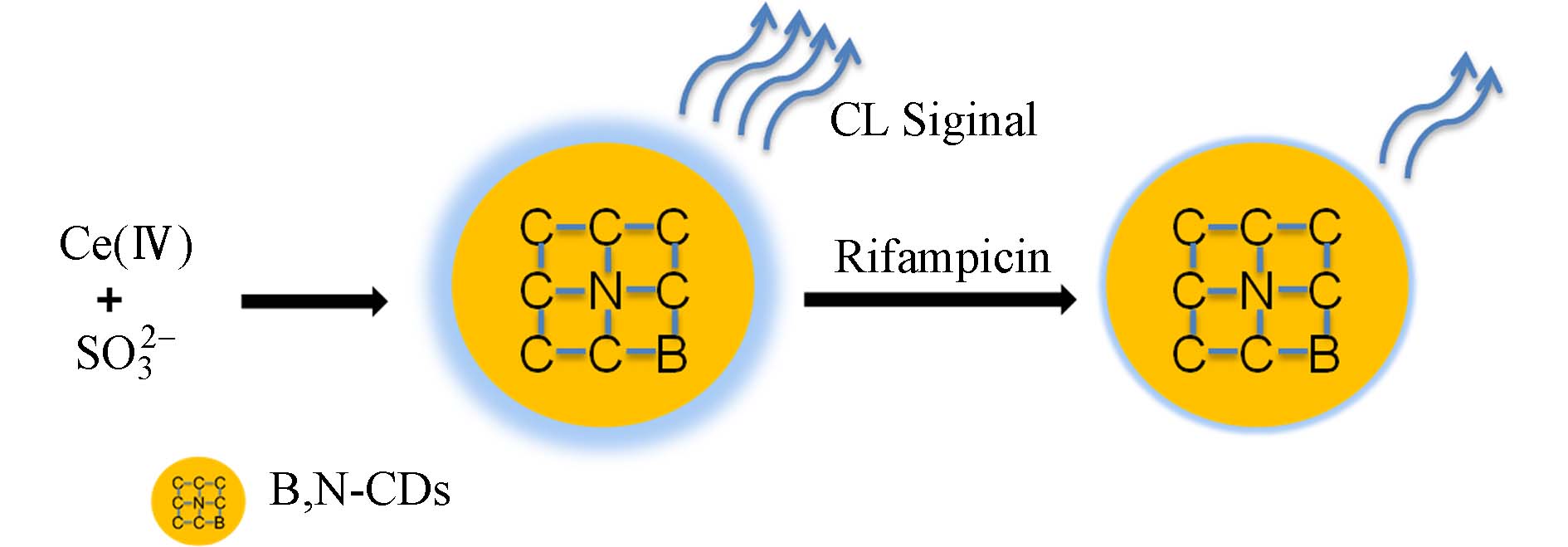
Ce(Ⅳ)与亚硫酸盐、高锰酸盐、重铬酸盐或碘酸盐等物质发生氧化还原反应可产生化学发光,发光体系较简单,此发光体系可通过有机化合物增敏. 近年来,碳纳米粒子也广泛用于化学发光领域[30]. Shokri等[30]利用硼氮共掺杂碳点(B,N-CDs)在化学发光反应中的突出行为,将其用于利福平抗生素的分析,其检测原理如图7所示. B,N-CDs用作Ce(Ⅳ)-SO32--CL系统的增强剂, 显著增强了化学发光强度,而利福平对此系统的化学发光具有显著的减弱作用,利用这种现象,开发了一种灵敏的传感器,用于测定利福平,检测限为0.050 nmol·L−1.
-
将化学发光与流动注射技术联用,可加快反应速度,提高重现性[11]. 李念兵等[31]通过流动注射抑制化学发光检测强力霉素. 在碱性环境中,强力霉素对鲁米诺-KMnO4化学发光体系具有较强抑制作用,结合流动注射技术,实现对强力霉素的检测,检测限为2.0 × 10–3 μg·mL−1.
另有化学发光与毛细管电泳技术联用,毛细管电泳具有设备简单、效率高及运行成本低等优点. 将化学发光的高灵敏度与毛细管电泳的高分离效率相结合,可获得较优的检测结果. 代婷婷等[32]通过毛细管电泳分离待测物质,并利用Ag(Ⅲ)配合物-鲁米诺化学发光体系构建化学发光检测器,对动物源性食品中磺胺甲噁唑、磺胺二甲氧嘧啶和磺胺噻唑残留进行分离检测,检测限分别为0.33、0.20、0.034 μg·mL−1.
近几十年来,化学发光法因其灵敏度高、操作简单、设备便宜、重现性好、速度快而受到广泛关注,在许多科学领域都有应用,包括食品、临床、法医、环境和药物分析等. 但同时此方法仍需进行不断优化来扩展检测范围,满足检测要求. 完善现有化学发光体系,开创新的化学发光体系,将化学发光体系与毛细管电泳、流动注射等技术联用,使其更广泛应用于抗生素检测领域.
-
利用肉眼观察溶液颜色变化,或用光电比色计进行测量来确定溶液中待测物质浓度的方法称为比色法. 原理是通过被测物质形成的溶液颜色或加入显色剂后有色溶液的颜色,根据光被有色溶液吸收的强度,即利用朗伯-比尔定律(A=εbc)可测定溶液中物质的含量. 金纳米粒子(AuNPs)是最常用于比色法的材料,检测原理如图8所示,下面对其在抗生素检测中的应用进行简要介绍.
-
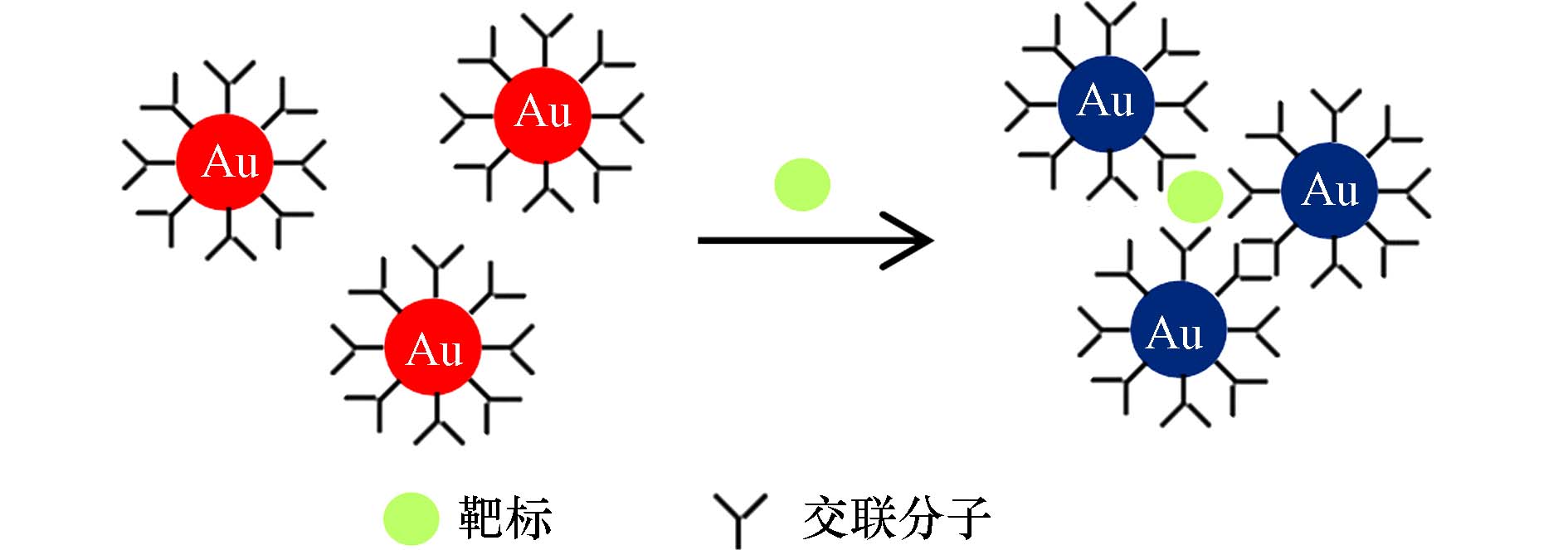
AuNPs具有独特的光学特性和高消光系数,被认为是用于检测各种小分子和离子的比色信号转换的有前途的候选材料. 通常,低直径AuNPs均匀地分散在溶液中,溶液呈红色并在520 nm处具有强吸收,AuNPs聚集变大后,溶液会从红色逐渐变为蓝色,导致吸收峰显著移动[12],以此来实现对待测物质的检测. 张彩艳等[34]基于AuNPs比色法对牛奶样品中卡那霉素的进行检测. 原理即AuNPs与质子化的卡那霉素阳离子结合,溶液颜色由酒红色变为蓝紫色,520 nm处的吸光度明显降低,620 nm处吸光度增加,根据吸光度值得出待测卡那霉素浓度,检测限为33 nmol·L−1. 此方法制备简单,操作方便,但选择性较差.
-
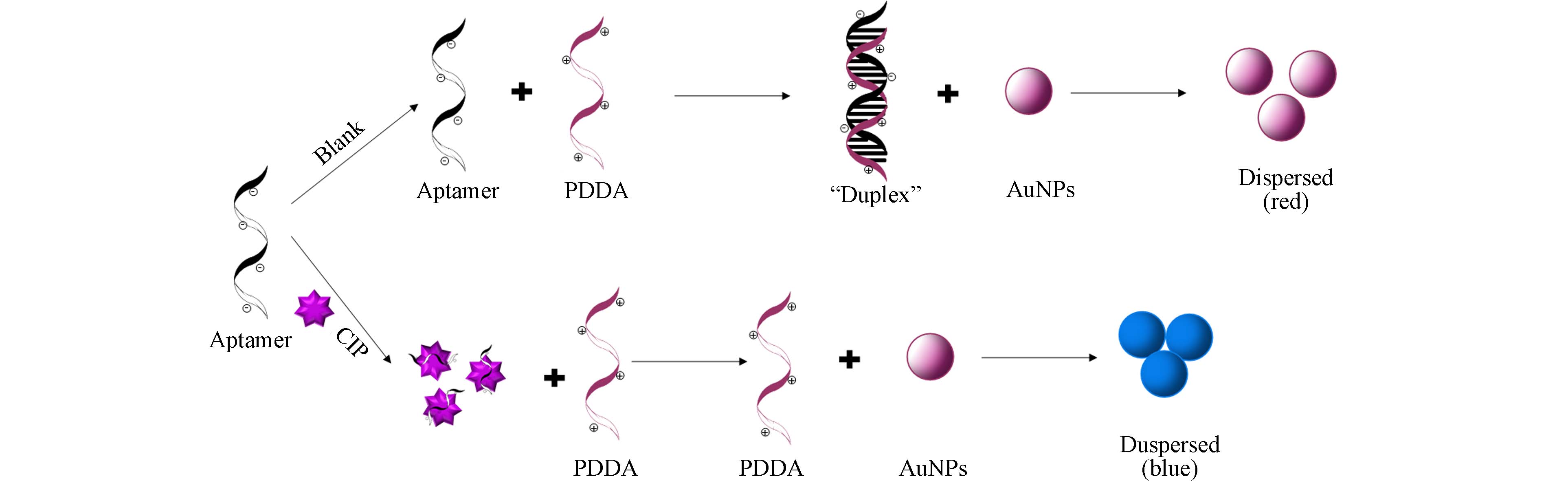
溶液中加入适体可提高体系选择性. 适体是短的单链寡核苷酸(DNA或RNA),可通过指数富集配体系统进化(SELEX)的体外过程进行选择,可以高亲和力和特异性结合目标分子,其还具有检测时间短、成本低和可修饰性高等优点,在抗生素等环境污染物检测领域具有潜力[12]. Huang等[12]建立了未修饰的适体和AuNPs溶液中检测环丙沙星的比色法,检测原理如图9所示. 在没有环丙沙星的情况下,适体可以通过静电相互作用与聚二甲基二烯丙基氯化铵(PDDA)杂交形成“双链体”结构,AuNPs保持分散在溶液中,溶液呈红色,在520 nm处出现明显的吸收峰;环丙沙星存在的情况下,适体可以特异性结合环丙沙星,因此PDDA可以聚集AuNPs,溶液颜色相应地由红色变为蓝色,在650 nm处呈现强吸收. 在一定条件下,AuNPs聚集程度与环丙沙星浓度成正比,以此对环丙沙星进行定性和定量分析,检测限为0.215 nmol·L−1.
-
在某些方面,AgNPs比色法相比较于AuNPs更具有成本效益[35]. Ganesh Dattatraya Saratale等[35]将金霉素包被的银纳米粒子(AgNPs-金霉素)作为传感元件,提出了一种用于测定链霉素和卡那霉素的选择性和灵敏的比色探针. 链霉素和卡那霉素不仅为目标分析物,而且还用作与AgNPs-金霉素探针静电耦合的分子接头,引起明显的颜色变化,从黄色到红色,同时也可通过紫外-可见光谱检测到,检测限分别为2000 pmol·L−1和120 pmol·L−1. 但AgNPs稳定性不如AuNPs且具有生物毒性,限制了其应用.
Abedalwafa[36]基于镍离子(Ni2+)固定的羧甲基纤维素/聚丙烯腈纳米纤维膜 (Ni@CMC/PAN NFMs)进行比色条设计和制造,结合静电纺丝技术、表面改性和固定化,用于土霉素检测. 金霉素中含有大量O和N的基团,具有与Ni2+络合的强烈趋势,在比色条上诱导颜色从浅绿色变为黄色,肉眼检测限为5.0 nmol·L−1. 此方法具有响应快、灵敏度高、选择性好等优点,可为比色材料的设计和开发提供新思路.
近年来,比色法因其成本相对较低、制备简单、选择性好、操作方便、易丢弃、检测时间短、不需要复杂设备、仅通过颜色变化即可被肉眼识别等特点而受到越来越多的关注,已被应用于重金属离子、药物和抗生素等有害物质的定性定量检测[37 − 38]. 但比色法也存在一些不足之处,例如目视比色法是靠人类肉眼观察颜色变化,存在主观误差,准确度较低,常用于定性或半定量分析. 因此开发出精确、快捷的技术来消除人为主观误差,提高比色法的精确度是未来研究的侧重方向.
-
荧光探针可在远紫外-近红外区域进行检测,利用待检测物质导致荧光产生或淬灭来实现对目标物的检测. 常用于荧光检测的探针包括有机荧光染料(荧光素、罗丹明、BODIPY、花青等)、无机荧光复合物、无机量子点和金、银纳米材料等[14]. 下面将分别介绍荧光探针与不同材料复合在抗生素检测中的应用.
-
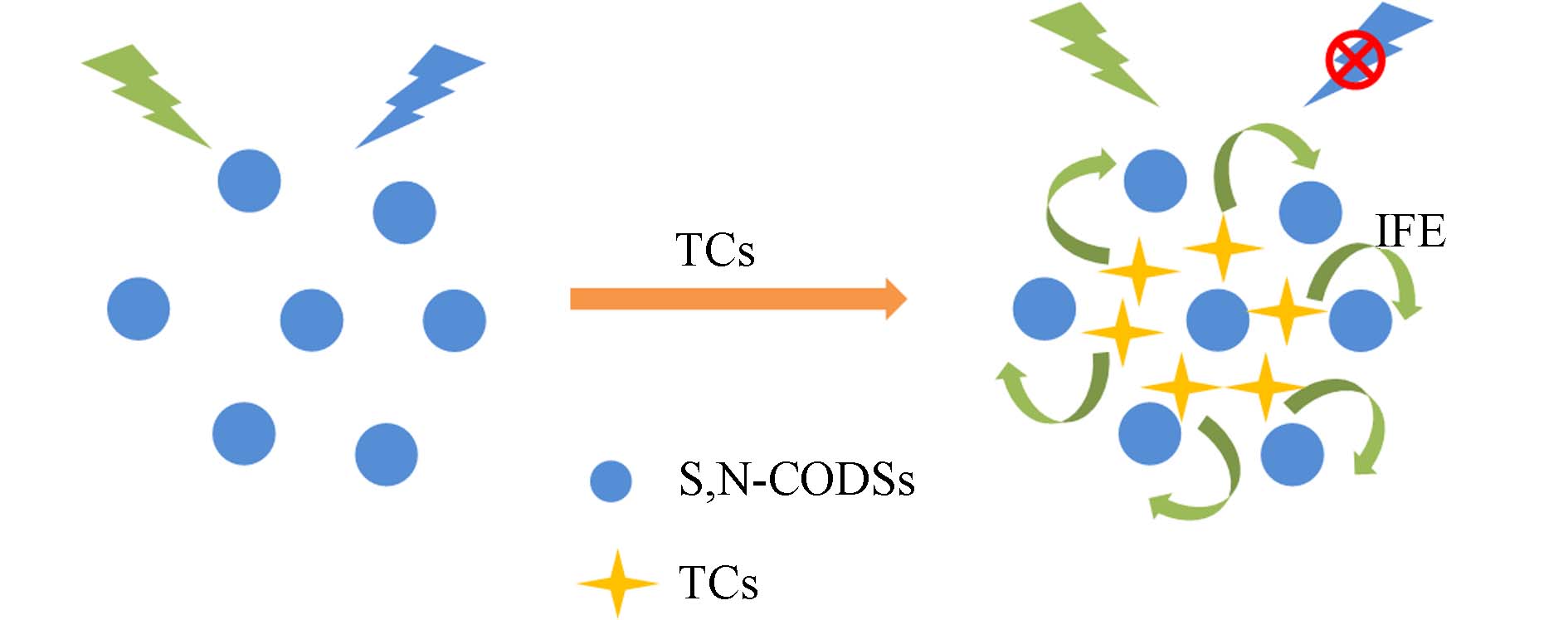
纳米材料具有优异的发光特性,如激发光谱宽、发射波长可调和光稳定性好等优点[14],荧光探针与纳米材料复合可提高荧光法的灵敏度和选择性. Orachorn等[39]合成了含有氧化石墨烯、聚苯胺和CdTe量子点的纳米探针,并将其纳入分子印迹聚合物中来检测食品中的洛美沙星. 基于洛美沙星与纳米复合荧光探针表面的特异性识别位点结合导致荧光猝灭来定量分析,探针的检测限为0.070 μg·L−1. Fan等[40]建立了一种基于S, N掺杂碳量子点(S,N-CQDs)的新型荧光探针,用于快速检测四环素类抗生素(TCs),检测原理如图10所示. S, N-CQDs可以特异性结合四环素类抗生素,通过内滤效应(IFE),量子点荧光被有效猝灭,从而实现对四环素类抗生素的鉴定和定量,检测限为0.56 μmol·L−1.
-
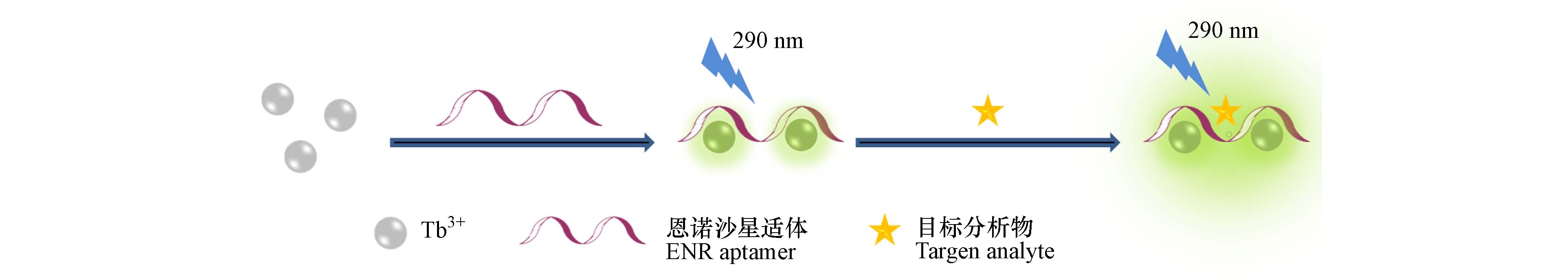
适体也可有效提高荧光探针的检测性能[14],适体的引入可使探针具有良好的选择性. Chen等[41]制备了一种新型Tb3+-恩诺沙星适体探针,用于特异性检测恩诺沙星、诺氟沙星和环丙沙星3种氟喹诺酮类药物,检测原理如图11所示. 在目标分析物存在的情况下,Tb3+-恩诺沙星适体探针与其特异性结合,导致探针的荧光发射增强,以此实现对3种氟喹诺酮类药物的检测,恩诺沙星、诺氟沙星和环丙沙星的检测限分别为0.061、0.020、0.053 ng·mL−1.
-
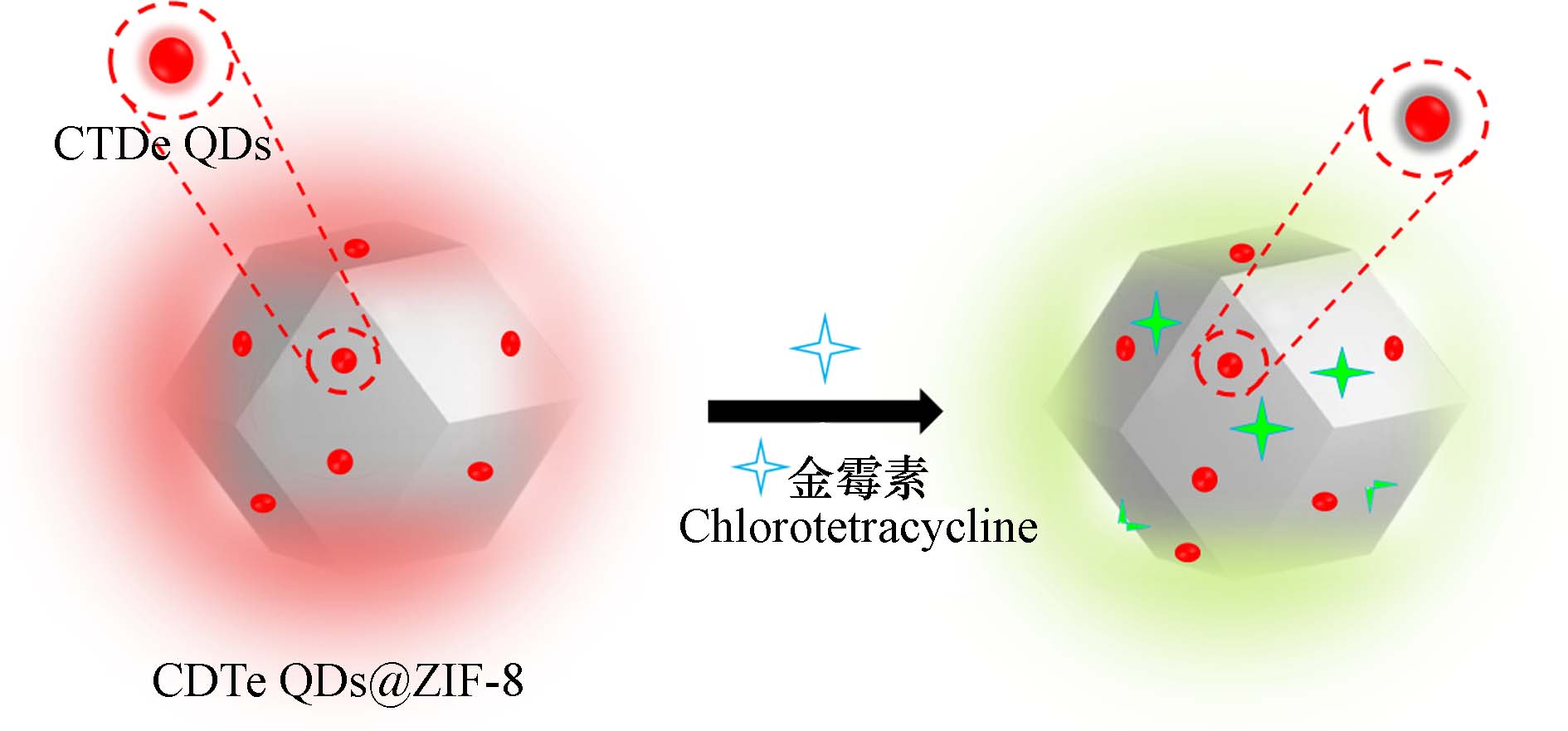
金属有机骨架材料(MOF) 是由金属离子和有机配体通过配位键连接而成的结晶多孔材料, 具有独特的发光特性、高孔隙率和可重复使用性等优点[42 − 43]. Yang等[42]通过将CdTe量子点嵌入ZIF-8生成复合材料CdTe QDs@ZIF-8,用于金霉素比例荧光分析,检测原理见图12. 添加金霉素后,在ZIF-8中Zn2+的敏化作用下,金霉素出现绿色发光,由于金霉素的内滤效应诱导CdTe量子点的红光猝灭,该体系以1min的短响应时间检测金霉素,检测限为37 nmol·L−1,具有实际应用潜力.
近年来,荧光探针克服了传统方法的不足,操作简单,分析快速,选择性好,仪器价格低廉,越来越受到研究者们的关注. 但在荧光分析过程中,易受多种因素影响,从而影响检测结果. 由于不是所有物质都具备荧光特性,并且分析过程中易受一些散射光的影响,应用范围较局限. 将荧光探针与不同材料进行复合来提高检测性能,从而拓宽其应用范围.
本部分简介了应用于抗生素检测的光学分析法的原理及优缺点,并对前文所述光学分析法优劣势进行比较(如表1所示). 纳米材料在光学分析法中应用较广泛,金属有机骨架材料(MOF)作为一种新型的材料在光学分析法中应用具有潜力. 光学分析法的优势在于可以快速、高精度完成对实际样品中存在的微量抗生素污染物的检测,降低了人力、物力消耗成本. 同时,光学分析法在检测过程中也存在一些问题,比如化学发光法选择性差、比色法易产生主观误差导致准确率降低、荧光法应用范围局限等,有待进一步研究解决,以充分发挥光学分析法的优势.
-
利用光学分析法检测实际样品中抗生素的残留应用广泛. 在食品安全领域,用于食品样品的快速分析,检测蜂蜜、牛奶、鱼类等食物中各类抗生素的残留,以提高食品安全性,避免食品中残留的抗生素危害人体;在医学领域,检测人尿、血液中抗生素含量,节省资源,并可缩短检测时间,从而可对患者进行快速精准治疗;在生态环境领域,对环境水样(湖水、自来水、河水等)中的抗生素残留进行检测,方便对水样进行针对性净化处理,避免毒害人类及其他生物体.
抗生素广泛使用给人类带来福利的同时,也给环境及生物体带来难以估量的危害,因此对抗生素的检测至关重要. 本文对化学发光法、比色法、荧光法等光学分析法及其在抗生素检测中的应用作了综述,阐明上述方法的优势及不足之处. 在实际样品检测中,由于所含成分的复杂性,使检测过程变得困难,导致检测结果的精度发生不同程度的偏差. 因此,开发多种方法联用且简便、准确、快捷的检测方法是未来需要侧重的研究方向,以实现对抗生素的精准检测分析.
基于光学分析法的抗生素检测研究进展
Research progress in antibiotic detection based on optical analysis
-
摘要: 抗生素滥用诱发了各类环境问题,同时也对人类和其他生物的健康造成威胁. 本文对喹诺酮类、四环素类、磺胺类等抗生素的化学特性、应用及危害进行综述,并对化学发光法、比色法、荧光法等光学分析法的原理及应用进行评析. 以开发简便、准确、快捷的检测方法为研究方向,为实现抗生素污染物的精准检测提供新视角.Abstract: The abuse of antibiotics has caused various environmental problems but also posed a threat to the health of humans and other organisms. This paper reviews the chemical characteristics, applications and hazards of quinolones, tetracyclines, sulfonamides and other antibiotics and presents an overview of principles and applications such as chemiluminescence, colorimetry and fluorescence. Taking the development of simple, accurate and fast detection methods as the research direction, so it can provide a new perspective for achieving precise detection of antibiotic contaminants.
-
Key words:
- antibiotics /
- chemiluminescence /
- colorimetry /
- fluorescence.
-

-
图 6 电化学发光适体传感器检测卡那霉素原理示意图[29]
Figure 6. Schematic diagram of electrochemiluminescence aptamer sensor for detecting kanamycin
表 1 不同光学分析法比较
Table 1. Comparison of different optical analysis methods
检测方法 Methods 体系
Systems优势
Advantages劣势
Disadvantages参考文献
Reference化学发光法 鲁米诺化学发光体系 结构简单、化学性质稳定且易于合成 选择性差,反应速度缓慢 [26] Ce(Ⅳ)化学发光体系 发光体系较简单 灵敏度较低 [30] 生物化学发光体系 灵敏度高、发光效率高 生物体系稳定性较差 [44] 化学发光体系与流动注射法、毛细管电泳法等技术联用 相比较于单一化学发光体系,检测效率、灵敏度等均得到优化 应用领域有待拓展 [31 − 32] 比色法 金纳米适配体传感器 避免了使用有机溶剂和复杂的预处理程序,具有对原料奶中抗生素残留进行半定量分析的潜力 结果准确性易受离子干扰 [8] 金霉素涂层银纳米粒子作为传感元件的比色探针 经济成本比AuNPs低,快速,具有皮摩尔级灵敏度 AgNPs探针对NaCl有反应,可能会产生假阳性结果 [35] 荧光法 利用铜纳米团簇(CuNC)的聚集诱导发射特性构建比率荧光探针(CuNC-Al3+) 具有良好的灵敏度和
选择性在紫外光下检测生物样品时,检测结果可能会受到生物底物荧光的干扰 [45] S, N掺杂碳量子点(S, N-CQDs)荧光
传感器S, N-CQDs制备简单,成本低,灵敏度高,选择性好 实际样品检测需进行复杂的样品前处理过程 [40] 基于Tb3+和适体的荧光探针 具有高选择性和灵敏度、低成本、操作方便、检测时间短、无需复杂设备等特点; 适体对检测环境要求较高 [41] 基于CdTeQDs@ZIF-8复合材料的比例荧光传感器 采用金属有机框架(MOFs)作为复合材料,易回收,检测响应时间短 由于实际样品的复杂性,可能会影响定量分析 [42] -
[1] 尤启冬. 药物化学[M]. 3版. 北京: 化学工业出版社, 2016. YOU Q D. Pharmaceutical chemistry[M]. 3rd ed. Beijing: Chemical Industry Press, 2016(in Chinese).
[2] NISHA A. Antibiotic residues - A global health hazard[J]. Veterinary World, 2008, 2(2): 375. doi: 10.5455/vetworld.2008.375-377 [3] ARULKUMARAN N, ROUTLEDGE M, SCHLEBUSCH S, et al. Antimicrobial-associated harm in critical care: A narrative review[J]. Intensive Care Medicine, 2020, 46(2): 225-235. doi: 10.1007/s00134-020-05929-3 [4] LANG L, ZHANG Y, YANG A J, et al. Macrophage polarization induced by quinolone antibiotics at environmental residue level[J]. International Immunopharmacology, 2022, 106: 108596. doi: 10.1016/j.intimp.2022.108596 [5] ZHU Y R, LU Y G, SHI L Y, et al. β-Cyclodextrin functionalized N, Zn codoped carbon dots for specific fluorescence detection of fluoroquinolones in milk samples[J]. Microchemical Journal, 2020, 153: 104517. doi: 10.1016/j.microc.2019.104517 [6] 刘爽, 朱海荣, 于燕萍, 等. 土壤中抗生素检测技术研究进展[J]. 安徽农业科学, 2020, 48(20): 9-13,16. doi: 10.3969/j.issn.0517-6611.2020.20.003 LIU S, ZHU H R, YU Y P, et al. Research progress of antibiotic detection technology in soil[J]. Journal of Anhui Agricultural Sciences, 2020, 48(20): 9-13,16 (in Chinese). doi: 10.3969/j.issn.0517-6611.2020.20.003
[7] WANG G, ZHANG H C, LIU J, et al. A receptor-based chemiluminescence enzyme linked immunosorbent assay for determination of tetracyclines in milk[J]. Analytical Biochemistry, 2019, 564/565: 40-46. doi: 10.1016/j.ab.2018.10.017 [8] DÍAZ-GARCÍA V, CONTRERAS-TRIGO B, RODRÍGUEZ C, et al. A simple yet effective preanalytical strategy enabling the application of aptamer-conjugated gold nanoparticles for the colorimetric detection of antibiotic residues in raw milk[J]. Sensors, 2022, 22(3): 1281. doi: 10.3390/s22031281 [9] MONTEIRO M, SPISSO B, FERREIRA R, et al. Development and validation of liquid chromatography-tandem mass spectrometry methods for determination of beta-lactams, macrolides, fluoroquinolones, sulfonamides and tetracyclines in surface and drinking water from Rio de Janeiro, Brazil[J]. Journal of the Brazilian Chemical Society, 2018, 29(4): 801-813. [10] NGUYEN T A H, PHAM T N M, LE T B, et al. Cost-effective capillary electrophoresis with contactless conductivity detection for quality control of beta-lactam antibiotics[J]. Journal of Chromatography. A, 2019, 1605: 360356. doi: 10.1016/j.chroma.2019.07.010 [11] 张静霞, 唐克慧, 常宁, 等. 化学发光分析法及其在抗生素分析中的应用进展[J]. 国外医药(抗生素分册), 2009, 30(2): 63-67. ZHANG J X, TANG K H, CHANG N, et al. Development and application of chemiluminescence method in antibiotic analysis[J]. World Notes on Antibiotics, 2009, 30(2): 63-67 (in Chinese).
[12] HUANG W W, WANG Y C, WANG L M, et al. Colorimetric detection of ciprofloxacin in aqueous solution based on an unmodified aptamer and the aggregation of gold nanoparticles[J]. Analytical Methods:Advancing Methods and Applications, 2021, 13(1): 90-98. [13] LIANG N N, HU X T, LI W T, et al. A dual-signal fluorescent sensor based on MoS2 and CdTe quantum dots for tetracycline detection in milk[J]. Food Chemistry, 2022, 378: 132076. doi: 10.1016/j.foodchem.2022.132076 [14] SUN Y M, ZHAO J L, LIANG L J. Recent development of antibiotic detection in food and environment: The combination of sensors and nanomaterials[J]. Microchimica Acta, 2021, 188(1): 21. doi: 10.1007/s00604-020-04671-3 [15] MILLANAO A R, MORA A Y, VILLAGRA N A, et al. Biological effects of quinolones: A family of broad-spectrum antimicrobial agents[J]. Molecules, 2021, 26(23): 7153. doi: 10.3390/molecules26237153 [16] SONG J L, LIN X H, JIANG N, et al. Carbon-doped WO3 electrochemical aptasensor based on Box-Behnken strategy for highly-sensitive detection of tetracycline[J]. Food Chemistry, 2022, 367: 130564. doi: 10.1016/j.foodchem.2021.130564 [17] UNGKU ABDULLAH U A A, MOHAMAD HANAPI N S, WAN IBRAHIM W N, et al. Pre-concentration and determination of tetracyclines antibiotics residues in water samples using RGO/Fe3O4 nanocomposite as extraction sorbent[J]. Indonesian Journal of Chemistry, 2021, 21(5): 1196. doi: 10.22146/ijc.64414 [18] SUN P Y, YANG D Y, LI J, et al. Aggregation-induced emission of 4-formyl-3-hydroxybenzoic acid for the ratiometric fluorescence detection of tetracycline antibiotics[J]. Dyes and Pigments, 2022, 197: 109841. doi: 10.1016/j.dyepig.2021.109841 [19] CHOI S Y, KANG H S. Multi-residue determination of sulfonamides, dapsone, ormethoprim, and trimethoprim in fish and shrimp using dispersive solid phase extraction with LC-MS/MS[J]. Food Analytical Methods, 2021, 14(6): 1256-1268. doi: 10.1007/s12161-021-01965-x [20] ADRIAN J, PASCHE S, DISERENS J M, et al. Waveguide interrogated optical immunosensor (WIOS) for detection of sulfonamide antibiotics in milk[J]. Biosensors and Bioelectronics, 2009, 24(11): 3340-3346. doi: 10.1016/j.bios.2009.04.036 [21] CHEN L T, LIU Y L, CHENG G H, et al. A novel fluorescent probe based on N, B, F co-doped carbon dots for highly selective and sensitive determination of sulfathiazole[J]. The Science of the Total Environment, 2021, 759: 143432. doi: 10.1016/j.scitotenv.2020.143432 [22] KAZEMI E, DADFARNIA S, HAJI SHABANI A M, et al. Indirect spectrophotometric determination of sulfadiazine based on localized surface plasmon resonance peak of silver nanoparticles after cloud point extraction[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2017, 187: 30-35. doi: 10.1016/j.saa.2017.06.023 [23] HU C, ZHANG Y, ZHOU Y, et al. A review of pretreatment and analysis of macrolides in food (Update Since 2010)[J]. Journal of Chromatography. A, 2020, 1634: 461662. doi: 10.1016/j.chroma.2020.461662 [24] FOTI C, PIPERNO A, SCALA A, et al. Oxazolidinone antibiotics: Chemical, biological and analytical aspects[J]. Molecules, 2021, 26(14): 4280. doi: 10.3390/molecules26144280 [25] PıNAR P T, ŞENTÜRK Z. Electrochemical and analytical performance of cathodically pretreated boron-doped diamond electrode for the determination of oxazolidinone antibiotic linezolid in cationic surfactant media[J]. Journal of Electroanalytical Chemistry, 2020, 878: 114681. doi: 10.1016/j.jelechem.2020.114681 [26] IRANIFAM M, KHABBAZ KHARAMEH M. Cupric oxide nanoparticles-enhanced chemiluminescence method for measurement of β-lactam antibiotics[J]. Luminescence, 2015, 30(5): 625-630. doi: 10.1002/bio.2796 [27] IRANIFAM M, TOOLOOE GARDEH RASHT M, AL LAWATI H A J. CuS nanoparticles-enhanced luminol-O2 chemiluminescence reaction used for determination of paracetamol and vancomycin[J]. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy, 2021, 261: 120038. doi: 10.1016/j.saa.2021.120038 [28] 陈浩汉. 化学发光分析及应用[J]. 培训与研究(湖北教育学院学报), 1997, 14(3): 59-61. CHEN H H. Chemiluminescence analysis and its application[J]. Training and Research, 1997, 14(3): 59-61 (in Chinese).
[29] CHENG S T, LIU H M, ZHANG H, et al. Ultrasensitive electrochemiluminescence aptasensor for kanamycin detection based on silver nanoparticle-catalyzed chemiluminescent reaction between luminol and hydrogen peroxide[J]. Sensors and Actuators B:Chemical, 2020, 304: 127367. doi: 10.1016/j.snb.2019.127367 [30] SHOKRI R, AMJADI M. Boron and nitrogen co-doped carbon dots as a chemiluminescence probe for sensitive assay of rifampicin[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2022, 425: 113694. doi: 10.1016/j.jphotochem.2021.113694 [31] 李念兵, 段建平, 陈红青, 等. 流动注射抑制化学发光法测定痕量强力霉素[J]. 光谱学与光谱分析, 2004, 24(1): 15-17. doi: 10.3321/j.issn:1000-0593.2004.01.005 LI N B, DUAN J P, CHEN H Q, et al. Flow injection analysis of trace amounts of doxycycline with inhibited chemiluminescence detection[J]. Spectroscopy and Spectral Analysis, 2004, 24(1): 15-17 (in Chinese). doi: 10.3321/j.issn:1000-0593.2004.01.005
[32] 代婷婷, 林华萍, 段婕, 等. 毛细管区带电泳化学发光法测定食品中残留的磺胺类药物[J]. 分析化学, 2016, 44(5): 747-753. doi: 10.11895/j.issn.0253-3820.150854 DAI T T, LIN H P, DUAN J, et al. Determination of sulfonamides residues in food by capillary zone electrophoresis-chemiluminescence method[J]. Chinese Journal of Analytical Chemistry, 2016, 44(5): 747-753 (in Chinese). doi: 10.11895/j.issn.0253-3820.150854
[33] 白文荟, 刘金钏, 陈爱亮. 纳米金比色法在食品安全检测中的应用研究进展[J]. 食品安全质量检测学报, 2014, 5(7): 1943-1950. BAI W H, LIU J C, CHEN A L. Gold nanoparticle based colorimetry and its application in rapid detection for food safety[J]. Journal of Food Safety & Quality, 2014, 5(7): 1943-1950 (in Chinese).
[34] 张彩艳, 冯荣荣, 李晓霞. 金纳米粒子比色法检测卡那霉素的研究[J]. 分析科学学报, 2018, 34(3): 372-376. ZHANG C Y, FENG R R, LI X X. Colorimetric sensing for the determination kanamycin based on gold nanoparticles[J]. Journal of Analytical Science, 2018, 34(3): 372-376 (in Chinese).
[35] SARATALE G D, SARATALE R G, GHODAKE G, et al. Chlortetracycline-functionalized silver nanoparticles as a colorimetric probe for aminoglycosides: Ultrasensitive determination of kanamycin and streptomycin[J]. Nanomaterials, 2020, 10(5): 997. doi: 10.3390/nano10050997 [36] ABEDALWAFA M A, LI Y, LI D, et al. Fast-response and reusable oxytetracycline colorimetric strips based on nickel (II) ions immobilized carboxymethylcellulose/polyacrylonitrile nanofibrous membranes[J]. Materials, 2018, 11(6): 962. doi: 10.3390/ma11060962 [37] GAO M M, LI L L, LU S X, et al. Silver nanoparticles for the visual detection of lomefloxacin in the presence of cystine[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2018, 205: 72-78. doi: 10.1016/j.saa.2018.05.072 [38] ABEDALWAFA M A, LI Y, NI C F, et al. Colorimetric sensor arrays for the detection and identification of antibiotics[J]. Analytical Methods, 2019, 11(22): 2836-2854. doi: 10.1039/C9AY00371A [39] ORACHORN N, BUNKOED O. A nanocomposite fluorescent probe of polyaniline, graphene oxide and quantum dots incorporated into highly selective polymer for lomefloxacin detection[J]. Talanta, 2019, 203: 261-268. doi: 10.1016/j.talanta.2019.05.082 [40] FAN Y, QIAO W J, LONG W J, et al. Detection of tetracycline antibiotics using fluorescent “Turn-off” sensor based on S, N-doped carbon quantum dots[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2022, 274: 121033. doi: 10.1016/j.saa.2022.121033 [41] CHEN J A, JIN Y T, REN T T, et al. A novel terbium (III) and aptamer-based probe for label-free detection of three fluoroquinolones in honey and water samples[J]. Food Chemistry, 2022, 386: 132751. doi: 10.1016/j.foodchem.2022.132751 [42] YANG W K, ZHENG X Y, GAO F, et al. CdTe QDs@ZIF-8 composite-based recyclable ratiometric fluorescent sensor for rapid and sensitive detection of chlortetracycline[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2022, 270: 120785. doi: 10.1016/j.saa.2021.120785 [43] 胡沛杉, 李宛儒, 邹薇等. 基于金属有机框架SERS基底在环境检测中的应用研究进展[J]. 环境化学,2023, 42(12): 4375-4383. HU P S, LI W R, ZOU W, et al. Research progress on the application of metal-organic framework-based SERS substrates in environmental detection[J]. Environmental Chemistry, 2023, 42(12): 4375-4383(in Chinese).
[44] 朱兰兰, 林洪, 王静雪, 等. 利用发光细菌进行褐牙鲆中氯霉素残留快速检测的研究[J]. 食品与发酵工业, 2007, 33(10): 155-159. ZHU L L, LIN H, WANG J X, et al. Rapid detection of chloramphenicol in Paralichthys olivaceus with luminescent bacteria[J]. Food and Fermentation Industries, 2007, 33(10): 155-159 (in Chinese).
[45] CAI X, YE J P, DUAN D, et al. Ratiometric fluorescence determination of chlortetracycline based on the aggregation of copper nanoclusters triggered by aluminum ion[J]. Microchimica Acta, 2021, 189(1): 28. -



 下载:
下载: