-
CdS NPs是一种宽带隙半导体材料,其拥有良好的光学特性、光电转化[1]和光催化性能[2]并且毒性远低于可溶性Cd[3]. CdS NPs广泛应用于生物、医药、环境、食品等领域,如碳点-硫化镉量子 (CD-CdS Q) 纳米复合材料 (1—3 nm) 能够在紫外线下显示白色荧光,在铬 (Ⅵ) 离子存在时荧光会被选择性猝灭,因此可以作为一种快速检测铬离子的新型探针[4];Gazizadeh等开发的S-CDs/CdS QDs (2—8 nm) 可用来检测人血清中的格列本脲 (GLC)[5]. 此外,纳米杂化明胶蛋白/硫化镉 (Gel/CdS) 纳米颗粒 (3.7—5 nm) 可用于细胞标记和电化学传感器制备[6]. CdS NPs还在生物成像[7]、分子组织病理学[8]、高级疾病诊断[9]等领域得到广泛应用.
CdS NPs的传统合成法包括化学沉淀法[10]、化学湿法合成[11 − 12]、脉冲激光烧蚀[13]、微波热反应法等[14]. 化学沉淀法利用化学物质如Na2S和CdSO4在室温下经过一系列搅拌来合成CdS NPs,这类方法简单、合成时间短,是生产CdS NPs最广泛使用的方法之一[15]. 然而,化学方法通常需要在反应介质中添加各种稳定剂和表面活性剂来抑制单颗粒的聚集,增加成本的同时引入有毒有害物质,还降低了产物纯度;物理方法通常需要高温、高能和高压且昂贵的仪器,导致安全隐患和成本上升.
生物合成CdS NPs的方法在稳定性、安全性、成本和粒径可控方面具有更大优势,近年来引起了广泛的关注. 除了细菌外,已证明许多生物可以合成CdS NPs,包括植物Panicumsarmentosum (4.6 nm)[16]、Dicliptera Roxburghiana (2.5—8 nm)[17],藻类Phormidium tenue (5 nm)[18],真菌Aspergillusniger (5 nm)[19]. 这些生物体各成分,如蛋白质、生物碱、多酚等可以被用作合成时的封端剂和还原前体,例如向植物提取物中加入Cd盐,化学物质发生生物还原从而合成CdS NPs[20];向微生物培养液中加入Na2S和Cd2+的组合溶液,或者利用微生物发生还原反应合成CdS NPs. 半导体材料的光电和理化性质与尺寸和形状相关[21]. 生物合成法可以精确地控制无机材料的形状和尺寸[22],便于根据所需调整合成条件,得到合适尺寸的纳米材料. 不同粒径的NPs有不同的应用. 在纳米药物的使用中,小粒径NPs (6—30 nm)可以更深入地穿透多细胞球体和实体肿瘤且均匀分布,而大粒径的NPs (100—200 nm) 可以在血液中长期循环、从血管外渗到靶细胞,并在肿瘤中滞留[23 − 26],Lü等[27]利用大粒径CdS NPs制备了G/M-CdS复合材料,基于CdS的光催化活性,这种复合材料可以处理水溶液中的废染料如罗丹明B. 然而,在已报道的文献中,大多关注于小粒径的合成[28 − 29],对于粒径大于100 nm NPs的研究非常有限,因为传统方法很难合成尺寸可控且均匀性好的大粒径NPs[30 − 31]. 本研究以恶臭假单胞菌B7为研究对象,主要研究B7在M9培养基中大粒径CdS NPs的生物合成.
-
课题组已经从广西大学水稻实验基地水田中分离出了一株耐镉的细菌B7,并用20%的甘油保存于−80 ℃超低温冰箱中备用.
以1%的接种量将B7接种于LB液体培养基中,置于30 ℃、200 r·min−1条件下培养活化8 h. 在超净工作台内用无菌接种环沾取少量菌液于LB琼脂培养皿上划线,观察并记录菌体特征;采用菌落PCR法扩增16S rDNA:取50 μL灭菌水于微管中,用灭菌枪头挑取单菌落置于微管中轻微搅拌后取出;95 ℃热变性15 min,低速离心,取2 μL裂解后的上清液作为PCR反应的模板. 使用通用引物27F (5'-AGAGTTTGATCCTGGCTCAG-3') 和1492R (5'-ACGGHTACCTTGTTTACGACTT-3') 扩增基因16S rDNA.
PCR反应扩增产物送至上海生工科技有限公司测序,将测序结果输入NCBI数据库Nucleotide BLAST进行核苷酸同源性分析,并根据同源性构建其系统发育树.
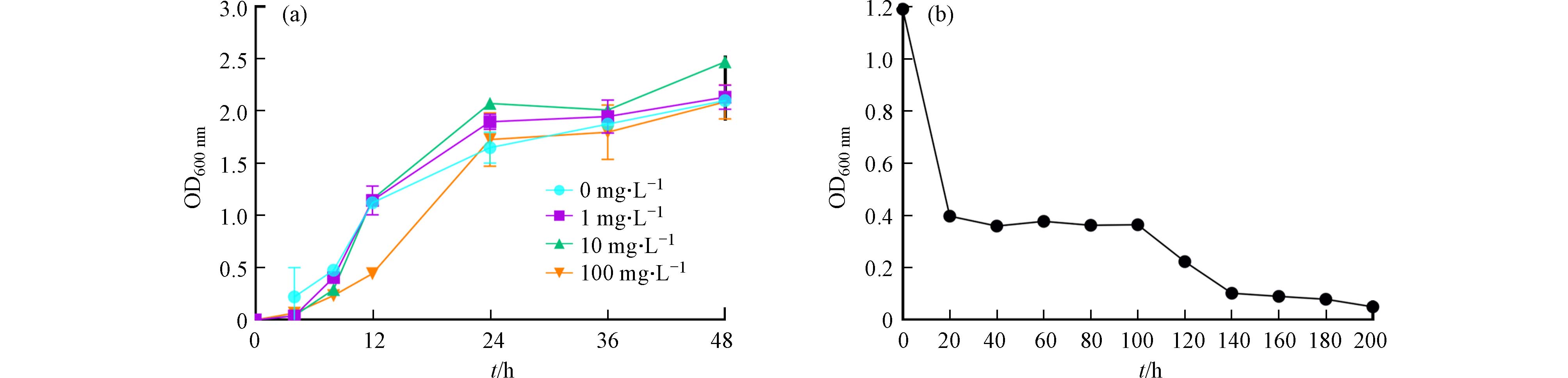
为探究B7在不同温度下的生长,将活化后的B7菌悬液接种于M9基础培养基 (minimal medium) 中,分别放置于20 ℃、25 ℃、30 ℃、35 ℃、40 ℃,200 r·min−1的恒温振荡培养箱中,以未接种B7的LB液体培养基作空白对照,测定不同培养时间的细菌菌液的OD600 nm值,并绘制生长曲线. 在培养过程发现B7菌液呈淡绿色,推测其可能在生长过程中产生了具有荧光的色素物质,于是在350 nm激发波长下测定其荧光发射光谱 (fluorescence emission spectra) .
-
为了利用生物稳定合成CdS NPs,有必要探究B7菌株的镉耐受能力. 将B7接种到M9液体培养基中,调整CdCl2·2.5H2O使Cd2+终浓度分别为1 mg·L−1、10 mg·L−1、100 mg·L−1,放置于30 ℃、200 r·min−1恒温振荡箱中培养. 每隔一定时间收集细菌培养液,以未添加CdCl2·2.5H2O的M9液体培养基作空白对照,测定不同培养时间的细菌培养液的OD600nm值,每组实验设置3个平行.
-
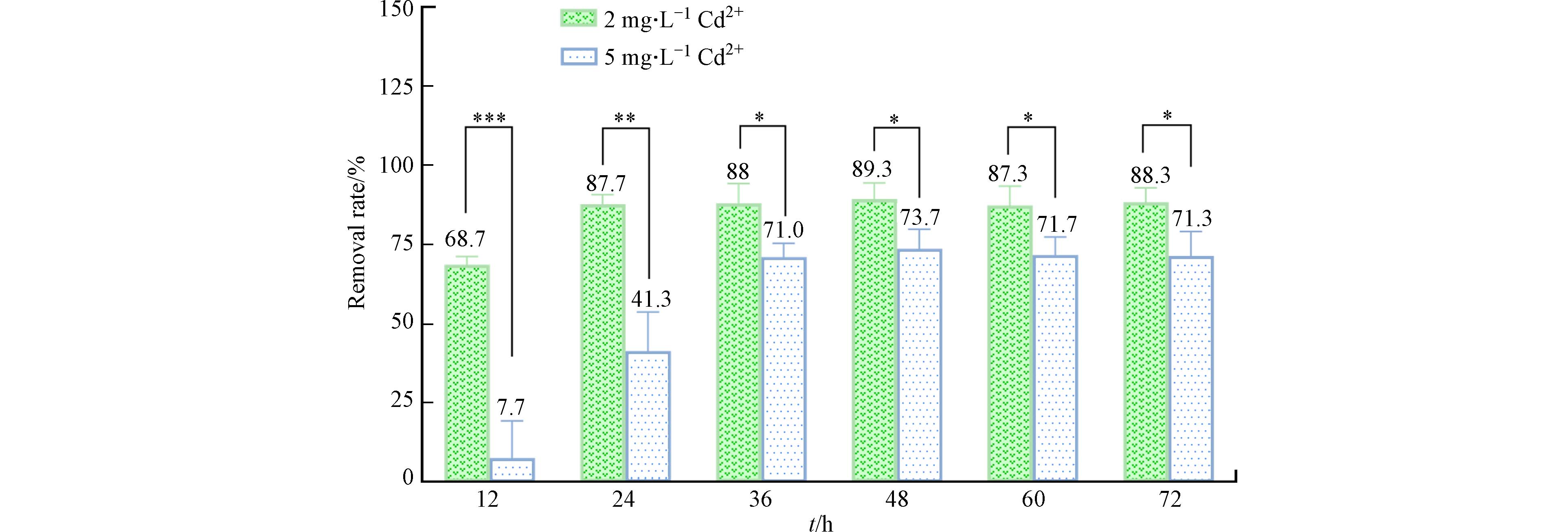
镉去除能力在某种程度上可以反映利用镉离子合成硫化镉的能力[32]. 为了解B7在真实镉污染浓度下的镉吸收能力,将B7菌株分别接种于含2 mg·L−1和5 mg·L−1 Cd2+的M9培养基中,每组实验设置3个平行. 置于30 ℃、200 r·min−1恒温培养箱中培养,每12 h收集1次细菌培养液.
4000 r·min−1离心5 min后留取上清,加入一定量的浓硝酸酸化并稀释至合适浓度后使用ICP-MS测定上清液中残留的镉离子的浓度. -
活化后的B7按1%的接种量接入200 mL新鲜M9培养基中. 30 ℃,200 r·min−1培养12 h后离心(
5000 r·min−1、5 min)收集菌体,M9培养基洗涤3次后转入含100 mg·L−1 Cd2+和8 mmol·L−1 L-Cys的M9培养基中培养48 h.X射线衍射 (X-Ray diffraction, XRD)检测制样:
5000 r·min−1离心5 min收集菌体,并用超纯水洗涤3次,然后置于-80 ℃冰箱中过夜放置,次日取出后,在真空冷冻干燥器中干燥48 h. 最后将干燥样品研磨成粉末状进行XRD检测.电镜制样:
1000 r·min−1离心收集菌体,用PBS缓冲液(4 ℃预冷)轻柔洗涤3次,转移到1.5 mL离心管,随后用固定液(2.5%的戊二醛)轻轻吹打悬浮1 min,在4 ℃冰箱过夜静置,于次日送至武汉纽泰斯生物科技有限公司拍摄透射电镜 (transmission electron microscope,TEM)图.CdS NPs收集:离心收集菌体后,用超纯水洗涤3次并重悬,超声破碎菌体,离心收集沉淀. 向沉淀中加入过量1 mol·L−1氢氧化钠溶液,放在25 ℃、200 r·min−1摇床过夜消解. 消解完成后用超纯水洗涤3次后在−80 ℃冰箱中过夜放置,次日取出放在真空冷冻干燥器中干燥48 h.干燥后的样品放在20%四甲基氢氧化铵 (TMAH) 溶液中,置于4 ℃保存. 使用酶标仪测定该颗粒悬液的紫外-可见光吸收光谱 (UV-vis),在350 nm激发波长下测定发射光谱. 同时送至中科百测(天津)检测技术有限公司进行选区电子衍射 (selected area electron diffraction,SAED)分析、能量色散X射线光谱学分析 (energy-dispersive X-Ray spectroscopy,EDX)、拍摄高分辨透射电子显微镜图像 (high resolution transmission electron microscope,HRTEM)和粒径分析. 其中粒径分析样品需经过前处理:CdS NPs悬液超声后用1 mol·L−1的氢氧化钠溶液洗涤3遍,然后用去离子水洗涤并重悬,稀释200倍后用纳米粒度及Zeta电位分析仪 (DLS) 测定CdS NPs的粒径.
-
将含100 mg·L−1 Cd2+和8 mmol·L−1 L-Cys的M9培养的初始pH调整为5、6、7、8,并按1%的接种量接种OD600 nm=0.5的B7于各pH培养基中,48 h后超声破碎收集培养液上清,分别测定紫外吸收光谱和荧光光谱的变化,以此测定pH对CdS NPs合成的影响.
-
选用253.7 nm波长的紫外线光源,参考Dadmehr[33]等的实验步骤,将3 mg CdS NPs加入到10 mL初始浓度为10 mg·L−1的染料或抗生素水溶液中,pH为9,置于室温下. 为了获得吸附/脱吸附的平衡,将溶液在黑暗条件下均匀搅拌30 min后,在UV光下照射90 min,同时每10 min取出样品,然后离心除去CdS NPs,测定染料或抗生素最大吸收值. 其中降解物质包括常见抗生素四环素 (TC) 和氯霉素 (CAP) ,及常见染料亚甲基蓝 (MB) 和罗丹明B (RhB) .
-
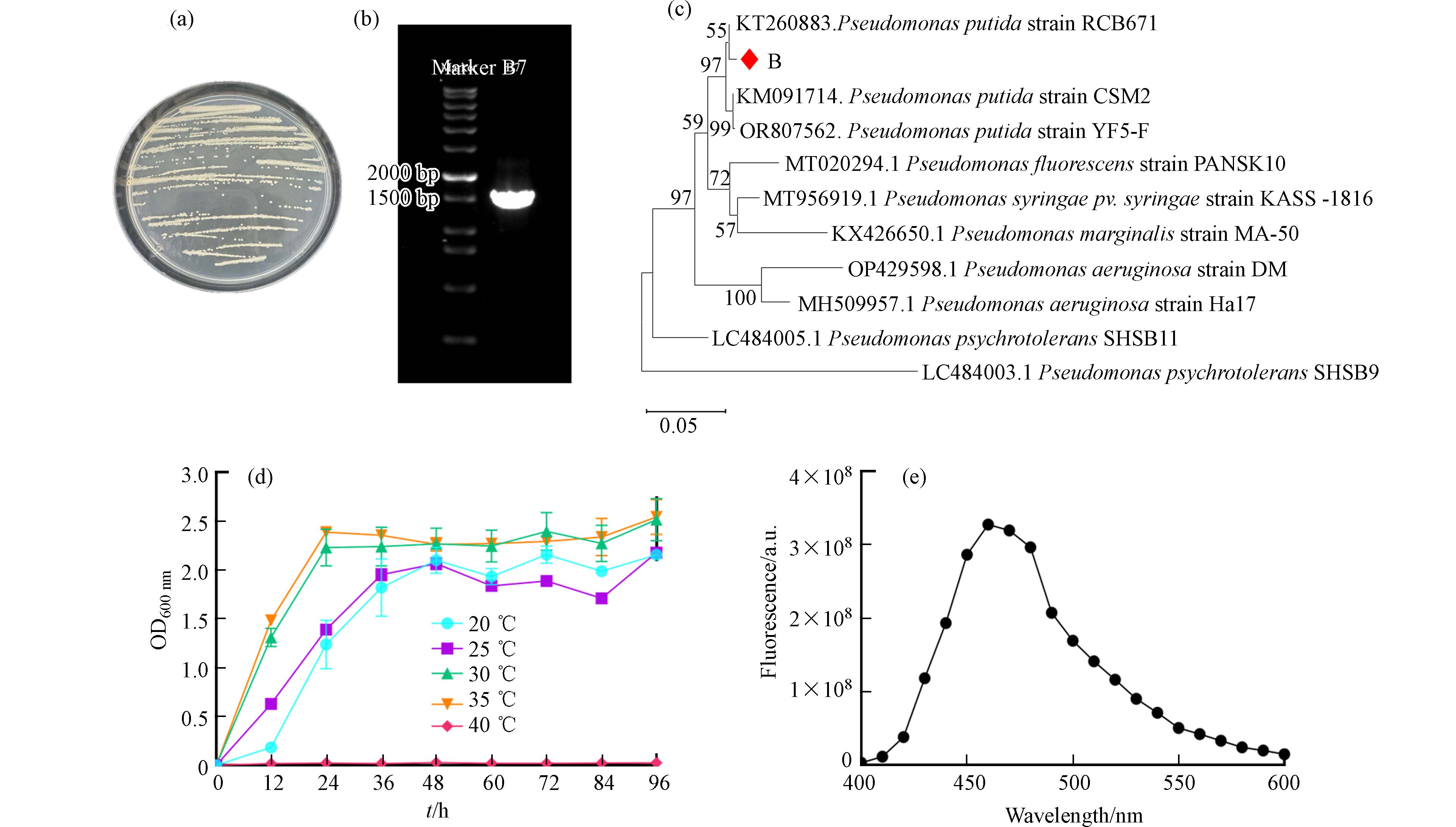
B7菌落在LB固体培养基上呈圆形、浅黄色、不透明、表面光滑、边缘整齐、略有隆起(图1a);使用通用引物对B7的16SrDNA片段扩增如图1b,将该条带切下,经过胶回收、纯化、测序后在NCBI上进行对比并利用MEGA11.0软件,基于邻接法 (Neighbor-Joining Method,NJ) 构建菌株B7与相关种的16SrRNA序列系发育树(图1c),进行
1000 次的相似度重复计算,图中发育树节点只显示Bootstrap值大于50%数值. 结果表明B7与恶臭假单胞菌Pseudomonas putida RCCB671的亲缘关系最近.通过测定细菌在不同温度下的生长得到细菌得最适生长温度,这对探究细菌的耐镉能力与生物合成CdS NPs能力有重要意义. 细菌的镉耐受能力与其生长状态有关,在最适生长条件下,细菌能够更好地抵抗重金属的胁迫[34]. 经过实验发现,B7的最适生长温度为30 ℃和35 ℃(图1d),在40 ℃时B7无法生长,这与同属恶臭假单胞菌的Pseudomonas putida KT2440[35]在30 ℃和37 ℃下生长基本一致. 对B7菌液的上清测定发现菌液上清在460 nm处有特殊荧光峰(图1e),表明细菌生长伴随着荧光素的生成,这一点符合恶臭假单胞菌能够合成荧光素(青脓素)的特征[36 − 37]. 结合细菌生长形态和生成荧光素的特征,B7最终确定为恶臭假单胞菌 (Pseudomonas putida) .
-
B7在0—10 mg·L−1 Cd2+胁迫下的M9基础培养基中有较好的生长状况(图2a),在0—4 h处于延迟期,4—24 h处于生长对数期,24—48 h为平台期. 值得注意的是,12 h后1 mg·L−1和10 mg·L−1镉暴露下的B7生长情况甚至优于未暴露组,这种一定剂量的重金属反而可以促进细菌生长的情况并非个例——“兴奋效应” (Hormesis) :一种低剂量增强而高剂量抑制的剂量-反应关系[38]. 如Diwu等[39]发现当Cd浓度分别为2.0—4.0 mg·kg−1和0.6—2.0 mg·kg−1时,细菌和真菌种群受到刺激而促进了生长;相反,超低浓度Cd2+(0.2 mg·kg−1和0.6 mg·kg−1)显著抑制细菌种群生长,0.2 mg·kg−1浓度下显著抑制真菌种群生长. 100 mg·L−1 Cd2+胁迫时,B7的生长受到轻微抑制,但在24 h后这种抑制得到缓解,同样在Ferreira等[40]的研究中,同属恶臭假单胞菌的Pseudomonas veronii 2E在M9培养基中能够更耐受镉,因为M9培养基中的葡萄糖和无机氮源增加了Cd2+配体——胞外聚合物 (EPS) 的产量,它可以提高细菌对Cd2+的吸附和累积. 而E.coli BL21只有在M9培养基中的Cd2+浓度低至10 μmol·L−1(约1.12 mg·L−1)时有较好的镉耐受[41]. 因此推测B7菌株在M9培养基中具有较强的镉耐受能力,适合作为CdS NPs的生物合成菌株;Cd2+对细菌B7的最小抑制浓度为140 mg·L−1(图2b),而Enshaei等[42]发现Pseudomonas putida PTCC
1649 的MIC为2.7 mmol·L−1,即约300 mg·L−1,约为B7的2倍. 镉纳米材料的合成通常需要较高浓度的镉离子,但高浓度的镉离子往往对细菌的生长、代谢以及酶活性产生抑制作用,这不利于纳米材料的有效合成. 然而,具有较强镉耐受能力的细菌菌株,如B7,为在较高镉浓度下进行纳米材料合成提供了可能性. -
B7在2 mg·L−1和5 mg·L−1 Cd2+暴露下的镉去除率如图3所示. 2 mg·L−1 Cd2+暴露下,B7在12 h内的镉去除率就已经接近70%,24 h后镉的去除率维持在90%左右;5 mg·L−1 Cd2+暴露下,12 h内B7的镉去除率仅有7.7%,随着时间的推移,去除率能够上升到70%左右. 前面提到Pseudomonas putida PTCC
1649 的MIC约300 mg·L−1,但其在1.5 mmol·L−1 Cd2+胁迫下去除率却仅为30%,猜测主要可能原因是由于该研究使用的是牛肉膏蛋白胨培养基和3CdSO4·8H2O,而本研究是M9基础培养基和CdCl2·2.5H2O,因此细菌表现出不同的镉耐受能力和镉去除能力;在一项研究中,Pseudomonas putida KNP9[43]可以耐受546 μmol·L−1CdCl2 (约100 mg·L−1),并且最大可以去除约85.73%的可溶性Cd (50 μg·mL−1),略低于本研究所得结果. B7菌株对镉具有较高的去除率,这表明该菌株能够有效地吸收镉离子,并且可能具备一种或多种镉离子的脱毒机制,如通过生物矿化过程形成镉硫化物 (CdS) 纳米颗粒[44]. 这种能力使得B7菌株不仅在生物修复领域具有潜在的应用价值,而且在合成镉基纳米材料方面也可能非常有用. -
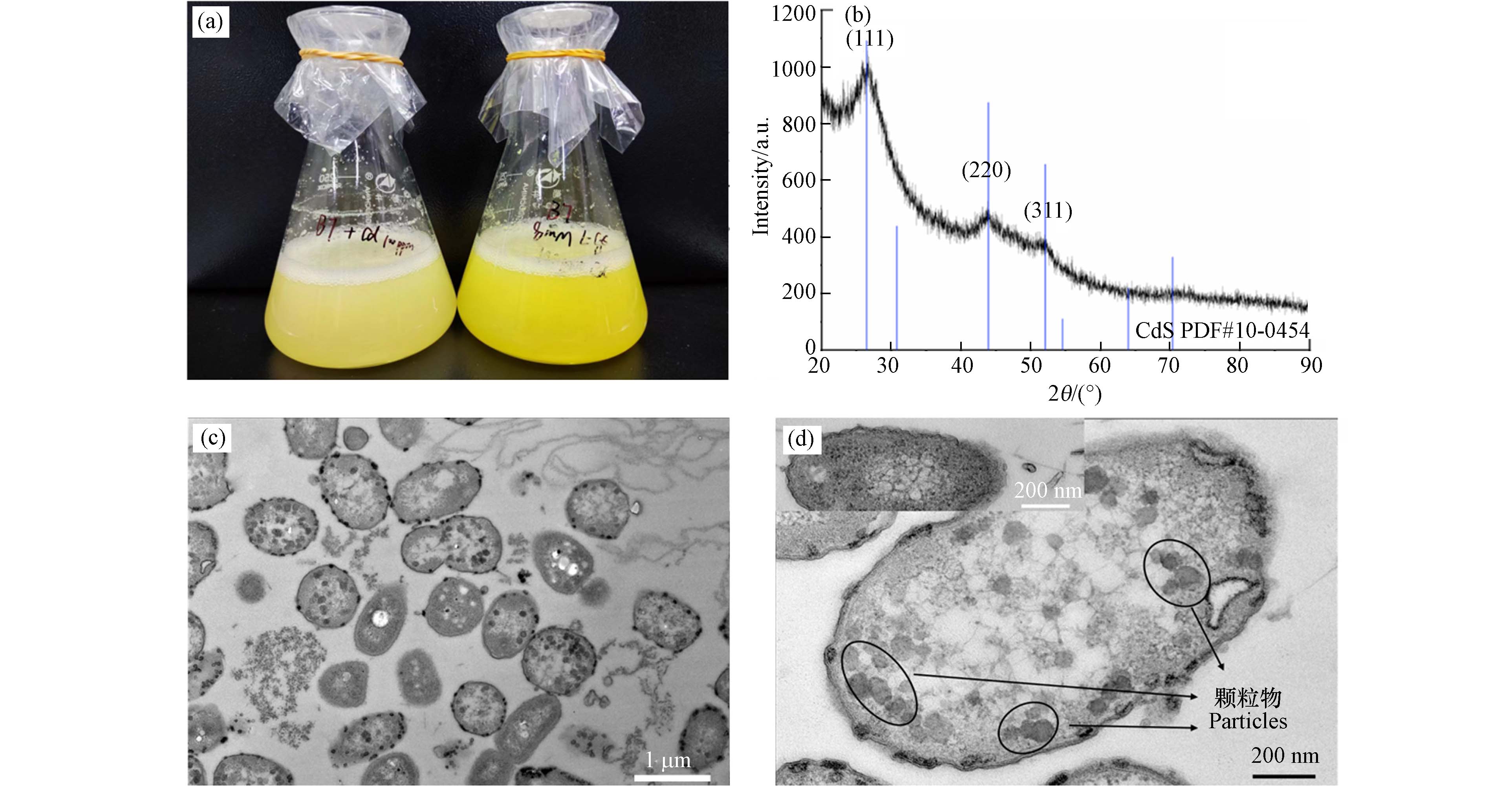
利用B7在含100 mg·L−1 Cd2+和8 mmol·L−1 L-Cys的M9培养基生物合成CdS,培养48 h后菌液中产生了亮黄色物质(图4a),根据CdS的标准PDF卡片PDF#10-0454对菌体产物进行XRD分析(图4b),在2θ =26.54°、44.04°和52.19°的位置出现了强峰,分别对应CdS (111) 、 (220) 和 (311) 3个晶格面.
TEM图(图4c、d)显示,暴露之后的B7细胞内出现了若干大小均一的颗粒,推测可能是B7胞内合成的CdS颗粒,目测其粒径在100 nm以上. 为了最终确定该物质成分,将菌液收集消解,作进一步表征.
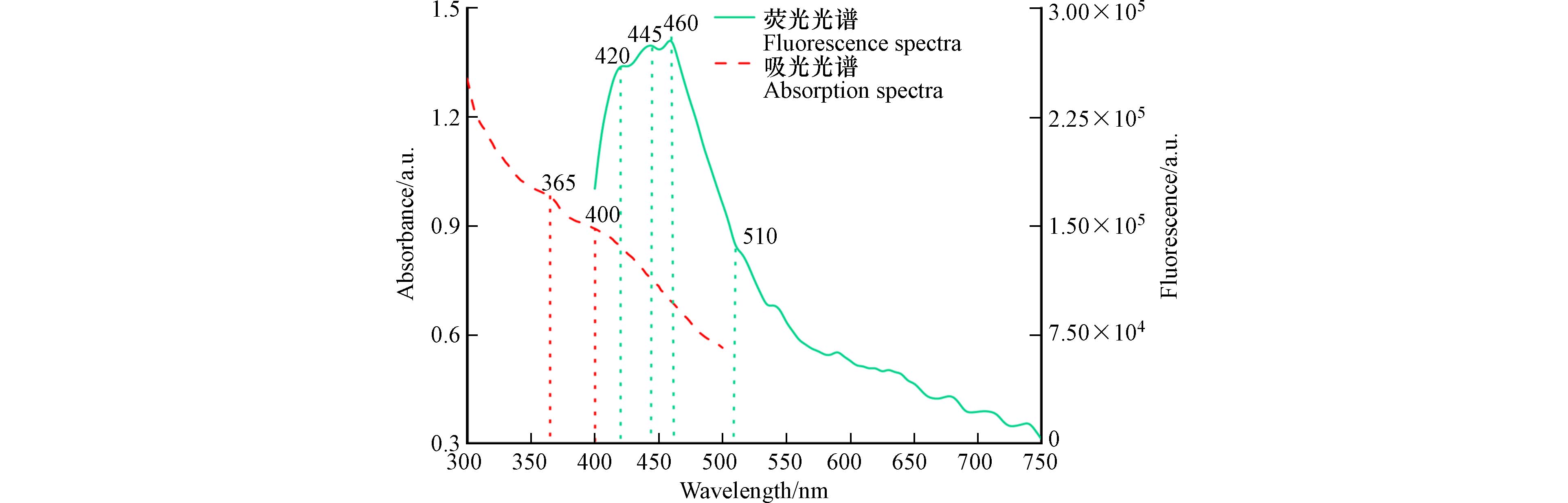
菌液经过消解后得到了亮黄色的颗粒物,对其测定紫外可见光吸收光谱和350 nm激发波长下的发射光谱(图5),在365 nm发现一个吸收峰,与Tripathi合成的CdS NPs在360—380 nm之间的吸收峰相符[43];在350 nm波长的激发光下,得到了颗粒的发射光谱图. 荧光峰值分别对应420、445、460 nm波长,表明纳米颗粒的激子带大小不同,510 nm波长处的峰值说明其中存在CdS晶体[21].
进一步表征的结果如图6所示. 通过能谱扫描结合电子图像和元素分析发现,黄色颗粒物中Cd元素和S元素(图6 b、c、d)分布均匀;质厚衬度像图6e中放置了一个颗粒物的粒径大小直方图,显示B7合成的颗粒粒径大小在175—275 nm之间. 在众多利用微生物合成CdS NPs的研究中,其粒径大小主要集中在2—10 nm[21 − 22,28,45],虽然小粒径的CdS NPs因其优异的光学特性常用于荧光探针制作,广泛应用于生物成像和分子组织病理学领域[46 − 47],但大粒径的CdS NPs也有重要用途,更多应用于肿瘤治疗和废物处理等方面[23 − 27];通过HR-TEM图像(图6f)计算出该物质的晶格条纹间距 (d) 约为0.36 nm,对应于CdS的 (111) 晶面[22];EDS能谱图像(图6g)显示S、Cd元素为该颗粒物的主要成分,两者比例接近1:1,多晶电子衍射花样的标定(图6h)分别对应了立方晶系硫化镉的 (111)、 (220) 和 (311) 的3个晶面,综合结果表明该颗粒物即立方晶系硫化镉.
在已报道生物合成CdS NPs的研究中[48 − 50],大多使用LB液体培养基,本实验中,CdS NPs的生物合成是在M9基础培养基中进行的. 相较于LB培养基,M9基础培养基的成分相对单一,成本更低. 而且,B7合成的CdS NPs是均一性高的大粒径颗粒,粒径在175—275 nm,这种尺寸的颗粒在肿瘤的治疗和染料的降解方面有广泛的研究[23 − 27],因此,该纳米颗粒的成功合成在大粒径CdS NPs生物合成方面提供了科学依据.
-
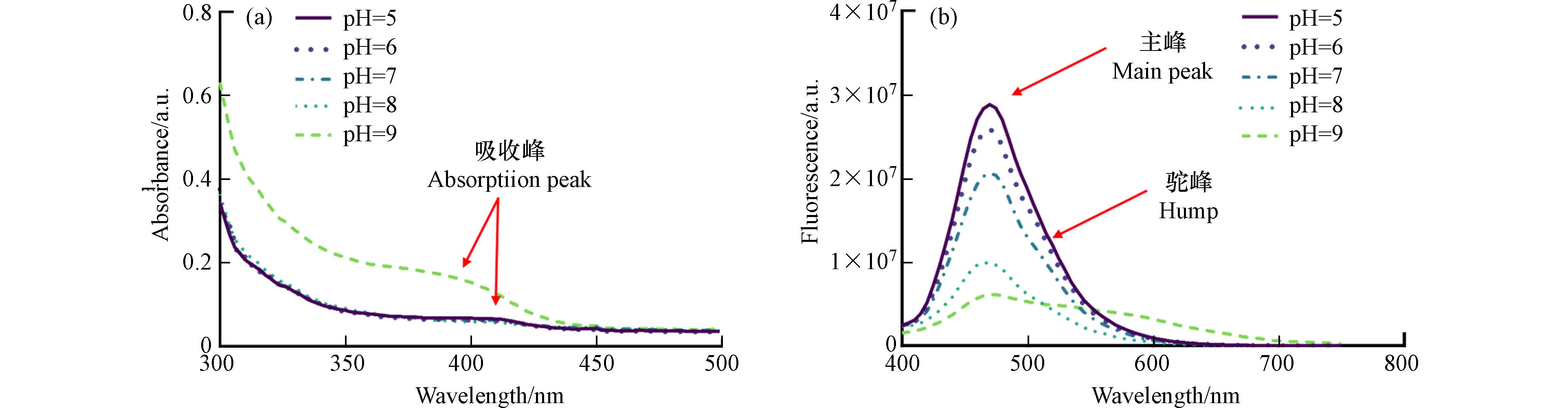
生物合成过程中的pH能够显著影响CdS NPs光电化学性能[51]. 本文初步探究了pH对生物合成的影响. 紫外可见光吸收光谱(图7a)表明,在pH=9时CdS NPs合成培养液上清中的最大吸收峰相较于其他pH明显向低波长侧移动,即发生蓝移现象——一种由颗粒粒径引起的量子尺寸效应,当物质的半径 (r) 小于激子玻尔半径 (rB) 时就会出现这种效应[52]. 该现象说明pH的提高减小了合成颗粒的粒径并导致光学带隙发生显著变化[53]. 在荧光光谱中,不同pH下的主峰都出现在吸收光谱的吸收边缘470 nm附近,这种现象在CdS NPs常见,人们通常称其为带边发射[54];而在大于500 nm处发现表面态发射的驼峰,但并不明显. 表面态发射峰表明CdS NPs受到环境中介质的强烈影响[55];另外,荧光强度随着pH降低而上升,这可能是由于高pH下阴阳离子配比不同造成的,因为阳离子占比大的体系荧光更强[56]. 因此生物合成CdS NPs过程的pH会影响纳米颗粒的形成速率以及光学、形态和结晶度等多种特性[57 − 58].
-
图8显示了CdS NPs对抗生素与染料的降解能力. 如图8所示,在黑暗中搅拌30 min后,CdS NPs对染料的吸附略大于对抗生素的吸附. CdS NP的降解效果随时间推移而缓慢提高,最终达到稳定. 90 min后,CdS NPs对四环素、氯霉素和亚甲基蓝的降解效果分别只有14.6%、6.1%、19.1%,而对罗丹明B有明显的降解效果,达到52.2%. CdS NPs对四环素和氯霉素的降解效果较低的一个原因可能是抗生素初始质量浓度低,与CdS NPs催化剂活性位点结合的抗生素分子过少,导致降解率降低[59]. 另一方面,对于抗生素TC和CAP的降解,需要h+和·O2−等一系列自由基的参与,若环境中不能产生足够的活性物种或者无法为降解对象提供利于吸附与解吸附的环境,便不足以攻击其关键基团[60 − 61];另外,本实验合成的大粒径CdS NPs在30 min内对罗丹明B的降解率达到22.24%,高于Dadmehr等[34]合成CdS QDs (2—6 nm)的降解率17.45%,并且最终降解率高于Ullah、Gurugubelli等[62 − 63]等合成CdS (32.7、18.75 nm) 的50%左右、30.18%. 表明本实验中合成的CdS NPs对罗丹明B有较好的降解效果. 在刘海涛等[64]的研究中,发现复合型材料对亚甲基蓝的光催化降解效果显著高于纯CdS,因此推测若将该CdS NPs与具有高导电性和光学稳定性的材料共同制成复合型材料,有望进一步提高对染料降解效果.
-
本实验鉴定了一株耐镉恶臭假单胞菌 (Pseudomonas putida) B7,它在M9培养基中可以耐受100 mg·L−1的Cd2+;并且对2 mg·L−1、5 mg·L−1 Cd2有分别高达90%和70%左右的去除率;利用其生物合成CdS NPs,经过系列表征最终确定该颗粒为立方晶系CdS NPs,粒径在175—275 nm. 此外,初步探究发现提高pH能够减小生物合成CdS NPs的粒径大小,且该CdS NPs可以有效地降解染料罗丹明B,降解率能够达到52.2%. 本研究通过细菌B7成功地合成了大粒径CdS NPs,大粒径CdS NPs的生物合成有重要意义,其在肿瘤治疗和染料降解方面有着广泛应用. 但本研究仍存在一些不足:只探讨了最重要因素pH对CdS NPs合成的影响,没有研究影响硫化镉合成的其它因素;而且大粒径CdS NPs对抗生素的降解能力偏低等. 在本研究的基础上,可以将大粒径CdS NPs与具有高π-π共轭网络稳定性和强导电性的材料组合起来,提高光催化剂的电子转移能力,将其应用在废弃染料污染环境,有望进一步提高CdS NPs的催化能力.
耐镉细菌B7的鉴定与CdS纳米颗粒生物合成
Identification of cadmium-resistant bacteria B7 and biosynthesis of CdS nanoparticles
-
摘要: 硫化镉纳米颗粒 (cadmium sulfide nanoparticles,CdS NPs) 属于Ⅱ—Ⅵ类半导体材料,在纳米电子学和光电器件中具有重要的应用潜力. 传统CdS NPs化学合成法存在成本高、环境危害大、反应条件苛刻以及粒径难以控制等局限性. 而生物合成因其生态友好性、成本效益、易于实施和粒径可控等优点而成为一种可行的替代方案,只是现有文献中对于CdS NPs的生物合成主要集中在小粒径颗粒上. 本研究从镉污染的环境中分离出一株耐镉恶臭假单胞菌B7. 在2 mg·L−1和5 mg·L−1 Cd2+胁迫下,B7对Cd2+的去除率分别约为90%和70%. B7可耐受高达100 mg·L−1的Cd2+,最低抑制浓度 (minimum inhibitory concentration,MIC) 为140 mg·L−1. 因此,我们用B7在含100 mg·L−1 Cd2+和8 mmol·L−1半胱氨酸的M9培养基中生物合成CdS NPs,所得的亮黄色物质被表征为CdS NPs,粒径在175—275 nm之间. 对CdS NPs的初步研究表明,pH升高能降低生物合成CdS NPs的粒径,此外,纯化的CdS NPs对10 mg·L−1罗丹明B的降解效果达到了52.2%,这表明B7可以在Cd2+污染环境中稳定合成具有应用价值的大粒径CdS NPs. 研究结果为大粒径CdS NPs的生物合成与环境修复中的应用前景提供了科学依据.Abstract: Despite the fact that cadmium sulfide nanoparticles (CdS NPs), a II-VI semiconductor material, have significant potential applications in nanoelectronics and optoelectronic devices. Traditional chemical synthesis methods for CdS NPs face limitations due to high costs, environmental hazards, harsh reaction conditions, and the difficulty in controlling particle size. In contrast, biosynthesis of CdS NPs has emerged as a practicable alternative due to its eco-friendliness, cost-effectiveness, ease of implementation, and controllable particle size, albeit the current research focus being on small-sized particles, as existing literatures indicate. In this study, a cadmium-resistant Pseudomonas putida B7 is isolated from a cadmium-polluted environment. Under Cd2+ stress conditions of 2 mg·L−1 and 5 mg·L−1, the removal rates of Cd2+ by B7 reach approximately 90% and 70%, respectively, while B7 can tolerate Cd2+ concentrations as high as 100 mg·L−1, with a minimum inhibitory concentration (MIC) of 140 mg·L−1. Therefore, B7 is used to biosynthesize CdS NPs in an M9 medium containing 100 mg·L−1 Cd2+ and 8 mmol·L−1 cysteine, and the resulting bright yellow substance is characterized as CdS NPs, with particle sizes ranging from 175 to 275 nm. Preliminary studies of the resulting CdS NPs suggest that increasing pH can reduce the particle size of biosynthesized CdS NPs, while purified CdS NPs can achieve a degradation efficiency of 52.2% for 10 mg·L−1 rhodamine B. Experiments indicate that, in Cd2+-contaminated environments, B7 is significantly viable for the stable synthesization of CdS NPs of large size with application value. Those findings would provide scientific evidence for the prospect of biosynthesis of large-sized CdS NPs and its application in environmental remediation.
-
Key words:
- cadmium sulfide /
- particle size /
- nanoparticles /
- Pseudomonas putida.
-

-
-
[1] 马兴泰, 辛宝平, 吴莹, 等. 硫化镉纳米膜的生物还原-化学沉淀耦合制备及其性能表征[J]. 无机化学学报, 2011, 27(5): 828-834. MA X T, XIN B P, WU Y, et al. Preparation and characterization of CdS nano film by CRBRCP-EDTA process[J]. Chinese Journal of Inorganic Chemistry, 2011, 27(5): 828-834 (in Chinese).
[2] GIRIBABU K, SURESH R, MANIGANDAN R, et al. Cadmium sulphide nanorods: Synthesis, characterization and their photocatalytic activity[J]. Bulletin of the Korean Chemical Society, 2012, 33(9): 2910-2916. [3] WU Q, HUANG L X, LI Z, et al. The potential application of raw cadmium sulfide nanoparticles as CT photographic developer[J]. Nanoscale Research Letters, 2016, 11(1): 232. doi: 10.1186/s11671-016-1424-7 [4] PATIL A B, CHAUDHARY P L, ADHYAPAK P V. Carbon dots-cadmium sulfide quantum dots nanocomposite for ‘on–off’ fluorescence sensing of chromium(VI) ions[J]. RSC Advances, 2024, 14(18): 12923-12934. doi: 10.1039/D4RA00436A [5] GAZIZADEH M, DEHGHAN G, SOLEYMANI J. A dual-emission ratiometric fluorescent biosensor for ultrasensitive detection of glibenclamide using S-CDs/CdS quantum dots[J]. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy, 2023, 297: 122714. doi: 10.1016/j.saa.2023.122714 [6] SAMAL S K, SOENEN S, PUPPI D, et al. Bio-nanohybrid gelatin/quantum dots for cellular imaging and biosensing applications[J]. International Journal of Molecular Sciences, 2022, 23(19): 11867. doi: 10.3390/ijms231911867 [7] ABDEL-GALIL A, BALBOUL M R, ALI H E. Synthesis and characterization of γ-irradiated cadmium sulfide/polyvinyl alcohol nanocomposites films[J]. Journal of Electronic Materials, 2020, 49(3): 2222-2232. doi: 10.1007/s11664-019-07926-9 [8] ALSAGGAF M S, ELBAZ A F, EL BADAWY- S, et al. Anticancer and antibacterial activity of cadmium sulfide nanoparticles by Aspergillus niger[J]. Advances in Polymer Technology, 2020, 2020: 4909054. [9] DURGA B, RAZIYA S, RAJAMAHANTI S. Synthesis and characterization of cadmium sulphide nanoparticles using Annona muricata leaf extract as reducing/capping agent[J]. Chemical Science Transactions, 2016, 5(4): 1035-1041. [10] QUTUB N, PIRZADA B M, UMAR K, et al. Synthesis of CdS nanoparticles using different sulfide ion precursors: Formation mechanism and photocatalytic degradation of Acid Blue-29[J]. Journal of Environmental Chemical Engineering, 2016, 4(1): 808-817. doi: 10.1016/j.jece.2015.10.031 [11] HU Y, LIU B, WU Y T, et al. Facile high throughput wet-chemical synthesis approach using a microfluidic-based composition and temperature controlling platform[J]. Frontiers in Chemistry, 2020, 8: 579828. doi: 10.3389/fchem.2020.579828 [12] CHEN J Z, MA Q L, WU X J, et al. Wet-chemical synthesis and applications of semiconductor nanomaterial-based epitaxial heterostructures[J]. Nano-Micro Letters, 2019, 11(1): 86. [13] GARCÍA GUILLÉN G, ZUÑIGA IBARRA V A, MENDIVIL PALMA M I, et al. Effects of liquid medium and ablation wavelength on the properties of cadmium sulfide nanoparticles formed by pulsed-laser ablation[J]. Chemphyschem, 2017, 18(9): 1035-1046. doi: 10.1002/cphc.201601056 [14] EMAMI MOGHADDAM S A, GHADAM P, RAHIMZADEH F. Biosynthesis of cadmium sulfide nanoparticles using aqueous extract of Lactobacillus acidophilus along with its improvement by response surface methodology[J]. Journal of Cleaner Production, 2022, 356: 131848. doi: 10.1016/j.jclepro.2022.131848 [15] ROSE M M, SHEELA CHRISTY R, ASENATH BENITTA T, et al. Phase transitions in cadmium sulfide nanoparticles[J]. 2021, 11(8): 085129. [16] BHAT I U H, YI Y S. Green synthesis and antibacterial activity of cadmium sulfide nanoparticles (CdS NPs) using Panicum sarmentosum[J]. Asian Journal of Green Chemistry, 2019, 3(4): 455-469. [17] ULLAH A, RASHEED S, ALI I, et al. Plant mediated synthesis of CdS nanoparticles, their characterization and application for photocatalytic degradation of toxic organic dye[J]. Chemical Review and Letters, 2021, 4(2): 98-107. [18] MUBARAKALI D, GOPINATH V, RAMESHBABU N, et al. Synthesis and characterization of CdS nanoparticles using C-phycoerythrin from the marine cyanobacteria[J]. Materials Letters, 2012, 74: 8-11. doi: 10.1016/j.matlet.2012.01.026 [19] SANKHLA A, SHARMA R, YADAV R S, et al. Biosynthesis and characterization of cadmium sulfide nanoparticles–An emphasis of Zeta potential behavior due to capping[J]. Materials Chemistry and Physics, 2016, 170: 44-51. doi: 10.1016/j.matchemphys.2015.12.017 [20] DIKSHIT P, KUMAR J, DAS A, et al. Green synthesis of metallic nanoparticles: Applications and limitations[J]. Catalysts, 2021, 11(8): 902. doi: 10.3390/catal11080902 [21] BOROVAYA M, PIRKO Y, KRUPODOROVA T, et al. Biosynthesis of cadmium sulphide quantum dots by using Pleurotus ostreatus(Jacq. )P. Kumm[J]. Biotechnology & Biotechnological Equipment, 2015, 29(6): 1156-1163. [22] BAI H J, ZHANG Z M, GUO Y, et al. Biosynthesis of cadmium sulfide nanoparticles by photosynthetic bacteria Rhodopseudomonas palustris[J]. Colloids and Surfaces. B, Biointerfaces, 2009, 70(1): 142-146. doi: 10.1016/j.colsurfb.2008.12.025 [23] PERRAULT S D, WALKEY C, JENNINGS T, et al. Mediating tumor targeting efficiency of nanoparticles through design[J]. Nano Letters, 2009, 9(5): 1909-1915. doi: 10.1021/nl900031y [24] TANG L, YANG X J, YIN Q, et al. Investigating the optimal size of anticancer nanomedicine[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(43): 15344-15349. [25] BLANCO E, SHEN H F, FERRARI M. Principles of nanoparticle design for overcoming biological barriers to drug delivery[J]. Nature Biotechnology, 2015, 33(9): 941-951. [26] WANG J Q, MAO W W, LOCK L L, et al. The role of micelle size in tumor accumulation, penetration, and treatment[J]. ACS Nano, 2015, 9(7): 7195-7206. doi: 10.1021/acsnano.5b02017 [27] LÜ W, CHEN J, WU Y, et al. Graphene-enhanced visible-light photocatalysis of large-sized CdS particles for wastewater treatment[J]. Nanoscale Research Letters, 2014, 9(1): 148. doi: 10.1186/1556-276X-9-148 [28] SANDOVAL-CÁRDENAS I, GÓMEZ-RAMÍREZ M, ROJAS-AVELIZAPA N G. Use of a sulfur waste for biosynthesis of cadmium sulfide quantum dots with Fusarium oxysporum f. sp. lycopersici[J]. Materials Science in Semiconductor Processing, 2017, 63: 33-39. doi: 10.1016/j.mssp.2017.01.017 [29] EL-BAZ A F, SOROUR N M, SHETAIA Y M. Trichosporon jirovecii–mediated synthesis of cadmium sulfide nanoparticles[J]. Journal of Basic Microbiology, 2016, 56(5): 520-530. doi: 10.1002/jobm.201500275 [30] NADAGOUDA M N, SPETH T F, VARMA R S. Microwave-assisted green synthesis of silver nanostructures[J]. Accounts of Chemical Research, 2011, 44(7): 469-478. doi: 10.1021/ar1001457 [31] VELIKOV K P, ZEGERS G E, van BLAADEREN A. Synthesis and characterization of large colloidal silver particles[J]. Langmuir, 2003, 19(4): 1384-1389. doi: 10.1021/la026610p [32] SUN H F, LI Y H, JI Y F, et al. Environmental contamination and health hazard of lead and cadmium around Chatian mercury mining deposit in western Hunan Province, China[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(2): 308-314. [33] DADMEHR M, KOROUZHDEHI B, TAVASSOLI A, et al. Photocatalytic activity of green synthesized cadmium sulfide quantum dots on the removal of RhB dye and its cytotoxicity and antibacterial studies[J]. Nanotechnology, 2022, 33(39): 395101. doi: 10.1088/1361-6528/ac79bc [34] LI X M, PENG W H, JIA Y Y, et al. Removal of cadmium and zinc from contaminated wastewater using Rhodobacter sphaeroides[J]. Water Science and Technology, 2017, 75(11/12): 2489-2498. [35] DETHLEFSEN S, JÄGER C, KLOCKGETHER J, et al. Metabolite profiling of the cold adaptation of Pseudomonas putida KT2440 and cold-sensitive mutants[J]. Environmental Microbiology Reports, 2019, 11(6): 777-783. doi: 10.1111/1758-2229.12793 [36] 陈华民. 微生物检验技术[M]. 北京: 中国中医药出版社, 2013: 207-208. CHEN H M. Microbiological testing techniques[M]. Beijing: China Press of Traditional Chinese Medicine, 2013: 207-208 (in Chinese).
[37] 周庭银. 临床微生物学诊断与图解[M]. 3版. 上海: 上海科学技术出版社, 2012: 232-233. ZHOU T Y. Diagnosis and illustration of clinical microbiology[M]. 3rd ed. Shanghai: Shanghai Scientific & Technical Publishers, 2012: 232-233 (in Chinese).
[38] AGATHOKLEOUS E, KITAO M, CALABRESE E J. Hormesis: A compelling platform for sophisticated plant science[J]. Trends in Plant Science, 2019, 24(4): 318-327. [39] DIWU F, SUN J W, LIU C L, et al. Measurement and modeling of hormesis in soil bacteria and fungi under single and combined treatments of Cd and Pb[J]. Science of the Total Environment, 2021, 783: 147494. doi: 10.1016/j.scitotenv.2021.147494 [40] FERREIRA M L, CASABUONO A C, STACCHIOTTI S T, et al. Chemical characterization of Pseudomonas veronii 2E soluble exopolymer as Cd(II) ligand for the biotreatment of electroplating wastes[J]. International Biodeterioration & Biodegradation, 2017, 119: 605-613. [41] NAFAEE Z H, EGYED V, JANCSÓ A, et al. Revisiting the hydrolysis of ampicillin catalyzed by Temoneira-1 β-lactamase, and the effect of Ni(Ⅱ), Cd(Ⅱ) and Hg(Ⅱ)[J]. Protein Science, 2023, 32(12): e4809. doi: 10.1002/pro.4809 [42] ENSHAEI M, KHANAFARI A, SEPAHEY A A. Metallothionein induction in two species of Pseudomonas exposed to cadmium and copper contamination[J]. Iranian Journal of Environmental Health Science and Engineering, 2010, 7(4): 287-298. [43] TRIPATHI M, KUMAR S, MAKARANA G, et al. Metal-tolerant bioinoculant Pseudomonas putida KNP9 mediated enhancement of soybean growth under heavy metal stress suitable for biofuel production at the metal-contaminated site[J]. Energies, 2023, 16(11): 4508. doi: 10.3390/en16114508 [44] TAYANG A, SONGACHAN L S. Microbial bioremediation of heavy metals[J]. Current Science, 2021, 120(6): 1013. doi: 10.18520/cs/v120/i6/1013-1025 [45] ULLOA G, QUEZADA C P, ARANEDA M, et al. Phosphate favors the biosynthesis of CdS quantum dots in Acidithiobacillus thiooxidans ATCC 19703 by improving metal uptake and tolerance[J]. Frontiers in Microbiology, 2018, 9: 234. [46] RIZVI S B, GHADERI S, KESHTGAR M, et al. Semiconductor quantum dots as fluorescent probes for in vitro and in vivo bio-molecular and cellular imaging[J]. Nano Reviews, 2010, 1: 1. [47] JIN S, HU Y X, GU Z J, et al. Application of quantum dots in biological imaging[J]. Journal of Nanomaterials, 2011(2): 834139. [48] REZVANI AMIN Z, KHASHYARMANESH Z, FAZLY BAZZAZ B S. Different behavior of Staphylococcus epidermidis in intracellular biosynthesis of silver and cadmium sulfide nanoparticles: More stability and lower toxicity of extracted nanoparticles[J]. World Journal of Microbiology & Biotechnology, 2016, 32(9): 140. [49] CHEN Y L, TUAN H Y, TIEN C W, et al. Augmented biosynthesis of cadmium sulfide nanoparticles by genetically engineered Escherichia coli[J]. Biotechnology Progress, 2009, 25(5): 1260-1266. doi: 10.1002/btpr.199 [50] SWEENEY R Y, MAO C B, GAO X X, et al. Bacterial biosynthesis of cadmium sulfide nanocrystals[J]. Chemistry & Biology, 2004, 11(11): 1553-1559. [51] REN X X, ZHAO G L, LI H, et al. The effect of different pH modifier on formation of CdS nanoparticles[J]. Journal of Alloys and Compounds, 2008, 465(1/2): 534-539. [52] MIRNAYA T A, ASAULA V N, VOLKOV S V, et al. Synthesis and optical properties of liquid crystalline nanocomposites of cadmium octanoate with CdS quantum dots[J]. Physchem Solid State, 2012, 13(1): 131-135. [53] MOHANRAJ V, JAYAPRAKASH R, CHANDRASEKARAN J, et al. Influence of pH on particle size, band-gap and activation energy of CdS nanoparticles synthesized at constant frequency ultrasonic wave irradiation[J]. Materials Science in Semiconductor Processing, 2017, 66: 131-139. doi: 10.1016/j.mssp.2017.04.006 [54] 刘辉, 李文友, 尹洪宗, 等. CdS纳米粒子制备的影响因素及CdS纳米粒子-酚藏花红体系的光谱特性[J]. 化学学报, 2005, 63(4): 301-306,257. LIU H, LI W Y, YIN H Z, et al. Influence factors for the preparation of CdS nanoparticles and spectroscopic study on the CdS-phenosafranine system[J]. Acta Chimica Sinica, 2005, 63(4): 301-306,257 (in Chinese).
[55] 张宇, 付德刚, 蔡建东, 等. CdS纳米粒子的表面修饰及其对光学性质的影响[J]. 物理化学学报, 2000, 16(5): 431-436. ZHANG Y, FU D G, CAI J D, et al. Surface-modification of CdS nanoparticle and its optical properties[J]. Acta Physico-Chimica Sinica, 2000, 16(5): 431-436 (in Chinese).
[56] 吴晓春, 汤国庆, 张桂兰, 等. 不同制备条件对纳米Bi2O3发光的影响[J]. 化学学报, 1996, 54(2): 146-151. WU X C, TANG G Q, ZHANG G L, et al. The effects of synthesis conditions on the luminescence of nanometer-sized Bi2O3 organosols[J]. Acta Chimica Sinica, 1996, 54(2): 146-151 (in Chinese).
[57] KAMBLE M M, RONDIYA S R, BADE B R, et al. Optical, structural and morphological study of CdS nanoparticles: Role of sulfur source[J]. Nanomaterials and Energy, 2020, 9(1): 72-81. doi: 10.1680/jnaen.19.00041 [58] ABU S N, MUHAMAD, IBRAHIM A L. The effect of pH, temperature on green synthesis and antibacterial activity of silver nanoparticles from polygonum minus extract[J]. Aip Conf. Proc. 2023, 2625(1): 020005. [59] 袁盛力, 何德勇, 方洁, 等. 复合纳米材料MoS_(2)@CNTs光电催化降解盐酸四环素的研究[J]. 现代化工, 2024, 44(9): 97-102. YUAN S L, HE D Y, FANG J, et al. Photocatalytic degradation of tetracycline hydrochloride by composite nanomaterial MoS_(2)@CNTs[J]. Modern Chemical Engineering, 2024, 44(9): 97-102 (in Chinese).
[60] 沈琳玉, 沈丹红, 陈康, 等. 高效降解环境新污染物四环素的复合光催化剂: 从材料设计到降解机制[J]. 环境化学, 2023, 42(9): 2859-2875. doi: 10.7524/j.issn.0254-6108.2022090103 SHEN L Y, SHEN D H, CHEN K, et al. Composite photocatalysts for efficient degradation of emerging contaminant tetracyclines: From material design to degradation mechanisms[J]. Environmental Chemistry, 2023, 42(9): 2859-2875 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022090103
[61] WANG W X, WANG L, LV Y C, et al. Simple synthesis of CoNi@ZrO2 nanospheres for catalytic degradation of chloramphenicol under visible light[J]. Water, Air, & Soil Pollution, 2024, 235(8): 539. [62] ULLAH H, VIGLAŠOVÁ E, GALAMBOŠ M. Visible light-driven photocatalytic rhodamine B degradation using CdS nanorods[J]. Processes, 2021, 9(2): 263. doi: 10.3390/pr9020263 [63] GURUGUBELLI T R, RAVIKUMAR R V S S N, KOUTAVARAPU R. Enhanced photocatalytic activity of ZnO–CdS composite nanostructures towards the degradation of rhodamine B under solar light[J]. Catalysts, 2022, 12(1): 84. [64] 刘海涛, 丁颖, 徐丽慧, 等. ZIF-8/CdS复合材料对亚甲基蓝的光催化降解[J]. 环境化学, 2023, 42(1): 288-297. doi: 10.7524/j.issn.0254-6108.2021082903 LIU H T, DING Y, XU L H, et al. Photocatalytic degradation of methylene blue by ZIF-8/CdS composites[J]. Environmental Chemistry, 2023, 42(1): 288-297 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021082903
-



 下载:
下载: