-
自20世纪40年代以来,大量塑料制品及其塑料废弃物进入自然或人工环境中[1 − 2],在光照、高温以及物理磨损、化学腐蚀和生物降解作用下发生破损、裂解等[3 − 5],形成粒径小于5 mm的纤维、颗粒、薄膜和碎片状的微塑料(microplastics,MPs)[2 − 3]. 近年来,海洋、湖泊、河流、土壤等生态系统中已检出种类丰富、数量巨大的MPs,地球南北极以及最深和最高的地方都检测到MPs的存在[6 − 9],反映出MPs污染已遍布全球. 经预测到2030年全球范围内MPs数量将达到5.3×107 t [10]. 这些数量庞大的MPs将对生态系统以及人类健康构成严重威胁[11 − 12]. 表现在:一方面MPs可吸附积累重金属[13]、农药[14]、内分泌干扰素[15]、抗生素等污染物[16],在产生复合毒性效应[16]的同时,可能将吸附的这些有害物质输送到任何没有被污染的生态系统[17];另一方面,附着于MPs载体上的非本地物种可随MPs在水体中长距离漂移后到达新的栖息地[4, 18],这可能加剧病毒等聚集、扩散和传播风险[19]. 作为全世界范围内不容忽视的新型污染物,MPs污染问题已被广泛关注[20 − 21].
与水体中漂浮的自然基质相比[22],MPs尺寸小、具有较大的比表面积,材质疏水性强,其难降解的特性使MPs可在水体中更长时间的存在,这些特征为微生物附着提供了理性的载体和独特的环境[23]. 近年来,关于MPs附着微生物的研究主要集中在聚合物材质、暴露时间等方面,且研究结果存在较大差异. 如Zettler等[24]认为MPs类型对微生物定殖有显著影响,该研究发现PE-MPs和PS-MPs附着微生物群落相似度仅为58%;但Di Pippo等[25]发现MPs类型对附着微生物群落的组成、结构和丰度没有显著影响. 由于MPs附着细菌主要来源于其所在水域水体等环境介质 [26 − 27],环境背景差异对附着细菌群落产生重要影响[28 − 29]. 如文开等[19]发现变形杆菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)是暴露于污染海水中的PS-MPs附着最主要的优势菌门,而Ogonowski等[30]则发现,除了变形杆菌门和拟杆菌门,浮霉菌门(Planctomycetes)也是波罗的海PS-MPs附着的核心细菌门. 可见,不同水域的MPs附着细菌群落差异较大. 尽管针对湖泊生态系统已有关于MPs附着微生物的研究报告[9, 20 − 22],但现有研究主要集中在不同暴露时间的MPs附着微生物群落多样性等方面,MPs附着微生物与所在水域环境介质中微生物群落及其功能的对比性研究仍不足. 基于此,本实验以淡水水域频繁检出的PE、PVC、PP、PS和PET共5种材质MPs为附着载体,开展为期42 d原位暴露实验,对比分析同一生境下MPs附着细菌与其所在水域环境样品(沉积物以及上覆水)细菌在群落及其功能上的差异,研究结果对于进一步积累淡水水域MPs附着细菌群落及其功能特征方面的基础数据具有重要的意义.
-
选用PE-MPs、PVC-MPs、PP-MPs、PS-MPs以及PET-MPs 颗粒作为原材料开展研究,MPs粒径介于2—3 mm.
首先用无菌水清洗MPs颗粒,待自然干燥后,5种材质MPs颗粒各取250颗(5.0—10.0 g)分别装入140 cm×105 cm网袋中(网孔直径0.15 mm,可避免MPs颗粒逃逸),每种材质各6袋,随机分成3组. 随后将5种材质MPs各2个网袋装入大网兜(10袋,5个材质MPs各2袋),共3个网兜;2022年4月,将3组网兜悬挂于江苏大学校内镜湖3个点位(记为3次重复)作为MPs暴露实验试验区,3个点位分别间隔10 m左右.
暴露实验期间,确保网兜始终浸没于水面以下,且定期对暴露区3个点位水体溶解氧(DO)、pH、温度等指标进行原位监测. 暴露第42天,先采集MPs暴露所在水域3个点位上覆水样5.0 L,用于水质参数以及水体浮游细菌测定;接着全部分别回收网兜中MPs颗粒,用于MPs附着物干重和附着物理化指标测定以及MPs附着细菌提取;最后采用抓斗采泥器采集3个点位沉积物样品约500 g,用于沉积物理化指标测定和微生物分析.
-
水质指标测定:上覆水样溶解氧(DO)采用HQ30d溶解氧仪测定;pH和温度采用HI
98128 防水型袖珍pH/温度微电脑测试笔测定;水体总氮(TN)、总磷(TP)、氨氮(NH4+-N)、硝氮(NO3--N)参考《水和废水监测分析方法》(第四版)测定.沉积物理化参数测定:沉积物pH(水土比为 2.5:1)采用复合电极pH计测定(雷磁 PHSJ-3F,INESA,上海). 沉积物NH4+-N通过2 mol·L−1 KCl浸提后采用靛酚蓝分光光度法测定;沉积物NO3--N采用酚二磺酸分光光度法测定;TN采用凯氏定氮仪(K9860海能仪器)测定. TP采用高氯酸-浓硫酸(HClO4-H2SO4)消煮后用钼锑抗比色法测定.
MPs附着物干重测定:3个点位5种材质MPs约5.0 g分别置于100 mL塑料瓶中,加入60 mL无水乙醇,随后振荡30 min,超声10 min,再振荡30 min. 将液体离心10 min后,弃去上清液后将离心管置于80 ℃的烘箱中烘干至恒重(约6 h以上),计算获得MPs附着物干重.
MPs附着物理化参数测定:3个点位5种材质MPs各2.0 g分别置于50 mL具塞玻璃瓶中,加入40 mL蒸馏水,超声10 min,振荡10 min,再超声10 min,之后将溶液倒入500 mL容量瓶中,反复冲洗4到5次,用蒸馏水定容后测定滤液中TN、TP、NH4+-N、NO3--N以及TOC的含量,并计算获得MPs附着物理化参数.
-
4 L上覆水样分别用5 μm和0.2 μm Millipore聚碳酸酯膜(Merck Millipore, USA)进行抽滤,抽滤后将滤膜置于无菌离心管中用于上覆水体浮游细菌提取. 3个点位5种材质MPs样品各2.0 g,放置于无菌离心管中用于MPs附着细菌DNA提取. 3个点位沉积物样品随机取2.0 g用于细菌DNA提取. 以上样品在DNA提取前均-25 ℃储存.
通过E.Z.N.A.® soil 试剂盒(Omega Bio-tek, Norcross, GA, U.S.)进行总DNA抽提. 通过338F (5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')引物进行PCR 扩增(PCR扩增仪ABI Gene Amp®
9700 型). PCR反应体系为4 μL 5×FastPfu Buffer,4 μL 2.5 mmol·L−1 dNTPs,0.8 μL正向引物,0.8 μL反向引物,10 ng DNA模板,无菌水补至总体系20 μL;程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s、55 ℃退火30 s、72 ℃ 延伸45 s),最后72 ℃延伸10 min. PCR扩增结束后,用2%琼脂糖凝胶电泳进行产物验证. 高通量测序委托上海美吉生物医药科技有限公司基于Illumina Miseq PE300平台(Illumina,美国)完成. -
所测原始序列经质控、过滤、拼接后利用UPARSE软件(http://drive5.com/uparse/)进行聚类,得到97%相似度的操作分类单元(operational taxonomic units,OTU). 按最小样本序列数将各样品抽平处理后共得到
5142 个OTUs. 基于所获OTUs,经RDP classifier(https://sourceforge.net/projects/rdp-classifier/,RDP:http://rdp.cme.msu.edu/)对OTUs结果注释得到各样本细菌物种分类信息(分类置信度:0.7);通过Mothur软件计算各实验组沉积物样品细菌Alpha多样性指数(Shannon、Simpson、ACE和Chao);基于层级聚类(hierarchical clustering)和非度量多维尺度分析(non-metric multidimensional scaling,NMDS)解析MPs附着细菌及所在水域环境样本(上覆水和沉积物)细菌群落Beta多样性(Bray-Curtis距离算法,OTUs水平),并通过PERMANOVA分析(permutational multivariate analysis of variance)对细菌群落结构差异进行统计学检验. 基于韦恩图(Venn)研究各组样品中共有和独有细菌;通过Circos图描述丰度排名前10的优势门;柱形累积图分析细菌群落在纲和属分类水平上相对丰度变化;通过PICRUSt2对细菌群落代谢功能等进行预测[31 − 32],通过FAPROTAX(functional annotation of prokaryotic taxa)对细菌群落物质循环等生态功能进行预测 [33]. 通过冗余分析(redundancy analysis, RDA)和Spearman相关性聚类热图对细菌群落矩阵及物种组成矩阵分别与理化参数矩阵进行分析. 细菌Alpha多样性指数、物种组成及功能预测结果通过Kruskal-Wallis秩和检验进行差异显著性分析. 以上与微生物相关的分析均在美吉生物云平台在线完成 (http://cloud.majorbio.com). 其他数据(平均值±标准差)采用Microsoft Excel和SPSS软件进行分析. P<0.05和P<0.01为差异显著和极显著水平. -
MPs暴露实验所在水域水体pH以及温度平均值分别为7.13和22.19 ℃,DO平均含量为8.80 mg·L−1,实验期间始终保持好氧状态. 水体TN、NH4+-N、NO3--N和TP平均浓度分别为0.86、0.24、0.17、0.03 mg·L−1. 沉积物pH介于7.17—7.41之间,TN、TP和O.M平均含量分别为0.52、0.33、5.62 g·kg−1,沉积物NH4+-N和NO3--N含量在0.36—17.60 mg·kg−1和9.84 —11.93 mg·kg−1之间波动. 除了沉积物NH4+-N,其他水质参数和沉积物理化参数在3个点位的变异系数均较小,表明MPs的3个暴露点位环境参数的变幅较小.
5种MPs附着物干重介于15.96—28.60 g·kg−1之间. PP-MPs附着物TN含量最高,其次为PVC-MPs、PE-MPs和PET-MPs,PS-MPs材质TN含量最低. 5种材质MPs附着物中TP含量表现为:PVC>PP>PS>PET>PE. 方差分析结果发现,MPs附着物干重以及氮磷含量在3个点位均无显著差异(P>0.05);MPs附着物TN含量在5种材质之间有显著差异(P<0.05),但附着物干重以及TP含量随MPs材质的不同无显著差异(P>0.05).
-
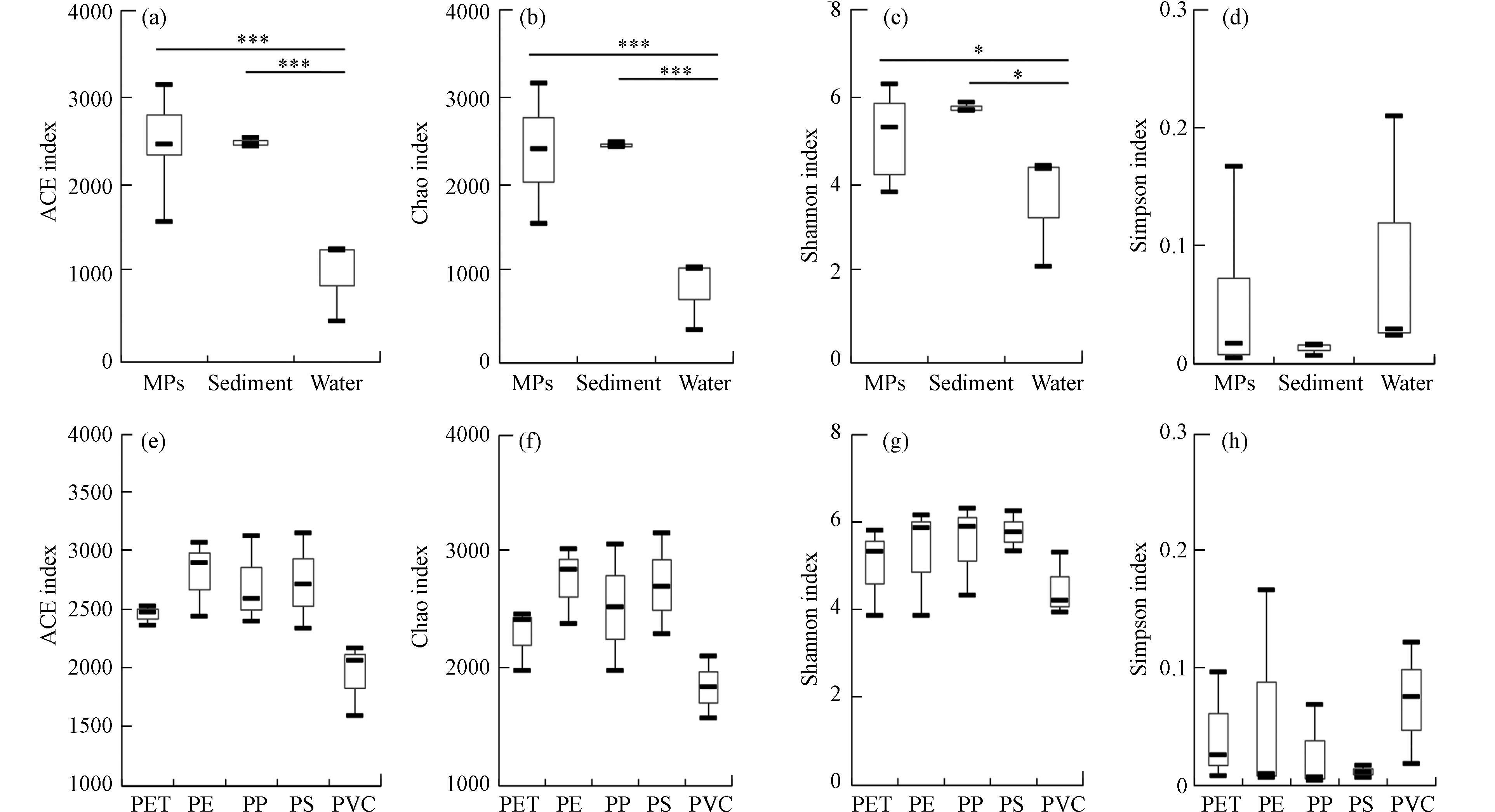
MPs附着细菌与所在水域环境样本(上覆水和沉积物)细菌群落Alpha多样性指数(ACE、Chao、Simpson和Shannon)统计结果见图1所示. 3种样品细菌群落Shannon和Chao指数平均值表现为沉积物>MPs>上覆水;ACE指数最高值出现在MPs组,其次为沉积物,最低值为上覆水;Simpson指数平均值表现为上覆水>MPs>沉积物. Kruskal-Wallis检验结果证实了水体浮游细菌与沉积物细菌Alpha多样性指数、水体浮游细菌与MPs附着细菌Alpha多样性指数(Shannon、ACE和Chao)间均存在显著差异(P<0.05),但MPs附着细菌与沉积物细菌Alpha多样性各指数均无显著差异(P>0.05). 从以上结果可知,沉积物中细菌物种丰富度(Chao指数)以及物种多样性(Shannon指数和Simpson指数)均高于MPs. 此外,无论是沉积物还是MPs样品,其细菌群落丰富度和物种多样性均高于水体浮游细菌群落,这与前人研究结果一致[34]. 自然水体细菌主要包括上覆水中的浮游细菌以及沉积物等介质中存在的细菌,这两种细菌是MPs附着细菌的主要来源[20]. 相对于上覆水而言,沉积物由于具有更为丰度的营养元素,存在较高的氧化还原微生境以及更为稳定的内环境等[35 − 36],是细菌群落的主要栖息生境,故沉积物中存在更为多样且丰富的细菌群落. 在生物扰动、水动力等各种因素的影响下,沉积物可能通过再悬浮等方式为MPs提供细菌源[37 − 38]. 对于MPs而言,其表面可吸附水体中粒径小于其自身的悬浮颗粒物,这些颗粒物中可能携带各种营养元素等,尽管其含量低于沉积物,但仍然在促使浮游细菌在MPs表面的附着及定居过程中发挥作用,这可能是MPs附着细菌物种多样性和丰富度高于水体浮游细菌群落的原因之一. MPs附着细菌群落丰富度和多样性介于上覆水和沉积物之间,意味着MPs附着细菌与其所处的沉积和水生生境有关[20, 39].
对5种材质MPs对比分析发现,3个点位Shannon、ACE和Chao指数最低的平均值出现在PVC-MPs组,而最高值则分别出现在PP-MPs组(Shannon指数)以及PE-MPs组(ACE和Chao指数),意味着本研究所选的PVC-MPs具有最小的细菌群落多样性和丰富度,PP-MPs具有最大的细菌群落多样性,而PE-MPs具有最大的细菌群落丰富度. 以上结果证实了MPs类型对微生物定殖的影响. 研究发现,MPs表面粗糙度、形状、比表面积、官能团以及亲水性/疏水性等特征均对微生物的附着产生影响[16, 38, 40 − 42],因此,微生物对聚合物类型表现出一定的选择性[43]. 陈玉芳等[38]发现附着于PET-MPs上的细菌群落alpha多样性高于PVC-MPs. 彭子淇等[16]研究发现珠江河口生境中不同MPs颗粒(PLA、PP及PS)种类对其附着定殖的原核微生物类群具有较强的选择作用. 李汶璐等[32]发现PVC-MPs添加可使沉积物细菌群落变化更明显,其原因可能是PVC的“毒性”将抑制细菌的生存和繁殖[38, 44 − 46]. Li等[47]发现较大表面积的发泡类MPs(例如PE-MPs)可从环境中吸附蛋白质等营养物质,进而促进微生物定殖,这也解释了本研究中PE-MPs具有最大的细菌群落丰富度.
-
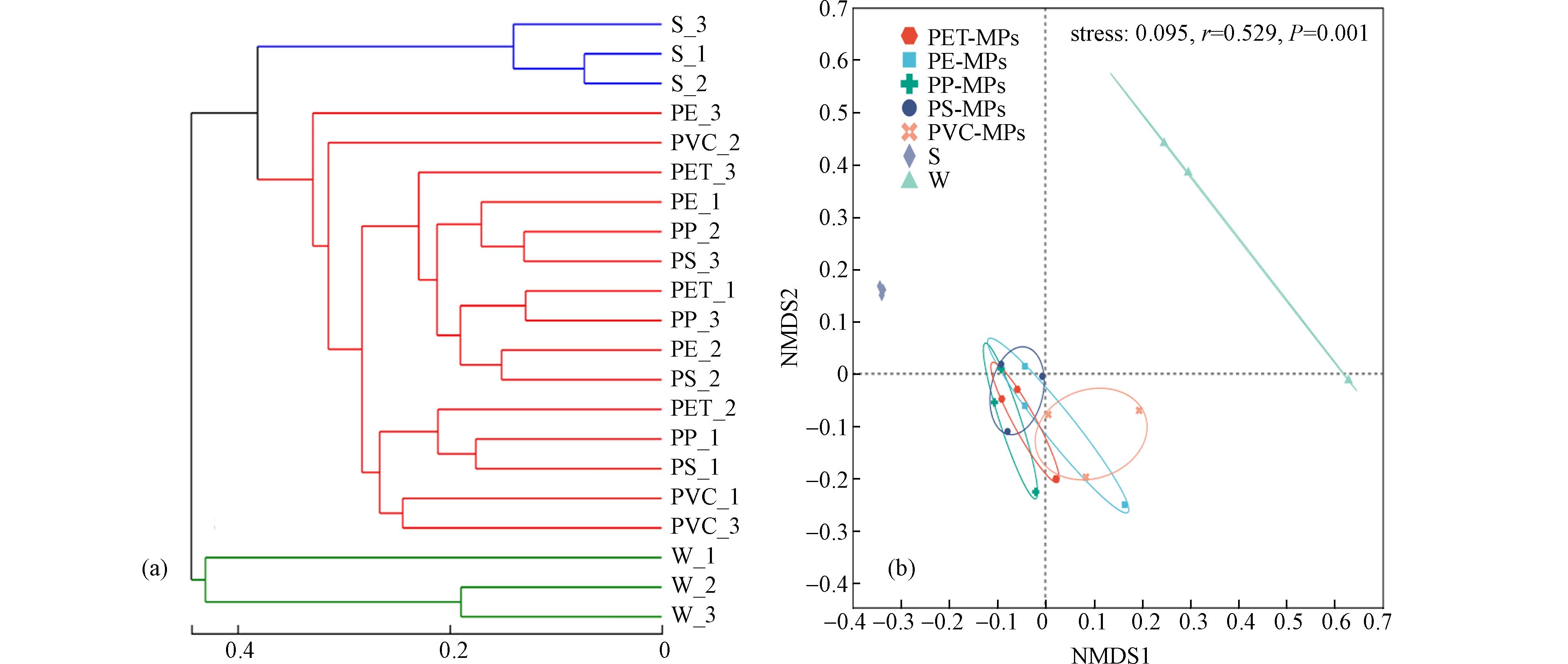
层级聚类分析结果显示(图2a),3种来源细菌群落均各自聚集成一组,表明相同来源样品的细菌群落结构相似度较高,而不同来源样品细菌群落结构差异较大. 非度量多维尺度(non-metric multidimensional scaling,NMDS)分析发现(图2b),stress值为0.095,表明NMDS对各组样品细菌群落结构相似性或差异性分析的结果具有可靠性. NMDS结果显示MPs、上覆水、沉积物等3种样品距离较远且无重叠,说明这3种样品细菌群落相似性较弱. 沉积物样品之间距离最近,表明3个暴露点位沉积物样品之间差异性最小;上覆水各样品间距离较远且单独处于1个区域,表明浮游细菌群落结构组内差异大于沉积物以及MPs样品. 5种材质MPs样品之间距离较近且存在部分重叠,表明5种材质MPs附着细菌群落相似度较高. 刘淑丽等[20]基于主坐标分析(PCoA)发现鄱阳湖南矶山湿地沉积物中3种类型微塑料彼此相距较近,而水体中不同微塑料样品相距较远,细菌群落差异比较大,与本文研究结果一致. PERMANOVA结果证实MPs、上覆水和沉积物样品细菌群落结构的显著差异(F=7.209,R2=0.444,P<0.01),本文所选5种材质MPs附着细菌群落结构则无显著差异(F=1.224,R2=0.329,P>0.05).
-
MPs与所在水域上覆水和沉积物样品中共检测到OTUs
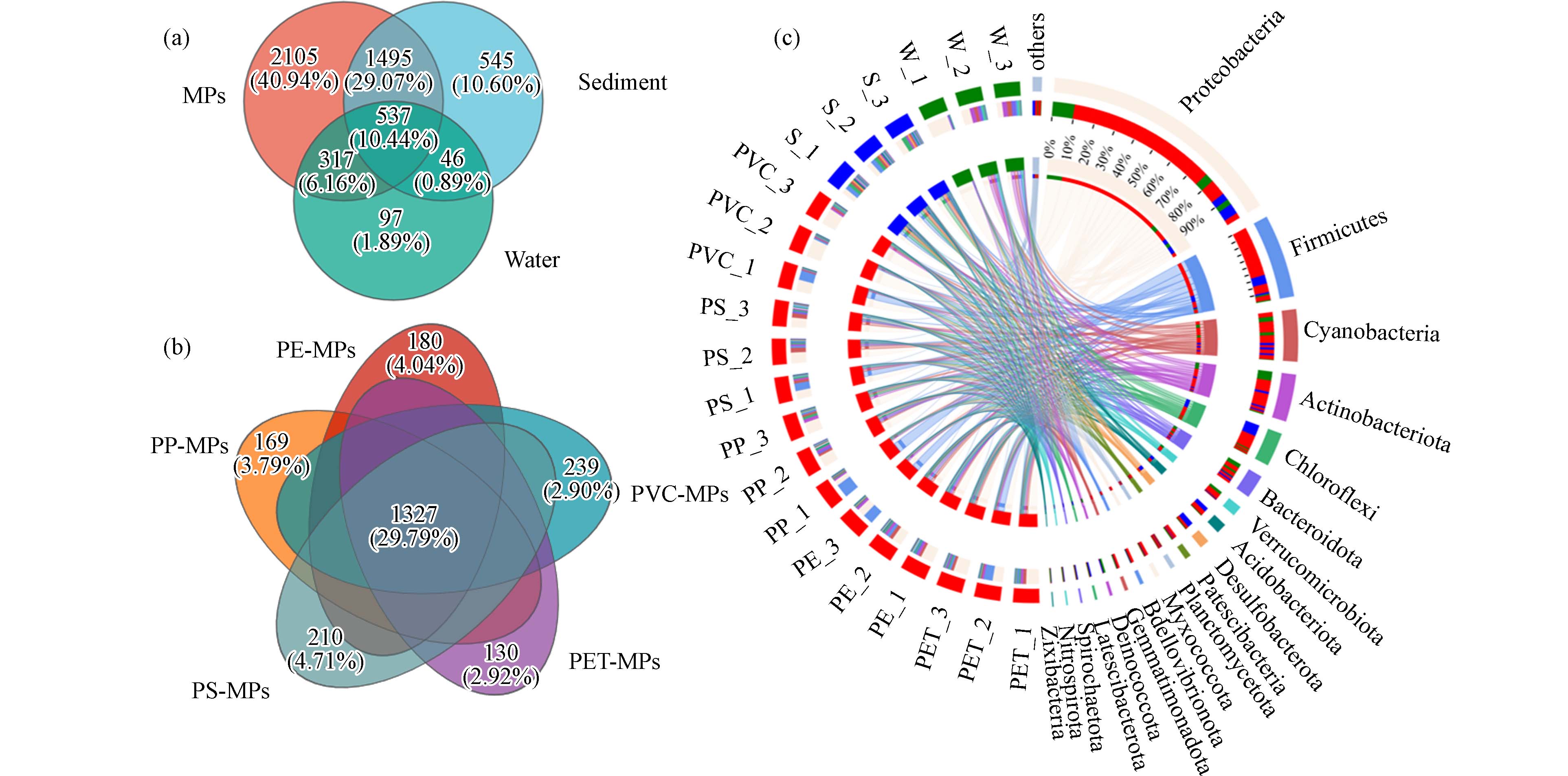
5142 个,包含细菌60门164纲377目598科1081 属2088 种. 其中,MPs附着细菌OTUs数量为4454 个(细菌51门147纲336目543科1002 属1888种);沉积物中检测到OTUs共计2623 个(细菌55门149纲319目463科735属1294 种),而水体浮游细菌OTUs数量最小,仅为997个(细菌29门79纲195目295科476属705种).基于韦恩图对3种样本中共有和独有OTUs进行分析(图3a),发现3种来源样品共有537个共有OTUs,占OTUs总数的10.44%,意味着仅有10.44%的细菌同时存在于上覆水、沉积物以及MPs. MPs与沉积物样本共有OTUs为
1495 个(占总OTUs的29.07%),远高于MPs与上覆水共有OTUs(317个,占总OTUs的6.16%). MPs、上覆水和沉积物3种样本中独有的OTUs数量为2105 个、97个和545个,分别占总OTUs的40.95%、1.89%和10.60%,独有OTUs反映了各组样品中细菌群落组成的差异性. 较高比例的独有OTUs证实了MPs可为细菌提供独特的生态位. 5种材质微塑料独有OTUs较少,仅占总OTUs的2.90%—4.71%,共有细菌OTUs所占比例为29.79%,意味着有29.79%的细菌同时附着于这5种材质MPs载体上(图3b).变形菌门、浮霉菌门、放线菌门(Actinobacteriota)、拟杆菌门、蓝细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)等是淡水水域MPs表面最常检出的优势细菌类群,也是淡水水域“塑料圈”中核心群落的组成成员[22, 27]. 本研究中MPs、上覆水和沉积物样品中相对丰度>1%的优势细菌门分别为9个、8个和12个,而相对丰度值<0.1%细菌门则分别为39个(MPs)、44个(上覆水)和33个(沉积物),占总细菌门的65%、73%以及55%. 共有优势细菌门(图3c)包含变形菌门、厚壁菌门、蓝细菌门、放线菌门、绿弯菌门(Chloroflexi)和拟杆菌门;而3种不同来源样品同样检测到独有的细菌类群,如Desulfobacterota、Latescibacterota、Spirochaetota以及Nitrospirota仅在沉积物样品中检测到;Deinococcota则仅在上覆水中被检测;而MPs样品中独有的细菌门有互养菌门(Synergistota)、Abditibacteriota以及Entotheonellaeota.
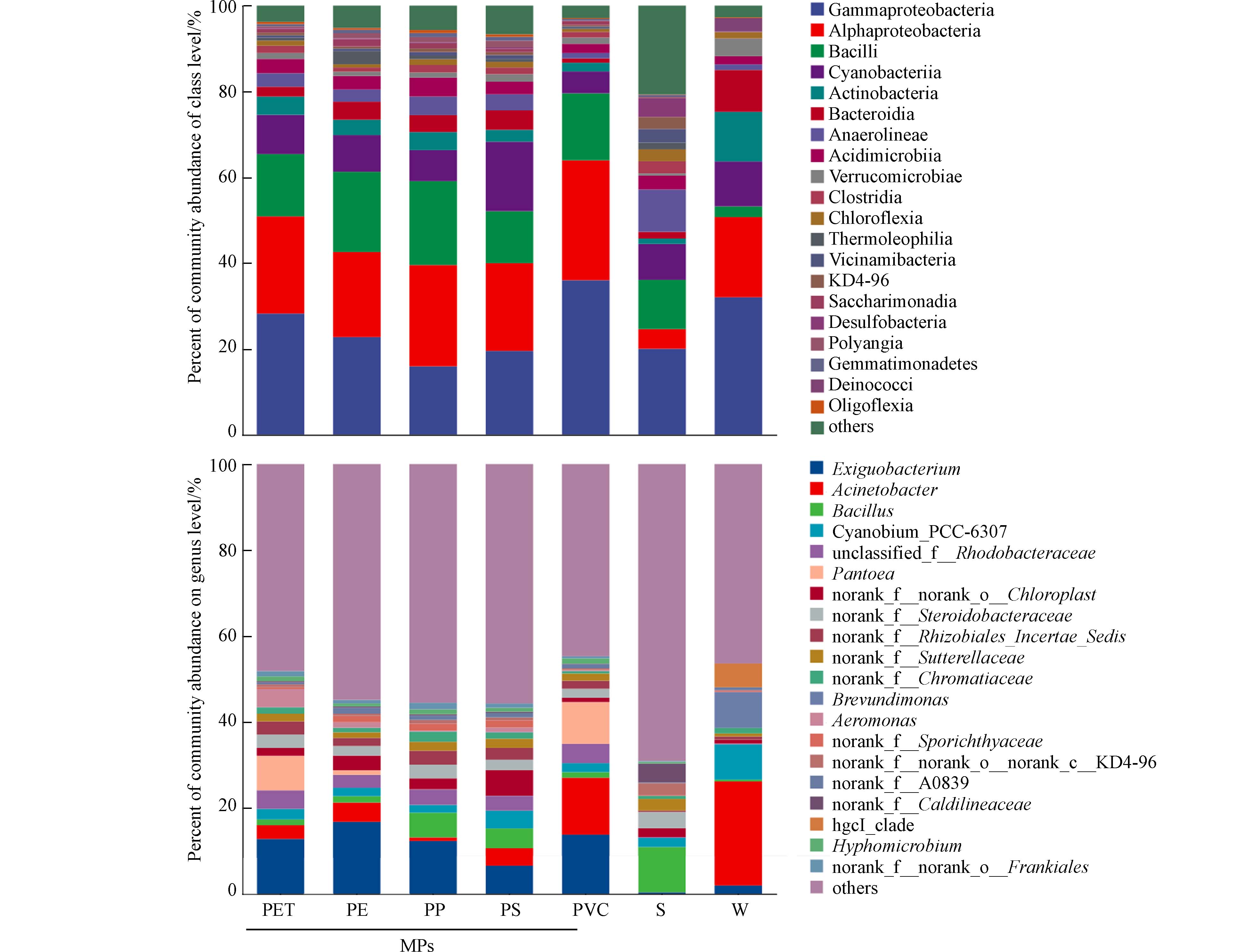
Yang等[48]认为MPs附着微生物的形成可分为原始定殖、中期定殖以及晚期定殖共3个阶段,这3个阶段细菌群落从最初的先驱定殖者逐渐演替到更加多样化的群落,这是微生物群落演替和动态平衡结果[22]. 变形菌门被认为是早期定殖于MPs载体表面的成员之一[27],其可对水环境中的各种营养物质等做出迅速反应[44]. 变形菌门以α-变形菌纲(Alphaproteobacteria)和γ‐变形菌纲(Gammaproteobacteria)为主[20]. 郭佳宝等[22]发现水体MPs首先形成以γ-变形菌为主的先锋群落,进而演替为α-变形菌和黄杆菌为主的微生物群落,最终形成适应环境条件更为复杂的微生物群落. 章宇晴等[27]证实了以上观点,随MPs暴露时间的推移α-变形菌、β-变形菌和黄杆菌的相对丰度增加,γ-变形菌的相对丰度则减少. 本研究3种样品中同样检出γ-变形菌纲(20.03%—32.04%)以及α-变形菌(4.60%—22.89%),但α-变形菌纲在MPs样品中的相对丰度最高(22.89%),γ-变形菌纲在上覆水中最高(32.04%)(图4a).
属水平(图4b),MPs、上覆水以及沉积物样本中分别检测到15个、19个以及21个相对丰度大于1%的优势属. 研究发现假单胞菌属(Pseudomonas)是MPs附着细菌群落的优势菌群之一,该属在塑料降解中可发挥重要作用[20],也被证实是潜在致病性菌属[20]. 本研究在MPs、沉积物以及上覆水中均检测到假单胞菌属,但其在MPs样品中的丰度最高,表明与周围水体和沉积物相比,假单胞菌等潜在致病菌更易选择性附着并定殖在MPs载体上,成为塑料附着微生物群落的“搭便车者” [27, 39]. 随着MPs在水环境中的自由移动,可能会导致这些潜在病原体在多种环境介质中迁移、扩散,从而加剧传播风险[21 − 22].
Kruskal-Wallis秩和检验发现,60个细菌门中共有23个在MPs、上覆水和沉积物中相对丰度存在显著差异(P<0.05),这些具有显著性差异的细菌大部分为偶见菌门(20个),优势门中仅有绿弯菌门相对丰度差异显著(P<0.05). 纲水平,3种来源样品有3个优势纲存在显著差异(P<0.05),64个偶见纲存在显著差异(P<0.05). 属水平(图4),MPs、上覆水以及沉积物仅有1个共有优势菌且差异不差异(P>0.05),而349个相对丰度小于0.1%的偶见属存在显著性差异(P<0.05). 以上结果可初步推断,MPs在湖泊中短期暴露后对细菌群落中占比较小的细菌类群产生更显著的影响. 尽管这些伴生菌群以及偶见菌群相对丰度较低,但其对淡水水域潜在的生态影响却不容忽视. 此外,本文所选5种材质MPs附着细菌优势门及其相对丰度无显著差异(P>0.05),表明材质差异对MPs附着细菌优势物种及其组成影响并不显著.
-
MPs附着的复杂微生物群落可在一定程度上影响淡水水域微生物的代谢途径以及部分生态功能[49]. 本研究基于PICRUSt2功能预测以及KEGG数据库的注释结果见表1和图5所示. MPs、上覆水以及沉积物样本共预测到6个KEGG一级代谢通路和46个二级代谢通路,其中5个KEGG一级代谢通路(占比83.33%)(表1)和33个(占比71.74%)二级代谢通路相对丰度在MPs、上覆水以及沉积物样本中存在显著差异(P<0.05)(图5a),表明附着于MPs的细菌与所在水域细菌代谢路径产生显著的差异. 这与前人研究结果一致. 如陈玉芳[38]发现MPs对微生物的代谢和遗传信息处理功能产生影响. 刘淑丽等[49]发现PE-MPs附着细菌的细胞运动性、信号转导和碳水化合物代谢降低,而能量代谢及辅助因子代谢升高,而PS-MPs附着细菌促进了外源性物质生物降解、细胞运动性和信号转导.
6个一级代谢通路中,新陈代谢路径相对丰度最高,其次为遗传信息处理,说明以上两个代谢路径在细菌定殖过程中起着重要的作用[38]. Lyons等[50]认为相比于环境介质中的浮游微生物,MPs附着微生物群落的聚集会导致更高的代谢周转率. 46个二级代谢通路上,相对丰度前10的通路分别为全局概览图(global and overview maps)、碳水化合物代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)、能量代谢(energy metabolism)、辅因子和维生素代谢(metabolism of cofactors and vitamins)、控制膜运输(membrane transport)、 翻译(translation)、信号传导(signal transduction)、复制和修复(replication and repair)以及cellular community prokaryotes通路,这10个二级代谢通路,除了碳水化合物代谢以及信号传导,其余8个通路在MPs、沉积物及上覆水3种样品中呈现显著差异(P<0.05)(图5a).
对5种材质MPs样本分析后发现,6个KEGG一级代谢通路(表1)和46个二级代谢通路均无显著差异(P>0.05),表明本文所选MPs对其附着细菌的代谢功能影响不大.
此外,通过FAPROTAX对细菌群落物质循环等生态功能进行预测,共得到62个细菌功能类群. 经Kruskal-Wallis检验发现,MPs、上覆水以及沉积物样本共有35个功能类型存在显著差异(P<0.05)(图5b),这些差异性的功能类群涉及到碳、氮和硫的生物化学循环. 本研究共鉴定与氮循环相关的功能类群11个,其中共有6个氮循环相关的功能类群在3组样本中存在显著差异(P<0.05). Chen等[51]发现MPs附着微生物群落具有促进亚硝酸盐氧化的作用. 本研究发现MPs附着细菌群落具有更高的硝酸盐还原(nitrate reduction)、氮呼吸(nitrogen respiration)和硝酸呼吸(nitrate respiration)功能,这些功能均参与淡水水域的氮循环过程. 李大圳等[52]针对红树林系统的研究发现,PE-MPs附着细菌参与的主要功能为碳代谢和硫循环,而氮循环活动较弱,其认为这与红树林系统中的高硫化物浓度限制了硝化和反硝化过程有关[53]. 由此可见,环境背景对于MPs附着细菌生态功能同样将产生影响. 本研究在沉积物样本中则具有更高的固氮作用(nitrogen fixation)、亚硝酸盐脱氮(nitrite denitrification)、氧化亚氮脱氮(nitrous oxide denitrification)、硝酸盐反硝化(nitrate denitrification)以及反硝化作用(denitrification);上覆水中浮游细菌的11个氮循环功能类群相对丰度均低于MPs与沉积物. 对5种材质MPs的分析发现,仅有2个细菌功能类群存在显著差异(P<0.05),表明本文所选5种MPs材质对附着细菌的生态功能影响较小.
-
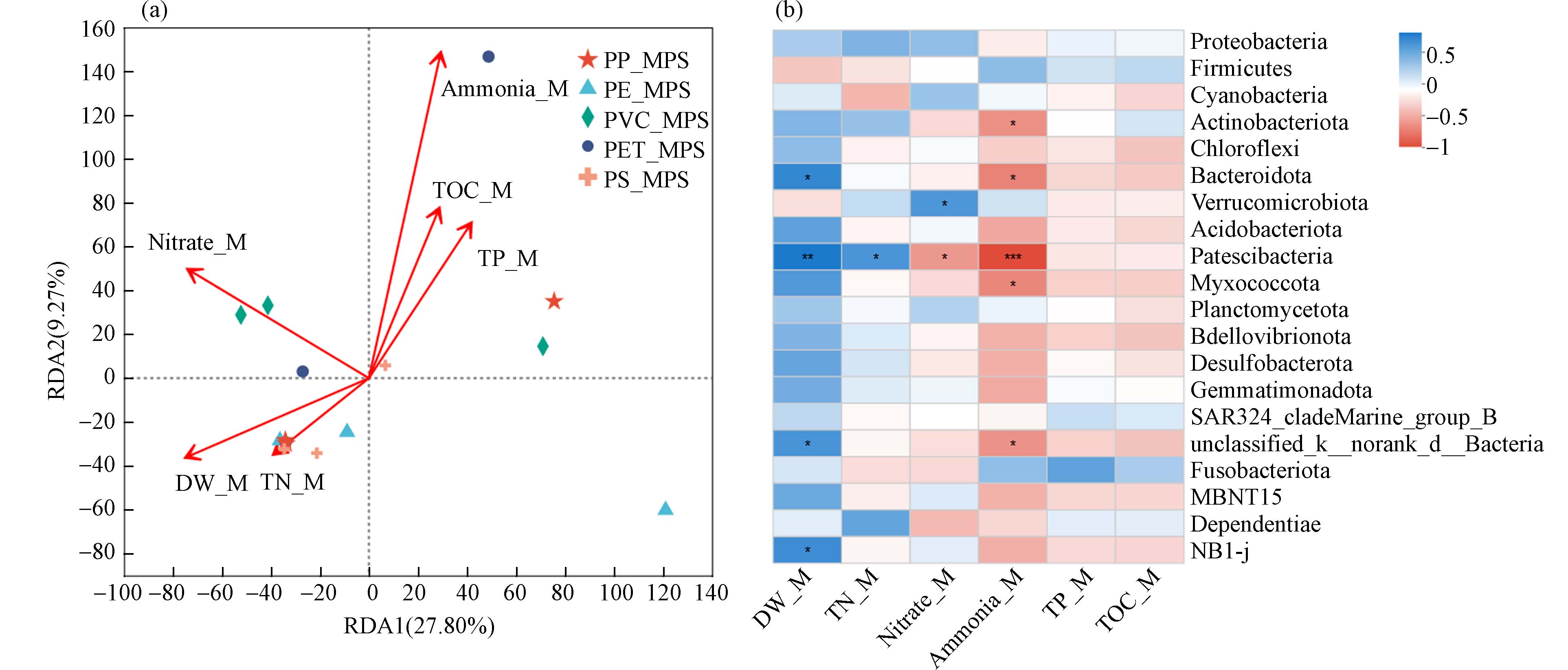
研究发现,MPs附着微生物群落分布受所在水域地理位置、温度、季节、水深以及水环境参数(pH、营养条件、污染程度等)的影响[22, 38]. 郭佳宝等[22]认为淡水水域中温度、营养水平和悬浮颗粒浓度决定了塑料附着微生物群落组成. 本研究基于RDA对MPs附着细菌群落与上覆水环境参数、沉积物理化参数以及附着物理化参数进行统计分析. 结果发现(图6a),仅MPs附着物氨氮对细菌群落产生显著影响(P<0.05).
Spearman相关性热图结果表明(图6b),如放线菌门、Bacteroidota、Patescibacteria以及Myxococcota与附着物氨氮含量间呈显著的相关关系(P<0.05),Patescibacteria受附着物总氮含量的影响(P<0.05),附着物硝态氮与Verrucomicrobiota和Patescibacteria之间存在显著相关性(P<0.05). 以上分析结果表明MPs附着物理化参数对附着细菌群落有一定的影响,这反映了MPs作为载体可吸附水体中的营养元素促使微生物的附着;本研究发现沉积物理化参数对细菌群落的影响并不显著,上覆水理化参数间与水体浮游细菌群落间也未发现显著的相关性,其主要原因可能在于,一方面本次暴露实验周期较短,短时间内研究区域内环境要素的变幅较小;另一方面,MPs的3个暴露点位距离近,与所在水域上覆水和沉积物理化参数间变幅较小有关.
-
(1)MPs短期暴露于湖泊水体后附着细菌群落与所在水域环境样本(上覆水和沉积物)细菌群落Alpha多样性以及Beta多样性有显著差异,但本文所选5种MPs材质(PE、PVC、PS、PP、PET)并未对附着细菌群落产生显著影响.
(2)MPs与所在水域上覆水和沉积物样本共检测OTUs
5142 个,共有细菌OTUs为537个,占比10.44%,这些共有的细菌可同时存在于上覆水、沉积物以及MPs载体表面.(3)MPs及上覆水、沉积物样品分别检测到细菌51门、29门和55门,相对丰度>1%优势菌门共有9个、8个和12个. 变形菌门、厚壁菌门、蓝细菌门、放线菌门、绿弯菌门以及拟杆菌门为共有优势细菌门. 3组样本中偶见菌门(相对丰度值<0.1%)分别为39个(占比65%)、44个(73.3%)和33个(55%),共有20个偶见菌门在3种样本中存在差异,反映出MPs在湖泊中短期暴露后可能对细菌群落中占比较小的物种产生更显著的影响.
(4)PICRUSt2功能预测结果发现5个KEGG一级代谢通路(占比83.33%)以及33个(占比71.74%)二级代谢通路相对丰度在MPs、上覆水以及沉积物细菌存在显著差异(P<0.05);FAPROTAX功能预测共得到62个细菌功能类群,其中35个涉及碳、氮和硫的生物化学循环功能的细菌类群在3组样本中差异显著. 相对于环境样本,MPs附着细菌具有更高的硝酸盐还原、氮呼吸和硝酸呼吸功能;而沉积物样本中则具有更高的固氮作用、亚硝酸盐脱氮、氧化亚氮脱氮、硝酸盐反硝化以及反硝化作用.
微塑料短期暴露后附着细菌与所在水域环境样本细菌群落及功能差异
Difference in community structure and function of bacteria attached to microplastics surface after short-term exposure compared to bacteria in the overlying water and sediment
-
摘要: 作为新兴环境污染物,微塑料已成为全球广泛关注的热点环境问题. 然而,微塑料附着微生物与所在水域环境介质中微生物群落及其功能的对比性研究仍不足. 基于此,以我国淡水湖泊高频检出的聚乙烯(PE)、聚氯乙烯(PVC)、聚丙烯(PP)、聚苯乙烯(PS)和聚对苯二甲酸乙二醇酯(PET)微塑料为研究对象,将其于湖泊水体短期暴露42 d后,对比分析微塑料附着细菌与所在水域环境样本(上覆水和沉积物)细菌群落及功能的差异. 结果表明,微塑料与所在水域上覆水和沉积物3种来源样本共检测操作分类单元(OTUs)
5142 个,包含细菌60门164纲377目598科1081 属2088 种;沉积物以及微塑料附着细菌群落丰富度和物种多样性均显著高于上覆水中浮游细菌(P<0.05);基于层级聚类以及非度量多维尺度分析(NMDS),发现微塑料、沉积物以及上覆水浮游细菌各自形成独特的群落结构. 10.44%的细菌同时存在于上覆水、沉积物以及微塑料,而微塑料、上覆水以及沉积物中分别检测到40.95%、1.89%和10.63%的独有OTUs. 从门、纲、属分类水平上均发现,微塑料在湖泊中短期暴露将对细菌群落中占比较小的物种产生更显著的影响. PICRUSt2功能预测发现5个KEGG一级代谢通路以及33个二级代谢通路相对丰度在微塑料、上覆水以及沉积物样本间存在显著差异(P<0.05);基于FAPROTAX的生态功能预测结果,发现共有35个功能类群在3种来源样本中存在显著差异(P<0.05),这些差异性的功能类群涉及到碳、氮和硫的生物化学循环;相对于环境样本,微塑料附着细菌具有更高的硝酸盐还原、氮呼吸和硝酸呼吸功能;而沉积物具有更高的固氮作用、亚硝酸盐脱氮、氧化亚氮脱氮、硝酸盐反硝化以及反硝化作用. 以上结果证实了微塑料的存在对所在水域细菌群落结构和功能均产生影响. 微塑料附着细菌与附着物理化参数间存在一定的相关性. 本文所选5种微塑料材质差异对附着细菌群落及其功能无显著影响. 上述结果为进一步理解微塑料在水体中暴露后在其表面富集的微生物与所在环境微生物的差异提供了数据支持.Abstract: Microplastics, an emerging environmental pollutant, has emerged as a hot environmental issue and has been widely concerned around the world. However, the difference in community structure and function between bacteria attached to microplastics surface and bacteria in the overlying water and sediment is still lacking. Hence, the microplastic particles of polyethylene (PE), polyvinyl chloride (PVC), polypropylene (PP), polystyrene (PS) and polyethylene terephthalate (PET) detected by high frequency in freshwater lakes in China were taken as the research objects and placed in the lake for short-term exposure for 42 days. The differences of bacterial communities and functions between the bacteria attached to the surface of microplastics and the water samples (overlying water and sediment) were compared and analyzed. The results showed that a total of5142 OTUs were detected in the microplastics samples, the overlying water samples, and the sediment samples. These OTUs include 60 phyla, 164 classes, 377 orders, 598 families, and1081 genera. The community richness and species diversity of bacteria attached to the surface of sediments and microplastics were significantly higher than that of plankton bacteria in overlying water (P<0.05). Complex and unique community structures were observed in microplastic surface, sediment and overlying water, respectively, based on hierarchical clustering and non-metric multidimensional scaling analysis (NMDS). 10.44% of common OTUs were detected both from on the surface of microplastics, the overlying water, sediment and microplastics, while 40.95%, 1.89% and 10.63% of unique OTUs were just detected from microplastics, overlying water and sediment samples, respectively. In terms of phyla, class and genus classification, it was found that microplastics surface after short-term exposure in lakes would have a more significant impact on species with low relative abundance. PICRUSt2 function prediction showed that the relative abundance of 6 primary metabolic pathways and 33 secondary metabolic pathways of KEGG were significantly different in microplastics, overlying water and sediment samples (P<0.05). The ecological function prediction results based on FAPROTAX shown that total 35 functional groups have significant differences in microplastics, overlying water and sediment samples (P<0.05), and these functional groups involved the biochemical cycles of carbon, nitrogen and sulfur. Compared with the environmental samples, the bacteria attached to the surface of microplastics had higher nitrate reduction, nitrogen respiration and nitric acid respiration functions. The sediment has higher nitrogen fixation, nitrite removal, nitrous oxide removal, nitrate denitrification and denitrification. The above results confirmed that the presence of microplastics had an effect on the structure and function of bacterial communities in the water. Bacteria were significantly affected by the physical and chemical parameters of the biofilm attached to the surface of microplastics, however, were not affected by microplastic types These results provide data support for further understanding of the impact of microplastics on freshwater ecosystems.-
Key words:
- microplastics /
- bacterial communities /
- function prediction /
- sediment /
- overlying water.
-

-
表 1 细菌群落KEGG代谢通路(Level 1)相对丰度
Table 1. Relative abundance of KEGG metabolic pathway (Level 1) in bacterial communities
分组
Groups新陈代谢
Metabolism遗传信息处理
Genetic
information
processing遗传信息处理
Environmental
information
processing细胞过程
Cellular processes人类疾病
Human diseases有机系统
Organismal
systems3组样本 MPs 76.53%±0.43% 6.39%±0.18% 6.00%±0.31% 4.87%±0.18% 4.28%±0.31% 1.92%±0.05% Sediment 77.37%±0.12% 7.42%±0.03% 5.38%±0.08% 4.67%±0.07% 3.30%±0.10% 1.86%±0.01% Water 77.58%±0.63% 6.75%±0.30% 5.25%±0.10% 4.11%±0.12% 4.38%±0.58% 1.98%±0.09% P值 <0.05 <0.05 <0.05 <0.05 <0.05 >0.05 5个材质 PP-MPs 76.93%±0.32% 6.51%±0.08% 5.80%±0.26% 4.76%±0.04% 4.12%±0.42% 1.89%±0.06% PE-MPs 76.64%±0.33% 6.40%±0.04% 5.93%±0.14% 4.89%±0.12% 4.17%±0.32% 1.97%±0.02% PVC-MPs 76.04%±0.04% 6.13%±0.11% 6.28%±0.08% 5.02%±0.11% 4.64%±0.07% 1.90%±0.02% PET-MPs 76.26%±0.47% 6.33%±0.02% 6.22%±0.43% 4.99%±0.23% 4.29%±0.27% 1.91%±0.04% PS-MPs 76.80%±0.09% 6.57%±0.14% 5.79%±0.25% 4.68%±0.10% 4.20%±0.20% 1.95%±0.06% P值 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 -
[1] YANG L, ZHANG Y L, KANG S C, et al. Microplastics in soil: A review on methods, occurrence, sources, and potential risk[J]. Science of the Total Environment, 2021, 780: 146546. doi: 10.1016/j.scitotenv.2021.146546 [2] 黄艺, 贾薇茜, 李康, 等. 土壤微塑料与微生物的相互作用关系[J]. 环境科学学报, 2022, 42(4): 64-74. HUANG Y, JIA W Q, LI K, et al. Interaction between soil microplastics and microorganisms[J]. Acta Scientiae Circumstantiae, 2022, 42(4): 64-74 (in Chinese).
[3] THOMPSON R C, OLSEN Y, MITCHELL R P, et al. Lost at sea: Where is all the plastic?[J]. Science, 2004, 304(5672): 838. doi: 10.1126/science.1094559 [4] 文晓凤, 尹令实, 蒋昌波, 等. 典型城市湖泊岳阳南湖表层水体中的微塑料污染特征[J]. 环境化学, 2022, 41(11): 3579-3588. doi: 10.7524/j.issn.0254-6108.2021071404 WEN X F, YIN L S, JIANG C B, et al. Microplastics in surface water of a typical urban lake: A case study from Nanhu Lake, Yueyang City[J]. Environmental Chemistry, 2022, 41(11): 3579-3588 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021071404
[5] 韦婧, 涂晨, 杨杰, 等. 微塑料对农田土壤理化性质、土壤微生物群落结构与功能的影响[J]. 生态与农村环境学报, 2023, 39(5): 644-652. WEI J, TU C, YANG J, et al. Impact of microplastics on the physicochemical properties, microbial community structure, and functions of farmland soils[J]. Journal of Ecology and Rural Environment, 2023, 39(5): 644-652 (in Chinese).
[6] NAPPER I E, DAVIES B F R, CLIFFORD H, et al. Reaching new heights in plastic pollution—Preliminary findings of microplastics on mount Everest[J]. One Earth, 2020, 3(5): 621-630. doi: 10.1016/j.oneear.2020.10.020 [7] 周雨柔, 姚娜, 胡超, 等. 亚热带浅水型内湖水体与沉积物微塑料分布特征及来源: 以大明湖为例[J]. 环境化学, 2025, 44(3), DOI:10.7524/j.issn.0254-6108.2023100702. ZHOU Y R, YAO N, HU C, et al. Distribution characteristics and sources of microplastics in water and sediment of subtropical shallow inner lake: A case study of Daming Lake[J]. Environmental Chemistry, 2025, 44(3), DOI:10.7524/j.issn.0254-6108.2023100702(in Chinese).
[8] JAMIESON A J, BROOKS L S R, REID W D K, et al. Microplastics and synthetic particles ingested by deep-sea amphipods in six of the deepest marine ecosystems on Earth[J]. Royal Society Open Science, 2019, 6(2): 180667. doi: 10.1098/rsos.180667 [9] 耿凤. 微塑料在全球水体及沉积物中的分布及污染特征[D]. 哈尔滨: 哈尔滨工业大学, 2020. GENG F. Distribution and Characteristics of Microplastics in Global Water and Sediments[D]. Harbin: Harbin Institute of Technology, 2020 (in Chinese).
[10] BORRELLE S B, RINGMA J, LAW K L, et al. Predicted growth in plastic waste exceeds efforts to mitigate plastic pollution[J]. Science, 2020, 369(6510): 1515-1518. doi: 10.1126/science.aba3656 [11] LESLIE H A, van VELZEN M J M, BRANDSMA S H, et al. Discovery and quantification of plastic particle pollution in human blood[J]. Environment International, 2022, 163: 107199. doi: 10.1016/j.envint.2022.107199 [12] JENNER L C, ROTCHELL J M, BENNETT R T, et al. Detection of microplastics in human lung tissue using μFTIR spectroscopy[J]. Science of the Total Environment, 2022, 831: 154907. doi: 10.1016/j.scitotenv.2022.154907 [13] 付东东, 张琼洁, 范正权, 等. 微米级聚苯乙烯对铜的吸附特性[J]. 中国环境科学, 2019, 39(11): 4769-4775. doi: 10.3969/j.issn.1000-6923.2019.11.036 FU D D, ZHANG Q J, FAN Z Q, et al. Adsorption characteristics of copper ions on polystyrene microplastics[J]. China Environmental Science, 2019, 39(11): 4769-4775 (in Chinese). doi: 10.3969/j.issn.1000-6923.2019.11.036
[14] AHMAD M, LI J L, WANG P D, et al. Environmental perspectives of microplastic pollution in the aquatic environment: A review[J]. Marine Life Science & Technology, 2020, 2(4): 414-430. [15] BAKIR A, ROWLAND S J, THOMPSON R C. Transport of persistent organic pollutants by microplastics in estuarine conditions[J]. Estuarine, Coastal and Shelf Science, 2014, 140: 14-21. doi: 10.1016/j.ecss.2014.01.004 [16] 韩冰, 李华南, 王梓静, 等. 微塑料和多种抗生素胁迫下土壤环境因子的响应特性[J]. 环境化学, 2024, 43(2): 506-514. doi: 10.7524/j.issn.0254-6108.2022072101 HAN B, LI H N, WANG Z J, et al. Response characteristics of soil environmental factors under the stress of microplastics and antibiotics[J]. Environmental Chemistry, 2024, 43(2): 506-514 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022072101
[17] 李道季, 董旭日. 海洋环境中的微塑料及其附着生物研究进展[J]. 华东师范大学学报(自然科学版), 2022(3): 1-7. LI D J, DONG X R. Research progress of microplastics and attached organisms in marine environment[J]. Journal of East China Normal University (Natural Science), 2022(3): 1-7 (in Chinese).
[18] GREGORY M R. Environmental implications of plastic debris in marine settings: Entanglement, ingestion, smothering, hangers-on, hitch-hiking and alien invasions[J]. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 2009, 364(1526): 2013-2025. doi: 10.1098/rstb.2008.0265 [19] 文开, 柳金涛, 王欢, 等. 微塑料污染对海水微生物群落特征的影响[J]. 环境科学与技术, 2022, 45(5): 60-69. WEN K, LIU J T, WANG H, et al. Effects of microplastics pollution on seawater microbial flora[J]. Environmental Science & Technology, 2022, 45(5): 60-69 (in Chinese).
[20] 刘淑丽, 胡启武, 杨慧林, 等. 鄱阳湖南矶山湿地微塑料表面微生物分布特征[J]. 环境科学学报, 2022, 42(6): 206-214. LIU S L, HU Q W, YANG H L, et al. Distribution characteristics of microorganisms on microplastic surface in Nanjishan wetland of Poyang Lake[J]. Acta Scientiae Circumstantiae, 2022, 42(6): 206-214 (in Chinese).
[21] 骆永明, 施华宏, 涂晨, 等. 环境中微塑料研究进展与展望[J]. 科学通报, 2021, 66(13): 1547-1562. doi: 10.1360/TB-2020-0979 LUO Y M, SHI H H, TU C, et al. Research progresses and prospects of microplastics in the environment[J]. Chinese Science Bulletin, 2021, 66(13): 1547-1562 (in Chinese). doi: 10.1360/TB-2020-0979
[22] 郭佳宝, 黄艺. 水体微塑料表面生物膜特征及影响因素[J]. 环境科学与技术, 2023, 46(6): 221-227. GUOJIA B, HUANG Y. Characteristics and influencing factors of biofilm on the surface of water microplastics[J]. Environmental Science & Technology, 2023, 46(6): 221-227 (in Chinese).
[23] WU X J, PAN J, LI M, et al. Selective enrichment of bacterial pathogens by microplastic biofilm[J]. Water Research, 2019, 165: 114979. doi: 10.1016/j.watres.2019.114979 [24] ZETTLER E R, MINCER T J, AMARAL-ZETTLER L A. Life in the “plastisphere” : Microbial communities on plastic marine debris[J]. Environmental Science & Technology, 2013, 47(13): 7137-7146. [25] Di PIPPO F, VENEZIA C, SIGHICELLI M, et al. Microplastic-associated biofilms in lentic Italian ecosystems[J]. Water Research, 2020, 187: 116429. doi: 10.1016/j.watres.2020.116429 [26] SUN X M, CHEN B J, XIA B, et al. Impact of mariculture-derived microplastics on bacterial biofilm formation and their potential threat to mariculture: A case in situ study on the Sungo Bay, China[J]. Environmental Pollution, 2020, 262: 114336. doi: 10.1016/j.envpol.2020.114336 [27] 章宇晴, 李大圳, 付茜茜, 等. 水环境中微塑料表面细菌群落特征研究进展[J]. 生态毒理学报, 2022, 17(1): 116-128. ZHANG Y Q, LI D Z, FU Q Q, et al. Review on bacterial community characteristics on microplastics surfaces in aquatic environment[J]. Asian Journal of Ecotoxicology, 2022, 17(1): 116-128 (in Chinese).
[28] MIAO L Z, YU Y, ADYEL T M, et al. Distinct microbial metabolic activities of biofilms colonizing microplastics in three freshwater ecosystems[J]. Journal of Hazardous Materials, 2021, 403: 123577. doi: 10.1016/j.jhazmat.2020.123577 [29] CHEN X C, XIONG X, JIANG X M, et al. Sinking of floating plastic debris caused by biofilm development in a freshwater lake[J]. Chemosphere, 2019, 222: 856-864. doi: 10.1016/j.chemosphere.2019.02.015 [30] OGONOWSKI M, MOTIEI A, ININBERGS K, et al. Evidence for selective bacterial community structuring on microplastics[J]. Environmental Microbiology, 2018, 20(8): 2796-2808. doi: 10.1111/1462-2920.14120 [31] YU W C, LI J H, MA X W, et al. Community structure and function of epiphytic bacteria attached to three submerged macrophytes[J]. Science of the Total Environment, 2022, 835: 155546. doi: 10.1016/j.scitotenv.2022.155546 [32] 李汶璐, 王志超, 杨文焕, 等. 微塑料对沉积物细菌群落组成和多样性的影响[J]. 环境科学, 2022, 43(5): 2606-2613. LI W L, WANG Z C, YANG W H, et al. Effects of microplastics on bacterial community composition and diversity in sediments[J]. Environmental Science, 2022, 43(5): 2606-2613 (in Chinese).
[33] GUO S Z, ZHANG S H, WANG S P, et al. Potamogeton crispus restoration increased the epiphytic microbial diversity and improved water quality in a micro-polluted urban river[J]. Environmental Pollution, 2023, 326: 121485. doi: 10.1016/j.envpol.2023.121485 [34] LI Q, HU Y P, KOU D H, et al. Factors impacting microplastic biofilm community and biological risks posed by microplastics in drinking water sources[J]. Water, Air, & Soil Pollution, 2022, 233(6): 179. [35] PERKINS T L, CLEMENTS K, BAAS J H, et al. Sediment composition influences spatial variation in the abundance of human pathogen indicator bacteria within an estuarine environment[J]. PLoS One, 2014, 9(11): e112951. doi: 10.1371/journal.pone.0112951 [36] SUN Y, LI X, LIU J J, et al. Comparative analysis of bacterial community compositions between sediment and water in different types of wetlands of Northeast China[J]. Journal of Soils and Sediments, 2019, 19(7): 3083-3097. doi: 10.1007/s11368-019-02301-x [37] 彭柯, 董志, 邸琰茗, 等. 基于16S rRNA高通量测序的北运河水体及沉积物微生物群落组成对比分析[J]. 环境科学, 2021, 42(11): 5424-5432. PENG K, DONG Z, DI Y M, et al. Contrasting analysis of microbial community composition in the water and sediments of the north canal based on 16S rRNA high-throughput sequencing[J]. Environmental Science, 2021, 42(11): 5424-5432 (in Chinese).
[38] 陈玉芳, 闫振华, 张燕, 等. 城市水体微塑料垂向分布下附着细菌群落结构和功能响应[J]. 环境科学, 2022, 43(6): 3088-3096. CHEN Y F, YAN Z H, ZHANG Y, et al. Community structure and microbial function responses of biofilms colonizing on microplastics with vertical distribution in urban water[J]. Environmental Science, 2022, 43(6): 3088-3096 (in Chinese).
[39] JIANG P L, ZHAO S Y, ZHU L X, et al. Microplastic-associated bacterial assemblages in the intertidal zone of the Yangtze Estuary[J]. Science of the Total Environment, 2018, 624: 48-54. doi: 10.1016/j.scitotenv.2017.12.105 [40] 付茜茜, 李大圳, 章宇晴, 等. 城市红树林系统中微塑料表面细菌群落结构特征分析[J]. 热带作物学报, 2021, 42(12): 3692-3698. doi: 10.3969/j.issn.1000-2561.2021.12.041 FU Q Q, LI D Z, ZHANG Y Q, et al. Microbial colonization and communities on microplastics in urban mangrove system[J]. Chinese Journal of Tropical Crops, 2021, 42(12): 3692-3698 (in Chinese). doi: 10.3969/j.issn.1000-2561.2021.12.041
[41] CAI L, WU D, XIA J H, et al. Influence of physicochemical surface properties on the adhesion of bacteria onto four types of plastics[J]. Science of the Total Environment, 2019, 671: 1101-1107. doi: 10.1016/j.scitotenv.2019.03.434 [42] 董旭日, 朱礼鑫, 徐佳奕, 等. 微塑料附着微生物研究进展[J]. 微生物学杂志, 2022, 42(2): 81-87. doi: 10.3969/j.issn.1005-7021.2022.02.011 DONG X R, ZHU L X, XU J Y, et al. Advances in microorganism attached to microplastics[J]. Journal of Microbiology, 2022, 42(2): 81-87 (in Chinese). doi: 10.3969/j.issn.1005-7021.2022.02.011
[43] 李文杰. 渤海湾海河河口不同塑料碎片表面的细菌群落特征及其环境影响因素的研究[D]. 天津: 天津大学, 2019. LI W J. Bacterial Communities on Plastic Debris, Influenced by Environmental Factors and Polymer Types in the Haihe Estuary of Bohai Bay, China[D]. Tianjin: Tianjin University, 2019 (in Chinese).
[44] BHAGWAT G, ZHU Q Y, O’CONNOR W, et al. Exploring the composition and functions of plastic microbiome using whole-genome sequencing[J]. Environmental Science & Technology, 2021, 55(8): 4899-4913. [45] SEELEY M E, SONG B, PASSIE R, et al. Microplastics affect sedimentary microbial communities and nitrogen cycling[J]. Nature Communications, 2020, 11: 2372. doi: 10.1038/s41467-020-16235-3 [46] DAI H H, GAO J F, WANG Z Q, et al. Behavior of nitrogen, phosphorus and antibiotic resistance genes under polyvinyl chloride microplastics pressures in an aerobic granular sludge system[J]. Journal of Cleaner Production, 2020, 256: 120402. doi: 10.1016/j.jclepro.2020.120402 [47] LI R L, YU L Y, CHAI M W, et al. The distribution, characteristics and ecological risks of microplastics in the mangroves of Southern China[J]. Science of the Total Environment, 2020, 708: 135025. doi: 10.1016/j.scitotenv.2019.135025 [48] YANG Y Y, LIU W Z, ZHANG Z L, et al. Microplastics provide new microbial niches in aquatic environments[J]. Applied Microbiology and Biotechnology, 2020, 104(15): 6501-6511. doi: 10.1007/s00253-020-10704-x [49] 刘淑丽, 简敏菲, 邹龙, 等. 鄱阳湖白鹤保护区微塑料表面微生物群落结构特征[J]. 环境科学, 2022, 43(3): 1447-1454. LIU S L, JIAN M F, ZOU L, et al. Microbial community structure on microplastic surface in the Grus leucogeranus reserve of Poyang Lake[J]. Environmental Science, 2022, 43(3): 1447-1454 (in Chinese).
[50] LYONS B P, COWIE W J, MAES T, et al. Marine plastic litter in the ROPME Sea Area: Current knowledge and recommendations[J]. Ecotoxicology and Environmental Safety, 2020, 187: 109839. doi: 10.1016/j.ecoenv.2019.109839 [51] CHEN X C, CHEN X F, ZHAO Y H, et al. Effects of microplastic biofilms on nutrient cycling in simulated freshwater systems[J]. Science of the Total Environment, 2020, 719: 137276. doi: 10.1016/j.scitotenv.2020.137276 [52] 李大圳, 章宇晴, 付茜茜, 等. 红树林退化对微塑料表面细菌群落特征的影响[J]. 农业环境科学学报, 2023, 42(2): 299-309. doi: 10.11654/jaes.2022-0690 LI D Z, ZHANG Y Q, FU Q Q, et al. Effects of mangrove degradation on the characteristics of bacterial communities colonizing microplastics[J]. Journal of Agro-Environment Science, 2023, 42(2): 299-309 (in Chinese). doi: 10.11654/jaes.2022-0690
[53] 杨雪琴, 连英丽, 颜庆云, 等. 滨海湿地生态系统微生物驱动的氮循环研究进展[J]. 微生物学报, 2018, 58(4): 633-648. YANG X Q, LIAN Y L, YAN Q Y, et al. Microbially-driven nitrogen cycling in coastal ecosystems[J]. Acta Microbiologica Sinica, 2018, 58(4): 633-648 (in Chinese).
-



 下载:
下载: