-
邻苯二甲酸酯(Phthalate esters, PAEs)作为塑化剂广泛应用于电子电器、化妆品和个人护理品、儿童玩具、食品包装材料和医疗器械等产品,以增加产品的延展性和可塑性[1 − 4]. 自20世纪20年代以来,全球PAEs产量已高达每年1.5亿t,消耗量为每年600×104 — 800×104 t [5];主要包括邻苯二甲酸二甲酯 (dimethyl phthalate,DMP)、邻苯二甲酸二乙酯 (diethyl phthalate, DEP)、邻苯二甲酸二正丁酯 (di-n-butyl phthalate,DNBP) 、邻苯二甲酸二异丁酯 (di-iso-butyl phthalate,DIBP)、邻苯二甲酸二(2-乙基)己酯 (di(2-ethylhexyl) phthalate,DEHP)、邻苯二甲酸二正辛酯 (di-n-octyl phthalate,DOP)和邻苯二甲酸二壬酯 (dinonyl phthalate,DNP) 等.
毒理学及流行病学研究表明,部分PAEs具有潜在神经毒性、生殖毒性、内分泌干扰作用和致癌效应等,能引发哮喘等一系列不良健康效应[6-7]. 因此,许多国家和地区相继出台了一系列制度法规,逐渐限制部分PAEs在产品中的使用[2, 8]. 工业界也积极开发多种新型产品作为替代类塑化剂(alternative plasticizers,APs)投入市场;如环己烷-1,2-二羧酸二异壬酯(di(isononyl)cyclohexane-1,2-dicarboxylate, DINCH)、对苯二甲酸二(2-乙基己基)酯(di(2- ethylhexyl) terenhthalate, DEHT)、己二酸二(2-乙基己基)酯(di-2-ethylhexyl adipate, DEHA)、邻苯二甲酸二(2-丙基庚基)酯(di (2-propylheptyl) phthalate, DPrHP)等作为PAEs替代品广泛应用于塑料产品中[8]. 目前关于APs的毒理学数据较为有限,但有研究表明DINCH、DEHT和DEHA等具有潜在生殖毒性、神经毒性、基因毒性和内分泌干扰效应[9 − 13].
PAEs和APs通常直接添加到产品中,而非与产品形成化学键,在产品生产、使用以及废弃处理过程中极易释放到环境中. 目前,PAEs以及DINCH、DEHT和DEHA等APs在室内灰尘和空气[14 − 16]、大气[17 − 18]、水体[19]、沉积物[20 − 21]以及生物体[22 − 23]中均有广泛检出. 环境中的PAEs和APs可通过饮食摄入、灰尘摄入、空气吸入和皮肤吸收等不同途径进入人体,对人体健康造成潜在危害[8]. 生物体内各种酶介导的代谢转化是促进化合物排出体外,降低其毒性的重要过程,但该过程也可能将化合物转化生成生物活性和毒性更强的代谢物[24]. PAEs在体内通常水解成邻苯二甲酸单酯,高分子量PAEs还可以进一步羟基化、氧化生成次级代谢物;APs也可经氧化反应,形成初级和次级产物,经尿液排出体外. 因此,尿液中DMP、DEP、DNBP、DIBP、DEHP、DOP和DNP等PAEs以及DINCH、DEHT、DEHA和DPrHP 等APs的代谢物(Metabolites of PAEs and APs, mPAEs和mAPs)可作为其人体暴露评估的良好生物标志物. 目前,已有较多研究报道了不同国家和地区人群尿液中mPAEs的暴露水平[25 − 28],但关于mAPs的暴露研究仍十分有限,且尚缺乏针对尿液中mPAEs和mAPs同步检测分析的研究方法.
本研究选择典型mPAEs和mAPs作为目标化合物,通过优化仪器参数和尿液样品前处理流程,建立基于固相萃取和高效液相色谱-三重四极杆串联质谱(HPLC-MS/MS)同步分析尿液中11种广泛报道的mPAEs,以及DINCH、DEHT、DEHA和DPrHP对应的7种mAPs的方法,并验证方法的可行性. 将该方法应用于广州市30名普通人群尿液样品中mPAEs和mAPs的浓度水平分析,证实方法的适用性,并为评估PAEs和APs的人体暴露评估提供技术支持.
-
Agilent
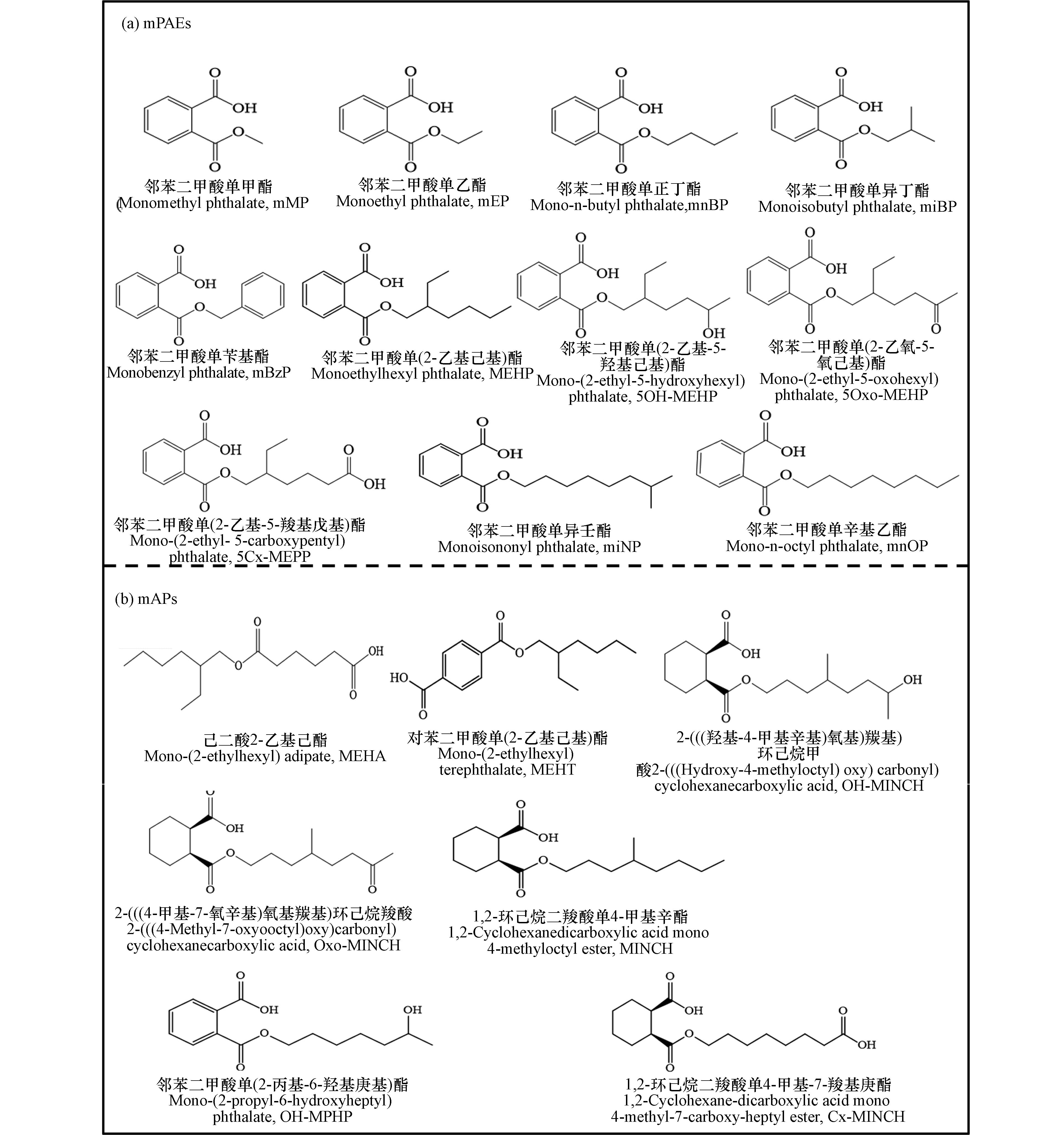
1260 液相色谱仪(Agilent,美国),AB SCIEX API4000 三重四极杆串联质谱仪 (Applied Biosystems,美国),Kinetex Biphenyl (2.1 mm×100 mm,2.6 μm) 色谱柱(Phenomenex,美国),Poroshell 120 EC-C18 色谱柱 (4.6 mm× 50 mm,2.7 μm) (Agilent,美国),水浴锅 (智诚分析仪器制造,中国),离心机 (Eppendorf,德国),Milli-Q超纯水系统 (Merck,德国),涡旋振荡器 (Scientific Industries,美国),WZB手持式数显折光仪 (上海仪电物理光学仪器,中国).8种mPAE标准品 (mMP、 mEP、mnBP、miBP、mBzP、mnOP、miNP、MEHP) 购自美国AccuStandard公司,3种mPAE标准品 (5OH-MEHP、5Oxo-MEHP、5Cx-MEPP) 和7种mAPs标准品 (MEHA、MEHT、OH-MPHP、MINCH、OH-MINCH、Cx-MINCH、Oxo-MINCH) 购自加拿大Toronto Research Chemicals公司;7种mPAE氘同位素或碳同位素标记标准品(mnOP-d4、mEP-13C4、mnBP-13C4、mBzP-13C4、MEHP-13C4、5OH-MEHP-13C4、5Oxo-MEHP-13C4)和3种mAP氘代同位素标记标准品 (Oxo-MINCH-d8、OH-MINCH-d8、OH-MPHP-d4) 均购自加拿大Toronto Research Chemicals公司. 各化合物基本信息详见表1,化学结构式见图1.
试剂:色谱纯甲酸、二氯甲烷、正己烷、甲醇和乙腈 (上海安谱实验科技,中国),β-葡萄糖醛酸苷酶/芳基硫酸酯酶 (Merck,德国).
其他材料:Oasis HLB固相萃取柱(3 mL, 60 mg;Waters,美国),1.5 mL聚丙烯离心管(广州洁特生物过滤,中国),0.22 μm亲水PTFE 针式滤器(天津津腾实验设备,中国),1 mL一次性使用无菌注射器(湖南平安医械科技,中国),2 mL白色透明进样瓶 (Agilent,美国).
-
2022年6月,于广州市征集30名普通居民志愿者,年龄介于22—36岁. 所有志愿者均在了解本研究的目的和内容后签署知情同意书. 使用聚丙烯尿液杯收集新鲜尿液,并立即倒入50 mL棕色玻璃瓶中,样品量约为30—50 mL;样品均为晨尿、中段尿. 尿液样品由采样人员编号,记录采样时间和日期后,置于冷冻运输箱,运输至实验室−80℃的超低温冰箱保存,待检测分析.
随机采取10 例志愿者尿液,每例取10 mL 进行混合,形成的混合尿液基质用于分析方法优化.
-
尿样样品置于4℃冰箱解冻,充分混匀后,准确取2 mL样品于干净玻璃离心管. 样品中加入20 µL mPAEs和mAPs内标混合溶液(各5 ng),1 mL磷酸盐缓冲液(1 mol·L−1, pH=6),25 µL β-葡萄糖醛酸苷酶/芳基硫酸酯酶,充分混匀,37℃避光酶解2 h. 酶解后的尿液样品采用Oasis HLB 固相萃取(SPE)柱富集和净化;SPE柱预先用3 mL DCM、3 mL MeOH和3 mL 超纯水依次活化. 随后,将尿液样品转移至SPE柱,使样品分散并充分吸附于填料表面;上样完成后,用3 mL含5% MeOH的超纯水淋洗SPE柱,并抽真空干燥1 h. 以6 mL MeOH洗脱目标化合物,洗脱液经温和氮气浓缩至近干,加入200 µL MeOH∶超纯水(1∶1,V/V)复溶,混匀后,转移至棕色玻璃进样瓶,−20 ℃保存,待仪器分析.
-
采用HPLC-MS/MS对mPAEs和mAPs进行检测分析,使用Kinetex Biphenyl (2.1 mm×100 mm,2.6 μm) 色谱柱分离目标化合物. 流速300 μL·min−1,进样量为5 μL,色谱柱温40℃. 以甲醇 (A) 和0.1%甲酸-超纯水溶液 (B) 作为流动相,梯度洗脱程序为:0—12 min,15%—45% A;12—15 min,45% A;15—19 min,45%—98% A;19—21 min,98% A;21—21.1 min,98%—15% A;21.1—25 min,15% A. 离子源为电喷雾电离负离子模式(ESI-),离子喷雾电压为
4500 V,干燥气体(N2)温度为350 ℃,气体流量为10 mL·min−1,输入电压为−10 V,碰撞池输出电压−5 V. 质谱扫描方式为多反应监测模式 (MRM). 目标化合物保留时间和谱分析参数详见表2. -
实验过程中所使用的玻璃器材均预先用碱液(pH>11)浸泡6 h,依次用自来水、超纯水冲洗,烘干后用于马弗炉中400℃的焙烧4 h;冷却后,依次用二氯甲烷和正己烷润洗、风干备用. 采用内标法定量,设置流程空白样品(n= 3),以监测实验室背景污染;样品中检测的目标化合物浓度均扣除程序空白样品中的浓度,以校正分析结果.
-
由于个体尿量的差异可导致待测物浓度的波动,本研究通过WZB手持式数显折光仪检测尿比重 (Specific gravity,SG),对实际检测的尿液样品中mPAEs和mAPs浓度进行校正. 超纯水校正仪器后,取300 μL解冻后的尿液滴至检测液池,待结果稳定后读数记录. 使用如下校正公式对代谢物浓度进行校正 [25]:
式 (1) 中,Pc为尿中代谢物校正后浓度 ( ng·mL−1),P为尿液中代谢物原始浓度(ng·mL−1);SG为实测的各个尿液 SG 值,SGm为SG分布的中位数.
-
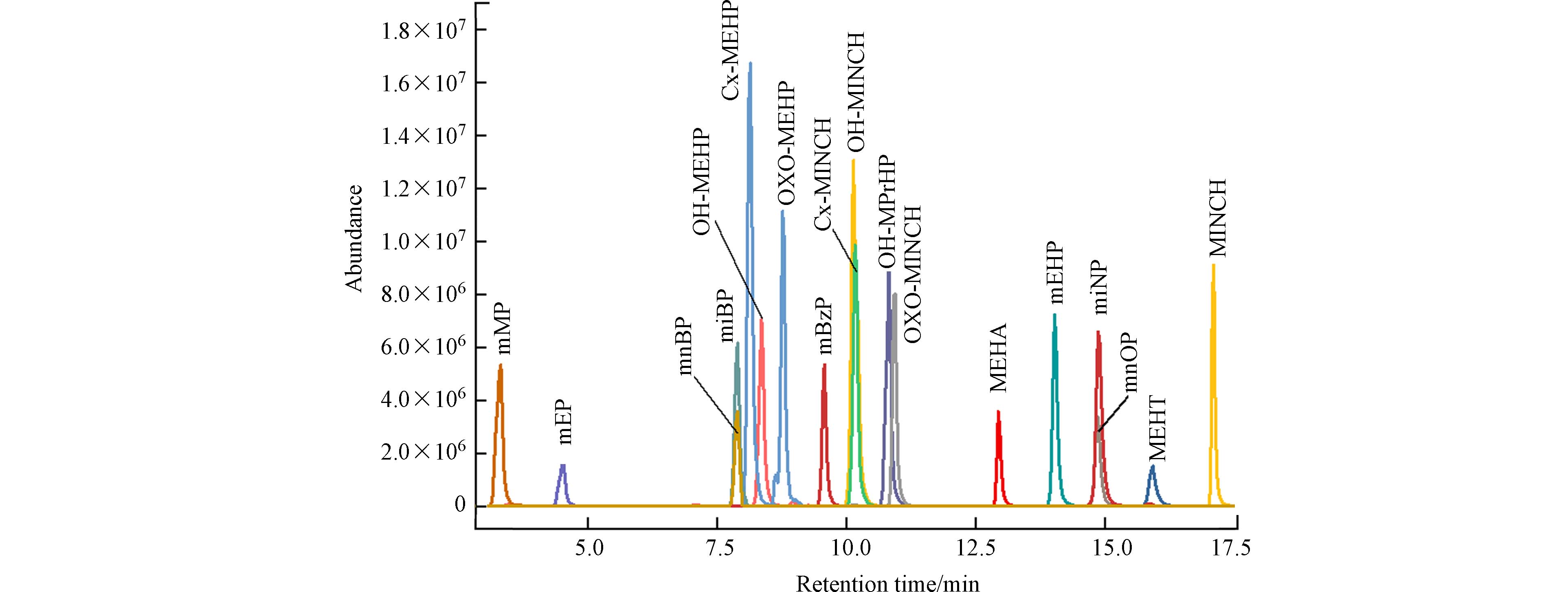
将目标化合物进HPLC-MS/MS分析,优化mPAEs和mAPs初级离子和次级离子对、去簇电压和碰撞能等质谱参数,结果如表2示. 参考文献报道中mPAEs的色谱分析方法[25 − 26],分别采用甲醇和乙腈,以及超纯水和0.1%甲酸-超纯水作为流动相,选用Kinetex Biphenyl (100 mm× 2.1 mm, 2.6 μm)、Luna C18 (150 mm× 2 mm, 3 μm)和Poroshell 120 EC-C18 (4.6 mm× 50 mm,2.7 μm)等液相色谱柱,比较不同色谱柱和流动相条件下目标化合物的分离效果. 结果表明,采用甲醇(A)和0.1%甲酸-超纯水(B)为流动相,Kinetex Biphenyl(100 mm× 2.1 mm, 2.6 μm)色谱柱时,目标化合物的分离效果最佳;优化后的化合物色谱图如图2所示
-
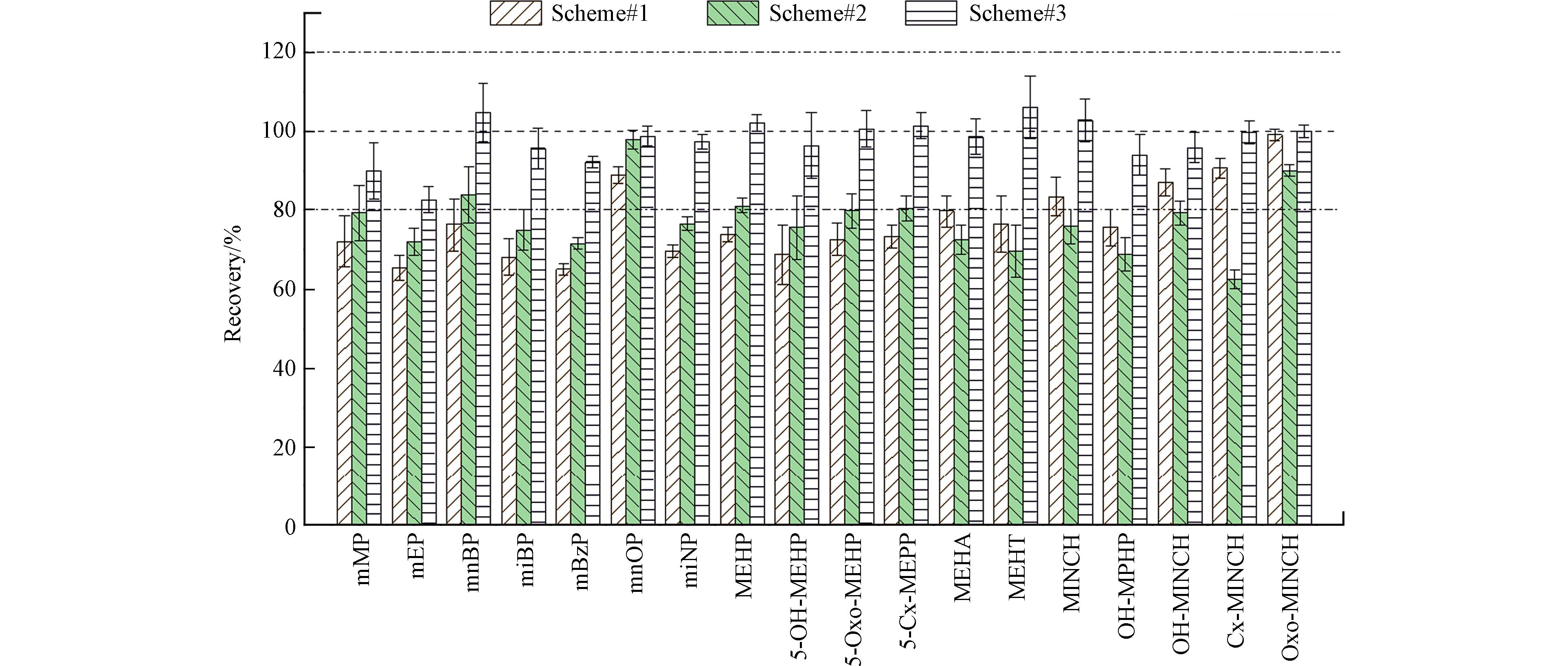
HLB是一种亲水-亲脂平衡的可浸润性反相吸附剂,具有较宽的pH适用范围,对酸性、碱性和中性化合物均具有较好的效果,并广泛应用于尿液中mPAEs的分析[27];因此,本研究选择Oasis HLB固相萃取柱(3 mL, 60 mg)用于尿液样品净化. 将mPAEs和mAPs目标物(10 ng)及内标(5 ng)添加于2 mL超纯水,经HLB柱富集后,对比3组不同清洗溶剂和洗脱溶剂的处理效果,每组设置3个平行样品. 方案#1采用3 mL 5%甲酸-超纯水清洗HLB柱,9 mL 5%甲酸-MeOH洗脱. 方案#2采用3 mL 5% MeOH-超纯水清洗HLB柱,9 mL 5%甲酸-MeOH洗脱;方案#3采用3 mL 5% MeOH-超纯水清洗HLB柱,9 mL MeOH洗脱(表3). 3种洗脱方案目标化合物的平均回收率分别为64.9%—90.8%,62.5%—92.2%和82.7%—106%(图3);总体而言,方案#3的目标化合物回收率最高,故选择其作为后续前处理方案.
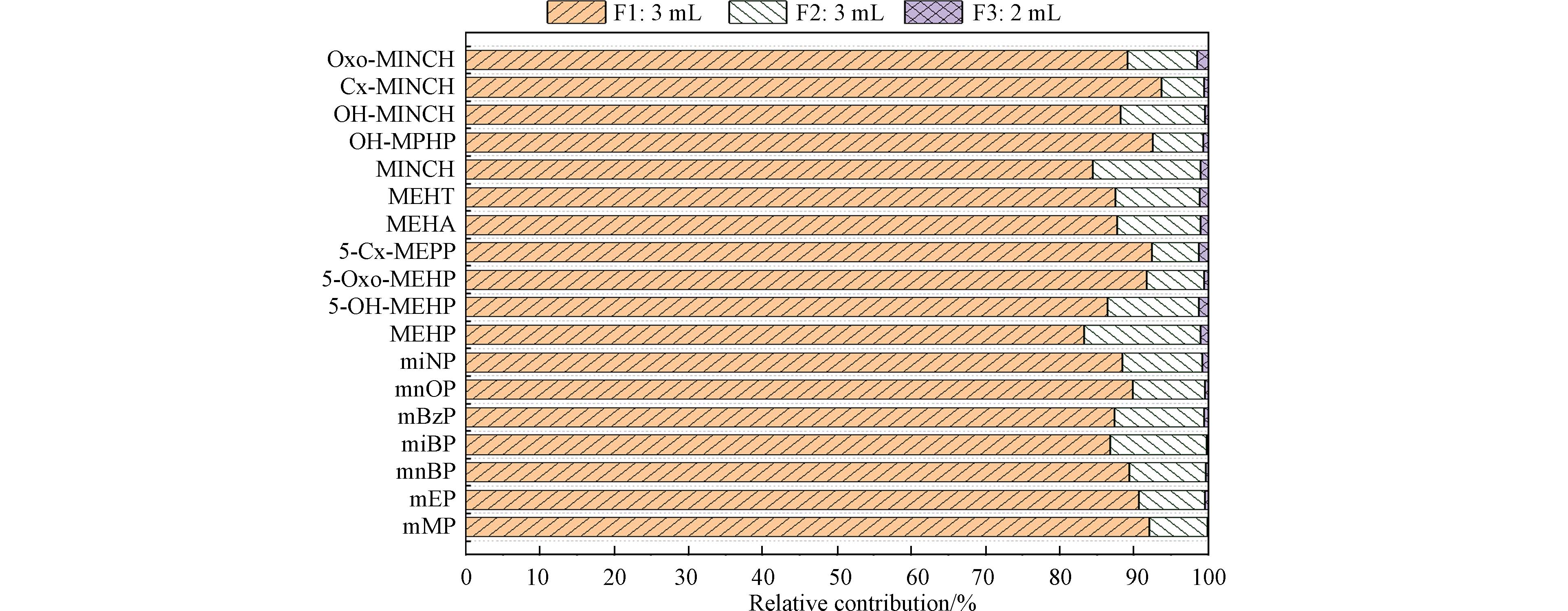
在确定最佳清洗溶剂和洗脱溶剂的基础上,进一步优化洗脱溶剂的体积. mPAEs和mAPs目标物(10 ng)及内标经HLB柱富集、3 mL 5% MeOH-超纯水清洗后,依次采用3 mL(F1)、3 mL(F2)和2 mL(F3)MeOH洗脱目标化合物. 如图4所示,F1组分洗脱后,除MEHP和MINCH外,其余化合物回收率均高于85%;F2组分洗脱后,mPAEs和mAPs的回收率均高于98%. 因此,洗脱次数最终设定为2 次,优化的洗脱液(MeOH)体积为6 mL.
-
使用甲醇将mPAEs和mAPs标准品稀释,分别配制mPAEs和mAPs混合标准溶液;将混合液依次稀释成9个系列浓度(分别为0.50、1.0、2.0、5.0、10.0、20.0、50.0、100.0、200.0 ng·mL−1),并加入对应的同位素标记混合液作为定量内标;内标浓度均为100.0 ng·mL−1. 将配制的标准曲线在仪器最佳条件下进行检测分析,以目标化合物物与对应内标的峰面积比值Y,对其体积分数X进行回归分析. mPAEs和mAPs各目标化合物在对应浓度范围内均呈良好的线性关系,相关系数(correlation coefficient, R)均≥0.995(表4).
-
参考文献报道的方法[28],方法检出限(Limits of detection,LOD)根据最低浓度标准曲线点相应化合物的3倍信噪比进行计算;目标物化合物的定量限(Limits of quantification,LOQ)为流程空白样品中的平均浓度加3倍标准差;若流程空白中未检出目标化合物,则记其LOQ为10倍信噪比(S/N)时的浓度(用标准曲线最低浓度进行实验). mPAEs和mAPs的LODs分别为0.02—0.72 ng·mL−1和0.01—0.11 ng·mL−1,LOQs分别为0.05—1.89 ng·mL−1和0.03—0.33 ng·mL−1(表4).
-
分析方法的准确度(Accuracy)通过尿液基质加标样品中目标化合物的回收率加以评估,即加标样品中各分析物的检测值(通过程序和基质空白样品中的含量进行校正)与实际加标量的百分比. 分析方法的精度定义为可重复条件下平行样品的相对标准偏差(Relative standard deviations,RSD). 使用同一标曲点每日重复测定3次且连续测定3 d获得的日内/间精密度评价方法的稳定性.
随机选取10例志愿者尿液,每例取10 mL形成混合尿液基质;采用混合尿液基质进行加标基质样品前处理,加标浓度分别为10 ng·mL−1(低加标组)和50 ng·mL−1(高加标组);每个加标浓度进行6次重复实验;同时,分别采用超纯水和混合尿液作为基质,设置6个流程空白样品和6个基质空白样品.
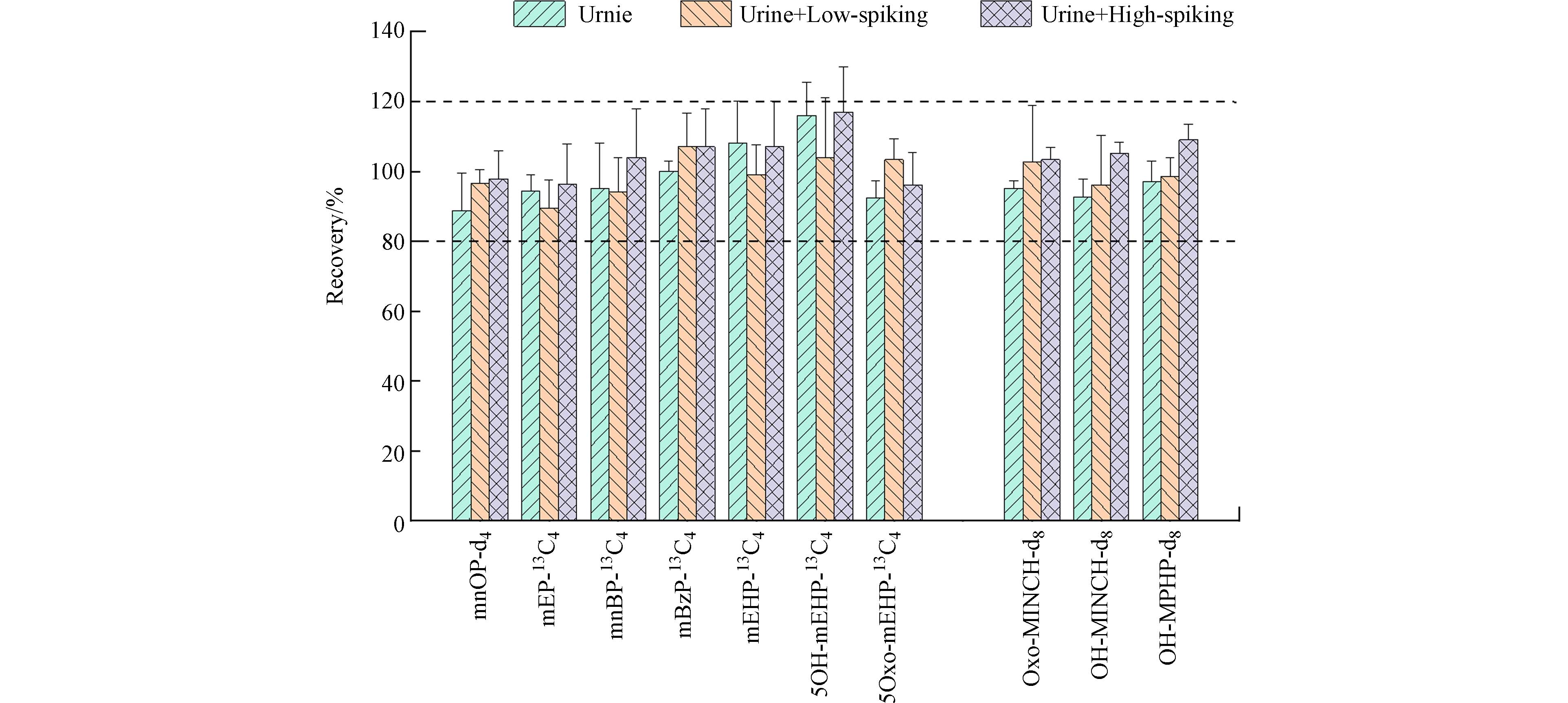
结果显示,基质低浓度加标组和高加标组中PAEs和mAPs目标化合物均具有良好的准确度和精密度(表4). 基质低浓度加标样品中mPAEs和mAPs的准确度和精密度分别为83.7%—108% (RSD <16%)和109%—120% (RSD≤12%);高浓度加标样品中相应的准确度和精密度分别为93.8%—115% (RSD<11%) 和106%—129%(RSD <10%). 混合尿液基质和加标基质样品中mPAEs和mAPs内标回收率分别为(88.7% ± 10.9%)至(116% ± 9.5%),及(92.6% ± 5.4% )至(109% ± 4.5% )(图5).
尿液等复杂生物基质的基质效应可能对目标化合物分析的准确度和精密度具有重要影响[29]. 本研究进一步通过检测分析混合尿液基质加标与溶剂标样以计算目标化合物的基质效应:
式中,ME为基质效应,%;A1为混合基质加标后目标物的响应峰面积;A0为混合基质中目标物的响应峰面积;A2为溶剂标样中目标物的响应峰面积. ME<0,表示有基质抑制效应;ME>0,表示有基质促进效应;ME=0,表示无基质效应. 结果表明,mPAEs和mAPs的基质效应分别为−16%—−4.3%和−18%—−5.4%(表3),基质效应对目标化合物分析的影响较小.
本研究汇总了近期文献报道中采用HPLC-MS/MS分析尿液中mPAEs和/或mAPs的方法,如表5所示. 与文献报道的方法相比,本研究建立的分析方法具有相对较低的检出限及较好的回收率,且首次实现了同步分析尿液中的mPAEs和mAPs,能够有效地提高分析效率、减少工作量;在针对两类化合物的人群暴露评估研究中具有较好的应用价值.
-
将本研究建立的方法应用于分析广州市30名普通人群尿液中mPAEs和mAPs;经SG校正后的志愿者尿液中mPAEs和mAPs浓度如表5所示. 除miNP和mnOP外,其余16种目标化合物均有不同程度的检出;其中,mPAEs和 mAPs的检出率分别为78%—100%和50%—100%,MINCH(63%)和OH-MPrHP(50%)的检出率相对较低(表5). 广州人群尿液中mPAEs和mAPs各化合物的几何均数浓度范围分别为0.54—28.4 ng·mL−1和0.37—4.09 ng·mL−1;Σ9mPAEs和Σ7mAPs的浓度范围分别为31.5—757 ng·mL−1和1.26—39.6 ng·mL−1,Σ9mPAEs的浓度均显著高于Σ7mAPs(P < 0.05).
本研究人群尿液中mPAEs以mnBP(中值21.2 ng mL−1)和miBP(中值14.4 ng mL−1)为主;其次,mEP、mMP、mEHP、5OH-MEHP和5Oxo-MEHP亦有相对较高浓度的检出(表5),需要关注其母体化合物DIBP、DNBP、DEP、DMP和DEHP暴露对人体健康的潜在影响. 对于mAPs,广州人群尿液中以MEHT为主,浓度为ND(未检出)—28.2 ng·mL−1(中值7.38 ng·mL−1);其次为MEHA,浓度为0.14—3.83 ng·mL−1;MINCH、OH-MINCH、OXO-MINCH、Cx-MINCH和OH-MPrHP的浓度相对较低(表6). 以上结果表明,本研究建立的方法可有效应用于尿液中mPAEs和mAPs的检测分析.
-
本研究通过优化仪器分析参数及样品前处理条件,建立了基于HLB固相萃取和HPLC-MS/MS同步分析尿液中11种mPAEs和7种mAPs的方法. 验证结果显示,mPAEs和mAPs的LOQs分别为0.05—1.89 ng mL−1和0.03—0.33 ng mL−1,准确度分别介于83.7%—115%和106%—129%,相对标准偏差(RSD)均小于20%,基质效应分别为-16%—-4.3%和-18%—-5.4 %. 采用该方法对30例广州市普通居民尿液样本进行分析. 结果显示,尿液中共检出16种目标化合物,包括9种mPAEs和7种mAPs,检出率分别为78%—100%和50%—100%. Σ9mPAEs和Σ7mAPs的浓度范围分别为31.5—757 ng·mL−1和1.26—39.6 ng·mL−1,Σ9mPAEs的浓度均显著高于Σ7mAPs. 本研究建立的方法具有回收率和精密度高、生物基质干扰小,且能同时有效检测尿液中mPAEs及mAPs,可满足人体尿液两类目标化合物的分析需求,为PAEs和APs人体暴露及健康风险评估研究提供技术支持.
尿液中邻苯二甲酸酯和替代型塑化剂代谢物同步分析方法的建立
Development and validation of an HPLC-MS/MS method for the simultaneous analysis of phthalate ester and alternative plasticizer metabolites in human urine
-
摘要: 随着邻苯二甲酸酯(PAEs)因其毒性效应而逐步禁用或限用,替代型塑化剂(APs)日益广泛应用于工业生产和日常生活产品中. 尿液中PAEs代谢物(mPAEs)和APs代谢物(mAPs)可作为其人体暴露评估的良好生物标志物. 然而,目前关于mAPs的暴露研究仍十分有限,且尚缺乏针对尿液中mPAEs和mAPs同步检测分析的研究方法. 因此,本研究通过优化仪器分析参数及样品前处理条件,建立并验证了基于固相萃取和高效液相色谱-三重四极杆串联质谱(HPLC-MS/MS)同步分析尿液中11种mPAEs和7种mAPs的方法. 结果显示,mPAEs和mAPs校正曲线的线性关系良好,相关性系数大于0.995;尿液中mPAEs和mAPs的定量限分别为0.05—1.89 ng·mL−1和0.03—0.33 ng·mL−1,加标回收率(方法准确度)分别介于83.7%—115%和106%—129%之间,相对标准偏差(方法精密度)均小于20%,基质效应分别为−16%—−4.3%和−18%—−5.4%. 采用该方法对30例广州市普通居民尿液样本进行分析发现,尿液中共检出16种目标化合物,包括9种mPAEs和7种mAPs,检出率分别为78%—100%和50%—100%. Σ9mPAEs的浓度范围为31.5—757 ng·mL−1,以邻苯二甲酸单正丁酯(mnBP)、邻苯二甲酸单异丁酯(miBP)为主;Σ7mAPs的浓度范围为1.26—39.6 ng·mL−1,对苯二甲酸单(2-乙基己基)酯(MEHT)和己二酸2-乙基己酯(MEHA)为主要化合物. 结果表明,该方法具有回收率和精密度高、生物基质干扰小,可满足同步分析人体尿液中mPAEs及mAPs的需求.Abstract: As phthalate esters (PAEs) are gradually banned or limited in their production and application due to their toxic effects, alternative plasticizers (APs) are increasingly used in industrial production and daily life products. Metabolites of PAEs (mPAEs) and APs (mAPs) in urine can be used as proper biomarkers for human exposure assessment. However, studies on mAPs are scarce thus far, and there is still a lack of an analytical method for the simultaneous determination of mPAEs and mAPs in human urine. Therefore, in this study, a method for simultaneous analysis of 11 mPAEs and 7 mAPs in human urine based on solid phase extraction and high-performance liquid chromatography-triple quadrupole tandem mass spectrometry (HPLC-MS/MS) was developed and validated by optimizing the instrumental parameters and the sample pretreatment procedures. The results showed that the calibration curves of mPAEs and mAPs had good linear relationships, with correlation coefficients ≥ 0.995. The limits of quantification of mPAEs and mAPs in urine were 0.05—1.89 ng·mL−1 and 0.03—0.33 ng·mL−1, respectively. The recoveries of mPAEs and mAPs in spiked matrix samples were 83.7%—115% and 106%—129%, respectively, and the relative standard deviations <20%. Matrix effects were −16% to −4.3% for PAEs and −18% to −5.4% for mAPs, respectively. Sixteen out of 18 target chemicals were detected in 30 urine samples of ordinary residents from Guangzhou, including 9 mPAEs and 7 mAPs, with detection frequencies as 78%—100% and 50%—100%, respectively. The concentrations of Σ9mPAEs were 31.5—757 ng·mL−1, and monon-butyl phthalate (mnBP) and monoisobutyl phthalate (miBP) were the predominant metabolites. The concentrations of Σ7mAPs were 1.26—39.6 ng·mL−1, with mono-(2-ethylhexyl) terphthalate (MEHT) and 2-ethylhexyl hexyl hexanoate (MEHA) as the major chemicals. The results of this study indicated that the developed method has high recovery, and precision, and low matrix effects, which meets the needs for simultaneous analysis of mPAEs and mAPs in human urine.
-
Key words:
- phthalate esters /
- alternative plasticizers /
- human urine /
- metabolites /
- exposed biomarkers
-

-
表 1 邻苯二甲酸酯和替代型塑化剂代谢物基本信息
Table 1. Basic information of the metabolites of phthalate esters and alternative plasticizers
中文全称
Full name in Chinese英文全称
Full name in English简称
Abbreviation分子量
Molecular
weight分子式
FormulasCAS号
CAS No.邻苯二甲酸酯代谢物 (Metabolites of phthalate esters,mPAEs) 邻苯二甲酸单甲酯 Monomethyl phthalate mMP 180.2 C9H8O4 4376 -18-5邻苯二甲酸单乙酯 Monoethyl phthalate mEP 194.2 C10H10O4 2306 -33-4邻苯二甲酸单正丁酯 Mono-n-butyl phthalate mnBP 222.2 C12H14O4 131-70-4 邻苯二甲酸单异丁酯 Monoisobutyl phthalate miBP 222.2 C12H14O5 30833 -53-5邻苯二甲酸单苄基酯 Monobenzyl phthalate mBzP 256.3 C15H12O4 2528 -16-7邻苯二甲酸单辛基乙酯 Mono-n-octyl phthalate mnOP 278.3 C16H22O4 5393 -19-1邻苯二甲酸单异壬酯 Monoisononyl phthalate miNP 292.4 C17H24O4 106610 -61-1邻苯二甲酸单(2-乙基己基)酯 Monoethylhexyl phthalate MEHP 278.3 C16H22O4 4376 -20-9邻苯二甲酸单(2-乙基-5-羟基己基)酯 Mono-(2-ethyl-5-hydroxyhexyl) phthalate 5OH-MEHP 294.3 C16H22O5 40321 -99-1邻苯二甲酸单(2-乙氧-5-氧己基)酯 Mono-(2-ethyl-5-oxohexyl) phthalate 5Oxo-MEHP 292.3 C16H22O5 40321 -98-0邻苯二甲酸单(2-乙基-5-羧基戊基)酯 Mono-(2-ethyl- 5-carboxypentyl) phthalate 5Cx-MEPP 308.3 C16H20O6 40809 -41-4替代型塑化剂代谢物 (Metabolites of alternative plasticizers,mAPs) 己二酸2-乙基己酯 Mono-(2-ethylhexyl) adipate MEHA 258.4 C14H26O4 4337 -65-9对苯二甲酸单(2-乙基己基)酯 Mono-(2-ethylhexyl) terephthalate MEHT 278.3 C16H22O4 — 1,2-环己烷二羧酸单4-甲基辛酯 1,2-Cyclohexanedicarboxylic acid mono
4-methyloctyl esterMINCH 298.4 C17H30O4 1889286 -78-5邻苯二甲酸单(2-丙基-6-羟基庚基)酯 Mono-(2-propyl-6-hydroxyheptyl) phthalate OH-MPHP 322.4 C18H26O5 1372605 -11-22-(((羟基-4-甲基辛基)氧基)羰基)环己烷甲酸 2-(((Hydroxy-4-methyloctyl) oxy) carbonyl)
cyclohexanecarboxylic acidOH-MINCH 314.4 C18H26O5 1637562 -52-71,2-环己烷二羧酸单4-甲基-7-羧基庚酯 1,2-Cyclohexane-dicarboxylic acid mono 4-methyl-7-carboxy-heptyl ester Cx-MINCH 328.4 C17H28O6 1637562 -51-62-(((4-甲基-7-氧辛基)氧基羰基)环己烷羧酸 2-(((4-Methyl-7-oxyooctyl)oxy)carbonyl) cyclohexanecarboxylic acid Oxo-MINCH 312.4 C17H28O5 1588520 -62-0内标化合物 (Internal standards,ISs) 邻苯二甲酸单辛酯-d4 Monooctyl phthalate-d4 mnOP-d4 282.4 C16H18D4O4 1398065 -74-1邻苯二甲酸单乙酯-13C4 Monoethyl phthalate-13C4 mEP-13C4 198.2 C6*C4H10O4 2687959 -71-1邻苯二甲酸单正丁酯-13C4 Mono-n-butyl phthalate-13C4 mnBP-13C4 226.2 C8*C4H14O4 2687959 -76-6邻苯二甲酸单苄基酯-13C4 Monobenzyl phthalate-13C4 mBzP-13C4 260.2 C11*C4H12O4 2483735 -88-0邻苯二甲酸单(2-乙基己基)酯-13C4 Monoethylhexyl phthalate-13C4 MEHP-13C4 282.3 C12*C4H22O4 959266 -61-6邻苯二甲酸单(2-乙基-5-羟基己基)酯-13C4 Mono-(2-ethyl-5-hydroxyhexyl) phthalate-13C4 5OH-MEHP-13C4 298.3 C12*C4H22O5 2483736 -27-0邻苯二甲酸单(2-乙氧-5-氧己基)酯-13C4 Mono-(2-ethyl-5-oxohexyl) phthalate-13C4 5Oxo-MEHP-13C4 296.3 C12*C4H22O5 1268238 -35-22-((4-甲基-7-氧辛基)氧基羰基)环己烷羧酸-d8 2-((4-Methyl-7-oxyooctyl)oxy)carbonyl cyclohexanecarboxylic acid-d8 Oxo-MINCH-d8 320.5 C17H20D8O5 — 2-(((羟基-4-甲基辛基)氧基)羰基)环己烷羧基酸-d8 2-(((Hydroxy-4-methyloctyl)oxy)carbonyl) cyclohexanecarboxylic acid-d8 OH-MINCH-d8 322.5 C17H22D8O5 — 邻苯二甲酸单(6-羟基-丙基庚基)酯-d4 Mono-propylheptylphthalate 6-hydroxy-d4 OH-MPHP-d4 326.4 C18H22D4O5 1412411 -11-0—:无相关数据, no data. 表 2 mPAEs和mAPs的质谱参数信息
Table 2. Mass spectrum information for the mPAE and mAPs
化合物
Chemicals初级离子
Precursor ion (m/z)次级离子
Product ion(m/z)保留时间/ min
Retention time去簇电压/ V Declustering potential 碰撞能/ eV Collision energy 对应内标
Corresponding ISsmPAEs mMP 179.0 107.0 3.40 −42.0 −14.0 mEP-13C4 mEP 193.0 121.0 5.80 −42.0 −18.0 mEP-13C4 mnBP 221.0 70.9 10.8 −39.0 −19.0 mnBP-13C4 miBP 220.9 134.2 10.5 −40.0 −18.0 mnBP-13C4 mBzP 255.1 106.9 12.5 −49.0 −20.0 mBzP-13C4 mnOP 277.0 125.0 18.2 −56.0 −22.0 mnOP-d4 miNP 291.2 141.0 18.2 −42.0 −23.0 mnOP-d4 MEHP 277.2 133.8 17.3 −40.0 −19.0 MEHP-13C4 5-OH-MEHP 293.0 145.1 10.8 −40.0 −19.0 5OH-MEHP-13C4 5-Oxo-MEHP 291.0 120.8 11.5 −40.0 −25.0 5Oxo-MEHP-13C4 5-Cx-MEPP 307.0 159.0 10.9 −93.0 −17.0 5Oxo-MEHP-13C4 mAPs MEHA 257.0 83.0 15.9 −57.0 −21.0 OH-MINCH-d8 MEHT 277.0 120.0 19.1 −68.0 −36.0 OH-MINCH-d8 MINCH 297.0 153.0 19.9 −81.0 −19.0 OH-MINCH-d8 OH-MPHP 321.0 121.0 13.7 −47.0 −27.0 OH-MPHP-d4 OH-MINCH 313.1 153.0 12.9 −111 −22.0 OH-MINCH-d8 Cx-MINCH 327.0 173.0 13.0 −62.0 −24.0 Oxo-MINCH-d8 Oxo-MINCH 311.0 153.0 13.7 −73.0 −21.0 Oxo-MINCH-d8 ISs mnOP-d4 281.2 126.9 18.2 −40.0 −21.0 — mEP-13C4 196.9 79.0 5.81 −42.0 −18.0 — mnBP-13C4 225.0 79.0 10.8 −49.0 −24.0 — mBzP-13C4 259.0 106.8 12.5 −42.0 −18.0 — MEHP-13C4 281.4 137.1 17.3 −40.0 −20.0 — 5OH-MEHP-13C4 297.1 145.0 10.8 −64.0 −20.0 — 5Oxo-MEHP-13C4 295.2 1430. 11.5 −56.0 −19.0 — Oxo-MINCH-d8 319.0 161.0 13.7 −33.0 −22.0 — OH-MINCH-d8 321.2 160.9 12.8 −64.0 −22.0 — OH-MPHP-d4 325.0 125.0 13.6 −70.0 −26.0 — —:无相关数据, no data. 表 3 HLB固相萃取柱净化的3种前处理方案
Table 3. Three pretreatment schemes for solid phase extraction using HLB cartridge
方案
Scheme清洗溶剂
Washing solvent洗脱溶剂
Elution solvent1 3 mL 5%甲酸-超纯水 9 mL 5%甲酸-MeOH 2 3 mL 5% MeOH-超纯水 9 mL 5%甲酸-MeOH 3 3 mL 5% MeOH-超纯水 9 mL MeOH 表 4 方法验证结果
Table 4. Validation results for the developed method
化合物
Target chemicals相关
系数
R检出限/
(ng·L−1)
LOD定量限/(ng·L−1)
LOQ低加标组(n = 6)
Low-spiking高加标组(n = 6)
High-spiking日内精
密度/%
Intra-day precisions日间
精密度/%
Inter-day
precisions基质
效应/%
Matrix
effects回收率/%
Recovery相对标准偏差/%
RSD回收率/%
Recovery相对标准偏差/%
RSDmMP 0.998 0.18 0.55 90.1 7.98 115 4.55 10.5 11.2 −5.5 mEP 0.998 0.10 0.33 83.7 4.16 101 7.74 9.85 11.6 −7.6 mnBP 0.997 0.62 1.36 105 7.01 110 7.02 4.95 5.57 −6.8 mPAEs miBP 0.997 0.06 0.20 95.8 5.42 101 4.05 3.59 11.8 −11 mBzP 0.999 0.05 0.16 92.4 15.4 95.6 0.35 1.97 3.01 −14 mnOP 0.999 0.16 0.49 98.9 2.46 105 4.86 1.48 3.12 −9.4 miNP 0.999 0.06 0.19 97.5 1.79 93.8 4.54 2.04 3.04 −8.6 MEHP 0.998 0.72 1.89 102 1.98 105 3.79 2.72 2.49 −12 5OH-MEHP 0.998 0.21 0.64 96.5 8.65 98.3 2.52 2.96 3.62 −5.8 5Oxo-MEHP 0.997 0.05 0.16 101 3.24 111 10.7 4.42 4.27 −4.3 5Cx-MEPP 0.995 0.02 0.05 108 4.52 108 3.18 3.14 2.89 −16 MEHA 0.995 0.11 0.33 119 12.0 129 9.76 2.80 7.49 −5.4 MEHT 0.999 0.09 0.28 116 7.14 106 6.18 3.11 11.3 −8.8 mAPs MINCH 0.999 0.01 0.03 113 7.65 120 7.32 4.89 7.30 −7.6 OH-MPHP 0.998 0.01 0.03 109 2.08 117 5.47 8.32 9.41 −9.3 OH-MINCH 0.997 0.01 0.03 114 6.90 126 1.10 5.12 8.98 −14 Cx-MINCH 0.999 0.04 0.12 120 3.12 120 4.80 3.76 8.45 −18 Oxo-MINCH 0.996 0.02 0.06 116 7.34 122 7.28 2.46 2.02 −7.7 表 5 HPLC-MS/MS分析尿液种mPAEs和mAPs的方法对比
Table 5. HPLC-MS/MS methods for the analysis of mPAEs and mAPs in human urine in the literatute
目标分析物
Target analytes前处理方法
Pretreatment method离子源
Ionization mode色谱柱
Analytical column流动相
Mobile phase分析方法参数
Analytical performance参考文献
Reference7种mPAEs 酶解—60 mg Oasis MAX SPE柱富集净化 电喷雾电离源,负模式(ESI-) ZORBAX
SB-PhenylA:0.1%乙酸-超纯水
B:0.1%乙酸-ACNLOD:0.013—0.08 ng·mL−1
回收率:88.8%—108.9%[30] 9种mPAEs 酶解—60 mg Oasis MAX SPE柱富集净化 电喷雾电离源,负模式(ESI-) Betasil phenyl A:0.1%乙酸-超纯水
B:0.1%乙酸-ACNLOD:0.06—0.85 ng·mL−1
回收率:84.1%—122%[31] 6种mPAEs 酶解—60 mg Hypersep Retain Pep SPE柱富集净化 电喷雾电离源,负模式(ESI-) BEH C18 A:0.1%乙酸-超纯水
B: ACNLOD:0.2—0.5 ng·mL−1
回收率:88.2%—105.9%[32] 14种mPAEs 酶解—50 mg Oasis MAX SPE柱富集净化 电喷雾电离源,负模式(ESI-) BEH C18 A:0.1%乙酸-超纯水
B: ACNLOD:< 0.84 ng·mL−1
回收率:76.5%—125%[33] 11种APs 酶解—60 mg Oasis HLB SPE柱富集净化 电喷雾电离源,负模式(ESI-) Phenomenex Kinetex
BiphenylA:0.05%甲酸-超纯水
B: 0.05%甲酸-ACNLOD:0.02—0.5 ng·mL−1
LOQ:0. 2—1.6 ng·mL−1
回收率:73%—92%[34] 11种mPAEs
和7种mAPs酶解—60 mg Oasis HLB SPE柱富集净化 电喷雾电离源,负模式(ESI-) Phenomenex Kinetex Biphenyl A:0.05%甲酸-超纯水
B:MeOHLOD:0.01—0.72 ng·mL−1
LOQ:0.03—1.89 ng·mL−1
回收率:83.7%—129%本研究 表 6 广州人群尿液中mPAEs和mAPs浓度(n = 30;ng·mL−1)
Table 6. Levels of mPAEs and mAPs in urine of population from Guangzhou
代谢物
Metabolites检出率/%
DF几何均值
Geometric mean中值
Median最小值
Min最大值
MaxmMP 100 5.93 7.51 0.55 57.1 mEP 100 10.7 10.1 0.47 103 miBP 90 28.4 14.4 ND 144 mnBP 100 28.3 21.2 6.55 221 mBzP 78 0.54 1.01 ND 2.09 mnOP — — — — — miNP — — — — — mEHP 100 14.1 23.3 0.83 52.7 OH-MEHP 100 25.0 24.7 3.43 106 Cx-MEHP 100 0.96 0.82 0.18 5.25 OXO-MEHP 100 10.9 9.39 1.48 64.5 ∑9mPAEs 100 143 127 31.5 737 MEHA 100 0.96 1.11 0.14 3.83 MEHT 97 4.09 7.38 ND 28.2 MINCH 63 0.61 0.61 ND 1.96 5OH-MINCH 100 0.57 0.58 0.12 2.11 5OXO-MINCH 100 0.45 0.41 0.10 1.62 Cx-MINCH 90 0.37 0.61 ND 2.59 OH-MPrHP 50 0.23 0.44 ND 4.85 ∑7mAPs 100 8.83 9.80 1.26 39.6 ND 未检出,not detected;—:无相关数据, no data. -
[1] LARSSON K. , LINDH C H, JONSSON B A, et al. Phthalates, non-phthalate plasticizers and bisphenols in Swedish preschool dust in relation to children's exposure[J]. Environment International, 2017, 102: 114-124. doi: 10.1016/j.envint.2017.02.006 [2] BU Z, MMEREKI D, WANG J, et al. Exposure to commonly-used phthalates and the associated health risks in indoor environment of urban China[J]. Science of the Total Environment, 2019, 658: 843-853. doi: 10.1016/j.scitotenv.2018.12.260 [3] 任 超, 赵祯, 柳金明, 等. 典型废物回收园区土壤中邻苯二甲酸酯分布与风险评价[J]. 环境化学, 2018, 37(8): 1691-1698. doi: 10.7524/j.issn.0254-6108.2017111101 REN C, ZHAO Z, LIU J M, et al. Distribution and risk assessment of phthalic acid ester (PAEs) in soil from a multi-waste recycling area[J]. Environmental Chemistry, 2018, 37(8): 1691-1698 (in Chinese). doi: 10.7524/j.issn.0254-6108.2017111101
[4] 孔昊玥, 刘红玲, 最大累积率识别中国地表水中邻苯二甲酸酯类关键污染物和复合污染生态风险[J]. 环境化学, 2021. 40 (3): 706-716. KONG H Y, LIU H L. Identification the key pollutants of phthalic acid esters in surface water of China and ecological risk of mixture based on maximum cumulative ratio [J]. Environmental Chemistry, 2021, 40 (3): 706-716 (in Chinese).
[5] NET S, SEMPERE R, DELMONT A, et al. Occurrence, Fate, Behavior and Ecotoxicological State of Phthalates in Different Environmental Matrices[J]. Environmental Science & Technology, 2015, 49(7): 4019-4035. [6] AIT B Y, ARAKI A, KAWAI T, et al. Associations of phthalate concentrations in floor dust and multi-surface dust with the interior materials in Japanese dwellings[J]. Science of the Total Environment, 2014, 468-469: 147-57. doi: 10.1016/j.scitotenv.2013.07.107 [7] GUO Y, WECK J, SUNDARAM R, et al. Urinary concentrations of phthalates in couples planning pregnancy and its association with 8-hydroxy-2'-deoxyguanosine, a biomarker of oxidative stress: longitudinal investigation of fertility and the environment study[J]. Environmental Science & Technology, 2014, 48(16): 9804-11. [8] BUI T T, GIOVANOULIS G, COUSINS A P, et al. Human exposure, hazard and risk of alternative plasticizers to phthalate esters[J]. Science of the Total Environment, 2016, 541: 451-467. doi: 10.1016/j.scitotenv.2015.09.036 [9] TAKESHITA A, IGARASHI M J, NISHIYAMA K, et al. Acetyl tributyl citrate, the most widely used phthalate substitute plasticizer, induces cytochrome P450 3a through steroid and xenobiotic receptor[J]. Toxicological Sciences, 2011, 123(2): 460-70. doi: 10.1093/toxsci/kfr178 [10] SHEIKH I A, BEG M A. Structural characterization of potential endocrine disrupting activity of alternate plasticizers di-(2-ethylhexyl) adipate (DEHA), acetyl tributyl citrate (ATBC) and 2, 2, 4-trimethyl 1, 3-pentanediol diisobutyrate (TPIB) with human sex hormone-binding globulin[J]. Reproductive Toxicology, 2019, 83: 46-53. doi: 10.1016/j.reprotox.2018.11.003 [11] KIM H, NAM K, OH S, et al. Toxicological assessment of phthalates and their alternatives using human keratinocytes[J]. Environmental Research, 2019, 175: 316-322. doi: 10.1016/j.envres.2019.05.007 [12] ELJEZI T, PINTA P, RICHARD D, et al. In vitro cytotoxic effects of DEHP-alternative plasticizers and their primary metabolites on a L929 cell line[J]. Chemosphere, 2017, 173: 452-459. doi: 10.1016/j.chemosphere.2017.01.026 [13] QADEER A, KIRSTEN K L, AJMAL Z, et al. Alternative Plasticizers As Emerging Global Environmental and Health Threat: Another Regrettable Substitution?[J]. Environmental Science & Technology, 2022, 56(3): 1482-1488. [14] CHRISTIA C, POMA G, HARRAD S, et al. Occurrence of legacy and alternative plasticizers in indoor dust from various EU countries and implications for human exposure via dust ingestion and dermal absorption[J]. Environmental research, 2019, 171: 204-212. doi: 10.1016/j.envres.2018.11.034 [15] TANG B, CHRISTIA C, MALARVANNAN G, et al. Legacy and emerging organophosphorus flame retardants and plasticizers in indoor microenvironments from Guangzhou, South China[J]. Environment International, 2020, 143: 105972. doi: 10.1016/j.envint.2020.105972 [16] GIOVANOULIS G, BUI T, XU F, et al. Multi-pathway human exposure assessment of phthalate esters and DINCH[J]. Environment International, 2018, 112: 115-126. doi: 10.1016/j.envint.2017.12.016 [17] HUANG Y Q, ZENG Y, WANG T, et al. PM2.5-bound phthalates and phthalate substitutes in a megacity of southern China: spatioseasonal variations, source apportionment, and risk assessment[J]. Environmental Science and Pollution Research, 2022, 29(25): 37737-37747 doi: 10.1007/s11356-022-18784-0 [18] CHAKRABORTY P, GADHAVI H, PRITHIVIRAJ B, et al. Passive Air Sampling of PCDD/Fs, PCBs, PAEs, DEHA, and PAHs from Informal Electronic Waste Recycling and Allied Sectors in Indian Megacities[J]. Environmental Science & Technology, 2021, 55(14): 9469-9478. [19] NAGORKA R, KOSCHORRECK J. Trends for plasticizers in German freshwater environments - Evidence for the substitution of DEHP with emerging phthalate and non-phthalate alternatives[J]. Environmental Pollution, 2020, 262: 114237. doi: 10.1016/j.envpol.2020.114237 [20] LIU Y E, LUO X J, HUANG C C, et al. Legacy and alternative plasticizers in surface sediment of black-odorous urban rivers across China: Occurrence, spatial distribution, and ecological risk assessment[J]. Chemosphere, 2021, 283: 131206. doi: 10.1016/j.chemosphere.2021.131206 [21] KIM S, KIM Y, MOON H B. Contamination and historical trends of legacy and emerging plasticizers in sediment from highly industrialized bays of Korea[J]. Science of the Total Environment, 2021, 765: 142751. doi: 10.1016/j.scitotenv.2020.142751 [22] LIU Y E, TANG B, LIU Y, et al. Occurrence, biomagnification and maternal transfer of legacy and emerging organophosphorus flame retardants and plasticizers in water snake from an e-waste site [J]. Environment International, 2019. 133(Pt B): 105240. [23] JEBARA A, ALBERGAMO A, RANDO R, et al. Phthalates and non-phthalate plasticizers in Tunisian marine samples: Occurrence, spatial distribution and seasonal variation[J]. Marine Pollution Bulletin, 2021, 163: 111967. doi: 10.1016/j.marpolbul.2021.111967 [24] LIU L, CUI H, HUANG Y, et al. Enzyme-Mediated Reactions of Phenolic Pollutants and Endogenous Metabolites as an Overlooked Metabolic Disruption Pathway[J]. Environmental Science & Technology, 2022, 56(6): 3634-3644. [25] DIRTU A C, GEENS T, DIRINCK E, et al. Phthalate metabolites in obese individuals undergoing weight loss: Urinary levels and estimation of the phthalates daily intake[J]. Environment International, 2013, 59: 344-53. doi: 10.1016/j.envint.2013.06.023 [26] DEWALQUE L, PIRARD C, DUBOIS N, et al. Simultaneous determination of some phthalate metabolites, parabens and benzophenone-3 in urine by ultra high pressure liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B, 2014, 949-950: 37-47. doi: 10.1016/j.jchromb.2014.01.002 [27] RAMESH K A, SIVAPERUMAL P. Analytical methods for the determination of biomarkers of exposure to phthalates in human urine samples[J]. TrAC Trends in Analytical Chemistry, 2016, 75: 151-161. doi: 10.1016/j.trac.2015.06.008 [28] CEQUIER E, MARCE R M, BECHER G, et al. A high-throughput method for determination of metabolites of organophosphate flame retardants in urine by ultra performance liquid chromatography-high resolution mass spectrometry[J]. Analytica Chimica Acta, 2014, 845: 98-104. doi: 10.1016/j.aca.2014.06.026 [29] RASTKARI N, AHMADKHANIHA R. Magnetic solid-phase extraction based on magnetic multi-walled carbon nanotubes for the determination of phthalate monoesters in urine samples[J]. Journal of Chromatography A, 2013, 1286: 22-28. doi: 10.1016/j.chroma.2013.02.070 [30] 高慧, 许媛媛, 孙丽, 等. 高效液相色谱-串联质谱法同时测定人尿液中7种邻苯二甲酸酯代谢物[J]. 色谱, 2015, 33(6): 622-627. doi: 10.3724/SP.J.1123.2015.01037 GAO H, XU Y Y, SUN L, et al. Determination of seven phthalate metabolites in human urine by high-performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2015, 33(6): 622-627 (in Chinese). doi: 10.3724/SP.J.1123.2015.01037
[31] 张续, 邱天, 付慧等. 超高效液相色谱-三重四极杆质谱法测定人尿中9种邻苯二甲酸酯代谢物[J]. 色谱, 2018, 36(9): 895-903. doi: 10.3724/SP.J.1123.2018.04002 ZHANG X, QIU T, FU H, et al. Determination of nine phthalate ester metabolites in human urine using ultra high performance liquid chromatography-tandem triple quadrupole mass spectrometry[J]. Chinese Journal of Chromatography, 2018, 36(9): 895-903 (in Chinese). doi: 10.3724/SP.J.1123.2018.04002
[32] ZHU Y, WAN Y, LI Y, et al. Free and total urinary phthalate metabolite concentrations among pregnant women from the Healthy Baby Cohort (HBC), China[J]. Environment International, 2016, 88: 67-73. doi: 10.1016/j.envint.2015.12.004 [33] WANG H. X, WANG B, ZHOU Y, et al. Rapid and sensitive analysis of phthalate metabolites, bisphenol A, and endogenous steroid hormones in human urine by mixed-mode solid-phase extraction, dansylation, and ultra-performance liquid chromatography coupled with triple quadrupole mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2013, 405(12): 4313-4319. doi: 10.1007/s00216-013-6779-3 [34] BEEN F, MALARVANNAN G, BASTIAENSEN M, et al. Development and validation of a bioanalytical assay based on liquid chromatography-tandem mass spectrometry for measuring biomarkers of exposure of alternative plasticizers in human urine and serum[J]. Talanta, 2019, 198: 230-236. doi: 10.1016/j.talanta.2019.02.024 -



 下载:
下载: