-
塑料制品在当今世界的用途十分广泛,但高聚物的结构也使得废弃后的塑料成为了地球上的一大污染物,对海洋生物、水质、土壤等生境造成了极大地负面影响[1]。在这样严峻的形势下,如何降解塑料则成为了治理环境污染的研究热点。通常高聚物的降解方式有光氧化、臭氧诱发、催化降解及生物降解等,其中生物降解是最为环保绿色的降解方式。
黄粉虫(Tenebrio molitor)是昆虫纲、鞘翅目、拟步甲科、粉甲属的一个物种,其食性杂,可取食纤维素含量高的材料,有研究报道黄粉虫可降解塑料[2]。除此之外,在土壤中也分离得到了多种对塑料有降解效果的菌株[3]。这些发现都可为未来解决塑料垃圾污染问题提供有力支撑。
本研究以黄粉虫和土壤为研究材料,对黄粉虫肠道菌进行分离,同时对土壤环境中的菌株进行分离。通过对液体培养基中的塑料进行切片观察和以塑料为唯一碳源对菌体浓度进行测定,来筛选对聚苯乙烯泡沫塑料和聚乳酸塑料有降解特性的菌株,并尝试模拟混菌体系。
-
聚苯乙烯泡沫塑料、生物降解型塑料聚乳酸及花鸟市场购买的黄粉虫幼虫。洛阳师范学院附近村庄收集的混杂有破裂、发脆、老化塑料的土壤。
-
取5个用于饲养黄粉虫的透明塑料盒,每个盒子里饲养生长状况良好,体型相近的幼虫50只,并依次编号。第一组饲喂聚乳酸塑料和麸皮,第二组饲喂聚乳酸塑料,第三组饲喂聚苯乙烯泡沫塑料和麸皮,第四组饲喂聚苯乙烯泡沫塑料,第五组作为对照组只饲喂麸皮。在整个实验过程中5个组饲喂的饲料均等量,第一组和第三组麸皮与塑料的质量比值均为6∶1,同时在每个盒子中添加一定量的小青菜和新鲜的胡萝卜,各处理的饲料温度、湿度、光照条件均相同。试验期21 d,记录黄粉虫的死亡数、蜕皮数生长状况。
-
缺碳源的基础培养基[4]:(NH4)2SO4 1.0 g,K2HPO4 0.7 g,MgSO4.7H2O 0.7 g,KH2PO4 0.7 g,NH4NO3 1.0 g,MnSO4.H2O 0.001 g,NaCl 0.005 g,FeSO4.7H2O 0.002 g,水1000 mL,pH 7.0。
NA固体培养基:牛肉膏 0.3 g,蛋白胨 1.0 g,NaCl 0.5 g,琼脂粉 1.5 g,水 100 mL,pH 7.2—7.4。
LB固体培养基:酵母提取物5.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂粉 20 g,水1000 mL,pH 7.4—7.6。
高氏一号固体培养基:可溶性淀粉20 g,NaCl 0.5 g,KNO3 1.0 g,K2HPO4.3H2O 0.5 g,MgSO4.7H2O 0.5 g,FeSO4.7H2O 0.01 g,琼脂粉20 g,水1000 mL,pH 7.4—7.6。
以上培养基,121 ℃灭菌20 min使用。
-
仪器:恒温摇床、微生物培养箱、超净工作台、离心机、PCR仪、酶标仪、高压蒸汽灭菌锅、电热干燥箱等。
试剂:乙醇、0.9% NaCl溶液、氯仿、2×PCR Master Mix等。
-
从饲喂塑料的1-4组中各取10条生长状况良好的黄粉虫,在超净工作台上用75%乙醇对虫体消毒,无菌水清洗3次。在蜡盘中将黄粉虫解剖并取出肠道,加5 mL无菌的0.9% NaCl 溶液,用灭菌的研钵研磨至无可见颗粒,作为肠道微生物培养母液。取无菌的EP管,按照10倍稀释法进行稀释,并取合适的稀释度分别涂布LB和NA平板,37 ℃培养24 h。待菌落长出后,挑取单菌落分别接种到所对应地LB和NA液体培养基中,每个菌落接1个EP管。37 ℃、160 r·min−1培养24 h。
-
称取0.5 g土壤样品,加5 mL无菌水于小烧杯中,用玻璃棒搅拌作为土壤微生物培养母液。按照10倍稀释法进行稀释,取10−6的稀释度分别涂布高氏一号和NA平板,在37 ℃培养24 h。待菌落长出后,挑取单菌落分别接种到所对应地高氏一号和NA液体培养基中,每个菌落接1个EP管。37 ℃、160 r·min−1培养24 h。
-
将剪成适当大小的两种塑料,用75%乙醇消毒3次,并用无菌水清洗3次,在超净工作台内吹干。置于已接种过菌株的LB、高氏一号(Gauze’s medium)和NA液体培养基中,37 ℃培养62 d,期间每隔5 d更换2 mL培养基。62 d后,取表面形态破裂、发脆的塑料进行切片,用扫描电镜观察表面的形态特征。取未经任何处理的聚苯乙烯塑料与聚乳酸塑料进行切片,75%乙醇消毒、无菌水清洗并烘干。之后进行切片观察,作为对照组。该阶段共20个实验组,1个对照组。
此阶段试验组编号,按照菌株分离时所用培养基的英文首字母加阿拉伯数字的格式,依次编号,即G-1, G-2…...;N-1, N-2…...;L-1, L-2…...。
-
塑料预处理:参照文献[4]的方法,将聚苯乙烯泡沫置于超净工作台的紫外灯下灭菌3 h。称取3 g聚苯乙烯溶于12 mL氯仿配制成均匀溶液,把溶液均匀涂于载玻片上成膜,在超净工作台的紫外灯条件下将膜片吹干,制备成20张2 cm×1 cm、厚度0.1 mm的聚苯乙烯薄膜,将膜片用95%乙醇消毒3次,并用无菌水清洗3次,紫外灭菌30 min备用;将聚乳酸塑料剪成20张2 cm×1 cm的膜片,用75%乙醇消毒3次,并用无菌水清洗3次,在超净工作台内吹干备用。
塑料膜片降解特性的测定:微生物细胞含碳量约占干重的50%,故除水分外,碳源是需要量最大的营养物[5]。本阶段将塑料作为培养基中的唯一碳源,并向其中接种菌株,每隔一段时间测定一次以所用塑料为唯一碳源的基础培养基内的活菌数,通过计数固体培养基表面的菌落数从而换算出原样中的菌落形成单位(cfu·mL−1)。通过其值的变化,判断向其中接种的菌株能否将塑料作为唯一碳源进行正常的代谢活动,即证明向其中接种的菌株是否可以利用试验所用塑料。
吸取“1.2.3”中培养5 d的菌悬液,按照10倍稀释法进行稀释,取10−6的稀释度涂布与液体培养基所对应的固体培养基,37 ℃培养24 h。待单菌落长出后,将其接入缺碳源的培养基中,37 ℃、160 r·min−1培养24 h。该步骤共挑取20株菌,每株菌接两个EP管,共设置40个处理组,之后向其中分别接入预处理后的聚苯乙烯塑料和聚乳酸塑料,作为相互对照,在37 ℃、160 r·min−1的恒温摇床中培养24 h。之后将40个处理组置于实验室的室温环境下进行培养,每隔一段时间测定1次菌数量。
接入聚乳酸塑料(PLA)的处理组按照塑料英文加阿拉伯数字的格式,依次编号,即PLA-1、PLA-2、PLA-3…...等,接入聚苯乙烯泡沫塑料(PS)的处理组按照塑料英文加阿拉伯数字的格式,依次编号,即PS-1、PS-2、PS-3…...等。
-
观察细菌单菌落在LB平板上的生长状况,即形状、形态、颜色等,同时采用革兰氏染色法观察并记录培养24 h后的菌体在显微镜下形态和染色特征,染色方法参照微生物学实验教程[6]。
-
对筛选所得到的菌株,采用CTAB/NaCl法进行基因组DNA提取。以细菌基因组DNA为模板,采用细菌通用引物(上游引物27F:5′-AGAGTTTGATCCTGGCTT-3′,下游引物1492R:5′-GGTTACCTTGTTACGACTT-3′)进行细菌16S rRNA基因扩增[7]。北京六合华大基因科技有限责任公司进行测序。
将测序得到的序列通过NCBI 网站(https://www.ncbi.nlm.nih.gov/)进行同源序列搜索(BLAST search),匹配出同源序列。选取代表性菌株序列作进一步的分析,利用MEGA 7.0.26 软件进行系统发育分析,并以自展法(Bootstrap)进行检测,共循环1000次,Neighbor-Joining 法构建系统发育树。根据系统发育树中组群关系对菌株进行分类,并结合菌株的形态观察结果确定菌株的分类地位。
-
从甘油保存管中分别挑取所筛选出的5株菌,并将其分别置于NA培养基中37 ℃培养24 h,每种菌液活菌数均多于109 CFU·mL−1,分别得5种菌悬液备用。聚苯乙烯泡沫塑料切成约3 cm×1 cm (长×宽)、厚度约0.5 mm的26片肉眼下表面结构紧密、表面平整且没有孔洞的薄片。之后,将薄片在紫外灯下杀菌1 h,75%酒精冲洗3次,无菌水冲洗3次,紫外灯下晾干备用。
NA液体培养基下两株菌等比例混合:该体系下每种菌悬液各吸取2.25 mL置于10 mL的EP管内,组成4.5 mL的混菌体系,之后将处理后的聚苯乙烯薄片置于其中。该条件下,所模拟的10组混菌体系,按照A1—A10依次编号。
NA液体培养基下33株菌等比例混合:该体系下每种菌悬液各吸取1.5 mL置于10 mL的EP管内,组成4.5 mL的混菌体系,之后将处理后的聚苯乙烯薄片置于其中。该条件下,所模拟的10组混菌体系,按照B1—B10依次编号。
NA液体培养基下4株菌等比例混合:该体系下每种菌悬液各吸取1.125 mL置于10 mL的EP管内,组成4.5 mL的混菌体系,之后将处理后的聚苯乙烯薄片置于其中。该条件下,所模拟的5组混菌体系, 按照C1—C5依次编号。
对照组体系:吸取4.5 mL无菌水于10 mL EP管中,之后放入预处理后的聚苯乙烯薄片。
上述26组体系置于37 ℃恒温培养箱内,每隔7 d更换2 mL NA培养基,试验期共43 d。
-
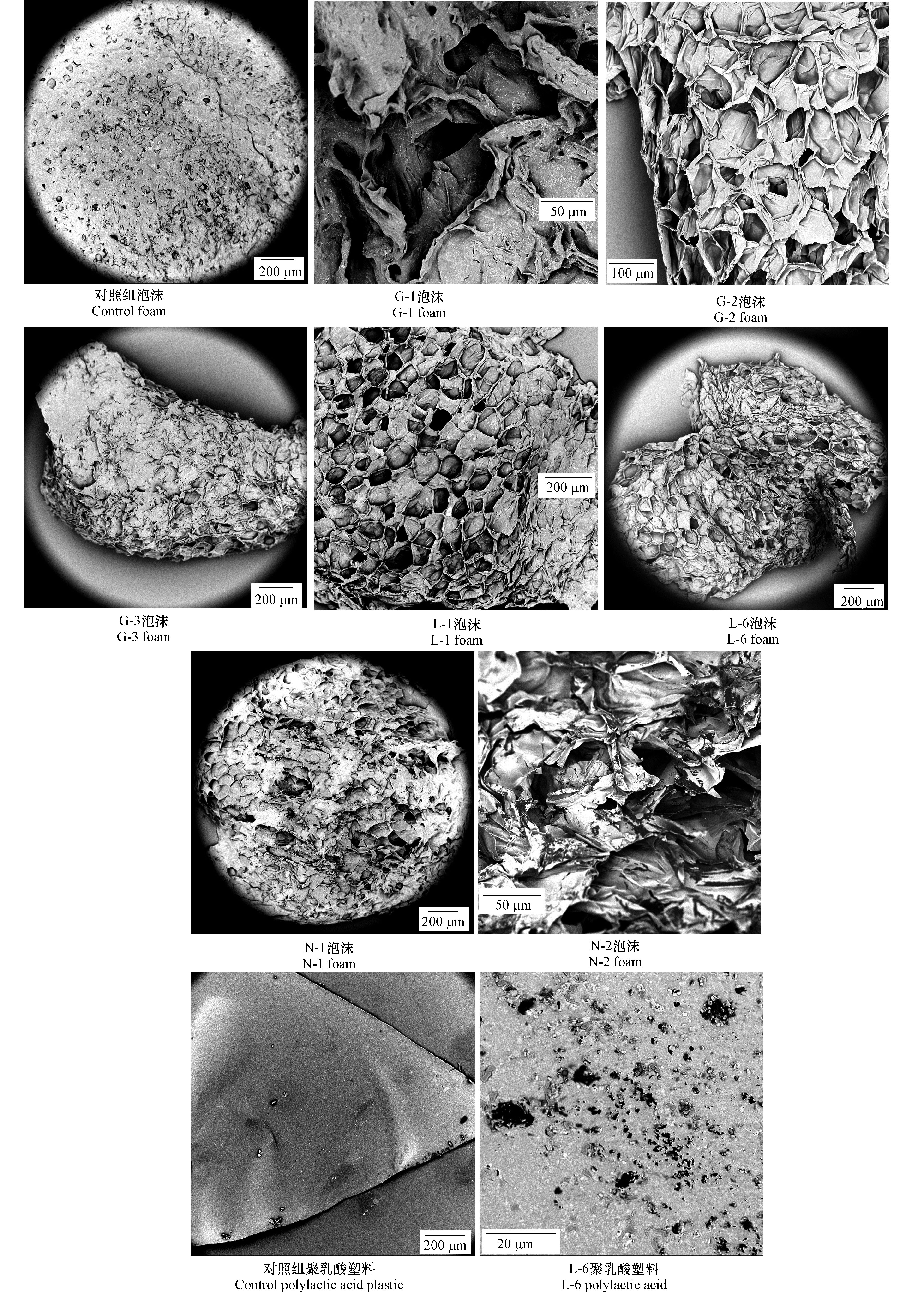
62 d后,在扫描电镜下,编号为G-1、G-2、G-3、L-1、N-1、N-2处理组(图1)的聚苯乙烯泡沫塑料表面形态与对照组差别较大。即在同样的制片条件下,对照组表面有由切割过程中刀片磨损造成的细微凹凸不平,但表面整体形态相对平整;处理组塑料有发脆破裂的现象,表面存在大面积蜂窝状结构,不完整程度较对照组更为明显。编号为L-6处理组(图1)的聚乳酸塑料,由初始的光滑变得粗糙,在电镜下可以看到膜片的部分区域出现破裂。
以上现象表明,在菌株以及液体培养基存在的前提下,聚苯乙烯泡沫塑料和聚乳酸塑料的表面形态会破裂、发脆、出现孔洞。可以推测这两种塑料表面形态的改变,与微生物的分解作用关系较大,但不能排除液体培养基在其中所起的作用。
-
预处理后的聚乳酸塑料及聚苯乙烯塑料在接入缺碳源培养基的21 d中,每隔一段时间测定一次其培养基内的活菌数。依据实验数据,发现在缺碳源的基础培养基中,大部分实验组的cfu·mL−1值均有增大,其中有4株菌的cfu·mL−1值增量较明显,即菌株的生长状况较好。如图2所示,PS-15组菌株能够以聚苯乙烯塑料为唯一碳源进行生长,PLA-2、PLA-7、PLA-15组的菌株能够以聚乳酸塑料为唯一碳源进行生长,其中编号为15的菌株利用聚苯乙烯的能力较聚乳酸塑料要强。
-
通过形态学研究发现,菌株G-1、PLA-15、PS-15的菌落形态为乳白色、圆形、黏液状、表面光滑(图3A-1),革兰氏染色均为阴性、短粗、杆状且呈短链状排列(图3A-2);菌株PLA-2、N-1的菌落形态为乳白色、圆形、黏液状、表面光滑(图3B-1),革兰氏染色均为阴性、卵圆形、杆状、大多成双排列(图3B-2);菌株N-2、PLA-7的菌落形态为乳白色、圆形、黏液状、表面光滑(图3C-1),革兰氏染色均为阴性短杆状(图3C-2);菌株G-2、G-3的菌落形态为乳白色、圆形、表面光滑(图3D-1),革兰氏染色均为阴性、短杆状(图3D-2);菌株L-1、L-6的菌落形态为乳白色、圆形、表面光滑结构(图3E-1),革兰氏染色均为阴性、两端呈钝圆形,短杆状(图3E-2)。
-
将“2.1.1”节和“2.1.2”节中获得的编号为G-1、G-2、G-3、L-1、L-6、N-1、N-2、PLA-2、PLA-7、PS-15的10株菌,采用CTAB/Nacl法进行基因组DNA提取。以细菌基因组DNA为模板,进行细菌16S rRNA基因扩增并测序。测序结果与Geneious中核酸数据库进行对比分析,共获得5种对聚苯乙烯泡沫塑料降解性相对较好的菌株,其中菌株G-1、PS-15、PLA-15为克雷伯氏菌属(Klebsiella sp.),菌株PLA-2、N-1为肺炎克雷伯氏菌(Klebsiella pneumoniae),菌株N-2、PLA-7为肺炎克雷伯氏菌亚种(Klebsiella pneumoniae subsp.),菌株G-2、G-3为肠杆菌(Bacterium)、菌株L-1、L-6为大肠杆菌(Escherichia coli)。将所得菌株分别命名,即将克雷伯氏菌属的一株菌命名为Klebsiella sp. G-1,将克雷伯氏属的肺炎克雷伯氏菌命名为Klebsiella pneumoniae strain PLA-2,将克雷伯氏属的肺炎克雷伯氏菌亚种命名为Klebsiella pneumoniae subsp. N-2,将肠杆菌科的一株菌命名为Bacterium strain G-2,将肠杆菌科的大肠杆菌命名为Escherichia coli strain L-1。
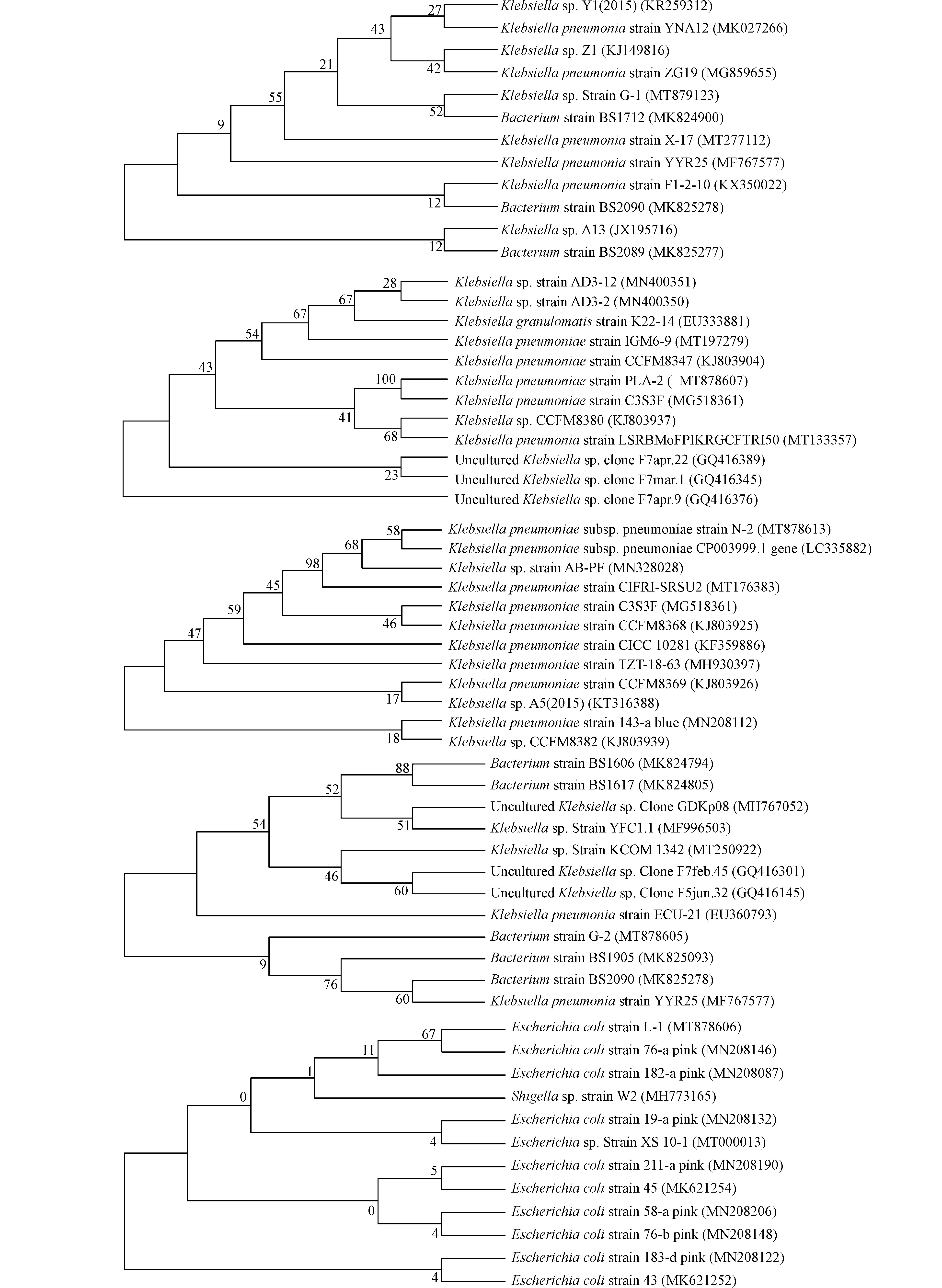
对以上5种菌进行16S rRNA基因序列分析,其中,Klebsiella sp. G-1的片段长度为1247 bp (GenBank登录号: MT879123),Klebsiella pneumoniae strain PLA-2的片段长度为1225 bp (GenBank登录号:MT878607),Klebsiella pneumoniae subsp. N-2的片段长度为1218 bp (GenBank登录号: MT878613),Bacterium strain G-2的片段长度为1207 bp (GenBank登录号: MT878605),Escherichia coli strain L-1的片段长度为1242 bp (GenBank登录号: MT878606)。将序列分别进行BLAST同源比对分析,挑出相似度最高的同源序列进行比对,构建系统发育进化树(图4),均为Bootstrap consensus tree格式,根据各自呈现出的自展值判断亲缘关系远近。
经形态学及进化树的对比结果,菌株Klebsiella sp. G-1可鉴定为克雷伯氏菌属,Klebsiella pneumoniae strain PLA-2可鉴定为克雷伯氏菌,Klebsiella pneumoniae subsp. N-2可鉴定为克雷伯氏菌亚种,Bacterium strain G-2可鉴定为肠杆菌,Escherichia coli strain L-1可鉴定为大肠杆菌。
张可等[8]发现黄粉虫能够取食和完全消化降解塑料薄膜。沈叶红[9]从黄粉虫肠道中分离出8株细菌,分别是Stenotrophomonas、Serratia、Bacillus subtilis、Enterobacter sp.、Bacterium、Staphylococcus、Stenotrophomonas maltophilia和Citrobacter。Yang等[10-11]发现以聚苯乙烯泡沫塑料为单一食源喂养黄粉虫幼虫,实验分离出PS降解细菌Exiguobacterium sp. YT2。冯静[12]从土壤中分离出了一株能够降解聚乙烯的放线菌,并鉴定该菌株为Streptomyces albogriseolus(白浅灰链霉菌)。钟越等[13]也从土壤中分离出了一株降解菌用于聚乙烯塑料生物降解菌株。本研究从黄粉虫肠道菌和土壤环境中分离出5种主要菌株,分别是克雷伯氏菌属(Klebsiella sp.)、肺炎克雷伯氏菌(Klebsiella pneumoniae)、肺炎克雷伯氏菌亚种(Klebsiella pneumoniae subsp.)、肠杆菌(Bacterium)和大肠杆菌(Escherichia coli)。其中,克雷伯氏菌属(Klebsiella sp.)、肺炎克雷伯氏菌(Klebsiella pneumoniae)、肺炎克雷伯氏菌亚种(Klebsiella pneumoniae subsp.)是首次被发现。
-
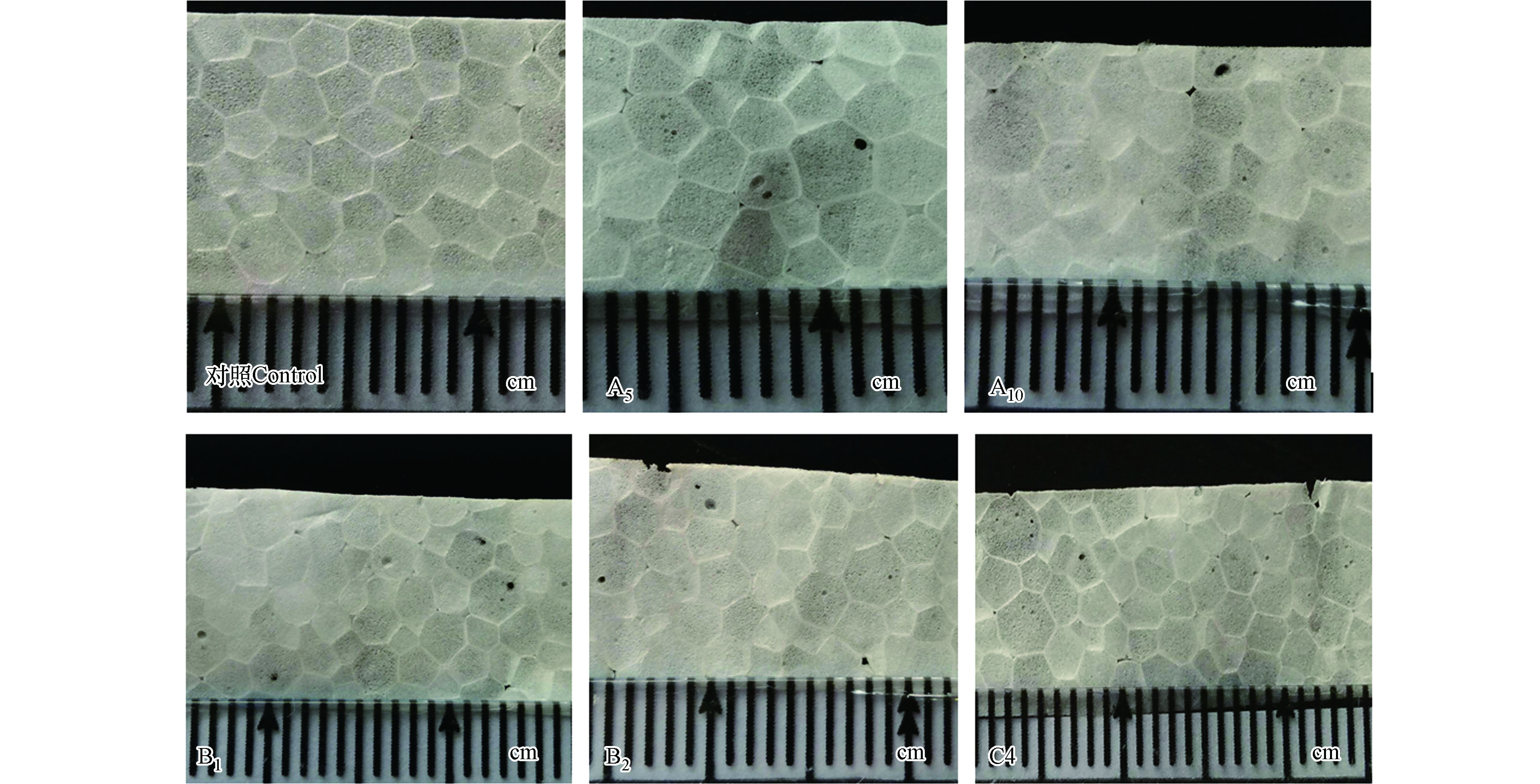
基于所得到的5种菌,该阶段共模拟25组实验组体系、1组对照组体系。43 d后,从塑料薄片可以看出,不同的体系下,聚苯乙烯薄片表面形态破裂、发脆的程度均不相同(图5)。从目前的26组数据可分析,两种菌的混合体系与3种菌的混合体系要优于4种菌的混合体系;其中A5、A10、B1、B2和C4组(图5)薄片表面肉眼可见的孔洞较大、数量较多,整体不完整程度较高。
这5个组所对应的菌株组合如下:
A5:Klebsiella pneumoniae strain PLA-2、Klebsiella pneumoniae subsp. N-2
A10:Escherichia coli strain L-1、Bacterium strain G-2
B1:Klebsiella sp. G-1、Klebsiella pneumoniae strain PLA-2、Klebsiella pneumoniae subsp. N-2
B2:Klebsiella sp. G-1、Klebsiella pneumoniae strain PLA-2、Escherichia coli strain L-1
C4:Klebsiella sp. G-1、Klebsiella pneumoniae subsp. N-2、Escherichia coli strain L-1、Bacterium strain G-2
Gilbert等[14]利用两株工程化的E. coli菌株,构建了可以降解有机磷杀虫剂的混菌体系。Minty等[15]通过工程化构建里氏木霉菌与大肠杆菌,形成了可以提高纤维素生物质原料转化为异丁醇的产量的人工合成混菌体系。可见混菌体系相较于纯培养体系而言,不仅能够完成复杂程度更高的工作,对环境的变化也拥有着较强的稳定性[16]。在本研究的前期,即依据扫描电镜观察来筛选菌株的实验阶段,扫描电镜下的聚苯乙烯膜片表面形态发生了破裂、发脆的变化,但肉眼下的现象效果并不明显。而在本研究的后期即混菌体系模拟阶段,试验期43 d后,A5、A10、B1、B2和C4实验组的试验塑料表面可以看到肉眼可见的孔洞,部分孔洞的直径可达0.1 cm。由此可见,本研究模拟的人工合成微生物混菌体系降解聚苯乙烯的效果要优于单株菌的降解效果。
-
(1)从黄粉虫肠道及土壤中分离筛选能降解聚苯乙烯泡沫及聚乳酸塑料的5种菌株,分别为克雷伯氏菌属(Klebsiella sp.G-1)、克雷伯氏菌(Klebsiella pneumoniae strain PLA-2)、克雷伯氏菌亚种(Klebsiella pneumoniae subsp. N-2)、肠杆菌(Bacterium strain G-2)和大肠杆菌(Escherichia coli strain L-1)。
(2)得到5个对聚苯乙烯泡沫降解性更好的混菌体系:A5(Klebsiella pneumoniae strain PLA-2、Klebsiella pneumoniae subsp. N-2)、A10(Escherichia coli strain L-1、Bacterium strain G-2)、B1(Klebsiella sp. G-1、Klebsiella pneumoniae strain PLA-2、Klebsiella pneumoniae subsp. N-2)、B2(Klebsiella sp. G-1、Klebsiella pneumoniae strain PLA-2、Escherichia coli strain L-1)和C4(Klebsiella sp. G-1、Klebsiella pneumoniae subsp. N-2、Escherichia coli strain L-1、Bacterium strain G-2)。
几株细菌对聚苯乙烯泡沫及聚乳酸的降解性能
Degradation of polystyrene foam and polylactic acid by several strains of bacteria
-
摘要: 由于塑料的大量使用,并且大部分塑料在自然界中难以降解,使得塑料垃圾对环境造成了巨大的负面影响。本研究从黄粉虫肠道和土壤分离能降解聚苯乙烯泡沫及聚乳酸塑料的菌株。黄粉幼虫以6∶1的麸皮与塑料配比饲喂21 d,对其肠道菌株进行分离、培养。同时对混杂有破裂、发脆、老化塑料的土壤菌株进行分离、培养。而后利用扫描电镜切片观察和菌数量测定,筛选对聚苯乙烯泡沫及聚乳酸这两种塑料有降解特性的菌株。最后设计混菌体系,优化出最佳的降解组合。结果从黄粉虫肠道和土壤中分离筛选出5种降解效果好的菌株,分别为Klebsiella sp.G-1、Klebsiella pneumoniae strain PLA-2、Klebsiella pneumoniae subsp. N-2、Bacterium strain G-2和Escherichia coli strain L-1。并得到5个对聚苯乙烯泡沫降解性更好的混菌体系:A5(Klebsiella pneumoniae strain PLA-2、Klebsiella pneumoniae subsp. N-2)、A10(Escherichia coli strain L-1、Bacterium strain G-2)、B1(Klebsiella sp. G-1、Klebsiella pneumoniae strain PLA-2、Klebsiella pneumoniae subsp. N-2)、B2(Klebsiella sp. G-1、Klebsiella pneumoniae strain PLA-2、Escherichia coli strain L-1)和C4(Klebsiella sp. G-1、Klebsiella pneumoniae subsp. N-2、Escherichia coli strain L-1、Bacterium strain G-2)。研究结果表明,黄粉虫肠道及土壤环境中存在对聚苯乙烯泡沫及聚乳酸塑料有一定降解性的细菌,且混菌体系对聚苯乙烯泡沫的降解效果要优于单株菌。Abstract: Plastics were used in large quantities and difficult to degrade in nature, making plastic waste have a huge negative impact on the environment. Strains which can degrade polystyrene foam and polylactic acid plastics were isolated from tenebrio molitor gut and soil mixed with cracked, brittle and aged plastic. The tenebrio molitors were feed with bran and plastics at a ratio of 6∶1 for 21 days and the gut bacteria were isolated and cultured. Plastic section and the cell concentration were used to investigate the characteristics of plastic degradation. Finally, the mixed bacteria system was designed to optimize the degradation. The results shown that five strains with good degradation effect were screened from the intestinal tract and soil, which were Klebsiella sp.G-1、Klebsiella pneumoniae strain PLA-2、Klebsiella pneumoniae subsp. N-2、Bacterium strain G-2 and Escherichia coli strain L-1. Meanwhile, five mixed bacteria systems [A5 (Klebsiella pneumoniae strain PLA-2、Klebsiella pneumoniae subsp. N-2)、A10 (Escherichia coli strain L-1、Bacterium strain G-2)、B1 (Klebsiella sp. G-1、Klebsiella pneumoniae strain PLA-2、Klebsiella pneumoniae subsp. N-2)、B2 (Klebsiella sp. G-1、Klebsiella pneumoniae strain PLA-2、Escherichia coli strain L-1) and C4 (Klebsiella sp. G-1、Klebsiella pneumoniae subsp. N-2、Escherichia coli strain L-1、Bacterium strain G-2)] with good degradation effect were also obtained through mixing and matching. The results suggested that strains which can degrade polystyrene foam and polylactic acid plastics could been isolated from tenebrio molitor gut and soil, the degradation of polystyrene foam by mixed bacteria system was better than single bacteria.
-
Key words:
- Tenebrio molitor /
- soil /
- polystyrene foam /
- polylactic acid
-

-
图 4 各菌株(Klebsiella sp. G-1、Klebsiella pneumoniae strain PLA-2、Klebsiella pneumoniae subsp. N-2、Bacterium strain G-2、Escherichia coli strain L-1)基于16S rRNA基因序列的系统发育进化树
Figure 4. Phylogenetic tree of strain ( Klebsiella sp. G-1,Klebsiella pneumoniae strain PLA-2,Klebsiella pneumoniae subsp. N-2,Bacterium strain G-2,Escherichia coli strain L-1)based on 16S rRNA gene sequence
-
[1] 李蕾, 李彦澄, 刘邓平, 等. 基于甲烷氧化菌的难降解有机物生物降解研究进展 [J]. 环境化学, 2020, 39(2): 467-74. doi: 10.7524/j.issn.0254-6108.2019081002 LI L, LI Y C, LIU D P, et al. Advancement overviews on methanotrph-based biodegradation of refractory organics [J]. Environmental Chemistry, 2020, 39(2): 467-74(in Chinese). doi: 10.7524/j.issn.0254-6108.2019081002
[2] 陈建兴, 郭成, 李静, 等. 黄粉虫的生物降解功能研究进展 [J]. 赤峰学院学报, 2018, 34(4): 42-44. CHEN J X, GUO C, LI J, et al. Research progress on biodegradation function of tenderfly [J]. Journal of Chifeng University, 2018, 34(4): 42-44(in Chinese).
[3] 张金宝, 李凤梅, 郭书海, 等. 高分子量多环芳烃降解菌筛选及在土壤电动-生物修复中应用 [J]. 生态学杂志, 2020, 39(1): 260-269. ZHANG J B, LI F M, GUO S H, et al. Isolation of high molecular weight PAHs degrading bacteria and its application in the electro- bioremediation of contaminated soil [J]. Chinese Journal of Ecology, 2020, 39(1): 260-269(in Chinese).
[4] 孔芳, 洪康进, 徐航, 等. 基于啮食泡沫塑料黄粉虫肠道菌群中聚苯乙烯生物降解的探究 [J]. 微生物学通报, 2018, 45(7): 1438-1449. KONG F, HONG K J, XU H, et al. Evidence of polystyrene biodegradation by gut microbiota of Styrofoam-feeding yellow mealworms [J]. Microbiology China Tongbao, 2018, 45(7): 1438-1449(in Chinese).
[5] 周德庆. 微生物学教程[M]. 北京: 高等教育出版社, 2011: 87-88. ZHOU D Q. Microbiology course [M]. Beijing: Higher Education Press, 2011: 87-88 (in Chinese).
[6] 周德庆, 徐德强. 微生物学实验教程[M]. 北京: 高等教育出版社, 2013: 30-32. ZHOU D Q, XU D Q. Microbiology experiment course[M]. Beijing: Higher Education Press, 2013: 30-32 (in Chinese).
[7] SIPOS R, SZEKELY A J, PALATINSZKY M, et al. Effect of primer mismatch, annealing temperature and PCR cycle number on 16S rRNA gene-targetting bacterial community analysis [J]. FEMS Microbiology Ecology, 2007, 60(2): 341-350. doi: 10.1111/j.1574-6941.2007.00283.x [8] 张可, 胡芮绮, 蔡珉敏, 等. 黄粉虫取食和消化降解PE塑料薄膜的研究 [J]. 化学与生物工程, 2017, 34(4): 47-49. doi: 10.3969/j.issn.1672-5425.2017.04.011 ZHANG K, HU R Q, CAI M M, et al. Degradation of plastic film containing polyethylene (PE) by yellow meal worms [J]. Chemistry & Bioengineering, 2017, 34(4): 47-49(in Chinese). doi: 10.3969/j.issn.1672-5425.2017.04.011
[9] 沈叶红. 黄粉虫肠道菌的分离和取食塑料现象的研究[D]. 上海: 华东师范大学, 2011. SHEN Y H. Isolation of intestinal bacteria from T. molitor L and study on the phenomenon of plastic degradation[D]. Shanghai: East China Normal University, 2011 (in Chinese).
[10] YANG Y, YANG J, WU W M, et al. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 1. Chemical and physical characterization and isotopic tests [J]. Environmental Science & Technology, 2015, 49(20): 12080-12086. [11] YANG Y, YANG J, WU W M, et al. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 2. Role of gut microorganisms [J]. Environmental Science & Technology, 2015, 49(20): 12087-12093. [12] 冯静. 白浅灰链霉菌对聚乙烯降解效果研究及降解酶的基因克隆[D]. 成都: 四川师范大学, 2016. FENG J. The study on the degradation of polyethylene by Streptomyces albogriseolus and degradation enzyme gene cloning[D]. Chengdu: Sichuan Normal University, 2016 (in Chinese).
[13] 钟越, 李雨竹, 张榕麟, 等. 一株聚乙烯降解菌的筛选及其降解特性研究 [J]. 生态环境学报, 2017, 26(4): 681-686. ZHONG Y, LI Y Z, ZHANG R L, et al. Screening a polyethylene degrading strain and study on the degradation characteristics [J]. Ecology and Environmental Sciences, 2017, 26(4): 681-686(in Chinese).
[14] GILBERT E S, WALKER A W, KEASLING J D. A constructed microbial consortium for biodegradation of the organophosphorus insecticide parathion [J]. Applied Microbiology Biotechnology, 2003, 61: 77-81. doi: 10.1007/s00253-002-1203-5 [15] MINTY J J, SINGER M E, SCHOLZ S A, et al. Design and characterization of synthetic fungal-bacterial consortia for direct production of isobutanol from cellulosic biomass [J]. National Academy of Sciences, 2013, 110(36): 14592-14597. doi: 10.1073/pnas.1218447110 [16] BRENNER K, YOU L, ARNOLD F H. Engineering microbial consortia: a new frontier in synthetic biology [J]. Trends in Biotechnology, 2008, 26: 483-489. doi: 10.1016/j.tibtech.2008.05.004 -



 下载:
下载: