-
草甘膦(Glyphosate),是目前世界范围内使用最广泛的除草剂[1]。文献[2]认为,草甘膦能够在土壤中因吸附和降解而迅速失活,因此被认为是环境中相对安全的化合物。文献[3-4]统计,2014年时全球范围内草甘膦的使用量达到了826 000 t。20世纪70年代末到2016年,世界范围内的草甘膦使用总量增加了100倍,未来仍有可能进一步增加[5]。由于不正确的应用实践和过量的施用,草甘膦广泛存在于水生和陆地环境中[6]。PESCE et al[7]的研究发现,草甘膦能够改变藻类群落的组成;WONG[8]的研究表明低浓度的草甘膦可以刺激四线藻的生长;还有研究称,草甘膦能够对水体中微藻造成不良影响[9],并有可能造成微生物群落的变化[10]。
塑料在机械作用、生物降解、光降解及光氧化降解作用下,能够被降解为微塑料(microplastics;< 5 mm)以及纳塑料 (nanoplastics;<0.1 µm)[11-12]。目前的城市污水处理技术,无法彻底清除微塑料[13],因此,这种塑料微珠最后常常进入当地的水流、河流和大型贮水池中[14],由于微塑料的持久性强,淡水中的微塑料能够随水体进入海洋并在全球范围内分散,甚至南极洲附近的海域中能探测出微塑料的存在[15]。微塑料自身,因其粒径小,易于被生物摄取,进入生物体的微塑料能够随着食物链进行传递和富集,并可能最终影响整个生态系统[16]。另外,微塑料尺寸小,比表面积大,疏水性强,因此容易吸附及富集多种有机污染物 [17]。此外,带正电荷的氨基修饰的钠聚苯乙烯塑料的毒性高于带负电荷的羧基修饰的钠聚苯乙烯微塑料[18]。当不同粒径的Nano-PS-NH2表面吸附其他有机污染物(菲)后,测试它们对蚤类生物的毒性,结果表明,粒径较小的Nano-PS-NH2(50 nm)显示出最高的毒性和生理损伤[19]。
我国的大多数湖泊及河流等都发生过水华现象,如洪泽湖、太湖和巢湖等[20]。微囊藻是造成蓝藻水华的重要种群之一,而铜绿微囊藻作为一种模式生物,在蓝藻水华中分布最为广泛[21]。对于单细胞藻类而言,光合作用是其生长代谢最重要的过程。光合作用的相关基因如负责编码PSII反应中心蛋白psb各亚基基因、负责编码PSI反应中心蛋白psa各亚基基因、负责编码CO2固定Rubisco酶的基因rbcS和rbcL,它们是控制光反应和暗反应过程的关键基因[22]。
目前对微塑料特别是Nano-PS-NH2与有机污染物的联合毒性的研究还相对匮乏。本研究选择铜绿微囊藻为研究对象,通过批次培养试验研究Nano-PS-NH2与草甘膦在单独暴露及复合条件下对铜绿微囊藻生长、产藻毒素和多种生理功能的调控效应,并选择rbcL、psaB和psbD3个光合作用相关基因,从基因水平上阐述其对铜绿微囊藻的毒理机制。
全文HTML
-
铜绿微囊藻(Microcystis aeruginosa, FACHB-905),购于中国科学院水生生物研究所淡水藻库;培养基为 BG-11(自制),高温高压(121 °C,20 min)灭菌后使用;草甘膦购于安徽东至广信农化有限公司(纯度95.25%);Nano-PS-NH2购于Bangs Laboratories,Inc(含固率10%);SOD试剂盒购自南京建成生物工程研究所;Rnaprotect®细菌试剂盒购于Qiagen, Hilden(德国);柱式细菌总 RNA 抽提纯化试剂盒购于上海生物工程(中国);PrimescriptTM RT reagent kit with gDNA Eraser购于Takara(日本);TB GreenTM Premix Ex TaqTM II (Tli RNaseH Plus)购于Takara(日本)。
-
无菌操作台(SW-CJ-2FD 中国苏净安泰公司);立式高压灭菌锅(LDZX-50KBS 中国上海申安医疗器械厂);恒温光照培养箱(GXM 中国宁波江南仪器厂);pH计(FE28,METTLER TOLEDO);可见分光光度计(SP-2100 中国上海元析仪器有限公司);分析天平(LE104E/02,METTLER TOLEDO);超声波细胞破碎仪(92-IIN 中国宁波新芝生物科技股份有限公司);恒温水浴锅(HH-2 中国常州博远实验分析仪器厂);高速冷冻离心机(3K15 美国Sigma公司);振荡器(ZD-85 中国精达公司);酶标仪(Spark瑞士Tecan公司);qPCR仪(Quantstudio 5美国Thermo Fisher公司);微量紫外-可见分光光度计(Nanodrop One美国Termo Fisher公司)。
-
铜绿微囊藻菌株FACHB-905在高压灭菌的标准BG-11培养基中培养。将配制好的培养基的pH调节至7.2~7.4,分装到250 mL的锥形瓶中,使每瓶中包含150 mL BG-11培养基,并用高压灭菌锅在121 ℃下高压灭菌25 min。灭菌结束后,将培养基静置冷却至室温后接菌。接菌时,按照每150 mL培养基加入1.5 mL铜绿微囊藻母液进行。所有培养体系均在光照培养箱中静置培养(温度:30 °C, 光强:1 800 lux)。用分光光度计测定藻样OD680值,以此表征铜绿微囊藻的生长情况。
-
分别进行草甘膦和Nano-PS-NH2单独暴露下对铜绿微囊藻的毒性作用,以确定草甘膦和Nano-PS-NH2对铜绿微囊藻的EC50。本研究设置3个实验组,即空白对照组,草甘膦急性毒性实验组和Nano-PS-NH2急性毒性实验组。草甘膦实验组共设置了5、10、20、30、40、50 和70 mg/L 7个浓度梯度,Nano-PS-NH2组共设置了1、2、3、4和4.5 mg/L 5个浓度梯度,每个浓度设3个平行。
铜绿微囊藻在接种至新鲜培养基后的1.5 d,分别投加草甘膦和Nano-PS-NH2。草甘膦被溶解在灭菌过的BG-11培养基中,Nano-PS-NH2用灭菌后的去离子水稀释,分别制成储备液以待投加。污染物投加后摇匀,以保证污染物和藻液混合均匀。通过紫外-可见分光光度计在680 nm波长下分别测定在加药后的第0、第1和第2 d铜绿微囊藻的细胞浓度OD680,并计算不同浓度草甘膦和Nano-PS-NH2暴露下铜绿微囊藻的抑制率。
-
根据1.3实验中的结果可以得到草甘膦和Nano-PS-NH2的EC50。在复合毒性实验中,污染物的浓度设置为铜绿微囊藻生长抑制率为30%时对应的浓度。
在复合毒性实验中,共设置4个实验组,分别是空白对照组、草甘膦和Nano-PS-NH2单独暴露组以及草甘膦和Nano-PS-NH2复合毒性组。草甘膦和Nano-PS-NH2单独暴露的实验组中的投加浓度分别为36.31和1.38 mg/L。在复合毒性实验组中,向体系中同时投加相应浓度的草甘膦和Nano-PS-NH2,最终体系中草甘膦的浓度为36.31 mg/L,Nano-PS-NH2的浓度为1.38 mg/L。污染物投加后的第0、第1和第2 d用紫外-可见分光光度计分别测定铜绿微囊藻的OD680。计算各实验组草甘膦和Nano-PS-NH2对铜绿微囊藻的抑制率。在污染物投加48 h后进行后续指标的测定。
-
细胞膜膜通透性使用SYTOX green核酸染料(Invitrogen, USA)来区别破裂的细胞和完整的细胞[23]。SYTOX green核酸染料能渗透入细胞膜受损的细胞并与核酸结合发出强烈的荧光,特别适合革兰氏阴性菌、阳性菌及某些病毒粒子的染色。取适量藻液离心重悬至BG-11 培养基中,并向其中加入SYTOX green染料,使其在体系中的浓度为0.1 μm,并在37 ℃下孵育10 min后于470 nm激发波长和520 nm发射波长下用酶标仪进行检测。
-
取适量铜绿微囊藻藻液,在4 ℃条件下,10 000 r/min离心5 min。去掉上清液,重悬至定量灭菌后的去离子水中,并用液氮反复冻融3次以达到破碎细胞的目的。液氮反复冻融后的藻液在10 000 r/min下离心5 min,取上清并稀释一定倍数后用于SOD的检测。使用超氧化物歧化酶(SOD)测试盒(南京建成生物工程研究所)处理上清液,并在450 nm波长下用酶标仪进行细胞内SOD的测定[23]。
-
取定量藻液,在10 000 r/min下离心5 min,取上清液用于胞外的藻毒素含量。弃去剩余的上清液,胞体重悬在300 μL的去离子水中使细胞涨破,并用液氮反复冻融3次。在10 000 r/min下离心5 min,取上清液用于胞内藻毒素的测定。使用微囊藻毒素(MCs)试剂盒处理胞内和胞外的上清液,并用酶标仪在450 nm下进行测定[24]。
-
取4 mL藻液于10 mL棕色离心管内,10 000 r/min, 4 °C下离心6 min,弃上清,加入90%甲醇溶液4 mL溶解沉淀并涡旋混匀,避光条件下于45 °C恒温震荡24 h,浸提后将藻样10 000 r/min离心6 min,分光光度计测上清液665 nm处吸光值[24]。
-
选择编码光合作用系统的核心蛋白的基因psaB、psbD以及与催化固定CO2相关的基因rbcL3种功能基因作为研究对象。在Nano-PS-NH2和草甘膦投加后48 h进行取样。16s rDNA基因被选作内参基因,用于标准化定量分析功能基因的结果。使用Rnaprotect®细菌试剂盒(Qiagen, Hilden, Germany)和柱式细菌总 RNA 抽提纯化试剂盒(上海生物工程,中国)提取总RNA。在逆转录之前,用PrimescriptTM RT reagent kit with gDNA Eraser(Takara, Japan)以去除RNA中的基因组DNA,以避免基因组DNA带来的影响。通过PCR逆转录反应合成cDNA,于−80 ℃保存。扩增反应的正反引物见表1。将逆转录得到的cDNA适当稀释后用实时定量qPCR进行检测。所有样品重复做3个平行,3种功能基因的表达水平用内参基因16s rDNA
表达水平标准化。测试结果使用2−△△Ct值计算测试组相对于对照组的基因相对表达差异[25]。 -
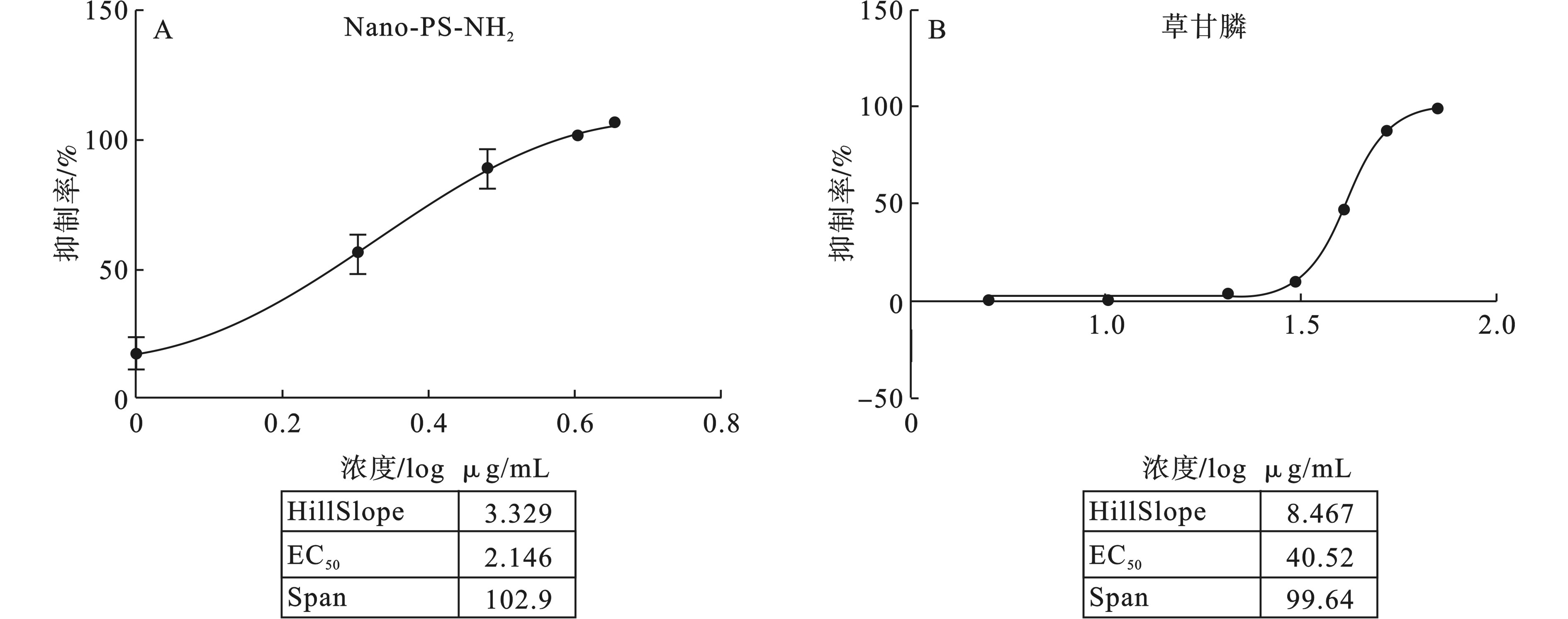
根据抑制率-浓度曲线分别求得草甘膦和Nano-PS-NH2的EC50。抑制率计算方法,见式(1)。
式(1)中,OD空白t为计算时空白组(未投加污染物)的OD值;OD空白0为初始时空白组的OD值;OD实验t为计算时实验组(投加污染物)的OD值;OD实验0为初始时实验组的OD值。
EC50值定义为引起藻类最大抑制率50%时草甘膦或Nano-PS-NH2的浓度,可通过Prism软件将抑制率(%)相对于草甘膦或Nano-PS-NH2浓度的对数作图来拟合与计算获得其对应的EC50。
显著性分析采用双尾t检验,p <0.05时被认为差异是显著,并以*(p <0.05)和**(p <0.01)表示。
1.1. 实验材料
1.1.1. 药品试剂
1.1.2. 仪器设备
1.2. 菌株的培养与测定
1.3. 实验设计
1.3.1. 草甘膦、纳塑料对铜绿微囊藻的急性毒性
1.3.2. 草甘膦与纳塑料对铜绿微囊藻的复合毒性
1.4. 分析方法
1.4.1. 膜通透性的测定
1.4.2. 超氧化物歧化酶(SOD)的测定
1.4.3. 藻毒素(MCs)含量的测定
1.4.4. 铜绿微囊藻中叶绿素a含量的测定
1.4.5. 相关基因的测定
1.5. 数据处理和计算
-
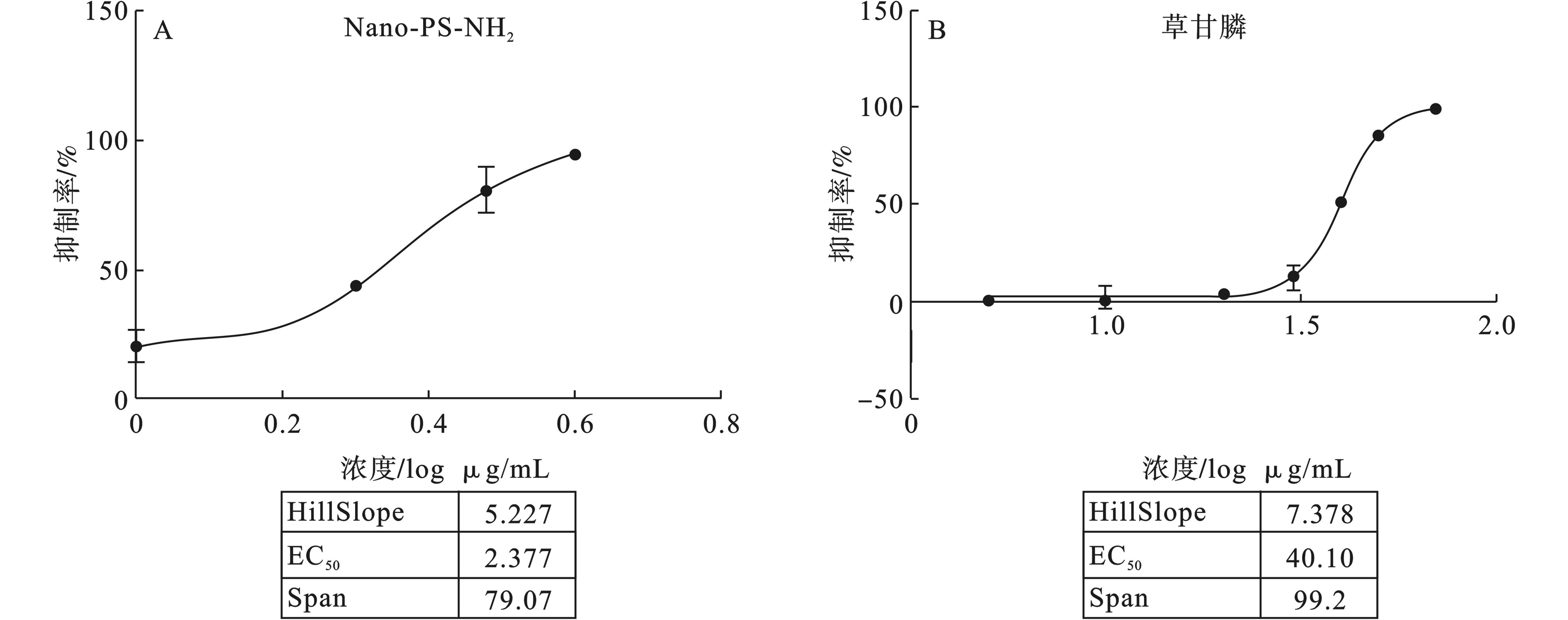
根据第1和第2 d的抑制率-浓度曲线图1和图2的EC50值可以得出,草甘膦在投加到体系后的第1天对铜绿微囊藻的抑制作用最强(EC50越小,抑制作用越强),而Nano-PS-NH2在投加后的第2天对铜绿微囊藻的抑制作用最强。污染物投加后的第1 天,Nano-PS-NH2的EC50为2.377 mg/L,草甘膦的EC50为40.10 mg/L。污染物投加后的第2 天,Nano-PS-NH2的EC50为2.146 mg/L, 草甘膦的EC50为40.52 mg/L。
-
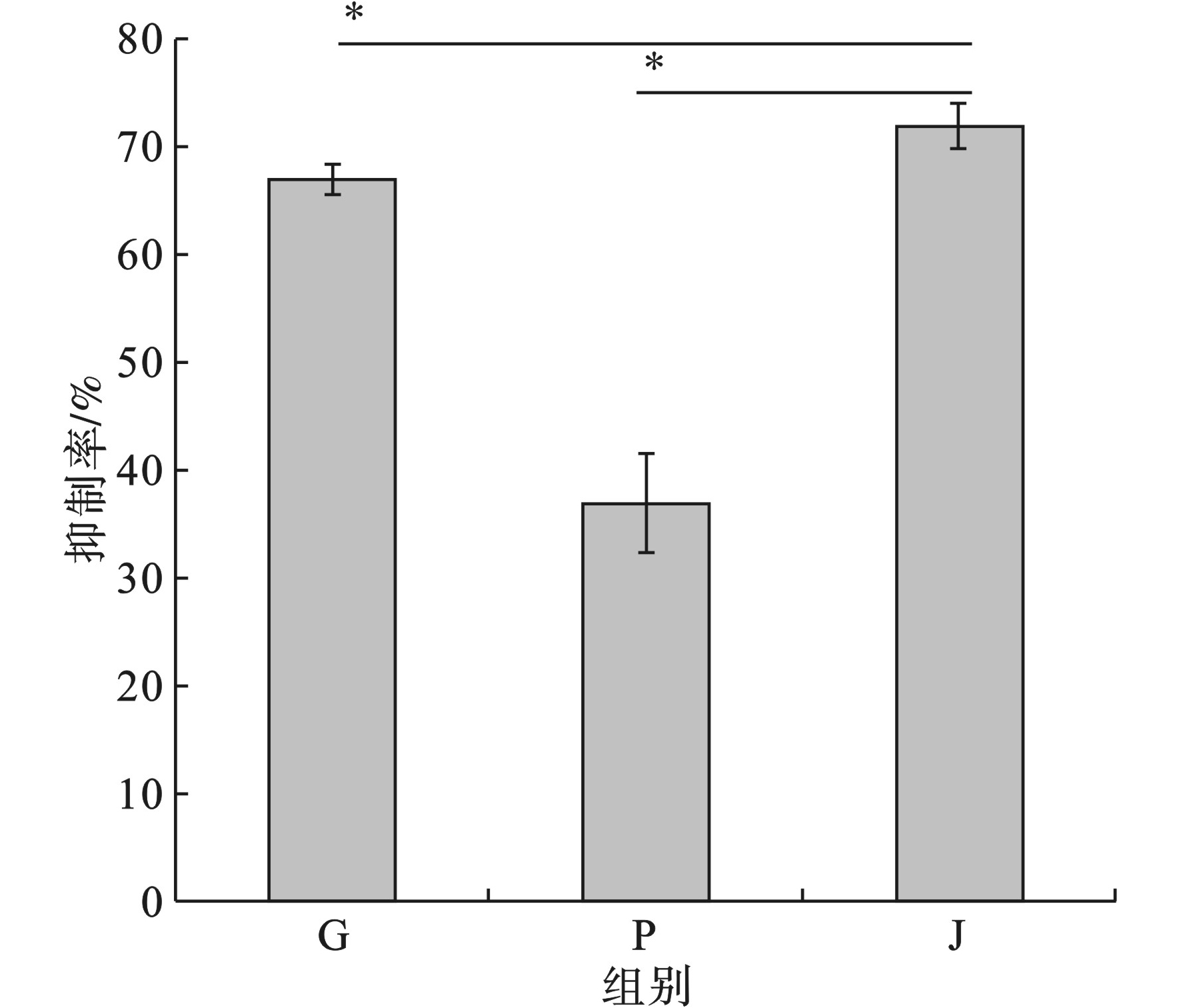
在复合毒性实验中,污染物的浓度设置为铜绿微囊藻生长抑制率为30%时对应的浓度。根据急性毒性实验中的抑制率-浓度曲线可以得出草甘膦对铜绿微囊藻的生长抑制率30%时的浓度为36.31 mg/L,Nano-PS-NH2对铜绿微囊藻的生长抑制率30%时的浓度为1.38 mg/L。
污染物投加后48 h 时,单独暴露草甘膦的实验组中草甘膦对铜绿微囊藻的生长抑制率为66.9%,单独暴露Nano-PS-NH2的实验组抑制率为37.1%,复合毒性实验组的抑制率为71.9%。其中复合毒性实验组与草甘膦和Nano-PS-NH2单独暴露的实验组相比,抑制率均有显著性差异(p<0.05),图3。
图3可见,草甘膦和Nano-PS-NH2复合毒性实验组对铜绿微囊藻的生长抑制作用均高于草甘膦和Nano-PS-NH2单独暴露下对铜绿微囊藻的抑制作用,其中草甘膦和Nano-PS-NH2的复合毒性对铜绿微囊藻的抑制作用略高于草甘膦单独暴露下对铜绿微囊藻的抑制作用,而远高于Nano-PS-NH2暴露下对铜绿微囊藻的抑制作用。草甘膦和Nano-PS-NH2联合暴露下对铜绿微囊藻的生长抑制作用最强,由于复合毒性小于二者毒性之和,故而其复合毒性作用体现为拮抗作用,在实际环境中两者的相互作用可能造成更严重的危害。
-
在污染物投加48 h后,测定草甘膦和Nano-PS-NH2对膜通透性造成的影响,见图4。
图4中无论是草甘膦和Nano-PS-NH2单独暴露还是联合暴露下的实验组,与空白对照组相比都对细胞膜造成了更强的损伤,导致膜通透性增强(p<0.05)。但复合毒性实验组与单独暴露实验组之间对膜通透性的影响均没有显著性差异(p>0.05)。
这一结果说明了Nano-PS-NH2和草甘膦都通过破坏细胞膜对铜绿微囊藻产生毒性,抑制了铜绿微囊藻的生长。
-
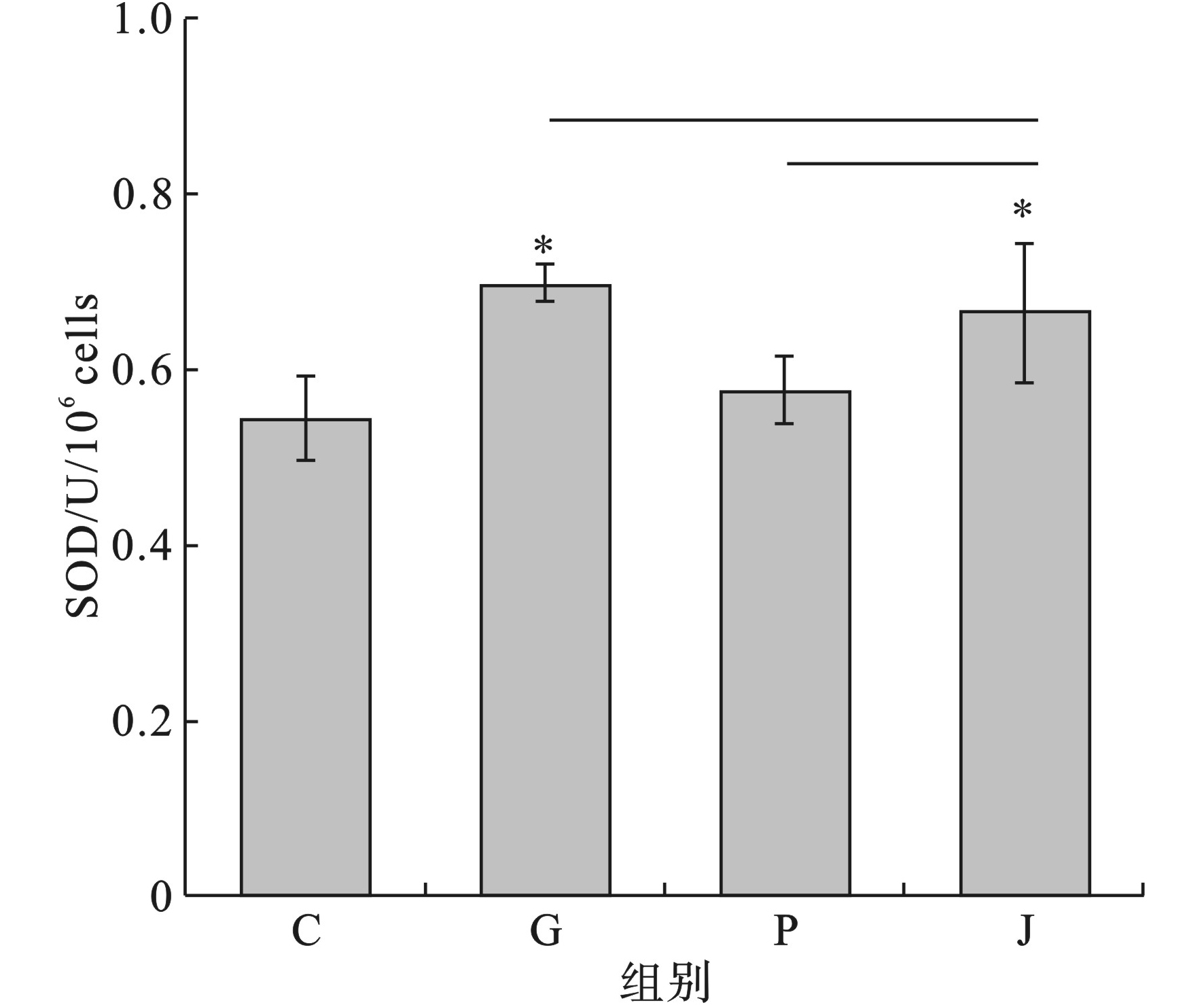
在污染物投加48 h后,测定空白组和实验组细胞内SOD的含量水平,见图5。
空白对照组细胞内SOD的含量为0.54 U/10^6 cells,草甘膦单独暴露组、Nano-PS-NH2单独暴露组、复合毒性实验组细胞内SOD含量分别为0.70、0.57和0.66 U/10^6 cells。所有实验组较空白对照组SOD的含量均有所升高。其中草甘膦单独暴露下和草甘膦与纳塑料联合暴露下细胞内SOD的含量水平与空白对照组之间有显著性差异(p<0.05)。
文献[26]报道,微米或纳米级的银颗粒或碳纳米管可以使藻类的活性氧(ROS)水平升高,导致藻类氧化应激,从而抑制藻类生长。也有研究发现,在加入化感物质后,铜绿微囊藻的SOD活力在12 h时稍升高,但随着时间的推迟SOD的活力开始显著降低[27],这种变化与观察的时间及细胞初期的应激反应有关[28]。
-
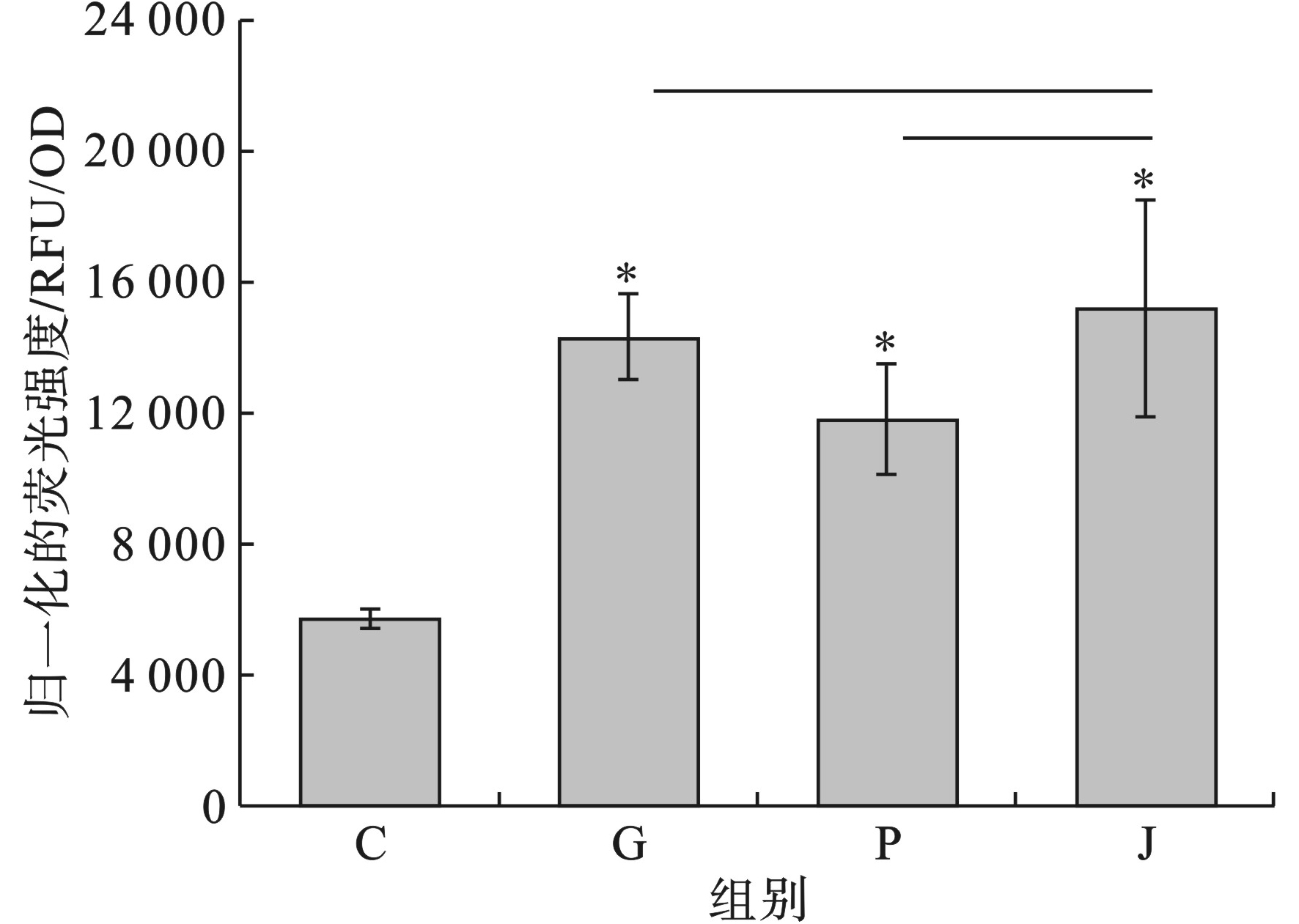
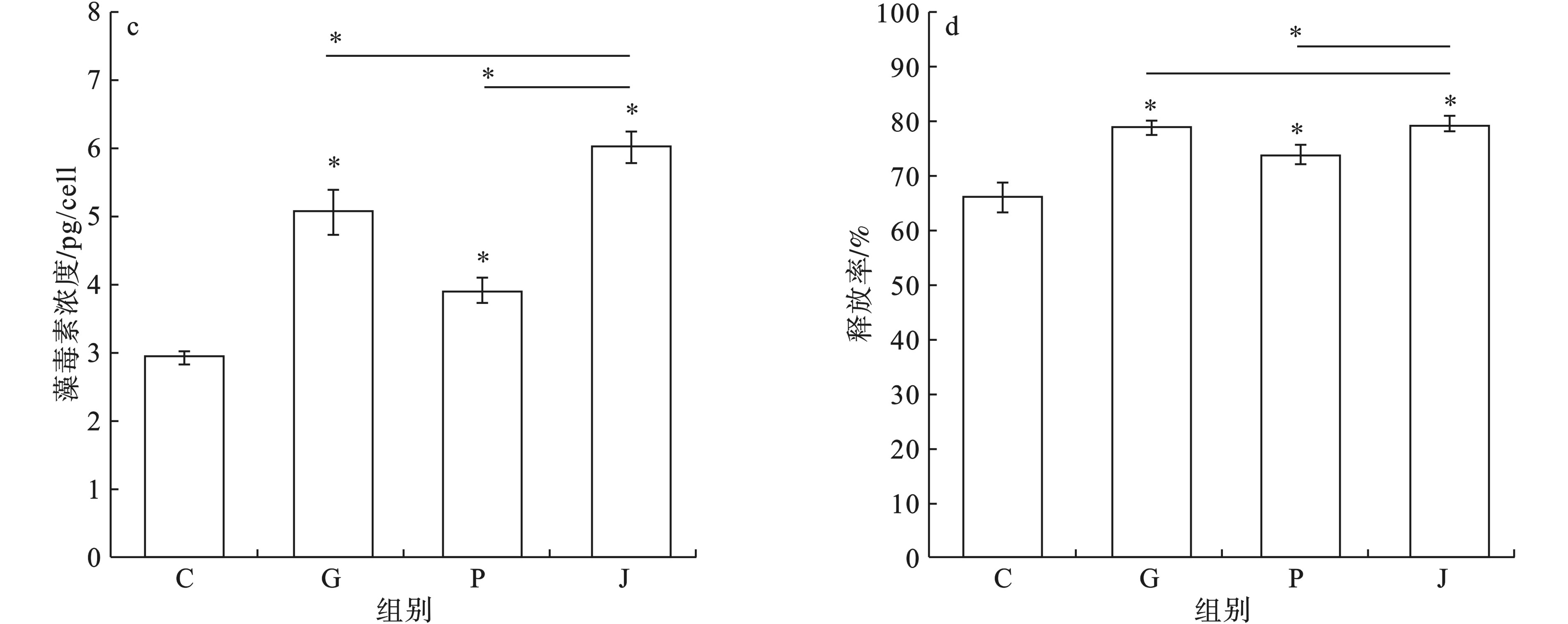
污染物投加48 h后,测定空白对照组和实验组胞外(a)、胞内(b)和总藻毒素(c)的释放水平以及释放率(d),见图6。
空白对照组、草甘膦单独暴露组、Nano-PS-NH2单独暴露组和复合毒性实验组中铜绿微囊藻细胞外藻毒素释放水平分别为1.95、4.03、2.92 和4.79 pg/cell;胞内藻毒素的含量分别为0.99、1.05、1.01和1.22 pg/cell;总藻毒素释放量分别为2.99、5.08、3.93和6.03 pg/cell;胞外藻毒素释放率分别为66.39%、79.29%、74.28%和79.83%。
与空白对照组相比,所有实验组的胞外藻毒素释放量都明显升高(p<0.05)。草甘膦和Nano-PS-NH2联合暴露实验组比单独暴露2种污染物胞外藻毒素的含量显著升高(p<0.05)。而对于胞内藻毒素的含量,单独暴露草甘膦和Nano-PS-NH2的实验组与空白组之间没有显著性差异(p>0.05),草甘膦和Nano-PS-NH2联合暴露的实验组与空白对照组相比,胞内藻毒素含量明显升高(p<0.05),且均明显高于单独暴露2种污染物的实验组胞内藻毒素的含量(p<0.05)。所有实验组的胞内和胞外藻毒素的释放总量均较空白对照组明显提高(p<0.05),草甘膦和Nano-PS-NH2联合暴露实验组藻毒素总释放量高于单独暴露草甘膦和Nano-PS-NH2时藻毒素的释放总量,且有显著性差异(p<0.05)。对于胞外藻毒素释放率,草甘膦和Nano-PS-NH2的暴露下,胞外藻毒素的释放率都显著上升(p<0.05)。草甘膦和Nano-PS-NH2联合暴露下,胞外藻毒素的释放率比单独暴露草甘膦,略微升高(P>0.05),比单独暴露Nano-PS-NH2下显著升高(P<0.05)。
综上,Nano-PS-NH2和草甘膦对铜绿微囊藻藻毒素的释放量有一定促进作用,其中草甘膦和Nano-PS-NH2联合暴露对藻毒素的释放促进作用最强。
微囊藻毒素对脊椎动物有很强的肝脏毒性[29],并能在生物体内积累沿着食物链向更高级的消费者传递[30],引起动物和人类的中毒事件[31]。2种污染物单独暴露和联合暴露下,铜绿微囊藻藻毒素的释放量均有明显提升,铜绿微囊藻的藻毒素释放水平在草甘膦和Nano-PS-NH2的复合毒性作用下相比草甘膦和Nano-PS-NH2单独作用有了更显著的升高。这说明草甘膦和Nano-PS-NH2的复合毒性作用可能对环境造成更严重的藻毒素污染。
-
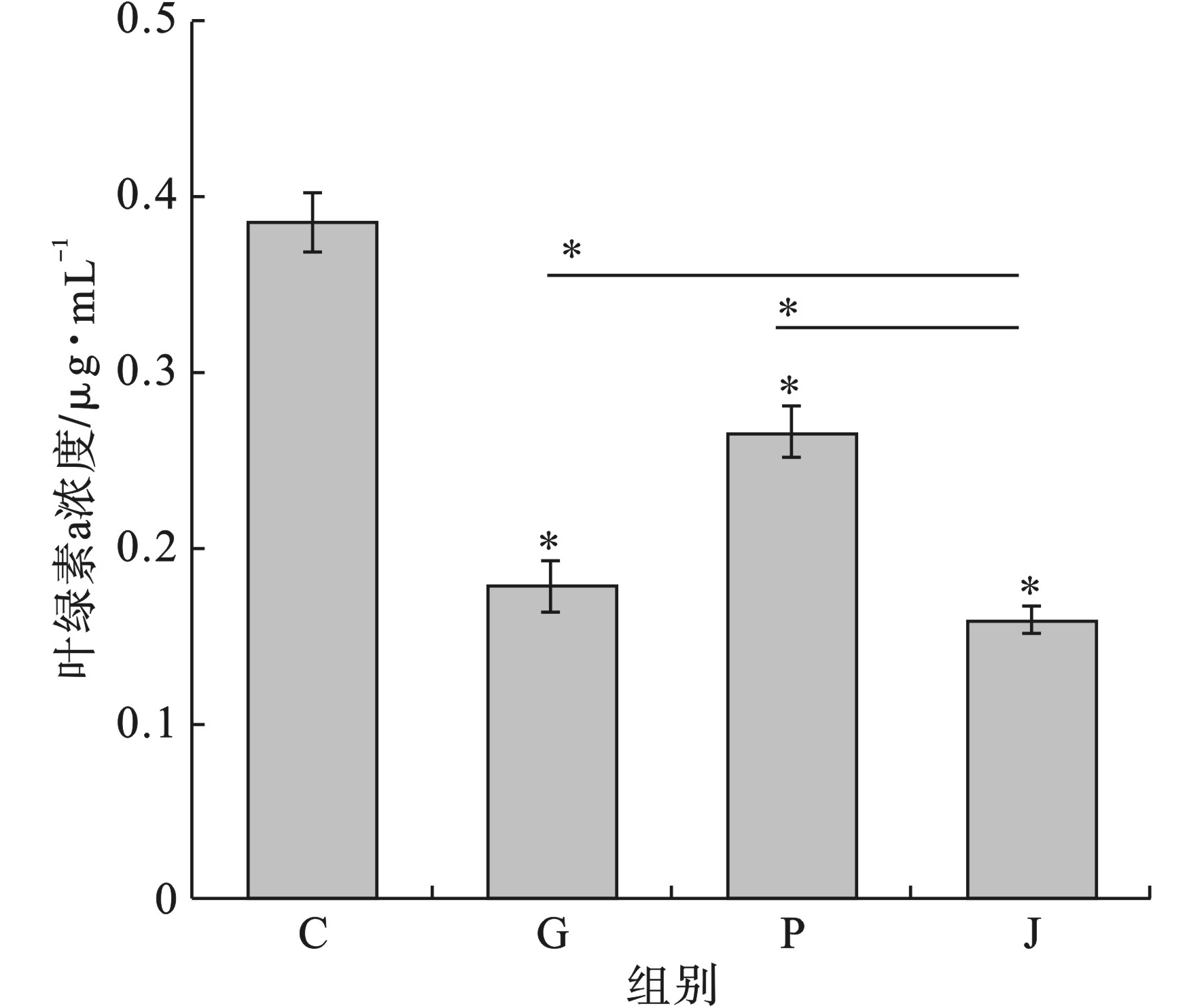
在污染物投加48 h后,测定草甘膦和Nano-PS-NH2对叶绿素a含量的影响,见图7。
空白对照组、草甘膦单独暴露组、Nano-PS-NH2单独暴露组、联合暴露草甘膦和Nano-PS-NH2实验组中叶绿素的含量分别为0.38、0.18、0.26和0.16 μg/L。所有实验组的叶绿素a含量均明显低于空白对照组的叶绿素a含量(p<0.05),且草甘膦和Nano-PS-NH2联合暴露组叶绿素a的含量明显低于草甘膦和Nano-PS-NH2单独暴露下的叶绿素a含量(p<0.05)。
光合作用是藻类进行生物质合成和产能的基础,BHATTACHARYA et al[32]经过对海洋中的绿藻的研究发现,表面带电的Nano-PS-NH2微粒可以在绿藻表面聚集并影响藻类的光合作用[33]。还有研究结果表明,酰胺类除草剂丁草胺可以作为电子传递的抑制剂抑制光合作用中的希尔反应和植物的呼吸作用[32]。对于藻类而言,纳塑料已经被证明可以减少二氧化碳的吸收并提高活性氧(ROS)的含量水平,Nano-PS-NH2还会降低藻类的种群增长和叶绿素浓度[34]。当铜绿微囊藻暴露在氨基修饰的聚苯乙烯Nano-PS-NH2中时,Nano-PS-NH2颗粒可以进入细胞并导致溶酶体损伤,细胞溶胶中的溶酶体内含物被释放出来,进而导致细胞的凋亡[35]。
一些研究表明,Nano-PS-NH2还会影响调控细胞氧化应激过程的基因的表达,Nano-PS-NH2在人脑星形细胞瘤1321N1细胞S39中激活cas3和cas7[36]。
-
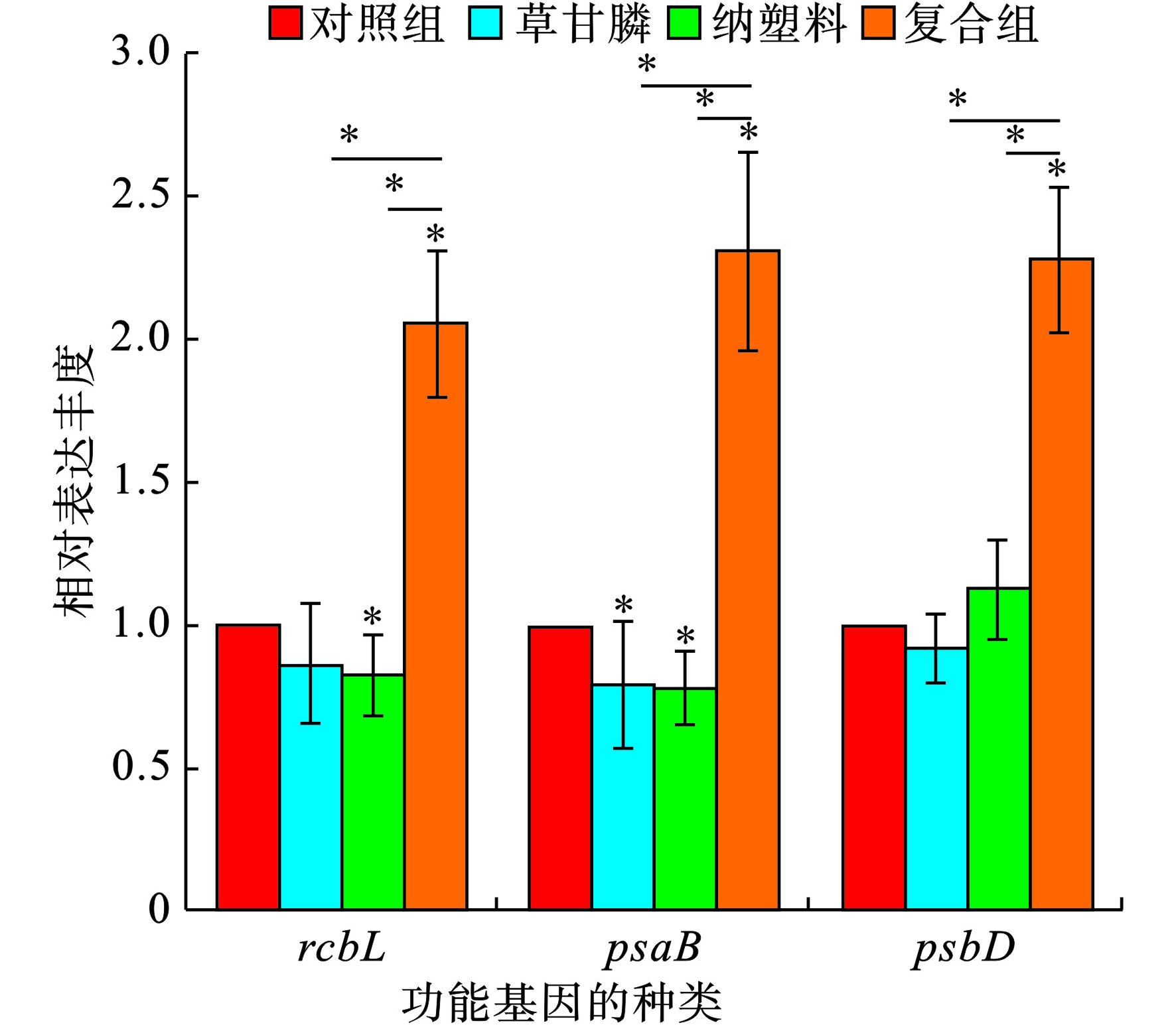
在草甘膦和Nano-PS-NH2不同暴露情况下,测定了对光合系统PSⅠ和PSⅡ反应中心蛋白编码基因(psaB和psbD)、催化固定CO2相关的基因rbcL的相对表达量产生的影响,见图8。
在草甘膦单独暴露下,铜绿微囊藻光合作用相关蛋白的编码基因psaB的表达量显著下降(P<0.05),光合作用相关蛋白的编码基因psbD和下游催化固定CO2相关的基因rbcL的表达量未受其干扰。Nano-PS-NH2单独暴露48 h之后,基因psaB和rbcL的表达量显著下降(P<0.05)。在草甘膦和Nano-PS-NH2联合暴露实验中,基因psaB、psbD和rbcL的表达量显著上升(p<0.05),其相对表达丰度分别为2.055、2.309和2.280。这可能是因为在草甘膦和Nano-PS-NH2的联合暴露下,由于污染物对铜绿微囊藻的强烈胁迫作用,光合作用系统产生了应激反应,psaB、psbD和rbcL基因的上调促进了生物质的合成以抵御外界污染物对藻细胞的刺激。
陈诗[30]的研究表明psbA和rbcL表达水平与阿莫西林的暴露浓度成正相关关系,psbA表达上调可促进D1蛋白的合成,加速电子传递,从而导致rbcL表达的上调。一些研究还表明,Nano-PS-NH2颗粒会对参与细胞应激反应相关的基因的表达产生影响,如PS-COOH会促进Abcb1基因的表达水平上调,Nano-PS-NH2会诱导基因cas8
表达水平的上调,这些基因表达量的变化与细胞凋亡的机理息息相关[37]。
2.1. EC50的确定
2.2. 草甘膦与纳塑料对铜绿微囊藻的复合抑制作用
2.3. 膜通透性的影响
2.4. 超氧化物歧化酶(SOD)的测定
2.5. 胞内、胞外藻毒素(MCs)含量的测定
2.6. 叶绿素a含量的测定
2.7. 相关基因的表达
-
草甘膦和Nano-PS-NH2联合暴露下对铜绿微囊藻的抑制作用最强,且草甘膦和Nano-PS-NH2对铜绿微囊藻的毒性作用体现为拮抗作用。草甘膦和Nano-PS-NH2单独暴露、复合作用下,均可对细胞膜造成损伤、降低叶绿素a含量,这表明草甘膦和Nano-PS-NH2可能通过抑制铜绿微囊藻的光合作用从而抑制铜绿微囊藻的生长。此外,草甘膦和Nano-PS-NH2能够激活铜绿微囊藻的氧化应激反应,提高细胞的SOD水平;草甘膦和Nano-PS-NH2均可以促进铜绿微囊藻藻毒素的释放,草甘膦和Nano-PS-NH2联合暴露时藻毒素的释放量最高。
Nano-PS-NH2和草甘膦单独暴露下,光合作用核心蛋白编码基因psaB和psbD、催化固定CO2的相关基因rbcL的表达量较空白对照组基本都有所下调;草甘膦和Nano-PS-NH2联合暴露下,光合作用核心蛋白编码基因psaB和psbD、催化固定CO2的相关基因rbcL的表达量较空白对照组均显著大幅度上调。这可能是因为铜绿微囊藻通过上调光合作用相关基因的表达保护藻细胞免受草甘膦和Nano-PS-NH2的过度损伤。



 下载:
下载: