-
填埋场作为陆地上重要的次生生态系统,微生物群落在其稳定化过程中发挥了重要作用。其通过同化和异化作用,广泛地参与到生活垃圾的降解过程[1-2]。堆体的非均质性与介质理化条件的变化胁迫微生物群落向结构复杂化、功能多样化的方向演替。以“场”的形式量化复杂的环境条件,从而刻画其中微生物群落分布规律及其对介质空间结构的影响,并识别关键驱动因子以及探究群落组装机制,对调节填埋场内复杂的生化反应以加速垃圾稳定化具有重要意义[3]。
现有研究主要关注不同垃圾理化性质对填埋场微生物群落结构的影响[4]。例如,利用高通量测序技术,筛选填埋场中优势菌属[1, 5-6];采用功能预测分析,了解填埋场微生物的潜在功能[7-11];借助统计学方法,识别影响微生物群落结构的驱动因子[12-15]。绝大多数研究局限于实验室模拟或场区同层垃圾调查,忽视了填埋场作为一个复杂体系,微生物群落会受到压力场、温度场以及渗流场等多场作用的影响。而由于地形和经济等因素影响,我国众多填埋场堆高达十余米,部分甚至超过30 m[16-17]。随着填埋高度的增加,垃圾上覆压力逐渐增大,垃圾孔隙率和饱和度等将出现分层现象,直接影响营养物质的纵向迁移,可能导致微生物群落结构和有机物降解等产生变化[18-20]。有机质的丰度和种类决定了其微生物利用效率,已有研究指出有机质源对微生物群落具有选择性,这将对小生境内的微生物的群落结构和代谢功能产生影响[21-22]。因此,针对填埋场压力场作用下垃圾组分对细菌群落的影响,仍需展开进一步系统研究。
考虑填埋场长周期、非均质、大尺度等特点,本研究以浙江省某实际填埋场为例,旨在探究压力场作用下垃圾有机组分对微生物群落的影响。运用中性群落模型、网络分析以及随机森林算法,解释微生物的组装机制,并推测其中的关键功能属,为强化填埋场生物降解实现加速稳定化提供实践基础。
-
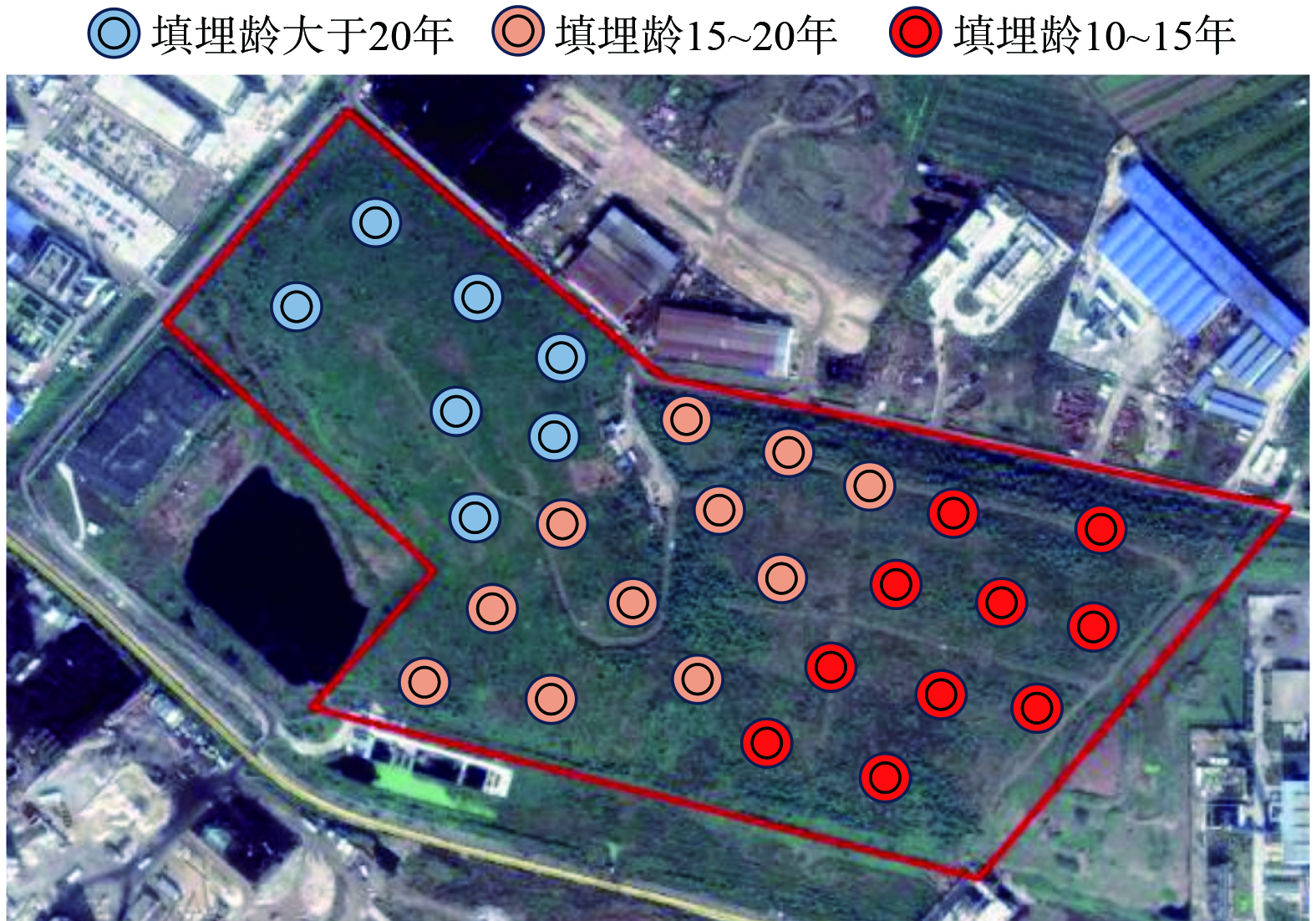
垃圾样品全部取自位于浙江省东南沿海某主要接收生活垃圾的填埋场,该场地经过初步整改后于2013年封场,服务期限共计14年,其中,垃圾存量约154×104 t,垃圾层平均最大埋深约为15 m,初始压实密度约为650 kg·m−3,垃圾含水率均值为40.3%,作业方式采用分区填埋。目前该场地大部分区域仍处在慢速产甲烷阶段,各监测点的甲烷浓度从0.14%~17.48%不等,高甲烷排放 (甲烷浓度>10.0%) 集中在填埋场的东部区域 (填埋龄10~15年) ,均值为12.4%;中部区域 (填埋龄为15~20年) 的甲烷排放浓度均值为5.8%;而西部区域 (填埋龄10~20年) 的甲烷排放低 (甲烷浓度≤1%) 。
-
为确保采样工作不会破坏填埋场底部的防渗系统,综合考虑堆体勘探结果及相关规定,选取的代表性点位如图1所示。根据采样点的垃圾埋深和压实密度,上覆压力可划分为3个区间<30 kPa、30~80 kPa、>80 kPa。收集到的样品先以四分法进行缩减,随后手动去除其中的惰性组分,如塑料、金属、石块等,最后得到约1 kg的样品,装入到无菌密封袋中,保存在−80 ℃下,尽快运送至实验室进行下一步分析。
-
基于Illumina MiSeq平台,对收集到的垃圾样品进行16S rRNA高通量测序。采用了Power Soil DNA分离试剂盒 (Mo Bio Laboratories, Solana Beach,CA,USA) 进行垃圾样品的DNA基因组提取。开展琼脂糖凝胶电泳实验用于提取物的检查,DNA提取物浓度和纯度的鉴定是用NanoDrop2000紫外分光光度计 (Thermo Scientific,Wilmington,USA) 完成的。使用引物338F (ACTCCTACGGGAGGCAGCAG) 和806R (GGACTACHVGGGTWTCTAAT) 对细菌16S rRNA的V3~V4高变区进行了PCR扩增,PCR扩增步骤采用了GeneAmp®
9700 程序 (Foster City,California,USA) 。接着,利用Axy Prep DNA凝胶提取试剂盒 (Promega,USA) 对PCR产物进行了提取、纯化和定量。采用UPARSR 7.1对操作分类单元OTU进行了聚类,去除了嵌合序列。根据上海美吉生物医药科技有限公司的标准方案,将经过纯化的扩增子在Illumina MiSeq PE300平台或NovaSeq PE250平台 (Illumina,San Diego,USA) 上进行等摩尔和配对末端匹配,设置对比阈值为70%,从而获得物种分类注释的结果。 -
测试了不同点位的垃圾有机质、BDM、纤维素以及木质素含量。有机质的测定参照标准CJ/T 96-2013采用灼烧法进行;生物可降解物 (BDM) 参照标准GB/T 23857-2009采用重铬酸钾滴定法进行;纤维素、木质素的测定采用范氏 (Van Soest) 洗涤纤维分析法[23]。每种测试重复3次后取平均值作为结果。
-
使用UPARSE 7.1版本对操作分类单元 (operational taxonomic unit,OTU) 进行优化处理和分类。剔除未被识别分类的细菌后,SPSS用于有机组分测定数据的显著性检验 (*代表p<0.05,**代表p<0.01,***代表p<0.001) ,使用Cytospace软件绘制细菌OTU的分类树状图,用于填埋场中微生物群落结构的可视化;使用R语言的Picante包分析不同样本中细菌群落α多样性;使用Vegan软件包进行冗余分析 (RDA) ,以反映不同样品之间的差异以及微生物与环境因子之间的关系;微生物网络模式图和拓扑分析是用Gephi软件绘制的,其能够分析微生物群落中的物种共现模式;中性群落模型用于量化随机过程在微生物群落组装中的重要性,以阐明共存物种的生态机制;采用随机森林算法评价细菌属的重要性程度。所有统计分析均在R环境下完成。
-
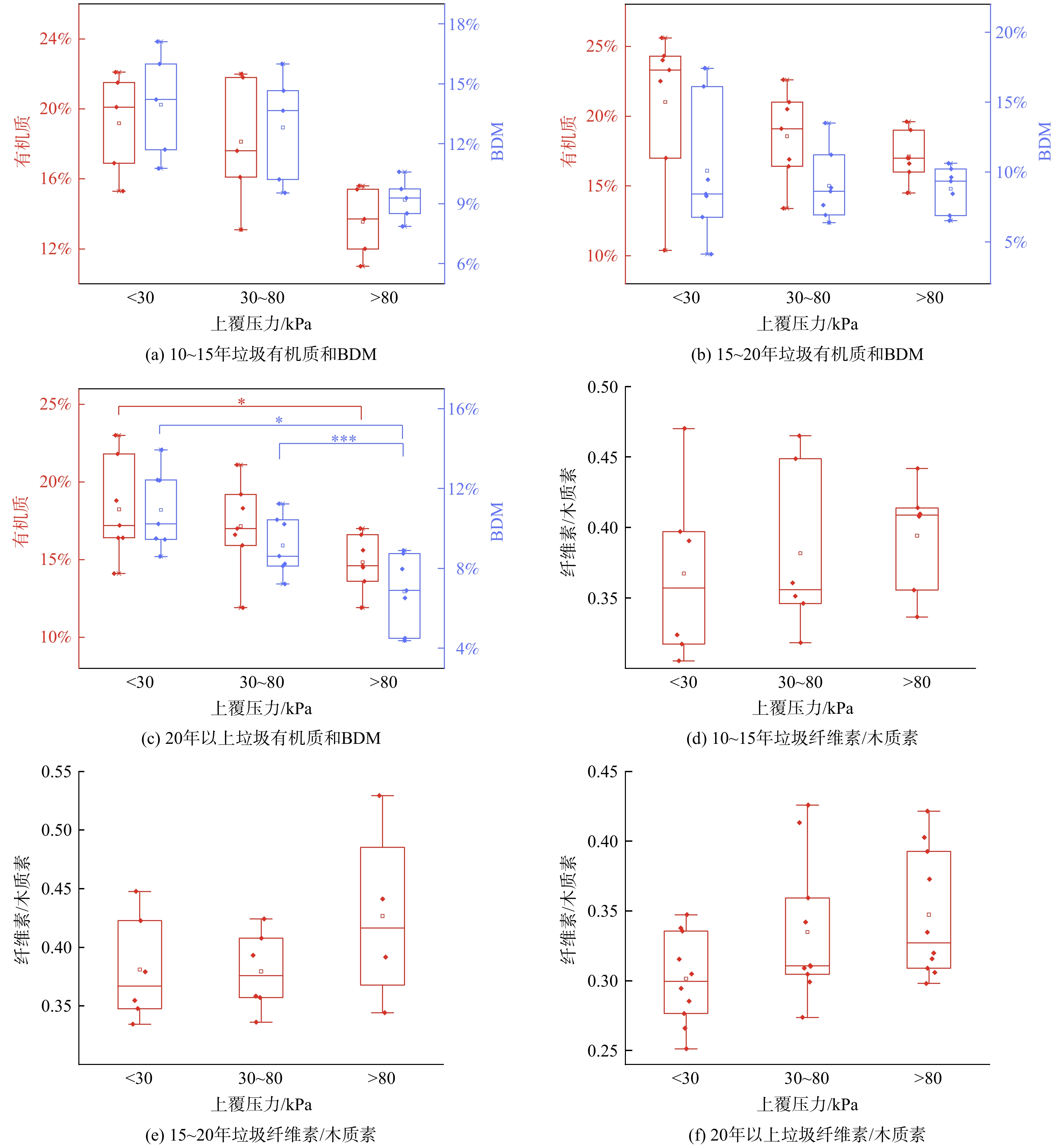
根据填埋单元区分不同垃圾样品中有机质、BDM、纤维素/木质素的变化与上覆压力的关系如图2所示。有机质的变化范围为10.41%~26.75%、BDM为4.10%~18.43%、纤维素/木质素为0.31~0.47。在不同填埋单元中,有机质与BDM总体呈现出随压力的增加,含量逐渐减少的趋势。当初始压缩密度一定时,上覆压力的大小由埋深决定,并且埋深与垃圾中的有机组分的关系受到填埋方式的影响。对于采用分区填埋工艺的填埋场来说,同一填埋单元中垃圾填埋龄与垃圾组分的变化有限。当垃圾理化性质相差不大时,此时影响细菌群落分布的重要因素可能是压力场的作用,上覆压力的变化显著影响了垃圾堆体的力学性质,特别是孔隙度和渗透系数,这将直接影响堆体内生化反应的接触面积。上覆压力与孔隙度和渗透系数呈反比,而堆体底部区域受到最大的上覆压力,因此具有更大的压实密度以及更小的孔隙度和渗透系数,其出现渗滤液淤积和填埋气滞留的可能性大,在这种固液气三相共存的环境下,堆体内可能产生明显高于大气压的压力场。较高的压力可能会改变物质的溶解度,生物膜的流动性以及微生物的生长速率,从而塑造堆体内的细菌群落分布[18, 24]。上覆压力的增加,还将一定程度上增大微生物与垃圾的接触面积,并增强传质效果,从而更好地降解其中的有机质[13]。相对于浅层垃圾,深层垃圾还会受到渗滤液沥滤的影响,导致有机质含量的下降[19]。
-
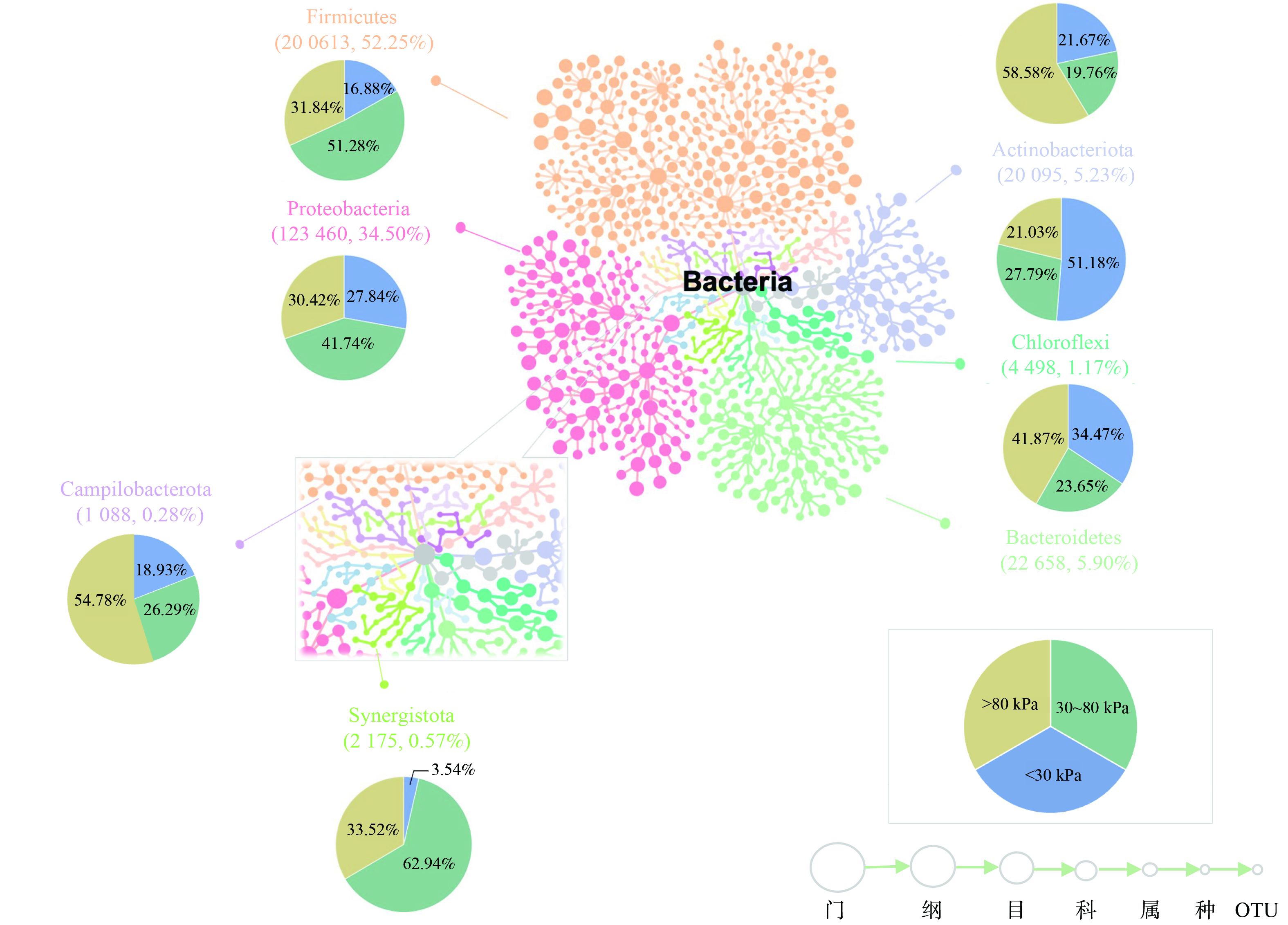
为直观展现不同上覆压力与垃圾有机组分下的细菌群落结构,对注释的门进行了统计分析。共获得3 189 653个有效序列,识别出59个门。根据97%序列相似性阈值,1 717 376个高质量序列被分类为4 232个OTU,平均覆盖率为99.40%。按照不同上覆压力划分区间,将分类学树状图与饼图结合 (图3) 用于揭示在门水平上细菌OTU分布最多的类型以及单一门类微生物在不同压力下的丰度的变化。Firmicutes在堆体内的微生物群落中具有显著数量优势 (52.25%) ,其它高丰度 (丰度>2%) 的微生物门类还包括: Proteobacteria (34.50%) 、Bacteroidetes (5.90%) 和Actinobacteriota (5.23%) ,它们是垃圾填埋场中常见的微生物,已在多项研究中被识别为优势菌门,它们能够广泛地参与到堆体内有机污染物的降解过程中[5, 25-26]。
按照上覆压力分区,压力区间在30~80 kPa主要分布的门类是Firmicutes、Proteobacteria和Synergistota,丰度随压力变化总体呈现出先增加后减少的趋势;而Bacteroidetes、Actinobacteriota和Campilobacterota倾向于在相对高上覆压力区域富集;Chloroflexi则在小于30 kPa的区域中富集。由于堆体的非均质性,生境内有机物的种类和含量可能决定了群落演替的方向,有机组分的分布将影响群落结构[8]。Bacteroidetes已被证实能够利用复杂难降解的有机物,而Firmicutes和Proteobacteria倾向于利用易降解有机物[4]。这可能是BDM与优势门类丰度随上覆压力变化的原因,即Firmicutes和Proteobacteria倾向于在易降解的高有机质的低上覆压力区域富集;而Bacteroidetes更能适应有机质含量低且难降解的逆境,从而在贫有机质的底层 (>80 kPa) 占据优势地位[27]。
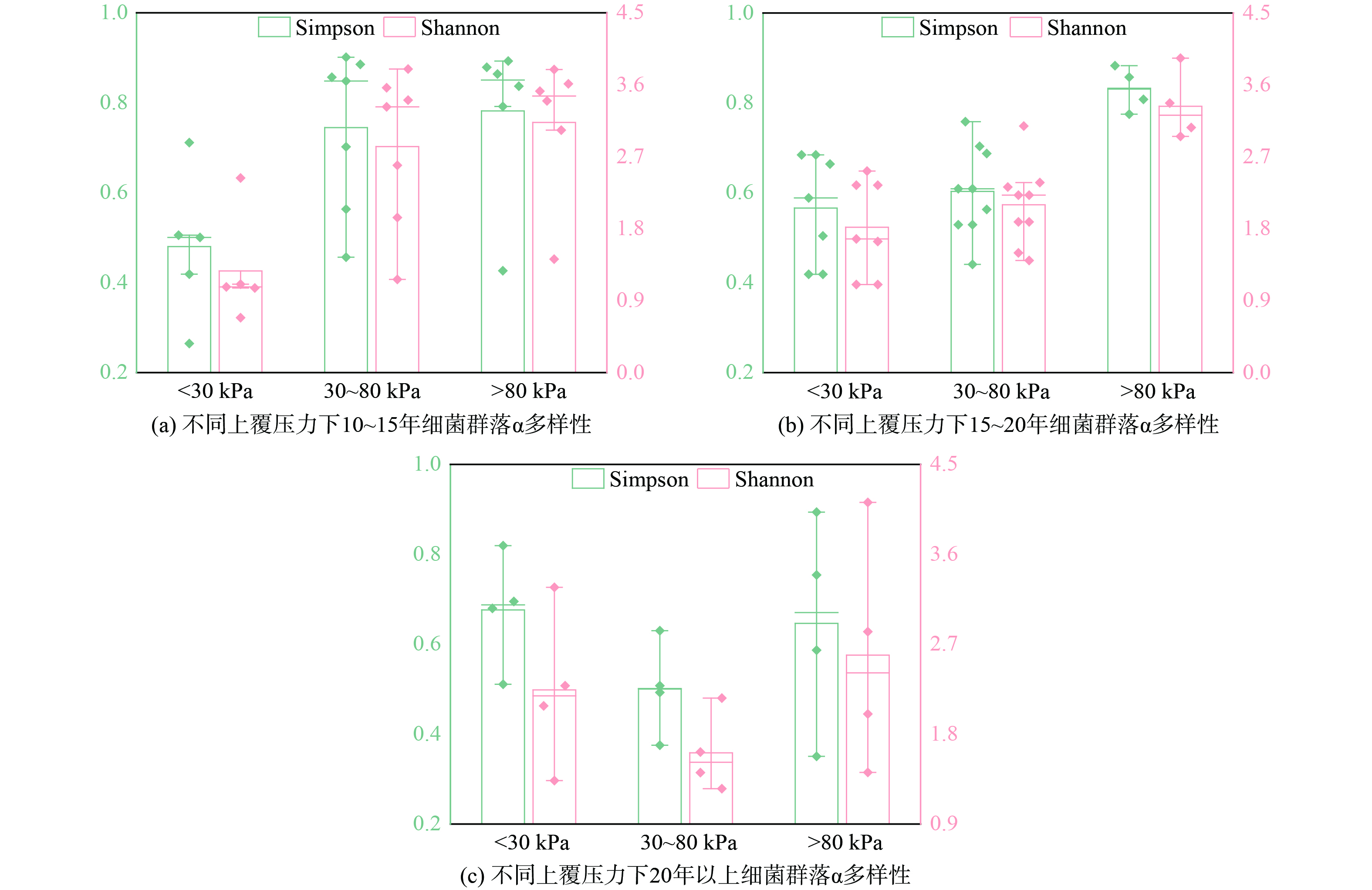
在不同填埋单元中,细菌群落的多样性(图4)呈现出一定的差异。对于填埋时间小于20年的堆体,细菌群落的多样性随上覆压力的增加而增加,这可能与渗滤液通常在堆体底部淤积有关[28]。细菌群落的生长繁殖通常需要较高的含水率,因此该视角下这一区域可能更适宜微生物生存。此外,上覆压力小于80 kPa的区域,其有机组分含量较高,这可能会导致少数优势菌群占据支配地位。大于20年的堆体其表层垃圾中的细菌多样性较高,这可能与氧气入侵堆体,使得更多好氧菌群在这一区域生存繁衍导致[29]。
-
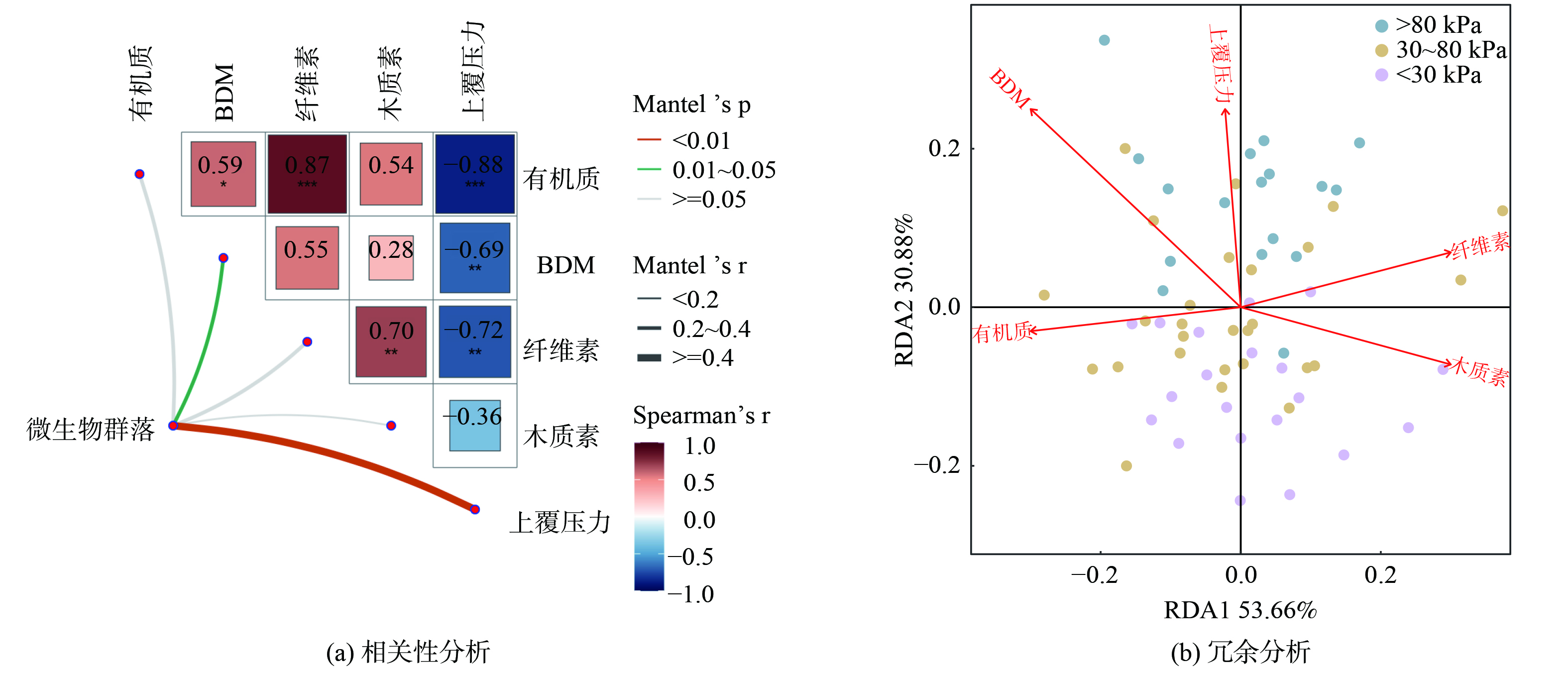
分别从整个堆体和不同压力梯度两个尺度下,研究垃圾有机组分与细菌群落的关联程度,图5展示了细菌群落与有机组分和上覆压力之间的相关性分析和RDA分析。相关性分析的结果表明,上覆压力与整个细菌群落的相关性最为显著 (R=0.51,p<0.01) ,这也在侧面印证了不同压力区间下的群落分组探讨的合理性。垃圾的BDM与群落也具有显著相关性 (R=0.31,p<0.05) ,而有机质、纤维素和木质素并未与微生物群落建立起相关性关系。RDA结果指出,纤维素含量和BDM对于处在上覆压力超过80 kPa下的细菌群落的影响更为显著,而在不足80 kPa区间内,群落更多的受到有机质含量的影响。
垃圾中的有机组分作为填埋场中主要的碳源,影响着细菌群落的空间演替[9]。XU等[30]的研究指出,Bacteroidetes在填埋场中的重要功能之一是降解纤维素、多糖等物质,因此在以Bacteroidetes为优势菌群的底层微生物群落中,纤维素作为碳源,成为了影响底层群落结构的重要环境因子。而在堆体的表层 (<30 kPa) 和中层 (30~80 kPa) ,尽管有机质相对富足,但微生物对有机质的竞争仍较为激烈,LI等[12]的研究也得到了相似的结论。由于塑料垃圾比例的不断提升,导致部分点位可能出现高有机质,低BDM的情况,因此即使在有机质含量相对较高的区域,微生物竞争易降解有机物十分激烈,这可能是有机质作为影响中层、表层堆体中细菌群落结构的重要环境因子之一的原因[6, 31-32]。另外,上覆压力的变化使得不同埋深下的垃圾呈现出压实密度梯度,这可能会影响营养物质在堆体内的迁移过程。而营养物质在随渗滤液迁移的过程中,在堆体内将产生与压实密度梯度相似的浓度梯度,这是由于在有限空间中的固体床层被压缩,造成了堆体孔隙度和渗透性能的下降,阻碍了养分的传输;另外,压力还会影响堆体的饱和度进而影响生化反应的效率[19]。已有研究表明[33],上覆压力的变化会影响堆体内总有机碳和挥发性脂肪酸在堆体内的运移,从而间接影响了甲烷的产量。
-
大多数微生物不是作为独立的种群生活,而是与其他种群共存并逐渐发展出复杂的相互作用,包括互利共生、竞争、寄生和捕食等,认识种群间的相互作用对理解微生物群落的形成至关重要[34]。为评估填埋场内细菌群落内的共生模式,进行了网络分析 (图6) 。网络的复杂程度能够在一定程度上表征群落内微生物合作的紧密程度,因此表层群落的内部存在较强的合作关系,微生物网络结构相较其他层更为复杂,稳定性最佳。这一压力区间下的垃圾中有机质含量相对丰富,且由于所处埋深较小,可能正处在兼性厌氧的环境,在这样的生境下,能够支持更多样的微生物代谢路径,进而促进了种群间的相互作用。Proteobacteria和Actinobacteria是上覆压力在30~80 kPa区间下群落的优势门,这两类细菌在代谢过程中会产生抑制其他菌群生长的碳氢化合物[16, 35],这可能是中层群落内微生物间的合作相对较弱的原因。
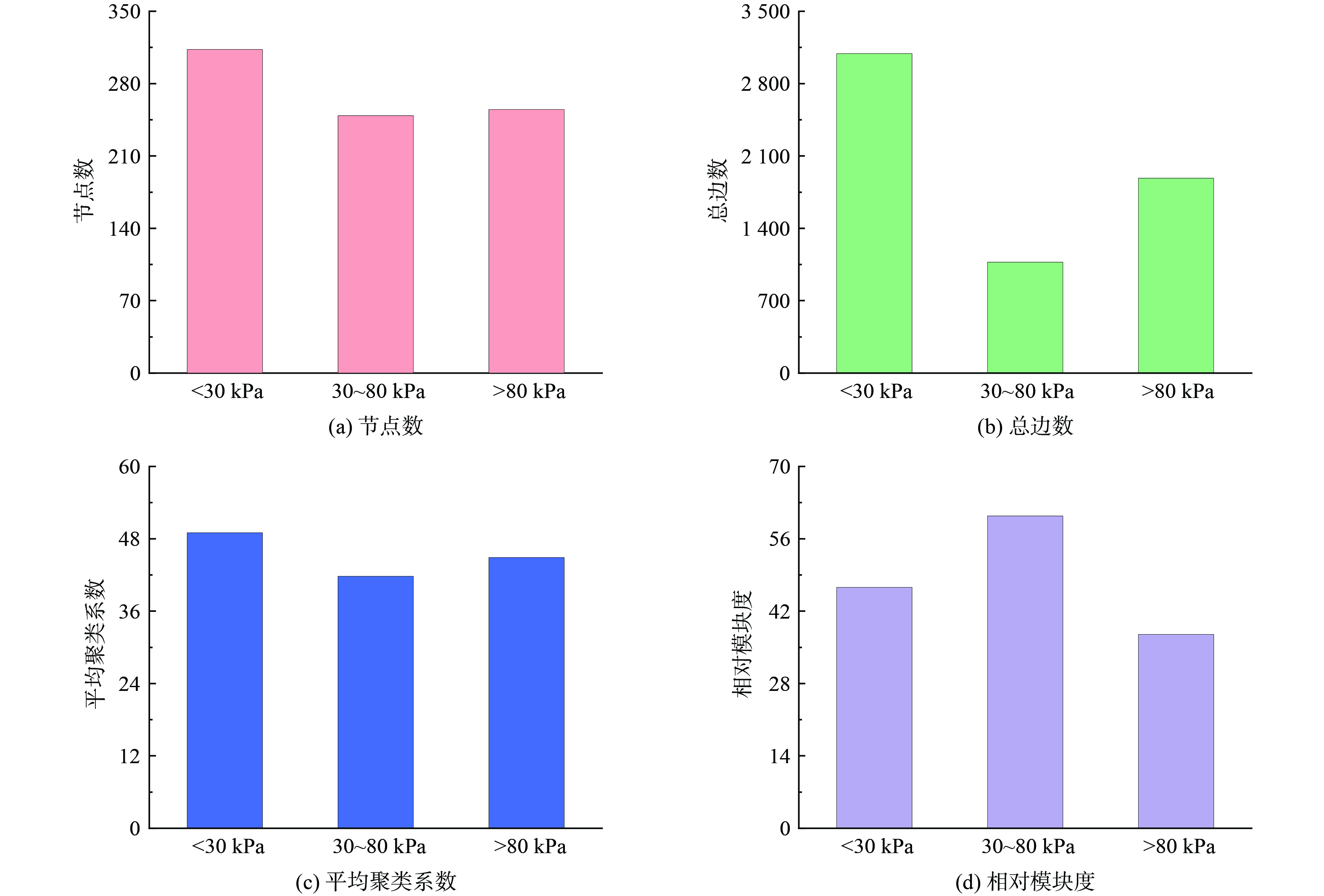
采用了拓扑分析来揭示不同上覆压力条件下的网络结构特性。图7展示了不同群落网络的四个关键拓扑特征:节点数、总边数、平均聚类系数及相对模块度。表层群落显示出最多的节点数 (316) 和总边数 (2 930) ,表明其网络复杂性最高[36]。中层群落与底层群落的节点数相差不大,但中层群落的总边数仅为890,远低于底层群落的1 620,反映了较低的连接密度,即相对较弱的合作关系;而大于80 kPa的群落,节点数 (255) 和总边数 (1 992) 的中等值指示了中等程度的网络复杂性。处在小于30 kPa上覆压力下的表层群落具有相对更高的平均聚类系数 (49) ,这可能与其群落内存在的共生关系有关;处在30~80 kPa上覆压力下,细菌群落较高的相对模块度 (60) 这可能意味着该群落包含多个子群落或模块,每个模块可能负责特定的功能,或对特定的环境条件具有适应性[36-37]。
微生物群落的组装过程可以理解为微生物群落形成的机理,即解释造成微生物群落“现状”的根本原因[34]。对于这个过程的解释包含确定性过程与随机性过程两种理论。确定性过程可以理解为微生物对环境因子的某种适应过程,或者是栖息地偏好 (如好氧微生物) ,其涉及生物和非生物因素,这两种因素共同影响微生物过程,分别对应微生物种间的相互作用 (如竞争、捕食、共生等) 和环境影响作用 (如盐分、pH值、温度等) ;而随机过程可以理解为微生物的耗损与收益间的随机平衡,其认为所有微生物在生态上都是相同的,包括随机出生、死亡、扩散、灭绝和物种形成等过程[13, 34]。
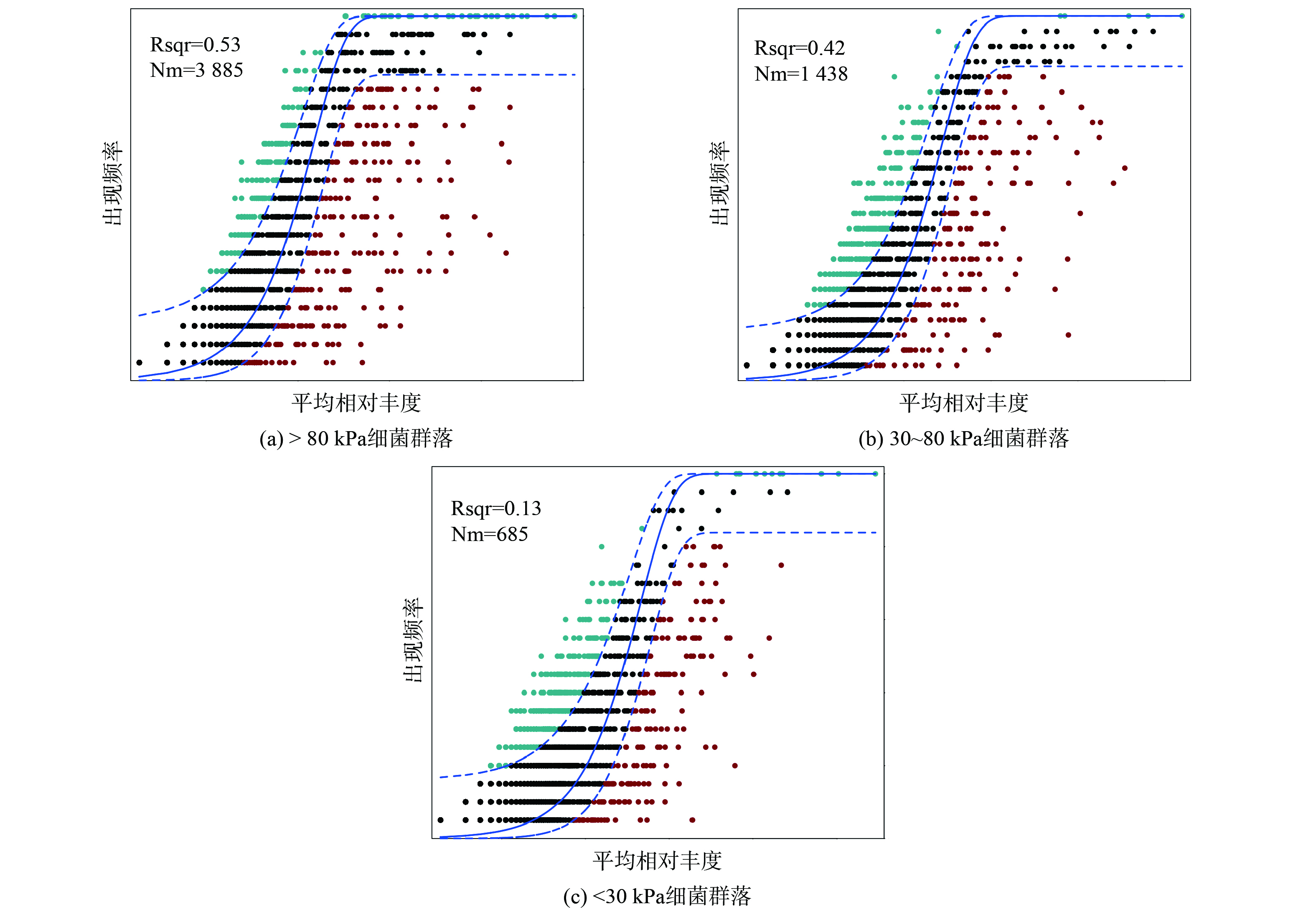
中性群落模型阐明了随机过程对不同上覆压力下细菌群落的形成过程中可能发挥的作用 (图8) 。随机过程的相对贡献分别解释了群落在>80 kPa、30~80 kPa和<30 kPa的53.10%、41.85%和12.76%。这表明小于30 kPa下细菌群落的形成可能受到确定性过程的影响更大,而大于80 kPa下,群落则更多的受到随机过程的驱动。填埋场表层由于承受上覆压力相对较低,通常处在低压实度下,渗透性相对较好,仍存在与大气间的气体交换,处于半好氧的环境下,这对于部分严格厌氧菌的生存是不利的,该区域的细菌群落将受到有氧环境的选择作用。有研究指出[38-39],在堆体浅层可能发生生物干燥过程,从而营造相对高温和干燥的环境,因此这一区域内细菌群落的形成可能因此倾向于受确定性过程的控制。而在大于80 kPa的区域,垃圾有机组分在这一区域内相对匮乏,分布随机且生物可利用性低,细菌群落在这一环境下的形成高度依赖于资源的分布,这可能是底层群落组装受随机过程控制的主要原因。
-
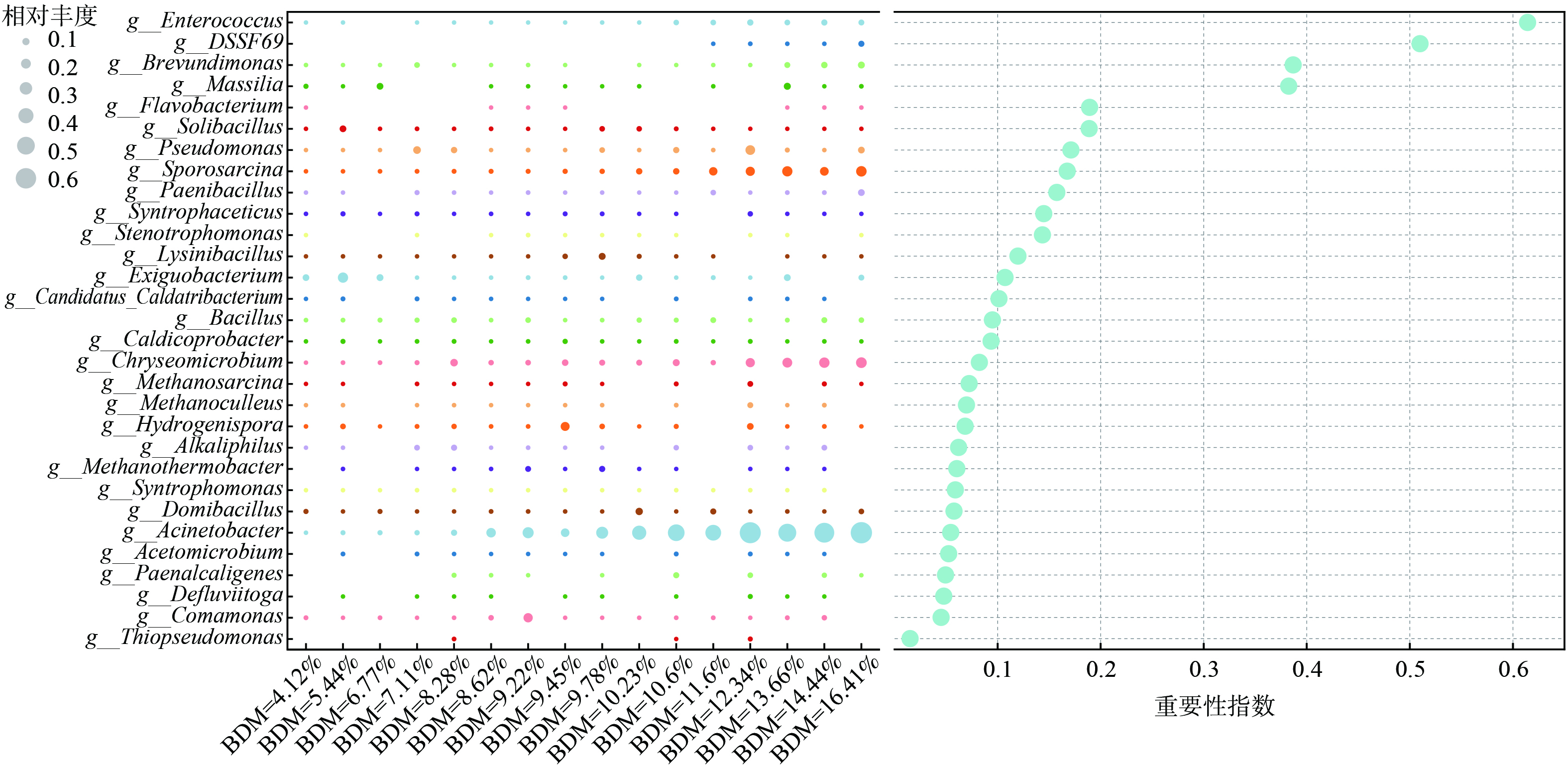
在所有垃圾样品中,共鉴定出细菌属1 127个,BDM水平的变化影响了不同细菌属的丰度。图9以气泡图的形式展示了丰度最高的前30种细菌属,它们主要属于Proteobacteria、Bacteroidetes、Synergistota和Actinobacteriota门类,占细菌群落总数的62.90%~91.50%。Acinetobacter (1.12%~19.73%)、Chryseomicrobium (0.43%~9.66%)、Exiguobacterium (0.04%~8.56%)、Sporosarcina (0.11%~7.63%) 和Comamonas (0.01%~5.70%) 是其中前五大优势菌属。
使用随机森林模型分析填埋场中的重要功能属,结果显示其中重要性得分前5的功能属分别为Enterococcus (0.61) 、DSSF69 (0.51) 、Brevundimonas (0.39) 、Massilia (0.38) 和Flavobacterium (0.19) ,它们可能作为不同BDM水平下垃圾有机组分降解过程中的潜在功能生物标志物[40-41]。已有研究指出[42],Enterococcus具有与碳水化合物、蛋白质和核酸代谢相关的功能,在不同栖息地中均表现出较强的适应性,这可能是其在填埋场的复杂环境中生存,并在不同BDM水平下,参与到垃圾有机组分降解过程中的原因。
-
1) 调查某正处于慢速产甲烷阶段的填埋场,分析其垃圾有机组分、压力场对细菌群落结构的影响,通过运用相关性分析和RDA分析,得出上覆压力和BDM对细菌群落结构的影响较为显著。
2) 运用网络分析、中性群落模型,从生态学的角度探讨了填埋场细菌群落的共现模式与组装机制,结果显示,处在小于30 kPa上覆压力下的细菌群落内的合作最为紧密;随机性过程对群落组装过程的贡献度与上覆压力呈正比。
3) 随机森林模型识别出填埋场有机组分降解过程中的重要功能属为Enterococcu。
压力场作用下填埋场生活垃圾组分对其中细菌群落的影响
The influence of landfill domestic waste components on bacterial communities under pressure field
-
摘要: 填埋场作为典型的生物反应器,其微生物群落受到多种作用的影响。探究填埋场中微生物群落结构与压力场、生活垃圾有机组分之间的关系,将为生物强化技术的开发提供理论依据。以浙江某实际填埋场为例,运用网络分析、中性群落模型以及随机森林算法,探究了不同上覆压力和有机组分对垃圾中微生物特征的影响。结果显示:垃圾有机质含量和生物可降解度 (BDM) 随上覆压力增加而减小。Firmicutes、Proteobacteria、Bacteroidetes和Actinobacteriota等是群落中的优势门类,细菌群落与上覆压力 (R=0.51,p<0.01) 和BDM (R=0.31,p<0.05) 具有相关性。群落内合作最为紧密、网络结构最稳定的是上覆压力低于30 kPa的填埋层,随机性过程在这一压力区间内对群落组装的贡献度最小,这可能与该区域的氧气条件和有机组分特征有关。Enterococcus被识别为填埋场有机组分降解过程中潜在的生物标志物。研究结果有助于深入理解填埋场稳定化过程。Abstract: Landfills is a typical bioreactors, and its microbial communities are influenced by various factors. Exploring the relationship between microbial community structure in landfills and pressure field, organic fractions of municipal solid waste, will provide a theoretical basis for the development of bioremediation technologies. Taking a landfill site in Zhejiang as an example, this study explored the impact of different overburden pressures and organic components on the characteristics of microbial communities in waste using network analysis, neutral community models, and random forest algorithms. The results showed that the content of organic matter and the biodegradability (BDM) of the waste decreased with increasing overburden pressure. Firmicutes, Proteobacteria, Bacteroidetes, and Actinobacteriota were the dominant phyla in the community. There was a correlation between bacterial communities and overlying pressure (R=0.51, p<0.01) and BDM (R=0.31, p<0.05). The most closely cooperating and stable network structures within the community were found in landfill layers with an overburden pressure below 30 kPa. Random processes contributed least to community assembly, possibly related to the oxygen conditions and organic component characteristics of the area. Enterococcus was identified as a potential biomarker in the degradation process of organic components in landfills. These findings contribute to a deeper understanding of the stabilization process in landfills.
-

-
-
[1] 李京航. 生活垃圾填埋场微生物群落与泡沫诱发堆体破坏机理研究[D]. 杭州: 浙江大学, 2022. [2] 占松林, 高磊, 周克斌. 存量生活垃圾填埋场治理方式及商业模式的探讨[J]. 环境卫生工程, 2022, 30(6): 11-15. [3] 熊贵耀, 吴吉春, 杨蕴, 等. 有机污染土壤-地下水系统中的微生物场及多场耦合研究[J]. 地学前缘, 2022, 29(3): 189-199. [4] SEKHOHOLA D L, TEKERE M. Microbiology of municipal solid waste landfills: a review of microbial dynamics and ecological influences in waste bioprocessing[J]. Biodegradation, 2020, 31(1-2): 1-21. doi: 10.1007/s10532-019-09890-x [5] CHUKWUMA O B, RAFATULLAH M, TAJARUDIN H A, et al. Bacterial diversity and community structure of a municipal solid waste landfill: A source of lignocellulolytic potential[J]. Life, 2021, 11(6): 493. doi: 10.3390/life11060493 [6] LIU S J, XI B D, QIU Z P, et al. Succession and diversity of microbial communities in landfills with depths and ages and its association with dissolved organic matter and heavy metals[J]. Science of the Total Environment, 2019, 651: 909-916. doi: 10.1016/j.scitotenv.2018.09.267 [7] KE H, LI J, ZHANG X, et al. Bacterial community structure and predicted metabolic function of landfilled municipal solid waste in China[J]. Sustainability, 2022, 14(6): 3144. doi: 10.3390/su14063144 [8] THORSTEN K T, LUIS S J, GAVAZZA S, et al. Analysis of microbial community structure and composition in leachates from a young landfill by 454 pyrosequencing[J]. Applied Microbiology and Biotechnology, 2015, 99(13): 5657-5668. doi: 10.1007/s00253-015-6409-4 [9] MORITA A K M, SAKAMOTO I K, VARESCHE M B A, et al. Microbial structure and diversity in non-sanitary landfills and association with physicochemical parameters[J]. Environmental Science and Pollution Research, 2020, 27(32): 40690-40705. doi: 10.1007/s11356-020-10097-4 [10] XU S, LU W, LIU Y, et al. Structure and diversity of bacterial communities in two large sanitary landfills in China as revealed by high-throughput sequencing (MiSeq)[J]. Waste Management, 2017, 63: 41-48. doi: 10.1016/j.wasman.2016.07.047 [11] SEKHOHOLA D L, SELVARAJAN R, OGOLA H J O, et al. Community diversity metrics, interactions, and metabolic functions of bacteria associated with municipal solid waste landfills at different maturation stages[J]. Microbiologyopen, 2021, 10(1): e1118. doi: 10.1002/mbo3.1118 [12] LI N, HAN Z, ZENG Z, et al. Effects of Environmental Factors on the Spatial Succession of the Bacterial Community in Municipal Solid-Waste Landfills[J]. Journal of Environmental Engineering, 2022, 148(7): 05022003. doi: 10.1061/(ASCE)EE.1943-7870.0002008 [13] SUN X, ZHANG X, ZHANG G, et al. Environmental response to root secondary metabolite accumulation in Paeonia lactiflora: Insights from rhizosphere metabolism and root-associated microbial communities[J]. Microbiology Spectrum, 2022, 10(6): e0280022. doi: 10.1128/spectrum.02800-22 [14] LIANG Y, YIN Q, JIANG Z, et al. Pollution characteristics and microbial community succession of a rural informal landfill in an arid climate[J]. Ecotoxicology and Environmental Safety, 2023, 262: 115295. doi: 10.1016/j.ecoenv.2023.115295 [15] 刘洪杰, 徐晶, 赵由才, 等. 生活垃圾填埋场微生物群落结构与功能[J]. 环境卫生工程, 2017, 25(2): 5-9+14. doi: 10.3969/j.issn.1005-8206.2017.02.002 [16] WANG P, DAI H, SUN B, et al. Bacteria community vertical distribution and its response characteristics to waste degradation degree in a closed landfill[J]. Applied Sciences-Basel, 2022, 12(6): 2965. doi: 10.3390/app12062965 [17] 戴世金, 钱剑文, 兰吉武, 等. 典型生活垃圾填埋场堆体安全监测及堆高稳定性分析[J]. 环境工程学报, 2022, 16(11): 3685-3695. doi: 10.12030/j.cjee.202206145 [18] ZHOU H, GUO S, HUI C, et al. Sulfate reduction behavior in response to changing of pressure coupling with temperature inside landfill[J]. Waste Management, 2023, 171: 491-501. doi: 10.1016/j.wasman.2023.10.005 [19] CAICEDO L M, WANG H, LU W, et al. Effect of initial bulk density on high-solids anaerobic digestion of MSW: General mechanism[J]. Bioresource Technology, 2017, 233: 332-341. doi: 10.1016/j.biortech.2017.02.107 [20] SHEN D, ZHOU H, JIN Z, et al. Sulfate reduction behavior in pressure-bearing leachate saturated zone[J]. Journal of Environmental Sciences, 2023, 126: 545-555. doi: 10.1016/j.jes.2022.04.032 [21] DRENOVSKY R E, VO D, GRAHAM K J, et al. Soil water content and organic carbon availability are major determinants of soil microbial community composition[J]. Microbial Ecology, 2004, 48(3): 424-430. doi: 10.1007/s00248-003-1063-2 [22] DOCHERTY K M, YOUNG K C, MAURICE P A, et al. Dissolved organic matter concentration and quality influences upon structure and function of freshwater microbial communities[J]. Microbial Ecology, 2006, 52(3): 378-388. doi: 10.1007/s00248-006-9089-x [23] 刘晓成. 填埋生活垃圾稳定化特征及开采可行性研究[D]. 杭州: 浙江大学, 2018. [24] ZHOU H, GUO S, HUI C, et al. Sulfate reduction behavior in response to landfill dynamic pressure changes[J]. Journal of environmental management, 2024, 351: 119784. doi: 10.1016/j.jenvman.2023.119784 [25] PEREZ L M I, TURMERO A, HERNANDEZ M, et al. Influence of xenobiotic contaminants on landfill soil microbial activity and diversity[J]. Journal of Environmental Management, 2012, 95: S285-S290. doi: 10.1016/j.jenvman.2010.07.017 [26] WANG Y-N, XU R, WANG H, et al. Insights into the stabilization of landfill by assessing the diversity and dynamic succession of bacterial community and its associated bio-metabolic process[J]. Science of the Total Environment, 2021, 768: 145466. doi: 10.1016/j.scitotenv.2021.145466 [27] SEKHOHOLA-D L, D P, SELVARAJAN R, et al. Influences of geochemical factors and substrate availability on Gram-positive and Gram-negative bacterial distribution and bio-processes in ageing municipal landfills[J]. International Microbiology, 2021, 24(3): 311-324. doi: 10.1007/s10123-021-00167-z [28] 兰吉武. 填埋场渗滤液产生、运移及水位雍高机理和控制[D]. 杭州: 浙江大学, 2012. [29] GRÉGOIRE D S, GEORGE N A, HUG L A. Microbial methane cycling in a landfill on a decadal time scale[J]. Nature Communications, 2023, 14(1): 7402. doi: 10.1038/s41467-023-43129-x [30] XU Q, QIN J, YUAN T, et al. Extracellular enzyme and microbial activity in MSW landfills with different gas collection and leachate management practices[J]. Chemosphere, 2020, 250: 126264. doi: 10.1016/j.chemosphere.2020.126264 [31] 蒋小红. 城市填埋场微生物分布及其环境响应特征[J]. 资源节约与环保, 2022(5): 61-63+67. doi: 10.3969/j.issn.1673-2251.2022.05.018 [32] FISGATIVA H, TREMIER A, LE R S, et al. Understanding the anaerobic biodegradability of food waste: Relationship between the typological, biochemical and microbial characteristics[J]. Journal of Environmental Management, 2017, 188: 95-107. [33] QIU Z, LI M, ZHANG L, et al. Effect of waste compaction density on stabilization of aerobic bioreactor landfills[J]. Environmental Science and Pollution Research, 2020, 27(4): 4528-4535. doi: 10.1007/s11356-019-06902-4 [34] STEGEN J C, LIN X, FREDRICKSON J K, et al. Estimating and mapping ecological processes influencing microbial community assembly[J]. Frontiers in Microbiology, 2015, 6: 370. [35] 郑慧芬, 曾玉荣, 叶菁, 等. 农田土壤碳转化微生物及其功能的研究进展[J]. 亚热带农业研究, 2018, 14(3): 209-216. [36] ABIRIGA D, JENKINS A, KLEMPE H. Microbial assembly and co-occurrence network in an aquifer under press perturbation[J]. Ann Microbiol, 2022, 72(1): 13. doi: 10.1186/s13213-021-01659-z [37] SU Y, WANG J, XIA H, et al. Comparative network analysis revealing the mechanisms of antibiotic resistance genes removal by leachate recirculation under different hydraulic loadings[J]. Science of the Total Environment, 2019, 649: 318-326. doi: 10.1016/j.scitotenv.2018.08.361 [38] SLEZAK R, KRZYSTEK L, LEDAKOWICZ S. Biological drying of municipal solid waste from landfill[J]. Drying Technology, 2020, 38(1-2): 189-199. doi: 10.1080/07373937.2019.1611599 [39] WANG Y, CHEN Z, MA J, et al. Migration and transformation of main components during perishable waste bio-drying process[J]. Journal of Environmental Management, 2022, 319: 115720. doi: 10.1016/j.jenvman.2022.115720 [40] LIU Y, ZHU Y, WU D, et al. Effect of free nitrous acid on nitritation process: Microbial community, inhibitory kinetics, and functional biomarker[J]. Bioresource Technology, 2023, 371: 128595. doi: 10.1016/j.biortech.2023.128595 [41] SUN H, ZHANG X, ZHANG F, et al. Tetrasphaera, rather than Candidatus Accumulibacter as performance indicator of free ammonia inhibition during the enhanced biological phosphorus removal processes[J]. Journal of Environmental Chemical Engineering, 2021, 9(5): 106219. doi: 10.1016/j.jece.2021.106219 [42] ZHONG Z, ZHANG W, SONG Y, et al. Comparative genomic analysis of the genus Enterococcus[J]. Microbiological Research, 2017, 196: 95-105. doi: 10.1016/j.micres.2016.12.009 -



 下载:
下载: