-
随着煤化工企业的发展,大量的高盐废水被产生,盐度为海水的三倍以上[1]。这类废水水质复杂,水量大,是典型的难降解有机废水,处理难度较大[2]。研究人员已在该废水中发现大量的多环芳烃 (PAHs) ,这些物质危害大,可生物降解性差,不仅对微生物有严重的抑制作用,而且对人类健康和生态环境构成威胁。
相比于物化法,生物法具备无二次污染和经济友好的优点。生物强化技术,即通过向活性污泥中投加功能菌来强化活性污泥对污染物的降解性能,是处理含PAHs高盐废水的常用技术[3]。但是基于传统活性污泥法的生物强化技术仍然存在单位容积生物量低的问题,在实际应用中受到限制。
好氧颗粒污 (AGS) 技术是特殊的生物膜法,已经显示出巨大的应用潜力,以其优异的生物量保留能力和污泥沉降性能而逐步取代活性污泥。微生物颗粒分为好氧颗粒污泥、厌氧颗粒污泥和菌丝体颗粒。颗粒污泥由许多丝状真菌和细菌组成,而菌丝体颗粒仅由丝状真菌组成,是丝状真菌的一种特殊形式[4]。由于菌丝球具备表面积大、自发缠绕形成颗粒等特征,其在好氧颗粒污泥中的应用愈加广泛,并且也有研究表明,菌丝球能够加速活性污泥的造粒。GENG等[5]将Aspergillus Niger Y3投加到反应器初始阶段的活性污泥中,发现在第22 d,颗粒污泥粒径达到0.5 mm,相比于对照组,造粒时间缩短了18 d。并且他们预测了真菌颗粒接种策略的可能机理包括以下步骤[6]:(1)真菌颗粒吸附细菌并形成大细丝为主的颗粒;(2)大颗粒裂成小颗粒;(3)所得碎片进一步吸附细菌并逐渐形成细菌为主的颗粒。尽管以细丝为主的颗粒不稳定[7-8],但它可以提供初始框架并作为其他微生物粘附的载体。本研究采用菌丝球构建耐盐好氧颗粒污泥,从颗粒粒径、污泥沉降性能、污泥生物量和EPS变化四个方面探究菌丝球对耐盐好氧颗粒污泥形成的影响,从COD去除效能、PAHs去除效能、1-羟基-2-萘甲酸 (1H2N) 的积累和 AD-3菌在反应器中的持留四个方面探究SAGS污染物去除性能,最后分别从细菌和真菌角度探究了微生物群落的演替。
-
无机盐培养基 (g·L−1) :葡萄糖20.00,酵母粉1.00,氯化钠50.00,氯化铵0.10,磷酸氢二钾0.02,六水合氯化镁3.85,七水合硫酸镁5.23,氯化钙0.38,氯化钾1.10,碳酸氢钠0.05,溴化钠0.13,微量元素添加浓度为0.5 mL·L−1。
微量元素溶液组成为 (g·L−1) :四水合硝酸钙3.2,七水合硫酸铁1.6,五水合硫酸铜0.32,四水合硫酸锰0.16,二水合钼酸钠0.032,七水合硫酸锌0.16,硼酸0.024。
以上海杭州湾潮间带污泥为接种源,采用高通量筛选技术,筛选在高盐条件下团聚性能良好的真菌。提取真菌DNA,以ITS1 /ITS2为引物进行PCR扩增。PCR产物送上海华大基因科技有限公司测序,测序所得序列于NCBI上进行Blast比对,采用MEGA-X构建系统发育树。
-
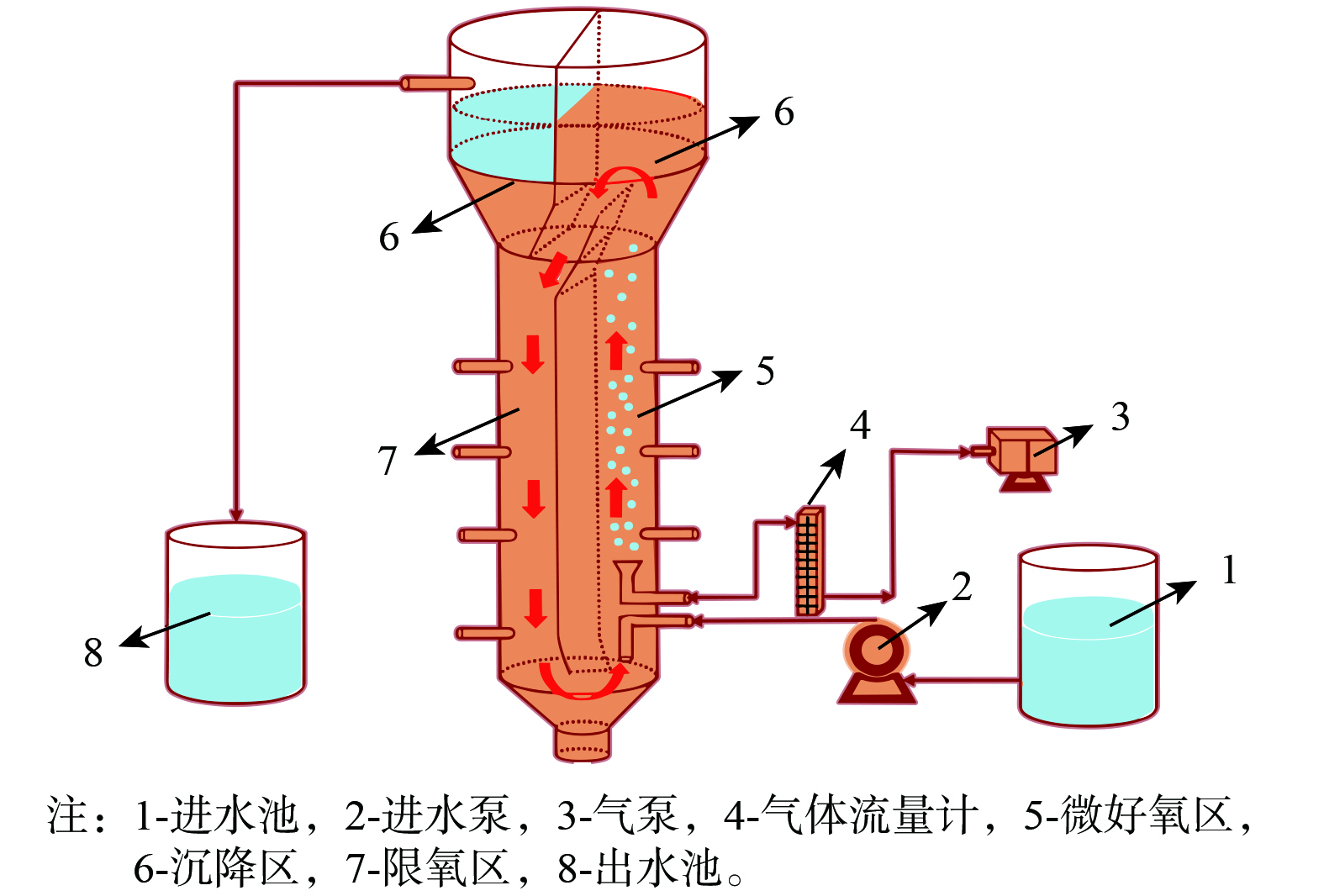
实验装置采用前期设计的升流式内循环反应器,实验装置设计图如图1所示[9]。1-进水池,2-进水泵,3-气泵,4-气体流量计,5-微好氧区,6-沉降区,7-限氧区,8-出水池。实际有效容积为11 L (高度1.0 m,直径为0.13 m) 。设置反应器的进水速度为15 mL·min−1,曝气量为1 L·min−1,上升气速0.3 cm·s−1,污泥负荷为0.5 kgCOD·kgVSS−1·d−1,溶解氧为3~4 mg·L−1,水力停留时间为13 h。
本试验活性污泥取自上海中法水务污水处理厂沉淀池,初始污泥浓度约为1 gMLSS·L−1,盐度为3%,模拟废水水质如表1所示。进水不添加葡萄糖运行2 d以耗尽污泥的内源性碳源。
设置2个反应器R1 (AD-3菌+活性污泥) 和R2 (菌丝球+AD-3菌+活性污泥) 。AD-3菌和活性污泥的投加按照最优比例 (AD-3菌:活性污泥=1%) 投加[10]。菌丝球的投加按照活性污泥∶菌丝球=5∶1的比例投加[11]。AD-3菌和菌丝球都先在摇瓶中进行培养。
-
以100 L水的消耗为1个周期,在周期开始和结束的时候取40 mL泥水混合液离心去上清液。将底部剩余污泥用乙酸乙酯萃取,污泥吸附的PHE会被萃取出来,周期开始和结束的差值即污泥降解的PHE。通过将微生物降解的PHE浓度除以污泥浓度,可得单位质量污泥降解的PHE,如公式(1)所示。
单位质量污泥PHE比降解率 (mg PHE·g VSS−1) :
式中:minf.phe为进水的PHE浓度,μg·L−1;meff.phe为出水的PHE浓度,μg·L−1;mmlvss为生物量,mg·L−1。
-
从R1和R2中取污泥混合液40 mL置于50 mL离心管中,在5 000 r∙min−1下离心10 min,去除上清液保留底部污泥,重复3次。先添加5 mL质量浓度为5%的Na2CO3母液稀释至质量浓度为0.5%,再加磷酸盐缓冲溶液(PBS)补充到50 mL。80 ℃水浴30 min后,离心取上清液,用0.45 µm的水系滤膜过滤所得即EPS溶液。将下层污泥冲洗3次,置于105 ℃烘箱中烘干得污泥干重。采用Lowry法测定蛋白浓度,采用硫酸-苯酚法测定多糖含量。
-
将R1和R2反应器运行分为三个阶段,第一阶段为0~20 d,第二阶段为21~40 d,第三阶段为41~70 d。每个反应器分为颗粒和絮体进行高通量基因测序。
细菌采用引物338F (5'-ACTCCTACGGGAGGCAGCA-3') 和806R (5'- GGACTACHVGGGTWTCTAAT-3') ,真菌采用引物ITS1 (5'-CTTGGTCATTTAGAGGAAGTA-3') 和ITS2 (5'-GCTGCGTTCTTCATCGATGC-3') 。
-
采用皮尔逊相关性分析方法对各菌群相对丰度与COD去除效能和PHE去除效能进行相关性分析。
-
采用高通量筛菌技术在5%的盐度下,以20 g·L−1葡萄糖和10 g·L−1 PHE为碳源,筛选得到一株能够在高盐条件下耐受PHE的真菌,命名为L22。由图2(a)可以看出平板背面呈现橘黄色,菌落表面干燥,凹凸不平,边缘清晰。由图2(b)可以看出平板上纯化后的真菌菌落正面呈现绿色。由图2(c)可以看出在无机盐液态培养基中,该菌能够形成尺寸在1~3 mm的白色光滑菌丝球颗粒。由图2(d)可以看出菌丝球能够互相黏附形成更大的菌丝球。系统发育树 (图2(e)) 显示L22与青霉属真菌Penicillium同源,因此将该菌命名为Penicillium sp. L22。
-
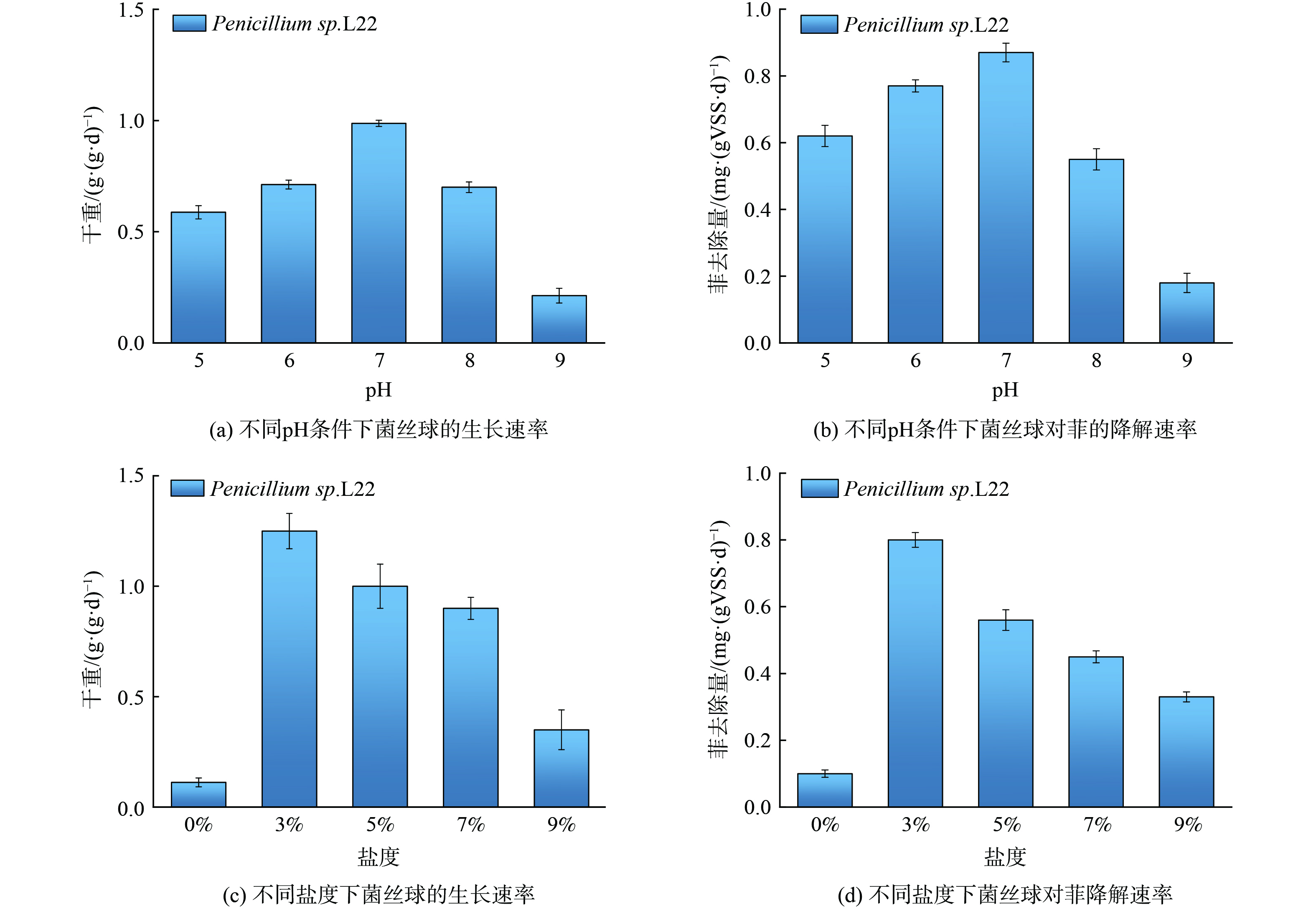
图3展现了不同pH和盐度条件下菌丝球的生长和对PHE的降解情况。研究发现菌丝球对酸碱的适应性较强,且最优生长pH为7。在pH为7时菌丝球干重增长速率为0.98±0.01 g·mL−1·d−1 (图3(a)) ,PHE比降解速率为0.87±0.02 mg·gVSS−1·d−1 (图3(b)) 。L22降解PHE的最佳盐度为3%,与最适生长盐度一致 (图3(d)) 。当盐度在3%~7%时,L22生物量有显著的增长,但当盐度为9%时,L22生长缓慢 (图3(c));当盐度为5%时L22对PHE的比降解速率为0.56±0.03 mg·gVSS−1·d−1。L22能够耐受高盐度可能是因为L22来源于海洋的潮间带污泥,一定浓度的NaCl有利于维持其正常的生理活动[12]。ALLAWAY和JENNINGS[13]也曾报告海洋真菌Dendryphiella salina在0.2 mol·L−1氯化钠和氯化钾存在下生长减慢的现象,和本实验现象类似。L22生长的最佳盐度为3%,表明从海洋环境中分离的微生物虽然可以在盐度水平高于海洋时生长,但它们的生长活性通常在海洋盐度水平 (3%NaCl) 下是最佳的[14]。此外,L22在高盐条件下对PHE有一定的降解能力,和传统活性污泥所具备降解活性 (0.15~0.50 mgPHE·gVSS−1·d −1) 相当[15]。但L22的降解PHE活性远小于AD-3菌,是AD-3菌降解PHE活性的1/1 800[16]。
-
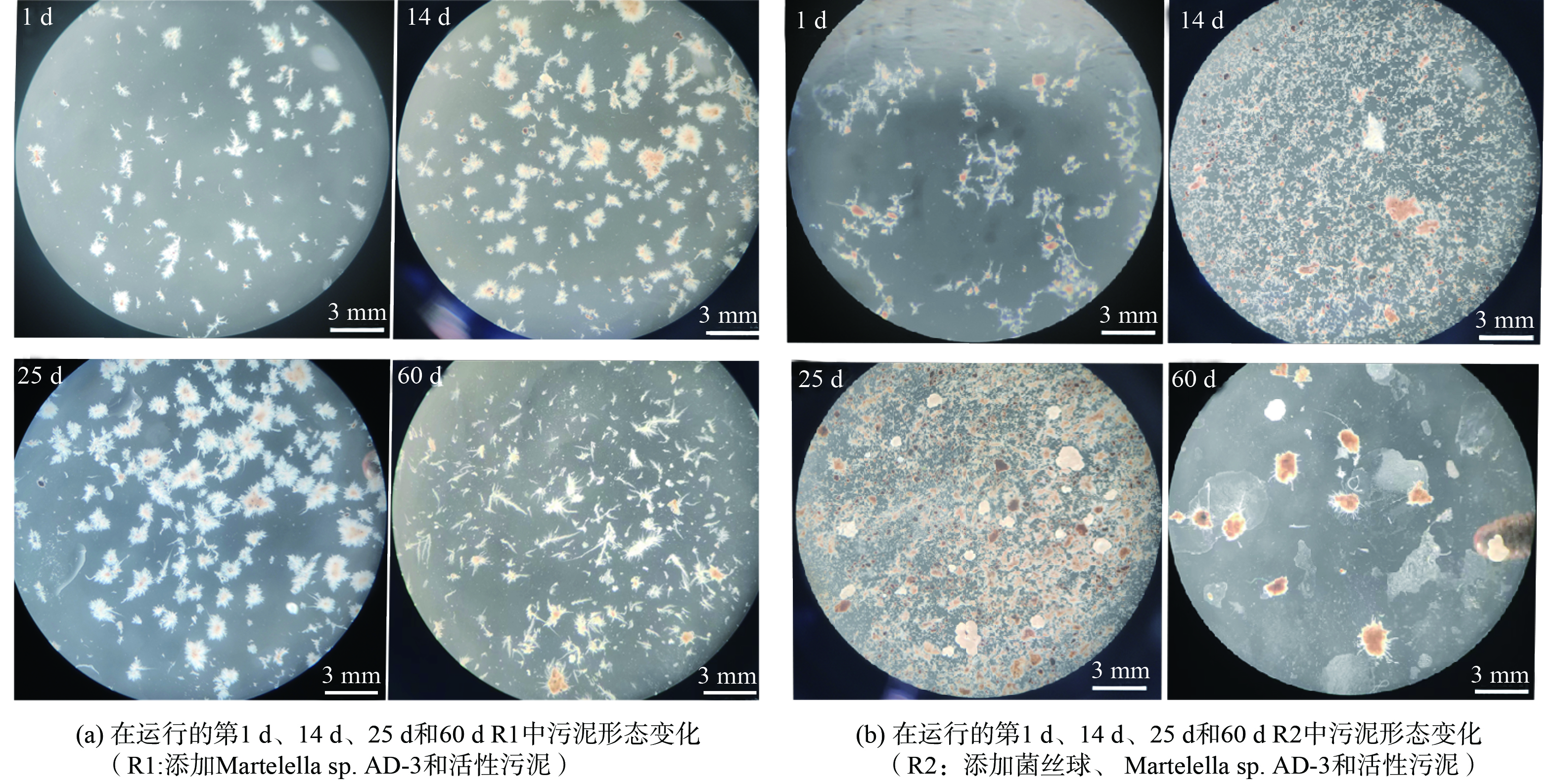
本研究拍摄了R1和R2反应器70 d运行过程中污泥的形态变化,如图4所示。将R1和R2好氧造粒分成三个阶段:第一阶段 (0~20 d) 、第二阶段 (21~40 d) 和第三阶段 (40~70 d) 。R1相对来说驯化期更短,运行到第14 d时,已有明显颗粒形成。运行到第25 d时,R1好氧造粒达到稳定期,颗粒大且均匀。但是当运行到60 d时,R1中的颗粒出现破碎解体,絮状污泥开始变多。研究发现R1中形成的耐盐好氧颗粒污泥表面毛糙结构松散,并且稳定性差,在长期的运行中逐渐解体破碎,污泥流失 (图4(a)) 。R2中的好氧造粒速度相对R1较慢,在运行14 d后,可以发现R2中出现菌丝球颗粒、好氧颗粒和絮体污泥共存的现象,说明R2在这个阶段已经开始形成好氧颗粒污泥。在运行到25 d,R2中的絮体污泥开始大量聚集形成细小的颗粒,菌丝球也开始繁殖,在体系中大量出现。运行到60 d时,R2反应体系到达一个稳定期,菌丝球数量减少,形成了1.5 mm左右密实的耐盐好氧颗粒污泥 (图4(b)) 。
由图4可以看出第三阶段形成的颗粒R2相对R1来说更密实。颗粒结构松散大多可能由于丝状菌过度生长导致的,据报道,活性污泥中原本就有丝状菌的存在,例如浮游球衣菌,在活性污泥体系和富营养化的水体中普遍存在[17]。当水中溶氧浓度低、碳氮比和碳磷比失调或缺乏氮源,该菌就会过度生长,形成松散的好氧颗粒污泥[18]。相比之下,R2由于菌丝球的添加,情况发生了改变。代星宝[19]研究发现菌丝球能够捕获悬浮球衣菌从而调控污泥的丝状菌膨胀。本研究中R2可能因为菌丝球的投加,导致反应体系中菌丝球和丝状细菌发生竞争,抑制了丝状细菌的过度生长。
-
图5(a)为R1和R2中污泥平均粒径的变化。R1和R2中接种污泥的平均粒径为273.2±43.1 µm。研究发现和2.3污泥形态结果一致,R1中污泥平均粒径先增大后减小,R2中污泥平均粒径先无明显变化后快速增加。R1在运行到23 d时污泥平均粒径达到1487.3±66.4 µm,但40 d后污泥粒径下降并稳定在843.2±73.3 µm。R2第一阶段污泥平均粒径无明显变化,从第30 d开始,R2中污泥平均粒径迅速增大,从300.6±50.2 µm增长到1 200.3±71.5 µm,增长了4倍。本研究发现R2形成的耐盐好氧颗粒污泥粒径小于R1 (平均粒径减少19.3%) ,但有报道称,小粒径的好氧颗粒污泥更稳定,过大的粒径会影响颗粒内部的氧气传递,阻碍代谢废物的排出,从而易发生颗粒裂解[20]。
图5(b)为R1和R2污泥的SVI30、SVI5以及它们比值的变化。本研究发现,虽然R1在第一阶段迅速造粒,但第一阶段SVI5呈现上升趋势,SVI5从50.2±6.1 mL·g−1升高到231.5±2.3 mL·g−1,说明第一阶段形成的耐盐好氧颗粒污泥沉降性差。R2在第一阶段缓慢造粒过程中,SVI5保持在60.5±3.3 mL·g−1,虽然第二阶段污泥的SVI5有略微的升高,但在第三阶段污泥沉降性恢复并保持稳定,相比R1,SVI5减小24.4%,SVI30/SV5达到0.9。有研究表明成熟的好氧颗粒污泥的SV30和SV5之间的偏差低于10%[21]。R2在第三阶段SVI30/SV5达到0.9说明R2在第三阶段形成了成熟的耐盐好氧颗粒污泥。
图5(c)为R1和R2污泥生物量的变化。R1生物量呈现先上升后下降的趋势,R2呈现出先上升后下降又上升的趋势。R2在第二阶段出现生物量下降现象,生物量从3.04±0.25 g·L−1下降到2.46±0.13 g·L−1,但是第三阶段R2生物量稳步升高,最终达到5.12±0.34 g·L−1,是R1的4.2倍。LI等[22]在耐盐好氧造粒中也观察到类似于第二阶段的现象,采用生物量平衡分析发现,水力冲刷和内源性消耗是生物量减少的主要原因。研究表明,在恶劣情况下,丝状细菌具有更高的生长速率,会使沉降性能恶化,造成生物量的流失[23]。在本实验中,第二阶段可能存在丝状细菌的快速增殖,在水力冲刷的条件下,丝状细菌从反应系统中流失,从而造成生物量的下降。但随着丝状细菌流出反应器,生物量在第三阶段开始稳定增长。
图5(d)为R1和R2污泥EPS含量及组成的变化。本研究发现,R1和R2在颗粒形成阶段都伴随着EPS含量的增长,其中PN含量增长明显,PS含量无明显变化。R1在造粒过程中PN含量从149.4±8.6 mg·gVSS−1增加到190.1±5.4 mg·gVSS−1。R2在造粒过程中PN含量从135.7±7.4 mg·gVSS−1增加到330.3±2.9 mg·gVSS−1。LIANG等[24]研究发现微生物可以分泌更多的PN以粘附在AGS系统中的载体上。本研究说明菌丝球的添加能够有效促进污泥EPS中PN含量的增加,从而促进了微生物桥接和耐盐好氧颗粒的形成。
-
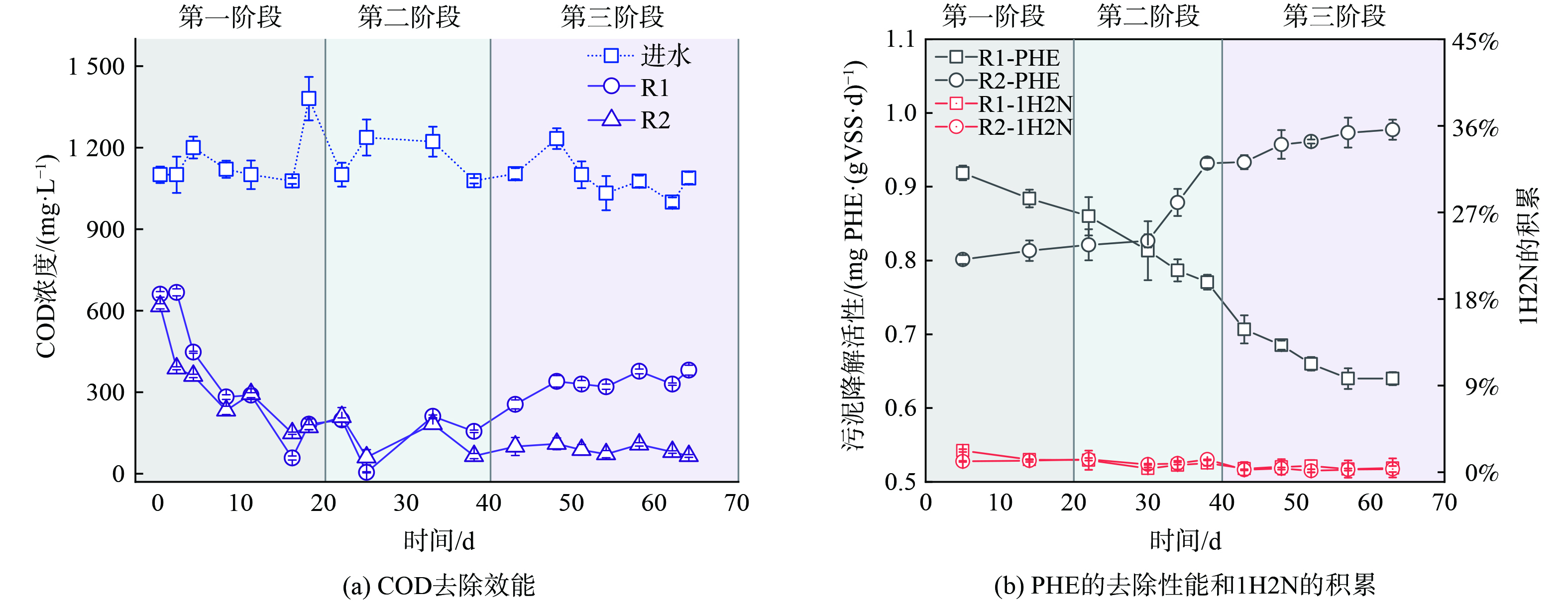
图6(a)是R1和R2中COD的去除效率。R1和R2在第一和第二阶段COD去除率相差不大,但在第三阶段COD去除率出现了波动,R1的COD去除效率下降,只有78.51%±3.30%,但R2的COD去除效率稳定在94.16%±3.83%,相比R1增加了20.50%。这可能是反应器生物量减少造成,R1的生物量减少至1.22±0.19 g·L−1,而相比之下R2的生物量为5.12±0.34 g·L−1,是R1的4.2倍。由此可见,菌丝球的投加持留了反应器中的微生物,从而巩固了反应器对COD的处理效能。
图6(b)是R1和R2中污泥对PHE的比降解活性和1H2N的积累率。总体来说,R1污泥的比降解活性呈现下降趋势,R2中的污泥比降解活性呈现上升趋势。R1的污泥比降解活性从0.88±0.01 mg PHE·gVSS−1·d−1最终下降至0.64±0.02 mg PHE·gVSS−1·d−1。这可能是因为刚开始R1快速形成松散的颗粒污泥,起到了负载捕获AD-3菌的作用,从而有较高的污泥比降解活性,但后续由于颗粒的解体生物量的流失,污泥比降解活性直线下降。R2中污泥比降解活性先缓慢增加后快速增加。R2先从0.81±0.02 mg PHE·gVSS−1·d−1增加到0.88±0.04 mg PHE·gVSS−1·d−1。这可能是因为菌丝球的添加延长了反应器的适应期。在反应器运行到第40 d时,R2的污泥比降解活性迅速增加,最终由0.88±0.04 mg PHE·gVSS−1·d−1增加到并稳定在0.98±0.07 mg PHE·gVSS−1·d−1,相比于R1污泥比降解活性增加了53.1%。研究发现,菌丝球能够作为生物载体并且吸附污染物[25]。因此出现这一现象的原因可能是菌丝球开始繁殖,为AD-3菌的附着提供了更多的生物载体。由于PHE和菌丝球都有较高的疏水性,PHE很有可能被菌丝球吸附,使污泥中的PHE浓度升高,增大AD-3菌的环境PHE浓度,从而增强R2中污泥的比降解活性。
本研究通过测定1H2N在反应器中的积累量衡量PHE是否被彻底矿化。本研究发现R1和R2的1H2N积累量都较低,3个阶段1H2N的积累量都低于5%。有研究表明AD-3菌和活性污泥能够发生协同作用,彻底矿化PHE[16]。该现象说明R1和R2中AD-3菌和活性污泥都有比较好的协同效果。
-
由图7(a)和(b)可知,在R1和R2中,污泥PHE降解活性和Martelella属的相对丰度成显著正相关(R=0.99,p<0.05;R=0.94,p<0.05),表明外源投加AD-3菌(Martelella属)起到了强化反应器对PHE去除效果的作用;污泥PHE降解活性和Bacillus属也成显著正相关 (R=0.90,p<0.05;R=0.89,p<0.05) ,证明Bacillus也很可能参与了PHE的降解。KONG等[26]也发现Bacillus sp.PAH-2具备降解原油的能力,对苯并[a]蒽、芘和苯并[a]芘的20 d降解率分别为6.12%、83.17%和49.2%。COD去除效能与Marinobacterium属的相对丰度呈显著的负相关 (R=−0.99,p<0.05;R=-0.90,p<0.05) 。虽然LI等[27]研究发现Marinobacterium属是耐盐微生物,能够增加反应器对高盐度的耐受能力,实现高效的异养反硝化,但是在本实验中该菌群不是有机物降解功能的承担者。
由图7(c)可知,在R1中,污泥PHE降解活性和Filobasidium属的相对丰度成显著负相关 (R=−0.99,p<0.05) ,和Penicillium属也成显著负相关 (R=−0.79,p<0.05) 。COD的去除效能主要是和Filobasidium、Cladosporium和Alternaria属的相对丰度成显著负相关 (R=−0.99,R=−0.97,R=−0.86,p<0.05) 。由图7(d)可知,在R2中,污泥PHE降解活性和Penicillium属的相对丰度成显著正相关 (R=0.86,p<0.05) ,和Filobasidium属成显著负相关 (R=−0.99,p<0.05) 。COD的去除效能主要是和Filobasidium、Cladosporium和Alternaria属的相对丰度成显著负相关 (R=−0.92,R=−0.99,R=−1,p<0.05) 。虽然真菌能够降解有机物,但是在活性污泥或者好氧颗粒中,有机物的降解还是以细菌为主,过高的真菌丰度会引起污泥膨胀和起泡[28]。
-
由图8(a)、(b)和(c)可知,不管是R1还是R2,污泥颗粒相对于污泥絮体具有更高的生物多样性。在第三阶段,群落趋于稳定时,R1和R2颗粒污泥中丰度最高的细菌均为Vibiro属和Bacillus属。研究表明Vibiro属和Bacillus属都属于海洋细菌[29]。EOM等[30]发现相比于活性污泥在3.5%盐度下7.3%的COD去除率,Vibiro属和Bacillus属能够分别降解75.3% 和 65.4%的COD,有很好的COD去除效能。由图我们可以发现第三阶段Vibiro属和Bacillus属的群落丰度都呈现出R2大于R1的趋势,和COD去除效果相对应。
由图8(d)、(e)和(f)可知,在本实验中,Penicillium属的丰度变化趋势和污染物降解效果一致,和ASSRESS等[28]研究结果一致。据报道,Penicillium属还能够增强处理过程中对活性污泥的脱水和过滤性[31]。在LIU等[32]研究好氧颗粒污泥中细菌、古菌和真菌的组成中更是发现,虽然颗粒中细菌和古菌占主要,但是好氧颗粒中真菌主要由Scopulariopsis属和Penicillium属组成,和R2中以Penicillium属为主这一现象一致。
-
本研究首先筛选得到一株能够形成菌丝球的丝状真菌,再通过设置R1 (投加AD-3菌和活性污泥) 和R2 (投加菌丝球、AD-3菌和活性污泥) 探究菌丝球对耐盐好氧颗粒污泥的影响。通过研究得出以下结论。
1)筛选所得为一株青霉菌Penicillium sp.L22,能够耐受5%的盐度和10 mg·L−1的菲,并在液态培养条件下能够形成白色菌丝球。通过pH和盐度的优化,发现该菌最佳生长和降解的pH为7,最优盐度为3%。
2)菌丝球的投加促进了反应器稳定造粒,形成的耐盐好氧颗粒污泥小而密实,沉降性好,生物量大。并通过探究EPS含量和组成发现,菌丝球能够促进污泥中蛋白质的产生是菌丝球能够形成耐盐好氧颗粒污泥的主要原因。
3)菌丝球能够强化污染物的去除性能,投加了菌丝球的反应器COD去除率达到94.1±3.8%,相比于未投加菌丝球反应器增加了20.5%;投加了菌丝球的反应器污泥对PHE的比降解活性为0.98±0.07 mg PHE·gVSS−1·d−1,相比于未投加菌丝球反应器增加了53.1%。由于AD-3菌和活性污泥的协同作用,反应器中均没有明显的1H2N积累。
4)细菌中,Martelella属的相对丰度与污泥的比降解活性成显著正相关,外源投加AD-3菌(Martelella属)起到了强化反应器对PHE去除效果的作用。此外,Bacillus属和PHE的降解也成显著正相关,证明Bacillus属也很可能参与了PHE的降解。真菌中,在投加了菌丝球的反应器中,污泥降解PHE的比降解活性和Penicillium属的相对丰度成显著正相关,证明菌丝球的投加有利于反应器中PHE的降解。
菌丝球强化耐盐好氧颗粒污泥构建、性能及其微生物群落特性
Mycelial pellets enhance the construction, performance and microbial community characteristics of salt-tolerant aerobic granular sludge
-
摘要: 基于Martelella sp. AD-3中度嗜盐功能细菌耦合活性污泥这一耐盐有机污染物强化降解体系,探究菌丝球外源投加对构建耐盐好氧颗粒污泥系统 (SAGS) 和PAHs类污染物去除的影响。以杭州湾潮间带污泥为接种源,在盐度为5%,以葡萄糖和菲为碳源的条件下筛选得到一株耐盐真菌Penicillium sp. L22。发现在pH为7,盐度为3%的条件下,菌丝球的生长量和降解性能都达到最佳。将上述菌丝球投加到Martelella sp. AD-3菌和活性污泥强化体系,进一步研究发现,相比于对照组 (AD-3菌+活性污泥) ,实验组 (菌丝球+AD-3菌+活性污泥) 虽然造粒缓慢且形成的颗粒较小 (平均粒径减小19.3%) ,但是形成的颗粒结构更加密实稳定,反应器生物量大 (VSS增加3.2倍) ,污泥沉降性更好 (SVI5减小24.4%) 。通过研究胞外多聚物 (EPS) 发现,菌丝球的投加增加了反应体系中污泥胞外蛋白质含量,从而促进了污泥团聚。在有机污染物降解方面,相比于对照组,菌丝球实验组在第三阶段COD去除率提升20.5%,代表性模式污染物菲的比降解活性提升53.1%。采用高通量基因测序技术分析发现, Martelella属的相对丰度与污泥的比降解活性成显著正相关,表明添加菌丝球可能是通过强化AD-3菌 (Martelella属) 的持留从而强化菲的降解。此外,菌丝球Penicillium属和菲的降解也成显著正相关。本研究揭示了真菌菌丝球强化SAGS系统的群落演替特征,为高盐有机废水的强化处理提供了技术支持和理论依据。Abstract: based on the Martelella sp. AD-3 moderately halophilic bacteria coupled with activated sludge, an enhanced degradation system for salt-tolerant organic pollutants, the impact of exogenous mycelium pellets on the construction of a SAGS system and the removal of PAHs pollutants was explored. A salt-tolerant fungus, Penicillium sp. L22, was obtained by screening the intertidal sludge of Hangzhou Bay as the inoculation source under the conditions of 5% salinity and glucose and phenanthrene as carbon sources. It was found that under the conditions of pH 7 and salinity 3%, the growth and degradation performance of mycelial pellets reached the best. The above-mentioned mycelial pellets were added to the Martelella sp. AD-3 bacteria and activated sludge enhancement system. Further research found that compared with the control group (AD-3 bacteria+activated sludge), the experimental group (mycelial pellets+AD-3 bacteria+activated sludge) although the granulation was slow and the formed particles were small (the average particle size was reduced by 19.3%), the formed particle structure was more compact and stable, and the biomass of the reactor was large (VSS increased by 3.2 times), and the sewage Mud settlement was better (24.4% reduction in SVI5). Through the study of extracellular polymers (EPS), it was found that the addition of mycelial pellets increased the content of extracellular protein in the sludge in the reaction system, thereby promoting sludge agglomeration. In terms of the degradation of organic pollutants, compared with the control group, the removal rate of COD in the third stage of the mycelial pellets experimental group increased by 20.5%, and the specific degradation activity of the representative model pollutant phenanthrene increased by 53.1%. Using high-throughput gene sequencing technology analysis, it was found that the relative abundance of Martelella was significantly positively correlated with the specific degradation activity of sludge, indicating that the addition of mycelial pellets may enhance the persistence of AD-3 bacteria (Martelella) and thus strengthen the phenanthrene. degradation. In addition, the degradation of mycelium Penicillium and phenanthrene also had a significant positive correlation. This study reveals the community succession characteristics of mycelial pellets enhanced SAGS system, and provides technical support and theoretical basis for the enhanced treatment of high-salt organic wastewater.
-

-
图 1 气升式内循环反应示意图[9]
Figure 1. Schematic diagram of airlift internal circulation reaction
图 5 R1和R2中平均粒径、沉降性能、生物量和EPS的变化 (R1:添加Martelella sp. AD-3和活性污泥,R2:添加菌丝球、 Martelella sp. AD-3和活性污泥)
Figure 5. Changes of average particle size, sedimentation performance, biomass and EPS in R1 and R2 (R1: Add Martelella sp. AD-3 and activated sludge, R2: Add mycelial pellets,Martelella sp. AD-3 and activated sludge)
图 7 细菌和真菌丰度与反应器效能的相关性分析。 (R1:添加Martelella sp. AD-3和活性污泥,R2:添加菌丝球、 Martelella sp. AD-3和活性污泥) ,图表中的星号表示统计结果的显著水平,*表示p值小于0.05
Figure 7. Correlation analysis between bacterial and fungal abundance and reactor efficiency. (R1: Add Martelella sp. AD-3 and activated sludge, R2: Add mycelial pellets,Martelella sp. AD-3 and activated sludge) ,The asterisk in the chart represents the significance level of the statistical results, and * represents a p-value less than 0.05
图 8 不同阶段R1和R2的属水平细菌、真菌群落组成结构:R1 添加Martelella sp. AD-3和活性污泥;R2 添加菌丝球、 Martelella sp. AD-3和活性污泥; KL 反应器中的污泥颗粒;XT 反应器中的污泥絮体
Figure 8. Genus-level bacterial and fungal community structure of R1 and R2 at different stages: R1 adds Martelella sp. AD-3 and activated sludge, R2 added mycelial pellets, Martelella sp. AD-3 and activated sludge; KL sludge particles in the reactor; XT sludge floc in the reactor
表 1 模拟废水基质组成
Table 1. Substrate composition of synthetic wastewater
基质 质量浓度/ (g·L−1) 基质 质量浓度/ (g·L−1) 菲(PHE) 0.001 K2HPO4 0.25 葡萄糖 0.937 NaCl 50 NH4Cl 0.1 CaCl2 0.2 MgCl2 4 MgSO4 5 NaHCO3 0.05 NaBr 0.15 KCl 1.1 微量元素 0.50% -
[1] LIU J, SHI S, JI X, et al. Performance and microbial community dynamics of electricity-assisted sequencing batch reactor (SBR) for treatment of saline petrochemical wastewater[J]. Environmental Science and Pollution Research, 2017, 24(21): 17556-17565. doi: 10.1007/s11356-017-9446-y [2] YANG L, LIU Y, LI C, et al. Biodegradation time series characteristics and metabolic fate of different aromatic compounds in the biochemical treatment process of coal chemical wastewater[J]. Bioresource Technology, 2022: 127688. [3] REN C, WANG Y, TIAN L, et al. Genetic bioaugmentation of activated sludge with dioxin-catabolic plasmids harbored by Rhodococcus sp. strain p52[J]. Environmental Science & Technology, 2018, 52(9): 5339-5348. [4] LI L X, MA F, SONG Z W, Et al. Research progress and development trend of mycelial pellets[J]. Advance Journal of Food Science and Technology, 2015, 8(8): 554-558. doi: 10.19026/ajfst.8.1566 [5] GENG M, MA F, GUO H, et al. Enhanced aerobic sludge granulation in a sequencing batch reactor (SBR) by applying mycelial pellets[J]. Journal of Cleaner Production, 2020, 274: 123037. doi: 10.1016/j.jclepro.2020.123037 [6] HAN X, JIN Y, YU J. Rapid formation of aerobic granular sludge by bioaugmentation technology: A review[J]. Chemical Engineering Journal, 2022, 437: 134971. doi: 10.1016/j.cej.2022.134971 [7] BASSIN J P, TAVARES D C, BORGES R C, et al. Development of aerobic granular sludge under tropical climate conditions: The key role of inoculum adaptation under reduced sludge washout for stable granulation[J]. Journal of Environmental Management, 2019, 230: 168-182. [8] ZHENG Y M, YU H Q, LIU S J, et al. Formation and instability of aerobic granules under high organic loading conditions[J]. Chemosphere, 2006, 63(10): 1791-1800. doi: 10.1016/j.chemosphere.2005.08.055 [9] 周锋, 刘勇弟, 厉巍. 同步短程硝化-厌氧氨氧化-短程反硝化颗粒污泥培育过程及其性能[J]. 环境科学, 2021, 42(10): 4864-4871. [10] 王宇. Martelella sp. AD-3强化活性污泥耐盐降解菲效能及其机制研究[D]. 上海: 华东理工大学, 2022. [11] GENG N, WANG S, HU T, et al. Fast granulation of flocculent activated sludge by mycelium pellet and wastewater biological treatment performance[J]. Journal of Water Process Engineering, 2022, 49: 103031. doi: 10.1016/j.jwpe.2022.103031 [12] 林佳辉, 王丹, 李霜. 一株中度嗜盐菌Salinicola sp. 在高盐环境中的烷烃降解特性[J]. 化工进展, 2019, 38(4): 1894-1902. [13] ALLAWAY A E, JENNINGS D H. The Influence of cations on glucose transport and metabolism by, and the Loss of Sugar Alcohols from, the Fungus Dendryphiella Salina[J]. New Phytologist, 1970, 69(2): 581-593. doi: 10.1111/j.1469-8137.1970.tb07610.x [14] MILLE G, ALMALLAH M, BIANCHI M, et al. Effect of salinity on petroleum biodegradation[J]. Fresenius’ Journal of Analytical Chemistry, 1991, 339(10): 788-791. doi: 10.1007/BF00321746 [15] CHU H, LIU X, MA J, et al. Two-stage anoxic-oxic (A/O) system for the treatment of coking wastewater: Full-scale performance and microbial community analysis[J]. Chemical Engineering Journal, 2021, 417: 129204. doi: 10.1016/j.cej.2021.129204 [16] WANG Y, ZHUANG J L, LU Q Q, et al. Halophilic Martelella sp. AD-3 enhanced phenanthrene degradation in a bioaugmented activated sludge system through syntrophic interaction[J]. Water Research, 2022, 218: 118432. doi: 10.1016/j.watres.2022.118432 [17] 陈接锋, 许旭萍, 李惠珍. 球衣菌属的研究概况[J]. 环境科学与技术, 2002(6): 43-46+49. doi: 10.3969/j.issn.1003-6504.2002.06.019 [18] BEUN J J, HENDRIKS A, VAN LOOSDRECHT M C M, et al. Aerobic granulation in a sequencing batch reactor[J]. Water Research, 1999, 33(10): 2283-2290. doi: 10.1016/S0043-1354(98)00463-1 [19] 代星宝. 菌丝球用于调控丝状菌膨胀污泥的效能研究[D]. 邯郸: 河北工程大学, 2021. [20] HAILEI W, PING L, QIANLONG J, et al. Specific aerobic granules can be developed in a completely mixed tank reactor by bioaugmentation using micro-mycelial pellets of Phanerochaete chrysosporium[J]. Applied Microbiology and Biotechnology, 2014, 98(6): 2687-2697. doi: 10.1007/s00253-013-5261-7 [21] LIU Y Q, TAY J H. Characteristics and stability of aerobic granules cultivated with different starvation time[J]. Applied Microbiology and Biotechnology, 2007, 75(1): 205-210. doi: 10.1007/s00253-006-0797-4 [22] LI W, YAO J, ZHUANG J, et al. Metagenomics revealed the phase-related characteristics during rapid development of halotolerant aerobic granular sludge[J]. Environment International, 2020, 137: 105548. doi: 10.1016/j.envint.2020.105548 [23] XIAO X, MA F, YOU S, et al. Direct sludge granulation by applying mycelial pellets in continuous-flow aerobic membrane bioreactor: Performance, granulation process and mechanism[J]. Bioresource Technology, 2022, 344: 126233. doi: 10.1016/j.biortech.2021.126233 [24] LIANG Z, TU Q, SU X, et al. Formation, extracellular polymeric substances, and structural stability of aerobic granules enhanced by granular activated carbon[J]. Environmental Science and Pollution Research, 2019, 26(6): 6123-6132. doi: 10.1007/s11356-018-04101-1 [25] LI L, LIANG T, LIU W, et al. A Comprehensive review of the mycelial pellet: research status, applications, and future prospects[J]. Industrial & Engineering Chemistry Research, 2020, 59(39): 16911-16922. [26] KONG X, DONG R, KING T, et al. Biodegradation potential of Bacillus sp. PAH-2 on PAHs for oil-contaminated seawater[J]. Molecules, 2022, 27(3): 687. doi: 10.3390/molecules27030687 [27] LI H, CHI Z, LI J, et al. Bacterial community structure and function in soils from tidal freshwater wetlands in a Chinese delta: Potential impacts of salinity and nutrient[J]. Science of the Total Environment, 2019, 696: 134029. doi: 10.1016/j.scitotenv.2019.134029 [28] ASSRESS H A, SELVARAJAN R, NYONI H, et al. Diversity, co-occurrence and implications of fungal communities in wastewater treatment plants[J]. Scientific Reports, 2019, 9(1): 14056. doi: 10.1038/s41598-019-50624-z [29] DUAN J, FANG H, SU B, et al. Characterization of a halophilic heterotrophic nitrification–aerobic denitrification bacterium and its application on treatment of saline wastewater[J]. Bioresource Technology, 2015, 179: 421-428. doi: 10.1016/j.biortech.2014.12.057 [30] EOM H, KIM J, KIM S, et al. Treatment of saline wastewater containing a high concentration of salt using marine bacteria and aerobic granule sludge[J]. Journal of Environmental Engineering, 2018, 144(5): 04018026. doi: 10.1061/(ASCE)EE.1943-7870.0001354 [31] MANNAN S, FAKHRU’L-RAZI A, ALAM M Z. Use of fungi to improve bioconversion of activated sludge[J]. Water Research, 2005, 39(13): 2935-2943. doi: 10.1016/j.watres.2005.04.074 [32] LIU J, LI J, TAO Y, et al. Analysis of bacterial, fungal and archaeal populations from a municipal wastewater treatment plant developing an innovative aerobic granular sludge process[J]. World Journal of Microbiology and Biotechnology, 2016, 33(1): 14. -



 下载:
下载: