-
微生物燃料电池(microbial fuel cell, MFC)可通过微生物作用将有机废物的化学能转化为电能,实现能源结构的优化。产电微生物附着在阳极上并催化有机物产生质子和电子,电子经过阳极电极和外部电路到达阴极,质子通过离子交换膜从阳极室传输至阴极室,质子、电子和电子受体三者在阴极室结合,形成电流回路,从而实现废水处理的同时回收电能[1-2]。然而,由于反应器存在建设成本较高和功率密度相对较低的问题,MFC的扩大化应用受到限制[3-4]。电极成本占反应器建造成本的50%以上[5-6]。而且,MFC的整体性能在很大程度上取决于电极的性能[7]。MFC中生物电化学的核心过程是复杂的底物可以在电极上进行生物催化氧化[8]。电极材料的选择对电极性能具有显著影响。电活性细菌的附着、生物膜的形成和电子从生物膜到电极材料的转移速率均会受到电极材料的表面性能、电子传递类型和电阻的影响[9]。
传统电极材料主要包括碳毡(carbon felt, CF)[10]、碳布(carbon cloth, CC)[11]以及活性炭(activated carbon, AC)[12]等碳基材料。但是,这些碳基材料的原料资源受限且制造成本较高。生物炭是废弃生物质热解的副产品,具有负碳平衡[13-14]。废弃生物质是一种具有高附加值的潜在电极材料,可以用于超级电容器的电极材料[15]。生物炭也可以作为MFC的电极材料用以传输能量[16-17]。大多废弃生物质具有天然的大孔结构,经过高温碳化后,其表面粗糙度会增加。与平面结构相比,这一特征有利于微生物的附着生长、生物膜的形成和电极表面上电活性的增加[18]。BATAILLOU等[17]以雪松木作为电极原料,经过高温热解后用于MFC阳极,结果表明,在900 ℃下热解的生物炭电极的输出功率是传统CF电极的5倍。我国是农业大国,玉米作物分布在大部分农业区,而玉米秸秆作为副产物,未得到充分合理的利用。在MFC中采用秸秆生物炭作为电极,不仅可以实现秸秆废弃物的再利用,还可以解决秸秆废弃物处理的环境和经济问题。
硫化物和硝酸盐是废水中常见的有害物质,其主要来自于工业废水和农业污染等。有研究表明,MFC同步脱硫除氮会提高MFC产电效率,增加污染物去除率。蔡靖等[19]构建了双室MFC同步脱氮除硫,污染物去除率和产电性能表现优异,硝态氮去除率可达96.5%,硫化物去除率达99.64%,最大电流密度达457.20 mA·m−2。关于MFC同步脱硫反硝化的大部分研究都是在阳极同步进行脱硫和反硝化,阴极配以强氧化性化学物质,但MFC电化学反应和反硝化过程都需要电子,不可避免地要产生竞争,使MFC总体产电性能和基质去除能力下降,而且阴极的强氧化性物质也会造成二次污染。
基于以上研究结果,本研究以玉米秸秆作为电极原料,通过碳化控制手段制备了生物炭作为MFC电极,阳极室内以S2−为电子供体,阴极室内以NO3−为电子受体,构建了同步脱硫反硝化MFC。以CF作为参照电极,考察了玉米秸秆生物炭电极MFC在电化学性能、电能输出和污染物去除等方面的性能,探究了硫氮比等条件对生物脱硫反硝化以及产电效能的影响。
-
玉米秸秆取自江苏徐州农场。将玉米秸秆通过破碎机粉碎过60目筛后,放入烘箱中80 ℃烘干24 h,之后将烘干的秸秆颗粒在N2氛围下600 ℃碳化2 h。利用60目不锈钢网编织成尺寸为7 cm×7 cm×1.5 cm的长方体,将碳化后的玉米秸秆置于不锈钢长方体中制备成三维网状电极,通过钛丝连接传输电流。传统电极材料CF(7 cm×7 cm×1.5 cm)用作对照电极。
-
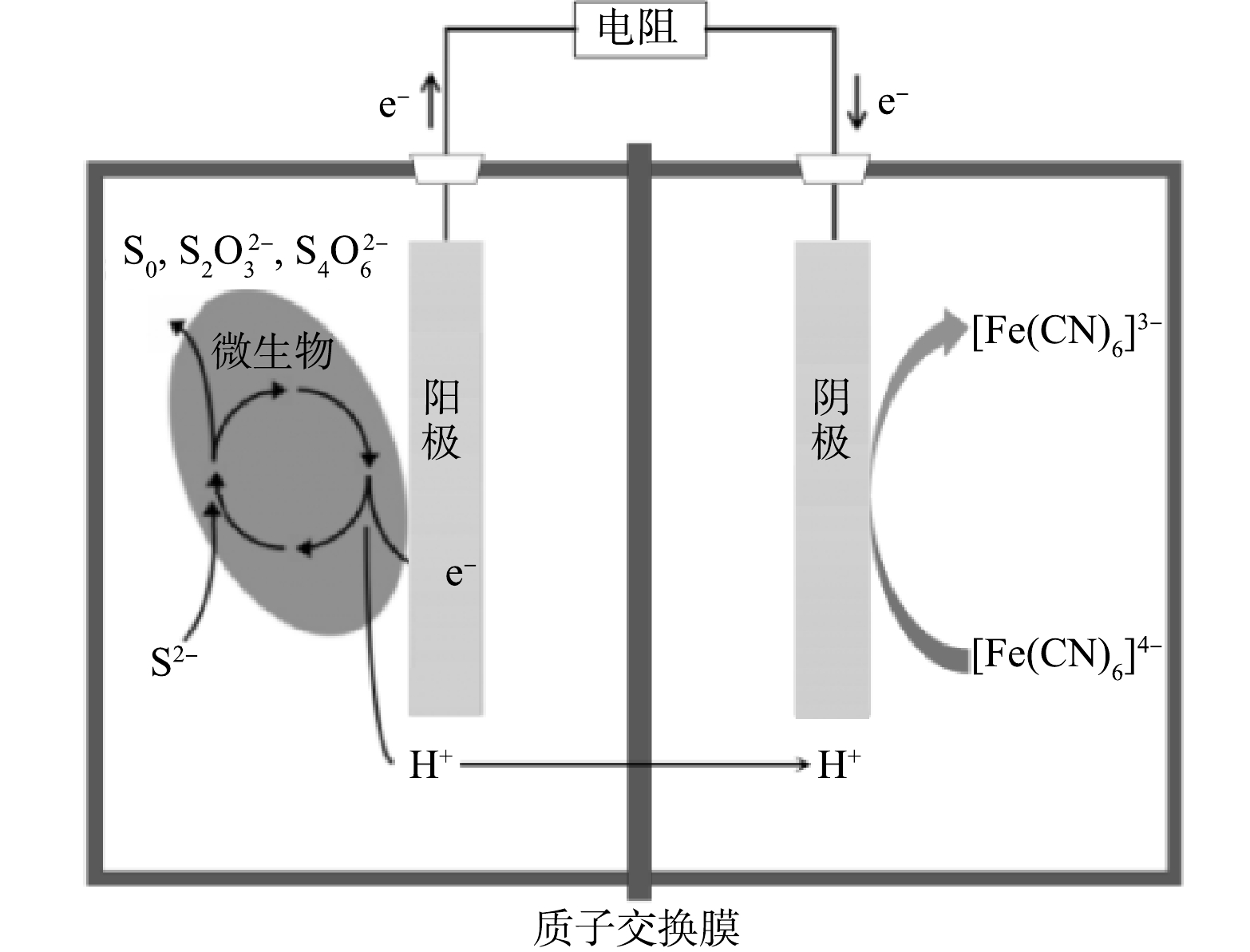
双室MFC为有机玻璃制成,每个腔室容积为320 mL,由质子交换膜(proton exchange membrane, PEM,Nafion N117,杜邦,美国)分隔(图1)。在每个腔室的顶部设有2个直径为2 cm的进出水孔。阳极接种微生物取自沈阳南部污水处理厂的厌氧池污泥,阴极污泥取自生物缺氧池。模拟化工废水基质包含0.1 g·L−1 NH4Cl、0.1 g·L−1 KCl、12.5 mL·L−1 矿物质溶液、5 mL·L−1 微生物溶液[20]、0.05 mol·L−1 磷酸盐缓冲溶液(phosphate buffered saline, PBS, 包括 2.65 g·L−1 KH2PO4、10.91 g·L−1 Na2HPO4·12H2O、0.5 g·L−1 NaHCO3),阳极投加0.9 g·L−1 Na2S·9H2O为电子供体,阴极以不同质量浓度梯度的NaNO3为电子受体,同时阴极加入0.5 g·L−1 CH3COOH为反硝化菌提供充足碳源。
-
电极材料置入MFC前,分别在接种污泥中浸泡48 h以富集产电微生物。在启动阶段,CF电极MFC (CF-MFC) 和玉米秸秆生物炭电极MFC (CS-MFC) 阳极进水S2−质量浓度均为120 mg·L−1,阴极NO3−-N质量浓度为48 mg·L−1。产电稳定后,在进水S2−质量浓度为120 mg·L−1的条件下,按硫氮比为5∶2、5∶4、5∶6、5∶8条件添加NaNO3溶液,并探讨硫氮比对MFC输出功率及污染物去除率的影响。MFC置于恒温培养箱中,控制温度为(30±1) ℃。反应器采用序批式运行方式,当MFC输出电压小于50 mV时,界定1个产电周期结束,更换阳极液和阴极液。
-
CS的表面形貌由扫描电子显微镜拍摄(scanning electron microscope, SEM, TESCAN MIRA LMS, Czech Republic)。MFC电压由数据采集器(Agilent 34972A, USA)每10min采集电压。在电化学工作站的三电极系统中,进行了循环伏安曲线(cyclic voltammetry, CV)、Tafel曲线、电化学阻抗谱(electrochemical impedance spectroscopy, EIS)的测量:将阳极电极设置为工作电极,将阴极电极和阳极室内饱和甘汞电极(saturated calomel electrode, SCE) 设置为对电极和参比电极;CV 测试在-1~0.5 V内进行;Tafel图通过10 mV·s−1的扫描速率进行;EIS测量的频率为1×105~0.01 Hz,正弦扰动幅度为10 mV。污染物测量采用国家标准方法(水和废水监测分析方法,2002):S2−,对氨基二甲基苯胺光度法;SO42−,铬酸钡光度法;NO3−,紫外分光光度法;NO2−,N-( 1-萘基)-乙二胺光度法。
-
生物炭的微观形貌结构如图2所示,在CS表面可以观察到开放的大孔结构。这种孔结构的形成可能是因为生物炭在碳化过程中有机物的分解和挥发性副产物的排放导致的;也可能是因为玉米秸秆生物炭本身存在的天然大孔结构。生物炭的大孔结构有助于总内比表面积的增加[21],也利于微生物的附着生长,从而为电活性微生物提供更多的有效表面积。
-
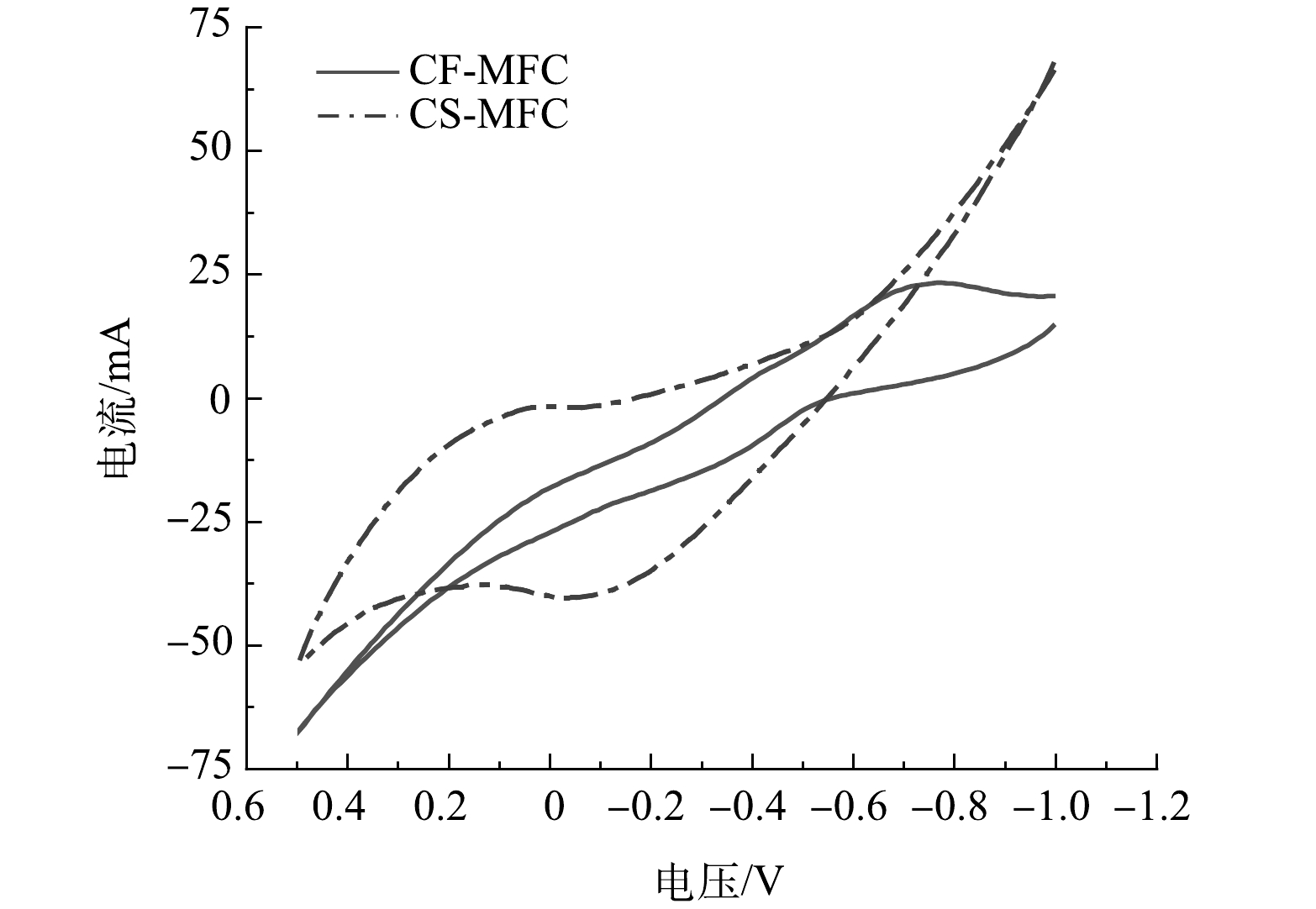
循环伏安测试可以了解电极的电化学行为[22]。CF-MFC和CS-MFC的CV扫描曲线如图3所示。可见,CS-MFC的氧化还原回路呈现出更大的面积,表明其具有更优的电容性能[23]。电容电流与电极材料的可用有效表面积之间存在关联,在相同的实验条件下,他们显示出正相关[24]。显著提升的电容性能可能与CS表面所呈现的开放大孔结构相关。
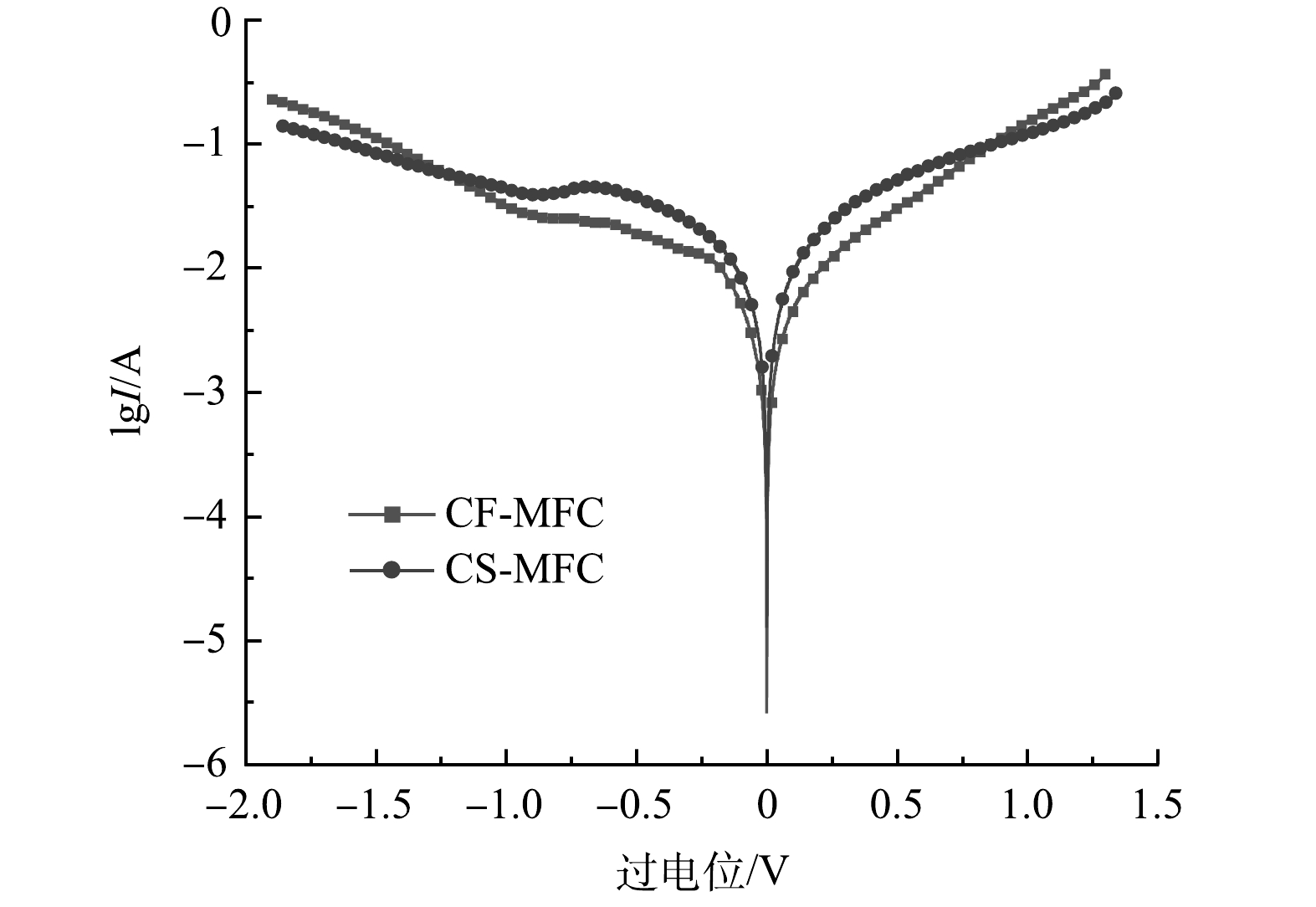
反应物与平衡产物之间的交换速率可以通过Tafel图衡量(图4)。由图4中计算得到的交换电流密度(i0)可以表征电极的电催化活性[25]。本研究中i0是通过将曲线(过电位60~80 mV;R2>0.99)外推到过电位为零进行计算(表1)。CF-MFC和CS-MFC的i0分别为5.01×10−3 A·cm−2和22.42×10−3 A·cm−2。交换电流密度的升高表明了氧化还原反应的活性增强[26]。微生物和电子供体在CS-MFC中能有效参与氧化还原反应,从而产生更高的电流。
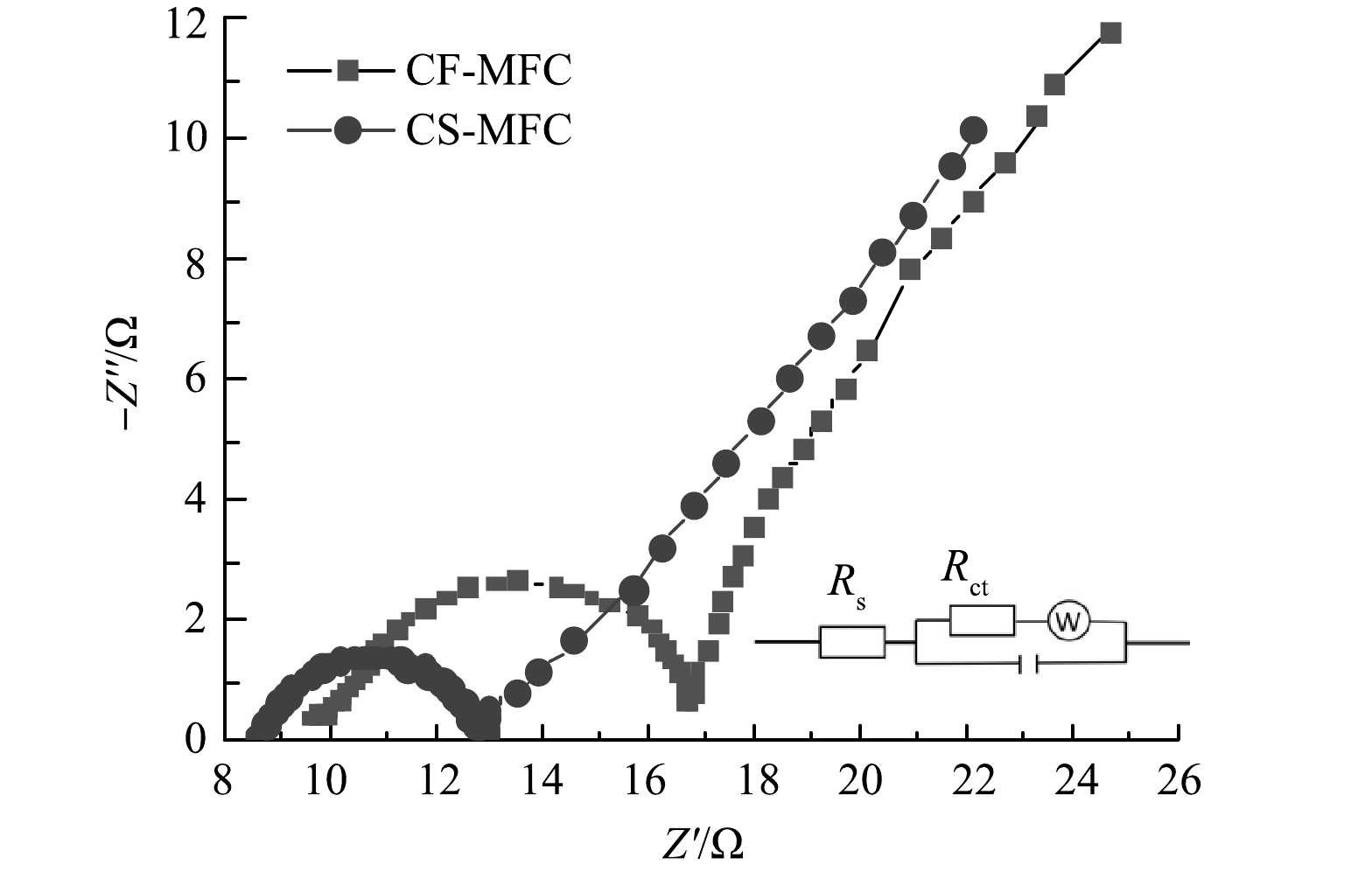
内阻是影响微生物燃料电池电能输出的重要因素。通过应用EIS测试技术对MFC进行表征,以深入研究其电阻特性。测试结果由Zview软件拟合,拟合结果图和等效电路模型如图5所示。电阻行为由高频区的半圆和低频区的直线组成,半圆部分对应着有限电荷转移过程,直线部分对应于电极电解质界面上的有限扩散过程或传质过程[27]。半圆部分提供了有关溶液电阻(Rs)和电荷转移电阻(Rct)的信息。CF-MFC和CS-MFC的Rs分别为9.57 Ω和8.60 Ω。低Rs值反映了溶液和电极之间传质的改善[28]。Rct可用于表征电子从生物膜到电极材料过程的转移能力[29]。CS-MFC的Rct为4.24 Ω,小于CF-MFC的Rct(7.10 Ω)。Rct的减少表明界面面积的扩大和阳极表面与微生物生物膜之间界面相互作用的加强[30]。CS表面的大孔结构可以提供更多的活性反应位点和接触面面积,促进了电荷的转移。
-
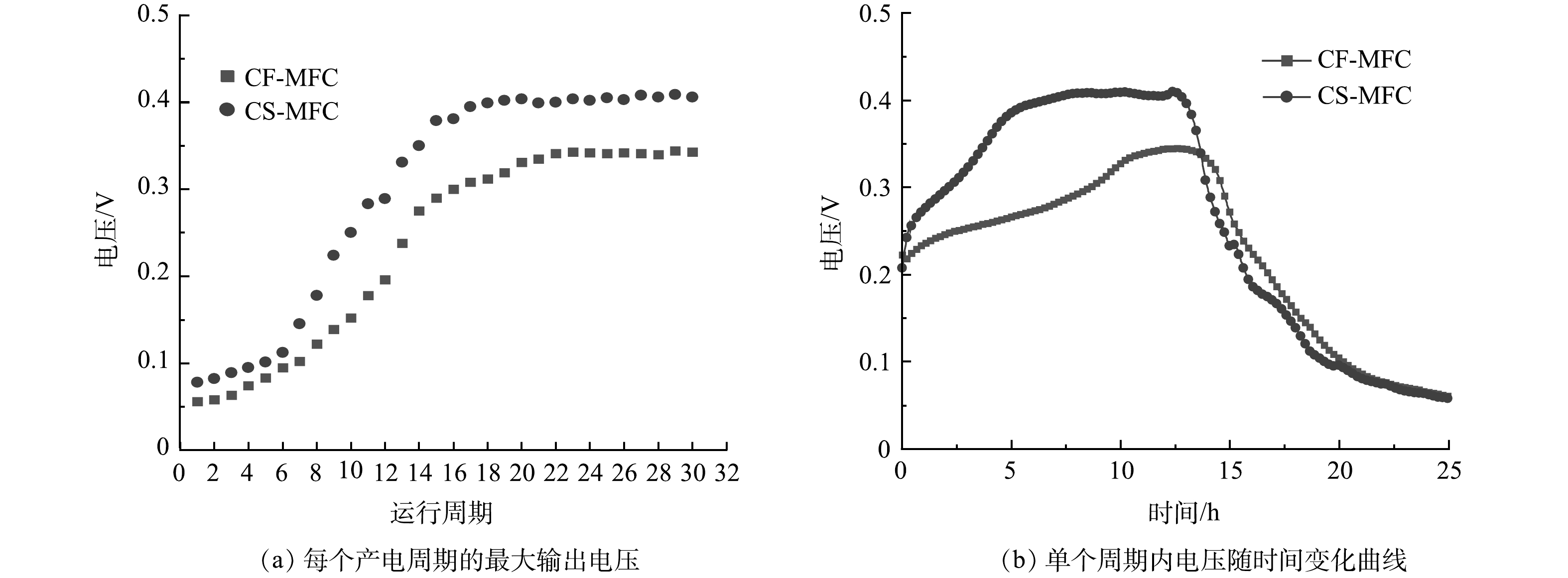
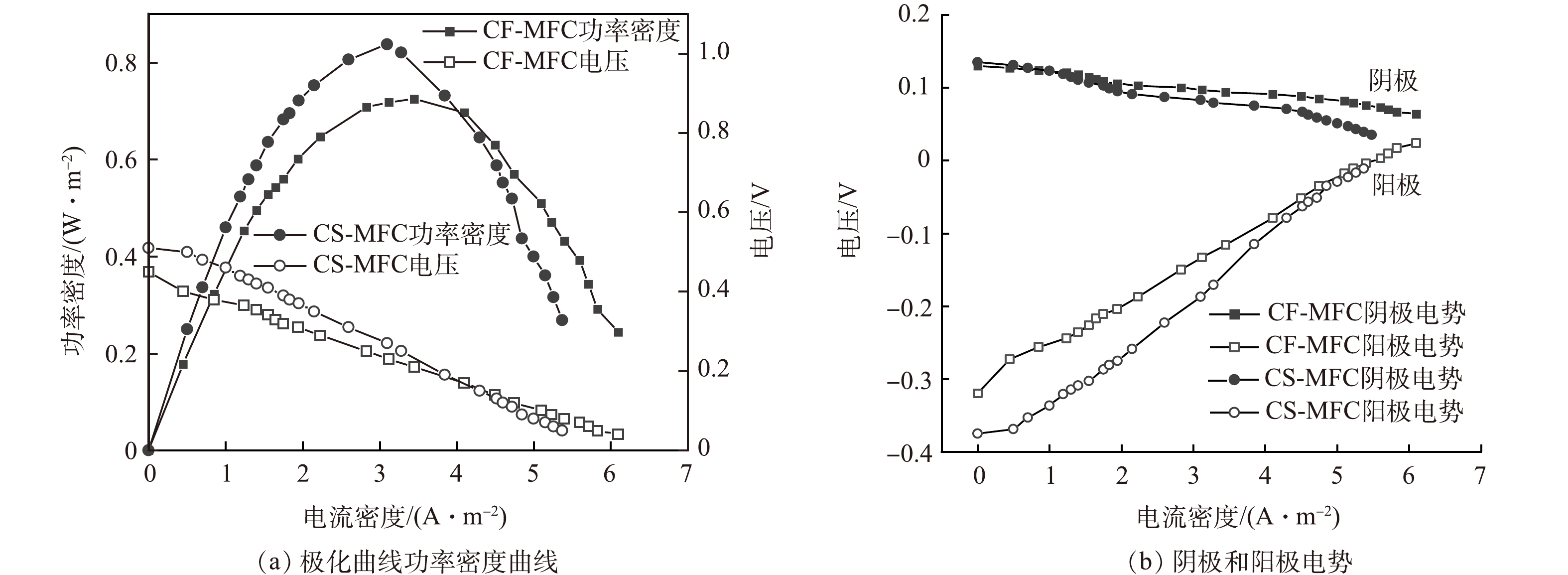
启动阶段,MFC连续产电周期的最大输出电压如图6(a)所示,图6(b)反映了反应器运行稳定后一个产电周期内的电压输出变化。其中,在前6个周期,MFC输出电压上升较为缓慢,可能是由于此时电活性微生物还处于悬浮状态,与电极的附着尚未紧密。随着电活性微生物的富集,电活性生物膜逐渐形成,输出电压迅速上升,最大电压趋于稳定。在至少连续3个产电周期内MFC均能取得相近的输出电压,则认为MFC启动成功[31]。在启动初期CS-MFC的输出电压(78 mV)高于CF-MFC的输出电压(56 mV)[32]。有研究[33]表明,初期MFC产电是自发电化学作用的结果。在EIS测试中,CS-MFC较低的电阻更有助于高效传输电子(图5),因此,CS-MFC在初期表现出较高的输出电压。CF-MFC在第22周期启动成功,CS-MFC输出电压在第17个周期达到稳态。CS-MFC启动时间更短,这可能是由于玉米秸秆生物炭丰富的多孔结构为微生物提供了更多的附着面积,加速了微生物的定殖和电活性生物膜的形成。MFC启动成功后,CF-MFC和CS-MFC能达到的最大输出电压分别为344.67 mV和409.84 mV,这进一步证明CS-MFC在产电能力方面具有显著优势。有关生物炭电极用于同步脱硫反硝化MFC的报道较少,在一项关于传统碳基材料电极脱硫反硝化MFC的研究[33]中,反应器运行20 d后,输出电压在176 mV左右趋于稳定,输出功率低于本研究中的最大输出功率。
MFC的最大功率密度反映了其单位面积的电能输出能力,这一参数对于评估MFC在可再生能源生产和废水处理等实际工程应用中的潜力具有重要的指导意义。CF-MFC和CS-MFC的最大输出功率密度分别为0.72 W·m−2和0.84 W·m−2 (图7)。生物炭的发达孔隙结构提供了更多的反应位点,从而促进微生物的附着和生长。这增加了微生物与电极之间的接触,有助于提高电极上的生物反应速率,从而提高了MFC的功率密度。
-
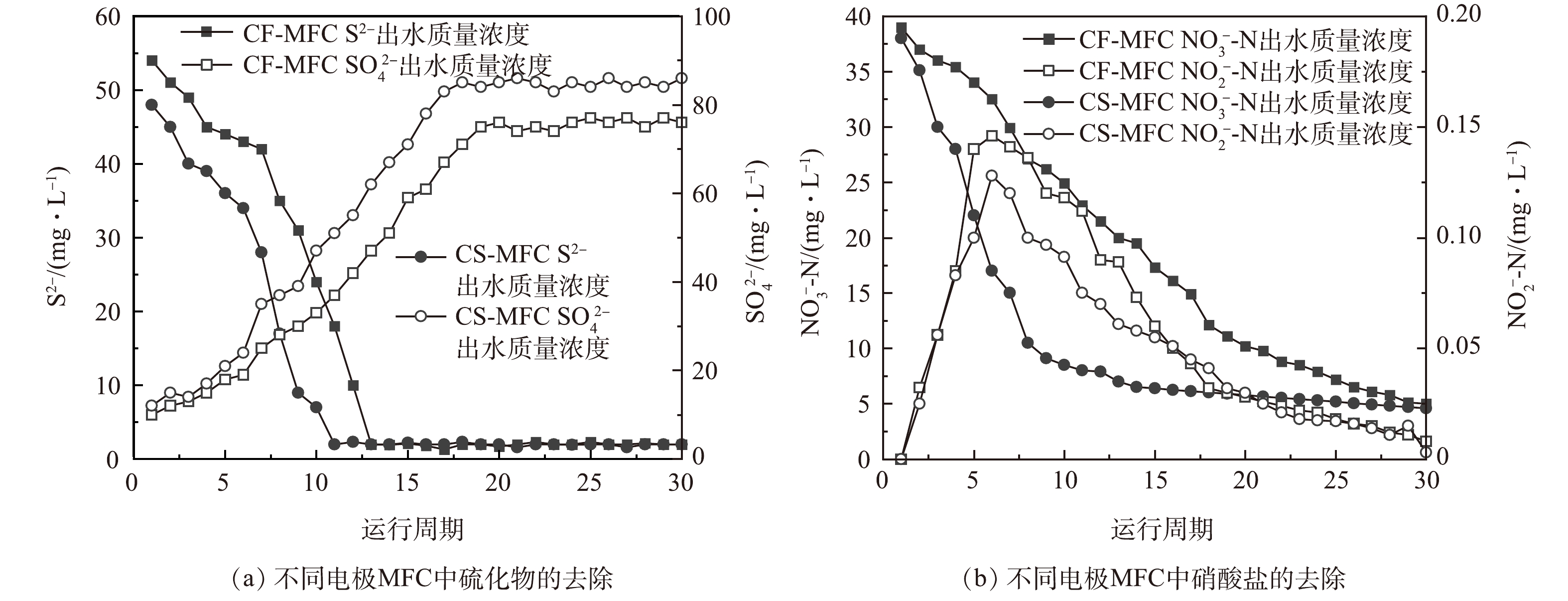
如图8(a)所示,在进水S2−质量浓度为120 mg·L−1的条件下,前6个周期启动阶段CF-MFC和CS-MFC的反应器S2−出水质量浓度均低于60 mg·L−1,之后几个周期S2−含量迅速降低至小于2 mg·L−1;CF-MFC和CS-MFC出水SO42含量也在6个产电周期后缓慢增长到19.3 mg·L−1和24.5 mg·L−1,之后迅速上升至76.3 mg·L−1和86.2 mg·L−1,稳定阶段SO42−-S转化率达到63.58%和73.22%;稳定阶段对阳极出水进行关于亚硫酸根离子(S2O32−)、二硫六酸根离子(S4O62−)、多硫化物(Sx2−)等硫中间价态化合物的质量浓度测定,检测结果均低于0.1 mg·L−1(可忽略不计)。有研究[34]表明,由S2−至S0的转化过程是电化学作用和微生物共同作用的结果,而由S0至SO42−的转化过程主要是通过微生物的氧化作用完成。结合MFC最大输出电压结果(图6)分析,在启动初期,电活性微生物尚未完全附着,电能输出水平较低,但仍能实现较高的S2−去除水平,可能是因为硫化物是阳极室内唯一的电子供体。随着电活性生物膜的逐步形成,电活性微生物将S2−氧化为SO42−,这是一种更稳定的氧化产物。此时出水S2−迅速下降,SO42−不断增多,输出电量也不断攀升。
反应器启动后,CF-MFC和CS-MFC的出水NO3−-N质量浓度不断下降,CS-MFC的下降速率明显高于CF-MFC(图8(b))。有研究表明,500 ℃下热解形成的CS对NO3−-N的吸附能力高达2.659 mg·g−1,硝酸盐去除率最高能达到93.4%[35]。因此,相比于CF-MFC,CS-MFC阴极在硝态氮去除过程中,不仅可以利用反硝化微生物在碳基材料表面的生物降解,还可以充分利用玉米秸秆生物炭电极表面的吸附特性,共同推动NO3−-N的快速去除。反应器运行稳定后,电活性生物膜在电极表面生成,此时吸附作用趋于平稳,2种电极对NO3−-N的降解效果也趋于接近。在整个运行期间,CF-MFC和CS-MFC阴极室出水NO2−-N含量呈现迅速升高后逐渐减少的趋势,其最高值均未超过0.15 mg·L−1,说明MFC阴极室的反硝化均较彻底,未产生明显NO2−-N释放。
MFC可以促进同步脱硫反硝化的过程,主要是因为MFC提供了一种有利于同时进行硫化物去除和硝酸盐还原的环境。首先,MFC中阳极和阴极提供了氧化还原反应所需的电子传输途径,硫化物在阳极被氧化释放的电子通过外部电路传输到阴极供硝酸盐还原使用。其次,电极表面生成的生物膜也产生了积极的促进作用,生物膜上的电活性微生物提高了催化活性,促进了硫化物的氧化和硝酸盐的还原。MFC的特殊的环境促进了硫化物和硝酸盐的氧化还原反应,有助于硫化物和硝酸盐的协同去除。
-
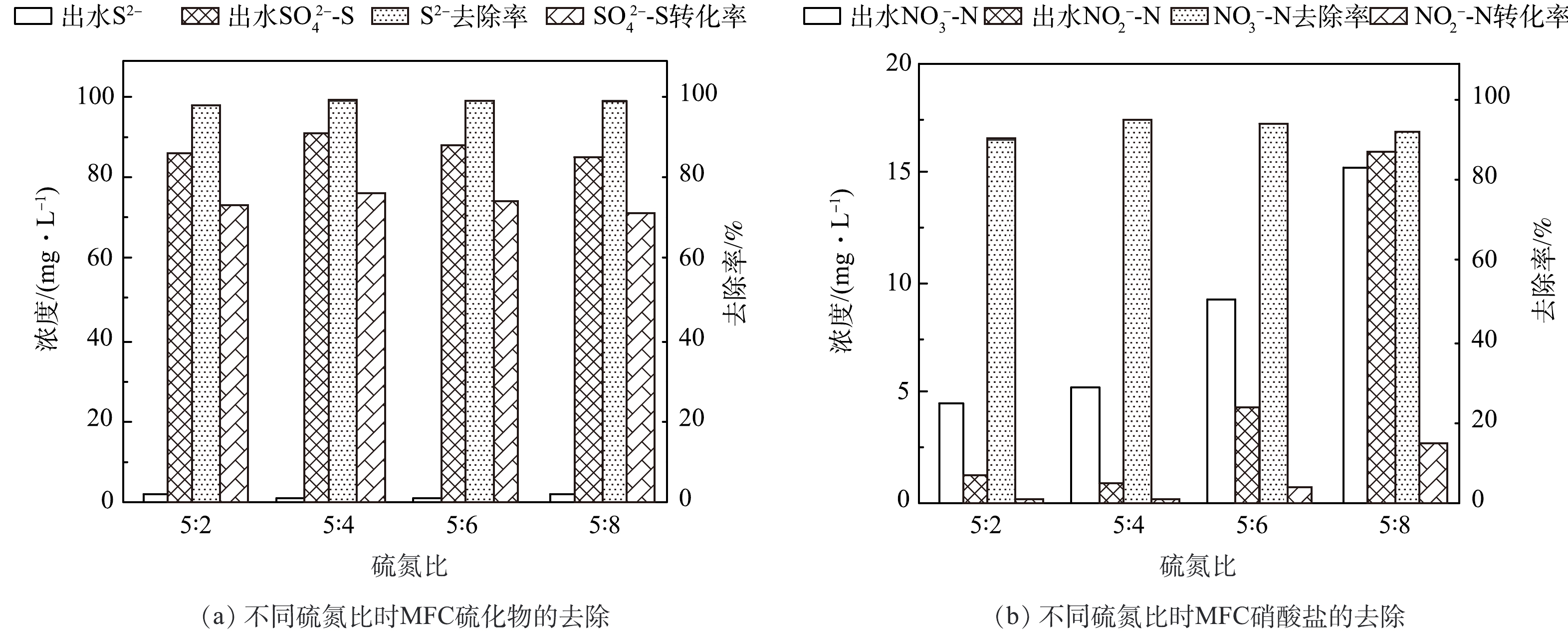
MFC稳定阶段,根据硫氮比对MFC性能影响的结果(图9(a))可知,当硫氮比分别为5∶2、5∶4、5∶6、5∶8时,S2−去除率分别为98.1%、99.1%、98.8%、98.5%,S2−去除率均在98%以上。本实验阳极室内未引入额外碳源,S2−为唯一电子供体,附着在阳极表面的微生物以及悬浮在水中的微生物均以S2−作为唯一的能量来源,导致S2−去除率显著提升。检测硫氮比为5∶2、5∶4、5∶6、5∶8时出水中SO42−-S的含量,SO42−-S转化率分别为73.31%、76.52%、74.39%、71.57%。均大于70%,多数S2−都转化为SO42−-S。硫氮比对阳极室S2−去除率和SO42−-S转化率的影响均较为有限。蔡靖等[19]构建的双室MFC阳极室以硫化物为电子供体,当硫化物质量浓度为540 mg·L−1时,硫酸盐转化率也为70%左右(71.14±1.57)%,与本研究实验结果相似。
对于阴极反硝化,如图9(b)所示,当NO3−-N质量浓度从48 mg·L−1增加到192 mg·L−1时,出水NO3−-N质量浓度不断上升。当硫氮比为5∶4时,即NO3−-N进水质量浓度为96 mg·L−1,NO3−-N去除率达到最高,为94.5%,NO2−-N出水仅为0.91 mg·L−1。当NO3−-N进水质量浓度增加到硫氮比为5∶6时,NO3−-N去除率为93.6%,此时NO2−-N出水为4.32 mg·L−1。当硫氮比为5:8时,NO3−-N去除率下降至92.1%,且NO2−-N出水质量浓度上升至15.93 mg·L−1。当阴极室NO3−质量浓度较低时,硝酸盐被完全还原为N2,没有中间产物NO2−的产生。由于硫氮比对阳极S2−去除的影响不大,其氧化产生的电子供体数量有限,所以当NO3−质量浓度不断上升时,NO3−无法全部被还原为N2,部分NO3−只能被还原为NO2−[36]。在本研究反应器中,硫氮比5∶4被确定为最佳质量浓度比。在此比例下,实现了S2−和NO3−-N的最大去除率,同时也促进了阳极氧化和阴极还原反应的充分进行。
在不同硫氮比条件下,反应器产电性能如表2所示。随着进水NO3−-N含量的不断上升,产电量先上升后下降,硫氮比为5∶4时电压和功率密度达到最大,同时也达到了最高的库伦效率(19.57%)[37]。随着硝酸盐含量的上升, MFC的产电性能提高的可能是因为硝酸盐的存在增加了电子受体的可用性,促进了氧化还原反应的进行,提高了反应速率,使更多的电子被释放并传递到电极之间,从而增加了电能产生。但当NO3−-N含量的继续增加后,反应器产电性能出现下降趋势。当硫氮比为5∶6时,出水NO2−-N含量明显上升。推测产电性能的降低是由于反应过程中产生的副产物NO2−对阴极电活性微生物的抑制作用所致[38]。
-
本实验研究了CS作为同步脱硫反硝化MFC电极的可行性以及影响因素。研究结果表明,相对于传统CF,CS作为MFC电极具有较好的电催化活性、产电性能和污染去除能力,结论如下。
1) CS表面存在天然大孔结构,其作为MFC电极时电容性能优于传统CF。CS-MFC更高的i0(22.42×10−3 A·cm−2)预示其强电催化活性,CS-MFC溶液电阻(8.60 Ω)和电荷转移电阻(4.24 Ω)与CF-MFC相比下降了10.14%和40.28%。
2) CS-MFC启动时间少于CF-MFC,且运行稳定后CS-MFC输出最大电压达到409.84 mV,相对于CF-MFC (344.67 mV)提升了18.91%。此外,CS-MFC功率密度(0.84 W·m−2)相对于CF-MFC (0.72 W·m−2)也有明显的提升。在S2−质量浓度为120 mg·L−1的条件下,S2−作为唯一电子供体被氧化殆尽。生物炭的强微生物亲和力使得S2−的氧化进程更深,CS-MFC的SO42−-S转化率达到73.22%。CS-MFC和CF-MFC的NO3−-N去除率水平相近,这源于所设置的较低硝酸盐含量,使得所有硝酸盐都被还原并接受电子。
3)硫氮比对于S2−去除率和SO42−-S转化率影响不大。硫氮比对NO3−-N去除的影响较大,在低硝酸盐质量浓度范围内,质量浓度的提升会导致较高的NO3−-N去除率且无NO2−-N累积。硫氮比为5∶4时,NO3−-N去除率达到最大(94.5%),此时输出最大电压和功率密度也达到最大,分别为450.68 mV和1.03 W·m−2。当硝酸盐含量进一步升高,副产物亚硝酸盐含量的升高对电活性微生物产生毒害作用,NO3−-N去除率和产电性能均呈下降趋势。
玉米秸秆生物炭电极用于微生物燃料电池脱硫反硝化性能
Desulfurization and denitrification performance of corn straw biochar electrode for microbial fuel cell
-
摘要: 研究了玉米秸秆生物炭作为微生物燃料电池电极的性能。阳极以S2−为单一电子供体,阴极以NO3−为电子受体,以碳毡为对照电极,考察玉米秸秆生物炭电极用于生物燃料电池同步脱硫反硝化的电化学性能、产电性能以及污染物去除能力,分析了不同硫氮质量浓度比对生物炭电极微生物燃料电池脱氮除硫效率以及输出电能的影响。结果表明,玉米秸秆生物炭电极微生物燃料电池实现了更高的交换电流密度(22.42×10−3 A·cm−2)和更低的电荷转移电阻(4.24 Ω)。与碳毡电极相比,玉米秸秆生物炭电极微生物燃料电池最大输出电压和最大功率密度分别提升了18.91%和16.67%。当硫氮比为5:4时,反应器脱硫反硝化和产电能力最佳。阳极室S2−出水质量浓度由120 mg·L−1降至1.08 mg·L−1,去除率为99.1%,其中76.52%转化为SO42−-S,阴极室NO3−-N去除率为94.5%。此时反应器输出电压和功率密度也达到最大值,分别为450.68 mV和1.03 W·m−2。Abstract: In this study, the performance of corn straw biochar as the electrode of microbial fuel cell was investigated. The anode and cathode were configured with S2− as the exclusive electron donor, and with NO3− as the electron acceptor, respectively, and carbon felt was employed as the reference electrode to assess the electrochemical performance, power generation capability, and pollutant removal capacity of the corn stalk biochar electrodes in the simultaneous desulfurization-denitrification microbial fuel cells. Furthermore, the influences of different sulfur-to-nitrogen concentration ratios on the denitrification and desulfurization efficiency and the electrical energy output of the biochar electrode microbial fuel cells were explored. The experimental results show that the corn straw biochar microbial fuel cell achieved higher exchange current density (22.42×10−3 A·cm−2) and lower charge transfer resistance (4.24 Ω). Compared with carbon felt electrode, the maximum output voltage and power density of microbial fuel cell with corn straw biochar electrode increased by 18.91% and 16.67%, respectively. When the ratio of sulfur to nitrogen was 5:4, the best desulfurization, denitrification and electricity generation capacity occurred for the reactor. The effluent concentration of S2− in anode chamber decreased from 120 mg·L−1 to 1.08 mg·L−1, and the removal rate was 99.1%, of which 76.52% converted to SO42−-S, and the removal rate of NO3−-N in cathode chamber was 94.5%. At this time, the output voltage and power density of the reactor reached the maximum values, which were 450.68 mV and 1.03 W·m−2, respectively.
-
Key words:
- microbial fuel cell /
- biochar /
- desulphurization and denitrification /
- electrocatalysis
-

-
表 1 Tafel曲线计算结果
Table 1. The calculation results of Tafel curve
电极 线性拟合方程 R2 i0/(A·cm−2) CF y= 1.518 1x − 2.300 9 0.998 7 5.01×10−3 CS y =0.751 7x − 1.649 4 0.994 9 22.42×10−3 表 2 不同硫氮比下MFC产电性能
Table 2. Electricity generation performance of MFCs at different sulfur-nitrogen ratios
硫氮比 最大输出
电压/mV最大功率
密度/(W·m2)库伦
效率/%5:2 409.84 0.84 14.36 5:4 450.68 1.03 19.57 5:6 446.85 0.94 18.21 5:8 420.13 0.89 14.36 -
[1] JATOI A S, AKHTER F, MAZARI S A, et al. Advanced microbial fuel cell for waste water treatment: A review[J]. Environmental Science and Pollution Research, 2021, 28(5): 5005-5019. doi: 10.1007/s11356-020-11691-2 [2] HERNÁNDEZ-FERNÁNDEZ F J, PÉREZ DE LOS RÍOS A, SALAR-GARCÍA M J, et al. Recent progress and perspectives in microbial fuel cells for bioenergy generation and wastewater treatment[J]. Fuel Processing Technology, 2015, 138: 284-297. doi: 10.1016/j.fuproc.2015.05.022 [3] WANG H, REN Z J. Bioelectrochemical metal recovery from wastewater: A review[J]. Water Research, 2014, 66: 219-232. doi: 10.1016/j.watres.2014.08.013 [4] XIE X, YE M, HU L, et al. Carbon nanotube-coated macroporous sponge for microbial fuel cell electrodes[J]. Energy & Environmental Science, 2012, 5(1): 5265-5270. [5] WEI J, LIANG P, ZUO K, et al. Carbonization and activation of inexpensive semicoke-packed electrodes to enhance power generation of microbial fuel cells[J]. ChemSusChem, 2012, 5(6): 1065-1070. doi: 10.1002/cssc.201100718 [6] HOU J, LIU Z, YANG S, et al. Three-dimensional macroporous anodes based on stainless steel fiber felt for high-performance microbial fuel cells[J]. Journal of Power Sources, 2014, 258: 204-209. doi: 10.1016/j.jpowsour.2014.02.035 [7] ZHENG J, CHENG C, ZHANG J, et al. Appropriate mechanical strength of carbon black-decorated loofah sponge as anode material in microbial fuel cells[J]. International Journal of Hydrogen Energy, 2016, 41(48): 23156-23163. doi: 10.1016/j.ijhydene.2016.11.003 [8] CHEN S, HE G, LIU Q, et al. Layered corrugated electrode macrostructures boost microbial bioelectrocatalysis[J]. Energy & Environmental Science, 2012, 5(12): 9769-9772. [9] CUI H F, DU L, GUO P B, et al. Controlled modification of carbon nanotubes and polyaniline on macroporous graphite felt for high-performance microbial fuel cell anode[J]. Journal of Power Sources, 2015, 283: 46-53. doi: 10.1016/j.jpowsour.2015.02.088 [10] ZHANG C, LIANG P, YANG X, et al. Binder-free graphene and manganese oxide coated carbon felt anode for high-performance microbial fuel cell[J]. Biosensors and Bioelectronics, 2016, 81: 32-38. doi: 10.1016/j.bios.2016.02.051 [11] NARAYANASAMY S, JAYAPRAKASH J. Carbon cloth/nickel cobaltite (NiCo2O4)/polyaniline (PANI) composite electrodes: Preparation, characterization, and application in microbial fuel cells[J]. Fuel, 2021, 301: 121016. doi: 10.1016/j.fuel.2021.121016 [12] GE B, LI K, FU Z, et al. The performance of nano urchin-like NiCo2O4 modified activated carbon as air cathode for microbial fuel cell[J]. Journal of Power Sources, 2016, 303: 325-332. doi: 10.1016/j.jpowsour.2015.11.003 [13] AWASTHI M K. Engineered biochar: A multifunctional material for energy and environment[J]. Environmental Pollution, 2022, 298: 118831. doi: 10.1016/j.envpol.2022.118831 [14] KANT BHATIA S, PALAI A K, KUMAR A, et al. Trends in renewable energy production employing biomass-based biochar[J]. Bioresource Technology, 2021, 340: 125644. doi: 10.1016/j.biortech.2021.125644 [15] NOROUZI O, MARIA F D, DUTTA A. Biochar-based composites as electrode active materials in hybrid supercapacitors with particular focus on surface topography and morphology[J]. Journal of Energy Storage, 2020, 29: 101291. doi: 10.1016/j.est.2020.101291 [16] CHENG D, NGO H H, GUO W, et al. Applying a new pomelo peel derived biochar in microbial fell cell for enhancing sulfonamide antibiotics removal in swine wastewater[J]. Bioresource Technology, 2020, 318: 123886. doi: 10.1016/j.biortech.2020.123886 [17] BATAILLOU G, LEE C, MONNIER V, et al. Cedar wood-based biochar: Properties, characterization, and applications as anodes in microbial fuel cell[J]. Applied Biochemistry and Biotechnology, 2022, 194: 4169-4186. doi: 10.1007/s12010-022-03997-3 [18] SONAWANE J M, YADAV A, GHOSH P C, et al. Recent advances in the development and utilization of modern anode materials for high performance microbial fuel cells[J]. Biosensors and Bioelectronics, 2017, 90: 558-576. doi: 10.1016/j.bios.2016.10.014 [19] 蔡靖, 刘思懿, 吴媛媛, 等. 同步脱氮除硫燃料电池的电化学特性研究[J]. 浙江大学学报(理学版), 2022, 49(1): 105-111. [20] REN Z, WARD T E, REGAN J M. Electricity production from cellulose in a microbial fuel cell using a defined binary culture[J]. Environmental Science & Technology, 2007, 41(13): 4781-4786. [21] HUGGINS T, WANG H, KEARNS J, et al. Biochar as a sustainable electrode material for electricity production in microbial fuel cells[J]. Bioresource Technology, 2014, 157: 114-119. doi: 10.1016/j.biortech.2014.01.058 [22] NAVEENKUMAR M, SENTHILKUMAR K. Microbial fuel cell for harvesting bio-energy from tannery effluent using metal mixed biochar electrodes[J]. Biomass and Bioenergy, 2021, 149: 106082. doi: 10.1016/j.biombioe.2021.106082 [23] CHEN Q, PU W, HOU H, et al. Activated microporous-mesoporous carbon derived from chestnut shell as a sustainable anode material for high performance microbial fuel cells[J]. Bioresource Technology, 2018, 249: 567-573. doi: 10.1016/j.biortech.2017.09.086 [24] TORCHAŁA K, KIERZEK K, GRYGLEWICZ G, et al. Narrow-porous pitch-based carbon fibers of superior capacitance properties in aqueous electrolytes[J]. Electrochimica Acta, 2015, 167: 348-356. doi: 10.1016/j.electacta.2015.03.153 [25] VENKATA MOHAN S, SRIKANTH S. Enhanced wastewater treatment efficiency through microbially catalyzed oxidation and reduction: Synergistic effect of biocathode microenvironment[J]. Bioresource Technology, 2011, 102(22): 10210-10220. doi: 10.1016/j.biortech.2011.08.034 [26] LIU Y, XU X, SADD M, et al. Insight into the Critical Role of Exchange Current Density on Electrodeposition Behavior of Lithium Metal[J]. Advanced Science, 2021, 8(5): 2003301. doi: 10.1002/advs.202003301 [27] KARTHIKEYAN R, WANG B, XUAN J, et al. Interfacial electron transfer and bioelectrocatalysis of carbonized plant material as effective anode of microbial fuel cell[J]. Electrochimica Acta, 2015, 157: 314-323. doi: 10.1016/j.electacta.2015.01.029 [28] BIAN B, SHI D, CAI X, et al. 3D printed porous carbon anode for enhanced power generation in microbial fuel cell[J]. Nano Energy, 2018, 44: 174-180. doi: 10.1016/j.nanoen.2017.11.070 [29] ERBAY C, YANG G, DE FIGUEIREDO P, et al. Three-dimensional porous carbon nanotube sponges for high-performance anodes of microbial fuel cells[J]. Journal of Power Sources, 2015, 298: 177-183. doi: 10.1016/j.jpowsour.2015.08.021 [30] XIE X, PASTA M, HU L, et al. Nano-structured textiles as high-performance aqueous cathodes for microbial fuel cells[J]. Energy & Environmental Science, 2011, 4(4): 1293-1297. [31] 苏志强, 付国楷, 王雪原, 等. 四室微生物燃料电池同步脱氮除碳及产电性能[J]. 环境工程学报, 2023, 17(9): 2879-2890. [32] 蔡靖, 郑平, 胡宝兰, 等. 硫氮比对厌氧生物同步脱氮除硫工艺性能的影响[J]. 环境科学学报, 2008(8): 1506-1514. [33] 魏炎, 张少辉, 赵丽, 等. 反硝化脱硫微生物燃料电池的可行性研究[J]. 环境科学学报, 2016, 36(8): 2832-2837. [34] SUN M, MU Z X, CHEN Y P, et al. Microbe-assisted sulfide oxidation in the anode of a microbial fuel cell[J]. Environmental Science & Technology, 2009, 43(9): 3372-3377. [35] XIA Y, LU D, QI Y, et al. Removal of nitrate from agricultural runoff in biochar electrode based biofilm reactor: Performance and enhancement mechanisms[J]. Chemosphere, 2022, 301: 134744. doi: 10.1016/j.chemosphere.2022.134744 [36] 郭昌梓, 姚佳玉, 张凤燕, 等. 硫自养反硝化燃料电池脱氮除硫及产电性能的实验研究[J]. 陕西科技大学学报, 2018, 36(4): 28-34. [37] 谢霄云. MFC同步处理含硫含氮废水的运行效能及微生物群落分析[D]. 合肥: 合肥工业大学, 2022. [38] JØRGENSEN B B. A thiosulfate shunt in the sulfur cycle of marine sediments[J]. Science, 1990, 249(4965): 152-154. doi: 10.1126/science.249.4965.152 -



 下载:
下载: