-
河流在地球水循环中具有不可替代的生态、环境和社会服务等功能,也是最脆弱的生态系统之一,易受气候变化、人为破坏等外界因素的影响。河流生态系统的保护、健康维持和恢复已成为全社会共同关注的问题[1-2]。尽管河流状况可通环境参数 (pH、COD、营养盐、溶解氧等) 来评价,但只能反映水体瞬时的污染物浓度,难以体现系统复合污染产生的综合效应[3]。为全面反映污染或人为干扰对水质、水生生物和水生态系统的影响,需要利用生物评价对其进行补充完善。
水体生物评价能监测生物对污染物质的反应,即通过研究水生生物的种群数量、群落结构组成和水生态系统功能等的动态,分析和判断水体受污染的性质和程度[4]。底栖动物即大型底栖无脊椎动物,是水生态系统的重要组成部分,其中的大多数对环境扰动敏感,迁移能力较弱,相比浮游动植物、鱼类等,可更有效地反映水体中各种污染因子对生物的综合作用和累积效应,常作为指示生物被广泛应用于水质评价和环境监测中[5-6]。胡小红等[7]对北运河流域底栖动物群落特征进行分析,并筛选得到水质驱动因子,最终对北运河流域水生态系统健康状况进行评价。GOLOVATYUK等[8]通过调查俄罗斯Samoroda河中游和河口河段大型底栖动物群落的物种组成、密度、生物量和估计产量探究了盐分对生态系统的影响。但针对数量众多、生态系统较为脆弱的内陆中小型河流生态系统健康评价及大型底栖动物与环境因子相关性方面的研究仍相对薄弱。
赤水河发源于云南省镇雄县,横跨滇、黔、川三省,是长江南岸较大的一级支流,对维持周围流域生物多样性和生态系统的稳定性具有重要意义[9-10]。赤水河也是贵州省的核心经济纽带,为流域社会经济发展提供了优质的水源和丰富的水生生物资源,具有极其重要的生态和经济地位[11]。近年来,随着赤水河流域社会经济活动显著增加和自然环境的恶化,流域水体逐渐面临水生态状况下降、生物多样性降低、水环境污染的威胁,准确评价其水体健康程度对水生态保护具有重大意义。
本研究以赤水河 (仁怀段) 为研究对象,对其开展底栖动物的系统调查,从空间结构上分析赤水河底栖动物群落组成,明确赤水河水体的污染状况,阐明底栖动物与环境因子间的相关关系,以期为赤水河生态环境保护提供参考,促进赤水河流域生态系统良性循环。
-
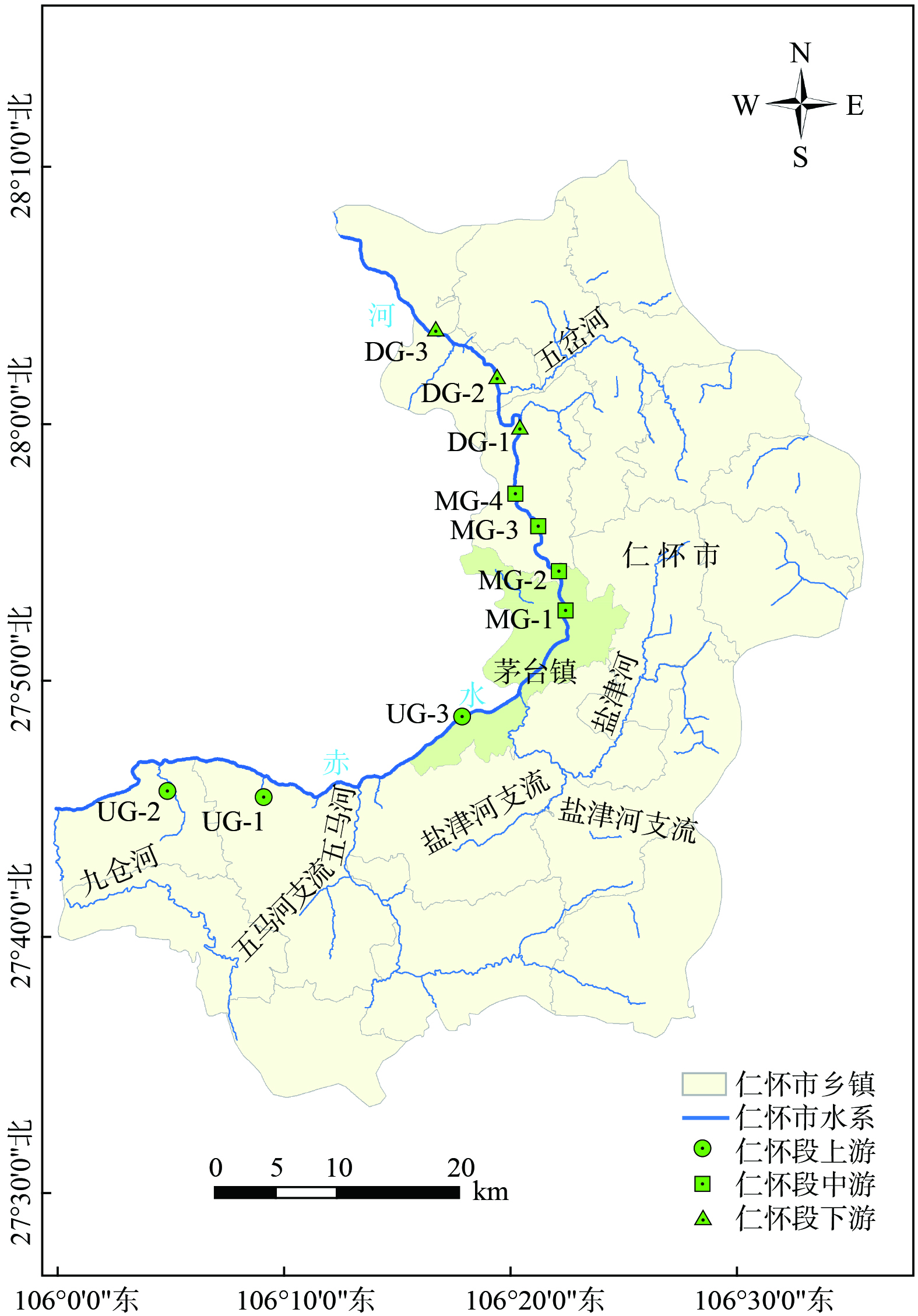
赤水河(104° 45'~106° 51'E、27° 20'~28° 50'N)发源于云南省镇雄县,流经云南、贵州、四川 3省,于四川省合江县注入长江,干流总长 436.5 km,流域面积 20 440 km2,河流落差为 1 588 km。根据赤水河流域特征、河流汇入等情况,采样点包括赤水河 (仁怀段) 上游 (编号 UG)、中游 (编号 MG)、下游 (编号 DG),其中UG-1、UG-2为赤水河支流,UG-3、MG-1、MG-2、MG-3、MG-4、DG-1、DG-2、DG-3为赤水河 (仁怀段) 干流点。具体点位情况如图1所示。
-
采用口径为 25 cm×25 cm索伯网 (孔径为 0.5 mm) 对大型底栖动物进行定量采集,依据生境情况使用口径为 25 cm×25 cm的 D型抄网 (孔径为 0.5 mm) 对大型底栖动物进行定性采集,对于不可涉水的位点,用 1/16 m2的彼得森采泥器采集底栖动物,每个采样位点重复采集 3 次。在现场将采集到的底栖动物样品经过60目筛网过筛冲洗,置于白色解剖盘中分拣,转入 50 mL的聚乙烯塑料瓶加入95%的酒精溶液保存。
底栖动物样品使用显微镜和解剖镜对其进行鉴定,为确保结果的准确性,参照《生物多样性观测技术指导 淡水底栖大型无脊椎动物》 (HJ 710.8-2014) 对底栖动物进行鉴定[12],底栖动物样本尽可能鉴定到种,对鉴定得到的数量及密度进行三次以上的核对。底栖动物种类鉴定参考书目主要有《底栖动物与河流生态评价》《辽河流域底栖动物监测图鉴》《中国经济动物志—淡水软体动物》《中国蜉蝣概述》以及 Aquatic insects of China useful for monitoring water quality[13-14]。
-
水质参数采取现场测定与实验室检测相结合,现场用多参数水质分析仪测定水体DO、pH和水温等指标。采集后的水样置于4 ℃冰箱中保存用于理化性质检测,参照《地表水环境质量标准(GB3838-2002)》测定水样理化指标。TN采用碱性过硫酸钾消解紫外分光光度法;[NH4+-N]采用纳氏试剂分光光度法;TP、[PO43−-P]采用钼锑抗分光光度法;COD采用快速测定法检测。
-
按公式 (1) 计算1 m2底栖动物丰度。
式中:N表示底栖动物丰度,ind·m−2;Ma为采样面积,m2;n为计数所得个体数,ind。
选用 Shannon-Wiener多样性指数(H
$'$ )、Margalef's物种丰富度指数(M)、Simpson's Diversity指数(D)和Pielou均匀度指数(P)[15-16]进行生物学评价,计算公式如 (2)~(5) 所示。使用 Excel 2019和origin 2021对数据进行相关处理并绘图。样点分布图采用 ArcGis 10.7绘制。采用 SPSS 26.0进行相关性分析;采用Canoco 5.0分析大型底栖动物群落结构与环境因子之间的关系。式中:S为群落中物种数目;N为群落的总个体数;ni为第i种物种的个数;Pi为种i的个体数占群落中总个体数的比例。
-
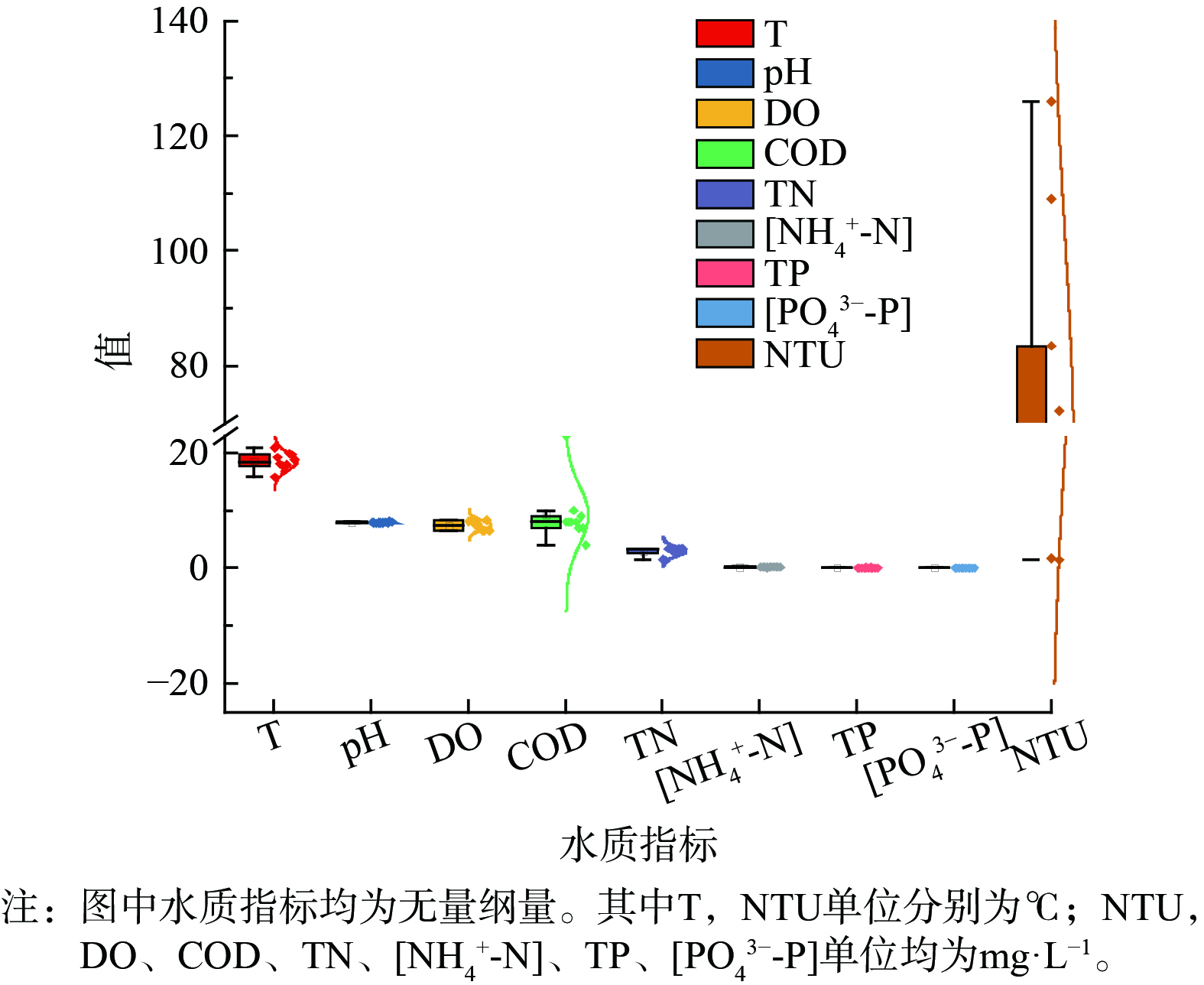
为分析赤水河 (仁怀段) 地区水质的空间变化特征,分别在上、中、下游布设采样点采集河流水样并对主要指标进行检测,各点位水体理化指标变化趋势见图2。pH、TP、[PO43−-P]、[NH4+-N]在不同分布空间变化不大,均值分别为7.95、0.03、0.01和0.08 mg·L−1。从上游至中游,DO出现下降趋势,并在下游基本持平。COD和浊度变化趋势相似,均呈现先上升在中游达到较大值再下降的趋势。其中,浊度在MG-1处最大,为126 NTU。COD是反应水体有机污染物含量的综合指标,在MG-4处质量浓度较高,达23 mg·L−1。TN为1.24~3.36 mg·L−1,从上游向下游含量逐渐增加,平均值由1.74 mg·L−1分别增至3.11和3.36 mg·L−1。参照水环境质量标准 (GB 3838-2002) ,赤水河 (仁怀段) 中游和下游平均TN超过Ⅴ类水质标准,并远超过国际上广泛认可的发生水体富营养化的临界质量浓度(0.2 mg·L−1)[17],富营养化程度严重。结合赤水河 (仁怀段) 沿线的主要污染源分布情况以及河流受到的入河污染物排放和人类活动等因素,中游地区的茅台镇附近集中了酿酒企业和人口,酿酒工业废水和生活污水的排放明显,有机物的输入导致了浊度、COD、TN等指标的增加,而有机物的降解和转化则导致了水体中溶解氧的降低。下游水质受到了河流的自净作用以及周边支流的稀释作用,呈现出改善的趋势,COD和浊度降低,但TN仍处于相对较高水平。
进一步对监测获得的9类环境因子进行相关性分析。首先进行 K-S正态检验,得出COD和TN不符合正态分布,故对这两类指标进行 Spearman分析,其余指标进行 Pearson分析,结果如表1所示。环境因子中,DO与[NH4+-N]和TP呈一定相关性,COD与[PO43−-P]呈负相关,TN与浊度具有较高相关性。由于pH、TP、[PO43−-P]、[NH4+-N]在调查区域内沿程变化不大,最终保留T、DO、COD、TN、浊度共5个指标,进行环境因子独立性分析。
-
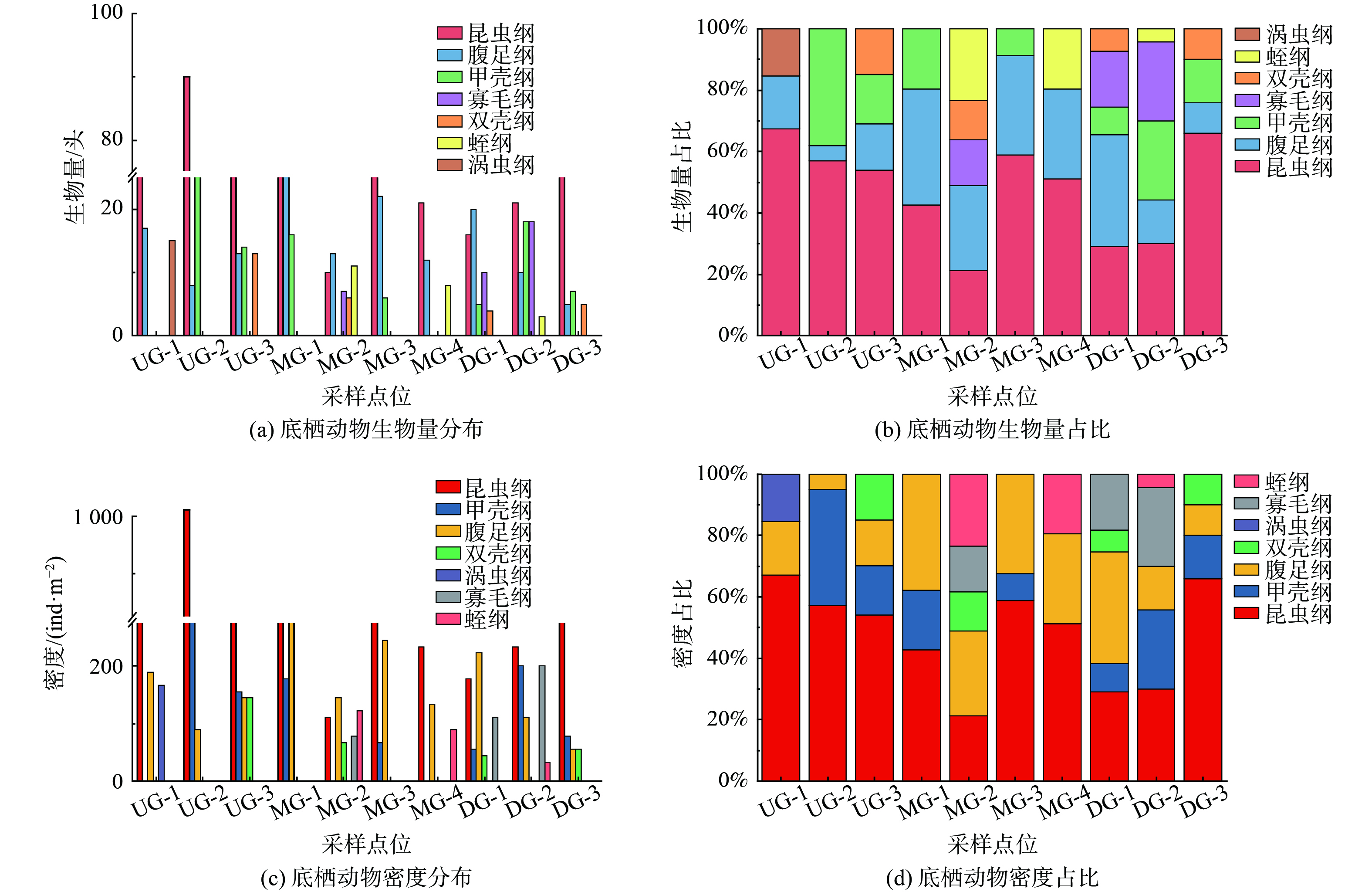
在赤水河 (仁怀段) 共布设了11个水生态监测点位,涵盖干流和上游主要支流,兼顾多种生境类型,各点位物种密度、生物量及其组成变化见图3。本研究共采获大型底栖无脊椎动物756头,包括环节动物、软体动物、节肢动物及扁形动物门,隶属于4门7纲32科48属种。其中,软体动物门2纲7科9属,节肢动物门2纲21科34属,环节动物门2纲3科4属,扁形动物门由涡虫科三角涡虫构成。
从生物量分布来看,昆虫纲总体上占绝对优势,共有33类种属,占总生物量的50.13%。其中,划蝽属、摇蚊属、等蜉属为优势种属,自河流上游至下游呈逐渐减少的趋势;腹足纲次之,生物量在中游占比最高;涡虫纲仅发现于UG-1点位处,且占比较低,仅为总生物量的1.98%。赤水河 (仁怀段) 流域底栖动物密度分布空间差异较大,总密度为8 400 ind·m−2,平均密度为1 200 ind·m−2,密度分布范围166.67~4 211.11 ind·m−2。底栖动物密度分布为节肢动物>软体动物>环节动物>扁形动物,其中昆虫纲密度最高 (4 211.11 ind·m−2) ,腹足纲次之 (1 677.78 ind·m−2) ,涡虫纲 (166.67 ind·m−2) 密度最低,与生物量呈对应关系。昆虫纲主要以划蝽属、摇蚊属、等蜉属为主,平均密度分别为40.00、37.78和34.44 ind·m−2,占昆虫纲总密度的26.65%。腹足纲中萝卜螺属、椭圆萝卜螺、膀胱螺丰度相对较高,总密度占腹足纲密度的83.44%。
从空间分布角度,赤水河 (仁怀段) 底栖动物生物量和密度均表现为上游>中游>下游,且上游物种生物量和密度均远高于中、下游。赤水河上游3个采样点分别采集到底栖动物18、13、11种,UG-1处底栖动物生物量最丰富 (18种) ,主要包括蜉蝣目、毛翅目和蜻蜓目类群;其次为UG-2处 (13种) ,同样以蜉蝣目,毛翅目和蜻蜓目类群为主。下游底栖动物种类数量相对较少,平均底栖动物种类为8.3种。物种数量最少的采样点为中游MG-2处 (7种) ,以腹足纲、双翅目摇蚊属和寡毛纲等中等耐污和耐污类群为主。赤水河底栖动物密度结果发现UG-2采样点处 (1 766.67 ind·m−2) 底栖动物密度最高,昆虫纲和甲壳纲 (1 011.11、666.67 ind·m−2) 贡献最多,物种组成以敏感类群如蜉蝣目等蜉属、小蜉属和蜉蝣属为主。UG-1样点 (1 044.44 ind·m−2) 密度次之,毛翅目 (144.44 ind·m−2) 和涡虫目 (166.67 ind·m−2) 为主要贡献类群,物种组成同样以敏感类群蜉蝣目蜉蝣属和小蜉属为主。底栖动物密度较低的采样点为MG-4 (455.56 ind·m−2) 和DG-3 (555.56 ind·m−2) ,该采样点位于赤水河干流下游,以蜉蝣目和半翅目类群贡献为主,其中蜉蝣目类群为中度耐污类群的四节蜉科和细蜉科。从底栖动物优势物种构成分析,群落结构变化显著,优势种呈现小型化的趋势,表现为从丰富的昆虫纲演变为小型软体动物河蚬和耐污能力较强的铜锈环棱螺。软体动物门的椭圆萝卜螺、铜锈环棱螺等高度耐污物种逐渐演变为赤水河 (仁怀段) 流域的优势物种。其中,螺类耐受营养盐,耐污能力强、对环境适应性相对较强[18]。
引起赤水河 (仁怀段) 底栖动物群落结构变化可能主要有如下原因。由于工农业、养殖业及城市化的快速发展,使得水体遭受了不同程度的污染,底栖动物物种丰度和密度整体不高,体型较大的软体动物已从优势类群组成中逐渐消失。在流域上游,受人为干扰相对较少,水质清洁,栖境良好;中、下游受到周边酿酒工业废水和城镇生活污染,富营养化水平加剧,底栖动物群落逐渐被小个体的耐污种类所主导,且群落有趋于简单化的演替趋势。赤水河 (仁怀段) 中、下游附近水体污染程度较高,双壳纲密度占比升高,而大型底栖动物密度整体降低,可能是随支流汇入的农业面源污染及工业废水等在该处聚集,水体氮磷含量迅速上升,藻类大量繁殖,而藻类生长挤占生态位使大型底栖动物的发展受到抑制[19],总密度迅速下降。在位于赤水河 (仁怀段) 中游的MG-2点位,仅捕捉到7种大型底栖动物,且腹足纲优势度远超于其他物种,这说明该河段生态系统相对脆弱,稳定性较低。大型底栖动物的群落组成依赖于河流生境的稳定性和多样性[20],下游水体中悬浮物浓度升高,影响大型底栖动物的浮游食物供应,生境异质性下降。同时,有研究表明低氧会降低生物的多样性[21-22],赤水河流域下游DO明显低于上游和中游,也导致了物种数量的大幅减少。
-
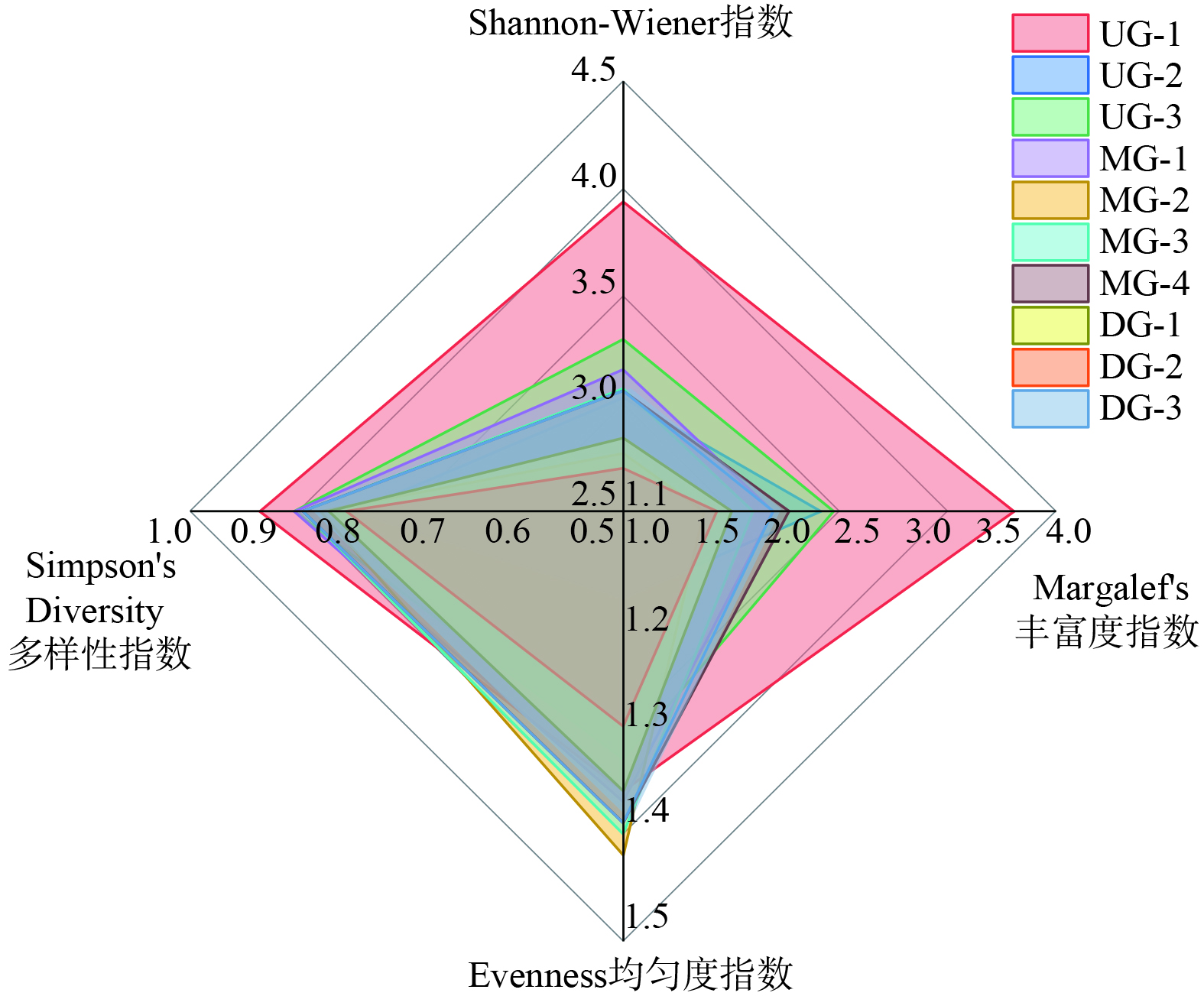
利用 Shannon-Wiener指数、Margalef's物种丰富度指数、Simpson's Diversity指数和Pielou均匀度指数对水质进行了生物学评价,结果如图4所示。Shannon-Wiener指数(H′)的大小意味着群落多样性的高低,其值越大,多样性越高,反之物种多样性越低。赤水河流域H′的波动范围为2.70~3.94,平均值为3.093,物种组成处于适中到较高的范畴,UG-1处H′为3.94,为调查点位的最高值,DG-2处H′值最低 (2.70) 。H′也能反应水体的污染,一般来说,H′值小于1,重污染;H′值为1~2,中等污染;H′值为 2~3,轻度污染;H′值大于3,清洁。赤水河 (仁怀段) 整体水质状况良好,介于“清洁”与“轻污染”之间,这可能与赤水河上游河段远离城镇,人为干扰较少,生态环境状况维持良好有关。尽管赤水河中游河段有城镇生活排污和酒厂排放物的影响,但因整个调查区域没有筑坝拦截,河流具有自身净化调节能力,所以水质相对较好,属于轻污染范围。Margalef’s物种丰富度指数代表系统物种的组成状况,为1.65~3.71,平均值为1.63,最大值仍为UG-1处 (3.71) ,上游物种丰富度明显优于中、下游。Simpson's Diversity值越大,表示各物种在群落内优势度物种越小,其变化范围为0.81~0.92,平均值为0.861,每个物种数量相对比较均衡。Evenness均匀度代表群落中物种分布的均匀性,其分布越均匀代表生态系统系统越稳定。赤水河流域均匀度指数变化不大,平均为1.35,这表明赤水河流域底栖底栖动物分布具有一定稳定性。张泽豪等[23]也采用相同的指数研究评估了淮河干流的水生态健康,并推测污染来源主要为周边的城市生活污水和工业生产废水,与本研究结果一致。
由相似性系数矩阵 (表2) 可知,各点位底栖动物组成差异较大,大部分点位之间的相似性系数均低于0.25,属于极不相似范围。另有部分点位的相似性系数为0.25~0.5,属于中度不相似,此类现象大多发生在同一采样空间点处,如UG-1和UG-2的相似性系数为最高0.45,DG-2和DG-1、DG-3相关性系数也均大于0.4。这3个采样点均位于赤水河下游,距离较近,在物种组成上有一定相似度。
-
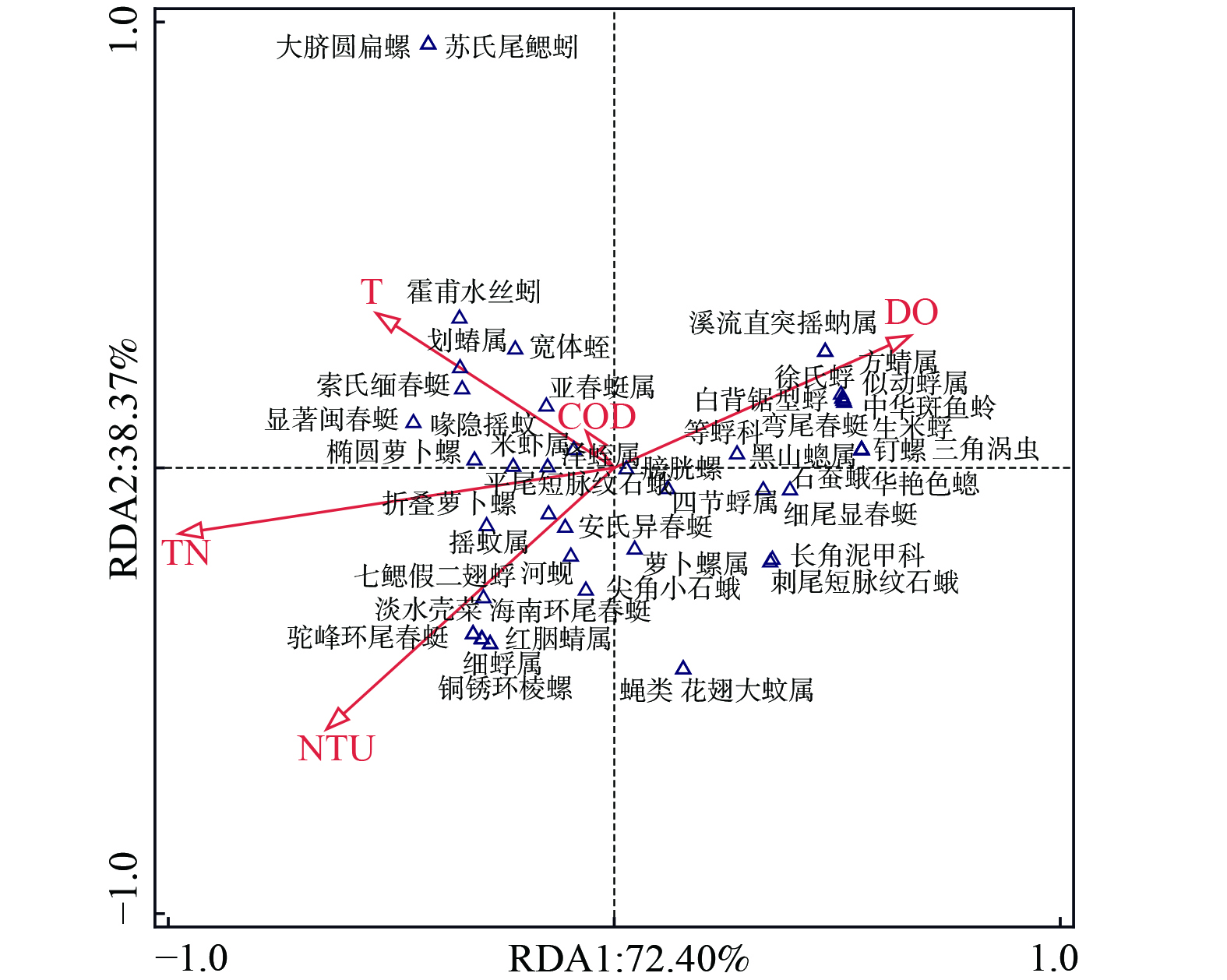
底栖动物的群落结构对环境变化的响应十分敏感,水体理化特征、流域位置状况、周边环境等因素均会导致底栖动物结构发生变化,但理化性质仍是最重要的因素之一[21, 24]。采用冗余分析(RDA)探究赤水河流域底栖动物群落结构与环境因子的关系。在冗余分析排序图中,环境因子与响应变量夹角余弦值及箭头的长短代表两者的相关性及影响强度,采样点之间距离的远近代表各点位的相似程度。通过比较分析,选用对赤水河水环境起主要作用的TN、浊度、温度、DO与COD与浮游动物群落进行对应分析,这5类参数具有一定的相关性,其中TN和DO呈显著相关。由分析结果(图5)可知,轴 1和轴 2的解释率分别为72.40%和 38.37%,TN和浊度与物种的变化最为显著,DO和温度对群落结构的影响次之。当TN、浊度较高时铜锈环棱螺、淡水壳菜、细蜉属等昆虫纲、贻贝科生物丰度较高;就温度而言,环节动物门的霍甫水丝蚓、宽体蛭、苏氏尾鳃蚓与其呈正相关;当DO较高时,徐氏蜉、生米蜉等蜉蝣目,方蜻属等蜻蜓目和蚋属、喙隐摇蚊、溪流直突摇蚊等双翅目生物分布广泛,在DO相对较低的情况下,甲壳类动物的存活率较低。
大量研究表明,浊度能通过改变水体的透明度影响底栖生物的生长、繁殖,进而改变底栖动物的群落结构[25]。赤水河水体浊度较高、含沙量大,在空间分布上表现为中下游高于上游。当水体浊度较低时,耐污性更强的铜锈环棱螺转变为优势种。BARTOLI等[26]研究发现浊度是驱动鄱阳湖底栖动物群落结构的影响显著因子,与本研究结果相似。TN可反映水环境的营养化水平,而富营养化通常会引起一系列生态问题,如栖境同质化、植被覆盖度和溶解氧含量降低,导致一些对营养盐富集和缺氧环境敏感的物种消失,从而降低底栖动物的生物多样性[27]。铜锈环棱螺和摇蚊幼虫等耐污种通常在营养水平高的水体中成为优势种[28]。赤水河上游水体DO较高,工、农业废水污染会消耗大量水体中的DO,导致下游DO降低,河流种群密度迅速降低[29],从而抑制甲壳类和河蚬类等物种的生长繁殖。这与怒江源区的调查结果一致,溶氧低的区域,颤蚓和摇蚊等物种为常见的优势种群[30]。水温对大型底栖动物的密度与分布具有一定影响,适宜的温度有利于底栖动物物种丰富度和密度的增加。水温较低会在一定程度上导致生物量下降。如霍甫水丝蚓等寡毛类生物是一种生活在深海栖息地的物种,这些栖息地通常与DO和温度有关[31]。王燕妮等[32]发现流域内温度升高会促进有机物降解,导致耗氧量增加,从而会干扰底栖动物的组成。COD虽然是评估河流污染的重要指标[22],但与以往研究不同,COD在赤水河流域对底栖动物群落结构的干扰较小,故仍需结合河流实际情况进行分析。
-
1) 在赤水河共采集并鉴定出大型底栖动物 4门7纲32科48属种,昆虫纲为优势类群,赤水河大型底栖动物群落结构呈现明显的上下游差别,上游物种多样性及密度显著高于中下游河流,随着生境和水质的退化,中下游样点优势物种过渡为中等敏感种和耐污种。2) 影响赤水河大型底栖动物物种空间分布的关键环境因子为TN、浊度和DO;随着下游工业化及城市化进程的推进,赤水河富营养化程度加重,优势物种转变为以双翅目摇蚊幼虫和寡毛类水丝蚓为代表物种的耐污类群。3) 为更好地实现赤水河生态保护,首先要降低水体营养水平,然后通过种植水生植物等手段提高河流的异质性,丰富底栖动物的种类,从而改善生态系统的功能,实现流域保护。
赤水河 (仁怀段) 底栖动物群落特征及驱动因素分析
Macroinvertebrate community characteristics and driving factors in the Chishui River (Renhuai section)
-
摘要: 为探究赤水河 (仁怀段) 底栖动物群落组成特点及其与环境因子的内在关联,开展底栖动物组成和水质参数的综合研究。通过采用密度、生物量调查,多样性指数,Pearson相关性和冗余性分析等方法,对赤水河 (仁怀段) 地区的大型底栖动物群落组成和主要影响环境因子进行分析。结果表明,在赤水河 (仁怀段) 地区共采集到48种大型底栖动物,隶属于4门7纲32科,底栖动物的物种数和密度分布均呈现上游高于中下游的趋势。其中,昆虫类动物丰度最高,共有33类种属,腹足纲次之。Shannon-Wiener多样性指数和Margalef's物种丰富度指数表现为上游高于中下游,表明底栖动物群落结构空间存在一定差异,而Pielou均匀度指数和Simpson's Diversity指数整体变化不大。冗余分析结果显示,TN、DO和浊度是影响赤水河底栖动物群落结构的主要环境因子。该研究结果可为赤水河底栖动物群落的恢复与生态环境保护提供参考。Abstract: To investigated the characteristics of the macrobenthic community composition in the Chishui River (Renhuai section) and its correlation with environmental factors, this study conducted a comprehensive investigation into benthic animal composition and water quality parameters. Density, biomass, diversity index, Pearson correlation and redundancy analysis were used to analyze the macrobenthic community composition and the main influencing environmental factors in the region. Results revealed that 48 species of macrobenthos were collected and identified in the Chishui River (Renhuai section), which belonged to 4 phylum, 7 classes and 32 orders. The species richness and density distribution of benthic animals decreased from upstream to downstream, among which the abundance of insects was the highest, with 33 species and genera, followed by gastropods. The Shannon-Wiener diversity index and Margalef's species richness index indicated values in the upstream region compared to the midstream and downstream areas, with some spatial variation in benthic community structure, whereas the Pielou evenness index and Simpson's Diversity index showed relatively consistent values across the spatial gradient. The redundancy analysis demonstrated that the most critical environmental factors affecting benthic community structure were TN, DO and turbidity. This research provided scientific support for the restoration of macrobenthic communities and ecological protection of the Chishui River.
-
Key words:
- Chishui River /
- macrobenthos /
- biodiversity /
- environmental factors
-

-
表 1 赤水河 (仁怀段) 水质指标相关性分析
Table 1. Correlation relationships of water quality indicators in the Chishui River (Renhuai section)
水质指标 T pH DO COD TN [NH4+−N] TP [PO43−−P] 浊度 T 1.000 pH 0.073 1.000 DO −0.224 −0.207 1.000 COD 0.163 −0.135 −0.270 1.000 TN 0.067 −0.162 −0.140 −0.016 1.000 [NH4+−N] 0.256 0.180 −0.671* −0.073 −0.340 1.000 TP 0.067 0.311 −0.638* 0.337 0.113 0.557 1.000 [PO43−−P] −0.006 0.152 −0.176 −0.664* 0.453 0.315 0.238 1.000 浊度 −0.333 −0.201 −0.164 −0.006 0.829** −0.274 0.353 0.407 1.000 注:*P≤0.05,**P≤0.01。 表 2 赤水河 (仁怀段) 底栖动物相似度分析
Table 2. Similarity analysis of the benthic fauna of the Chishui River (Renhuai section)
采样位点 UG-1 UG-2 UG-3 MG-1 MG-2 MG-3 MG-4 DG-1 DG-2 DG-3 UG-1 1 UG-2 0.45 1 UG-3 0.31 0.3 1 MG-1 0.14 0.25 0.15 1 MG-2 0.17 0 0.23 0.12 1 MG-3 0 0.1 0.28 0.36 0.11 1 MG-4 0.18 0.15 0.28 0.38 0.33 0.3 1 DG-1 0.09 0.16 0.12 0.21 0.3 0.21 0.31 1 DG-2 0 0.05 0.11 0.13 0.15 0.21 0.31 0.43 1 DG-3 0 0.05 0.05 0.27 0 0.29 0.23 0.31 0.41 1 -
[1] 张续同, 李卫明, 张坤, 等. 长江宜昌段桥边河大型底栖动物功能摄食类群时空分布特征[J]. 生态学报, 2022, 42: 2559-2570. [2] HILL B H, HERLIHY A T, KAUFMANN P R, et al. Assessment of streams of the eastern United States using a periphyton index of biotic integrity[J]. Ecological Indicators, 2003, 2: 325-338. doi: 10.1016/S1470-160X(02)00062-6 [3] BHADRECHA M H, KHATRI N, TYAGI S. Rapid integrated water quality evaluation of Mahisagar river using benthic macroinvertebrates[J]. Environmental Monitoring and Assessmeent, 2016, 188: 254. doi: 10.1007/s10661-016-5256-9 [4] 贺玉晓, 李珂, 任玉芬, 等. 春季北京市河流大型底栖动物群落结构特征及影响因子分析[J]. 环境科学, 2020, 41(6): 2951-2962. [5] RIATO L, LEIBOWITZ S G, WEBER M H. The use of multiscale stressors with biological condition assessments: A framework to advance the assessment and management of streams[J]. Science of the Total Environment, 2020, 737: 139699. doi: 10.1016/j.scitotenv.2020.139699 [6] 渠晓东, 陈军, 陈皓阳, 等. 大型底栖动物快速生物评价指数在城市河流生态评估中的应用[J]. 水生态学杂志, 2021, 42(3): 14-22. [7] 胡小红, 左德鹏, 刘波, 等. 北京市北运河水系底栖动物群落与水环境驱动因子的关系及水生态健康评价[J]. 环境科学, 2022, 43(1): 247-255. [8] GOLOVATYUK L V, ZINCHENKO T D, NAZAROVA L B. Macrozoobenthic communities of the saline Bolshaya Samoroda River (Lower Volga region, Russia): Species composition, density, biomass and production[J]. Aquatic Ecology, 2019, 54: 57-74. [9] 魏秘, 朱爱民, 王瑞, 等. 赤水河春季浮游植物群落结构变化及其优势种生态位分析[J]. 水生态学杂志, 2022, 43(5): 49-59. [10] LIU F, WANG X, WANG M R, et al. Diet partitioning and trophic guild structure of fish assemblages in Chishui River, the last undammed tributary of the upper Yangtze River, China[J]. River Research and Applications, 2019, 35: 1530-1539. doi: 10.1002/rra.3519 [11] 代堂刚, 余仲相, 杨中兰. 云南省境内赤水河流域水资源水生态现状分析 J]. 人民长江, 2021, 52(S1): 47-51.
[12] 中华人民共和国生态环境保护部. 生物多样性观测技术指导-淡水底栖大型无脊椎动物: HJ 710.8-2014, [S]. 北京: 中国环境科学出版社, 2014. [13] 刘爱玲, 黄绵达, 刘旻璇, 等. 八里湖大型底栖动物群落结构及水质生物学评价[J]. 人民长江, 2022, 53(10): 37-44. [14] LI Q, WANG G, WANG H, et al. Macrozoobenthos variations in shallow connected lakes under the influence of intense hydrologic pulse changes[J]. Journal of Hydrology, 2020, 584. [15] NOURIANI H, EZZATI R. Application of Simpson quadrature rule and iterative method for solving nonlinear fuzzy delay integral equations.[J]. Fuzzy Sets and Systems, 2020, 400: 147-161. doi: 10.1016/j.fss.2020.01.007 [16] WEI X, LI J, CHEN Y Y, et al. Determinants of community structure of zooplankton in heavily polluted river ecosystems[J]. Science Report, 2016, 6: 22043. doi: 10.1038/srep22043 [17] 闵文武, 黄福江, 王伟. 赤水河秋季浮游动物群落结构及其与环境因子关系[J]. 安徽农业科学, 2021, 49(11): 75-79. [18] 胡芳, 刘聚涛, 温春云, 等. 抚河流域底栖动物群落结构及基于完整性指数的健康评价[J]. 水生态学杂志, 2022, 43(1): 30-39. [19] PABURU P, MAVUTI K M, HARPER D M, et al. Population structure and secondary productivity of Limnodrilus hoffmeisteri (Claparede) and Branchiura sowerbyi Beddard in the profundal zone of Lake Naivasha, Kenya[J]. Hydrobiologia, 2002, 488: 153-161. doi: 10.1023/A:1023382631822 [20] 沙婧婧, 杜小媛, 刘欣禹, 等. 2016-2018年夏季渤海浮游生物和大型底栖动物多样性与优势种的时空变化研究[J]. 海洋通报, 2022, 41(3): 268-280. doi: 10.11840/j.issn.1001-6392.2022.03.004 [21] XU K, WANG R Q, GUO W H, et al. Factors affecting community structures of benthic macroinvertebrates and microorganisms in Yellow River Delta wetlands: Seasons, habitats, and interactions of organisms[J]. Ecohydrology & Hydrobiology, 2020, 20: 570-583. [22] 邹亮华, 邹伟, 张庆吉, 等. 鄱阳湖大型底栖动物时空演变特征及驱动因素[J]. 中国环境科学, 2021, 41: 2881-2892. [23] 张泽豪, 张景晓, 于淼, 等. 淮河干流信阳段大型底栖动物功能摄食类群时空分布及水质评价[J/OL]. 应用生态学报: 1-10[2023-10-19]. http://kns.cnki.net/kcms/detail/21.1253.q.20230726.1048.002.html. [24] 郝韵, 尚光霞, 丁森, 等. 湟水河流域秋季大型底栖动物群落结构及关键影响因子识别[J]. 水生态学杂志, 2023, 44(2): 64-72. doi: 10.15928/j.1674-3075.202110210364 [25] 黎明杰, 张又, 张颖, 等. 湖滨带开发利用对大型底栖动物群落结构的影响: 以洪泽湖为例[J]. 湖泊科学, 2022, 34: 2055-2070. [26] BARTOLI M, BENELLI S, MAGRI M, et al. Contrasting effects of bioturbation studied in intact and reconstructed estuarine sediments[J]. Water, 2020, 12. [27] REN S Z. Community structure of macroinvertebrates and trophic level of several small lakes in Beijing city[J]. Chinese Journal of Applied Ecology, 1991, 2: 221-225. [28] 李艳, 刘苗, 余业鑫, 等. 氨氮对软体动物生长的影响: 以铜锈环棱螺为例[J]. 水生生物学报, 2023, 47(1): 45-54. [29] 薛庆举, 蔡永久, 龚志军. 不同温度条件下霍甫水丝蚓(Limnodrilus hoffmeisteri)的氮磷排泄[J]. 应用与环境生物学报, 2016, 22(6): 1089-1095. [30] 张志远, 张思九, 林育青, 等. 怒江源区不同层级河流底栖动物群落结构特征及影响因子分析[J/OL]. 环境科学学报: 1-12. (3-10-19].https://doi.org/10.13671/j.hjkxxb.2023.0172. [31] BEISEL J N, POLATERA P U, THOMAS S, et al. Stream community structure in relation to spatial variation: the influence of mesohabitat characteristics. [J]. Hydrobiologia. 1998, 389: 73-88. [32] 王燕妮, 田伊林, 刘雨薇, 等. 新疆巩乃斯河枯、丰水期大型底栖动物群落结构与环境因子的关系[J]. 生态科学, 2022, 41(5): 208-218. -



 下载:
下载: