-
抗生素作为新型污染物,累积于环境,引发全球关注。为了积极应对并有效管理这些新兴的环境威胁,我国根据《新污染物治理行动方案》的明确要求,由生态环境部等相关部门牵头,发布了一份涵盖多种重点管控新污染物的清单。在清单中,抗生素类污染物,如诺氟沙星(norfloxacin,NOF)被广泛应用于畜牧业、动物水产养殖和人类医学领域[1-2],被明确列入其中。NOF作为一种氟喹诺酮类(fluoroquinolones,FQs)抗生素。与其他抗生素相比,FQs存在时间更持久,容易在环境中进行累积[3],给人类和生态环境带来潜在的负面影响[4-5]。因此,对于抗生素去除来减少水体污染是至关重要的。目前抗生素的处理主要有生物技术[6]、物理技术[7]和高级氧化技术[8]。生物法中的生物降解法、生物接触氧化法、厌氧生物法等,由于抗生素主要为大分子生物难降解有机物,能够被生物利用部分较少,导致处理效率较低。物理法中的混凝沉淀法由于需要投加絮凝剂,容易产生二次污染,膜分离法中的膜成本高、寿命短、易污染、且对水样预处理要求高。而臭氧氧化技术被认为是一种成熟的技术,具有无二次污染、操作简单、反应效率高和成本低的优势。
臭氧氧化技术降解有机污染物是运用了臭氧的强氧化还原电位和较强的反应性。臭氧(ozone,O3)分为两种作用机理:一是可以直接与有机污染物发生氧化反应;二是O3在水溶液中可由链式反应分解产生活性氧物质[9](reactive oxygen species,ROS),如·OH、1O2、·O2−等,·OH具有强氧化性(E0 = 2.80 eV)和非选择性的特点[10],可以与溶液中大多数抗生素药物发生快速反应[11]。但是,传统的臭氧氧化技术(coarse bubble ozone oxidation technology,CB/O3)存在去除效率和矿化效率低等问题。为了提高去除性能,胡晋博[12]采用现有O3-O3/UV工艺处理污水中微量有机污染物安赛蜜、布洛芬和磺胺二甲嘧啶,其最终去除率分别为78.2%、58.4%和87.3%。但O3-O3/UV体系中并未完全去除这些污染物,存在初期投资及运行费用较高、后期需要维护臭氧利用率低等问题[5]。微气泡(micro bubble,MB,直径小于100 μm)技术的研究为单独臭氧化过程的不足提供了解决办法,可更高效地利用O3。MB不同于传统气泡(coarse bubble,CB),MB表面张力会引起较高的内部压力,使得O3溶解在水中,导致MB收缩和塌陷[13]。MB的界面面积更大,MB在水中具有较低的瑞利数[14],导致MB在水中缓慢上升。因此,与CB相比,MB在水中停留时间更长,提高了气相中的O3向液相有效转移,这大大增加了抗生素与臭氧微气泡产生的ROS反应的可能性[15-16]。为此,通过实验优化来提高臭氧氧化技术去除性能具有非常重要的意义。
本研究利用微气泡发生器,使其产生更多细腻的微小气泡,提高了气体溶解效率,进而影响抗生素的去除性能。通过研究NOF去除率、总有机碳(total organic carbon,TOC)去除率、波长在254 nm的紫外(ultraviolet in wavelength of 254 nm,UV254)去除率、溶液pH、液相臭氧浓度、臭氧利用率等指标,对比了CB/O3技术和微气泡臭氧氧化技术(micro bubble ozone oxidation technology,MB/O3)对NOF去除性能。通过紫外-可见吸收光谱(UV-Vis)和三维荧光光谱(3D EEMs)对2种技术进行了分析,并探究了MB/O3体系工艺参数(臭氧投加量、臭氧气体流量和初始NOF浓度)对其NOF去除性能的影响,最后对2种技术的一级反应动力学进行了模拟。本研究分析了喹诺酮类抗生素NOF在MB/O3体系中的降解性能及其影响,可为预测其他喹诺酮类抗生素降解过程中的相似行为及效果提供参考依据,进而为制定合适且高效的最优降解方案提供数据支持。
-
NOF,购自上海麦克林生化科技有限公司。碘化钾(KI)、硫代硫酸钠(Na2S2O3)和磷酸二氢钠(NaH2PO4),购自天津市永大化学试剂有限公司。靛蓝二磺酸钠(C16H8N2Na2O8S2),购自上海易恩化学技术有限公司。甲醇(CH3OH)、乙腈(CH3CN),购自赛孚瑞化工邯郸有限公司。三乙胺(C6H15N),购自上海麦克林生化科技股份有限公司。磷酸(H3PO4),购自天津市大茂化学试剂厂。浓硫酸(H2SO4),购自上海易恩化学技术有限公司。所用H2SO4为优级纯,CH3OH、CH3CN、C6H15N和H3PO4为色谱纯,其余试剂均为分析纯,且未经二次处理。
-
MB的产生基于水力旋转剪切微气泡发生装置的工作原理,该装置通过内部旋转元件产生强大的剪切力作用于流经的水流。这种剪切力破坏了水流中的分子平衡,促使溶解在水中的气体达到局部过饱和状态。随后,在剪切力和湍流效应的共同作用下,过饱和的气体分子聚集成微小的气泡核,并随着湍流的进一步作用而不断分裂和细化,最终形成大量均匀分布的微气泡。这一过程有效地提高了气体在水中的分散度和传质效率。
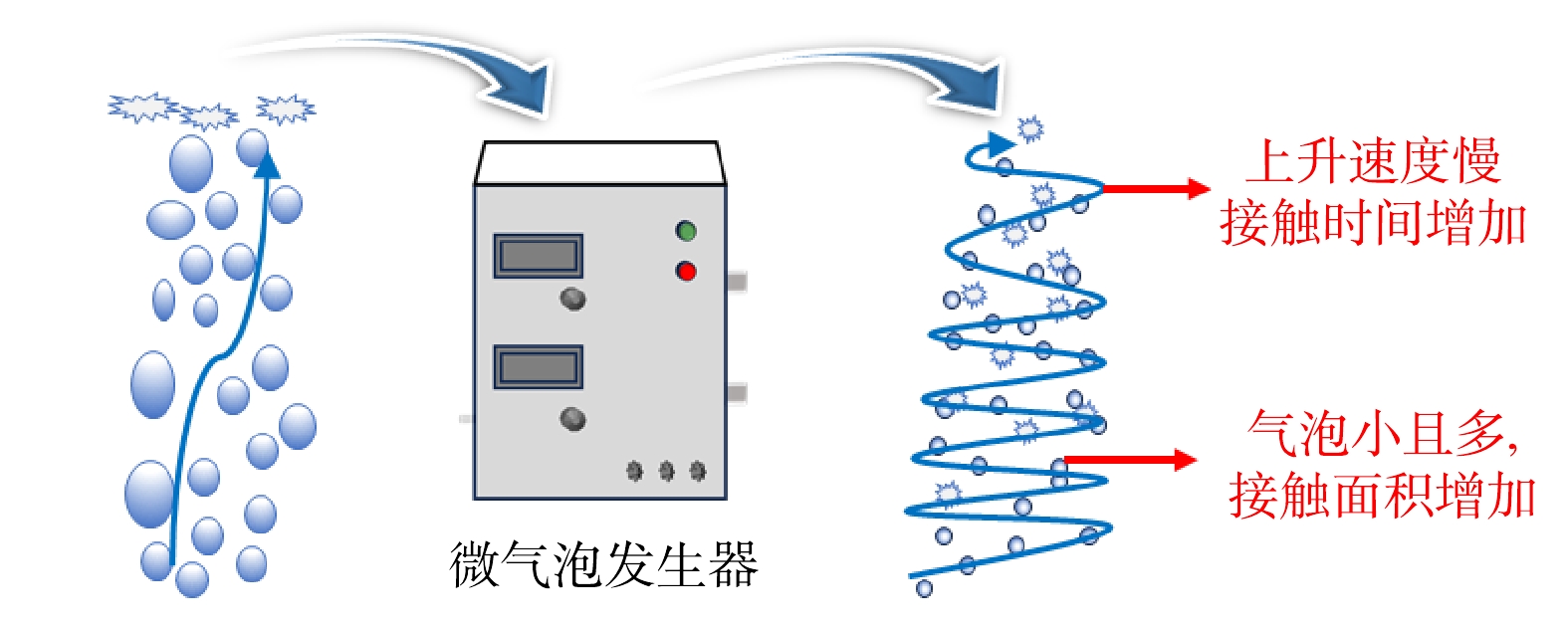
如图1所示,CB与MB相比[17]:1) MB的气泡体积小,受到的水的浮力小,进而导致其上升速度慢,能在水中停留更长的时间;2) MB的气体与液体接触面积大,增加了与NOF的接触反应机会;3) MB气体溶解速率快;4) MB的界面电位高;5) MB能产生更多的·OH。
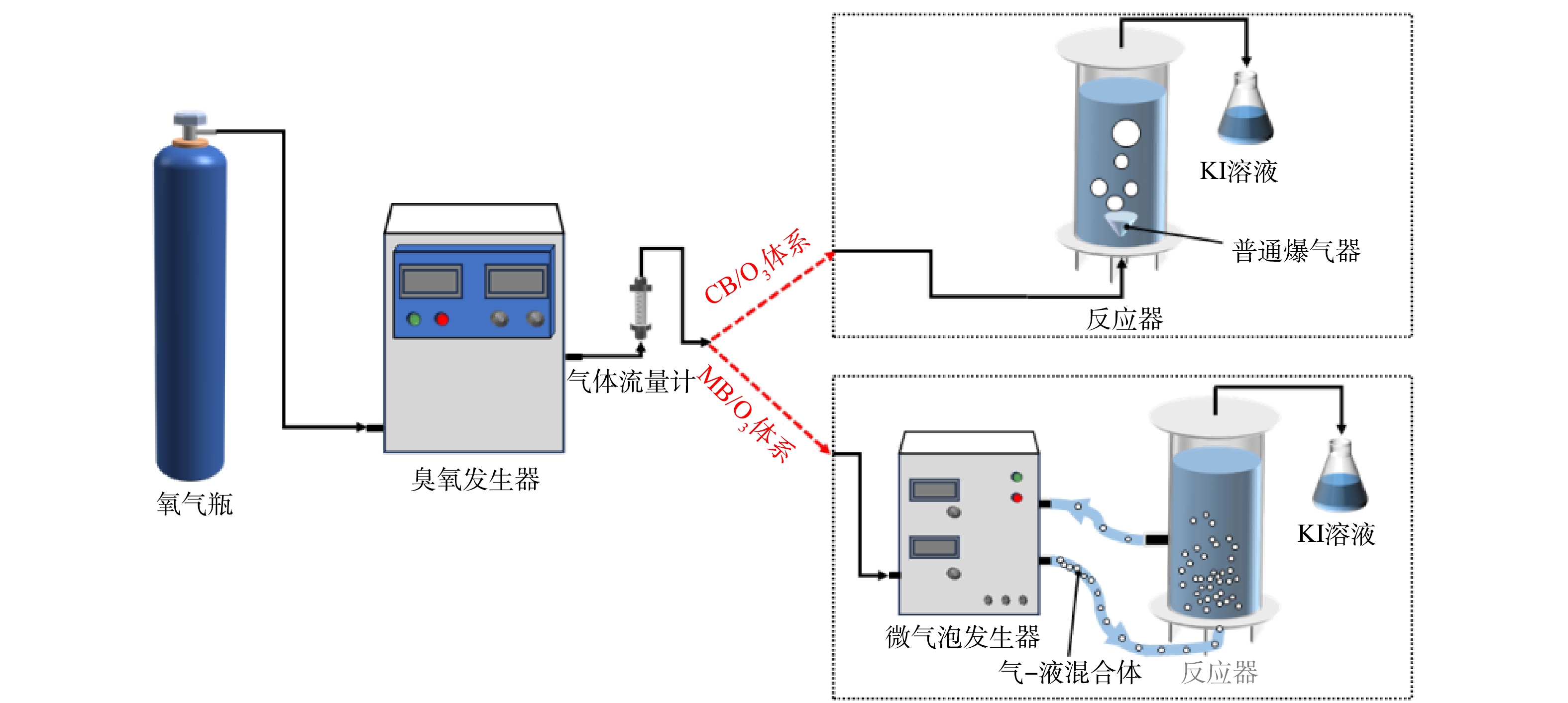
-
实验体系如图2所示,实验所用臭氧是由氧气瓶中的氧气通入臭氧发生器(MTS-CFG-20A)产生O3,再经气体流量计流入CB/O3或MB/O3体系。在CB/O3体系中,臭氧直接通入反应器,再由普通曝气器进行曝气反应。在MB/O3体系中,臭氧先经过微气泡发生器,再通入反应器。由于反应器中的溶液会在反应器与微气泡发生器之间循环,微气泡发生器产生的微气泡会随着循环进入反应器中,进一步增加了接触时间。2种体系的反应器流出的废气用KI溶液收集。进水和进气均采用下进上出式,NOF废水是由NOF与纯净水(RO)组成的模拟废水。实验条件:NOF质量浓度50 mg·L−1(体积10 L),臭氧投加量12 mg·min−1,臭氧气体流速300 mL·min−1,反应时间90 min。为确保实验数据的可靠性,每组实验至少进行2次平行实验。
-
水样中NOF的浓度通过高效液相色谱仪(Waters e2695,Waters,美国)测定,高效液相色谱仪配备C18色谱柱(4.6 mm×250 mm,5.0 μm)和紫外检测器(UV/Vis
2489 ),紫外检测波长为278 nm。流动相由色谱纯乙腈,25 mmol·L−1磷酸溶液和三乙胺组成,磷酸溶液用三乙胺调节pH=3,乙腈与磷酸溶液的体积按1∶4的比例混合。流速为1 mL·min−1,进样体积为5 μL。以NOF不同浓度为横坐标,其浓度所测的峰面积为纵坐标。相关系数R2 = 0.999 2。本实验中CB/O3和MB/O3水样的紫外-可见光谱通过紫外-可见分光光度计(TU-1810, Pu-Analysis, 中国)测定,扫描范围为190~600 nm,波长间隔1 nm。CB/O3和MB/O3水样的三维荧光光谱通过荧光分光光度计(F-
7000 ,Hitachi,日本)测定。在室温下,用荧光分光光度计表征了荧光激发发射矩阵光谱。通过在200~400 nm(步长5 nm)的激发波长和250~560 nm(步长5 nm)的发射波长下扫描来获取EEM光谱。激发和发射的狭缝宽度为5 nm。扫描速度12 000 nm·min−1,以Milli-Q超纯水为参比扣除拉曼散射,采用drEEM工具箱中扣除散射命令去除瑞利散射。水样的pH用PHS-3C型pH计测定。 -
TOC采用有机碳测定分析仪(日本岛津仪器有限公司,TOC-VCPN)测定,根据式(1)计算;气相臭氧浓度采用碘量法测定[18],液相臭氧浓度用靛蓝法[19]在紫外波长为610 nm处测定,臭氧浓度根据式(2)计算;臭氧利用率根据式(3)计算;反应动力学常数根据式(4)计算。
式中:CTOC为水样中总有机碳浓度,mg·L−1;CTC为水样中总碳浓度,mg·L−1;CIC水样中无机碳浓度,mg·L−1。
式中:ρ为液相臭氧质量浓度,g·L−1;A0为初始时刻水样的吸光度;At为t时刻水样的吸光度;M为臭氧的摩尔质量,48 g·mol−1,ε为摩尔吸收光度,20 400 L·(mol·cm)−1;b为比色皿厚度,cm;V水样为水样体积,mL。
式中:η为臭氧利用率,%;T0为臭氧投加总量,mg;LO3为液相中臭氧总量,mg;GO3为气相臭氧逸散总量,mg。
式中:C0为NOF或TOC的初始浓度,mg·L−1;Ct为t时刻NOF或者TOC的浓度,mg·L−1;ke为反应动力学常数,min−1;t为反应时间,min。
-
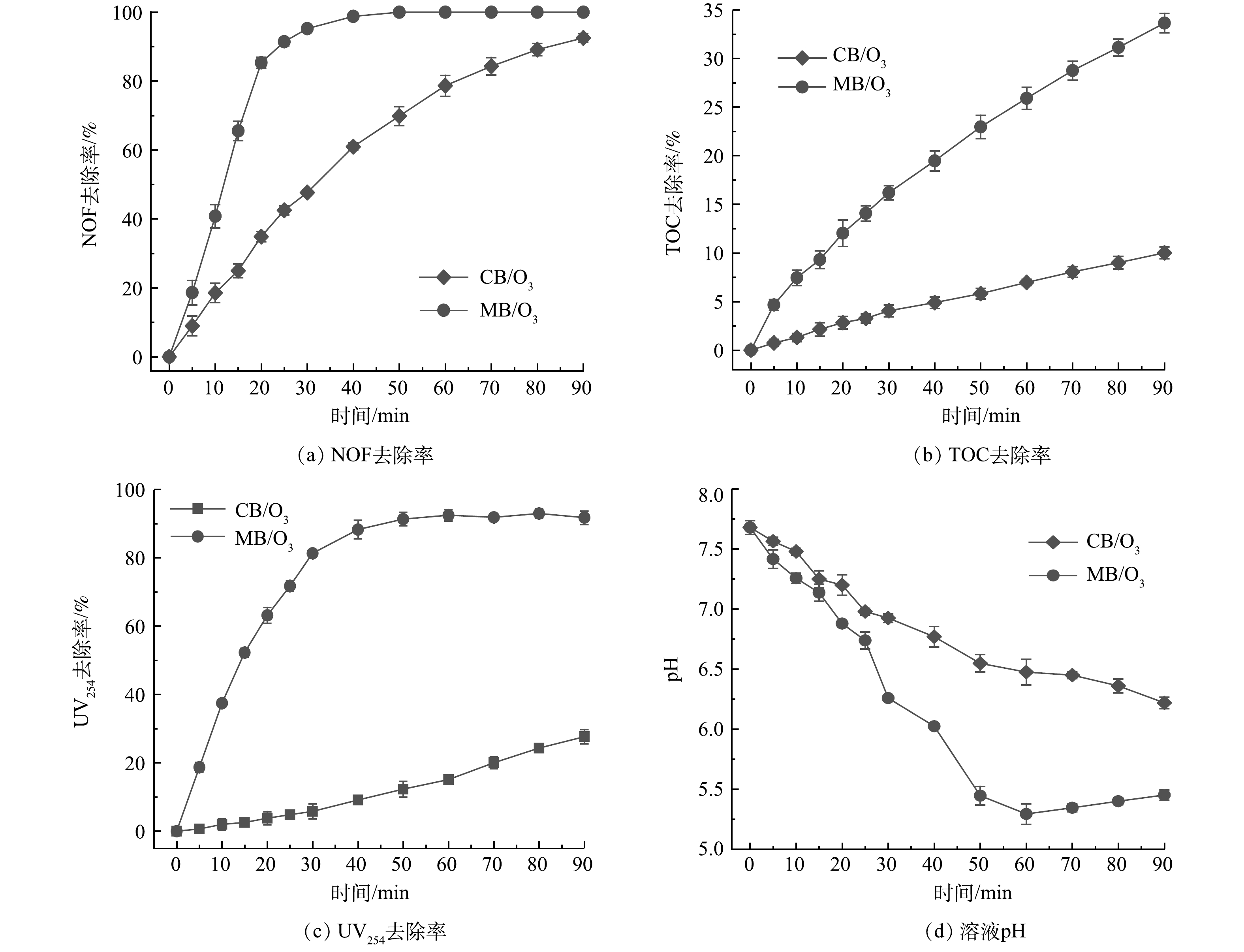
由图3(a)~(c)中可看出,CB/O3和MB/O3体系均能有效降解NOF,对TOC和UV254均有不同去除效果。在30 min时,MB/O3体系中NOF去除率高达95.24%,而CB/O3体系中NOF的去除率仅有47.66%;在90 min时,MB/O3体系中TOC去除率可达32.57%,为CB/O3体系的3.44倍。对比2个体系,MB/O3体现更高效的去除性能,实现了NOF的完全去除。若CB/O3体系要达到或接近100%的去除率,理论上需要更长的反应时间。虽然在CB/O3体系中可通过氧化作用破坏NOF的分子结构,但其对中间产物氧化降解作用较弱,并未能有效地进一步矿化为CO2和H2O。在30 min时,CB/O3和MB/O3体系中UV254去除率分别为5.81%和81.31%。在MB/O3和CB/O3体系中,含C=C和C=O双键的芳香族化合物不能完全被去除,这可能是由于体系中间产物具有更高的稳定性和复杂性。90 min时MB/O3体系中UV254去除率是CB/O3体系UV254去除率的3.36倍,这一结果与之前关于2个体系TOC去除率的比较结果是一致的,即MB/O3体系对TOC的去除率约为CB/O3体系TOC去除率的3.44倍。在对比CB/O3与MB/O3体系时,MB/O3体系在NOF去除率、TOC去除率以及UV254去除率方面效果更佳。这是由于O3通过微气泡发生器产生微小气泡,可促进O3分解为更多的活性氧物质,提高了气-液传质效率[20-21],从而实现对NOF及其中间产物的高效降解。
图3(d)反映了MB/O3和CB/O3体系降解NOF过程中pH的变化。2个体系的pH随反应时间的增长而下降,CB/O3氧化过程pH下降速度比MB/O3缓慢。在CB/O3中,50 min前pH由7.68快速下降到6.55,而在剩余40 min内pH的变化并不大,这与CB/O3体系中后40 min TOC去除率变化较小有关。在MB/O3体系中,60 min前pH由7.75迅速下降到最小值5.29,pH发生下降可能是在O3及ROS氧化降解NOF过程中生成小分子酸性物质。而60 min后,pH由5.29上升到5.45。pH呈现略微上升趋势,这可能是由体系中累积的小分子酸性物质被氧化引起的。对比NOF降解率、TOC去除率和UV254去除率可以看出,MB/O3比CB/O3体系降解NOF的氧化能力更强和矿化效果更佳,MB/O3体系中产生了更多的·OH和其他活性氧物质。此外,在CB/O3和MB/O3体系中,观察到pH的变化趋势,这一变化间接证明了MB/O3体系相较于CB/O3体系具有更高的矿化效果。
-
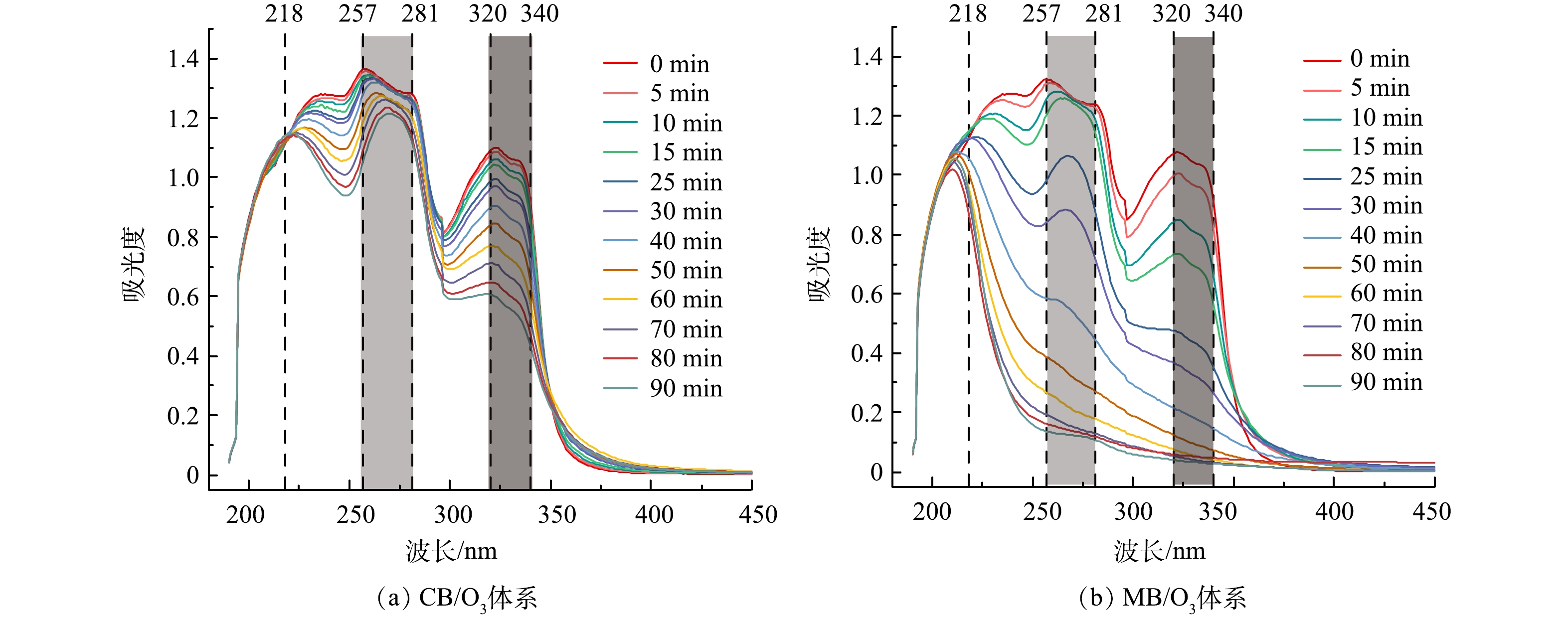
测定了CB/O3和MB/O3体系降解过程紫外-可见吸收光谱,如图4所示。在UV-Vis光谱中,有3个条带:分别为218、257~281和320~340 nm处的双波段[22]。218 nm处的特征吸收峰是由于NOF结构中含有2个双键的共轭体系不饱和键π-π*跃迁。257~281 nm处的特征吸收峰归因于芳香环的π-π*跃迁。320~340 nm处的双波段是因为喹诺酮类抗生素上的N原子n→π* 的电子跃迁[23-24]。当水样被照射时,在MB/O3和CB/O3体系中三处波段的吸光度都呈现出降低状态,尤其是MB/O3体系中的257~281 nm和320~340 nm处的双波段的特征吸收峰,说明在反应过程中NOF结构上的生色基团被氧化。从图4(b)看出在MB/O3降解过程中,320~340 nm处双波段的吸光度比257~281 nm处的吸光度下降的快,表示哌嗪环比芳香环更容易发生氧化反应。图4中的218 nm和320~340 nm处的峰在反应过程中分别发生了蓝移和红移现象。218 nm处的吸收峰向短波方向移动可能是由于氧化过程中共轭体系的不饱和键被破坏。在降解过程中哌嗪环会氧化变为含有羰基或醛基的物质,可能会导致320~340 nm处发生红移。
-
液相臭氧的浓度变化和臭氧利用率如图5所示。不同体系下,液相臭氧浓度随时间变化而增加。在90 min时,CB/O3和MB/O3体系中液相臭氧质量浓度分别为0.148 1和2.59 1 mg·L−1,臭氧利用率分别为93.02%和72.98%。在CB/O3体系中,各时段液相臭氧浓度均最低。这可能是由于进气方式和气-液传质效率低导致O3还没来得及与NOF发生反应就逸出水环境中。相较于CB/O3体系,MB/O3体系中液相臭氧浓度更高,这可能归因于微气泡溶解速率高和气-液传质效率高的特性导致臭氧更快速溶解于液相中。尽管液相浓度有所提升,但约有93.02%的O3被有效利用于NOF的降解过程中。MB/O3体系臭氧利用率是CB/O3体系的1.27倍,高出20.04%。高利用率不仅减少了臭氧的浪费,还说明在相同处理量下,MB/O3体系可能需要更少的臭氧投加量,从而降低了运行成本并减少了潜在的二次污染风险。这可能与微气泡的特点有关,微气泡的气泡尺寸小于100 μm,界面面积大,可以提高臭氧传质系数,从而提高液相中臭氧浓度,更多的臭氧被用来参与氧化反应。这个结果与ZHENG等[25]得出的结论相似,在微气泡臭氧化和大气泡臭氧化处理湿纺丙烯酸纤维废水过程中,前者的平均臭氧利用效率是后者的1.5倍。
-
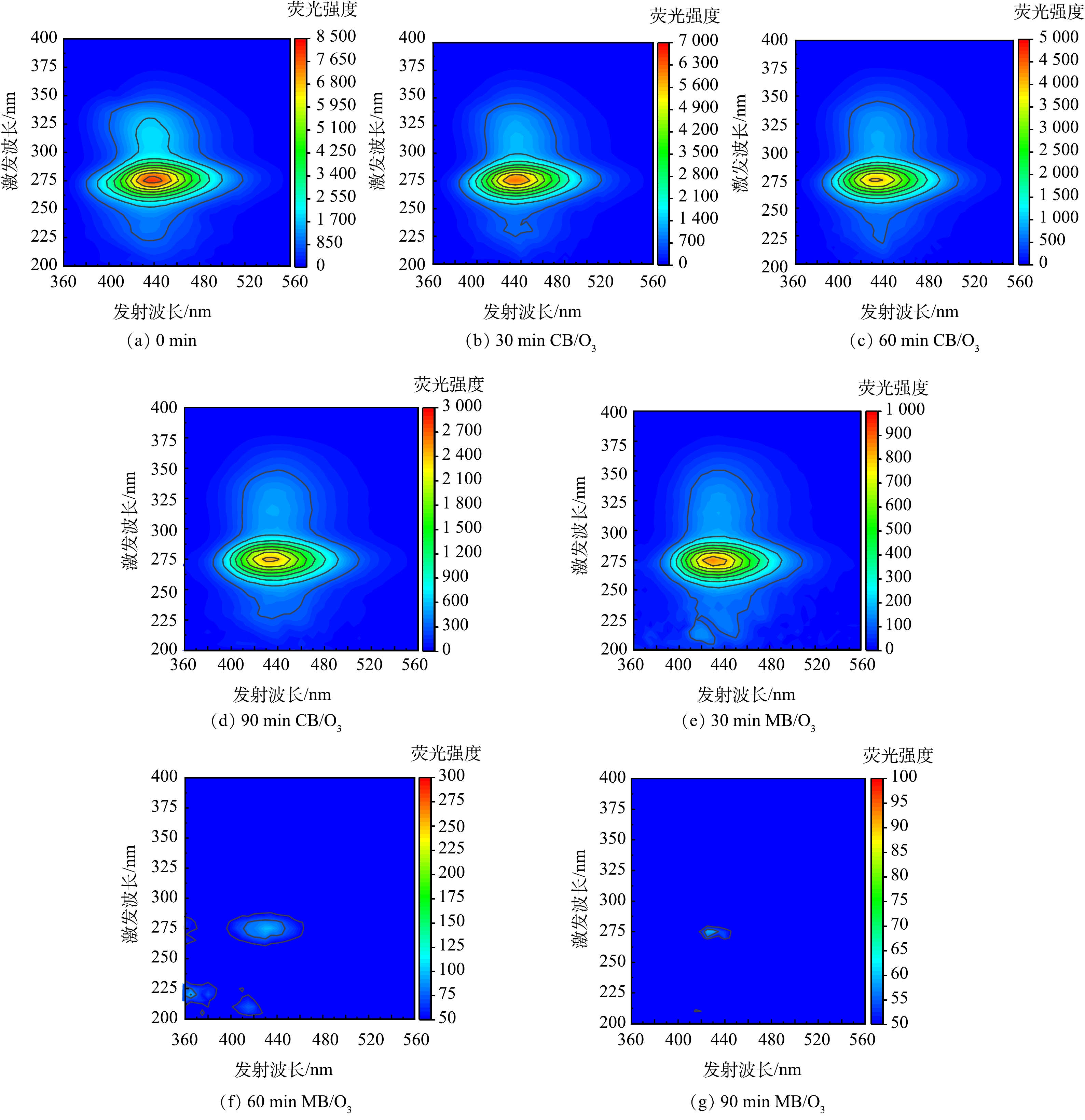
在紫外光的激发下,NOF的分子展现出独特的光学特性。这归因于NOF分子内部存在着强烈的共轭效应,这种效应使得分子在受到紫外光照时,可以以荧光的形式表现[26]。因此,3D EEMs结果可以在一定程度上反映NOF的降解和矿化能力。在上述实验条件下,对CB/O3和MB/O3降解过程测定各时段NOF的3D EEMs变化,进一步探究MB/O3体系的高效性。CB/O3和MB/O3体系中各时段所对应的3D EEMs如图6所示。使用三维荧光光谱仪鉴定出2种主要组分,所对应的荧光峰分别为Ex/Em=250~300 nm/420~480 nm和Ex/Em=300~325 nm/430~460 nm。这与WEN等[27]研究结果一致,NOF溶液主要包括2个荧光峰。根据WEN等的结果,这2个荧光峰为类腐殖酸物质。在CB/O3和MB/O3中,NOF各时段水样在被可见光照射下2个荧光峰强度有所降低,表明NOF的浓度有所降低。尤其是MB/O3工艺,60 min时已经观察不到2个荧光峰,这与之前2个体系的NOF去除率所得结果一致。这进一步证实了MB/O3对NOF的有效降解,并且去除能力强于CB/O3工艺。
-
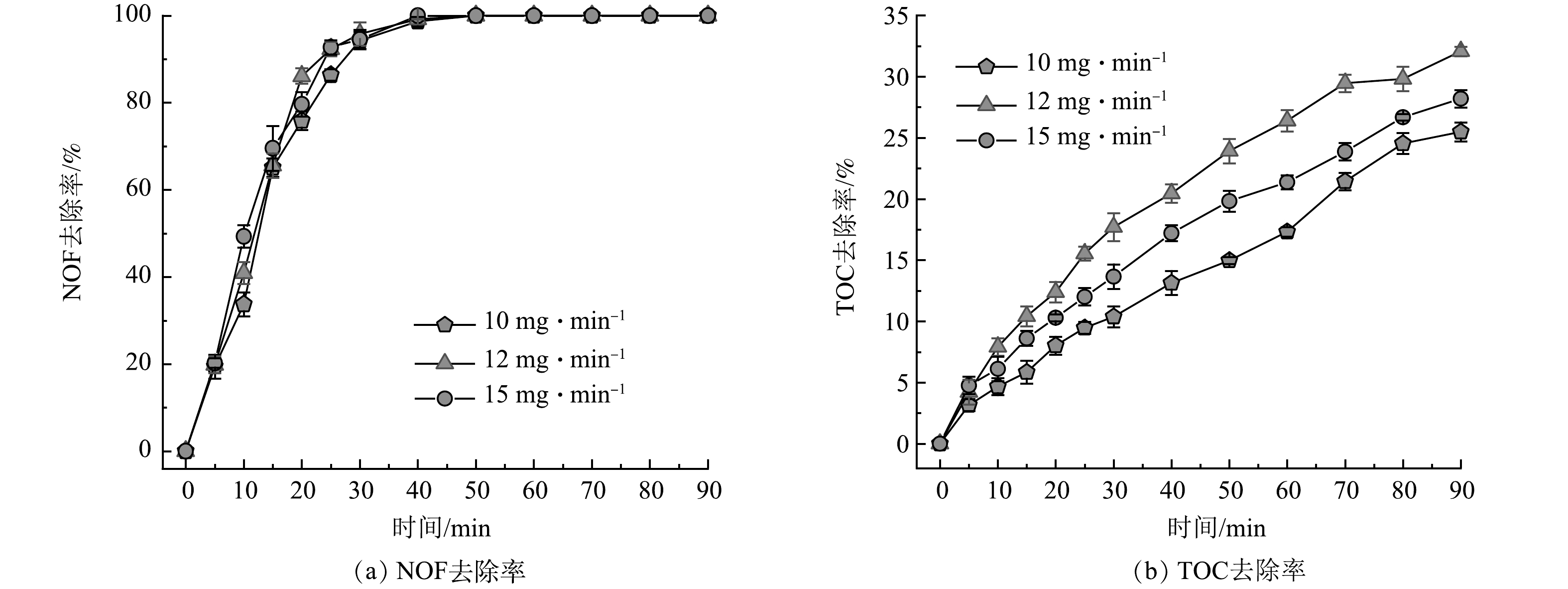
1)臭氧投加量对NOF去除的影响。在初始NOF质量浓度50 mg·L−1、臭氧气体流速300 mL·min−1和反应时间90 min的实验条件下,将臭氧投加量进行调整,分别设置为10、12和15 mg·min−1,探究在MB/O3反应体系中臭氧投加量的不同对于NOF去除率影响。TOC作为评价水质有机污染物的指标。进一步研究了NOF降解过程中不同浓度臭氧投加量的影响。在MB/O3体系中NOF去除率和TOC去除率随时间的变化如图7所示。从图7中可得出,在40~50 min时,在不同臭氧投加量下NOF均可以达到完全被去除的效果,且差异并不明显。10、12和15 mg·min−1条件下的TOC去除率分别为25.48%、32.57%和28.19%。当臭氧投加量从10 mg·min−1增加为12 mg·min−1时,TOC的去除率提高了7.09%。这是因为臭氧投加量的增加使得用于发生反应的臭氧总量也得到了增加,氧化了溶液中更多的含碳有机污染物。当臭氧投加量从12 mg·min−1增至15 mg·min−1时,TOC去除率反而从32.57%降至28.19%。增加臭氧投加量并未使TOC去除率更高,这可能是因为体系中活性氧化物质与多余的臭氧发生反应,并没有过多的臭氧或自由基作用于NOF。
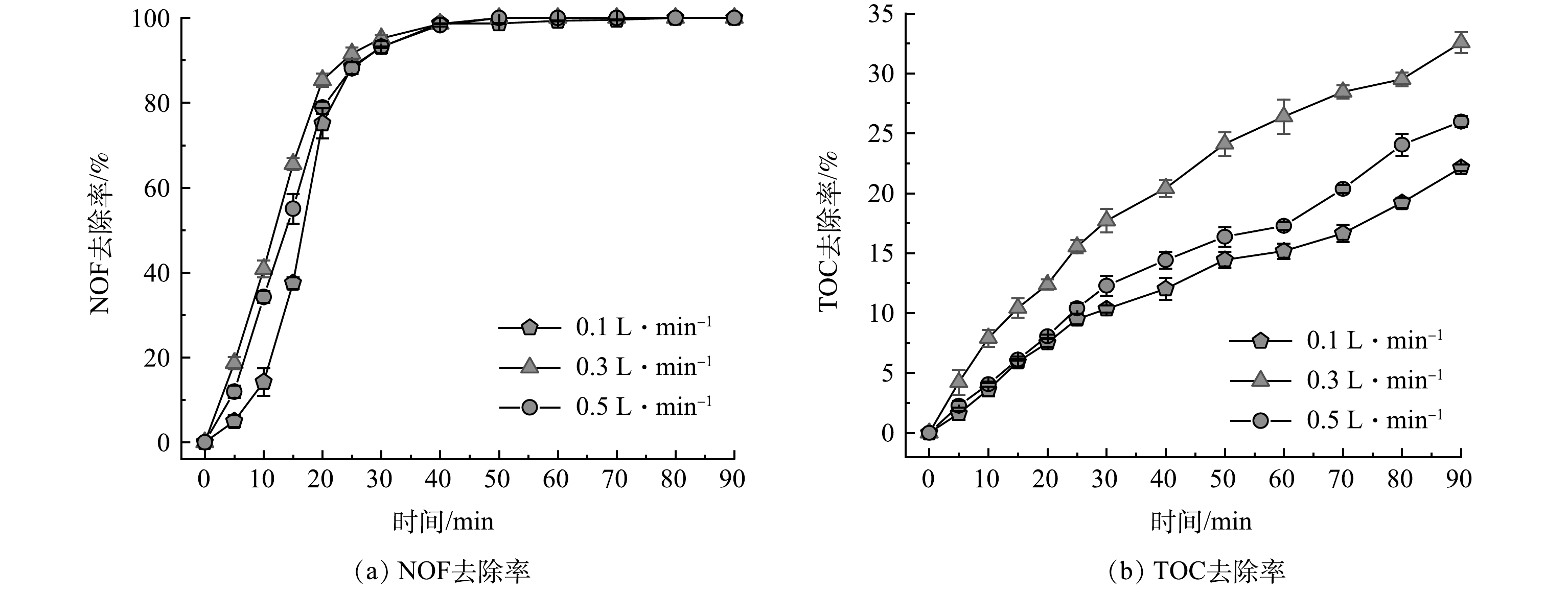
2)臭氧气体流量对NOF去除的影响。在初始NOF质量浓度50 mg·L−1、臭氧投加量12 mg·min−1和反应时间90 min的实验条件下,将臭氧气体流速进行调整,分别设置为100、300和500 mL·min−1,探究在MB/O3反应体系中臭氧气体流量的不同对于去除NOF和矿化的影响。在MB/O3体系中NOF去除率和TOC去除率随时间的变化如图8所示。从图8中可得出,在40~50 min时,不同臭氧气体流量下NOF均可以达到完全去除的效果。当仅改变气体流量时,在15 min时,NOF去除率分别为37.52%、55.04%和65.58%。TOC去除率随臭氧气体流量的增加先呈增加趋势后出现降低现象。在不同气体流量条件下,90 min时,TOC去除率分别为22.13%、32.57%和25.98%。当气体流量100 mL·min−1时,TOC去除率比气体流量为300 mL·min−1低10.44%。这可能是由于气体流量较小导致进入反应器中的进气速率不足,无法和NOF快速发生反应。适当提高气体流速能有效提高进气速率,从而导致微气泡臭氧分布更加均匀。当气体流量500 mL·min−1时,TOC去除率比300 mL·min−1低6.59%。过多提高气体流量会使微气泡粒径变大,从而对微气泡效果产生负面影响。因此,当气体流量300 mL·min−1时,TOC去除率和NOF去除率均效果最佳。
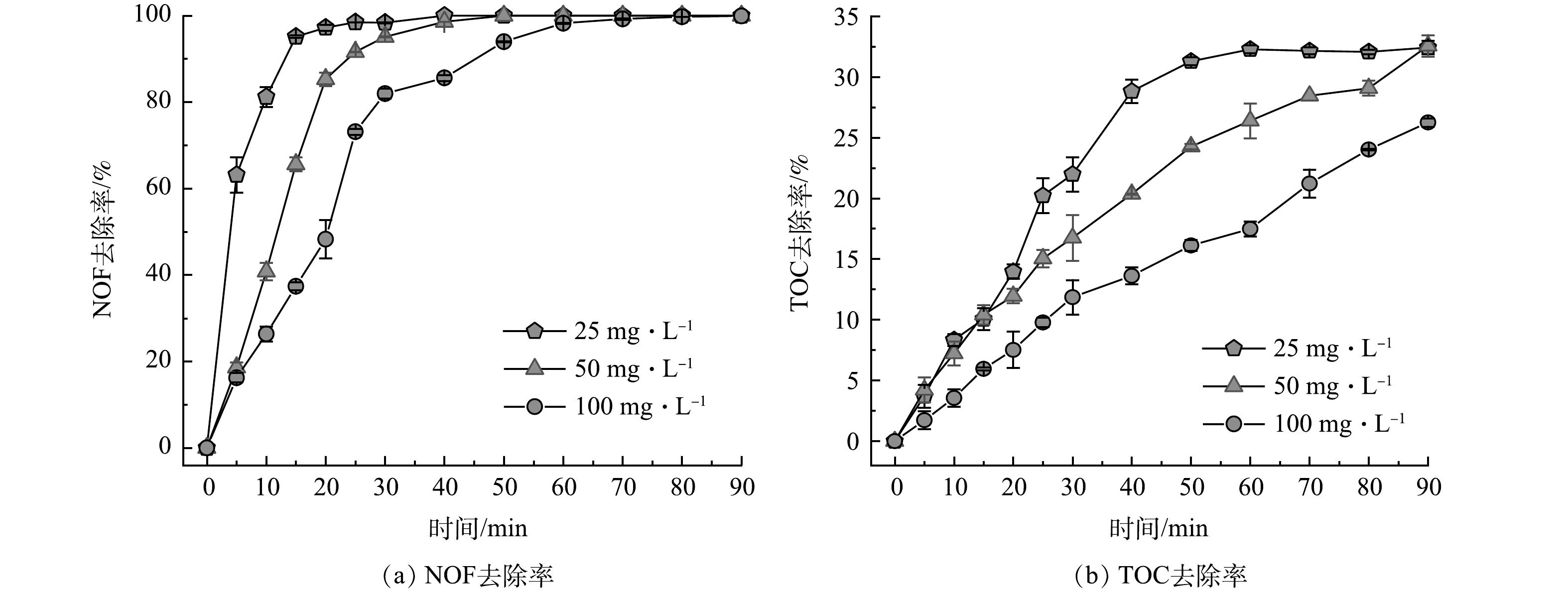
3)初始NOF质量浓度对NOF去除的影响。在臭氧投加量12 mg·min−1、臭氧气体流速300 mL·min−1、反应时间90 min和不同初始NOF质量浓度的实验条件下,将初始NOF质量浓度进行调整,分别设置为25、50和100 mg·L−1,探究在MB/O3反应体系中初始NOF质量浓度的不同对于NOF去除率和NOF矿化效果的影响。在MB/O3体系中NOF去除率和TOC矿化率随时间的变化如图9所示。由图9可见,随着初始质量浓度的增加完全降解NOF所需要的时间随之变长。在3种不同初始NOF质量浓度条件下,对NOF完全去除需要的时间分别为30、40和70 min。在反应进行到50 min时,对初始质量浓度为25 mg·L−1的TOC去除率已经达到32.52%。但在之后的40 min,TOC去除率呈现一个稳定趋势。这可能说明在50 min之后,体系中的含碳有机污染物浓度已达到最低浓度无法进一步被降解。初始质量浓度50 mg·L−1和100 mg·L−1的TOC去除率分别为32.57%和26.26%。尽管在初始质量浓度25 mg·L−1条件下呈现出最佳的降解情况,但当初始质量浓度为50 mg·L−1时,仍能够取得较好的TOC去除率,而进一步增加初始质量浓度后TOC去除率呈现显著下降趋势。
-
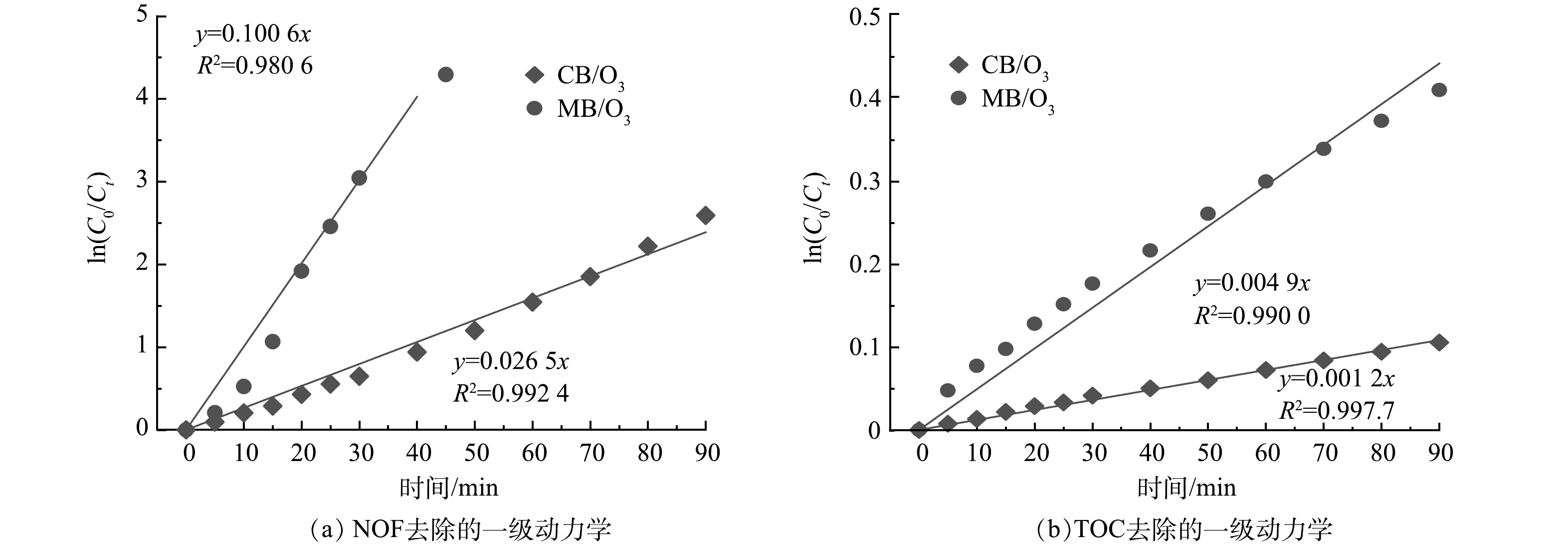
在MB/O3体系中对NOF去除率和TOC去除率进行一级反应动力学模拟,如图10所示。伪一级动力学模型精确地模拟NOF在CB/O3和MB/O3体系下NOF和TOC的去除过程,这一模型的适用性通过高相关系数R²得以验证,充分表明了模拟结果与实际数据之间的高度一致性。CB/O3和MB/O3体系的反应动力学常数分别为0.100 6和0.026 5 min−1,MB/O3约为CB/O3体系反应动力学常数的4倍。MB/O3体系的TOC反应动力学常数为0.004 9 min−1,为CB/O3体系的4倍。这非常直观地揭示与CB/O3体系相比,MB/O3体系在加速NOF降解和矿化的优越性。MB/O3体系的高效降解和矿化能力得益于其微气泡结构。微气泡不仅增加了气-液接触面积,促进了臭氧向液相中的传质效率,从而在局部区域内形成了高浓度的臭氧环境。此外,微气泡的破裂过程还伴随着强烈的剪切力和湍流效应,这些物理作用进一步促进了臭氧与NOF的直接反应,以及臭氧分解产生ROS的链式反应。因此,MB/O3体系显著提高了降解速率和矿化能力。
-
1) MB/O3体系相较于CB/O3体系,NOF去除率、TOC去除率和UV254去除率均有显著提高。而且MB/O3体系中pH下降速度更快。由UV-Vis和3D EEMs光谱可知,MB/O3体系在特征吸收峰或主要荧光峰处呈现显著地下降趋势。
2)在臭氧投加量为12 mg·min−1、臭氧气体流速为300 mL·min−1、初始NOF质量浓度为50 mg·L−1的最佳实验条件下,NOF去除率和TOC去除率分别为100%和32.52%。
3) MB/O3体系的反应动力学常数和TOC反应动力学常数约为CB/O3体系的4倍。MB/O3体系中具有独特的微气泡效应,不仅可提高臭氧的利用率,还可增强体系中氧化性物种的浓度和活性,从而实现了对NOF的高效去除和矿化。
传统臭氧化与微气泡臭氧化技术对废水中诺氟沙星的去除性能
Performance of conventional bubble ozonation and microbubble ozonation on norfloxacin removal from wastewater
-
摘要: 传统臭氧氧化技术(CB/O3)在废水中去除抗生素的性能较差,而微气泡臭氧化技术(MB/O3)因其气泡小、上升速度慢等特点可强化对抗生素的去除性能。该研究主要从诺氟沙星(norfloxacin,NOF)去除率、总有机碳(total organic carbon,TOC)去除率、UV254去除率、pH、液相臭氧浓度、臭氧利用率等指标探究了CB/O3与MB/O3技术在NOF废水中的去除性能,并对2种技术的紫外-可见吸收光谱、三维荧光光谱、一级反应动力学拟合进行了分析,最后对MB/O3的实验条件进行了优化。结果表明,MB/O3较CB/O3的NOF、TOC、UV254去除率和臭氧利用率均有显著提高,分别提高了7.49%、22.56%、64.08%和20.04%;最佳实验条件为:NOF质量浓度50 mg·L−1(体积10L);臭氧投加量12 mg·min−1;臭氧气体流速300 mL·min−1。以上研究结果对MB/O3技术在工程应用上可提供数据支撑。Abstract: Conventional bubble oxidation technology (CB/O3) has a poor performance on removing antibiotic from wastewater, while microbubble ozonation technology (MB/O3) can strengthen its performance on antibiotic removal due to its properties of small bubbles, slow rise rate, etc.. In this study, the performances of CB/O3 and MB/O3 technologies on NOF removal from wastewater were investigated mainly in terms of norfloxacin (NOF) removal, TOC removal, UV254 removal, pH, liquid phase ozone concentration, and ozone utilization. And the UV-visible absorption spectra, three-dimensional fluorescence spectra, and first-order reaction kinetic fitting for both techniques were also analyzed. Finally, the experimental conditions for MB/O3 technology were optimized. The results showed that MB/O3 technology had a significant improvement in NOF, TOC, UV254 removal and ozone utilization over the CB/O3 technology by 7.49%, 22.56%, 64.08% and 20.04%, respectively. The optimal experimental conditions were following: NOF wastewater concentration of 50 mg·L−1 (volume 10L); ozone dosage of 12 mg·min−1 and ozone gas flow rate of 300 mL·min−1. The above findings can provide a data support for MB/O3 technology in engineering applications.
-
Key words:
- ozone /
- microbubbles /
- norfloxacin /
- the performance on removal /
- optimization of conditions
-

-
-
[1] DU J, LIU Q, PAN Y, et al. The research status, potential hazards and toxicological mechanisms of fluoroquinolone antibiotics in the environment[J]. Antibiotics, 2023, 12(6): 1058. doi: 10.3390/antibiotics12061058 [2] CHEN Z, HE G, YOU T, et al. Complex pollution of Fluoroquinolone antibiotics and metal oxides/metal ions in water: a review on occurrence, formation mechanisms, removal and ecotoxicity[J]. Journal of Environmental Chemical Engineering, 2024, 12(2): 112191. doi: 10.1016/j.jece.2024.112191 [3] ZHU F, WU Y, LIANG Y, et al. Degradation mechanism of norfloxacin in water using persulfate activated by BC@nZVI/Ni[J]. Chemical Engineering Journal, 2020, 389: 124276. doi: 10.1016/j.cej.2020.124276 [4] WANG C, YU G, CHEN H, et al. Degradation of norfloxacin by hydroxylamine enhanced Fenton system: Kinetics, mechanism and degradation pathway[J]. Chemosphere, 2021, 270: 129408. doi: 10.1016/j.chemosphere.2020.129408 [5] 孙磊, 秦文磊, 吴广宇, 等. 基于臭氧的组合氧化法降解有机污染物研究进展[J]. 水处理技术, 2020, 46(6): 9-14. [6] 吴娜娜, 钱虹, 李亚峰. 水中磺胺类抗生素去除技术研究进展[J]. 建筑与预算, 2017(6): 43-50. [7] KOUNDLE P, NIRMALKAR N, MOMOTKO M, et al. Ozone nanobubble technology as a novel AOPs for pollutants degradation under high salinity conditions[J]. Water Research, 2024: 122148. [8] JIANG Z, ABDOULAYE M G, WEI T, et al. Treatment of Eucalyptus chemical-mechanical pulp wastewater by coupling system of advanced catalytic oxidation and biodegradation: Synergistic effect of ozonation photocatalytic-microbial[J]. Journal of Water Process Engineering, 2023, 55: 104071. doi: 10.1016/j.jwpe.2023.104071 [9] ZHANG J, LV S, YU Q, et al. Degradation of sulfamethoxazole in microbubble ozonation process: Performance, reaction mechanism and toxicity assessment[J]. Separation and Purification Technology, 2023, 311: 123262. doi: 10.1016/j.seppur.2023.123262 [10] CHENG Y, ZHENG F, DONG H, et al. Enhanced oxidation of micropollutants by ozone/ferrate(VI) process: Performance, mechanism, and toxicity assessment[J]. Journal of Water Process Engineering, 2023, 55: 104211. doi: 10.1016/j.jwpe.2023.104211 [11] WOJNÁROVITS L, HOMLOK R, KOVÁCS K, et al. Oxidation and mineralization rates of harmful organic chemicals in hydroxyl radical induced reactions[J]. Ecotoxicology and Environmental Safety, 2024, 281: 116669. doi: 10.1016/j.ecoenv.2024.116669 [12] 胡晋博. 臭氧-臭氧/紫外工艺对市政污水中微量有机污染物的降解及机理研究[D]. 赣州: 江西理工大学, 2021. [13] LI P, TAKAHASHI M, CHIBA K. Degradation of phenol by the collapse of microbubbles[J]. Chemosphere, 2009, 75(10): 1371-1375. doi: 10.1016/j.chemosphere.2009.03.031 [14] JOHN, BROOKES A, CARRA I, et al. Microbubbles and their application to ozonation in water treatment: a critical review exploring their benefit and future application[J]. Critical Reviews in Environmental Science and Technology, 2022, 52(9): 1561-1603. doi: 10.1080/10643389.2020.1860406 [15] VERINDA S, MUNIROH M, YULIANTO E, et al. Degradation of ciprofloxacin in aqueous solution using ozone microbubbles: spectroscopic, kinetics, and antibacterial analysis[J]. Heliyon, 2022, 8(8): e10137. doi: 10.1016/j.heliyon.2022.e10137 [16] YAO K, CHI Y, WANG F, et al. The effect of microbubbles on gas-liquid mass transfer coefficient and degradation rate of cod in wastewater treatment[J]. Water Science and Technology, 2016, 73(8): 1969-1977. doi: 10.2166/wst.2016.018 [17] PARMAR R, MAJUMDER S K. Microbubble generation and microbubble-aided transport process intensification—A state-of-the-art report[J]. Chemical Engineering and Processing: Process Intensification[J], 2013, 64: 79-97. doi: 10.1016/j.cep.2012.12.002 [18] AKHTAR J, AMIN N S, ARIS A. Combined adsorption and catalytic ozonation for removal of sulfamethoxazole using Fe2O3/CeO2 loaded activated carbon[J]. Chemical Engineering Journal, 2011, 170(1): 136-144. doi: 10.1016/j.cej.2011.03.043 [19] FARIA P C C, ÓRFÃO J J M, PEREIRA M F R. Catalytic ozonation of sulfonated aromatic compounds in the presence of activated carbon[J]. Applied Catalysis B: Environmental, 2008, 83(1): 150-159. [20] LIU T, ZHANG B, LI W, et al. The catalytic oxidation process of atrazine by ozone microbubbles: Bubble formation, ozone mass transfer and hydroxyl radical generation[J]. Chemosphere, 2023, 325: 138361. doi: 10.1016/j.chemosphere.2023.138361 [21] XIAO W, ZHANG H, WANG X, et al. Interaction Mechanisms and Application of Ozone Micro/Nanobubbles and Nanoparticles: A Review and Perspective[J]. Nanomaterials, 2022, 12(12): 1958. doi: 10.3390/nano12121958 [22] TEGZE A, SÁGI G, KOVÁCS K, et al. Radiation induced degradation of ciprofloxacin and norfloxacin: Kinetics and product analysis[J]. Radiation Physics and Chemistry, 2019, 158: 68-75. doi: 10.1016/j.radphyschem.2019.01.025 [23] LU C, GU J, WEI G, et al. Three-dimensional electro-Fenton degradation of ciprofloxacin catalyzed by CuO doped red mud particle electrodes: Influencing factors, possible degradation pathways and energy consumption[J]. Journal of Environmental Chemical Engineering, 2022, 10(3): 107737. doi: 10.1016/j.jece.2022.107737 [24] ZHANG J, LIU M, PANG B, et al. Ciprofloxacin degradation in microbubble ozonation combined with electro-generated H2O2 process: Operational parameters and oxidation mechanism[J]. Separation and Purification Technology, 2023, 325: 124676. doi: 10.1016/j.seppur.2023.124676 [25] ZHENG T, WANG Q, ZHANG T, et al. Microbubble enhanced ozonation process for advanced treatment of wastewater produced in acrylic fiber manufacturing industry[J]. Journal of Hazardous Materials, 2015, 287: 412-420. doi: 10.1016/j.jhazmat.2015.01.069 [26] HE Y, CAI Y, FAN S, et al. Hydroxyl radicals can significantly influence the toxicity of ofloxacin transformation products during ozonation[J]. Journal of Hazardous Materials, 2022, 438: 129503. doi: 10.1016/j.jhazmat.2022.129503 [27] WEN X, NIU C, HUANG D, et al. Study of the photocatalytic degradation pathway of norfloxacin and mineralization activity using a novel ternary Ag/AgCl-CeO2 photocatalyst[J]. Journal of Catalysis, 2017, 355: 73-86. doi: 10.1016/j.jcat.2017.08.028 -



 下载:
下载: