-
近年来,随着城市建设进程的加快,污水排放和化肥施用等人类活动使得部分水体受到了严重的氨氮污染[1-2]。在水利工程中,为了降低河道防洪水位,提高防洪能力,常常对城市河道进行裁弯取直,使流域河道的形态过于单一,影响河道对污染物的自净能力,加剧了河流区域的环境问题[3]。因此,需要对河道进行生态修复,这不仅关乎水质改善,也涉及生态系统的恢复与生物多样性的保护,一个健康的河道生态系统能够自然净化水质、调节水流、减少洪涝灾害,并为众多生物提供栖息地。构建丁坝和深潭浅滩是河道整治和防护工程中常见的措施。丁坝又称挑流丁坝,是指从河道岸边伸出的挑流体[4]。目前国内外已有许多学者通过实验室水槽实验和计算机模拟软件研究了不同结构丁坝周围的水流形态和河床冲刷特征。吴伊平等[5]利用数值模拟,发现丁坝挑角和丁坝长度会直接影响到丁坝周围的湍流动能和湍流黏度的大小。近年来,许多学者提出生态丁坝的概念,即引入生物材料,利用丁坝和微生物的共同作用提高河道对水中污染物的自净作用[6-7]。李慧[8]提出了用大块毛石堆积并种植沉水植物的生态丁坝,该由该生态丁坝构建的生态整治工程的鱼类流速适宜指数均保持在0.7以上,具有显著的河流生态治理效果。
浅滩指河床底部的一些不同规模的冲击物堆积体,水流急而浅;深潭指浅滩之间水深较大的部分,水流缓而深[9-10]。河道的深浅交替使河道内的生态系统更具有多样性。在整体河段尺度上,深潭浅滩既能增强河流输沙的平稳性和连续性,又能满足河流的防洪设计[11-12]。目前国内外关于深潭浅滩的形成机理有了一定的认识[13],如THOMPSON等[14]研究了康涅狄格州的布莱克里奇河上一对深潭浅滩的形成过程,同时定量评价了深潭浅滩的动力稳定性。目前的一些研究表明,深潭浅滩也可以对河流中的污染物起到一定净化的作用。李如忠等[15]发现深潭中主流区和暂态存储区具有较好的氮磷滞留潜力。阙凤翔等[16]研究了河床深潭、浅滩等5种地貌单元类型的潜在硝化速率,结果表明,其潜在硝化速率为0.002~0.079 μmol·(g·h)−1(平均值为0.024 μmol·(g·h)−1)。马博健等[17]发现丁坝、潜坝、深潭-浅滩相结合方案对河道水中DO的提高较为明显。针对深潭浅滩大型动物生境方面国内外也有所研究[18-20]。林欢等[21]的研究表明连续浅滩-深潭式仿自然生境修复技术方案有利于鱼类的产卵与栖息。综上所述,生态水利工程中对于深潭浅滩的形成机理、污染去除和生境作用的研究,对不同结构丁坝周围的污染物迁移扩散过程及不同材料的生态丁坝的研究较为丰富,而关于生态丁坝和深潭浅滩对河流氨氮污染净化效果、净化机理的研究较少,且对于生态丁坝和深潭浅滩的研究只停留在工程结构方面,对于微生物方面的研究较少。
本研究以安徽省芜湖市南陵县市桥河2段作为研究区域。经调研发现,该河段水质和水生态系统恶化的主要原因是河流自身的形态问题和沿岸污染问题。该河段形状较为顺直,横纵断面规则,河流自西北向东南流动,水动力条件不足,扩散能力与净化能力差。该河段周边存在许多住宅、农田及工厂,且排水系统比较混乱,大量工业污水和生活污水随雨水一同汇入河流,造成较为严重的氨氮面源污染,进而导致河流功能衰退。因此,该研究基于室内水槽实验,将生态丁坝和深潭浅滩联合构建,首先测定生态丁坝和深潭浅滩组合对水中氨氮的去除效果,并通过测定水槽运行30 d时生态丁坝和深潭浅滩的表面硝化速率和潜在硝化速率,并且对生物沸石、深潭浅滩底质中的微生物种群进行多样性测序,探究生态丁坝和深潭浅滩组合中的微生物多样性以及对水中氨氮污染物的净化机制。这对于实际河道修复中生态丁坝和深潭浅滩的结构布置和参数设置具有指导意义。
-
1)室内水槽模型。为了探究生态丁坝和深潭浅滩组合对河流氨氮的净化效果及影响因素,搭建了单向流动的室内水槽模型。根据安徽省芜湖市南陵县市桥河2段的平均河宽,按照1:60比例进行缩放。水槽中水流运动的主要作用力为重力,其他次要影响忽略不计,考虑水力条件相似,应用弗汝德定律,模型时间比例根据式(1)计算,流速比例根据式(2)计算,流量比例根据式(3)计算,力的比例根据式(4)计算。
式中:Lr为长度比例;Tr为时间比例;Vr为流速比例;Ar为面积比例;Qr为流量比例;ρr为密度比例;gr为重力加速度比例;Fr为力的比例 。
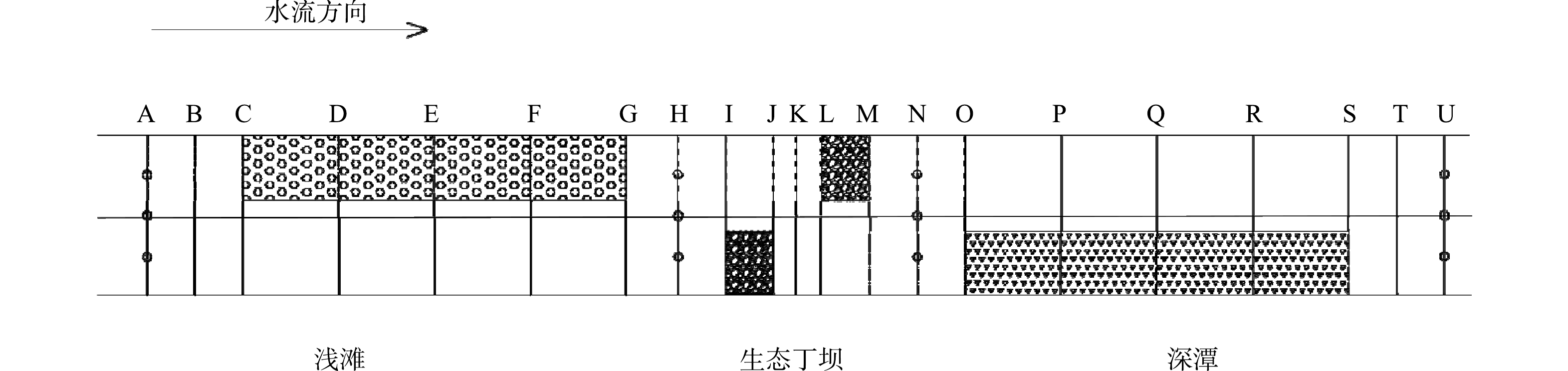
如图1和图2所示,水槽模型整体为矩形横断面,长5.0 m,宽0.5 m,高0.3 m,坡度为0.001,糙率为0.016。图2中A~U为水槽不同位置的横断面。在水槽模型中,水流从经测定不含氮素的中水管道流出,首先进入长0.5 m的布水段,在多孔布水盒和多孔稳水板的作用下,水流达到稳定状态;随后水流进入长4.0 m的实验段;之后水流经过长0.5 m的出水段,通过调节活动插板控制水位高度;最后水流从水槽末端的出水三角堰流出。
2)生态丁坝(生物沸石)。本研究利用优势菌种挂膜法将天然沸石制备为生物沸石。生物沸石可以利用离子交换与生物膜的耦合作用,以较快的速度达到吸收-再生动态平衡,获得更长时间的吸附效率。
首先将粒径为5.0~8.0 mm的天然沸石用蒸馏水洗涤,并加入直径为0.1 m,高为1.0 m的有机玻璃圆柱体中。随后将2.0 g固体硝化细菌和2.0 g固体反硝化细菌用1.0 L的蒸馏水溶解,并加入圆柱体中[22]。再加入微生物培养溶液[23],直至圆柱体中的水位高度高于沸石5.0 cm左右。控制曝气泵的曝气速率为0.05 L·min−1,使得圆柱体内溶液DO质量浓度维持在2~5 mg·L−1。微生物培养溶液由质量浓度为250 mg·L−1 C6H12O6、4.2 mg·L−1 MgSO4、20 mg·L−1 NH4Cl、4.2 mg·L−1 MnSO4、4.2 mg·L−1 CaCl2、2.3 mg·L−1 NaH2PO4组成。
每培养3 d后,关闭曝气泵并静置2 h。随后分别将圆柱体中1/5、2/5、3/5、4/5的上层溶液在出水口排出,并加入微生物培养溶液至初始水位高度,以加快培养速度。培养15 d后,沸石表面及间隙附着大量的絮状物,停止培养。根据安徽省芜湖市南陵县市桥河某一排污口的水质情况配置了模拟污水(C6H12O6 150 mg·L−1,NH4Cl 20 mg·L−1),并将其从下至上注入圆柱体中[24],使装置在0.85 m·h−1的水力负荷下运行。对出水水质监测5 d后发现,该装置对污染物的去除率逐渐达到稳定状态,其中氨氮去除率为43%,耗氧有机污染物(以COD计)去除率为54%。至此,生物沸石制备成功[25]。
3)深潭浅滩底质。天然河流的不同形态结构的底质具有一定差异,因此不同形态结构所营造的水生环境和微生物多样性也有所差异,进而影响河流污染物的净化效果。有研究表明,浅滩底质多为砂粒和砾石,而深潭底质多为黏粒和粉砂[26]。该研究选用研究区域河段的下游采样,并利用筛网将部分混合底质中的砾石与黏粒分开,分别作为水槽模型中的浅滩底质和深潭底质。浅滩底质和深潭底质的实物图如图3所示。
-
经实地调研发现,安徽省芜湖市南陵县市桥河的流速为0.019~0.256 m·s−1。根据弗汝德定律设置Q1流量(1.5×10−3 m3·s−1)。目前一般将生态丁坝和深潭浅滩结构串联在河道内,来探究生态丁坝和深潭浅滩组合对河流生境的改善效果。之前研究表明,错口生态丁坝和异侧深潭浅滩对氨氮净化效果最好[22]。因此,本实验选用一对错口丁坝和一对异侧深潭浅滩进行组合安置在水槽中。为了模拟实际河道环境,在水槽模型内铺设厚度为3 cm的混合底质。随后将制备好的生物沸石分别装入2个长20 cm、宽10 cm、高10 cm钢丝网笼,制成生态丁坝;将采集的浅滩底质装入长80 cm、宽20 cm、高10 cm钢丝网笼,并均匀的种植挺水植物菖蒲,以模拟浅滩结构;在长80 cm、宽20 cm、深10 cm的深槽中铺设厚度为5 cm的深潭底质,并均匀的种植沉水植物苦草,以模拟深潭结构。水槽模型如图1和图2所示。向水槽中通入Q1流量污水,水槽模型外另设一个装有50 mg·L−1 NH4Cl溶液的塑料污水箱。调节水槽模型的进水阀及活动插板,并利用蠕动泵将塑料污水箱中的溶液在水槽的布水段以恒定的流量释放,以模拟上游污染源的释放。待水槽中的水位高度稳定在15 cm,开始对水槽中的水质和流速进行监测。在实验段共设置了4个测量断面(A、H、N、U)和12个测量点,如图2所示。A断面代表污染物在浅滩上游的浓度,H断面代表污染物经浅滩后的下游浓度和生态丁坝前的上游浓度,N断面代表污染物经生态丁坝下游的浓度和深潭上游的浓度,U断面代表污染物经深潭后的下游浓度。待水槽中的水位高度达到稳定状态,使用塑料滴管分别在A、H、N和U断面的3个测量点取样,并对水样中的氨氮浓度进行监测。设置3组平行实验,以保证实验结果的可靠性和准确性。待30 d后,利用氯酸钾抑制法比较生物沸石、浅滩底质和深潭底质的潜在硝化速率和表面硝化速率,并对生物沸石、浅滩底质和深潭底质进行微生物群落多样性测序。在测定潜在硝化速率和表面硝化速率的过程中可能会有部分N2O产生造成误差,由于使用的氨氮溶液浓度较低,产生气体的量不大,本研究暂忽略不计。
-
1)氨氮和亚硝酸盐氮的测定。氨氮质量浓度采用《水质 氨氮的测定 水杨酸分光光度法》(HJ 536-2009)测定;亚硝酸盐氮质量浓度采用《水质 亚硝酸盐氮的测定 分光光度法》(GB 7493-1987)测定。
2)表面硝化速率的测定。水槽模型运行30 d后,取出12 g生物沸石、12 g浅滩底质和12 g深潭底质分别置于50 mL离心管中,加入20 mL蒸馏水、10 mL浓度为20 mmol·L−1的(NH4)2SO4溶液和10 mL浓度为75 mmol·L−1 KClO3溶液。以KClO3溶液加入的时间为0,分别在0、8、16、24 h从离心管中取3 mL水样,并加入3 mL蒸馏水。每组样品设置3个平行样。测量各水样的亚硝态氮含量。生物沸石、浅滩底质和深潭底质的表面硝化速率根据式(5)计算。
式中:v1为表面硝化速率,μmol·(m2·h)−1;ka为亚硝态氮积累浓度与时间的线性拟合斜率,μmol·(L·h)−1;V1为上覆水体积,取40 mL;S为离心管截面积,取5.73 cm2;10为单位转换系数。
3)潜在硝化速率的测定。水槽模型运行30 d后,取出2 g生物沸石、2 g浅滩底质和2 g深潭底质分别置于50 mL锥形瓶中,加入5 mL蒸馏水、5 mL浓度为60 mmol·L−1的KClO3溶液和10 mL浓度为8 mmol·L−1的(NH4)2SO4溶液,于200 r·min−1、20 ℃的恒温振荡培养箱中振荡培养。设置首次培养时间0、2、4、6 h,共4个培养组,每个培养组设3个平行样。首次培养完成后,加入20 mL浓度为4 mol·L−1的KCl溶液,再次振荡培养30 min。振荡完成后测量各锥形瓶水样的亚硝态氮含量。生物沸石、浅滩底质和深潭底质的潜在硝化速率根据式(6)计算。
式中:v2为潜在硝化速率,μmol·(g·h)−1;kp为亚硝态氮积累浓度与时间的线性拟合斜率,μmol·(L·h)−1;V2为提取体系体积,取0.04 L;m为样品烘干后的质量,g。
4)微生物群落多样性测序。水槽模型运行30 d后,分别取出一定量的生物沸石、浅滩底质和深潭底质于100 mL离心管中,每组采集5个平行样品,累计共收集15个样品。将采集的样品存储在液氮罐中冷存。将上述样品送至上海美吉生物医药科技有限公司,并采用Miseq高通量测序技术进行微生物群落多样性测序,主要步骤包括:提取样品的DNA;使用
$ 338\mathrm{F}(5\mathrm{\text{'}}-\mathrm{A}\mathrm{C}\mathrm{T}\mathrm{C}\mathrm{C}\mathrm{T}\mathrm{A}\mathrm{C}\mathrm{G}\mathrm{G}\mathrm{G}\mathrm{A}\mathrm{G}\mathrm{G}\mathrm{C}\mathrm{A}\mathrm{G}\mathrm{C}\mathrm{A}-3\mathrm{\text{'}}) $ 和806R$(5\mathrm{\text{'}}-\mathrm{G}\mathrm{G}\mathrm{A}\mathrm{C}\mathrm{T}\mathrm{A}\mathrm{C}\mathrm{H}\mathrm{V}\mathrm{G}\mathrm{G}\mathrm{G}\mathrm{T}\mathrm{W}\mathrm{T}\mathrm{C}\mathrm{T}\mathrm{A}\mathrm{A}\mathrm{T}-3\mathrm{\text{'}}) $ 引物序列对样品16SrDNA基因的V3~V4区域进行扩增,并按照测序量要求进行相应比例的混合;采用2%的琼脂糖凝胶进行电泳检测,并回收PCR产物;使用QuantiFluor™ -ST蓝色荧光定量系统实现PCR产物的定量检测和均一化;进行Illumina高通量测序,并将测序获得的原始数据进行拼接质控与优化,便于进行后续的微生物群落多样性分析。 -
为了探究生态丁坝和深潭浅滩组合对河流氨氮的净化效果,检测各采样点和采样断面的氨氮浓度,根据4个断面(A、H、N、U)的氨氮浓度分析得到浅滩、生态丁坝、深潭对氨氮的去除率,结果如图4所示。由图4可知,在0~24 h内生态丁坝和深潭浅滩组合中生态丁坝的氨氮去除率由24.38%降至8.06%,24~48 h内生态丁坝的氨氮去除率逐渐达到稳定,48 h氨氮平均去除率为7.92%。0~24 h内浅滩和深潭的氨氮去除率均处于波动状态,分别为2.53%~5.85%和1.31%~4.45%,24~48 h内浅滩和深潭的氨氮去除率均逐渐达到稳定状态,48 h氨氮平均去除率分别为4.56%和3.42%。以上结果表明,生态丁坝和深潭浅滩均对水中的氨氮均有去除作用,且氨氮去除率均表现为生态丁坝>浅滩>深潭。
-
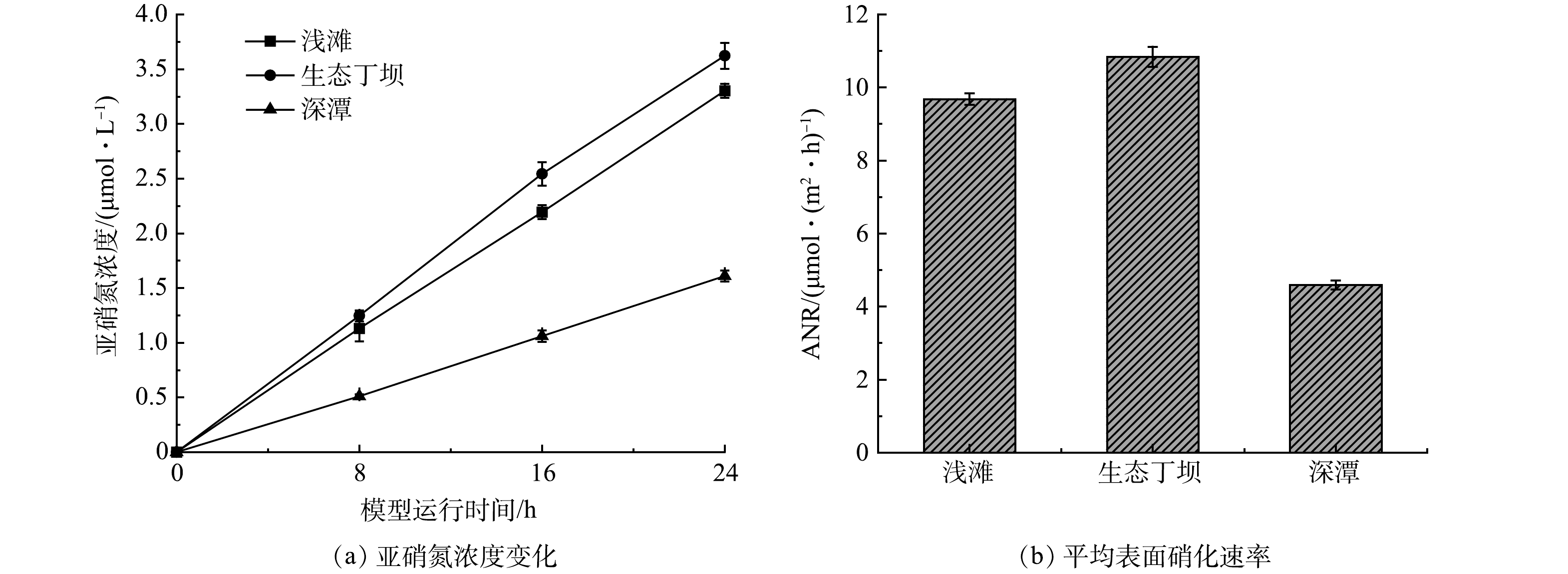
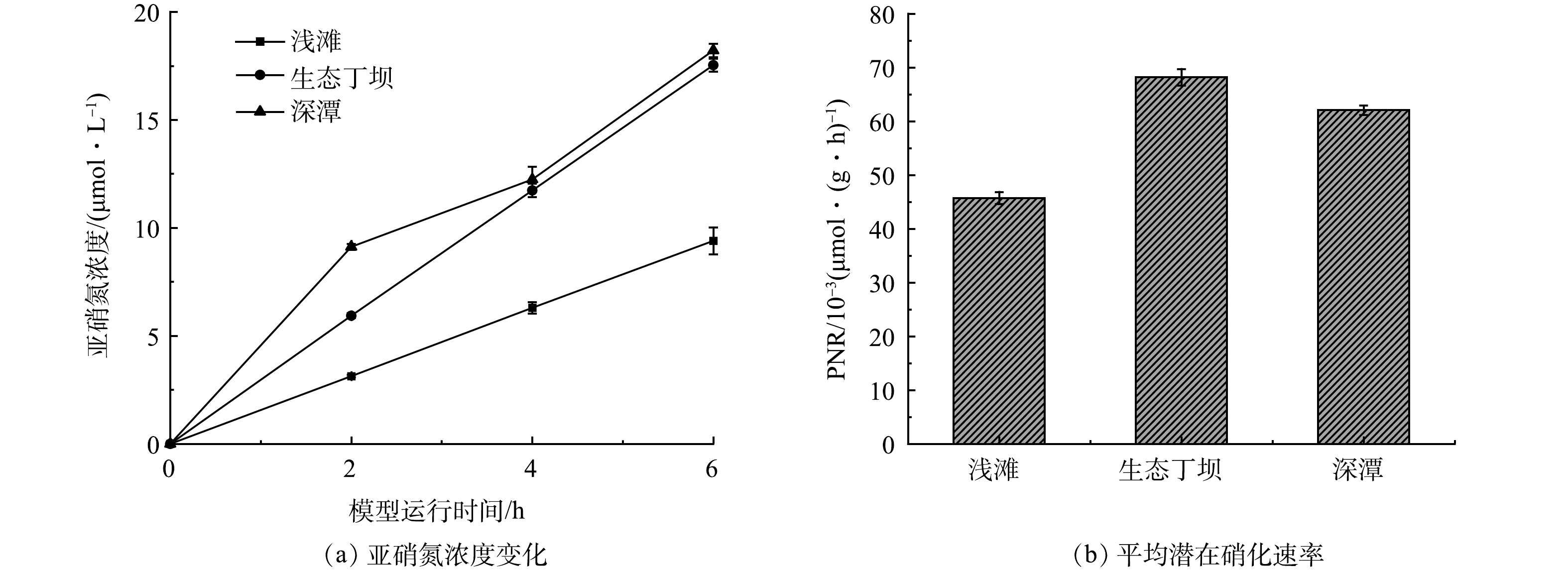
微生物的硝化作用是河流氨氮净化的主要机制和重要循环过程[27]。为了进一步探究生态丁坝和深潭浅滩组合对河流氨氮的净化效果,分析浅滩、生态丁坝和深潭的硝化能力,首先在水槽模型运行的第30天,分别从浅滩、生态丁坝和深潭中取出部分底质样品,并利用氯酸钾抑制法测定各底质的表面硝化速率和潜在硝化速率,结果如图5和图6所示。
由图5可以看出,浅滩、生态丁坝和深潭底质中的亚硝氮浓度均呈上升趋势,并且浅滩的平均表面硝化速率为9.68 μmol·(m2·h)−1,生态丁坝的平均表面硝化速率为10.84 μmol·(m2·h)−1,深潭的平均表面硝化速率为4.59 μmol·(m2·h)−1,表面硝化速率表现为生态丁坝>浅滩>深潭。表面硝化速率能够反应底质的实际硝化过程,这也与水槽模型的净化实验结果相符。硝化过程是多种好氧及兼性硝化细菌完成的。生态丁坝中的沸石由于其多孔结构更容易使得硝化细菌附着和生长,且生态丁坝区域和浅滩区域相比深潭区域的溶解氧更加充足[28],有利于微生物的生长代谢,因此,表现出较强的表面硝化速率。
由图6可以看出,浅滩、生态丁坝和深潭底质中的亚硝氮浓度都随模型运行时间呈上升趋势,并且浅滩的平均潜在硝化速率为45.72×10−3 μmol·(g·h)−1,生态丁坝的平均潜在硝化速率为68.19×10−3 μmol·(g·h)−1,深潭的平均潜在硝化速率为62.06×10−3 μmol·(g·h)−1,潜在硝化速率表现为生态丁坝>深潭>浅滩。潜在硝化速率能够表示底质的最大硝化潜力。在溶解氧充足的水生态系统中,潜在硝化速率越高,表面硝化速率也应该越高。然而深潭的潜在硝化速率大于浅滩的潜在硝化速率,深潭的表面硝化速率却小于浅滩的表面硝化速率。这是由于深潭区域受到溶解氧的限制[29],从而导致深潭的硝化潜能难以充分发挥。
-
为了进一步探究生态丁坝和深潭浅滩组合的微生物群落特征,在水槽模型运行的第30d,分别从浅滩、生态丁坝和深潭中取出部分底质样品,每个区域采集4组平行样品,并采用Miseq高通量测序技术进行微生物群落多样性测序,并对实验结果取平均值。共采集12个底质样品,共获得715 245个优化序列,平均序列长度为4 161。
OTU是为了方便生物信息统计分析而人为设置的分类单元。该研究通过提取优化序列中的非重复非单序列,并按照97%的相似性对其进行OTU聚类分析,即将Miseq高通量测序获得的非重复非单序列按照97%的相似性划分为多个OTU分类单元,随后根据划分的OTU分类单元识别底质样品的物种信息,以分析其微生物群落的组成情况。本实验中3种底质样品共存在7 504个OTUs,其中,浅滩中含有5 178个OTUs,生态丁坝中含有5 816个OTUs;深潭中含有5 723个OTUs。因此,不同底质样品中OTUs数量表现为生态丁坝>深潭>浅滩。
Alpha多样性分析可以反映微生物群落的丰富度和多样性水平信息,主要包含Ace、Chao、Shannon和Simpson等统计学分析指数。其中,Ace指数和Chao指数可以评价样品菌群的丰富度。Shannon和Simpson指数均可以估计样品菌群的多样性,Shannon指数越大,菌群多样性越高,Simpson指数越大,菌群多样性越低。覆盖度(Coverage)指数可以反映样品覆盖率,覆盖度指数越大,样品中序列被检测出的概率越高,越能反映样品中菌群的真实情况。将4组平行实验结果取平均值得到不同底质样品中菌群Alpha多样性指数信息如表1所示。不同底质样品的Ace指数和Chao指数均处于较高水平,浅滩中分别为4 559.79和4 448.54,生态丁坝中分别为4 949.51和4 891.20,深潭中分别为4 823.94和4 795.33,底质样品中的菌群组成丰富度表现为生态丁坝>深潭>浅滩。此外,浅滩、生态丁坝和深潭的Shannon指数分别为6.93、6.95和6.92,Simpson指数分别为0.004、0.002和0.003,这也说明底质样品中的菌群组成丰富度为生态丁坝>深潭>浅滩。不同底质样品的覆盖度值均为0.98,代表测序覆盖率高,可以真实展示样品中绝大部分细菌的情况。
对不同底质样品的所有OTUs进行识别,共检出属水平的细菌数量为1 371个,隶属于52个门,171个纲,407个目,691个科。浅滩、生态丁坝和深潭中共同拥有的“属”水平的细菌数量为905个,占属水平的细菌总量的66.01%。浅滩中特有的属水平的细菌数量为29个,占细菌物种总数的2.12%;生态丁坝中特有的“属”水平的细菌数量为137个,占细菌物种总数的9.99%;深潭中特有的属水平的细菌数量为47个,占细菌物种总数的3.43%。
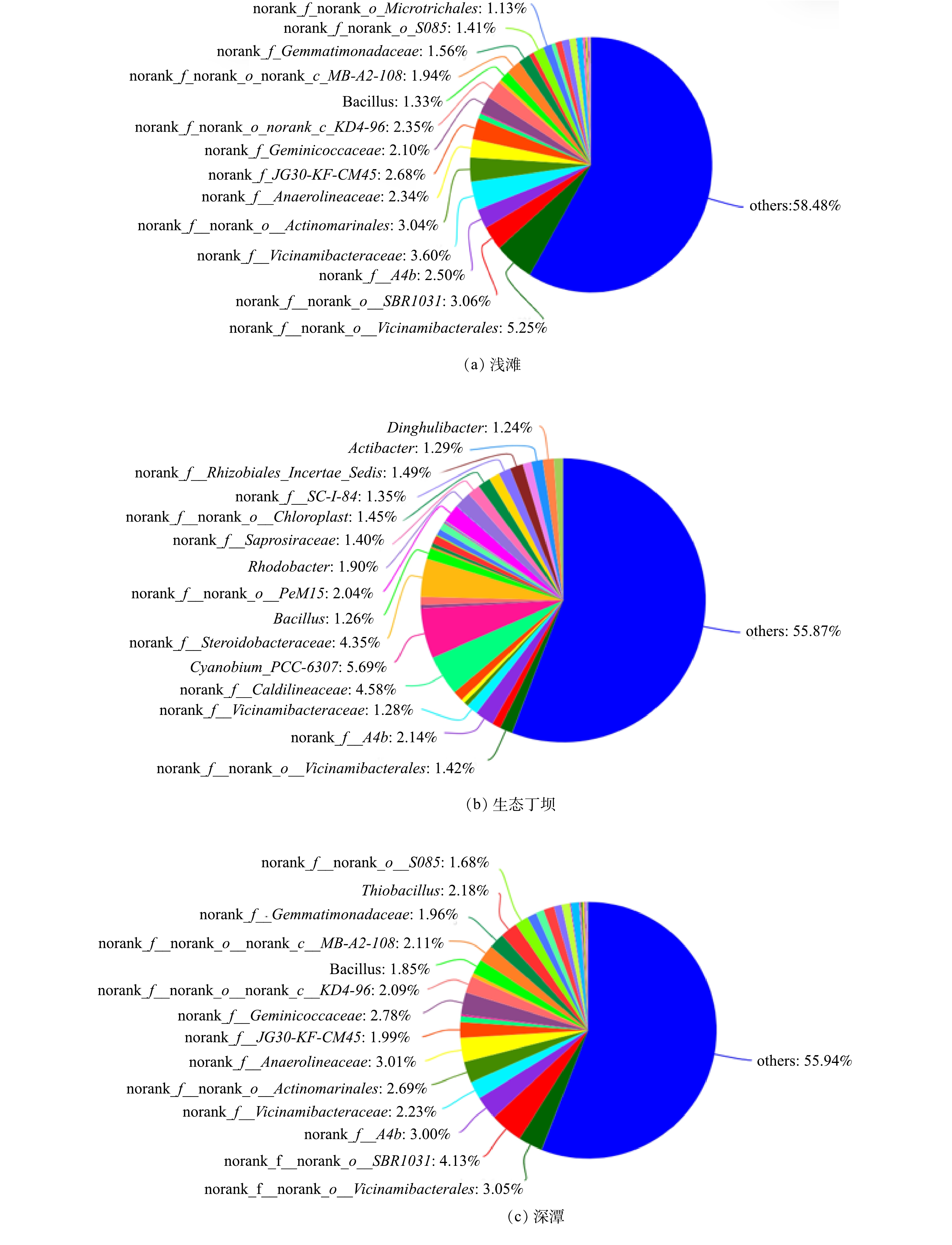
在属水平上,不同底质样品中的菌群组成差异较为明显。图7为不同底质样品中在属水平上的菌群组成结构。其中浅滩中的优势菌属主要包括放线菌门中的未分类属(norank_f_norank_o_Vicinamibacterales、norank_f_norank_o_norank_c_MB-A2-108、norank_f_norank_o_Actinomarinales),绿弯菌门中的未分类属(norank_f_norank_o_SBR1031、norank_f_JG30-KF-CM45、norank_f_A4b、norank_f_norank_o_norank_c_KD4-96、norank_f_Anaerolineaceae);生态丁坝中的优势菌属主要包括蓝细菌门中的蓝菌属(Cyanobium_PCC-
6307 )、未分类属(norank_f_norank_o_Chloroplast),变形菌门中的未分类属(norank_f_Steroido-bacteraceae、norank_f_Rhizobiales_Incerta_Sedis)、红细菌属(Rhodobacter),绿弯菌门中的未分类属(norank_f_Caldilineaceae、norank_f_A4b),放线菌门中未分类属(norank_f_norank_o_PeM15、norank_f_norank_o_Vicinamibacterales);深潭中的优势菌属主要包括绿弯菌门中的未分类属(norank_f_norank_o_SBR10-31、norank_f_Anaerolineaceae、norank_f_A4b、norank_f_KD4-96),放线菌门中的未分类属(norank_f_norank_o_Vicinamibacterales、norank_f_norank_o_Act-inomarinales、norank_f_norank_o_norank_c_MB-A2-108)。这与已有研究结果相似,如何晓乐[30]利用16S r DNA和ITS扩增子测序研究了西安四条河流急流—深潭—河滩系统沉积物中的细菌及真菌的分布规律,发现变形菌门是绝对优势物种(47.33%),不同河流的微生物种类分布不同。王佳等[31]发现浑河底泥中的微生物主要属于变形菌门( Proteobacteria) 、蓝藻菌门( Cyanobacteria) 、厚壁菌门( Firmicutes) 和拟杆菌门( Bacteroidetes)。通过本研究可以看出,浅滩和深潭中的菌群组成相似度较高,优势菌属主要属绿弯菌门和放线菌门。有研究表明,变形菌、放线菌和绿弯菌广泛存在于城市污水处理系统中,在生物降解中起着重要作用[32]。绿弯菌门和放线菌门中包含大量的硝化细菌和反硝化细菌,并且其丰度水平与氨氮呈正相关[33-34]。与浅滩和深潭相比,生态丁坝中的菌群组成则表现出明显的差异性,即除绿弯菌门和放线菌门的优势菌属外,还包含蓝细菌门和变形菌门。有研究[35]表明,蓝细菌门细菌可以通过产氧性光合作用生长,在氮磷丰富的水体中生长旺盛,与总氮、氨氮呈显著的正相关性。变形菌门与硝态氮呈显著的正相关性,对可以促进水环境中氮的循环流动[36]。绿弯菌门具有将NO3−-N转化为NO2−-N的能力,与硝态氮呈负相关[37]。放线菌门与硝态氮、总氮呈正相关,与氨氮呈负相关。根据氨氮去除率分析、硝化作用分析及Alpha多样性分析结果可知,该结构氨氮去除率均表现为生态丁坝>浅滩>深潭,表面硝化速率表现为生态丁坝>浅滩>深潭,潜在硝化速率表现为生态丁坝>深潭>浅滩,底质中的菌群组成丰富度表现为生态丁坝>深潭>浅滩。因此,不同底质中菌群丰富度和组成结构,是影响浅滩、生态丁坝和深潭硝化能力及净化效果的重要因素。 -
1)在流量为1.5×10−3 m3·s−1、错口生态丁坝和异侧深潭浅滩组合的条件下,生态丁坝、深潭和浅滩均对水中的氨氮有明显的去除效果,并且氨氮去除速率表现为生态丁坝>浅滩>深潭。表面硝化速率表现为生态丁坝>浅滩>深潭,而潜在硝化速率表现为生态丁坝>深潭>浅滩,这是由于深潭区域受到溶解氧的限制,从而导致深潭的硝化潜能难以得到充分发挥。
2)不同底质样品中OTUs数量表现为生态丁坝>深潭>浅滩,菌群组成丰富度表现为生态丁坝>深潭>浅滩,并且浅滩和深潭的菌群组成相似度较高,而生态丁坝的菌群组成则表现出明显的差异性,其包含蓝细菌门和变形菌门,具有良好的固氮作用,可以促进水环境中氮的去除,这导致了生态丁坝的氨氮去除速率、硝化速率与深潭浅滩有明显差异。
3)不同底质中菌群丰富度和组成结构是影响浅滩、生态丁坝和深潭硝化能力以及净化效果的重要因素。
微生物作用下生态丁坝和深潭浅滩组合对氨氮的净化效果
Purification effect of ammonia nitrogen by ecological groin and deep pool shoals combination under the action of microorganisms
-
摘要: 在河道中布置生态丁坝和深潭浅滩是河道整治和防护工程中常见的措施。然而,目前的研究大多数集中在生态丁坝的材料和深潭浅滩对河流生境的影响方面,很少关注微生物作用下生态丁坝和深潭浅滩对河流中氨氮的净化机理。为此,该研究将错口生态丁坝和异侧深潭浅滩组合,采用水槽模型实验的方法研究生态丁坝和深潭浅滩组合布置对河道水体氨氮的净化能力,并对生态丁坝和深潭浅滩的微生物多样性进行分析。结果表明:河流中的氨氮总去除率表现为生态丁坝>浅滩>深潭,即氨氮的净化能力为生态丁坝>浅滩>深潭;生态丁坝和深潭浅滩组合对河流中氨氮的表面硝化速率表现为生态丁坝>浅滩>深潭,而潜在硝化速率表现为生态丁坝>深潭>浅滩;不同底质样品中OTUs数量表现为生态丁坝>深潭>浅滩,菌群组成丰富度表现为生态丁坝>深潭>浅滩;与深潭和浅滩相比,生态丁坝中菌群组成则表现出明显的差异性,除绿弯菌门和放线菌门的优势菌属外,还包含蓝细菌门和变形菌门。研究显示:生态丁坝和深潭浅滩底质中的菌群对河流中氨氮起主要净化作用,其组成结构和丰富度的差异,是导致浅滩、生态丁坝和深潭硝化速率及净化效果不同的重要原因。Abstract: The installation of ecological groin and deep pool shoals is a prevalent practice in river regulation and protection engineering. Nevertheless, prevailing research primarily focuses on the material composition of ecological groin and the impact of deep pool shoals on river habitats, the purification mechanism of ammonia nitrogen in rivers using ecological groin and deep pool shoals under the action of microorganisms has received slight attention. Thus, the ecological alternate groin and deep pool shoals on varying sides was combined to assess their capacity for purifying ammonia nitrogen with the water tank modeling experimental method, and the microbial diversity in them was analyzed. The results showed that the order of the total removal rate of ammonia nitrogen in rivers, as well as the order of the purification effect of ammonia nitrogen, was ecological groin > shoal > deep pool. The order of the surface ammonia nitrogen nitrification rate for this combination was ecological groin > shoal > deep pool, while the order of the potential nitrification rate was groin > deep pool > shoal. The OTU counts in various sediment samples presented the following order: ecological groin > deep pool > shoal, whereas the bacterial community richness presented the following order: groin > deep pool > shoal. Compared with that in deep pools and shoals, a notable contrast occurred in the microbial community composition of ecological groin. Besides the dominated bacterial community of Cyanobacteria and Proteobacteria at phylum levle, Cloroflexi and Actinomyces were also dominated ones. The findings indicated that the microbial community at the bottom of the ecological groin and the deep pool significantly contributed to the purification of ammonia nitrogen in the river. Furthermore, the difference in microbial composition and abundance is a key factor affecting the the nitrification rates and purification efficiency among the shoal, groin and deep pool.
-

-
表 1 底质样品中菌群Alpha多样性指数
Table 1. Alpha diversity index of microflora in substrate samples
样品 Ace Chao Shannon Simpson 覆盖度 浅滩 4 559.79 4 548.54 6.93 0.004 0.98 生态丁坝 4 949.51 4 891.20 6.95 0.002 0.98 深潭 4 823.94 4 795.33 6.92 0.003 0.98 -
[1] XU J, JIN G, TANG H, et al. Assessing temporal variations of ammonia nitrogen concentrations and loads in the huaihe river basin in relation to policies on pollution source control[J]. Science of the Total Environment, 2018, 642: 1386-1395. doi: 10.1016/j.scitotenv.2018.05.395 [2] 杨琴, 张永勇. 沙颍河流域(河南段)非点源氨氮污染模拟与时空特征分析[J]. 环境科学研究, 2021, 34(2): 319-327. [3] XIAO C G, CHEN J, YUAN X J, et al. Model test of the effect of river sinuosity on nitrogen purification efficiency[J]. Water, 2020, 12(6): 1667. doi: 10.3390/w12061667 [4] AUNG H, ONORATI B, OLIVETO G, et al. Riverbed morphologies induced by local scour processes at single spur dike and spur dikes in cascade[J]. Water, 2023, 15(9): 1746. doi: 10.3390/w15091746 [5] 吴伊平, 张岩, 崔鹏义, 等. 丁坝挑角及长度对回流区流动特性影响的数值模拟[J]. 上海理工大学学报, 2020, 42(1): 79-87. [6] RAO L , WANG P F , DAI Q S , et al. The coupling between hydrodynamic and purification efficiencies of ecological porous spur-dike in field drainage ditch[J]. Journal of Hydrodynamics, 2018, 30(3): 373-83. [7] CHEN, Y T. , WANG, X L. , LI S M , et al. Purification efficiency of ecological spur dikes for river pollutants in different geometric arrangements: Experiments and numerical modeling[J]. Journal of Hydrodynamics, 2022, 34, 934-947. [8] 李慧. 基于河道不同生态治理方案的数值模拟探究[J]. 黑龙江水利科技, 2018, 46(11): 13-16. doi: 10.3969/j.issn.1007-7596.2018.11.004 [9] 王兵, 刘慧博, 李峪, 等. 深潭的功能及在城市河道治理中的构建模式[J]. 中国水土保持科学, 2014, 12(3): 107-112. doi: 10.3969/j.issn.1672-3007.2014.03.016 [10] SCHUMM S A, KHAN H R. Experimental study of channel patterns[J]. Nature, 1971, 233(5319): 407-409. doi: 10.1038/233407a0 [11] 黄国鲜, 周建军. 复杂边界下三维水流数学模型的建立和验证[J]. 水力发电学报, 2007, 26(4): 66-70. doi: 10.3969/j.issn.1003-1243.2007.04.013 [12] CALDERON M S, AN K-G. An influence of mesohabitat structures (pool, riffle, and run) and land-use pattern on the index of biological integrity in the Geum River watershed[J]. Journal of Ecology and Environment, 2016, 40(2): 107-119. [13] 王宏涛, 董哲仁, 赵进勇, 等. 蜿蜒型河流地貌异质性及生态学意义研究进展[J]. 水资源保护, 2015, 31(6): 81-85. doi: 10.3880/j.issn.1004-6933.2015.06.013 [14] THOMPSON D M, FIXLER S A. Formation and maintenance of a forced pool-riffle couplet following loading of large wood[J]. Geomorphology, 2017, 296: 74-90. doi: 10.1016/j.geomorph.2017.08.030 [15] 李如忠, 何瑞亮, 刘超, 等. 水库泄洪闸下溪流深潭氮磷营养盐滞留特征及动力学模拟[J]. 环境科学学报, 2021, 41(11): 4606-4614. [16] 阙凤翔. 巢湖十五里河不同河床地貌类型沉积物硝化反硝化潜力与限制性研究[D]. 合肥: 合肥工业大学, 2019. [17] 马博健. 河道仿自然生境营造技术研究: 以太子河本溪城区段为例[D]. 沈阳: 辽宁大学, 2018. [18] WILKINSON S N, RUTHERFURD I D, KELLER R J. An experimental test of whether bar instability contributes to the formation, periodicity and maintenance of pool-riffle sequences[J]. Earth Surface Processes & Landforms, 2010, 33(11): 1742-1756. [19] PAN B, YUAN J, ZHANG X, et al. A review of ecological restoration techniques in fluvial rivers[J]. International Journal of Sediment Research, 2016, 31(2): 110-9. doi: 10.1016/j.ijsrc.2016.03.001 [20] ASSUMPCAO L, MAKRAKIS M , SILVA J F M D , et al. Deep pools: Ecological sanctuaries for steindachneridion melanodermatum, a large endemic and endangered pimelodid of the Iguau river[J]. Multidisciplinary Digital Publishing Institute, 2021, 13(12): 1700. [21] 林欢, 王丽, 杨胜发, 等. 广阳坝河段连续浅滩-深潭式仿自然生境修复技术研究[J]. 水电能源科学, 2023, 41(4): 85-87+96. [22] WANG Q H, LI S M, WANG X L, et al. Study on purification effect of river ammonia nitrogen and optimization of layout parameters in the combination of ecological spur dikes and deep pool shoals: Experiments and MIKE21[J]. River Research and Applications, 2024, 40(4): 529-543. doi: 10.1002/rra.4246 [23] 周群英, 王士芬. 环境工程微生物学[M]. 高等教育出版社2008: 443-446. [24] HUANG T L, ZHOU Z M, XU J L, et al. Biozeolite capping for reducing nitrogen load of the ancient canal in Yangzhou city[J]. Water Science and Technology, 2012, 66(2): 336-344. doi: 10.2166/wst.2012.189 [25] CHEN S, CHEN Y, PEI H, et al. Biofilm development dynamics and pollutant removal performance of ceramsite made from drinking-water treatment sludge[J]. Water Environment Research, 2019, 91(7): 616-627. doi: 10.1002/wer.1089 [26] 郭春祥, 王震洪, 刘立波, 等. 清水江河道深潭—急流—河滩系统水质差异[J]. 绿色科技, 2016(12): 90-94. doi: 10.3969/j.issn.1674-9944.2016.12.032 [27] ISNANSETYO A , SEGUCHI M , KORIYAMA M. Nitrification potential rate of different sediment types of the ariake sea tidal flat in summer and autumn[J]. Research Journal of Environmental & Earth Sciences, 2011, 3(6): 704-716. [28] 赵文博, 解永新, 于英潭, 等. 不同生态复氧方式对城市河流溶解氧影响研究[J]. 环境生态学, 2019, 1(3): 61-66. [29] 王超, 单保庆, 赵钰. 滏阳河水系沉积物硝化速率分布及溶解氧的限制效应[J]. 环境科学学报, 2015, 35(6): 1735-1740. [30] 何晓乐. 西安四条河流急流—深潭—河滩系统底泥微生物多样性及退化河流恢复策略[D]. 西安: 长安大学, 2021. [31] 王佳, 彭剑峰, 宋永会, 等. 浑河底泥微生物群落的季节性变化特征[J]. 环境科学研究, 2016, 29(2): 202-210. [32] YANG Z C, ZHOU Q, SUN H M, et al. Metagenomic analyses of microbial structure and metabolic pathway in solid-phase denitrification systems for advanced nitrogen removal of wastewater treatment plant effluent: A pilot-scale study[J]. Water Research, 2021, 196: 117067. doi: 10.1016/j.watres.2021.117067 [33] PJEVAC P, SCHAUBERGER C, POGHOSYAN L, et al. AmoA-Targeted polymerase chain reaction primers for the specific detection and quantification of comammox nitrospira in the environment[J]. Frontiers in Microbiology, 2017, 8: 1508. doi: 10.3389/fmicb.2017.01508 [34] DAIMS H, LüCKER S, WAGNER M. A new perspective on microbes formerly known as nitrite-oxidizing bacteria[J]. Trends in Microbiology, 2016, 24(9): 699-712. doi: 10.1016/j.tim.2016.05.004 [35] CHEN M Y, TENG W K, ZHAO L, et al. Phylogenomics uncovers evolutionary trajectory of nitrogen fixation in cyanobacteria[J]. Molecular Biology and Evolution, 2022, 39(9): msac171. doi: 10.1093/molbev/msac171 [36] HOEFEL D, MONIS P T, GROOBY W L, et al. Profiling bacterial survival through a water treatment process and subsequent distribution system[J]. Journal of Applied Microbiology, 2005, 99(1): 175-186. doi: 10.1111/j.1365-2672.2005.02573.x [37] FENG C J, ZHANG Z J, WANG S M, et al. Characterization of microbial community structure in a hybrid biofilm-activated sludge reactor for simultaneous nitrogen and phosphorus removal[J]. Journal of Environmental Biology, 2013, 34(2): 489-499. -




 下载:
下载: