-
堆肥是一种前景广阔的处理生物或有机废物的方法,适用于动物粪便、秸秆、木屑、蘑菇渣、食物废物、花园废物和纸张等任何可进行好氧或厌氧分解的废物[1]。然而,传统的堆肥法存在着一些问题,如发酵时间长、肥效低、腐殖质转化不完全等。为了解决这些问题,缩短堆肥周期并提高堆肥质量成为国内外学者关注的焦点[2]。堆肥物料中难降解有机物的存在是导致上述问题的主要原因,而堆肥高温期是有机大分子分解的主要阶段,也是确保堆肥无害化的重要阶段[3]。然而,当堆肥温度升到高温期时,绝大部分微生物的生长繁殖受到了抑制,其种群数量和多样性普遍降低,酶活性受到影响从而限制了有机质的分解。
目前,针对促进堆肥无害化的研究主要集中在工艺优化和筛选耐高温/嗜热菌方面[4]。嗜热菌具有代谢快、活性高、酶的热稳定性高、能够在高温条件下杀死病原菌等特点。在堆肥过程中引入嗜热菌,可以增加高温期微生物的数量,促进难降解有机物的快速转化,从而有效提高堆肥效率[5]。与常温菌相比,嗜热菌具有更高的微生物代谢活性和有机物降解速率,在高温环境下对有机物的生物转化具有重要作用[6]。
由于真菌生长较慢,耐热性较差,代谢较弱等局限性,目前应用于堆肥的微生物菌剂多为细菌[7-8]。微生物群落演替受原材料自然和外部环境的影响[9-11]。目前很多国内学者已从不同来源的有机物料堆肥中,有针对性地分离大量的菌株用于堆肥研究工作,且取得了一定的成果。程旭艳等[12]采用先富集培养再稀释平板法,通过水解试验初筛以及酶活性复筛的方法,从好氧堆肥样品中分离得到一株可在70 ℃条件下生长同时高效降解纤维素、蛋白质和淀粉的耐高温细菌,经初步鉴定确定为属于Geobacillus的菌株,并成功应用于鸡粪堆肥,且有效地促进了堆肥升温,延长了高温期持续时间;阮馨怡等[13]使用LB培养基在55 ℃分离筛选出4株污泥堆肥菌株,经鉴定,这4株菌均为芽孢杆菌属 (Bacillus) ,并作为微生物菌剂应用到污泥堆肥中,明显提高了堆肥效果;陈枭嘉等[14]使用CYS培养基筛选分离7 株可在 70 ℃条件下生长的细菌,鉴定确定其分别属于 Geobacillustoebii、Geobacillus sp.、Methylobacterium sp.和 Thermus thermophilus等4个类别的属种;江高飞等[15]以水稻秸秆粉为唯一碳源,在75 ℃条件下,筛选鉴定出2株菌,分别为短小芽孢杆菌 (Bacillus pumilus) 和嗜热脂肪芽孢杆菌 (Geobacillus stearohermophilus) ,在高温条件下对纤维素和秸秆有较强的降解能力。
尽管以往研究学者使用不同的培养条件筛选出一些有降解作用的高温菌,但仍缺乏系统性的高温菌株筛选。培养组学是一种采用多种培养条件,结合高通量菌种鉴定技术的培养方法[16]。培养组学广泛用于人类肠道微生物组的研究,并通过这种方法分离出大量新的细菌种类和以前未在人类中分离出的其他细菌,极大地促进了人类肠道微生物组的研究[17-18]。
本研究基于培养组学的研究方法,采用多种培养条件分离、筛选、鉴定堆肥过程中的耐高温菌,并通过高通量测序开展了堆肥耐高温菌群的结构分析,可为甄选高效堆肥微生物菌剂提供一定的参考。主要内容是采用多种培养条件,设置了48种培养条件,涵盖了6种培养基,2种氧还原环境 (好氧&厌氧) ,4种高温条件 (50、60、70、80 ℃) ,对不同基质堆肥高温期样品筛选耐高温细菌,并进行分离、纯化、鉴定,测定耐高温菌株对淀粉、蛋白质、纤维素和脂肪等大分子有机物的降解能力,考察嗜热菌株的最高生长温度。结合环境样品总DNA提取和基于16S rRNA的高通量扩增子测序,对4组不同基质堆肥的各个阶段样品进行微生物群落结构分析,探究微生物群落在堆肥不同阶段和不同堆肥方式的变化及相异性,为后期堆肥工作研究提供参考依据。
-
本研究共涉及5个批次的样品采集,采集地点分别为:① 2022年4月30日于广西泰宝生物科技有限公司堆肥厂 (A1) ;② 2022年10月11日~26日于广西贵港巨子种养有限公司堆肥厂 (A2) ;③ 2022年11月2日~15日于广西金苗农业有限公司堆肥厂 (A3) ;④ 2022年10月29日~11月10日于广西桂沃有机肥科技有限公司堆肥厂 (A4) ;⑤ 2022年8月10日于广西邦禾红鹰生态农业科技公司堆肥厂 (仅用于耐高温菌的筛选) 。
采集方法:从堆肥反应堆的5个不同区域 (上部位采集2个不同点,中部位采集1个点,下部位采集2个不同点) 采集等量的样品,人工彻底混合后作为代表性样品 (采集量约为200 g) 。现场采集后放置冰盒低温保存,尽快带回实验室,将收集的样品分成2部分。一部分保存在4 ℃,用于耐高温菌的分离与筛选;另一部分保存在−80 ℃,用于物理化学特性分析和DNA提取[19]。采集样品的基本物化特征如表1所示。
-
本研究共选择6种培养基类型,设置2种氧环境条件,开展耐高温菌的筛选。所采用的培养基如下。
纤维素刚果红培养基:硝酸钠1.0 g 、羟基纤维素钠5.0 g、磷酸氢二钠1.2 g、磷酸二氢钾0.9 g、刚果红0.2 g、硫酸镁0.5 g、氯化钾0.5 g、酵母提取物0.5 g、酸水解酪蛋白0.5 g、pH 7.0,蒸馏水1 000 mL。
R2A培养基:蛋白胨0.5 g、无水硫酸镁0.024 g、酵母提取物0.5 g、酪蛋白水解物0.5 g、丙酮酸钠0.3 g、葡萄糖0.5 g、可溶性淀粉0.5 g、磷酸二氢钾0.3 g、pH 7.0,蒸馏水1 000 mL。
LAMVAB培养基:蛋白胨10 g、醋酸钠5.0 g、牛肉膏10 g、酵母粉5 g、硫酸镁0.1 g、葡萄糖20 g、吐温1.0 g、硫酸锰0.05 g 、磷酸氢二钾2.0 g、柠檬酸三铵2.0 g、pH 7.0,蒸馏水1 000 mL。
强化梭菌培养基:蛋白胨10 g、牛肉膏10 g、酵母粉3.0 g、葡萄糖5.0 g、可溶性淀粉1.0 g、氯化钠5.0 g、醋酸钠3.0 g、pH 7.0,蒸馏水1 000 mL。
牛肉膏蛋白胨培养基:牛肉膏10 g、蛋白胨3.0 g、氯化钠5.0 g、pH 7.0,蒸馏水1 000 mL。
改良亚硫酸盐培养基:蛋白胨10 g、无水亚硫酸钠1.0 g、pH 7.0,蒸馏水1 000 mL。
厌氧环境:在6种培养基的基础上,通过添加去氧剂实现厌氧环境。去氧剂在培养基的浓度为L-半胱氨酸0.5 g·L−1,使用时需配制适量浓度后在无菌环境单独过滤除菌后再添加至培养基。
-
选择5个来源于堆肥高温期的样品,开展耐药高温菌的筛选、分离与纯化实验。
样品预处理按照样品:PBS缓冲液比1∶10 (w∶v) 混合后放置在转速为200 r∙min−1,温度为常温的摇床振荡1 h,静置0.5 h后取上清液放置在4 ℃保存待用。
设置50 、60 、70 、80 ℃四种培养温度,以及好氧和厌氧两种条件。先使用液体培养基,在50 ℃条件下,对预处理样品进行连续3次传代培养,获得耐高温菌的富集样品,并筛选掉50 ℃生长缓慢或不生长的微生物[20]。在50 ℃富集样品的基础上,继续在60 ℃开展连续三代的传代培养,获得60 ℃富集样品,以此类推获得70 ℃和80 ℃的富集样品。初始样品接种量为10%,第二、三传代培养筛菌接种量为5%,每次接种培养2 d。每一种培养基均设置两个平行实验。为避免杂菌污染,整个实验过程需在无菌环境进行。不同高温条件下获得的耐高温菌富集样品,采用稀释涂布平板法,在50 ℃条件下,进行分离与纯化。
-
本研究共获得196株耐高温菌,为明确耐高温菌的物种分类信息,采用菌落PCR的方法对目标菌种的16S rDNA全长进行了扩增。首先,用灭菌的牙签或枪头挑取单一菌落作为PCR模板,正反引物各为1 μL,快速PCR混合液 (2*Rapid Taq Master Mix) 为12.5 μL,补超纯水至25 μL。引物27F为5’-AGAGTTTGATCCTGGCTCAG-3’,1492R为5’-ACGGCTACCTTGTTACGACTT-3’对细菌16S rDNA全长进行扩增。PCR反应程序为95 ℃预热15 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共35个循环,最后引物延伸5 min。取5 μL的PCR产物进行1%琼脂糖凝胶电泳检测,检测合格后,送上海生工进行Sanger双端测序,序列经拼接后,通过NCBI比对,获得耐高温菌的物种分类信息。
将纯化后的耐高温菌,在无菌环境下,与40%的甘油按照体积比1∶1混合于1.5 mL的EP管中,后放在−80 ℃冰箱长期保藏。
-
基于菌种鉴定结果,本研究共筛选到35个种水平的耐高温菌。因此,对应这35个种水平耐高温菌,本研究随机挑选了35个菌株,开展其在高温条件下对有机大分子的降解实验。正式实验之前随机取5个菌种在30、37和50 ℃不同温度下对有机大分子的降解能力测定。研究发现,50 ℃条件测定菌种降解能力略大于37 ℃,远高于30 ℃培养的菌种。有机物降解实验均在50 ℃培养条件下进行。
1) 淀粉水解实验。淀粉水解培养基:蛋白胨20 g、可溶性淀粉20 g、酵母粉10 g、锥虫蓝0.1 g、琼脂15 g,pH 7.0~7.2,蒸馏水1 000 mL,121 ℃,20 min。
先配制淀粉水解培养基,用灭菌的牙签挑取单菌落在在平板上点接,每个平板点接3个点,置于50 ℃培养箱中培养3 d。此淀粉培养基颜色为蓝色,若菌落周围出现透明,表明淀粉已被菌分泌的淀粉酶水解,透明圈的大小和菌落的大小反映该菌降解淀粉能力的强弱,按公式(1)来进行计算。
式中:d为菌落直径 (mm) ,D为透明圈直径 (mm) 。
2) 油脂水解实验。油脂水解培养基:蛋白胨10 g、NaCl 5 g、牛肉膏5 g、油脂10 g、琼脂15 g、1.6%中性红水溶液1 mL,pH 7.2,蒸馏水1 000 mL。
用灭菌的牙签挑取单菌落在平板上进行稀释划线,置于50 ℃培养箱中培养3 d。观察培养基底部,若菌株对脂肪有降解作用就会产生脂肪酸,导致培养基pH偏低,菌株附近培养基会出现红色斑点,为阳性反应,记为“+”,否则为阴性,记为“—”,根据红色斑点数量以及大小判断其对脂肪的降解能力大小[21]。
3) 蛋白质水解实验。明胶-琼脂培养基:NaCl 0.3 g、K2HPO4 0.3 g、MgSO4·7H2O 0.3 g、明胶10.0 g、琼脂15.0 g,pH 7.0,蒸馏水1 000 mL,115 ℃灭菌20 min。
酸性汞试剂:HgCl2 15 g,36%的盐酸20 mL,蒸馏水100 mL。
用灭菌的牙签挑取单菌落在在平板上点接,每个平板点接3个点,置于50 ℃培养3 d后取出。在菌落周围滴加酸性汞试剂,若出现透明圈则说明该菌具有蛋白酶,可水解明胶,同样按公式(1)来进行计算。
4) 纤维素水解实验。纤维素水解培养基:羧基纤维素钠10 g、蛋白胨1 g、氯化铵0.1 g、磷酸氢二钾0.7 g、磷酸二氢钾0.3 g、氯化钠0.1 g、七水硫酸亚铁0.01 g、七水硫酸镁0.5 g、琼脂15 g、蒸馏水1 000 mL,pH 7.0,121 ℃灭菌20 min[21]。
将待测菌株点接在纤维素水解培养基上,50 ℃培养3 d。在平板上滴加1~2 mL刚果红溶液,10 min后用蒸馏水小心冲洗培养皿上的刚果红溶液,若出现透明圈或者淡黄色圈,则为纤维素分解菌。圈的大小可反映纤维素水解能力的大小。同样按公式(1)来进行计算。
-
本研究共收集14个样品,来源于前4批不同的堆肥厂 (第5批堆肥样品未开展群落分析) ,开展微生物群落结构分析;参考地球微生物组计划,选择引物515F/806R[22]。取0.5 g样品,采用Fast DNA Spin Kit for Soil 试剂盒 (MP Bio,USA) ,按照说明书,提取堆肥样品总DNA,并通过NanoDrop测定DNA的质量和浓度。DNA样品经检测合格后,送至基迪奥生物科技有限公司在Illumina MiSeq PE250平台上进行扩增、建库和测序。
测序得到raw reads之后,首先用FASTP软件[23]对低质量reads进行过滤,然后采用FLASH软件[24]将双端reads拼接为tag,再对tag进行过滤,得到的数据称为Clean tag。接下来用USEARCH软件[25]的UPARSE算法基于Clean tag进行聚类,用USEARCH软件的UCHIME算法去除聚类比对过程中检测到的嵌合体tag,最终得到的数据为Effective tag。获得OTU后,基于Effective tag进行OTU丰度统计。根据分析流程,在RDP 数据库对比序列进行物种注释,使用扩增子分析软件Qiime进行α多样性分析和β多样性分析,使用PICRUSt2软件[26]在KEGG数据库进行群落功能预测等。
-
本研究共筛选并鉴定了196株耐高温细菌,覆盖4个门,14个属 (图1(c)) ,35个种 (图1(d)) 。在门水平上,主要为厚壁菌门 (Firmicutes) 、变形菌门 (Proteobacteria) 、栖热菌门 (Deinococcus-Thermus) 和放线菌门 (Actinobacteria) ,其中厚壁菌门占比98.0%,放线菌门2株,栖热菌门和放线菌门各1株 (图1(a)) 。这表明,堆肥中可培养的耐高温菌多为厚壁菌门;在属水平上,共有芽孢杆菌属101株,占总菌株数的51.5% (图1(b)) 。据报道,芽孢杆菌属对有机物质分解能力强,能产生丰富的代谢物质,还有抑菌、除臭等作用[27];其次是硫胺素芽孢杆菌属 (Aneurinibacillus) ,菌株数量为34株,占比17.3%。硫胺素芽孢杆菌属能还原硝酸盐,分解硫胺素、酪朊、明胶和吐温80等[28];魏茨曼氏菌属 (Weizmannia) 和土芽孢杆菌属 (Geobacillus) ,菌株数量分别为23和14株,占比17.3%和11.7%。魏茨曼氏菌属[29]可作为一种益生菌,调节脂质代谢、抗氧化应激和保护内皮细胞损伤来改善动脉粥样硬化;土芽孢杆菌属[30]在分解代谢方面具有多功能性,是许多耐热酶的来源,还可以用作生物转化和生物修复等过程中的全细胞催化剂。
在196株嗜热细菌中,地衣芽孢杆菌 (Bacillus licheniformis) 的菌株数量为56株,占比28.6%,为所有菌种中占比最大 (图1(d)) 。地衣芽孢杆菌具有较强的蛋白酶、脂肪酶和淀粉酶活性,能使有机物质快速分解,促进堆肥腐殖化[31];其次是嗜热嗜气解硫胺杆菌 (Aneurinibacillus thermoaerophilus) ,菌株数量为30株,占比15.3%,其能分解硫胺素,还原硝酸盐[28];凝结芽孢杆菌 (Weizmannia coagulans) 和枯草芽孢杆菌 (Bacillus subtilis) 也占有一定比例,菌株数量分别为23和15株。凝结芽孢杆菌能分解糖类物质,在厌氧条件下能产生蛋白酶;而枯草芽孢杆菌自身合成淀粉酶、蛋白酶、脂肪酶、纤维素酶等酶类,其中纤维素酶活性较强[32]。
-
使用SPSS统计学显著性检验分析,p<0.05,不同菌株之间的降解能力有显著性差异。根据透明圈D2/d2的大小划分降解强度为4个等级,分别为:强 (D2/d2>9) 、中 (9>D2/d2>4) 、弱 (4>D2/d2>1) 和无 (D2/d2=0) 降解脂肪强度根据红色斑点数量以及大小判断其对脂肪的降解能力大小,同样划分为4个等级。本研究中筛选了35株耐热细菌,Aeribacillus pallidus、Agrobacterium tumefaciens、Ammoniibacillus agariperforans、Bacillus pervagus、Bacillus tequilensis、Geobacillus thermoglucosidasius、Geobacillus pallidus、Geobacillus thermodenitrificans等8株未表现出对任一大分子有机物的强降解作用,表2展示了27株耐高温菌在高温条件下 (50 ℃) 对大分子有机物的降解能力,6株对3种以上有机大分子具有强降解作用,分别为嗜热嗜气解硫胺杆菌 (Aneurinibacillus thermoaerophilus) 、解淀粉芽孢杆菌 (Bacillus amyloliquefaciens) 、宫本寿芽孢杆菌 (Bacillus hisashii) 、地衣芽孢杆菌 (Bacillus licheniformis) 、枯草芽孢杆菌 (Bacillus subtilis) 和巨孢链霉菌 (Streptomyces megasporus) 。
针对单一有机大分子,对淀粉降解能力最强的耐高温菌为Bacillus thermoamylovorans (D2/d2=26.26,图2(a)) >Aneurinibacillus thermoaerophilus (D2/d2=8.15) >Bacillus licheniformis (D2/d2=6.76) >Weizmannia coagulans (D2/d2=5.14) 。蛋白质:Brevibacillus borstelensis (图2(b)) >Bacillus subtilis>Streptomyces thermovulgaris >Aneurinibacillus thermoaerophilus,它们的D2/d2为 112.3>76.78>60.21>42.63。纤维素:Bacillus subtilis (图2(c)) >Paenibacillus cineris>Bacillus thermoamylovorans> Bacillus amyloliquefaciens,它们的D2/d2 =为38.16>34.16>29.91>18.25。脂肪酸:Geobacillus thermocatenulatus、Bacillus subtilis、Aneurinibacillus thermoaerophilus和Bacillus hisashii (图2(d)) 对脂肪的降解能力最强。同以往研究相比,韩波波等[21]筛选的耐高温菌中降解淀粉、蛋白质、纤维素最大D2/d2分别为18.78、3.21、3.62,而本研究中的最大值分别为26.26、112.3、38.16,远高于其结果,有可能是由于其降解实验在37 ℃进行,未体现耐高温菌的嗜热特性。WANG等[33]在猪粪堆肥中筛选筛选降解淀粉菌中最大D2/d2为4.08,降解蛋白质菌中最大D2/d2为12.17,降解纤维素菌中最大D2/d2为3.66,鉴定它们分别为地衣芽孢杆菌、短芽孢杆菌和Kitasatospora phosalacine,它们降解大分子有机物能力与本研究筛选菌株相比弱了很多,这同其在常温下筛选降解菌株有关,嗜热耐高温菌在高温条件下表现出了更强的大分子有机物降解特征。刘国防[34]根据透明圈法,测晕圈大小和晕圈透明程度判断降解脂肪酸能力大小,筛选得到2株高效降解脂肪酸菌株,鉴定其为地衣芽孢杆菌 (Bacillus licheniformis) 和解淀粉芽孢杆菌 (Bacillus amyloliquefaciens) 。但本实验筛选得到的地衣芽孢杆菌和解淀粉芽孢杆菌并未表现对脂肪酸有降解效果,这也有可能是本实验筛到的菌株对其他有机物降解较强,降解脂肪能力反而变弱了,这也可能是没有经过脂肪酸富集培养驯化有关。
-
本研究中微生物群落多样性和丰富度表现出高温期降低,腐熟期增加的特征,且覆膜堆肥进一步增加了多样性和丰富度指数,而堆肥物料、堆肥方式、周期的不同亦会导致微生物群落多样性在不同阶段有不同的变化规律 (表3) 。如在A1组中α多样性指数在高温期减少,在腐熟期增加,其丰富度指数表现出相同特征;在A2组中,α多样性在高温期下降,在腐熟期增加,且腐熟期的α多样性比堆肥初期还要高,与此同时,其丰富度指数随堆肥过程不断增加;在A3组中,细菌的α多样性在高温期下降后又上升,在腐熟期下降,其丰富度指数随堆肥的进程在不断下降;在第A4组,覆膜堆肥中,在高温期α多样性增加,在腐熟期降低,其丰富度指数变化规律同α多样性一致。对比表1,堆肥从初期很快达到高温期的最高温度。此时细菌的α多样性指数在高温阶段是最高,在高温持续过程中,细菌的α多样性指数在不断下降。
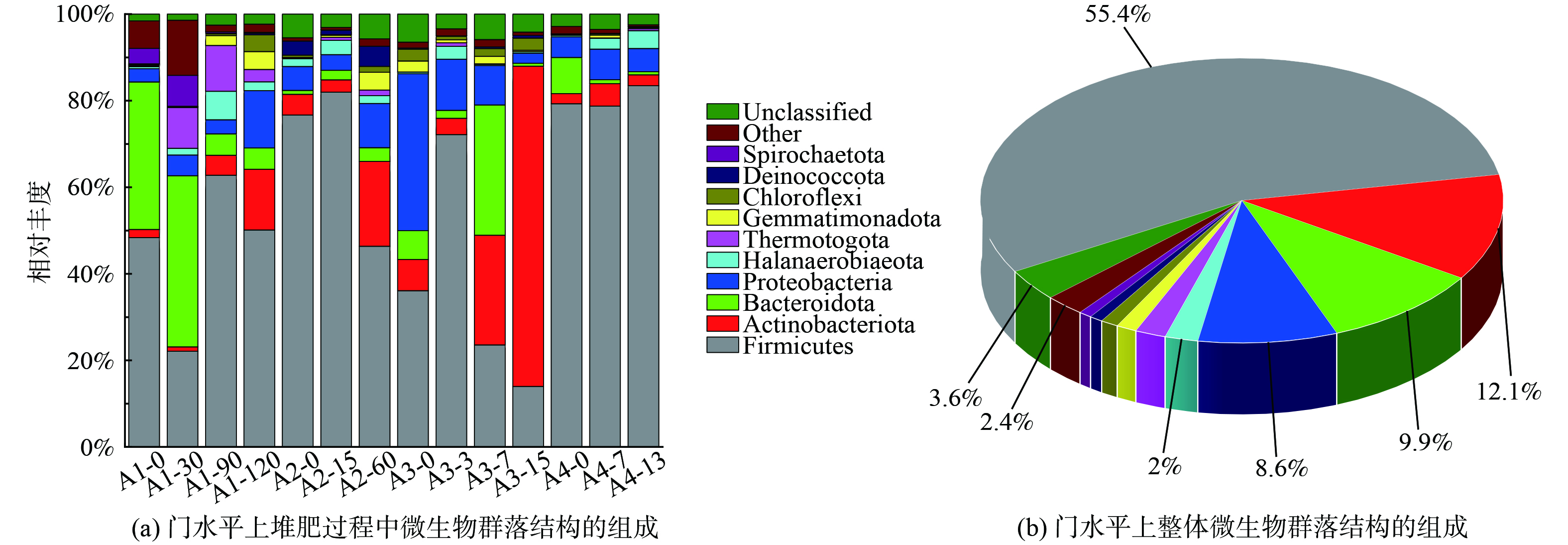
厚壁菌门、放线菌门和拟杆菌门是堆肥过程中的主要微生物 (图3(b)) ,与堆肥中细菌微生物群落结构得到的结果相同[35]。对堆肥过程中微生物群落结构在门水平的组成进行分析 (图3(a)) ,A1-30、A2-15、A3-7和A4-7均为堆肥过程中的高温期样品,温度分别达到了63.7、65.2。A1-30中厚壁菌门、放线菌门和拟杆菌门分别占比22.1%、1.0%、39.5%;A2-15中厚壁菌门、放线菌门和拟杆菌门分别占比82%、2.8%、2.2%;A3-7中厚壁菌门、放线菌门和拟杆菌门分别占比14%、74%、0.7%;A4-7中厚壁菌门、放线菌门和拟杆菌门分别占比77.8%、5.2%、0.9%。从高温期到腐熟期还是处于高温持续阶段,发现高温持续阶段,除了A4组之外,放线菌门的相对丰度是增加的;在A4组中放线菌门从高温期到腐熟期的相对丰度在下降,这可能是A4组的高温阶段处于较高平均温度为75 ℃;而拟杆菌门在高温持续阶段的相对丰度在下降,可能高温环境对拟杆菌门的生长繁殖有较大影响。在筛选高温菌实验得到的菌株多为厚壁菌门。在A1-30样品中,优势菌门为厚壁菌门和拟杆菌门,但在筛菌实验中,并未筛选到拟杆菌门。这可能是在50 ℃筛菌中拟杆菌门与其他菌门相比,生长繁殖速度并不占优势,在更高温度下的耐受性较差;在A3-7样品中,优势菌门为厚壁菌门和放线菌门,在筛菌实验仅仅筛选到厚壁菌门。
在不同原料堆肥不同阶段 (图4(a)) ,A1组中,堆肥初期A1-0和高温期A1-30的最优势菌属为嗜蛋白菌属 (Proteiniphilum) ,可能是蛋白质含量较高,嗜蛋白菌属细菌有较强蛋白质酶活性,易分解利用蛋白质类物质[36]。在腐熟期A1-90的最优势菌属转变为芽孢杆菌属,芽孢杆菌属细菌对有机物质具有分解作用,产生更多的代谢产物[37];在A2组中,堆肥初期A2-0优势菌属为热杆菌属 (Caldicoprobacter) ,具有分解木质素和纤维素作用[38]。在高温期A2-15和腐熟期A2-60转变为Limnochorda,其被认为是潜在的抗生素降解菌[39]。可能对类似抗生素结构物质有分解作用;在A3组中,堆肥初期A3-0和高温期A3-7优势菌属为芽孢杆菌属,具有对有机质进行快速分解并升温作用。在腐熟期A3-15转变为热多孢菌属 (Themopolyspora) ,能合成木聚糖酶,在高温对木聚糖有较强的降解效果[40];在A4组中,堆肥初期A4-0的优势菌属为Savagea,其能利用几十种碳水化合物为自身提供能量且产生其他代谢产物,对菊粉酶、果胶酶和木聚糖酶也有较弱的分解效果[41]。在高温期A4-7优势菌属为热杆菌属,在腐熟期A4-13转变为芽孢杆菌属和Savagea。
在堆肥过程中的优势耐高温菌中芽孢杆菌属、Savagea、热杆菌属 (Caldibacillus) 、Limnochorda和嗜蛋白菌属 (Proteiniphilum) 的占比较大,对堆肥的温度上升、有机物降解以及腐殖质的形成起着很大作用。同时4个堆肥组之间的高温期和腐熟期的优势菌株不完全一样,可能是由于堆肥基质、堆肥周期和方式不同。A1组高温期A1-30样品中的优势菌属主要有芽孢杆菌属、嗜蛋白菌属、盐胞菌属 (Halocella) 、Defluviitoga、Lactobacillus和热杆菌属,在分离得到的高温菌中仅有芽孢杆菌属、热杆菌属和其他劣势菌属;A2组高温期A2-15样品中的优势菌属主要有芽孢杆菌属、嗜蛋白菌属、盐胞菌属、Limnochorda、Lactobacillus、Defluviitoga和热杆菌属,比1组多了Limnochorda,仅有分离得到芽孢杆菌属和其他劣势菌属;A3组高温期A3-7样品中的优势菌属主要有芽孢杆菌属、Savagea、Limnochorda、栖热菌属,同样仅有分离得到芽孢杆菌属和其他劣势菌属;A4组高温期A4-7样品中的优势菌属主要有芽孢杆菌属、热杆菌属、Defluviitoga和热杆菌属,同样仅有分离得到芽孢杆菌属和其他劣势菌属。本研究即便结合培养组学的方法,以目前传统的分离高温手段,对于优势菌属仅能分离得到芽孢杆菌属和热杆菌属。本研究筛选得到的4个门,14个属均在群落中检测到。对于Savagea属、Limnochorda属、嗜蛋白菌属、盐胞菌属、Defluviitoga属和Lactobacillus属等6个优势菌属尚未分离得到。这说明堆肥过程中仍有很多耐高温/嗜热细菌资源有待筛选和挖掘,需要设置更多样化的培养条件。
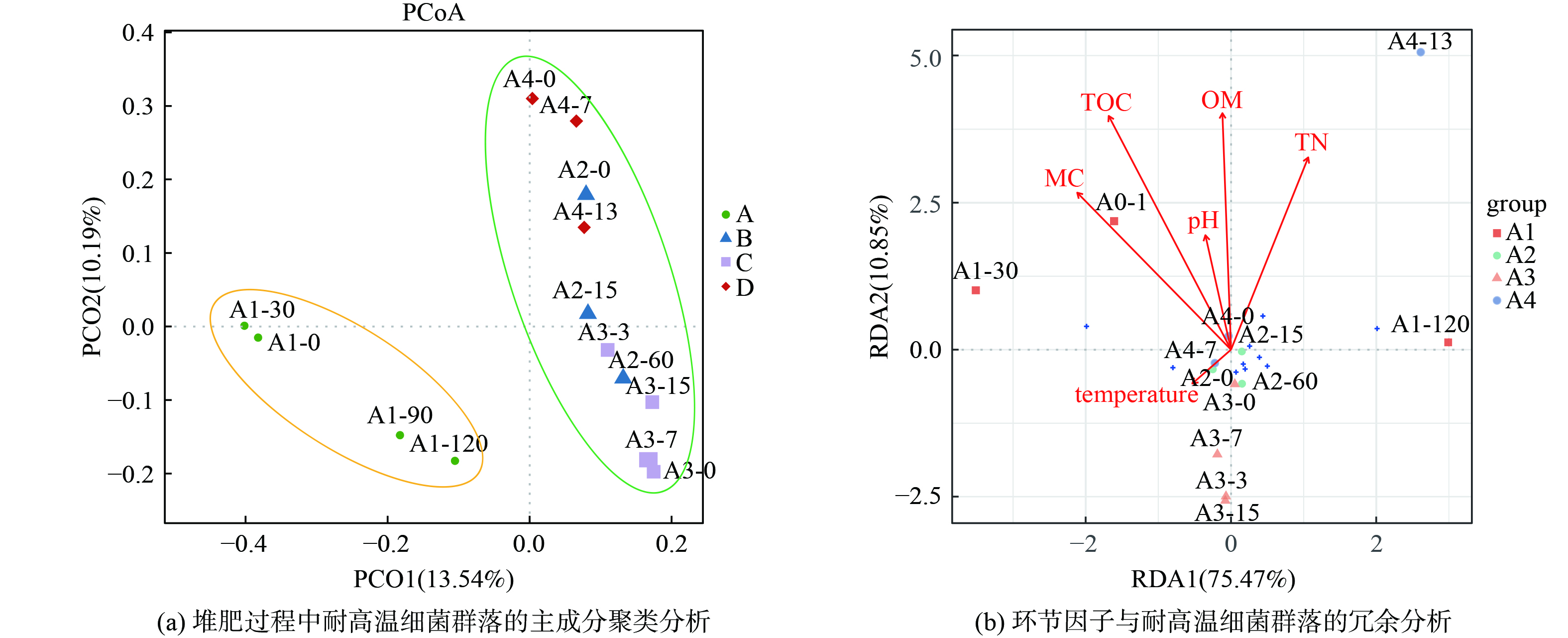
堆肥环境因素对耐高温菌群的变化具有显著影响。相关性分析表明 (图4(b)) ,Savagea、Bacteroides、Anaerosalibacter bizertensis、Atopostipes等与TN (总氮) 、TOC (有机碳) 、OM (有机质) 、MC (含水率) 呈显著正相关 (p<0.05) ;Erysipelothrix与OM呈正相关;Limnochorda、 Longispora与MC呈强负相关 (p<0.01) ,Sphaerobacter与MC呈负相关 (p<0.05) ;温度与微生物并未呈现出显著相关性 (p>0.05) ,这可能是由于不同堆肥原料和堆肥方式所致,而非单个堆肥的连续化实验变化。
采用主成分聚类分析 (Principal component analysis,PCoA) 对堆肥中耐高温微生物群落进行了样本件的相似性或差异性解析 (图5(a)) ,A1组耐高温微生物群落显著区别于其它组。A1组的堆肥基质复杂,且堆肥周期更长,已进入后腐熟期,而其它组在采样阶段一直处于高温期。在A1组中,第0 d和第30 d样品组成差异性较小,这可能是在第30 d的时候才刚刚到达高温期,微生物群落结构还尚未发生较大改变,到第90 d的时候,30 d和90 d样品之间的差异很大,到了120 d样品属于成品了,可是含水率变得更低,微生物群落发生明显变化。其它组的堆肥周期较短,但每个堆肥阶段的样品差异仍然存在尤其是在堆肥初期和高温期之间。这说明不同的堆肥原料和堆肥周期是导致样品距离的主要因素,其次是堆肥的各个阶段进一步促进样品之间的差异性。冗余分析结果表明 (图5(b)) ,MC、TOC、OM对耐高温菌群结构影响较大,pH和温度的影响相对较小,这与相关性分析结果一致。
-
使用PICRUSt群落功能预方法对堆肥耐高温菌群进行代谢通路分析 (图6) 。高温期谢功能丰度约为14.0%,氨基酸代谢丰度约为14.2%,辅助因子和维生素的代谢丰度约为13.1%,萜类和多酮类的代谢丰度约为9.2%,其他氨基酸的代谢丰度约为8.2%,脂肪代谢丰度约为7.5%,DNA复制和修复约为5.1%,能量代谢约为5.4%,异种生物降解和代谢丰度约为3.2%,其他功能途径如聚糖的生物合成和代谢、次生代谢物的生物合成、核苷酸代谢、转录翻译、跨膜分泌等等功能丰度相对较小。在糖代谢中C5支链二元酸代谢、戊糖磷酸途径、丙酮酸代谢途径、柠檬酸循环、糖酵解/糖异生、丁酸甲酯代谢、氨基糖和核苷酸糖的代谢等占比较大。在堆肥高温期的微生物功能中,抗霉素的生物合成功能丰度是其他功能的3倍以上。抗霉素具有杀虫和抗真菌作用[42],在堆肥过程中真菌的丰度和多样性远不如细菌[8],可能是受到抗霉素这类物质的影响。在有机大分子的降解实验中,筛选的菌株对淀粉、纤维素、蛋白质的降解在菌株数量上比降解脂肪的菌株多一些。
-
本研究通过培养组学和高通量测序的方法对堆肥过程中耐高温微生物群落结构进行了较为系统的分析,主要结论如下。
1) 从堆肥高温期样品中共筛选了196株耐高温细菌,包含4门、14属、35种,并以地衣芽孢杆菌 (56株) 、嗜热嗜气解硫胺杆菌 (30株) 、凝结芽孢杆菌 (23株) 和枯草芽孢杆菌 (15株) 为主。
2) 在高温条件下的大分子有机物降解实验表明, Bacillus thermoamylovorans、Brevibacillus borstelensis、Bacillus subtilis和Geobacillus thermocatenulatus分别对淀粉、蛋白质、纤维素、脂肪降解作用最强。
3) 细菌群落结构分析表明,堆肥过程中的主要耐高温菌为芽孢杆菌属、Savagea、热杆菌属、Limnochorda和嗜蛋白菌属等。这表明堆肥中仍然存在大量本研究未培养得到的耐高温/嗜热细菌。
4) 基于PICRUSt2的功能预测结果表明,堆肥过程高温阶段以糖代谢、氨基酸代谢及辅助因子和维生素相关代谢为主,相对丰度分别为14.0%、14.2%和13.1%。
堆肥过程中耐高温菌群的分离鉴定与群落结构分析
Isolation, identification, and community structure analysis of thermophilic bacteria during composting
-
摘要: 高温菌剂能够缩短堆肥周期,提高堆肥品质,是一种常见的堆肥技术提升手段。通过结合培养组学研究方法,设置48种培养条件,包含6种培养基、2种氧环境 (好氧&厌氧) 和4种高温情境 (50、60、70、80 ℃) ,从堆肥高温期样品中分离纯化获得196株耐高温菌株。基于16S rRNA生物学分类方法,共鉴定出4个门14个属35个种,其中厚壁菌门 (98%) 、芽孢杆菌属 (51.5%) 、地衣芽孢杆菌 (28.6%) 分别为在门、属、种水平上的优势菌,也包含一些嗜热菌属如热杆菌属 (Caldibacillus) 、栖热菌属 (Thermus) 等。有27株耐高温菌表现出了嗜热特性,在高温条件下对至少一种大分子 (淀粉、纤维素、蛋白质、脂肪酸) 有更强的降解作用,且有6株嗜热菌同时表现出对这4种大分子有机物的强降解作用。通过16s rRNA扩增子测序对比分析了不同来源高温堆肥样品中耐高温菌群结构。结果表明,厚壁菌门、放线菌门和拟杆菌门为优势菌门,而芽孢杆菌属、Savagea、热杆菌属、Limnochorda和嗜蛋白菌属为优势耐高温菌属,堆肥过程中仍有很多耐高温/嗜热细菌资源有待筛选和挖掘,需要设置更多样化的培养条件;基于PICRUSt2的耐高温菌群功能预测结果表明,高温阶段糖代谢、氨基酸代谢及辅助因子和维生素相关代谢为主要代谢途径。Abstract: The addition of thermotolerant bacterial agents is a common technique to accelerate the composting process and improve compost quality. Combined with the culture omics research method with 48 culture conditions, including 6 culture media, 2 oxygen environmental conditions (aerobic & anaerobic) and 4 high temperature scenarios (50, 60, 70, and 80 °C), 196 thermotolerant strains were isolated and purified from the thermophilic stage of composting. A total of 35 species belonging to 14 genera from 4 phyla of thermotolerant bacteria were identified. Among them, the phylum Firmicutes (98%), the genus Bacillus (51.5%) and Bacillus licheniformis (28.6%) were predominant at the phylum, genus, and species levels, respectively. Additionally, some thermotolerant genera such as Caldibacillus and Thermus were also identified. Among the isolated strains, 27 exhibited thermophilic characteristics and showed enhanced degradation capabilities for at least one of the macromolecules (starch, cellulose, protein, and fatty acids) under high-temperature conditions, with 6 thermophilic strains simultaneously demonstrating strong degradation capabilities for all four macromolecular organic compounds. Furthermore, a comparative analysis of the thermotolerant bacterial community structures in high-temperature compost samples from different sources was conducted through 16S rRNA amplicon sequencing. The results revealed that the phyla Firmicutes, Actinobacteria, and Bacteroidetes were dominant, while the genera Bacillus, Savagea, Caldibacillus, Limnochorda, and Proteocatella were the predominant thermotolerant genera. The study highlighted the need for further screening and exploration of thermotolerant/thermophilic bacterial resources in composting, with a requirement for the establishment of more diversified cultivation conditions. Moreover, functional predictions of the thermotolerant bacterial community using PICRUSt2 indicated that sugar metabolism, amino acid metabolism, and cofactor and vitamin-related metabolism were the predominant metabolic pathways during the high-temperature composting phase.
-

-
表 1 堆肥样品的物化参数特征
Table 1. Characteristics of the samples from the composting
样品 堆肥时间 样品
编号堆体温度/ ℃ pH 含水率/% 有机质含量/% C元素
含量/%N元素
含量/%第一批 (CMC1)
(槽式堆肥,鸡粪∶鸭粪∶蘑菇渣∶滤泥=3∶3∶3∶2)堆肥前 (0 d) A1-0 28.8 8.55 42.74 41.58 24.41 1.34 高温期 (30 d) A1-30 63.7 7.78 59.83 47.76 27.39 1.14 腐熟期 (90 d) A1-90 60.0 7.88 48.09 36.29 21.33 0.88 成品 (120 d) A1-120 37.0 7.76 36.17 34.55 17.29 1.18 第二批 (CMC2)
(条垛堆肥,鸡粪∶甘蔗渣=6∶4)堆肥前 (0 d) A2-0 33.2 8.53 59.60 39.89 20.08 1.12 高温期 (15 d) A2-15 65.2 8.48 32.85 27.92 16.62 0.78 腐熟期 (60 d) A2-60 56.8 8.43 30.41 23.93 19.36 1.66 第三批 (CMC3)
(槽式堆肥,鸡粪∶鸭粪∶滤泥∶甘蔗渣=1∶1∶1∶7)堆肥前 (0 d) A3-1 40.8 7.64 42.43 35.59 19.77 0.96 中高期 (3 d) A3-3 54.3 8.06 45.52 33.56 18.46 1.10 高温期 (7 d) A3-7 60.8 7.82 40.09 38.09 20.35 1.04 腐熟期 (15 d) A3-15 58.6 7.72 28.15 32.12 18.26 1.08 第四批 (CMC4)
(覆膜堆肥,鸡粪∶谷糠=7∶3)堆肥前 (0 d) A4-0 48.0 7.75 56.13 65.66 31.70 2.08 高温期 (7 d) A4-7 75.0 7.56 53.01 59.34 28.74 1.33 腐熟期 (13 d) A4-13 62.0 8.11 49.59 59.00 26.95 1.67 第五批 (条垛堆肥) 高温期 (60 d) A5-60 56.6 8.23 50.12 48.96 28.39 0.82 注:CMC是鸡粪堆肥 (chicken manure compost) 英文缩写;第五批堆肥原料为烟粉∶甘蔗渣∶滤泥∶草木灰=2∶2∶1∶1。 表 2 堆肥中可培养耐高温菌对典型大分子有机物的降解特征*
Table 2. Degradation characteristics of Cultivable thermotolerant bacteria in compost towards typical macromolecular organic compounds*
序号 菌种 淀粉降解
强度/(D2/d2)蛋白质降解
强度/(D2/d2)纤维素降解
强度/(D2/d2)脂肪降解
强度/(+/−)1 Aneurinibacillus aneurinilyticus 弱(3.14) 无(0) 无(0) 无(−) 2 Aneurinibacillus thermoaerophilus 中(5.64) 强(39.49) 无(0) 强(+++) 3 Bacillus aerius 无(0) 强(10.89) 弱(1.85) 无(−) 4 Bacillus amyloliquefaciens 弱(2.02) 强(14.44) 强(18.25) 无(−) 5 Bacillus cereus 无(0) 强(32.08) 无(0) 中(++) 6 Bacillus hisashii 中(4.72) 中(7.09) 无(0) 中(++) 7 Bacillus licheniformis 中(4.17) 强(23.01) 强(11.54) 无(−) 8 Bacillus paralicheniformis 弱(2.29) 无(0) 无(0) 无(−) 9 Bacillus smithii 弱(1.8) 无(0) 强(9.56) 无(−) 10 Bacillus subtilis 弱(5.41) 强(36.12) 强(38.16) 无(−) 11 Bacillus thermoamylovorans 强(26.26) 无(0) 强(29.91) 无(−) 12 Bacillus velezensis 弱(2.09) 无(0) 无(0) 无(−) 13 Brevibacillus borstelensis 弱(2.42) 强(112.2) 无(0) 无(−) 14 Brevibacillus parabrevis 弱(1.89) 无(0) 无(0) 无(−) 15 Caldibacillus thermoamylovorans 弱(2.95) 中(8.94) 无(0) 中(++) 16 Geobacillus kaustophilus 弱(2.35) 强(31.26) 无(0) 无(−) 17 Geobacillus proteiniphilus 弱(2.75) 无(0) 无(0) 无(−) 18 Geobacillus stearothermophilus 弱(2.92) 无(0) 无(0) 无(−) 19 Geobacillus thermocatenulatus 弱(2.97) 无(0) 无(0) 强(+++) 20 Geobacillus thermoleovorans 中(19.38) 无(0) 无(0) 中(++) 21 Paenibacillus cineris 弱(3.45) 无(0) 强(34.71) 无(−) 22 Paenibacillus cisolokensis 弱(1.81) 无(0) 无(0) 弱(+) 23 Parageobacillus thermoglucosidasius 中(5.27) 无(0) 无(0) 无(−) 24 Streptomyces megasporus 弱(1.42) 强(24.12) 弱(3.35) 无(−) 25 Streptomyces thermovulgaris 无(0) 强(60.21) 无(0) 无(−) 26 Thermus scotoductus 弱(2.67) 强(42.49) 无(0) 无(−) 27 Weizmannia coagulans 中(5.82) 无(0) 无(0) 无(−) 表 3 堆肥过程中微生物群落的α多样性指数表
Table 3. The occurrence of α diversity of microbial community during composting
样品编号 Shannon Simpson Chao Coverage A1-0 7.01 0.970 2 020.1 0.997 A1-30 6.38 0.953 1 773.5 0.997 A1-90 5.73 0.905 1 599.9 0.996 A1-120 6.72 0.965 1 664.6 0.996 A2-0 6.86 0.942 1 286.3 0.991 A2-15 5.80 0.866 1 402.0 0.993 A2-60 7.46 0.974 2 130.2 0.994 A3-0 7.49 0.958 1 897.0 0.992 A3-3 6.62 0.947 1 735.1 0.996 A3-7 7.10 0.966 1 449.8 0.992 A3-15 5.90 0.928 1 215.6 0.995 A4-0 6.20 0.888 1 889.7 0.996 A4-7 7.52 0.976 2 234.3 0.995 A4-13 5.58 0.886 1 370.8 0.996 -
[1] CHIA W Y, CHEW K W, LE C F, et al. Sustainable utilization of biowaste compost for renewable energy and soil amendments[J]. Environmental Pollution, 2020, 267: 115662. doi: 10.1016/j.envpol.2020.115662 [2] 程艳, 刘永德, 赵继红, 等. 污泥堆肥中高温菌的研究进展[J]. 中国资源综合利用, 2014(2): 31-32. doi: 10.3969/j.issn.1008-9500.2014.02.015 [3] PATRA R K, BEHERA D, MOHAPATRA K K, et al. Juxtaposing the quality of compost and vermicompost produced from organic wastes amended with cow dung[J]. Environmental Research, 2022, 214: 114119. doi: 10.1016/j.envres.2022.114119 [4] SANCHEZ Q J, OSPINA DA M S. Compost supplementation with nutrients and microorganisms in composting process[J]. Waste Management, 2017, 69: 136-153. doi: 10.1016/j.wasman.2017.08.012 [5] MENG X, LIU B, ZHANG H, et al. Co-composting of the biogas residues and spent mushroom substrate: Physicochemical properties and maturity assessment[J]. Bioresource Technology, 2019, 276: 281-287. doi: 10.1016/j.biortech.2018.12.097 [6] XIAO Y, ZENG G M, YANG Z H, et al. Continuous thermophilic composting (CTC) for rapid biodegradation and maturation of organic municipal solid waste[J]. Bioresource Technology, 2009, 100: 4807-4813. doi: 10.1016/j.biortech.2009.05.013 [7] LIM S L, WU T Y. Characterization of matured vermicompost derived from valorization of palm oil mill byproduct[J]. Journal of Agricultural and Food Chemistry, 2016, 64(8): 1761-1769. doi: 10.1021/acs.jafc.6b00531 [8] XIE G, KONG X, KANG J, et al. Fungal community succession contributes to product maturity during the co-composting of chicken manure and crop residues[J]. Bioresource Technology, 2020, 27(9): 9658-9668. [9] BAKER G C, SMITH J J, COWAN D A. Review and re-analysis of domain-specific 16S primers[J]. Journal of Microbiological Methods, 2004, 55(3): 541-555. [10] YANG W, ZHANG L. Addition of mature compost improves the composting of green waste[J]. Bioresource Technology, 2020, 105: 190-197. [11] WU X, SUN Y, DENG L, et al. Insight to key diazotrophic community during composting of dairy manure with biochar and its role in nitrogen transformation[J]. Waste Management, 2022, 350: 126927. [12] 程旭艳, 霍培书, 尚晓瑛, 等. 堆肥中高温降解菌的筛选、鉴定及堆肥效果[J]. 中国农业大学学报, 2012, 17(5): 105-111. doi: 10.11841/j.issn.1007-4333.2012.05.017 [13] 阮馨怡, 刘曦, 关玥, 等. 高效污泥降解菌种的筛选及在污泥堆肥中的效果[J]. 浙江农业学报, 2018, 30(9): 1569-1575. doi: 10.3969/j.issn.1004-1524.2018.09.18 [14] 陈枭嘉, 李立, 马新新, 等. 豆渣降解高温菌的筛选及应用[J]. 河南农业科学, 2021, 50(1): 172-179. [15] 江高飞, 暴彦灼, 杨天杰, 等. 高温秸秆降解菌的筛选及其纤维素酶活性研究[J]. 农业环境科学学报, 2020, 39(10): 2465-2472. doi: 10.11654/jaes.2020-0958 [16] 邱菲, 韩依辛, 魏琦麟, 等. 培养组学在动物肠道微生物应用的研究进展[J]. 中国畜牧兽医, 2023, 50(2): 598-605. [17] MATAR G, BILEN M. Culturomics, a potential approach paving the way toward bacteriotherapy[J]. Current Opinion in Microbiology, 2022, 69: 102194. doi: 10.1016/j.mib.2022.102194 [18] LAGIER J C, DUBOURG G, MILLION M, et al. Culturing the human microbiota and culturomics[J]. Nature Reviews Microbiology, 2018, 16: 540-550. doi: 10.1038/s41579-018-0041-0 [19] WANG S P, SUN Z Y, WANG S T, et al. Bacterial community structure and metabolic function succession during the composting of distilled grain waste[J]. Applied Biochemistry and Biotechnology, 2022, 194(4): 1479-1495. doi: 10.1007/s12010-021-03731-5 [20] 林燕, 阮馨怡, 张伟, 等. 一种利用普通生化设备分离纯化高温菌株的方法: CN109517754A[P]. 2019-03-26. [21] 韩波波. 高温菌的分离纯化及性质研究[D]. 上海: 华东师范大学, 2008. [22] THOMPSON L R, SANDERS J G, MCDONALD D, et al. A communal catalogue reveals Earth’s multiscale microbial diversity[J]. Nature, 2017, 551: 457-463. doi: 10.1038/nature24621 [23] BOKULICH N A, SUBRAMANIAN S, FAITH J J, et al. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing[J]. Nature Methods, 2013, 10(1): 57-59. doi: 10.1038/nmeth.2276 [24] MAGOČ T, SALZBERG S L. FLASH: Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963. doi: 10.1093/bioinformatics/btr507 [25] EDGAR R C. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19): 2460-2461. doi: 10.1093/bioinformatics/btq461 [26] LÖYTYNOJA A, VILELLA A J, GOLDMAN N. Accurate extension of multiple sequence alignments using a phylogeny-aware graph algorithm[J]. Bioinformatics, 2012, 28(13): 1684-1691. doi: 10.1093/bioinformatics/bts198 [27] MPOFU E, VEJARANO F, SUZUKI-MINAKUCHI C, et al. Complete genome sequence of Bacillus licheniformis TAB7, a compost-deodorizing strain with potential for plant growth promotion[J]. Microbiology Resource Announcements, 2019, 8(4): 11-18. [28] MUSILOVA J, KOURILOVA X, PERNICOVA I, et al. Novel thermophilic polyhydroxyalkanoates producing strain Aneurinibacillus thermoaerophilus CCM 8960[J]. Applied Microbiology and Biotechnology, 2022, 106(12): 4669-4681. doi: 10.1007/s00253-022-12039-1 [29] MA L, ZHAO Z, ZHAO Y, et al. Weizmannia coagulans JA845 improves atherosclerosis induced by vitamin D3 and high-fat diet in rats through modulating lipid metabolism, oxidative stress, and endothelial vascular injury[J]. Journal of Applied Microbiology, 2023, 134(8): 159-165. doi: 10.1093/jambio/lxad159 [30] KANANAVIČIUTE R, ČITAVIČIUS D. Genetic engineering of Geobacillus spp.[J]. Journal of Microbiological Methods, 2015, 111: 31-39. doi: 10.1016/j.mimet.2015.02.002 [31] CHANG Y, ZHOU K, YANG T, et al. Bacillus licheniformis inoculation promoted humification process for kitchen waste composting: Organic components transformation and bacterial metabolic mechanism[J]. Environmental Research, 2023, 237(Pt 2): 117016. [32] KARPOV D S, DOMASHIN A I, KOTLOV M I, et al. Biotechnological potential of the Bacillus subtilis 20 Strain[J]. Molecular Biology, 2020, 54(1): 137-145. [33] WANG W K, LIANG C M. Enhancing the compost maturation of swine manure and rice straw by applying bioaugmentation[J]. Scientific Reports, 2021, 11(1): 6103. doi: 10.1038/s41598-021-85615-6 [34] 刘国防. 高效油脂降解菌剂构建与效果研究[D]. 杭州: 浙江大学, 2012. [35] ZHAO Y, LIU Y, NIU H, et al. The structure and function analysis of bacterial community during aerobic composting of chicken manure[J]. Shengwu Gongcheng Xuebao/Chinese Journal of Biotechnology, 2023, 39(3): 1175-1187. [36] CHEN S, DONG X. Proteiniphilum acetatigenes gen. nov. , sp. nov. , from a UASB reactor treating brewery wastewater[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(Pt 6): 2257-2261. [37] LIU L, LIU Y, SHIN H D, et al. Developing Bacillus spp. as a cell factory for production of microbial enzymes and industrially important biochemicals in the context of systems and synthetic biology[J]. Applied Microbiology and Biotechnology, 2013, 97(14): 6113-6127. doi: 10.1007/s00253-013-4960-4 [38] BOUANANE-DARENFED A, HANIA W Ben, HACENE H, et al. Caldicoprobacter guelmensis sp. nov. , a thermophilic, anaerobic, xylanolytic bacterium isolated from a hot spring[J]. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(Pt 6): 2049-2053. [39] ZHANG J, YUE Z, DING C, et al. Metagenomic binning analyses of pig manure composting reveal potential antibiotic-degrading bacteria and their risk of antibiotic resistance genes[J]. Bioresource Technology, 2023, 371: 128540. doi: 10.1016/j.biortech.2022.128540 [40] ANBARASAN S, WAHLSTRÖM R, HUMMEL M, et al. High stability and low competitive inhibition of thermophilic Thermopolyspora flexuosa GH10 xylanase in biomass-dissolving ionic liquids[J]. Applied Microbiology and Biotechnology, 2017, 101(4): 1487-1498. doi: 10.1007/s00253-016-7922-9 [41] PATIL V S, LUGANI Y, CHAUDHARI R D, et al. Description and genomic insights into a multidrug resistant novel bacterium Savagea serpentis sp. nov. , isolated from the scats of a vine snake (Ahaetulla nasuta)[J]. Antonie van Leeuwenhoek, International Journal of General and Molecular Microbiology, 2021, 114(6): 687-696. [42] SKRZYPCZAK N, PRZYBYLSKI P. Modifications, biological origin and antibacterial activity of naphthalenoid ansamycins[J]. Natural Product Reports, 2022, 39(9): 1653-1677. doi: 10.1039/D2NP00002D -




 下载:
下载: