-
多环芳烃 (PAHs) 是一类具有2个及以上芳环的难降解有机化合物,主要来源于煤炭和其它化石燃料的不完全燃烧[1]。在自然环境中能长久存在,产生生物毒害作用,其中菲是具有3个非直线型排列结构苯环的低分子量多环芳烃 (low molecular weight PAHs,LMW-PAHs) 。美国环保署已将菲列为优先管控污染物的16种PAHs之一[2]。已有从石油污染土壤和废水等来源中分离得到菲降解菌的报道,包括不动杆菌属 (Acinetobacter) [3]、假单胞菌属 (Pseudomonas) [4]、芽孢杆菌属 (Bacillus) [5]、鞘氨醇单胞菌 (Sphingomonas) [6]、拜叶林克氏菌属 (Beijernckia) [7]、克雷伯氏菌属 (Klebsiella) [8]等。ARULAZHAGAN等从印度金奈港的石油污染海水中分离出1株苍白杆菌,对低浓度的菲 (3 mg·L−1) 降解率高达92%[9]。GHOSAL等还通过色谱分析、摄氧量测定研究了1株从污染土壤中分离的苍白杆菌对菲的可能降解途径,证实其通过2-羟基-1-萘甲酸、水杨酸和邻苯二酚降解菲[10],但由于其本身的的毒性效应及难降解性,寻找高效多环芳烃降解微生物及如何提高降解效能仍是目前有待解决的难题。
共代谢是提高PAHs降解率的常用手段之一,其机理是在原有二级基质 (PAHs) 的基础上添加一级基质,以提供碳源并适应胁迫环境,从而增加生物量并诱导降解所需关键酶[11]。一级基质可选择葡萄糖、酵母、甘油等简单可利用碳源。也可选择与二级基质结构类似或其降解过程中的代谢产物,例如邻苯二酚、琥珀酸钠、水杨酸等。陈弘昊等[12]利用从翅碱蓬根系和辽宁盘锦沿海滩涂土壤中分离出的3株菌:微杆菌 (Microbacterium sp.) 、刘志恒菌 (Zhihengliuella sp.) 和恶臭假单胞菌 (Pseudomon putida) ,进行了葡萄糖与菲的共代谢实验,在菲初始浓度为20 mg·L−1时,添加1 g·L−1的葡萄糖的7 d降解率分别显著提升了49.66%、45.87%和38.29%。臧淑艳等[13]研究发现,以琥珀酸钠为共代谢基质明显促进了芽孢杆菌 (BA-07) 对苯并[a]芘 (BaP) 的降解效果。刘海滨等[14]从北京焦化厂污染土壤中分离出1株Lasiodiplodia theobromae,在加入200 mg·L−1的水杨酸及琥珀酸钠后对100 mg·L−1的BaP降解率均有一定程度的提高。WANG等[15]将不同浓度的鼠李糖脂和Tween-80添加到PAHs污染土壤中,在90 d内,10 mg·kg−1的鼠李糖脂对土壤PAHs的降解率最高可达到95%,50 mg·kg−1的鼠李糖脂降解率为92%,发现鞘氨单胞菌属 (Sphingomonas) 、芽孢杆菌属 (Bacillus) 和假单胞菌属 (Pseudomonas) 是对表面活性剂反应敏感的菌属,鼠李糖脂对芽孢杆菌的增殖影响最大。
辽宁抚顺石油污染土壤中分离出1株具有降解PAHs能力的苍白杆菌 (Ochrobactrum sp.) FP1,具有较好环境适应性。通过研究以菲为唯一碳源的基础培养基中FP1最佳生长条件和降解率,探究在外加碳源、可能的中间产物以及表面活性剂等条件下,FP1对菲的的共代谢能力,为菲及其它PAHs的共代谢去除机理提供理论依据。
-
菌株:菌株FP1为本实验室分离自辽宁抚顺石油污染土壤,经细菌生理生化及16SrDNA序列分析鉴定为苍白杆菌 (Ochrobactrum sp.) FP1[16]。
-
高效液相色谱仪 (Prominence LC-20A,岛津) 、高压灭菌锅 (GI80DS,美国致微) 、离心机 (Neofuge 15R,Heal Force) 、紫外分光光度计 (UV-2102PC,美国Unico) 。葡萄糖 (C6H12O6) 、甘油 (C3H8O3) 、鼠李糖脂 (C32H58O13) 、水杨酸 (C7H6O3) 、邻苯二酚 (C6H6O2) 、菲 (C14H10) 、均为分析纯;正己烷 (C6H14) 、甲醇 (CH4O) 为色谱级。
-
LB液体培养基:蛋白胨5 g,酵母粉2.5 g,NaCl 5 g,蒸馏水500 mL,调整pH为7.0~7.2。
LB固体培养基:蛋白胨5 g,酵母粉2.5 g,NaCl 5 g,琼脂10 g,蒸馏水500 mL,调整pH为7.0~7.2。
基础培养基:NH4NO3 1.5 g,NaCl 0.25 g,K2HPO4 0.75 g,KH2PO4 0.75 g,FeCl2 0.005 g,无水CaCl2 0.005 g,MgSO4·7H2O 0.05 g,蒸馏水500 mL,调整pH为7.0~7.2后超声溶解。以上培养基均进行1×105 Pa,121 ℃灭菌20 min冷却备用。
菲-基础培养基 (50 mg·L−1) :准确称取0.1 g菲,用丙酮定容至100 mL,再用有机微孔滤膜除菌后加入1 mL至50 mL锥形瓶中,过夜挥发丙酮后加入20 mL已灭菌的基础培养基制成。
-
将苍白杆菌 (Ochrobactrum sp.) FP1接种于5 mL LB液体培养基中,于30 ℃,180 r·min−1振荡培养10 h至生长对数期,6 000 r·min−1离心10 min后收集菌体,以0.85%的生理盐水重悬两次后调整其OD600为1.0,以4%的接种量将其接种于20 mL以菲 (50 mg·L−1) 为唯一碳源的基础培养基中,分别在不同温度 (10、20、25、30、35、40、50 ℃) 、不同pH (4、5、6、7、8、9、10) 以及不同转数 (80、100、120、140、160、180 r·min−1) 条件下,振荡培养10 d,提前调整摇床温度和转速,配置基础培养基时调整pH为对应数值以控制实验参数,每隔1 d在LB固体培养基上采用稀释平板涂布法进行细菌计数,以培养时间10 d时的细菌数为基准确定FP1在以菲为唯一碳源的基础培养基中的最适温度、pH和培养转数。每个梯度设置3个平行。
-
选取葡萄糖、甘油、水杨酸、邻苯二酚以及鼠李糖脂作为外加基质,配置葡萄糖 (1.25 g·L−1) 、甘油 (5 g·L−1) 、水杨酸 (400 mg·L−1) 、邻苯二酚 (1 g·L−1) 和鼠李糖脂 (1 g·L−1) 的储备液,于微孔滤膜过滤除菌后,分别加入0.8、0.2、2.5、1.0、1.0 mL于菲-基础培养基中以调整终浓度为50 mg·L−1。在最适条件下培养,每隔1 d进行取样并在LB固体培养基上稀释平板涂布进行细菌计数,以确定菌株对以上基质的利用情况。设计菌株加菲为空白自然降解组,菌株加基质为对照组。每组设置3个平行。
-
将在锥形瓶中降解10 d后的菲-基础培养基倒入离心管,向锥形瓶中分3次 (10、5、5 mL) 添加正己烷分别进行瓶壁冲洗后合并有机相和水相,进行15 min、2 000 r·min−1的漩涡振荡和4 000 r·min−1低速离心萃取。静置30 min后取1 mL上层有机相用色谱级甲醇定容至5 mL,经0.22 μm的有机滤膜过滤后加入2 mL棕色进样小瓶中,保存至−20 ℃冰箱待测。
-
利用岛津高效液相色谱仪进行菲浓度的测定。测定条件:流动相为甲醇-超纯水 (90∶10) ,柱温箱设置为35 ℃,流速为0.8 mL·min−1,UV检测波长为254 nm,在检测样品前色谱柱先用流动相进行冲洗约1 h,进样体积为10 μL,通过与标品比对保留时间定性,峰面积定量,利用外标法检测菲的含量,并计算降解率。
-
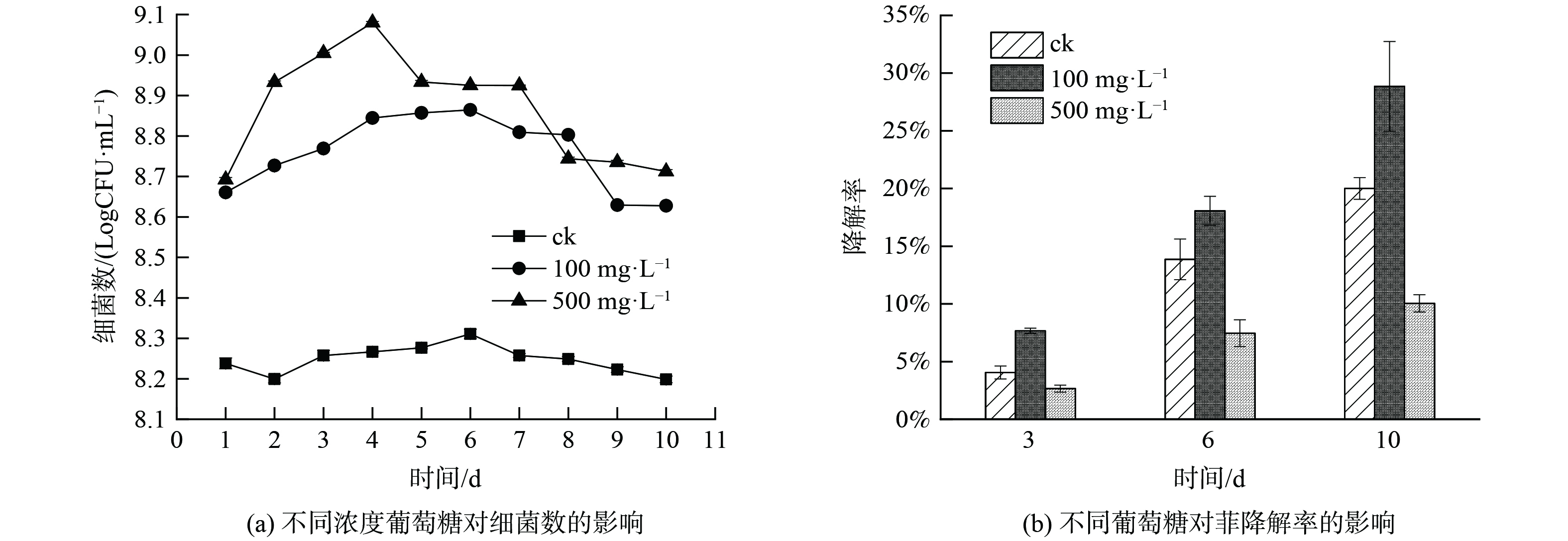
配置葡萄糖 (5 g·L−1) 的储备液,于微孔滤膜过滤除菌后,分别加入0.4、2 mL于菲-基础培养基中以调整终浓度为100、500 mg·L−1。在最适条件下培养,每隔1 d进行取样并在LB固体培养基上稀释平板涂布进行细菌计数,以确定菌株在高浓度葡萄糖条件下的生长情况。在3、6、10 d取样并进行菲降解率的测定。设计菌株加菲为自然降解组,菌株加葡萄糖为对照组。每组设置3个平行。
-
苍白杆菌FP1接种在以菲为唯一碳源的基础培养基中,分别设置不同pH、不同温度、不同转数的处理组进行培养,培养结束时间10 d结果如图1所示,在pH6~8的范围内FP1菌体生长较好,细菌数达到108 CFU·mL−1。pH为5时,其细菌数为106 CFU·mL−1,pH为4、9、10时菌株生长被强烈抑制,细菌数仅为103 CFU·mL−1,降解菲的最适pH为7 (图1(a)) 。
在温度为20~35 ℃范围内菌株均能正常生长,细菌数达到107~108 CFU·mL−1。30 ℃为最佳培养温度,温度较高 (40 ℃) 时,细菌数为106 CFU·mL−1,菌株生长受到抑制,低温 (10 ℃) 和高温 (50 ℃) 时菌株几乎无法利用菲生长,可能是低温和高温影响了菌株降解菲的酶活性,进而影响菌株的生长 (图1(b)) 。
在120 r·min−1时细菌数达到峰值,此时溶解氧的利用率最高,而随着转数继续提升,菌株的生长略有降低,变化不大 (图1(c)) 。这可能是由于溶解氧在培养转数大于120 r·min−1时过饱和所致。综上确定FP1在以菲为唯一碳源的基础培养基中最适生长温度30 ℃、最适pH 7以及最佳培养转速120 r·min−1。有人发现适度的提升培养转数以增加溶解氧的含量,有利于菌株对于PAHs的降解[17]。
-
分别选取葡萄糖、甘油,邻苯二酚、水杨酸及鼠李糖脂为外加基质,添加到含菲基础培养基,接种苍白杆菌FP1进行共代谢培养,每隔24 h取样稀释涂布平板计数,结果如图2所示,接种前3 d处理组菌落细菌数有一定程度的降低,可能是菌株FP1在刚加入菲-基础培养基的属于适应期,而且菲作为一种水溶性较差并且难以利用的碳源对FP1有一定的胁迫作用,3 d后菌株适应胁迫环境,开始利用菲进行生长代谢活动,6 d时菌株生长最为旺盛,细菌数最大,随后细菌数开始降低,随着时间推移趋于稳定减少。与自然降解组对比,葡萄糖和甘油处理组降低了菲对菌株FP1的胁迫作用,葡萄糖加入1 d后,实验组相比对照组的细菌数增加明显,可能是葡萄糖的加入促进了FP1对菲的降解酶的产生,从而促进了菌株的生长代谢,2 d起趋于稳定 (图2(a)) 。7d时菌株共代谢实验组细菌数的下降速率远高于对照组,从侧面反映了菌株对菲-葡萄糖的共代谢达到饱和。
水杨酸与邻苯二酚是菲降解过程中可能的中间产物,在菌株利用菲代谢过程中可能涉及到中间产物诱导酶的反馈抑制机制[18]沈小娟[19]在铜绿假单胞菌NY3降解菲的过程中加入水杨酸、邻苯二酚等中间产物,邻苯二酚实验组OD600相较于水杨酸等中间产物实验组明显降低,菌株生长被明显抑制。如图2(c)可知,邻苯二酚处理组菌株FP1的生长受到强烈抑制,抑制程度达到一个数量级。实验组菲的加入使得菌株在1~4 d属于菲胁迫适应期,4 d起对菲进行利用,细菌数略有回升。如图2(d)可知,对照组与自然降解组的细菌数相差不大,这是由于水杨酸的下游产物是邻苯二酚所以使得菌株FP1在利用水杨酸为代谢基质的降解过程中的生长被抑制,但水杨酸本身又是微生物容易利用的碳源,使得总体抑制效果不如邻苯二酚明显。
不同菌株的生长特性及其降解途径不同,中间产物并不总能提高PAHs的降解,在某些特定情况下,添加中间产物会抑制PAHs的降解[20]。MA等[21]用一株假单胞菌Pseudomonas sp. JM2和水杨酸-菲进行共代谢实验,发现JM2在24 h内对50 mg·L−1的菲降解率达到72.12%,但加入20×10−3 mol·L−1的水杨酸后降解率仅为35.7%,4 d后JM2对菲的降解率达到92%以上,而水杨酸-菲体系中的降解率为80%。
PAHs具有很强的疏水性,很大程度上降低了微生物利用PAHs的效率。表面活性剂作为两性化合物,即同时具有亲水性和疏水性,可以通过降低界面张力来增加微生物与PAHs的接触面积,从而提高微生物对PAHs的利用率[22]。鼠李糖脂具有提高PAHs的溶解度、细胞膜的通透性以及降低降解菌表面Zeta电位等优势,已成为微生物降解PAHs共代谢过程中广泛应用的一种表面活性剂[23]。在FP1对菲的降解体系中加入鼠李糖脂后 (图2(e)) ,1~5 d的细菌数相比自然降解组有一定的提升。鼠李糖脂能够帮助菌株适应菲的胁迫环境,5 d起各组的细菌数趋于稳定。3 d起,对照组细菌数有一定的提升,这可能是由于鼠李糖脂有一定的促生长作用,但其作用机理并非碳源,故细菌数提升并不大[23]。
综上所述,适当浓度葡萄糖、甘油以及鼠李糖脂作为共基质可以不同程度的缓解菲对菌株的胁迫作用。水杨酸以及邻苯二酚作为共代谢基质时抑制了以菲为唯一碳源的菌株FP1的生长,且邻苯二酚的抑制性更为明显。
-
在pH为7、温度为30 ℃且转速为120 r·min−1的最适菌株降解菲的生长条件下,选取终浓度为50 mg·L−1的不同共代谢基质 (葡萄糖、甘油、邻苯二酚、水杨酸) 以及表面活性剂 (鼠李糖脂) 与50 mg·L−1的菲进行共培养实验,探究不同外加基质和菲的共代谢培养体系在10 d后对菲的降解效果,如图3所示。不添加外加基质的菌株和菲的培养体系对照处理组菌株对菲的降解率为21.59%,加入甘油、葡萄糖和鼠李糖脂后均对菲的降解有不同程度的提升,甘油和葡萄糖显著提升了21.58%和15.38% (p<0.001) ,鼠李糖脂提升了6.76%,其中甘油对菌株PF1的菲降解促进作用最好,水杨酸及邻苯二酚对菌株降解菲有明显抑制作用,分别显著降低了46.27%和70.31% (p<0.001) 。菲的降解中通常存在两种降解途径,分别为邻苯二甲酸为中间产物代表的邻位裂解以及水杨酸为中间产物代表的间位裂解[24]。邻苯二酚为低环PAHs生物降解过程中的关键产物之一,微生物通过代谢邻苯二酚进入三羧酸循环。在培养体系中加入水杨酸及邻苯二酚后酶的反馈抑制存在间接说明了苍白杆菌FP1对菲的降解途径可能是间位裂解的水杨酸途径。
-
选取100 mg·L−1和500mg·L−1的葡萄糖添加到含菲基础培养基中,接种苍白杆菌FP1进行共代谢培养,每隔24 h取样在LB固体培养基上进行稀释涂布平板计数 (图4(a)) ,与自然降解组对比,两个葡萄糖处理组均降低了菲对菌株FP1的胁迫作用,细菌数有一定程度的提升,且随着葡萄糖浓度的增加细菌数也随之增加。在3、6、10 d取样并进行菲降解率的测定 (图4(b)) ,100 mg·L−1葡萄糖处理组相比空白处理组在3、6、10 d的降解率分别提升了89.38%、30.47%、44.30%,表明适度的添加易被利用的碳源会有效的提升菌株对菲的降解率,葡萄糖代谢能够产生促进菌株降解菲的辅助因子NADH,诱导菌株合成更多的菲降解酶,从而帮助菌株提前适应菲胁迫环境[25]。500 mg·L−1葡萄糖处理组相比空白处理组在3、6、10 d的降解率分别降低了34.32%、46.14%、49.75%,这可能是由于菌株会优先利用浓度足够高的速效碳源葡萄糖,待葡萄糖耗尽后再进行菲的代谢,故而影响对菲的降解率[26],这种外加碳源对其他碳源的抑制作用被称为分解代谢产物阻碍[27]即当环境中存在大量易被利用的碳源时,菌株将不会消耗较大的能量和物质去合成利用效率不高的诱导酶,也印证了苍白杆菌FP1对菲的降解酶系为诱导酶。
-
1) 苍白杆菌FP1在以菲 (50 mg·L−1) 为唯一碳源的基础培养基中能较好生长,在pH 5~8、温度20~40 ℃范围内可以正常生长,其最适生长条件为pH 7、温度30 ℃、培养转数为120 r·min−1。
2) 苍白杆菌FP1在菲和不同外加基质下培养,葡萄糖、甘油以及鼠李糖脂均对菌株的生长有一定程度的提升,其中甘油对菌株FP1的促生长作用最为明显。邻苯二酚和水杨酸对菌株的生长产生不同程度的抑制,其中邻苯二酚的抑制作用最明显。
3) 外加基质葡萄糖、甘油以及鼠李糖脂能明显促进苍白杆菌FP1对菲的降解能力,其中甘油作用最为明显。添加水杨酸和邻苯二酚对菲的降解率有一定的抑制,邻苯二酚的抑制作用更明显,其降解作用与菌株生长情况呈现正相关。
4) 适量添加葡萄糖有利于苍白杆菌FP1对菲的降解,而添加高浓度葡萄糖则明显抑制。菌株对菲的降解酶系为诱导酶。
外加基质条件下苍白杆菌 (Ochrobactrum sp. ) FP1对菲的共代谢特性
Co-metabolic characteristics of phenanthrene by a strain of Ochrobactrum sp. FP1 under the addition of substrates
-
摘要: 多环芳烃 (PAHs) 污染物的可降解性能较低,在自然环境长期蓄积,造成环境污染及生物毒害作用。苍白杆菌 (Ochrobactrum sp.) FP1是从石油污染土壤分离的高效石油降解菌。采用涂布平板计数、高效液相色谱 (HPLC) 等方法研究了该菌在含菲基础培养基中的生长特性及最适生长条件,探究了葡萄糖、甘油、邻苯二酚、水杨酸和鼠李糖脂等不同外加基质存在下菌体的生长特性及菲降解能力。结果表明,苍白杆菌FP1能在pH5~8和20~40 ℃的条件下,在菲含量为50 mg·L−1的基础培养基中正常生长,其最适生长pH 7、最适温度为30 ℃。外加基质葡萄糖、甘油及鼠李糖脂对菌株生长有良好促进作用,甘油的促进作用最明显,而水杨酸和邻苯二酚对菌株的生长有抑制作用。HPLC分析结果显示,外加基质甘油、葡萄糖、鼠李糖脂处理组的降解率分别较空白组提升了21.58%、15.38%、6.76%,而水杨酸和邻苯二酚处理组的降解率分别下降了46.27%和70.31%,细菌对菲降解率的变化与其生长能力呈正相关,高浓度葡萄糖对菌株代谢菲有抑制作用,苍白杆菌FP1对菲的降级酶系为诱导酶。本研究结果可为细菌共代谢多环芳烃提供理论参考。Abstract: Polycyclic aromatic hydrocarbons (PAHs) have low degradability and accumulate in natural environment for a long time, causing environmental pollution and biological toxicity. Ochrobactrum sp. FP1 is an efficient petroleum degrading bacterium isolated from oil contaminated soil. The growth characteristics and optimum growth conditions of Ochrobactrum sp. FP1 were studied by coated plate counting and High Performance Liquid Chromatography (HPLC). The growth characteristics and phenanthrene degradation ability of bacteria in the presence of different external substrates such as glucose, glycerol, catechol, salicylic acid and rhamnoolipid were studied. The results showed that Ochrobactrum sp. FP1 could grow normally at pH 5~8 and 20~40 ℃ with phenanthrene content of 50·mg L−1, and the optimum growth temperature was 30 ℃ and pH 7. The addition of substrates glucose, glycerol and rhamnose-lipids had a good promotion effect on the growth of the strain, and glycerol was the most obvious promotion effect, while salicylic acid and catechol had an inhibitory effect on the growth of the strain. The results of HPLC analysis showed that compared with the control group, the degradation rates of the additional substrates glycerol, glucose and rhamnose-grease treatment groups were increased by 21.58%, 15.38% and 6.76%, respectively, while the degradation rates of salicylic acid and catechol treatment groups were decreased by 46.27% and 70.31%, respectively. The change of bacterial degradation rate of phenanthocyanin was positively correlated with its growth ability. High glucose concentrations inhibited the metabolism of phenanthrene by the strain, and the degradation enzymes of phenanthrene in Ochrobactrum sp. FP1 were inducible enzymes.The results of this study can provide theoretical reference for bacterial co-metabolism of polycyclic aromatic hydrocarbons.
-
Key words:
- ochrobactrum sp /
- phenanthrene /
- growth characteristics /
- co-metabolism /
- degrading rate
-

-
-
[1] DAT N D, CHANG M B. Review on characteristics of PAHs in atmosphere, anthropogenic sources and control technologies[J]. Science of the Total Environment, 2017, 609: 682-693. doi: 10.1016/j.scitotenv.2017.07.204 [2] RIVAS F J. Polycyclic aromatic hydrocarbons sorbed on soils: a short review of chemical oxidation based treatments[J]. Journal of Hazardous Materials, 2006, 138(2): 234-251. doi: 10.1016/j.jhazmat.2006.07.048 [3] 马丹, 王永刚, 陈吉祥, 等. 1株高效菲降解不动杆菌的筛选、鉴定及性能研究[J]. 微生物学杂志, 2018, 38(6): 15-23. doi: 10.3969/j.issn.1005-7021.2018.06.002 [4] 白红娟, 卫燕红, 张晴, 等. 适冷假单胞菌1-2D降解菲的途径及其酶动力学研究[J]. 现代化工, 2022, 42(9): 155-159. [5] 闫双堆, 刘利军, 曹燕篆, 等. 3株多环芳烃高效降解菌株的分离鉴定及降解特性[J]. 应用生态学报, 2021, 32(12): 4439-4446. [6] CUNLIFFE M, KERTESZ M A. Effect of Sphingobium yanoikuyae B1 inoculation on bacterial community dynamics and polycyclic aromatic hydrocarbon degradation in aged and freshly PAH-contaminated soils[J]. Environmental Pollution, 2006, 144(1): 228-237. doi: 10.1016/j.envpol.2005.12.026 [7] 张晴, 白红娟, 孙慧敏, 等. 一株菲高效降解菌的分离鉴定及去除特性[J]. 应用化工, 2020, 49(7): 1720-1726. doi: 10.3969/j.issn.1671-3206.2020.07.029 [8] KIM Y M, AHN C K, WOO S H, et al. Synergic degradation of phenanthrene by consortia of newly isolated bacterial strains[J]. Journal of Biotechnology, 2009, 144(4): 293-298. doi: 10.1016/j.jbiotec.2009.09.021 [9] ARULAZHAGAN P, VASUDEVAN N. Biodegradation of polycyclic aromatic hydrocarbons by a halotolerant bacterial strain Ochrobactrum sp. VA1[J]. Marine Pollution Bulletin, 2011, 62(2): 388-394. doi: 10.1016/j.marpolbul.2010.09.020 [10] GHOSAL D, CHAKRABORTY J, KHARA P, et al. Degradation of phenanthrene via meta-cleavage of 2-hydroxy-1-naphthoic acid by Ochrobactrum sp strain PWTJD[J]. Fems Microbiology Letters, 2010, 313(2): 103-110. doi: 10.1111/j.1574-6968.2010.02129.x [11] 李萍, 刘俊新. 废水中难降解性有机污染物的共代谢降解[J]. 环境污染治理技术与设备, 2002(11): 43-46. [12] 陈弘昊, 李作扬, 陈泉睿, 等. 3株耐盐细菌对萘、菲、惹烯和苯并[a]芘的降解性能[J]. 大连海洋大学学报, 2018, 33(3): 307-315. [13] 臧淑艳, 李培军, 周启星, 等. 苯并(a)芘及其代谢产物的连续降解研究[J]. 环境科学, 2006(12): 2531-2535. doi: 10.3321/j.issn:0250-3301.2006.12.029 [14] 刘海滨, 王翠苹, 张志远, 等. 苯并[a]芘高效降解菌筛选及其降解特性研究[J]. 环境科学, 2011, 32(9): 2696-2702. [15] WANG L W, LI F, ZHAN Y, et al. Shifts in microbial community structure during in situ surfactant-enhanced bioremediation of polycyclic aromatic hydrocarbon-contaminated soil[J]. Environmental Science and Pollution Research, 2016, 23(14): 14451-14461. doi: 10.1007/s11356-016-6630-4 [16] 罗旦. 红平红球菌rpf基因突变、生物活性及应用研究[D]. 兰州: 兰州理工大学, 2019. [17] 李哲斐, 孙然, 简利茹, 等. 一株耐碱性芘降解菌的筛选及特性研究[J]. 西北农业学报, 2011, 20(12): 140-144. doi: 10.3969/j.issn.1004-1389.2011.12.028 [18] SEO J S, KEUM Y S, LI Q X. Bacterial degradation of aromatic compounds[J]. International Journal of Environmental Research and Public Health, 2009, 6(1): 278-309. doi: 10.3390/ijerph6010278 [19] 沈小娟. 铜绿假单胞菌NY3降解多环芳烃的特性研究[D]. 西安: 西安建筑科技大学, 2012. [20] LI Z. Surfactant-enhanced oxidation of trichloroethylene by permanganate--proof of concept[J]. Chemosphere, 2004, 54(3): 419-423. [21] MA J, XU L, JIA L Y. Degradation of polycyclic aromatic hydrocarbons by Pseudomonassp JM2 isolated from active sewage sludge of chemical plant[J]. Journal of Environmental Sciences, 2012, 24(12): 2141-2148. doi: 10.1016/S1001-0742(11)61064-4 [22] LIANG X J, GUO C L, LIAO C J, et al. Drivers and applications of integrated clean-up technologies for surfactant-enhanced remediation of environments contaminated with polycyclic aromatic hydrocarbons (PAHs)[J]. Environmental Pollution, 2017, 225: 129-140. doi: 10.1016/j.envpol.2017.03.045 [23] 吴洁婷, 赵若帆, 包红旭, 等. 鼠李糖脂强化多环芳烃微生物修复的研究进展[J]. 生态环境学报, 2022, 31(1): 205-214. [24] MALLICK S, CHAKRABORTY J, DUTTA T K. Role of oxygenases in guiding diverse metabolic pathways in the bacterial degradation of low-molecular-weight polycyclic aromatic hydrocarbons: A review[J]. Critical Reviews in Microbiology, 2011, 37(1): 64-90. doi: 10.3109/1040841X.2010.512268 [25] Gotschalk G. Bacterial metabolism[M]. New York: Spinger-Verlag, 1979. [26] 杨旭. 修复多环芳烃复合污染水体的高效菌群构建及降解特性[D]. 镇江: 江苏科技大学, 2011. [27] DEUTSCHER J. The mechanisms of carbon catabolite repression in bacteria[J]. Current Opinion in Microbiology, 2008, 11(2): 87-93. doi: 10.1016/j.mib.2008.02.007 -




 下载:
下载: