-
社会经济发展带来的碳排放极大程度增加了环境大气中温室气体含量,二氧化碳 (carbon dioxide,CO2) 作为最主要的温室气体,其在大气中浓度上升会显著加剧全球变暖、海洋酸化、海平面上升等问题[1],已成为人类面临的最大挑战之一。2021年我国CO2排放量达1.19×1011 t,约占全球排放总量的33%[2]。二氧化碳捕集、利用与封存 (carbon dioxide capture, utilization and storage,CCUS) 技术被认为是最具前途的碳减排技术,2050年前能够有效减少20%碳排放[3]。有机胺化学吸收法被认为是一种有效的燃烧后捕集CO2法,具有吸收能力强和吸收速率快等优势,是工业中常用的吸收剂之一。许多研究人员将多种优势互补的有机胺结合起来,开发高吸收容量、高吸收速率和再生性能好的复合有机胺吸收剂。ZHANG等[4]发现由单乙醇胺、N-甲基二乙醇胺和哌嗪构成三元混合体系 (MEA-MDEA-PZ) 较5 mol∙L−1的单乙醇胺 (MEA) 吸收剂有更好的吸收和解吸性能,甚至降低了15.22%~49.92%的再生能耗。GUO等[5]对比添加2-氨基-2-甲基-1-丙醇 (AMP) 溶液前后的氨乙基乙醇胺 (AEEP) 溶液吸收CO2的循环利用性。发现在第2~6次的吸收-解吸循环实验中,添加AMP可有效提高AEEP溶液的CO2吸收容量,并且第6次的再生效率明显提升11.3%。尽管复合有机胺吸收剂可弥补单一有机胺吸收剂捕集CO2的缺陷,但有机胺吸收剂因其易发泡降解、溶剂损耗大、易腐蚀设备以及在高温下易挥发等问题制约该技术大面积推广[6-9]。
近年来,离子液体 (ionic liquids,ILs) 作为一种绿色吸收剂因其独具结构可调性质成为研究热点,被广泛用于气体分离、催化加成等诸多领域[10-12]。1914年首次被WALDEN[13]发现,具有较宽的温度范围、极低的饱和蒸汽压、良好的化学稳定性和热稳定性等特点。1999年BLANCHARD等[14]首次证明离子液体可有效吸收CO2,自此衍生发展出多种离子液体应用在CO2捕集领域。常规离子液体 (traditional ionic liquids,TILs) 主要包括咪唑盐型、吡啶盐型、吡咯烷盐型、季铵盐型和季鏻盐型离子液体。其中咪唑盐型离子液体因碱性较强,且易烷基化而被广泛研究[15],但是TILs捕集CO2为物理吸收从而限制吸收性能。受到有机胺吸收剂捕集思路启发,研究者在TILs基础上引入以胺基为主的碱性基团作为CO2吸收反应位点,开发合成新型氨基功能化离子液体 (amino-functionalized ionic liquids,AFILs) 用于CO2捕集。
胺基与CO2反应遵循两性离子机理[16-17],每mol胺基可捕集0.5 mol~1.0 mol CO2,理论上胺基数量越多对应CO2捕集效果越好。JING等[18]的实验结果表明,阴离子相同的氨基功能化离子液体[DETAH][Lys]和[TETAH][Lys]在40 ℃时纯离子液体状态下,分别吸收CO2 2.13 mol∙mol−1和2.59 mol∙mol−1 (每mol离子液体吸收的CO2物质的量) ,并通过13C NMR表征和量子化学计算验证反应过程遵循两性离子机理。然而,胺基数量增多会导致离子液体黏度变大,且与CO2反应生成氨基甲酸酯类物质会加大反应过程中的黏度变化,从而影响传质阻碍CO2吸收。同时,使用单一AFILs吸收剂还存在CO2捕集成本高的问题。为此一些研究者利用助溶剂混合离子液体,来降低AFILs黏度和捕集成本。LIU等[15]将离子液体[TEPAH][AICA]溶于正丙醇 (NPA) 和乙二醇 (EG) ,通过调节NPA和EG间的体积配比得到最佳CO2吸收容量。发现40 ℃下当[TEPAH][AICA]浓度为0.5 mol∙L−1、VNPA∶VEG=8∶2时,该混合体系的CO2吸收容量达到1.78 mol∙mol−1,经过10次循环吸收-解吸后仍有良好的循环再生性。ZHAN等[19]将离子液体[DETAH][Tz]溶解在1-丙醇 (1-propanol) 和水中,发现30 ℃下当[DETAH][Tz]浓度为0.5 mol L−1、1-丙醇和水的体积比为1∶1时,每摩尔混合体系能够吸收1.71 mol CO2并分相。再生时将2 mL贫相加入至富相中,在120 ℃和常压条件下解吸60 min,5次循环吸收-解吸后仍保持初始吸收量的90%。
综上,在TILs基础上引入胺基能够明显提升CO2吸收容量,添加一定配比的助溶剂会有效降低AFILs黏度和捕集成本。因此,本研究以多元胺为原料合成氨基功能化离子液体三乙烯四胺-3-溴苯酚盐 ([TETAH][3-Br-PhO]) ,并添加助溶剂五甲基二乙烯三胺 (PMDETA) 溶液以及去离子水组成水基CO2吸收体系。采用核磁共振碳谱 (13C NMR) 、傅里叶变换红外光谱 (FTIR) 和热重分析 (TGA) 分析了AFILs结构、热稳定性以及该体系吸收CO2的机理。实验探究了反应温度、体系配比以及含水量对体系吸收CO2性能的影响,并考察了不同解吸条件下的体系循环再生性能。
-
三乙烯四胺 (TETA,质量分数为70%) 、3-溴苯酚 (3-Br-PhOH,质量分数为98%) 、五甲基二乙烯三胺 (PMDETA、质量分数为99%) 均购自上海阿拉丁生化科技股份有限公司;CO2 (体积分数
$ \ge $ 99.0%) 和N2 (体积分数$ \ge $ 99.0%) 均购自武汉氛启辉科技有限公司;实验用水均为自制去离子水。 -
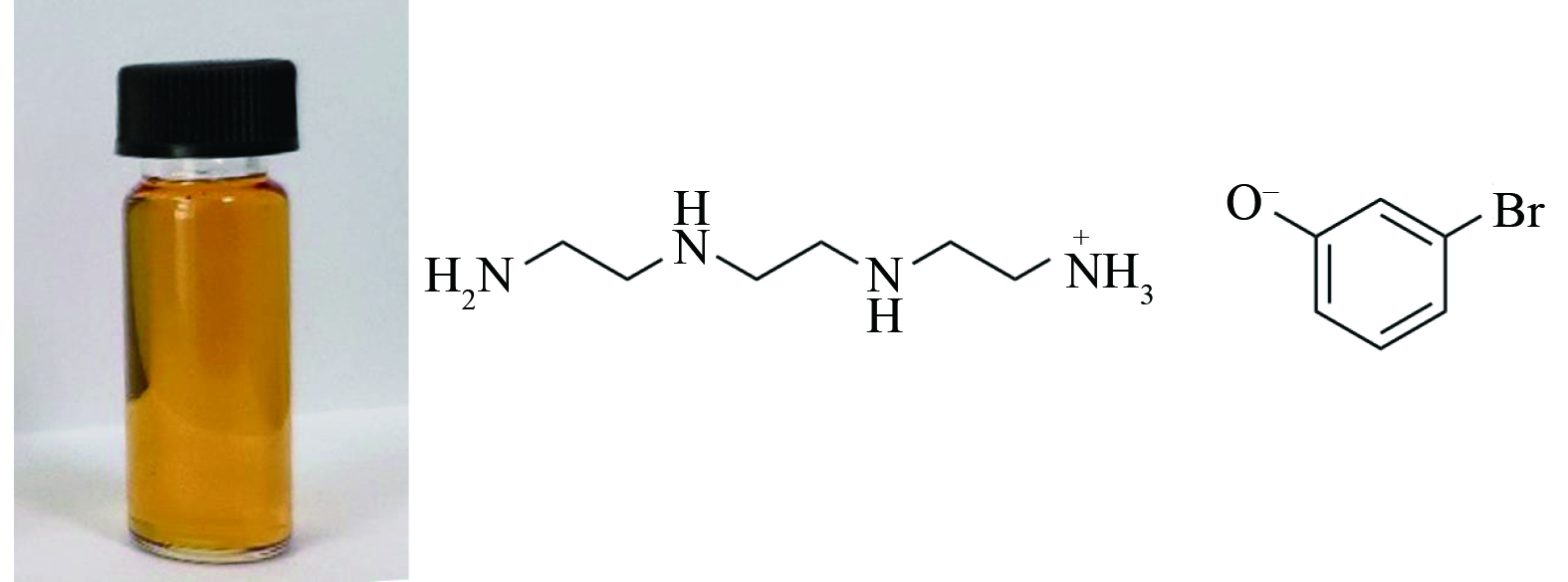
取一定摩尔数的三乙烯四胺置于圆底三口烧瓶内,加入等摩尔的3-溴苯酚在25 ℃水浴条件下磁力搅拌反应24 h;反应结束后移入旋转蒸发仪中在70 ℃条件下减压蒸馏,最后在70 ℃的真空干燥箱中干燥24 h至恒重,得到棕黄色透明黏稠液体[TETAH][3-Br-PhO],如图1所示。
-
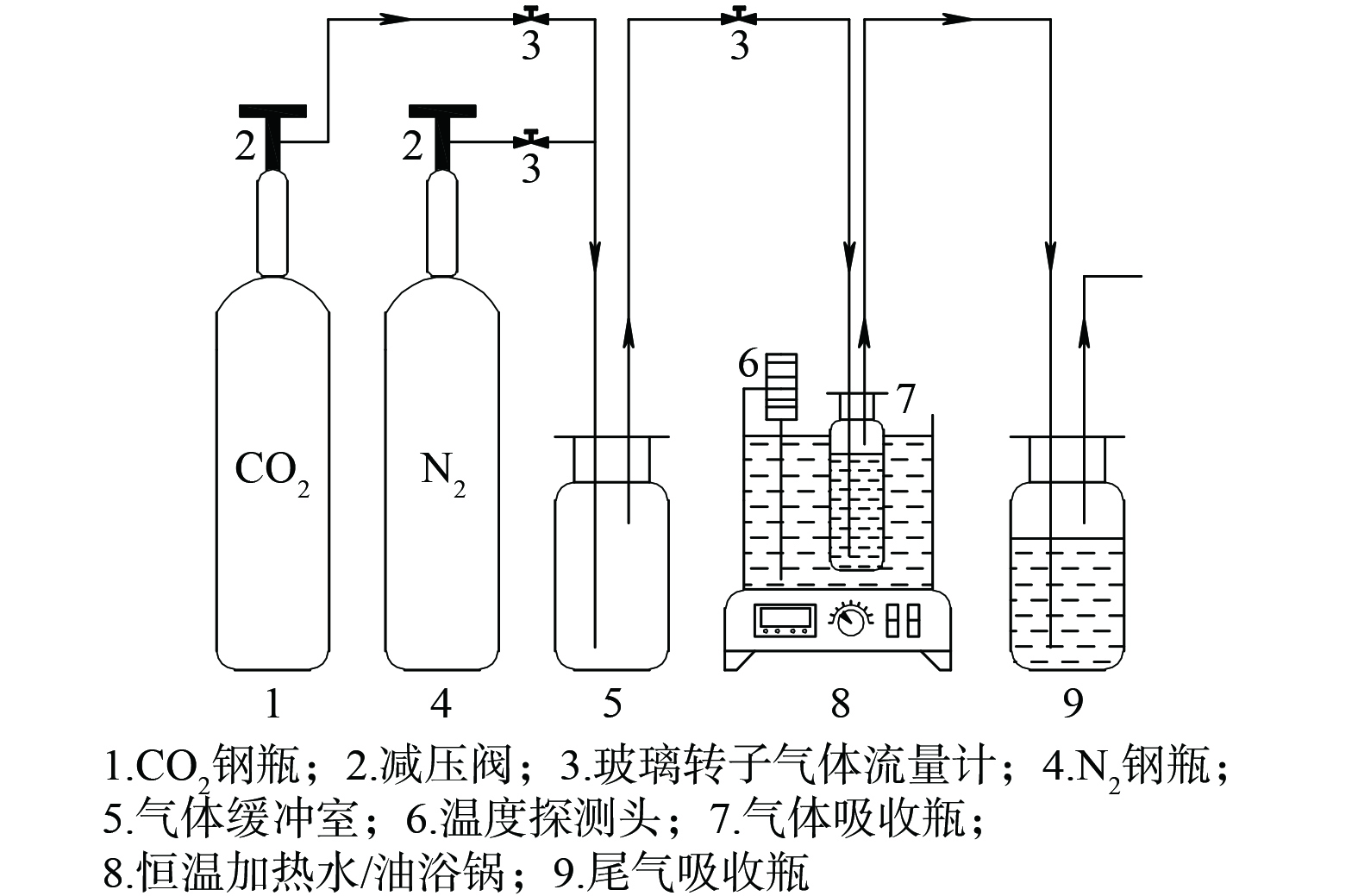
吸收体系的CO2吸收实验利用如图2所示装置完成。该装置由恒温加热水浴锅精准控温,精度±0.1 ℃。进气流量保持120 mL∙min−1,每隔5 min用万分之一电子分析天平称量吸收瓶的质量变化,通过CO2吸收容量 (公式(1)) 评价体系的吸收性能,多余的CO2气体由尾气吸收瓶内NaOH碱液吸收。每组实验均重复3次进行。
式中:
$ {\alpha _{{\text{C}}{{\text{O}}_2}}} $ 为体系的CO2吸收容量,mol∙L−1;$ {m_{\text{t}}} $ 为任一反应时刻吸收体系的质量,g;$ {m_{\text{0}}} $ 为吸收体系的初始质量,g;$ {M_{{\text{C}}{{\text{O}}_{\text{2}}}}} $ 为CO2摩尔质量 ($ {M_{{\text{C}}{{\text{O}}_{\text{2}}}}} $ =44 g∙mol−1) ;$ {V_{{\text{aq}}}} $ 为吸收体系的总体积,L。以氨基功能化离子液体[TETAH][3-Br-PhO]与PMDETA的体积和作为吸收体系总体积,通过改变[TETAH][3-Br-PhO]与PMDETA的复配比例 (1∶9、2∶8、3∶7、4∶6、5∶5) ,以及添加去离子水的体积分数占比 (20%、40%、50%、60%、70%、80%、100%) ,探究吸收体系最优配比并测得最佳温度条件下 (25、35、45、55、65 ℃) 体系的最大CO2吸收容量。按照表1的配比方案,开展氨基功能化离子液体复配PMDETA的水基吸收体系吸收CO2实验研究。
实验开始前调节水浴锅温度至实验温度,配置一定比例的吸收体系置于吸收瓶内后称重记录,用试管夹将吸收瓶固定并浸入水浴锅;调节玻璃转子气体流量计向实验装置持续通入N2 30 min,旨在检查气密性并排除装置内空气,后通入CO2开始吸收实验;每隔5 min取下吸收瓶,用吸水滤纸擦干后称重记录,再接入装置继续实验,循环重复称重步骤至前后两次重量不变,即吸收饱和,停止CO2通入,实验结束。
-
对吸收体系的饱和溶液在常压加热条件下进行解吸-再生实验。油浴加热控制解吸温度80~120 ℃并解吸30~90 min,得到最佳解吸温度和时间条件。CO2从体系中脱附并冷却后再次进行吸收CO2实验,共进行5次循环吸收-解吸实验,通过再生效率 (公式(2)) 考察吸收体系的循环再生性能。
式中:
$ \eta $ 为吸收体系再生数次后的再生效率,%;$ {L_{\text{n}}} $ 为吸收体系再生数次后的CO2吸收容量,mol∙L−1;$ {L_{\text{1}}} $ 为吸收体系第一次的CO2吸收容量,mol∙L−1;$ {L_{\text{n}}} $ 和$ {L_{\text{1}}} $ 均按公式(1)计算。 -
通过核磁共振碳谱 (13C NMR) 和傅里叶变换红外光谱 (FTIR) 表征分析[TETAH][3-Br-PhO]-PMDETA-H2O在吸收CO2前后的物种分布,用于初步推测和探索吸收机理。使用Bruker光谱分析仪进行13C NMR分析,氘代二甲亚砜 (DMSO-d6) 为溶剂;以及光谱仪在4 000~450 cm−1范围内、ATR模式下记录FTIR光谱。
-
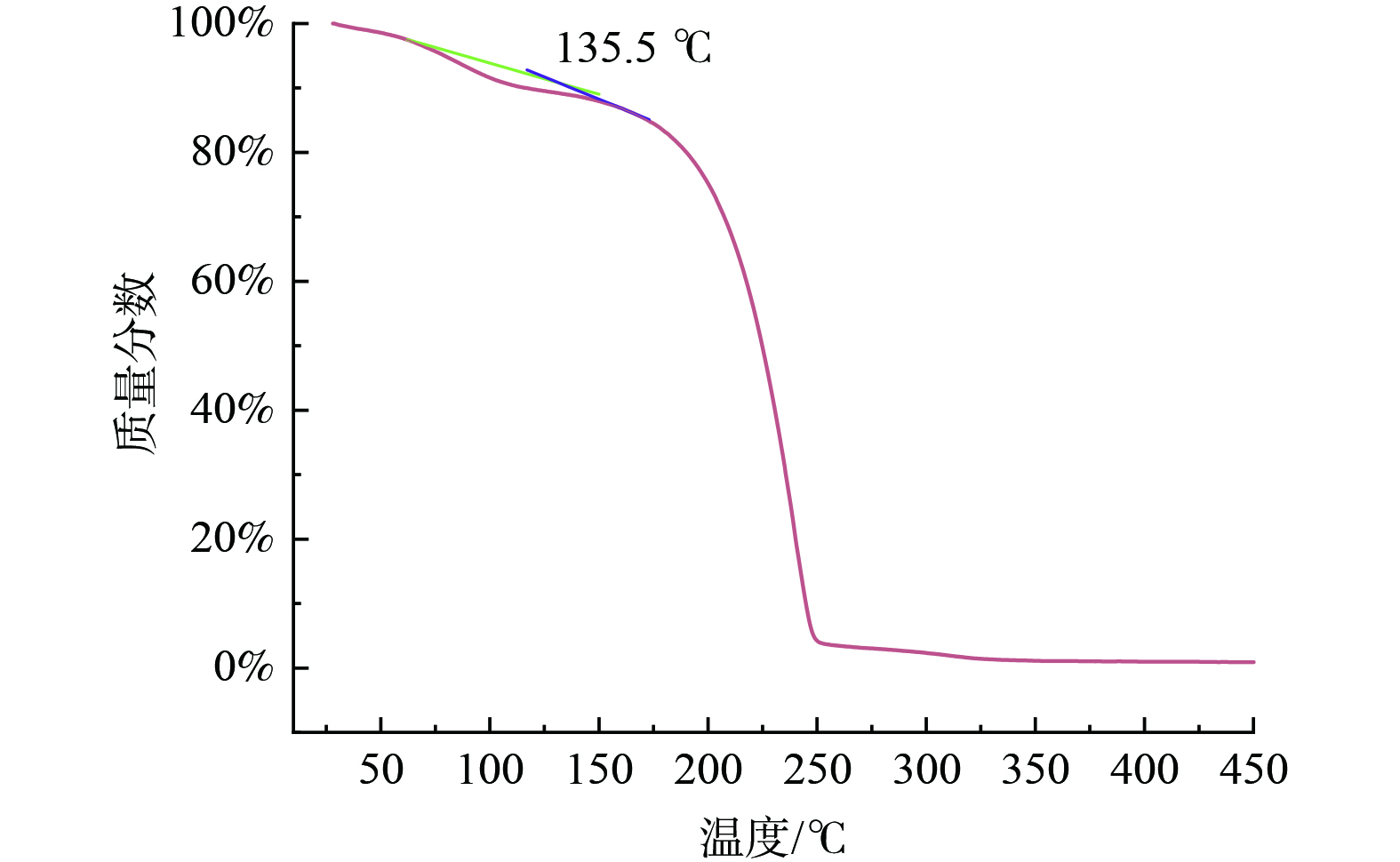
1) 13C NMR和TGA分析。图3和图4分别为[TETAH][3-Br-PhO]离子液体的13C NMR谱图以及采用热重分析法 (TGA) 测得的曲线图。由图3可知,所用溶剂为氘代甲醇 (CD3OD) ,在13C NMR光谱中49.00化学位移处出现信号,不干扰最终的结果分析。分析表征数据为,13C NMR (600 MHz,CD3OD,25 ℃,TMS) ,δ (ppm) :164.04、131.77、123.58、121.05、120.71、117.09、53.96、52.03、41.65、39.82、38.89。证明实验成功合成[TETAH][3-Br-PhO]离子液体,并非TETA和3-Br-PhOH的混合溶液。根据图4,[TETAH][3-Br-PhO]离子液体在135.5 ℃失重约10%,满足解吸温度 (80~120 ℃) 要求。
-
1) 温度对[TETAH][3-Br-PhO]-PMDETA-H2O吸收性能的影响。温度显著影响吸收体系的黏度,进而影响对CO2的吸收动力学[20]。因此测量了[TETAH][3-Br-PhO]及[TETAH][3-Br-PhO]-PMDETA-H2O黏度随温度的变化,列于表2中。黏度随温度升高均有降低趋势,[TETAH][3-Br-PhO]在25 ℃下黏度高达667.6 mPa∙s,添加PMDETA后体系黏度明显降至50 mPa∙s以下。吸收体系较低的黏度有利于高效传质,相比于纯[TETAH][3-Br-PhO]更便于CO2在体系中扩散。
为研究温度对[TETAH][3-Br-PhO]-PMDETA-H2O吸收性能的影响,首先对
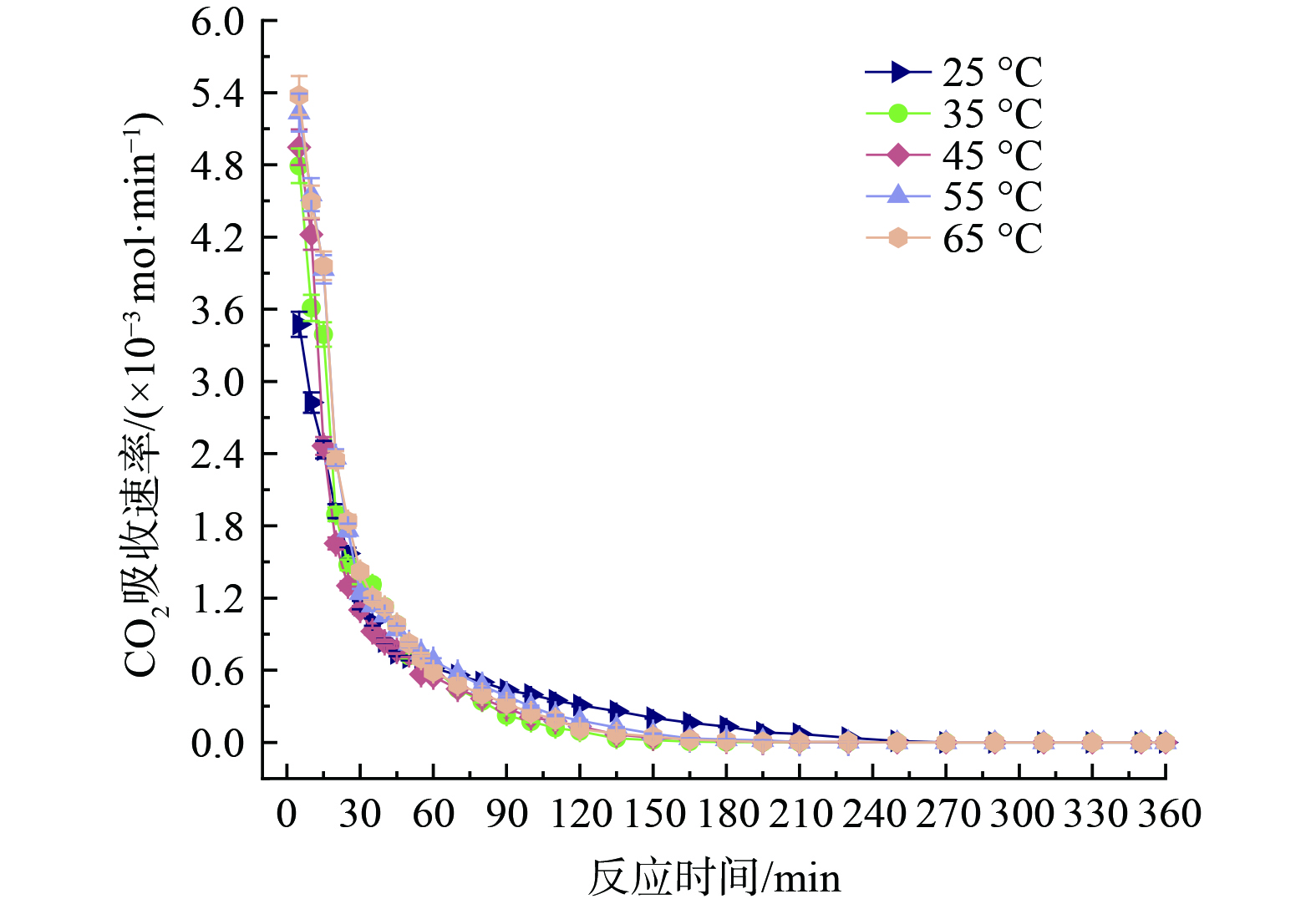
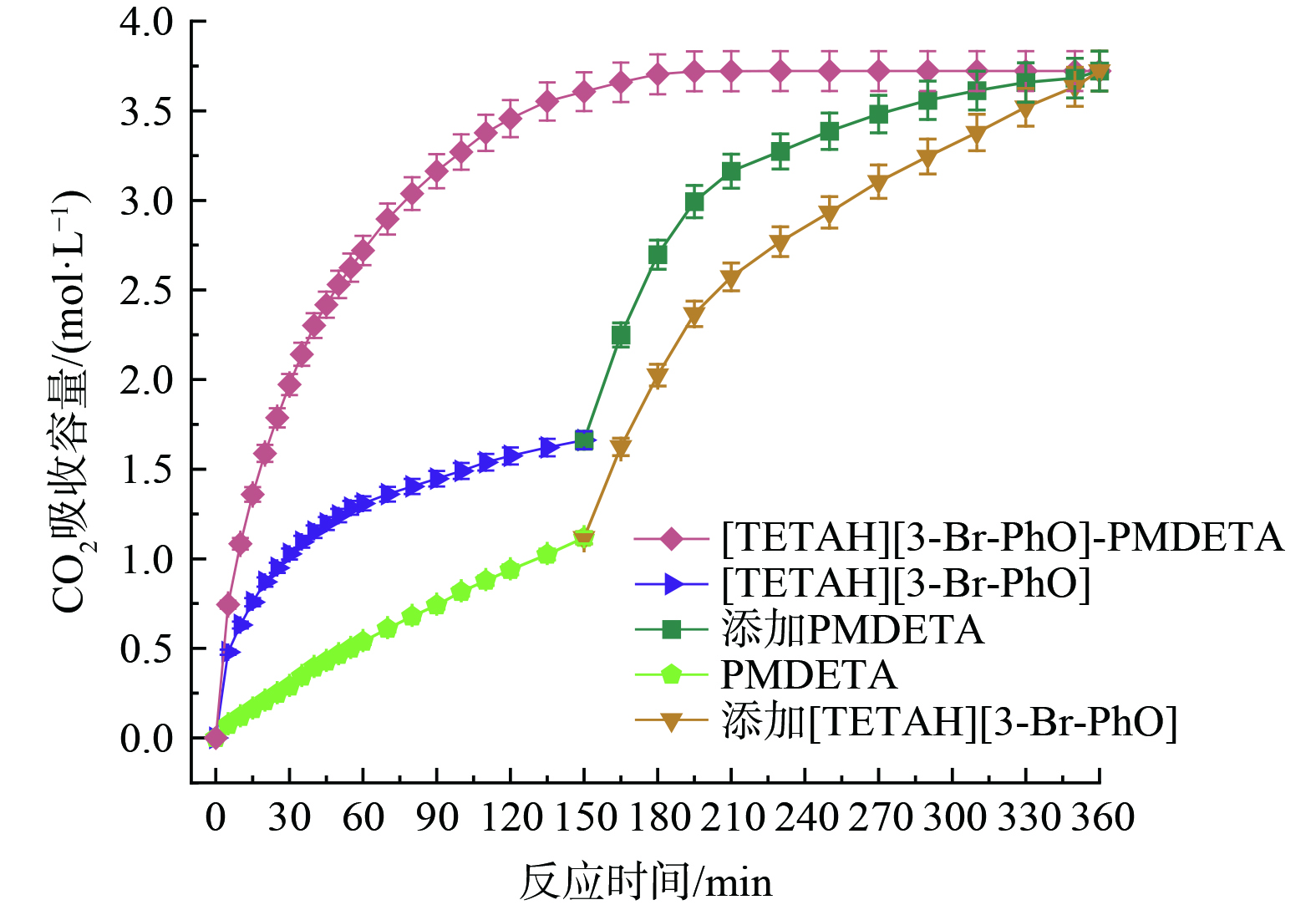
$ {\phi }_{1}:{\phi }_{2} $ =3∶7的[TETAH][3-Br-PhO]-PMDETA-H2O吸收体系在25~65 ℃范围内考察了CO2吸收情况,结果如图5和图6所示。该体系的CO2吸收容量随温度升高而降低,但25、35、45、55和65 ℃条件下吸收容量差距并不显著,分别对应为3.27、3.21、3.00、2.80和2.61 mol∙L−1。表明温度与吸收容量呈负相关趋势,原因是CO2与胺基反应为酸碱中和放热反应,降低温度有利于反应进行。值得注意的是,初始吸收速率高的体系对应饱和吸收容量不一定高,这是因为温度升高会降低体系黏度并加快分子热运动,但随着吸收容量增加会导致黏度增大,从而产生阻碍。所以反应前30 min在65 ℃条件下吸收速率最快,25 ℃条件下吸收速率最慢。体系在前30 min处于高速吸收阶段,随着反应进行,体系变浑浊并出现油状沉淀,从而吸收速率减缓经历低速吸收阶段。随后油状沉淀逐渐增多聚集,在150 min左右开始沉淀完全,最后在360 min左右达到吸收饱和。考虑到25 ℃下体系具有最高吸收容量,所以选择25 ℃为后续优化实验反应温度。
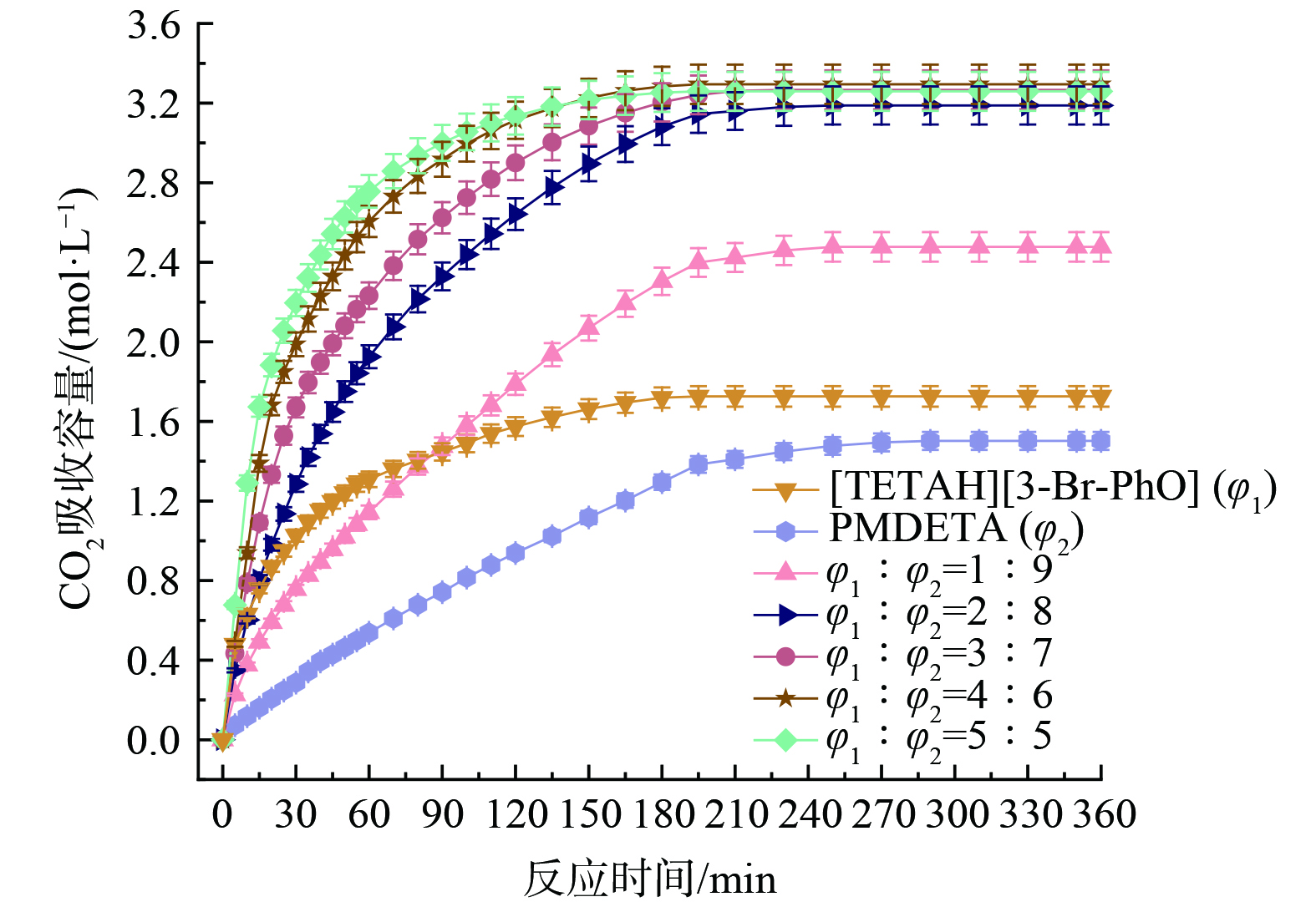
2) 体系配比对[TETAH][3-Br-PhO]-PMDETA-H2O吸收性能的影响。由于[TETAH][3-Br-PhO]与PMDETA的体系配比会影响CO2吸收性能,为此开展了体系配比优化实验,结果如图7和图8所示。根据[TETAH][3-Br-PhO] (曲线:[TETAH][3-Br-PhO] φ1) 和PMDETA (曲线:PMDETA φ2) 单独对CO2的吸收结果,判断体系中[TETAH][3-Br-PhO]吸收CO2起到主要作用。
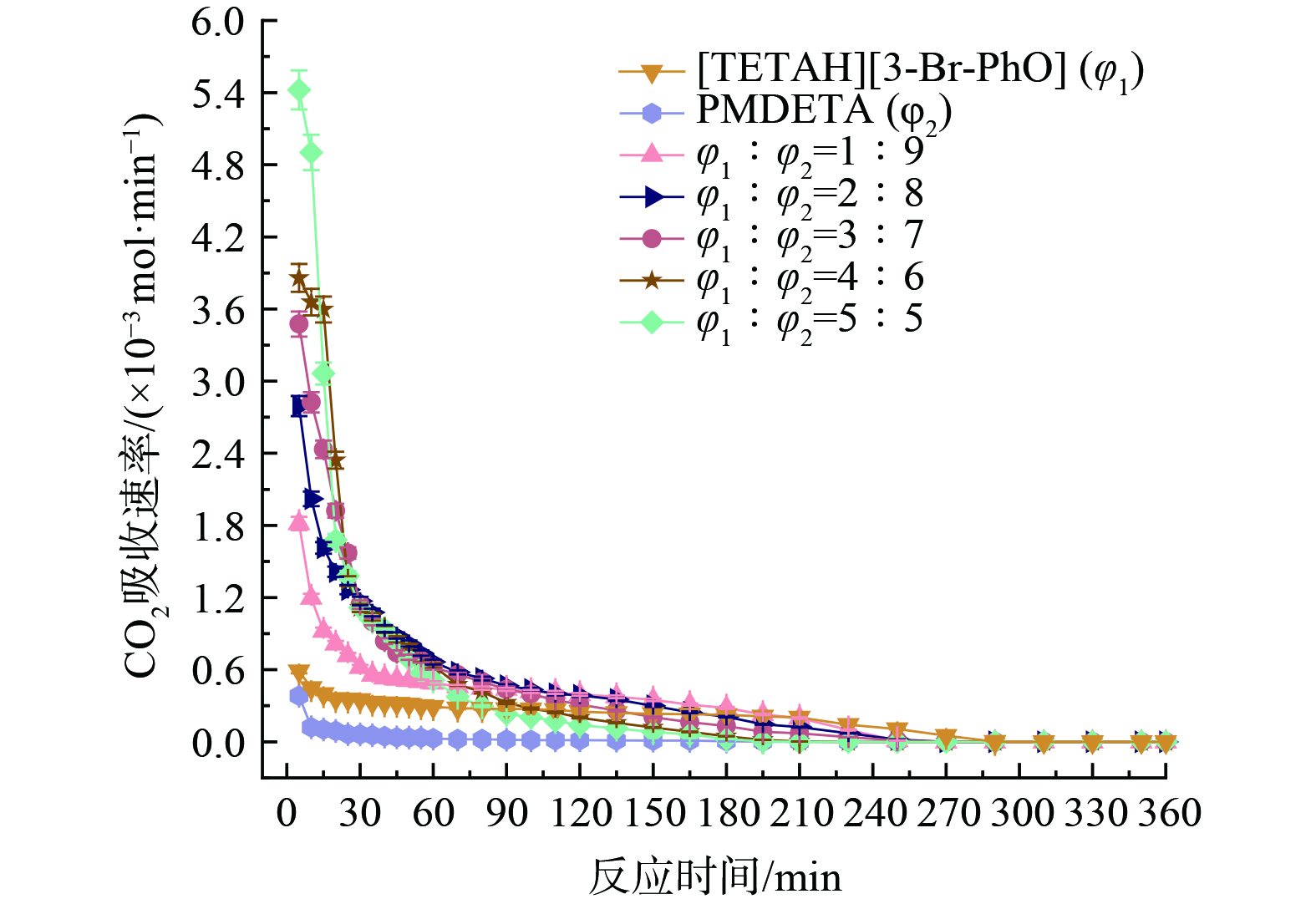
根据图7和图8,随着[TETAH][3-Br-PhO]体积增加,体系吸收容量从2.48 mol∙L−1增加至3.29 mol∙L−1,然后下降成3.27 mol∙L−1。体积比为5∶5时吸收容量是1∶9时的1.3倍,并且体系吸收速率与[TETAH][3-Br-PhO]体积成正比关系。当[TETAH][3-Br-PhO]与PMDETA的体积比为4∶6时,CO2吸收容量达到最大值3.29 mol∙L−1,但是3∶7、4∶6和5∶5体积比下CO2吸收容量差距很小,甚至在吸收进行120 min内,体积比为5∶5的体系更有优势。分析原因是体积比为5∶5的体系内含有最多体积的[TETAH][3-Br-PhO],进而加快体系吸收CO2。并且,不同配比下的体系在前15 min都以较高吸收速率进行,之后迅速下降。在吸收30 min以后,体系到达低速吸收阶段,在360 min时吸收达到饱和。不同配比下体系吸收CO2的前后状态如图9所示。
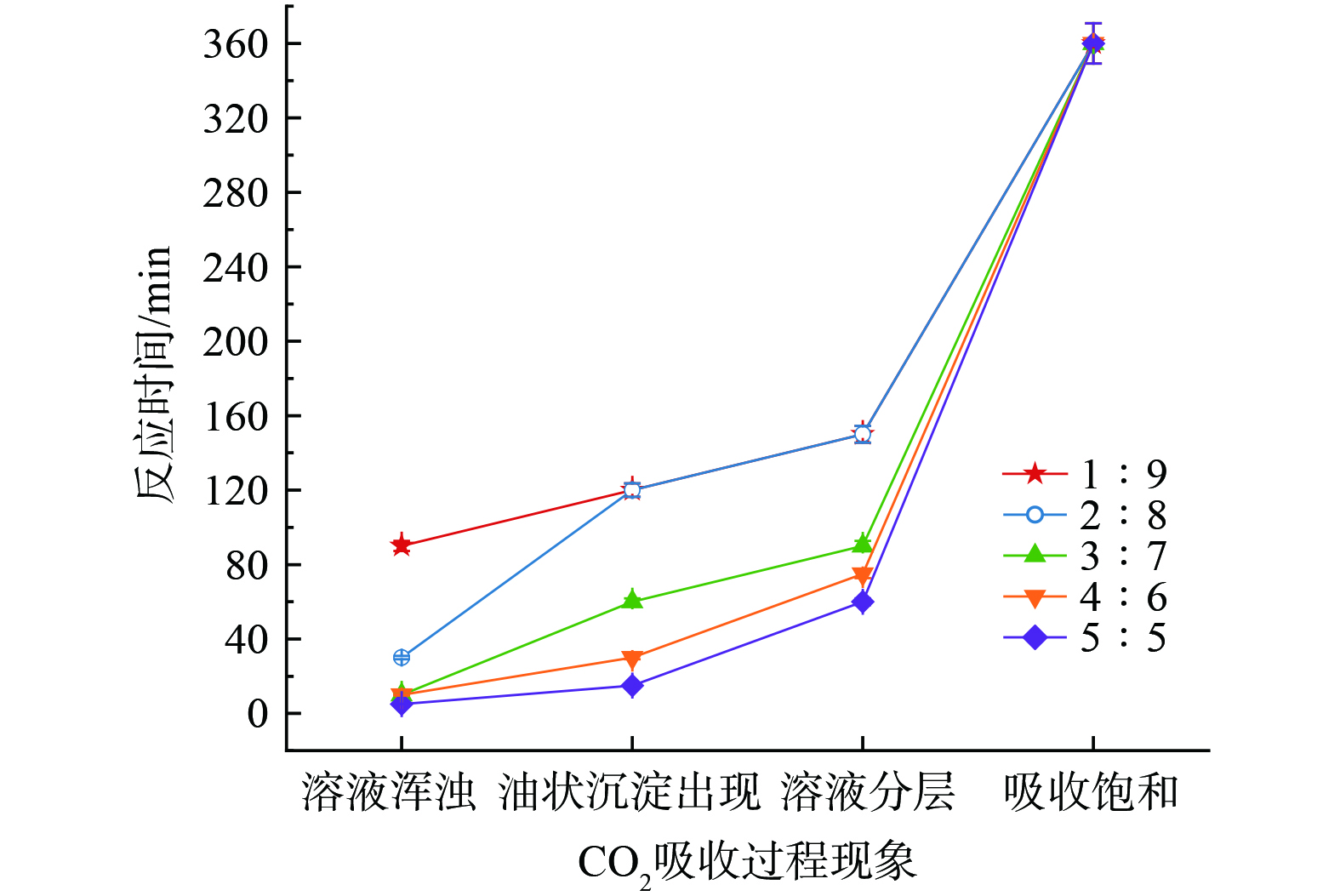
随着反应进行,吸收过程中出现不同程度的油状沉淀影响吸收速率,如图10和图11。根据图10,吸收CO2过程主要经历体系开始浑浊、油状沉淀出现后聚集、沉淀完全以及吸收饱和四个阶段。但单独使用[TETAH][3-Br-PhO]或PMDETA吸收CO2时,体系前后状态不发生变化。当[TETAH][3-Br-PhO]与PMDETA体积比为1∶9时,不出现油状沉淀,仅150 min时体系开始浑浊直至饱和,猜测体系内[TETAH][3-Br-PhO]体积直接影响油状沉淀生成。当[TETAH][3-Br-PhO]体积逐渐增加时,体系浑浊、油状沉淀出现后聚集和沉淀完全阶段的时间节点明显缩短,但吸收饱和时间均稳定在360 min。其中,体积比为3∶7、4∶6和5∶5的体系在吸收5~10 min时开始浑浊,而体积比为2∶8的体系在反应30 min时才开始浑浊。当吸收进行一段时间后油状沉淀出现并开始聚集下沉,体积比为2∶8的体系沉淀完全时间为150 min,体积比为5∶5的体系沉淀完全时间缩短至60 min。可见增加[TETAH][3-Br-PhO]体积,吸收过程各阶段时间明显缩短,吸收饱和时间略有缩短。同时,体系中油状沉淀体积随着[TETAH][3-Br-PhO]体积增加而增加,最多占体系的11vol%,如图11所示。
分析可能的原因是,体系中[TETAH][3-Br-PhO]起到主要吸收CO2作用,吸收容量及吸收速率均大于PMDETA吸收CO2。所以随着[TETAH][3-Br-PhO]体积增加,[TETAH][3-Br-PhO]和PMDETA体积比由1∶9变化至5∶5时,油状沉淀体积和体系饱和CO2吸收容量明显增加。同时,受到油状沉淀不完全溶解影响,溶液浑浊、油状沉淀出现后聚集和沉淀完全阶段的时间节点明显缩短。而吸收饱和时间均稳定在360 min的原因是,降低黏度作用的助溶剂PMDETA自身具有较缓慢的CO2吸收速率,延缓并稳定整个CO2吸收过程。另外,油状沉淀黏度明显大于体系黏度,一定程度上可能阻碍CO2溶解和传质效率,进而影响CO2吸收性能。因此,考虑[TETAH][3-Br-PhO]和PMDETA体积比对CO2的吸收影响,认为体积比4∶6是最佳吸收体系。
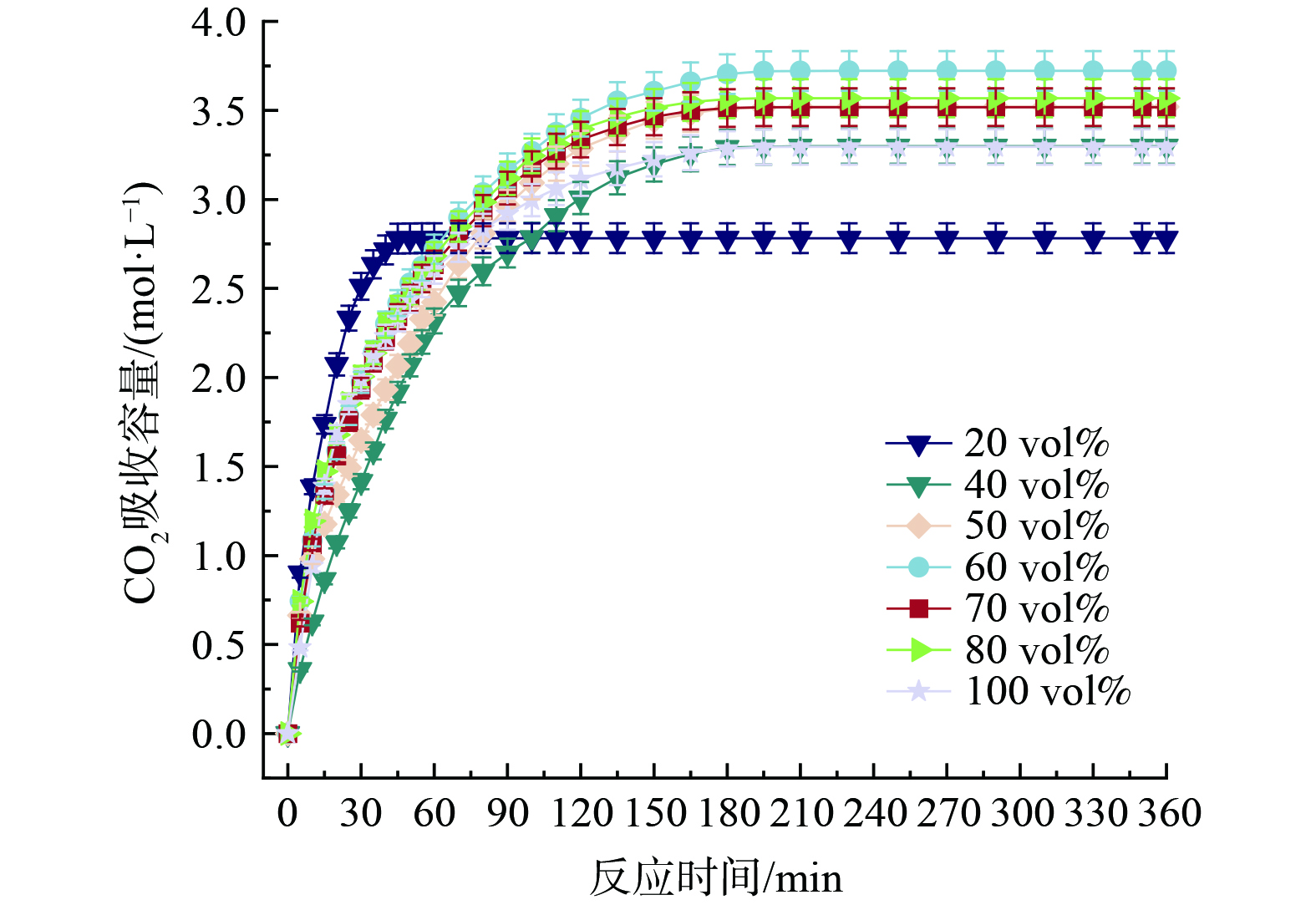
3) 含水量对[TETAH][3-Br-PhO]-PMDETA-H2O吸收性能的影响。图12是考察25 ℃、[TETAH][3-Br-PhO]与PMDETA的体积比为4∶6时添加不同体积去离子水量对体系CO2吸收性能的影响。由图12可知,随着去离子水体积增加,CO2吸收容量明显提高。添加20vol%去离子水时仅吸收CO2 2.78 mol∙L−1,继续添加去离子水至60vol%,此时CO2吸收容量达到最大值3.72 mol∙L−1,再添加去离子水为100vol%时CO2吸收容量下降至3.29 mol∙L−1。虽然提高体系含水量可明显提高体系对CO2的吸收容量,但并不认为添加去离子水越多越好。一定体积的去离子水能够促进[TETAH][3-Br-PhO]和PMDETA的相互作用并加强吸收CO2,但过量体积的去离子水会削弱[TETAH][3-Br-PhO]和PMDETA的相互作用,进而导致随着含水量的增加,体系CO2吸收容量呈现先升高后降低的趋势。
4) [TETAH][3-Br-PhO]与PMDETA间的相互作用。为探究氨基功能化离子液体[TETAH][3-Br-PhO]与助溶剂PMDETA在吸收CO2时的相互作用,在25 ℃下将[TETAH][3-Br-PhO]和PMDETA分别单独吸收CO2,一定时间后再分别添加PMDETA和[TETAH][3-Br-PhO]继续吸收CO2至饱和。根据图7和图8,由于[TETAH][3-Br-PhO]和PMDETA单独吸收的饱和时间较长,故在反应进行至150 min时添加剩余组分,最后得到[TETAH][3-Br-PhO]与PMDETA间的相互作用曲线如图13所示。
根据图13,单独使用[TETAH][3-Br-PhO]或PMDETA吸收CO2都难以被充分利用。[TETAH][3-Br-PhO]在前30 min以较高速率吸收CO2,随之减缓,150 min时吸收容量为1.66 mol∙L−1。原因是与TETA具有与CO2反应较高活性的伯胺基和仲胺基,使吸收初期速率快,随之减缓是由于[TETAH][3-Br-PhO]黏度会随着吸收反应进行而增大,加入PMDETA后,[TETAH][3-Br-PhO]得到有效稀释进而降低黏度,由此[TETAH][3-Br-PhO]和PMDETA共同吸收CO2直至饱和。而PMDETA对CO2的吸收速率和吸收容量却远低于[TETAH][3-Br-PhO],分析原因是PMDETA中的叔胺基与CO2的反应活性低于伯胺基和仲胺基,150 min时的吸收容量为1.11 mol∙L−1,且仅能在有水条件下与CO2低速反应。加入[TETAH][3-Br-PhO]后吸收速率明显增加,吸收容量随之提高,也表明体系中[TETAH][3-Br-PhO]吸收CO2起到主要作用。将[TETAH][3-Br-PhO]和PMDETA混合后吸收CO2,二者能够相互促进并以较快吸收速率吸收CO2直至饱和。
-
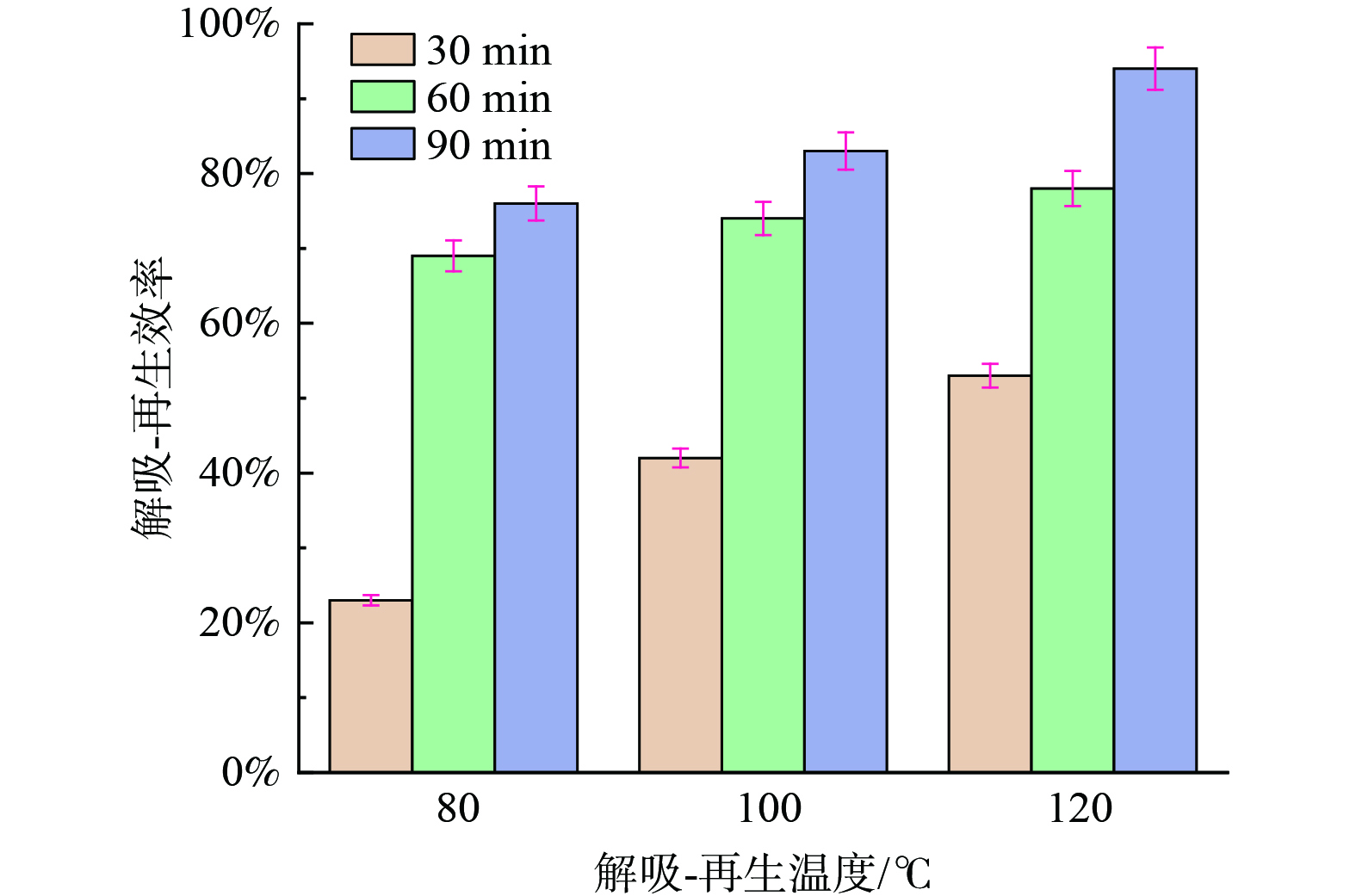
为考察[TETAH][3-Br-PhO]-PMDETA-H2O体系的循环再生性,分别测算得80、100和120 ℃以及30、60和90 min条件下的再生效率,如图14所示。当解吸温度从80 ℃提高至120 ℃时,再生效率提高1.34;当解吸时间从30 min提高至90 min时,80、100和120 ℃下再生效率分别从23%、42%、53%提高至76%、83%、94%。这是由于温度升高使分子热运动加快,有助于产物分解从而使体系释放出更多的CO2。同时,解吸时间的延长能够保证产物的充分分解,促使体系能够更高效的解吸CO2。在解吸温度和时间分别为120 ℃和90 min条件下经过5次循环吸收-解吸后,如图15所示。体系损失小于5wt%,再生效率保持在87%,CO2总吸收容量达到20.65 mol∙L−1,说明其循环再生性良好。
-
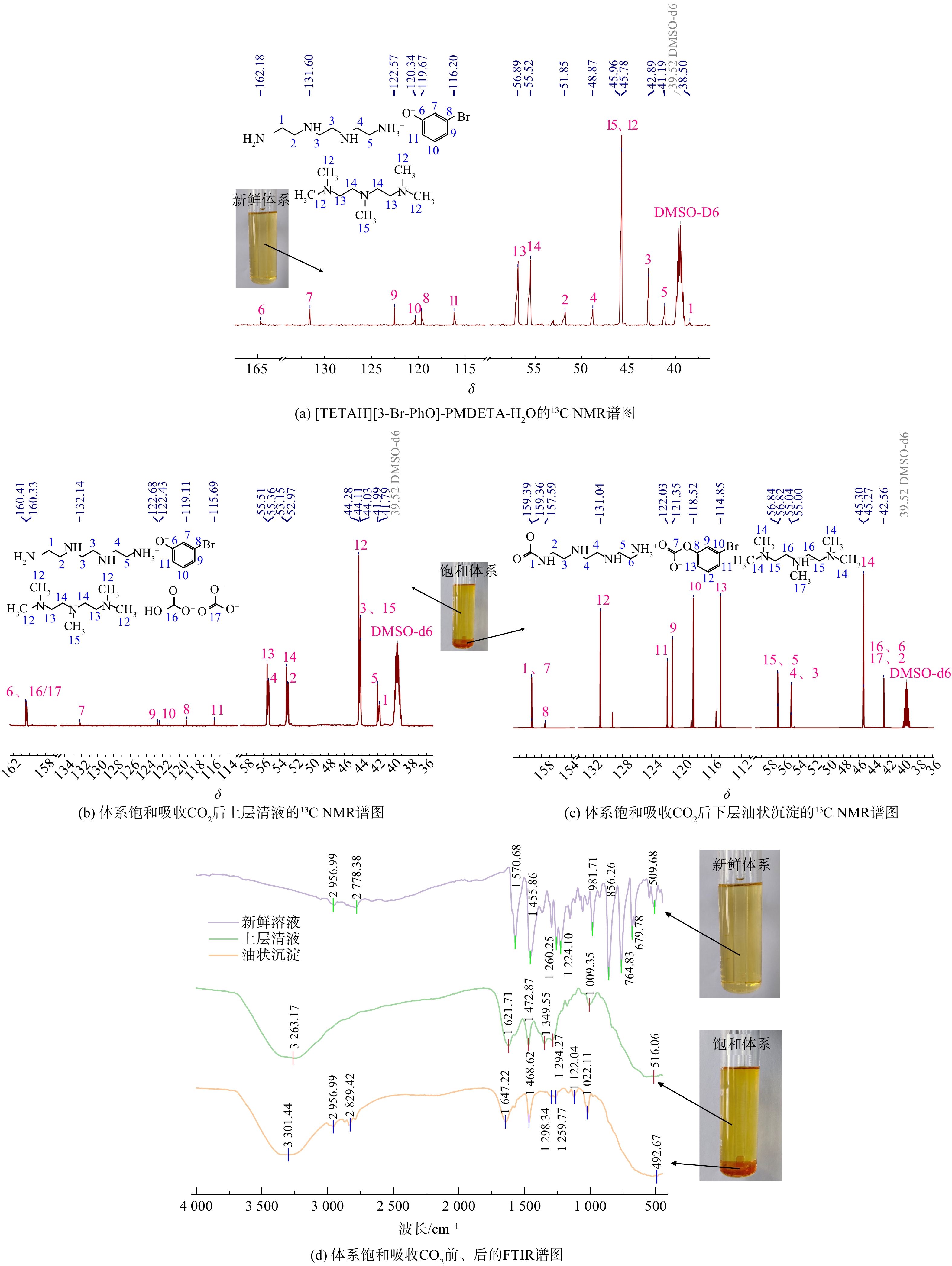
体系中不同物质的分子结构如图16所示,图16(a)~(c)和图16(d)别是体系吸收CO2前后的13C NMR和FTIR谱图。由图16(a),在新鲜[TETAH][3-Br-PhO]-PMDETA-H2O体系中,162化学位移处信号6为3-溴苯酚中连接酚羟基的碳原子。随着吸收进行,油状沉淀产生并开始聚集。根据图16(b),在清液中的160化学位移附近信号归属为HCO3−/CO32−物质,即PMDETA吸收CO2后生成HCO3−/CO32−物质存在于此。在油状沉淀中的157~160化学位移处信号归属于碳酸酯羰基碳和3-溴苯酚中连接酚羟基的碳原子,示于图16(c)。结合图16(d),在上层清液中,δ=1 621 cm−1存在羰基上的碳原子伸缩信号,说明生成了HCO3−/CO32−物质。同样,在油状沉淀中,δ=2 956 cm−1和2 829 cm−1存在较宽的N-H伸缩信号以及δ=1 571 cm−1存在羰基上的碳原子伸缩信号,说明有氨基甲酸酯或烷基碳酸酯的生成。
通过以上信息以及吸收实验现象,分析得到体系在吸收CO2反应的开始阶段为均相状态,随着反应进行体系开始浑浊,出现油状沉淀进而聚集下沉,这是由于[TETAH][3-Br-PhO]与CO2反应生成氨基甲酸酯或烷基碳酸酯位于油状沉淀中,当体系中[TETAH][3-Br-PhO]体积增加时,油状沉淀体积也会随之增加,反应过程见式(3)、(4)和(5) [21-22]。而助溶剂PMDETA吸收CO2后生成HCO3−,反应过程见式(6)和(7),部分水解成CO32−并与HCO3−共同存在于上层清液中[23-24]。
-
提出了一种氨基功能化离子液体[TETAH][3-Br-PhO]复配PMDETA的水基CO2吸收剂。通过开展[TETAH][3-Br-PhO]-PMDETA-H2O在不同条件下CO2吸收性能的实验研究,发现该吸收剂具有良好的吸收性能。当[TETAH][3-Br-PhO]与PMDETA体积比为4∶6,去离子水含量为60vol%,吸收温度为25 ℃时,该体系CO2吸收容量达到最大值3.72 mol∙L−1,远高于[TETAH][3-Br-PhO]和PMDETA单独吸收CO2的容量值。同时,该体系还具有良好的循环再生性能。在120 ℃加热解吸-再生90 min后,再生效率为94%。此条件下经过5次循环吸收-解吸后,再生效率保持在87%,CO2总吸收容量达到20.65 mol∙L−1。可见良好的吸收性能和高效的循环再生性能保证了该体系用于CO2吸收的可持续性。因此,[TETAH][3-Br-PhO]-PMDETA-H2O体系具有良好的CO2捕集和应用潜力。另外,根据13C NMR和FTIR光谱表征初步分析了该体系吸收CO2机理。但本工作目前处于实验室阶段,对工业化应用还需要进一步探索。
氨基功能化离子液体复配PMDETA吸收剂的制备及其捕集CO2实验
Preparation and CO2 capture experiment of amino-functionalized ionic liquid combined with PMDETA absorbent
-
摘要: 以三乙烯四胺 (TETA) 和3-溴苯酚 (3-Br-PhOH) 为原料,采用一步法合成氨基功能化离子液体三乙烯四胺-3-溴苯酚盐 ([TETAH][3-Br-PhO]) ,并添加助溶剂五甲基二乙烯三胺 (PMDETA) 溶液以及去离子水组成水基CO2吸收体系[TETAH][3-Br-PhO]-PMDETA-H2O用于CO2吸收。采用核磁共振碳谱 (13C NMR) 、傅里叶变换红外光谱 (FTIR) 和热重分析 (TGA) 进行表征,分析所合成氨基功能化离子液体的结构、热稳定性以及体系吸收CO2的反应机理。实验探究了反应温度、体系配比以及含水量对体系吸收CO2性能的影响。结果表明,当[TETAH][3-Br-PhO]与PMDETA的体积比为4∶6,去离子水含量为60vol%,吸收温度为25 ℃时,该体系的CO2吸收容量达到最大值3.72 mol∙L−1,远高于[TETAH][3-Br-PhO]和PMDETA单独吸收CO2的容量值。同时,在120 ℃加热解吸-再生90 min并经过5次循环吸收-解吸后,再生效率保持在87%,CO2总吸收容量达到20.65 mol∙L−1,具有良好的再生循环性能。该研究表明,氨基功能化离子液体复配溶剂对于CO2捕集具有较大的应用潜力。Abstract: The amino-functionalized ionic liquids ([TETAH][3-Br-PhO]) was synthesized using a one-step method from triethylenetetramine (TETA) and 3-bromophenol (3-Br-PhOH). A water-based CO2 absorption system, [TETAH][3-Br-PhO]-PMDETA-H2O, was created by mixing a PMDETA solution with deionized water as a co-solvent. Nuclear Magnetic Resonance Carbon Spectroscopy (13C NMR), Fourier Transform Infrared Spectroscopy (FTIR), and Thermogravimetric Analysis (TGA) were utilized to characterize the structure and thermal stability of the synthesized amino-functionalized ionic liquids. Furthermore, these techniques were used to investigate the reaction mechanism of CO2 absorption in the system. The effects of reaction temperature, system ratio, and water content on the absorption performance of CO2 were investigated. The results indicated that using a volume ratio of 4∶6 for [TETAH][3-Br-PhO] to PMDETA, a deionized water content of 60vol%, and an absorption temperature of 25 °C, the CO2 absorption capacity of the system reached a maximum of 3.72 mol∙L−1. It was significantly higher than the CO2 absorption capacity of [TETAH][3-Br-PhO] and PMDETA alone. After undergoing heating desorption-regeneration at 120 °C for 90 min and completing 5 cycles of absorption-desorption, the regeneration efficiency remained at 87%. Additionally, the total CO2 absorption capacity reached 20.65 mol∙L−1, indicating excellent performance in the regeneration cycle. The research shows that the amino-functionalized ionic liquids mixed solvent has significant potential for capturing CO2.
-
Key words:
- CO2 capture /
- ionic liquids /
- absorption-desorption /
- regeneration /
- reaction mechanism
-

-
表 1 氨基功能化离子液体-PMDETA-H2O吸收体系配比
Table 1. Ratio of AFILs-PMDETA-H2O absorbent solution
编号 [TETAH][3-Br-PhO]
体积分数$ {\phi }_{1} $ PMDETA
体积分数$ {\phi }_{2} $ 去离子水
体积分数$ {\phi }_{3} $ $ {\phi }_{1}:{\phi }_{2} $ 1 10 90 100 1∶9 2 20 80 100 2∶8 3 30 70 100 3∶7 4 40 60 100 4∶6 5 50 50 100 5∶5 表 2 不同温度下的黏度对比 (100vol%H2O)
Table 2. Viscosity comparison at different temperatures
黏度/
(mPa∙s)[TETAH][3-Br-PhO]与PMDETA的体积比 [TETAH][3-Br-PhO] 1∶9 2∶8 3∶7 4∶6 5∶5 PMDETA 25 ℃ 667.6 6.73 19.47 28.81 37.33 45.62 1.52 35 ℃ 403.1 3.17 12.31 20.10 26.06 31.82 — 45 ℃ 172.8 2.41 9.55 15.92 20.64 25.23 — -
[1] MORO C, FRANCIOSO V, LOPEZ-ARIAS M, et al. The impact of CO2 uptake rate on the environmental performance of cementitious composites: A new dynamic Global Warming Potential analysis[J]. Journal of Cleaner Production, 2020, 375: 134155. [2] WANG F, HARINDINTWALI J D, YUAN Z Z, et al. Technologies and perspectives for achieving carbon neutrality[J]. The Innovation, 2021, 2(4): 100180. doi: 10.1016/j.xinn.2021.100180 [3] REN H W, LIAN S H, WANG X, et al. Exploiting the hydrophilic role of natural deep eutectic solvents for greening CO2 capture[J]. Journal of Cleaner Production, 2018, 193: 802-810. doi: 10.1016/j.jclepro.2018.05.051 [4] ZHANG R, ZHANG X W, YANG Q, et al. Analysis of the reduction of energy cost by using MEA-MDEA-PZ solvent for post-combustion carbon dioxide capture (PCC)[J]. Applied Energy, 2017, 205: 1002-1011. doi: 10.1016/j.apenergy.2017.08.130 [5] GUO C, CHEN S Y, ZHANG Y C. A 13C NMR study of carbon dioxide absorption and desorption in pure and blended 2-(2-aminoethylamine)ethanol (AEEA) and 2-amino-2-methyl-1-propanol (AMP) solutions[J]. International Journal of Greenhouse Gas Control, 2014, 28: 88-95. doi: 10.1016/j.ijggc.2014.06.025 [6] BARZAGLI F, MANI F, PERUZZINI M. A comparative study of the CO2 absorption in some solvent-free alkanolamines and in aqueous monoethanolamine (MEA)[J]. Environmental Science & Technology, 2016, 50(13): 7239-7246. [7] DU Y, WANG Y K, ROCHELLE G T. Piperazine/4-hydroxy 1-methylpiperidine for CO2 capture[J]. Chemical Engineering Journal, 2017, 307: 258-263. doi: 10.1016/j.cej.2016.08.095 [8] ZHANG S H, SHEN Y, WANG L D, et al. Phase change solvents for post-combustion CO2 capture: Principle, advances, and challenges[J]. Applied Energy, 2019, 239: 876-897. doi: 10.1016/j.apenergy.2019.01.242 [9] 杨菲, 刘苗苗, 陆诗建, 等. 适用于烟气CO2捕集的相变吸收剂研究进展[J]. 低碳化学与化工, 2023, 48(2): 113-120. [10] DONG H, YUAN X L, WANG Y L, et al. Preparation of two-dimensional nanoconfined ionic liquid membrane and its molecular mechanism of CO2 separation[J]. Chemical Engineering Science, 2024, 283: 119393. doi: 10.1016/j.ces.2023.119393 [11] ZENG Q T, HUI Y H, WANG Y T, et al. An efficient synthesis of 2-aminothiophenes via the Gewald reaction catalyzed by enzymes in ionic liquids[J]. Journal of Molecular Structure, 2023, 1294(2): 136511. [12] MORITA M, HOSOYA T, MIYAFUJI H. CO formation from glucose and cellulose as treated in ionic liquids[J]. Carbohydrate Research, 2023, 534: 108961. doi: 10.1016/j.carres.2023.108961 [13] WALDEN P. Molecular weights and electrical conductivity of several fused salts[J]. Materials Science, 1914, 8(6): 405-422. [14] BLANCHARD L A, HANCU D, BECKMAN E J, et al. Green processing using ionic liquids and CO2[J]. Nature, 1999, 399(6731): 28-29. [15] LIU F, SHEN Y, SHEN L, et al. Sustainable ionic liquid organic solution with efficient recyclability and low regeneration energy consumption for CO2 capture[J]. Separation and Purification Technology, 2021, 275: 119123. doi: 10.1016/j.seppur.2021.119123 [16] CAPLOW M. Kinetics of carbamate formation and breakdown[J]. Journal of the American Chemical Society, 1968, 90(24): 6795-6803. doi: 10.1021/ja01026a041 [17] DANCKWERTS P V. The reaction of CO2 with ethanolamines[J]. Chemical Engineering Science, 1979, 34: 443-446. doi: 10.1016/0009-2509(79)85087-3 [18] JING G H, QIAN Y H, ZHOU X B, et al. Designed and screened of multi-amino-functionalized ionic liquid solution for CO2 capture by quantum chemical simulation[J]. ACS Sustainable Chemical Engineering, 2017, 6: 1182-1191. [19] ZHAN X H, LV B H, YANG K X, et al. Dual functionalized ionic liquid biphasic solvent for carbon dioxide capture: high efficiency and energy saving[J]. Environmental Science & Technology, 2020, 54(10): 6281-6288. [20] SEMA T, NAAMI A, FU K, et al. Comprehensive mass transfer and reaction kinetics studies of CO2 absorption into aqueous solutions of blended MDEA-MEA[J]. Chemical Engineering. Journal. 2012, 209: 501-512. [21] 陈阳. 多位点功能化离子液体吸收剂的研制及其捕集CO2规律研究[D]. 武汉: 华中科技大学, 2017. [22] SHI G L, CHEN K H, WANG Y T, et al. Highly efficient synthesis of quinazoline-2, 4(1H, 3H)-diones from CO2 by hydroxyl functionalized aprotic ionic liquids[J]. ACS Sustainable Chemical & Engineering, 2018, 6: 5760-5765. [23] ZHOU X B, JING G H, LIU F, et al. Mechanism and kinetics of CO2 absorption into an aqueous solution of a triamino-functionalized ionic liquid[J]. Energy & Fuels, 2017, 31(2): 1793-1802. [24] LIU F, SHEN Y, SHEN L, et al. Novel amino-functionalized ionic liquid/organic solvent with low viscosity for CO2 capture[J]. Environmental Science & Technology 2020, 54(6): 3520-3529. -



 下载:
下载: