-
随着我国城镇居民生活水平的提高,人民对猪肉类食品的需求逐年增加。规模化生猪养殖业的快速发展产生了大量养猪废水。然而,其污染强度高,资源化水平低的特点难以满足我国养殖业双碳目标的发展要求。厌氧发酵技术可通过厌氧微生物的一系列代谢过程将有机物转化为清洁能源甲烷,是一类重要的污废水低碳处理技术[1]。其中,厌氧膜生物反应器(anaerobic membrane bioreactor, AnMBR)基于厌氧发酵与膜分离原理相结合,可实现可控式分离水力停留时间(hydraulic retention time,HRT)与污泥停留时间(sludge retention time,SRT);膜截留可延长废水中难降解污染物的停留时间,强化其水解过程,保证出水水质的同时提升了系统能源回收效率[2]。WANG等[3]研究表明,在21.2 g·(L·d)−1(以COD计)的高有机负荷(organic load rate,OLR)情况下,AnMBR处理养猪废水可以实现90.1%的COD去除率;PU等[4]研究发现,AnMBR有着稳定的COD去除率(约90%),远高于升流式厌氧污泥床反应器的60%,可实现更高效的甲烷回收效率;BU等[5]应用AnMBR处理猪粪废水实现了96%的COD去除率,且相较于单一的连续搅拌槽式反应器(continuous stirred-tank reactor,CSTR)可提高83%的甲烷产率;YANG等[6]构建了一个处理养猪废水的高效AnMBR系统,通过优化SRT/HRT比值,在HRT为1.0 d,OLR为4.7 g·(L·d)−1(以VS计)时,依然保持稳定的甲烷产量。可见,与常规甲烷发酵系统相比,应用AnMBR处理养猪废水在污染物去除与甲烷回收效率等方面均具有一定先进性。
养猪废水中含有大量的蛋白、尿素等富氮物质,且高浓度有机物在厌氧发酵水解阶段过程中会产生大量的氨氮[7]。诸多研究表明,畜禽养殖废水中过高的氨氮浓度会对厌氧微生物产生毒性,抑制菌群代谢活性,进而降低厌氧发酵效能[8, 9]。当总氨氮(total ammonia,TAN)质量浓度达到1 500~7 000 mg·L−1时,可能会导致厌氧发酵过程不稳定[10];当系统中铵根离子(NH4+)质量浓度达到3 000 mg·L−1时,产甲烷过程会受到一定的抑制作用,当NH4+质量浓度达到3 300 mg·L−1时,产甲烷过程则会被完全抑制[11]。然而,也有研究认为经过一个适应期后,厌氧发酵系统的TAN抑制阈值可达3 000~6 000 mg·L−1[12-13]。针对氨氮抑制问题,向甲烷发酵系统中投加碳基、铁基等导电材料,可通过优化发酵菌群结构,加速互营微生物种间电子传递速率等作用机制,缓解氨氮对发酵菌群的毒性抑制,提升高浓度氨氮条件下的甲烷发酵效能。其中,生物炭作为一种制备简单、成本低廉的环境友好型材料,因其大规模应用对于碳减排的重要贡献而备受关注[14]。生物炭丰富的孔隙结构和氧化还原表面官能团以及优异的酸碱缓冲能力有利于强化厌氧发酵效能[15]。在氨氮质量浓度超过8.0 g·L−1的厌氧发酵系统中,椰子壳生物炭的投加可提高7.5%的甲烷产率[16];PAN等[17]将生物炭用于厌氧发酵系统中,与对照组相比FAN的浓度最高可降低58%,缓解了氨氮抑制;WANG等[18]发现,在氨氮抑制的厌氧发酵系统中,生物炭的投加增加了微生物的胞外电子传递(extracellular electron transfer,EET)能力,富集了Methanosarcina产甲烷古菌并上调了CO2还原产甲烷途径相关基因表达。
虽然已有关于厌氧发酵过程中氨氮抑制以及生物炭缓解效能的相关报道,但鲜有研究考察高浓度氨氮抑制条件下生物炭投加对AnMBR处理效能的调控作用及潜在作用机制。基于此,本研究构建了常规AnMBR与基于生物炭强化的AnMBR系统,考察了不同氨氮负荷条件下AnMBR处理养猪废水的甲烷发酵效能,基于污染物去除效率、甲烷产率、微生物代谢产物分泌及产甲烷活性等解析了生物炭调控对氨氮抑制的缓解效能及潜在作用机制。
-
本研究采用的厌氧微生物种泥来自西安市餐厨垃圾处理厂。养猪废水由取自陕西省周至县某中型生猪养殖场的新鲜猪粪稀释所得。分装称量猪粪后,立即于-20 ℃冰柜中冷冻保存,以防止酸化变质。猪粪使用时化冻且根据实验需求添加一定量的自来水稀释,使用破壁机充分混匀猪粪并使混合物均匀。为模拟养猪废水处理过程中的固液分离条件,使用50目(0.25 mm)的不锈钢筛网将稀释后的猪粪进行过滤。测定并调节基质的COD,额外投加氨氮后于基质罐中使用;基质罐内部装有搅拌器,外部连接4 ℃水浴装置,以保障基质均匀且理化特性稳定。实验中具体选取的种泥与反应器猪粪基质的理化性质见表1。
-
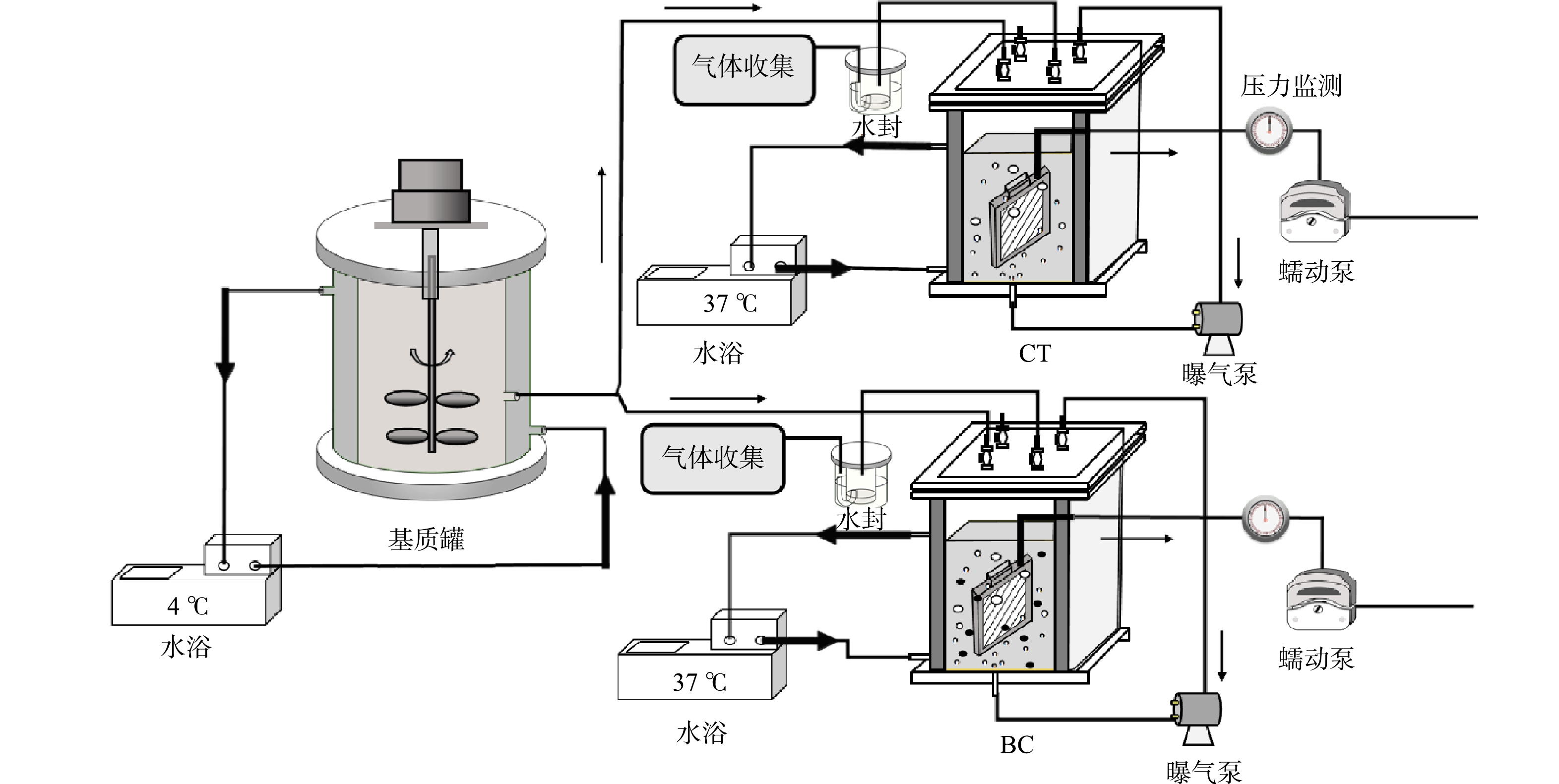
本研究所使用的反应器构型为浸没一体式AnMBR(图1),工作体积为2.5 L,反应温度为(37±1) ℃,所用膜组件为孔径0.22 μm的聚偏二氟乙烯(PVDF)平板膜(SINAP,中国),有效膜面积312 cm2。AnMBR的进水、出水均采用蠕动泵(BT100-2J;Longer,中国)自动控制,出水平均膜通量为0.35 L·(m2·h)−1,出水瞬时膜通量为2.11 L·(m2·h)−1。使用气体循环曝气泵(C50s-42T;Hilin Tech,中国)将沼气从反应器顶部以10 L·min−1的速度循环到底部,起到搅拌均匀传质及冲刷膜面以缓解膜污染的作用。
为探究生物炭投加对高浓度氨氮抑制发酵效能的缓解作用,设置2组AnMBR,分别为控制组(CT)和生物炭投加组(BC)。生物炭采用玉米芯为原材料,在马弗炉中500 ℃ 绝氧热解2 h后,筛选控制粒径为0.25~1.00 mm。BC的生物炭投加量10 g·L−1, 一次投加完成。在BC组排泥口处设置滤网以避免生物炭随排泥流失,因此,在系统运行过程无生物炭补充。2组AnMBR的HRT、SRT均控制为8 d、48 d,OLR为2.3 g·(L·d)−1。系统运行过程中,氨氮负荷的提升由外源投加NH4Cl的方式完成,运行分为3个阶段,分别为阶段Ⅰ、阶段Ⅱ和阶段Ⅲ,三阶段相应总氨氮质量浓度分别为0、3 000、4 500 mg·L−1。由此,2组AnMBR运行阶段分别命名为BC-0、CT-0、BC-3000、CT-3000、BC-4500与CT-4500。
-
系统运行过程中,定期对AnMBR出水的COD,VFA,多糖,蛋白含量及pH等进行检测;采用重铬酸钾快速消解分光光度法(DR6000,哈希水质分析仪器(上海)有限公司)测定COD;采用福林酚比色法测定蛋白;采用苯酚硫酸比色法测定多糖。AnMBR厌氧发酵产生的沼气由集气袋收集后以湿式气体流量计(LMF-1,Wale,中国)定时测量。沼气中H2、N2、CH4和CO2的测定采用气相色谱仪(GC-TCD;7900,天美,中国),柱箱温度为140 ℃,配备160 ℃的TCD检测器,载气为氩气。采用气相色谱仪(GC-FID,Panno,中国)配备火焰电离检测器测定VFA,色谱柱为DB-FFAP,进样口温度为260 ℃,柱箱以10 ℃·min−1的速率从100 ℃升温到200 ℃。采用苯酚-次氯酸盐光度法测定总氨氮(TAN),氨氮以铵根离子(NH4+)和游离氨2种形式共存于溶液中。游离氨质量浓度根据式(1)计算,FAN浓度受TAN浓度、pH和温度3个参数的影响。
式中:ρFA为游离氨质量浓度,mg·L−1;CNH4+-N为氨氮质量浓度,mg·L−1;pH为溶液的酸碱度;T为开尔文温度,K。
-
系统运行过程中,采用热处理法对氨氮负荷下污泥混合液中的可溶性微生物产物(soluble microbial product,SMP)与微生物胞外聚合物(extracellular polymeric substance,EPS)检测;根据与细胞结合的紧密程度,将EPS分为松散结合型(loosely bound-EPS,LB-EPS)与紧密结合型EPS(tightly bound-EPS,TB-EPS)。除了分析SMP和EPS的多糖、蛋白及COD含量外,采用三维荧光光谱(3D-EEM)对蛋白的化学成分及相对含量进行分析。
比较CT与BC的比产甲烷活性,研究在AnMBR中投加生物炭后微生物活性的变化;分别选用0.5、1.0、2.0、4.0、7.0 g·L−1 5个浓度的乙酸钠、丙酸钠、丁酸钠作为基质进行比产甲烷活性实验(specific methanogenic activity, SMA)。为最大限度地表征某负荷下的厌氧污泥产甲烷活性,实验所需污泥混合液皆来自稳定期的反应器内部;从AnMBR中取30 mL污泥混合液到120 mL血清瓶中,加入2 mL上述基质浓缩液;用氮气对每个血清瓶吹脱3 min,然后用丁基胶塞密封并用铝盖固定,于35 ℃水浴摇床中140 r·min−1培养,10 min后排除热胀冷缩带来的气压;每2~3 h测1次气量与气组,每组实验进行1 d。
-
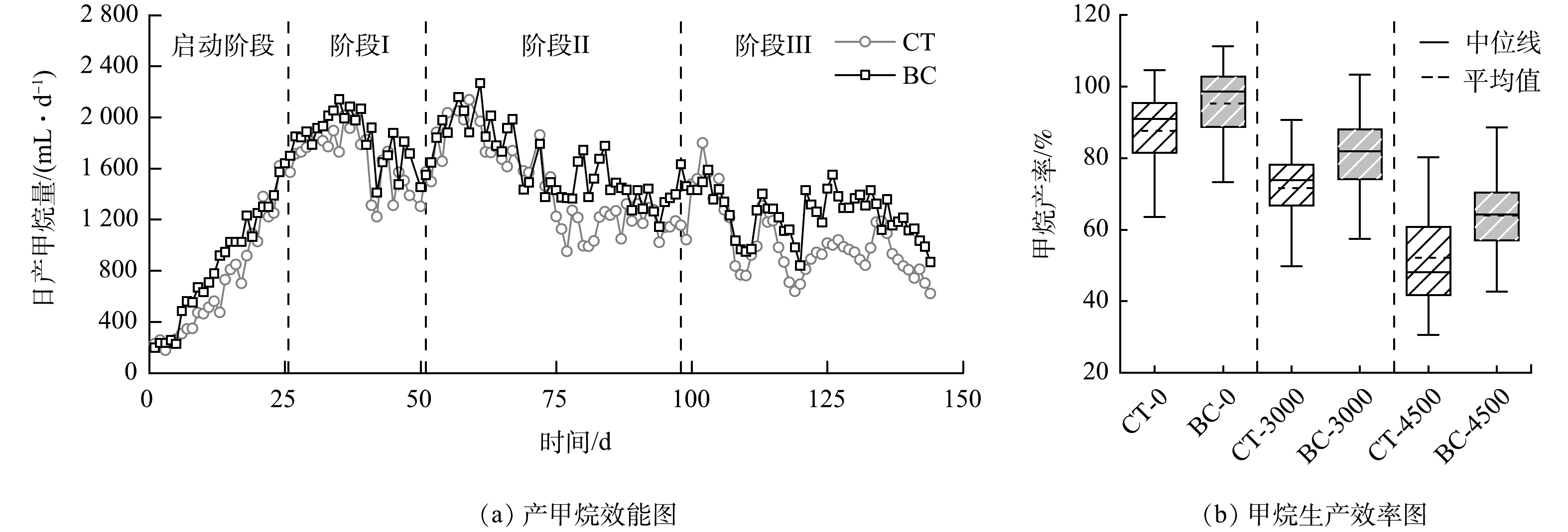
反应器启动后,随着氨氮负荷的提高,CT组的甲烷产量(图2(a))显著降低, CT-0、CT-3000、CT-4500甲烷产量分别为1.7、1.4、1.0 L·d−1,对应的甲烷产率为85.2%、73.2%、51.7%。高浓度的氨氮对产甲烷效能产生较大的影响,这可能是由于在氨氮抑制下微生物为了恢复活性而消耗了更多的有机物进行同化等过程[19]。投加生物炭可以缓解氨氮抑制的影响,在BC-0、BC-3000、BC-4500实验组各阶段保持有1.8、1.6、1.3 L·d−1的甲烷产量,对应甲烷产率为93.2%、83.7%、63.7%,相比于CT组分别升高了9.4%、11.7%、23.4%,表明生物炭可以促进AnMBR将更多的COD转化为CH4,提高了出水水质和资源利用效率;且随着氨氮负荷的提高,生物炭对产甲烷效能的促进作用更明显。有研究[3, 20]表明,生物炭的投加可以通过改善胞外电子传递途径、促进关键微生物的富集等途径提高甲烷产量。值得注意的是,即便受到高浓度氨氮抑制的影响,相较于传统厌氧发酵系统,AnMBR依然有着较高的甲烷产率和较好的稳定性(图2(b))。在氨氮为5.0 g·L−1的CSTR中,常规条件下仅有184.6 mL·g−1的甲烷产率,通过生物炭强化使甲烷产率提高了31.3%[21],相比于AnMBR依然有较大的差距。这可能由于AnMBR截留了功能性微生物,从而一定程度上维持了高浓度氨氮条件下的厌氧污泥代谢活性。
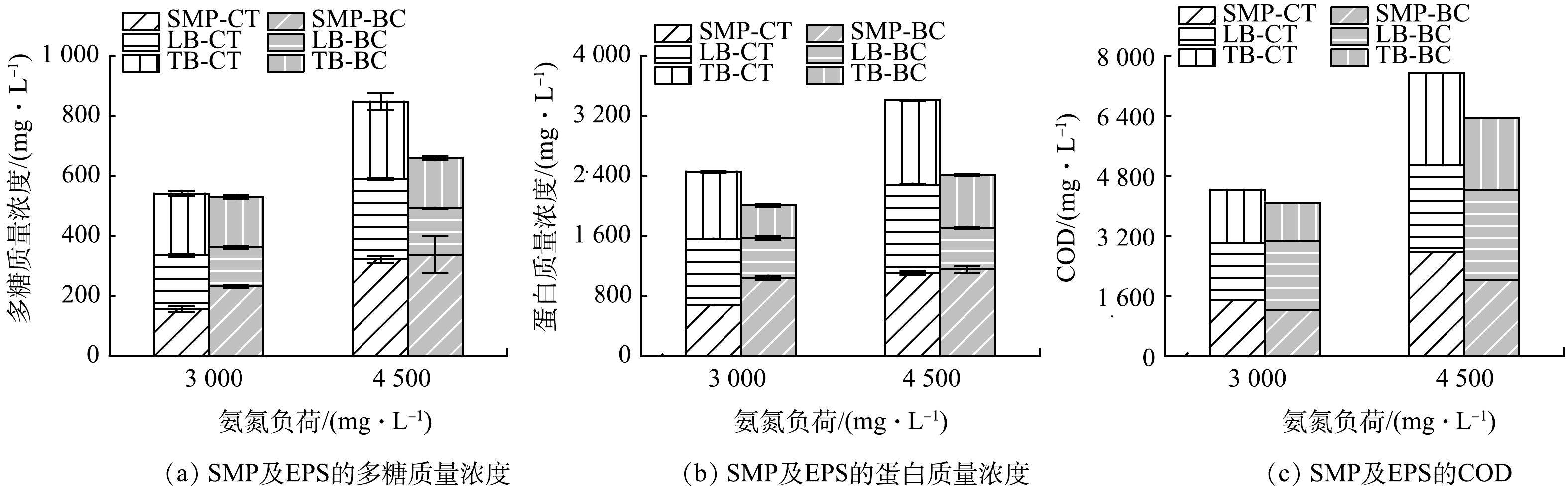
多糖和蛋白是养猪废水的主要成分,VFA是厌氧发酵过程的重要中间产物,基于上述组分及COD在养猪废水与AnMBR出水中的浓度变化,来评估不同氨氮负荷下2组AnMBR的处理效能。如图3所示,随着氨氮负荷的提高,CT组出水中COD分别为1.0、1.1、1.4 g·L−1,对应去除率为94.0%、93.7%、92.4%;与CT组相比,BC组COD分别为0.9、1.0、1.3 g·L−1,分别为94.6%、94.2%、92.7%。可见,氨氮浓度的上升对于AnMBR的COD去除率影响不大,无论是否生物炭投加,均可实现较理想的COD去除率。然而,随着氨氮负荷的提高,AnMBR出水中蛋白含量逐渐提高,在氨氮负荷分别为3 000 mg·L−1和4 500 mg·L−1时,CT组出水中蛋白的含量为555.5 mg·L−1和856.2 mg·L−1;生物炭的投加降低了出水中蛋白的含量,为537 mg·L−1和697 mg·L−1,使得蛋白去除率由CT组的80.2%~89.4%提高到BC的84.3%~90.2%。同时,AnMBR出水中多糖(图3(b))的含量随着氨氮负荷的提高而增长,在CT组中为51.5、63.4、143.7 mg·L−1,BC组中为51.2、59.9、123.2 mg·L−1;多糖的去除率维持一个较高的水平,在CT组中为85.9%~96.1%,在BC组中为89.0%~96.7%。诸多研究发现,AnMBR在处理养猪废水过程中对蛋白的去除能力低于多糖[22-23],这可能是由于在不利环境下蛋白更难降解,以及微生物分泌的蛋白类微生物产物随出水排出所致[24]。出水中VFA(图3(d))的含量维持在120 mg·L−1(以COD计)以下,说明该系统在运行过程中没有酸积累,且在运行过程中,系统的pH稳定在7.3~7.6(图3(d)),说明氨氮对VFA互营氧化过程的影响不是系统厌氧发酵效能下降的原因[25]。理论上,由于VFA生成速率与互营氧化消耗速率不平衡,VFA倾向于在高有机负荷条件下积累[26];但是除了系统运行参数的设置外,基质也是影响VFA积累的另一个因素。与餐厨垃圾等易腐有机废弃物相比,养猪废水的水解与酸化速率趋于平衡,因此,在本研究中,即使高浓度氨氮造成了一定程度的产甲烷效能下降,但并没有出现明显的VFA积累现象。
氨氮同时以铵根离子(NH4+)和游离氨(FAN) 2种形式共存于溶液中。为了进一步探究氨氮对AnMBR厌氧发酵的影响,本研究测算了在厌氧发酵过程中NH4+与FAN的浓度变化。FAN是一种毒性较高的物质,且被普遍认为是导致厌氧发酵过程受到抑制的主要原因[27-28]。然而,LI等[29]研究表明,FAN的变化只反映了沼气产量的变化而并非是对产甲烷菌活性抑制的决定因素。FAN浓度受TAN浓度、pH和温度3个参数的影响,这些因素共同决定了FAN在溶液中的浓度。在本研究中,AnMBR厌氧污泥中NH4+的浓度(图4(a))随着氨氮负荷的增加由345.9~469.7 mg·L−1逐渐提高到4 966.4~5 218.7 mg·L−1,CT组与BC组差别不大;由于氨氮负荷提高后,AnMBR需至少经过1个HRT才能达到与基质相同浓度的氨氮,所以NH4+的浓度表现为逐渐上升。有研究表明,质量浓度在40~45 mg·L−1的FAN对产甲烷过程有抑制作用[30-31];在本研究中,随着氨氮负荷的增加,FAN(图4(b))的质量浓度由15.7~35.18 mg·L−1提高到123.4~125.5 mg·L−1,在氨氮负荷为3 000 mg·L−1后,经过1个HRT(8 d),FAN的质量浓度达到51.9~81.5 mg·L−1,AnMBR开始受到明显的抑制,这与产甲烷效能开始下降的结果一致。有研究[32]进一步指出,由于古菌有着坚固的细胞膜而仅受到来自被动扩散的FAN的影响,细菌同时受到FAN与NH4+的氨氮胁迫,所以FAN的浓度更能反映厌氧发酵系统的产甲烷效能变化。另外,生物炭为一次投加,且对氨氮的吸附效果有限(平均吸附量为20.7 mg·g−1)[18],对比CT组,生物炭的投加并没有显著降低BC组的氨氮浓度,说明生物炭并不是通过吸附作用来缓解氨氮抑制。
-
在不利的环境条件下,微生物可能通过加速分泌代谢产物(SMP和EPS)以起到保护自身与提高物质传递效率的作用[33]。本研究对不同氨氮负荷条件下2组AnMBR中微生物分泌SMP和EPS的强度与组成成分进行了分析。结果表明,CT-3000组中SMP、LB、TB的COD由1 503.6、1 527.9、1 404.3 mg·L−1分别提高到CT-4500的2 767.9、2 307.7、2 457.8 mg·L−1(图5(c));生物炭的投加可降低代谢产物的分泌,在氨氮负荷由3 000 mg·L−1提升至4 500 mg·L−1时,BC组SMP、LB、TB的COD由1 234.5、1 830.2、1 024.5 mg·L−1提高到2 017.4、2 399.2、1 921.9 mg·L−1。BC-3000相对于CT-3000,SMP和EPS的COD值分别降低了17.9%~27.0%; BC-4500相对于CT-4500,SMP和EPS的COD值降低了21.8%~27.1%。三维荧光光谱分析进一步表明,高浓度氨氮抑制条件主要促进了芳香族蛋白类代谢产物的分泌,说明这类代谢产物的分泌可能与微生物在不利环境条件下的应激自我保护机制有关[34-36]。生物炭的投加缓解了氨氮抑制对微生物的影响,降低了代谢产物的生成,这可能是由于生物炭表面的多孔结构可为微生物附着性生长提供保护性场所,避免微生物直接暴露于高浓度氨氮环境中,产生毒性抑制[37-38];另一方面,也可能与生物炭介导DIET过程,使得互营细菌-产甲烷古菌间能够通过更高效的电子传递方式实现代谢,从而免于过度分泌并借助代谢产物实现代谢过程有关[39-40]。
-
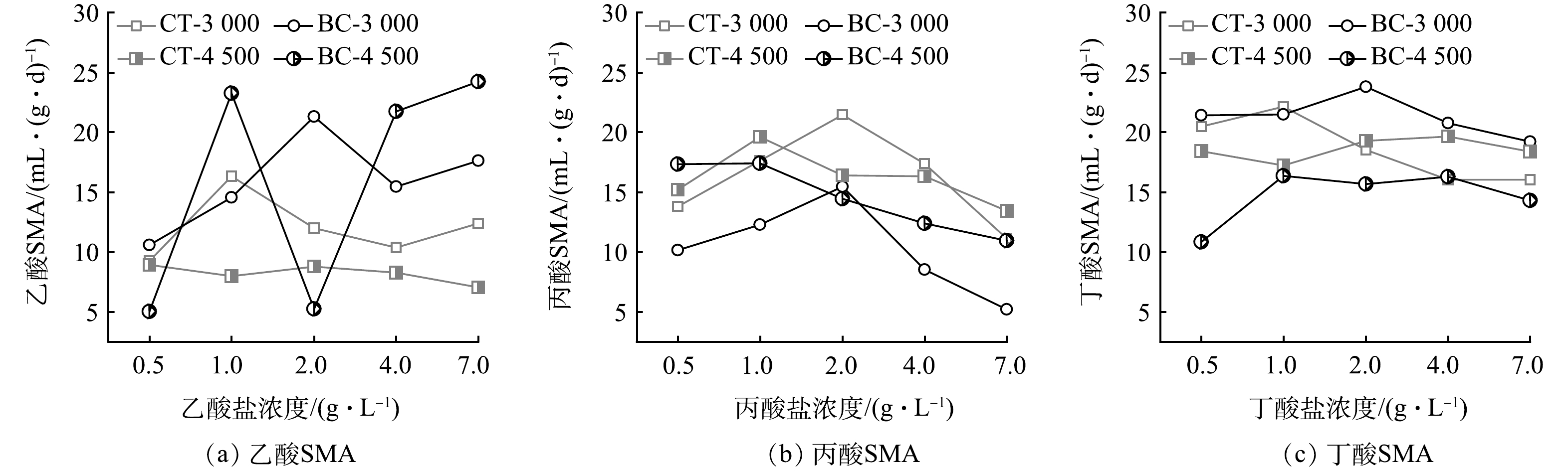
AnMBR在不同的运行条件下,系统内厌氧污泥微生物活性会随着氨氮负荷的不同而产生变化,对系统运行效能有显著影响,同时一定程度上反映AD系统的厌氧发酵效能。考虑到产甲烷阶段是厌氧发酵4个阶段中的限速步骤,因此,对不同负荷条件下比产甲烷活性进行研究是必要的[41]。结果表明,随着氨氮负荷的提高,CT组的乙酸SMA由16.3 mL·(g·d)−1(以VS计)下降到8.9 mL·(g·d)−1(图6(a));丙酸SMA由21.5 mL·(g·d)−1下降到19.6 mL·(g·d)−1(图6(b));丁酸SMA由22.1 mL·(g·d)−1下降到19.7 mL·(g·d)−1(图6(c))。由于氨氮可以通过抑制VFA互营氧化过程降低系统厌氧发酵效能,并且乙酸SMA受氨氮抑制明显,所以AnMBR对乙酸盐的低利用能力可能是导致产甲烷效能下降的主要原因。不同的是,生物炭的投加维持甚至提高了AnMBR中乙酸SMA的水平,为24.2 mL·(g·d)−1,相较于CT-3000组提高了2.4倍;生物炭可以通过介导DIET过程使氢营养型产甲烷古菌直接利用VFA氧化细菌产生的电子,将CO2还原为CH4[18],这一过程提高了电子传递效率,使得BC组相较于CT组产生更高的SMA。另外,CT组中最大乙酸SMA对应的COD由1.0 g·L−1下降为0.5 g·L−1,最大丙酸SMA对应的COD由2.0 g·L−1下降为1.0 g·L−1,表明随着氨氮抑制程度的提高,由于不利的热力学影响,厌氧发酵系统对于VFA的利用能力逐渐下降,氨氮显著抑制了甲烷的生成[32];然而,BC组中最大乙酸SMA对应的COD由2.0 g·L−1提高为7.0 g·L−1,表明生物炭的投加提高了AnMBR对高浓度乙酸盐的利用能力, 这可能与生物炭对乙酸营养型产甲烷菌的选择性富集有关[42-43]。
-
1)高质量浓度(3 000~4 500 mg·L−1)氨氮可显著抑制AnMBR处理养猪废水过程中的甲烷产率,在不同氨氮负荷下,生物炭投加可将系统的甲烷产率提升9.4%~23.4%,证明了生物炭缓解氨氮抑制的调控效能。
2)在氨氮抑制条件下,菌群的EPS分泌强度显著提升,生物炭可能为微生物提供不利环境条件下的庇护场所,并协助互营微生物完成高效代谢过程等方式,缓解高浓度氨氮抑制条件下EPS的过度分泌。
3)菌群的比产甲烷活性随着氨氮负荷含量的提高而降低,高浓度氨氮使得乙酸产甲烷活性降低了45.4%,而生物炭投加可显著提升高氨氮浓度下菌群的乙酸代谢活性,这可能是生物炭缓解氨氮抑制的主要作用机制。
高浓度氨氮对厌氧膜生物反应器处理养猪废水的抑制影响及生物炭缓解效能
Inhibitory effect of high concentration ammonia nitrogen on anaerobic membrane bioreactor treating swine wastewater and the associated biochar regulation performances
-
摘要: 针对养猪废水中高浓度氨氮对甲烷发酵过程的抑制问题,研究了不同氨氮负荷对厌氧膜生物反应器(anaerobic membrane bioreactor,AnMBR) 处理养猪废水效能的影响及生物炭投加的缓解调控效能。结果表明,在(外源)氨氮负荷为0、3 000、4 500 mg·L−1时,常规AnMBR的甲烷产率分别为85.2%、73.2%、51.7%,生物炭的投加可使甲烷产率提高至93.2%、83.7%、63.7%。随着氨氮负荷的提高,AnMBR对污染物的去除能力下降:氨氮负荷由0提升至4 500 mg·L−1时,常规AnMBR对养猪废水中化学需氧量(chemical oxygen demand , COD)、多糖、蛋白的去除率分别由94.0%、95.7%、86.8%降低至92.4%、90.2%、80.2%,生物炭的投加使其去除率维持在92.7%、91.6%、84.3%。进一步研究发现,高浓度游离氨(free ammonia,FAN)的存在是导致AnMBR发酵效能下降的主要原因。且在氨氮负荷由3 000 mg·L−1提高到4 500 mg·L−1时,常规AnMBR污泥中的可溶性微生物产物(soluble microbial products,SMP)与微生物胞外聚合物(extracellular polymeric substances,EPS)含量分别提高了84.1%、62.6%,其中,芳香族蛋白类是微生物代谢产物的主要物质;生物炭的投加减少了17.9%~27.1%的SMP含量与2.6%~9.3%的EPS含量。挥发性脂肪酸(volatile fatty acids, VFA)甲烷发酵活性实验结果表明,高浓度氨氮主要抑制了乙酸降解微生物的比产甲烷活性,而生物炭的投加利于维持污泥在高氨氮浓度下的乙酸盐降解产甲烷能力。本研究结果可为缓解高浓度氨氮抑制AnMBR处理养猪废水效能的应用提供参考。Abstract: To investigate the ammonia inhibition during anaerobic digestion of swine wastewater, the effects of ammonia loading rates on anaerobic membrane bioreactor (AnMBR) treating swine wastewater, and the regulatory benefits of biochar addition were studied. The results showed that when the ammonia load rate was 0, 3 000 and 4 500 mg·L−1, the methane yields of conventional AnMBR were 85.2%, 73.2% and 51.7%, respectively, which could increase to 93.2%, 83.7% and 63.7% by adding biochar. With the increase of ammonia loading rate, the pollutant removal ability of AnMBR decreased. As the ammonia loading rate increased from 0 to 4 500 mg·L−1, the removal rates of chemical oxygen demand (COD), polysaccharide and protein in swine wastewater by conventional AnMBR decreased from 94.0%, 95.7% and 86.8% to 92.4%, 90.2% and 80.2%, respectively, while they maintained at 92.7%、91.6%、84.3% after biochar addition, respectively. Further study showed that the existence of high concentration of free ammonia (FAN) was the main reason for the decline of fermentation efficiency of AnMBR. When the ammonia loading rate increased from 3 000 mg·L−1 to 4 500 mg·L−1, the contents of soluble microbial products (SMP) and extracellular polymeric substances (EPS) in conventional AnMBR sludge increased by 84.1% and 62.6%, respectively, of which aromatic proteins were the main substances of microbial metabolites. Addition of biochar reduced SMP content by 17.9%~27.1% and EPS content by 2.6%~9.3%. The experimental results of methane fermentation activity of volatile fatty acids (VFA) showed that high concentration of ammonia nitrogen mainly inhibited the specific methanogenic activity of acetic acid-degrading microorganisms, while biochar addition was conducive to maintain the ability of sludge to degrade acetate and produce methane at high concentration of ammonia nitrogen. The results of this study provide some suggestions for the operation of AnMBR treating swine wastewater with high ammonia nitrogen contents.
-

-
表 1 种泥与基质的理化性质
Table 1. Physicochemical properties of the mud and matrix
种泥/基质 总固体含量/
(g·L−1)挥发固体
含量/(g·L−1)pH 总COD /
(g·L−1)溶解性COD/
(g·L−1)多糖/
(g·L−1)蛋白/
(g·L−1)挥发性脂肪酸/
(mg·L−1)种泥 24.6±0.3 11.4±0.4 7.7±0.1 — — — — 24.6±0.3 基质 24.6±0.3 21.5±0.4 7.9±0.1 18.0±2.3 1.4±0.1 4.5±0.1 1.4±0.2 32.4±1.4 -
[1] YANG S, DENG D, LIANG D, et al. Progress in anaerobic digestion models[J]. Science & Technology Review, 2012, 30(25): 74-79. [2] HU Y S, CAI X L, DU R D, et al. A review on anaerobic membrane bioreactors for enhanced valorization of urban organic wastes: Achievements, limitations, energy balance and future perspectives[J]. Science of the Total Environment, 2022, 820: 153284. [3] WANG G J, LIU G H, YAO G F, et al. Biochar-assisted anaerobic membrane bioreactor towards high-efficient energy recovery from swine wastewater: Performances and the potential mechanisms[J]. Bioresource Technology, 2023, 369(11): 128480. [4] PU Y H, TANG J L, ZENG T, et al. Pollutant removal and energy recovery from swine wastewater using anaerobic membrane bioreactor: A comparative study with up-flow anaerobic sludge blanket[J]. Water, 2022, 14(15): 2438. [5] BU F, DU S Y, XIE L, et al. Swine manure treatment by anaerobic membrane bioreactor with carbon, nitrogen and phosphorus recovery[J]. Water Science and Technology, 2017, 76(8): 1939-1949. [6] YANG Z Y, WANG W, LIU C, et al. Mitigation of ammonia inhibition through bioaugmentation with different microorganisms during anaerobic digestion: Selection of strains and reactor performance evaluation[J]. Water Research, 2019, 155: 214-224. [7] SUN Y J, ZHAO J J, CHEN L L, et al. Methanogenic community structure in simultaneous methanogenesis and denitrification granular sludge[J]. Frontiers of Environmental Science & Engineering, 2018, 12(4): 1-9. [8] CHEN J L, ORTIZ R, STEELE T W J, et al. Toxicants inhibiting anaerobic digestion: A review[J]. Biotechnology Advances, 2014, 32(8): 1523-1534. [9] ZHANG Y, ZAMUDIO CAñAS E M, ZHU Z W, et al. Robustness of archaeal populations in anaerobic co-digestion of dairy and poultry wastes[J]. Bioresource Technology, 2011, 102(2): 779-785. [10] MUSA M A, IDRUS S. Physical and biological treatment technologies of slaughterhouse wastewater: A review[J]. Sustainability, 2021, 13(9): 4656. [11] HAJARNIS S R, RANADE D R. Inhibition of methanogens by n- and iso-volatile fatty acids[J]. World Journal of Microbiology & Biotechnology, 1994, 10(3): 350-351. [12] GIULIANO A, BOLZONELLA D, PAVAN P, et al. Co-digestion of livestock effluents, energy crops and agro-waste: Feeding and process optimization in mesophilic and thermophilic conditions[J]. Bioresource Technology, 2013, 128: 612-618. [13] SAWAYAMA S, TADA C, TSUKAHARA K, et al. Effect of ammonium addition on methanogenic community in a fluidized bed anaerobic digestion[J]. Journal of Bioscience and Bioengineering, 2004, 97(1): 65-70. [14] 张佩云, 赵丹阳, 丁丽姿, 等. 高温条件下生物炭强化丙酸与乙酸产甲烷的动力学及热力学机制[J]. 环境工程学报, 2023, 17(6): 1955-1966. doi: 10.12030/j.cjee.202301079 [15] YU L P, WANG Y Q, YUAN Y, et al. Biochar as electron acceptor for microbial extracellular respiration[J]. Geomicrobiology Journal, 2016, 33(6): 530-536. [16] CAI Y F, SHEN X, MENG X Y, et al. Syntrophic consortium with the aid of coconut shell-derived biochar enhances methane recovery from ammonia-inhibited anaerobic digestion[J]. Science of the Total Environment, 2023, 872: 162182. [17] PAN J T, MA J Y, LIU X X, et al. Effects of different types of biochar on the anaerobic digestion of chicken manure[J]. Bioresource Technology, 2019, 275: 258-265. [18] WANG G, FU P, ZHANG B, et al. Biochar facilitates methanogens evolution by enhancing extracellular electron transfer to boost anaerobic digestion of swine manure under ammonia stress[J]. Bioresource Technology, 2023, 388: 129773. [19] ZHANG H, YUAN W D, DONG Q, et al. Integrated multi-omics analyses reveal the key microbial phylotypes affecting anaerobic digestion performance under ammonia stress[J]. Water Research, 2022, 213: 118152. [20] WANG G J, ZHU J L, XING Y, et al. When dewatered swine manure-derived biochar meets swine wastewater in anaerobic digestion: A win-win scenario towards highly efficient energy recovery and antibiotic resistance genes attenuation for swine manure management[J]. Science of the Total Environment, 2022, 803: 150126. [21] FOTIDIS I A, WANG H, FIEDEL N R, et al. Bioaugmentation as a Solution To Increase Methane Production from an Ammonia-Rich Substrate[J]. Environmental Science & Technology, 2014, 48(13): 7669-7676. [22] CHENG H, HIRO Y, HOJO T, et al. Upgrading methane fermentation of food waste by using a hollow fiber type anaerobic membrane bioreactor[J]. Bioresource Technology, 2018, 267: 386-394. [23] YU D W, ZHANG J Y, CHULU B, et al. Ammonia stress decreased biomarker genes of acetoclastic methanogenesis and second peak of production rates during anaerobic digestion of swine manure[J]. Bioresource Technology, 2020, 317: 124012. [24] MUHAYODIN F, FRITZE A, ROTTER V S. A review on the fate of nutrients and enhancement of energy recovery from rice straw through anaerobic digestion[J]. Applied Sciences-Basel, 2020, 10(6): 2047. [25] WU X H, ZHOU Y W, LIANG M X, et al. Insights into the role of biochar on the acidogenic process and microbial pathways in a granular sulfate-reducing up-flow sludge bed reactor[J]. Bioresource Technology, 2022, 355: 127254. [26] LI Q, LIU Y Q, YANG X H, et al. Kinetic and thermodynamic effects of temperature on methanogenic degradation of acetate, propionate, butyrate and valerate[J]. Chemical Engineering Journal, 2020, 396: 125366. [27] 胡崇亮, 张栋, 戴翎翎,等. 厌氧消化过程氨抑制研究进展[J]. 环境工程, 2016, 34(12): 23-27. [28] CHEN H, WANG W, YAN H, et al. Ammonia inhibition on anaerobic digestion and control strategy: A review[J]. Environmental Science and Technology, 2016, 39(9): 88-95. [29] LI N, XUE Y G, CHEN S S, et al. Methanogenic population dynamics regulated by bacterial community responses to protein-rich organic wastes in a high solid anaerobic digester[J]. Chemical Engineering Journal, 2017, 317: 444-453. [30] XU S Y, WANG C Y, SUN Y Y, et al. Assessing the stability of co-digesting sewage sludge with swine manure under different mixing ratios[J]. Waste Management, 2020, 114: 299-306. [31] BELMONTE M, HSIEH C-F, FIGUEROA C, et al. Effect of free ammonia nitrogen on the methanogenic activity of swine wastewater[J]. Electronic Journal of Biotechnology, 2011, 14(3): 2. [32] ZHANG N, PENG H J, LI Y, et al. Ammonia determines transcriptional profile of microorganisms in anaerobic digestion[J]. Brazilian Journal of Microbiology, 2018, 49(4): 770-776. [33] WANG Y L, WANG D B, YI N, et al. Insights into the toxicity of troclocarban to anaerobic digestion: Sludge characteristics and methane production[J]. Journal of Hazardous Materials, 2020, 385: 121615. [34] MASSE A, SPERANDIO M, CABASSUD C. Comparison of sludge characteristics and performance of a submerged membrane bioreactor and an activated sludge process at high solids retention time[J]. Water Research, 2006, 40(12): 2405-2415. [35] ZHOU J, WANG J J, BAUDON A, et al. Improved fluorescence excitation-emission matrix regional integration to quantify spectra for fluorescent dissolved organic matter[J]. Journal of Environmental Quality, 2013, 42(3): 925-930. [36] MA J X, DAI R B, CHEN M, et al. Applications of membrane bioreactors for water reclamation: Micropollutant removal, mechanisms and perspectives[J]. Bioresource Technology, 2018, 269: 532-543. [37] ZHANG D Q, TRZCINSKI A P, KUNACHEVA C, et al. Characterization of soluble microbial products (SMPs) in a membrane bioreactor (MBR) treating synthetic wastewater containing pharmaceutical compounds[J]. Water Research, 2016, 102: 594-606. [38] ZHANG W J, CAO B D, WANG D S, et al. Influence of wastewater sludge treatment using combined peroxyacetic acid oxidation and inorganic coagulants re-flocculation on characteristics of extracellular polymeric substances (EPS)[J]. Water Research, 2016, 88: 728-739. [39] SU C Y, ZHAO L J, LIAO L M, et al. Application of biochar in a CIC reactor to relieve ammonia nitrogen stress and promote microbial community during food waste treatment[J]. Journal of Cleaner Production, 2019, 209: 353-362. [40] SU C, ZHENG P, LU Y, et al. Enhanced efficiency of an anaerobic reactor containing sepiolite or biochar for treatment swine wastewater[J]. China Environmental Science, 2017, 37(10): 3764-3772. [41] LI Q, QIAO W, WANG X C, et al. Kinetic characterization of thermophilic and mesophilic anaerobic digestion for coffee grounds and waste activated sludge[J]. Waste Management, 2015, 36: 77-85. [42] BI S J, QIAO W, XIONG L P, et al. Effects of organic loading rate on anaerobic digestion of chicken manure under mesophilic and thermophilic conditions[J]. Renewable Energy, 2019, 139: 242-250. [43] RUAN Y N, JIANG Y Z, LI M T, et al. Straw biochar-facilitated methanogenesis from acetic acid and ethanol: Correlation with electron exchange capacity[J]. Fermentation-Basel, 2023, 9(7): 584. -



 下载:
下载: