-
厌氧膜生物反应器(anaerobic membrane bioreactor,AnMBR)集成了膜分离与厌氧生物处理技术,是污水处理系统实现“水质可持续、能源回收、资源循环、环境友好”目标的重要途径[1-2]。然而,膜污染导致的通量降低和运行成本增加严重制约了AnMBR的稳定运行和工程应用[3]。大量研究表明,溶解性微生物产物(soluble microbial products,SMP)在膜表面及膜孔中的积累是导致膜污染的重要原因[4-5]。
SMP是微生物在正常的代谢活动及衰亡的过程中释放出的溶解性有机物[6],其组成复杂,主要包括蛋白质、多糖、脂类、核酸、腐殖酸、有机酸及氨基酸等物质[7]。不同进水水质、不同反应器类型及其运行条件等会引起SMP分子质量、可生物降解性、亲疏水性、螯合性、表面电荷强度等特性改变[8-10],从而影响其膜污染行为[11]。目前已有许多研究采用光谱与质谱等分析手段研究SMP的组成成分,并利用原子力显微镜和扫描电子显微镜等技术进一步解析其在膜表面形成污染层的结构特征[7,[12],揭示膜污染机理。但是,目前关于SMP膜污染行为的研究通常采用海藻酸钠、牛血清蛋白、富里酸等模型污染物[10,[13],AnMBR中SMP特性及膜污染行为的研究均基于实验室小试实验[14],这在很大程度上缺乏对实际生产的指导意义。
基于此,本研究以AnMBR处理市政污水中试系统中的SMP为研究对象,多尺度识别了其中的有机成分组成情况,解析了不同组分的膜截留特征,揭示了各组分的膜污染行为,以期为膜污染控制方法开发提供参考。
-
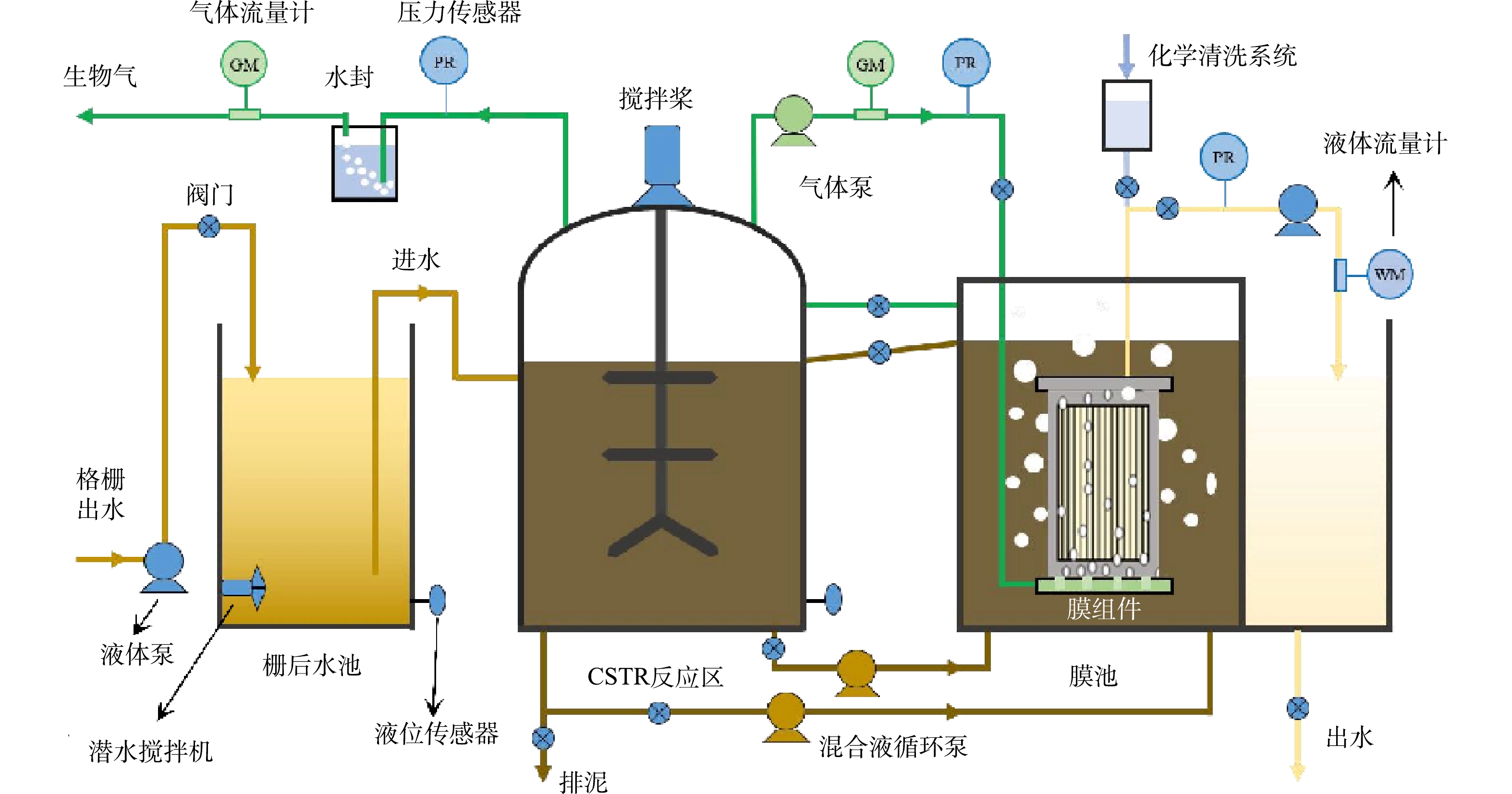
内置浸没式AnMBR示意图如图1所示,该中试系统包含总体积分别为10 m3和19 m3的栅后调节池和AnMBR系统,AnMBR系统由膜池和连续反应搅拌釜(continuous stirred tank reactor, CSTR)构成,二者由连接管和混合液循环泵连通。本研究AnMBR系统的有效运行体积为11.5 m³,膜组件为PVDF材质平板膜,有效膜面积为120 m2,膜孔径0.1 μm,膜抽吸模式为出水8 min、间歇2 min,膜平均通量为2.9~15.0 L·(m2·h)−1,生物气体回流流量为40~100 m3·h−1,生物气冲刷膜表面强度为0.3~0.8 m3·(m2·h)−1。AnMBR共设定6个运行工况,对应的HRT分别为24、18、16、12、10和8 h。进水水质情况如下:COD为(320±40) mg·L−1,SCOD为(145.0±37.7) mg·L−1,TS为(620±130) mg·L−1,TN为(60.5±2.5) mg·L−1, TP为(6.5±1.4) mg·L−1。进水采用西安思源学院污水处理厂格栅出水,污水类型主要为学校生活污水(包括生活污水、洗浴废水、冲厕废水和粉碎的学生食堂餐厨垃圾)。
-
SMP提取:每周采集反应器内污泥混合液,置于预冷至4 ℃的冷冻离心机,在4 500 r·min−1的条件下离心30 min得到上清液,经0.45 μm聚醚砜(PES)滤头过滤,滤液即SMP样品溶液。
超滤分级:SMP样品溶液采用切割分子质量(molecular weight,MW) 为100 000、50 000、10 000、5 000、500 Da的PES超滤膜(摩速,中国)依次过滤,然后测定每级分割膜滤液的溶解性有机碳(dissolved organic carbon,DOC)浓度。具体分级步骤如下:将所要使用的各级PES超滤膜在超纯水中浸没24 h;在0.15 MPa的恒压下,将MW=100 000 Da的PES超滤膜置于搅拌式超滤杯(MSC300,摩速,中国)过滤超纯水20 min;其后在0.1 MPa的压力下,用少量经0.45 μm PES滤头过滤的SMP样品溶液润洗超滤杯后再过滤,控制磁力搅拌器速度为150 r·min−1,为避免浓差极化的影响,进行连续搅拌且每张滤膜仅过滤50 mL水样,弃用前20 mL水样后收集的滤液即为<100 000 Da的SMP溶液。用MW=50 000 Da的PES超滤膜根据上述步骤过滤<100 000 Da的SMP溶液,即得到<50 000 Da的SMP溶液,后依次采用MW为10 000、5 000、500 Da的PES超滤膜过滤上一级的SMP溶液,即可得到不同分子质量的SMP溶液。
-
在1.2节经过超滤分级的滤液中滴加H2SO4酸化并用氮气吹扫,采用TOC分析仪(multi N/C 2100,Analytik Jena,德国)测定溶解性物质的总有机碳(total organic carbon,TOC),每个样品重复测定3次,相对标准偏差<2%[15]。
-
三维荧光光谱采用荧光分光光度计(Hitachi F-7000,日立,日本)测定,具体扫描参数如下:光电倍增管电压为700 V,发射(emission,Em)波长扫描范围为200~500 nm,激发(excitation,Ex)波长扫描范围为250~600 nm,扫描间隔均为2 nm,狭缝宽度为5 nm,扫描速度为12 000 nm·min−1。
本研究采用平行因子(parallel factor,PARAFAC)分析法根据3D-EEMs荧光峰的识别位置将物质主要分为7种类型,并根据MURPHY等[16]基于PARAFAC开发的OpenFluor荧光光谱共享平台,将分析所得组分与OpenFluor数据库中以往报道的组分在线匹配(Tucker's Congruence Coefficient,TCC≥0.95)[17]比对,确定荧光成分。
-
SMP样品经0.22 μm的滤膜过滤后用1 mol·L−1盐酸酸化至pH = 2,通过固相萃取法[18]进行预处理富集。测定前用1 mL体积比为1:1的甲醇水溶液(或甲醇)溶解样品,取200 µL进行质谱分析。采用傅里叶变换离子回旋共振质谱(Fourier transform ion cyclotron resonance mass spectrometry,FT-ICR MS)检测待测样品,检测参数设置如下:进样方式为连续进样,进样速度为120 µL·h−1,磁场强度为15.0 T,离子源为电喷雾离子源(ESI),负离子模式,毛细管入口电压为-3.8 kV,离子累积时间为0.1 s,扫描质量范围为100~1 600 Da,采样点数为4 M 32位数据,时域信号叠加300次以提高信噪比[19]。质谱数据进行内标校准后按照S/N>4,C,H,O元素个数不限,N3S1,得到可能分子式结果,保留0.2≤H/C≤2.2且0≤O/C≤1.2的分子式,采用最小杂元素个数法筛选正确分子式,分析m/z值范围在100~800 Da的质谱峰[20]。
-
本研究使用耗散型石英晶体微量天平(quartz crystal microbalance with dissipation monitoring,QCM-D) 探究经超滤分级后不同分子质量SMP在PVDF膜界面的吸附行为及吸附层结构特征。首先使用超声浴清洗系统并用氮气吹扫干燥;然后在QCM-D流动模块中安装PVDF涂层晶体芯片,温度为(23.0±0.5) ℃,蠕动泵流速为0.1 mL·min−1,实时监测芯片的振动频率变化和能量耗散变化,直至获得基线;随后将SMP超滤分级后的溶液在3倍频下进行测定;最后使用QTools软件解析吸附过程的信号,并对数据进行分析。
-
化学需氧量(chemical oxygen demand,COD) 采用快速消解分光光度法测定,蛋白质(PN)和多糖(PS)的含量分别采用苯酚-硫酸法和福林-酚法测定。
污染物的截留率计算方法:由于膜组件自身、膜表面污染层结构及膜孔内污染物共同的拦截作用,可将反应器污泥混合液上清液中的物质部分截留在反应器内部,污染物的截留率根据式(1)进行计算。
式中:R为污染物的截留率,%;C上为污泥混合液上清液中污染物的质量浓度,mg·L−1;C出为出水中污染物的质量浓度,mg·L−1。
-
本研究中AnMBR处理市政污水中试系统共运行220 d,进水COD为(320±40) mg·L−1。在HRT由24 h逐渐缩短至8 h过程中,生物气中甲烷含量保持在80%以上,甲烷产量为0.25~0.31L·g−1,出水COD为(52.2±10.7) mg·L−1,COD去除率为(81.6±3.4)%。较高的甲烷产量和COD去除率表明AnMBR处理市政污水中试系统能够高效稳定的实现有机物的甲烷化。
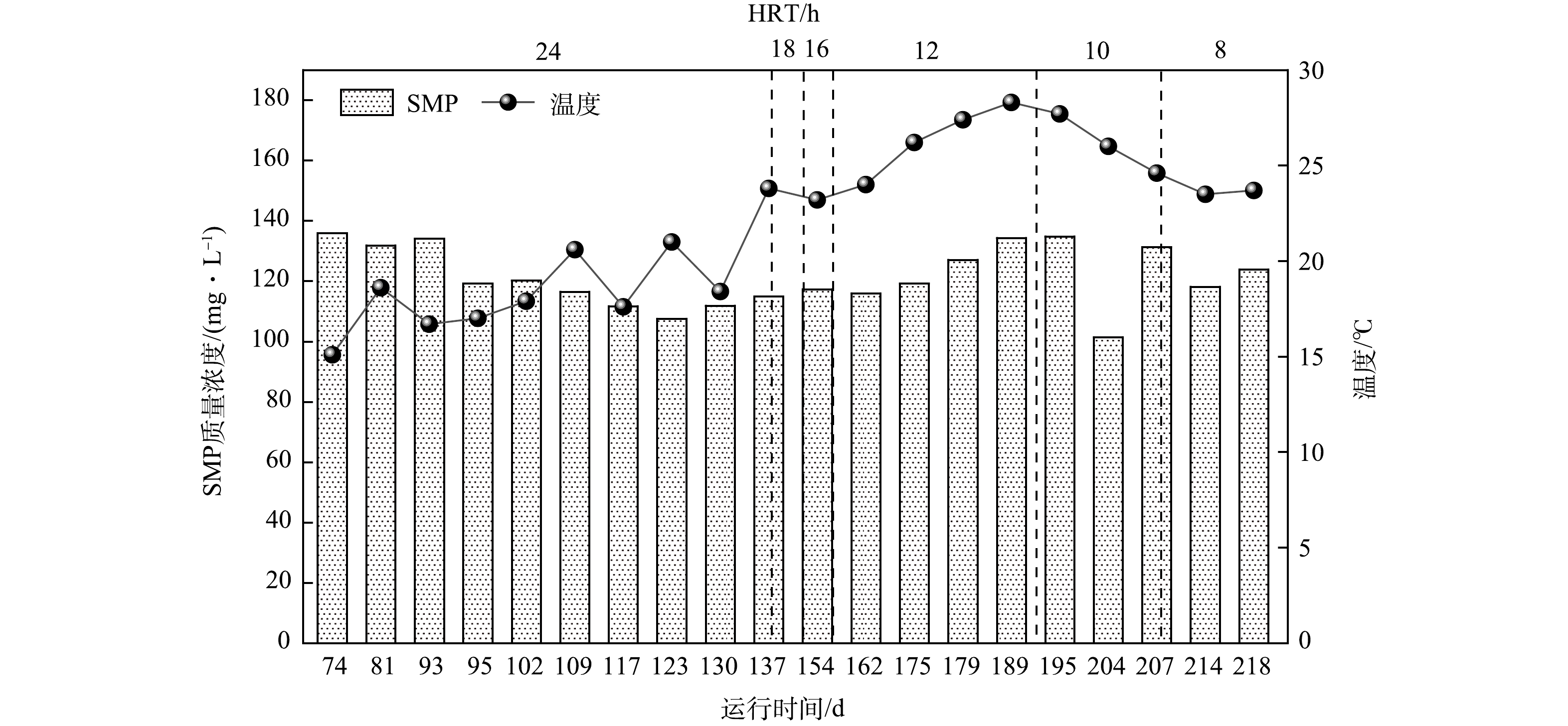
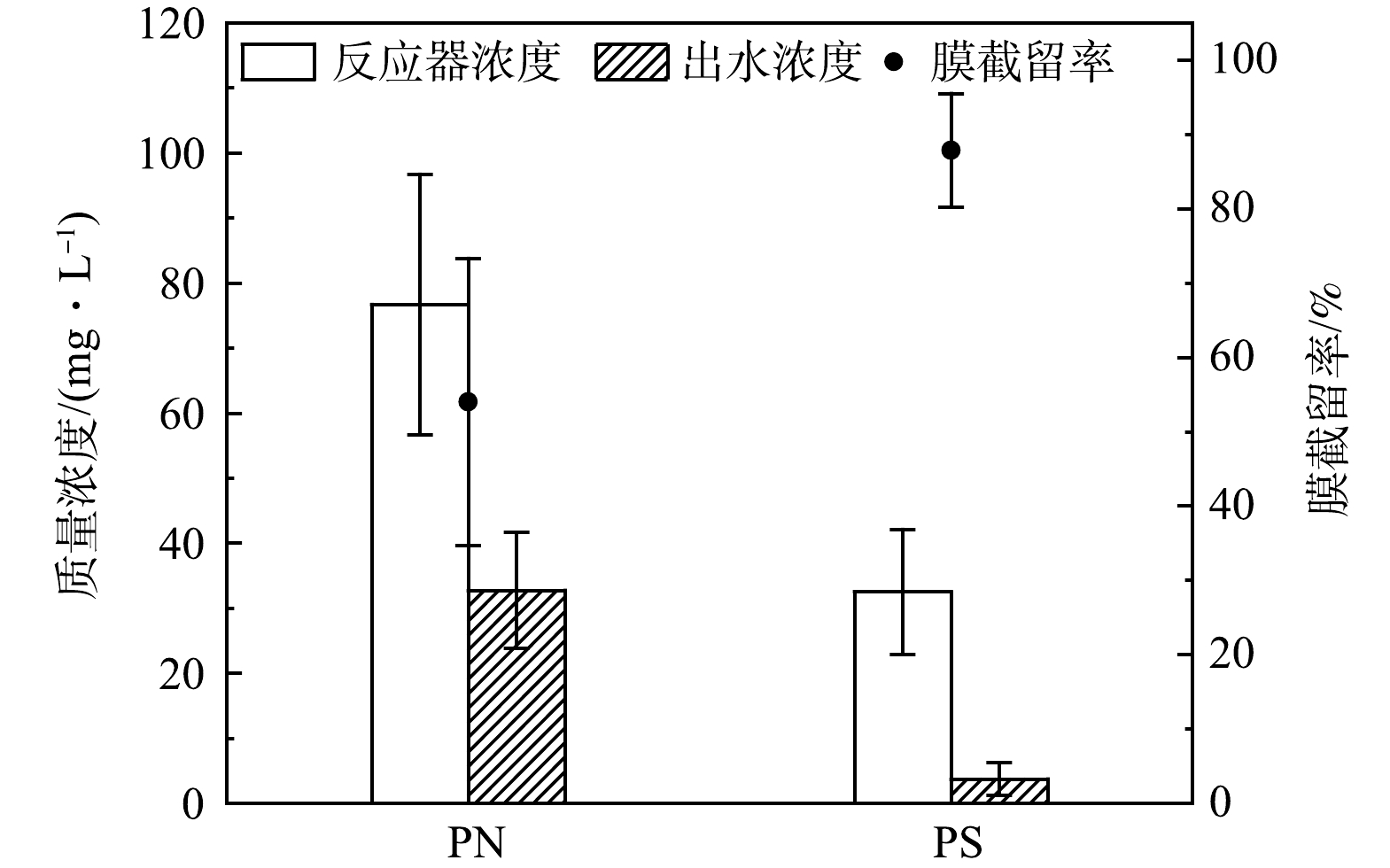
本研究中AnMBR污泥混合液中SMP质量浓度随运行时间的变化如图2所示。低温启动和升温阶段(74~109 d),SMP质量浓度由 (133.9±2.0) mg·L−1(以DOC计)降低至(118.6±1.9) mg·L−1;稳定运行 (112~220 d),随着HRT逐渐降低,有机负荷增大,但SMP质量浓度仍能够稳定在(119.3±10.0) mg·L−1,这是由于温度升高,微生物代谢活性增加,对AnMBR中有机物的代谢能力增强[21]。如图3所示,蛋白质和多糖是SMP的主要组分,质量浓度分别为(76.7±20.1) mg·L−1和(32.5±9.6) mg·L−1,共占总SMP的90%,这与以往的研究有一定的区别。实际污水处理厂膜生物反应器中SMP(6.3~23.9 mg·L−1)和实验室规模AnMBR中SMP(60~80 mg·L−1)的质量浓度维持在较低水平,且多糖的质量浓度明显高于蛋白质[22-23],说明不同规模反应器中的SMP组成和含量存在显著差异。
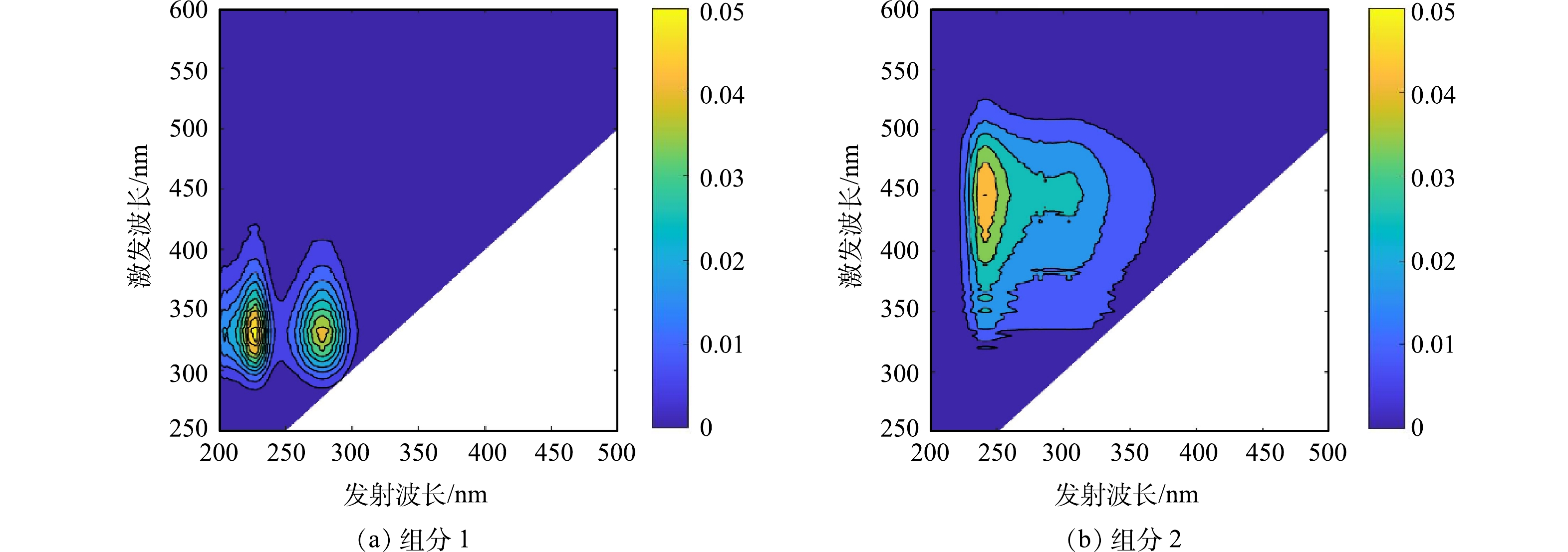
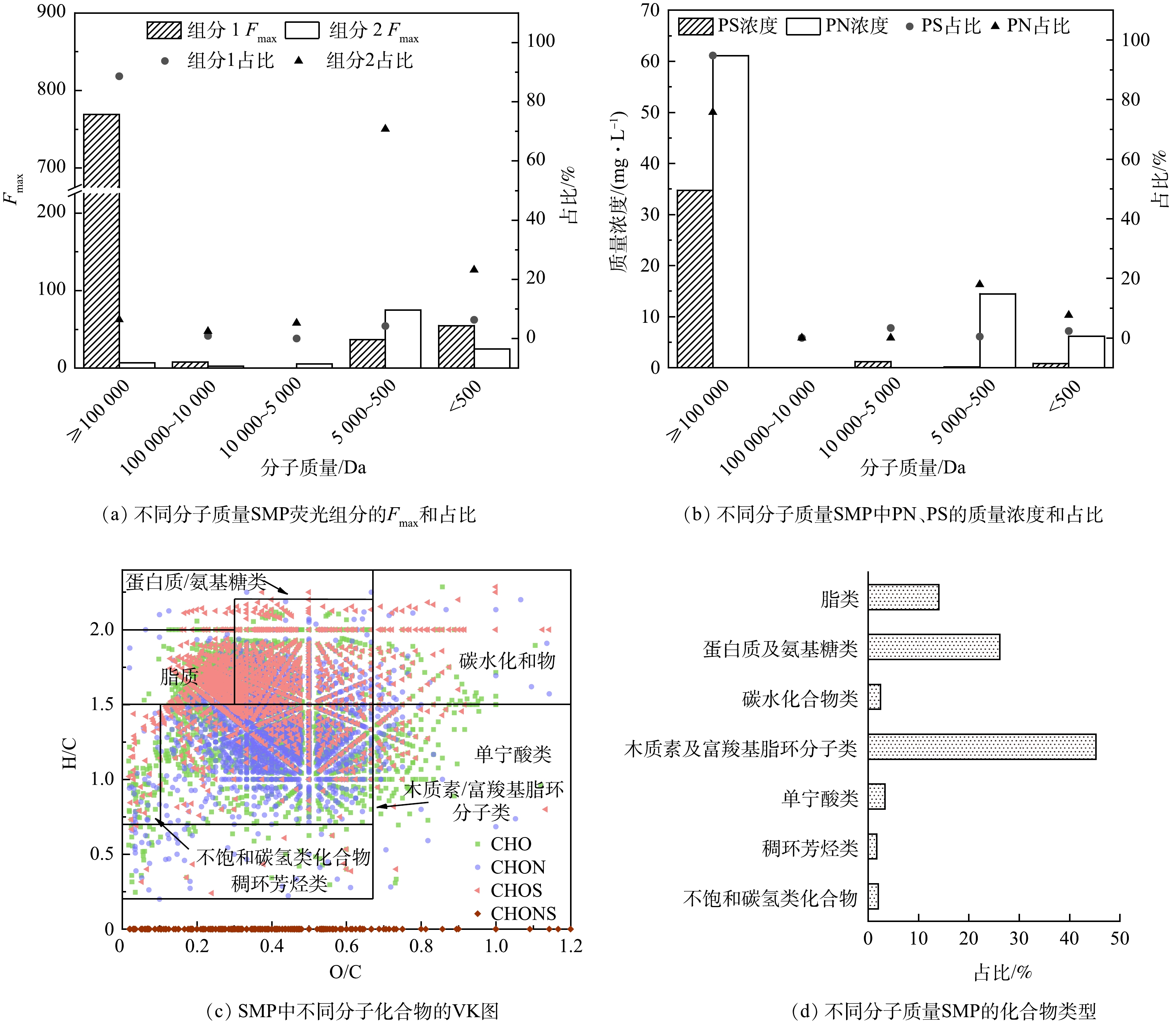
基于三维荧光测试结果,通过平行因子模型分析得到如图4所示结果。可见,SMP包含2个荧光组分,组分1属于类蛋白质(类色氨酸)[24-25],其对应2个荧光峰处得到,Ex/Em分别为228/332 nm和278/332 nm,通常认为是由微生物降解产生的代谢产物,易与大分子蛋白质结合[26];组分2属于类腐殖质[27],分为紫外光类腐殖质和可见光类腐殖质,对应的Ex/Em分别为242/446 nm和304/446 nm。其中组分1与组分2的最大荧光强度(Fmax)的相对含量分别为(88.8±0.8)%和(11.2±0.8)%,显示SMP荧光物质组成主要为类色氨酸,在实验室规模的MBR中存在相同的实验结果[28]。
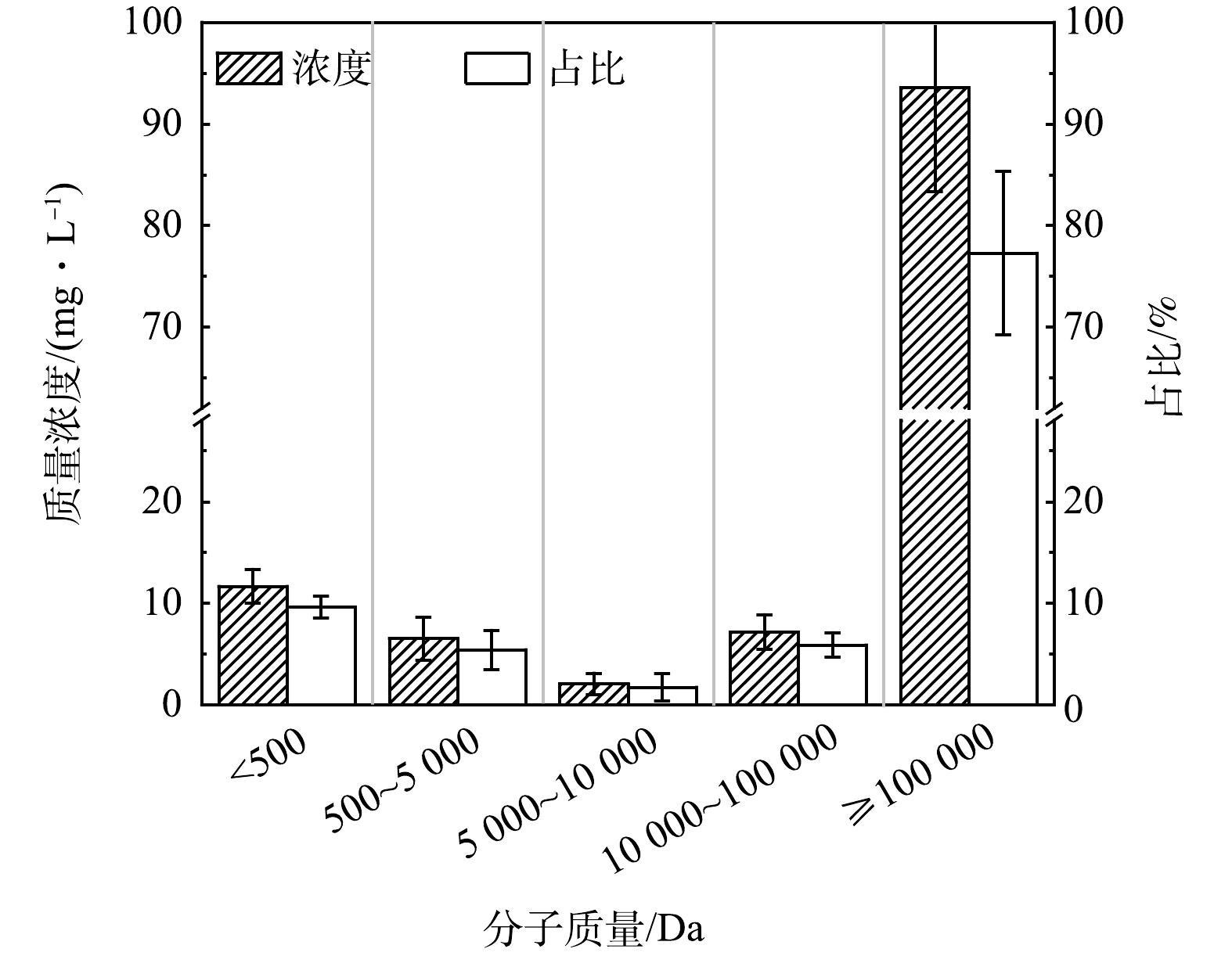
采用差减法计算SMP的表观分子质量分布,结果如图5所示。SMP以MW ≥100 000 Da的大分子为主,质量浓度为(93.6±10.2) mg·L−1,占比为(77.3±8.1)%。但在上升流浸没式AnMBR中SMP以MW <1 000 Da的小分子为主[29],这可能与进水水质和SRT有关。本研究为实际污水,污泥混合液中可能积累了基质降解过程中形成的中间产物,而中间产物通常是大分子的衍生物[30]。有研究发现污泥龄越长,污泥混合液中的大分子有机物越多[12] ,本研究污泥龄较长,故大分子较多。
-
将超滤分级后SMP进行三维荧光-平行因子分析,解析出不同分子质量SMP拥有的2个荧光组分同2.1节,经差减后其最大荧光强度及占比如图6(a)所示。结果表明,类色氨酸主要是MW≥100 000 Da的大分子,占88.6%,MW<500 Da的小分子占比很低(6.3%)。类腐殖质主要是小分子,500 Da≤MW<5 000 Da的占70.8%,MW<500 Da的占23.2%。超滤分级后各分子质量区间PN、PS质量浓度及占比如图6(b)所示。PN的分布与类色氨酸相似,大分子和小分子皆存在;PS主要是大分子,占总PS的91%。
采用范克莱夫伦(van Krevelen,VK)图将每个分子按不同H/C和O/C划分在不同区域[31],主要划分为7种化合物类型(图6(c)),即脂类、蛋白质及氨基糖类、碳水化合物类、稠环芳烃类、木质素及富羧基脂环分子类、单宁酸类和不饱和碳氢类化合物。按照化合物类型对其进行半定量分析,结果如图6(d)所示,SMP的化合物类型中,木质素及富羧基脂环分子类占比达45.2%,其次分别为蛋白质及氨基糖类(26.1%)和脂质类(14.0%),单宁酸、碳水化合物、不饱和碳氢类化合物和稠环芳烃类占比极低,这与XU等[32]研究的实际污水处理厂沉淀池中有机物的物质类型相似。木质素类化合物为陆源有机物,分子质量分布范围较广,其化学组成和结构特征决定其具有较高的化学稳定性和难微生物降解性。富羧基脂环分子是水体中一类典型的惰性有机质,主要为生物大分子的水解产物,大多由羧基化的稠合脂环组成,双键中氢原子含量很少[33]。值得注意的是SMP中脂质类的含量不低,可能是由于与蛋白质和多糖相比,脂质具有高结垢性质,在AnMBR中更难降解[34]。
-
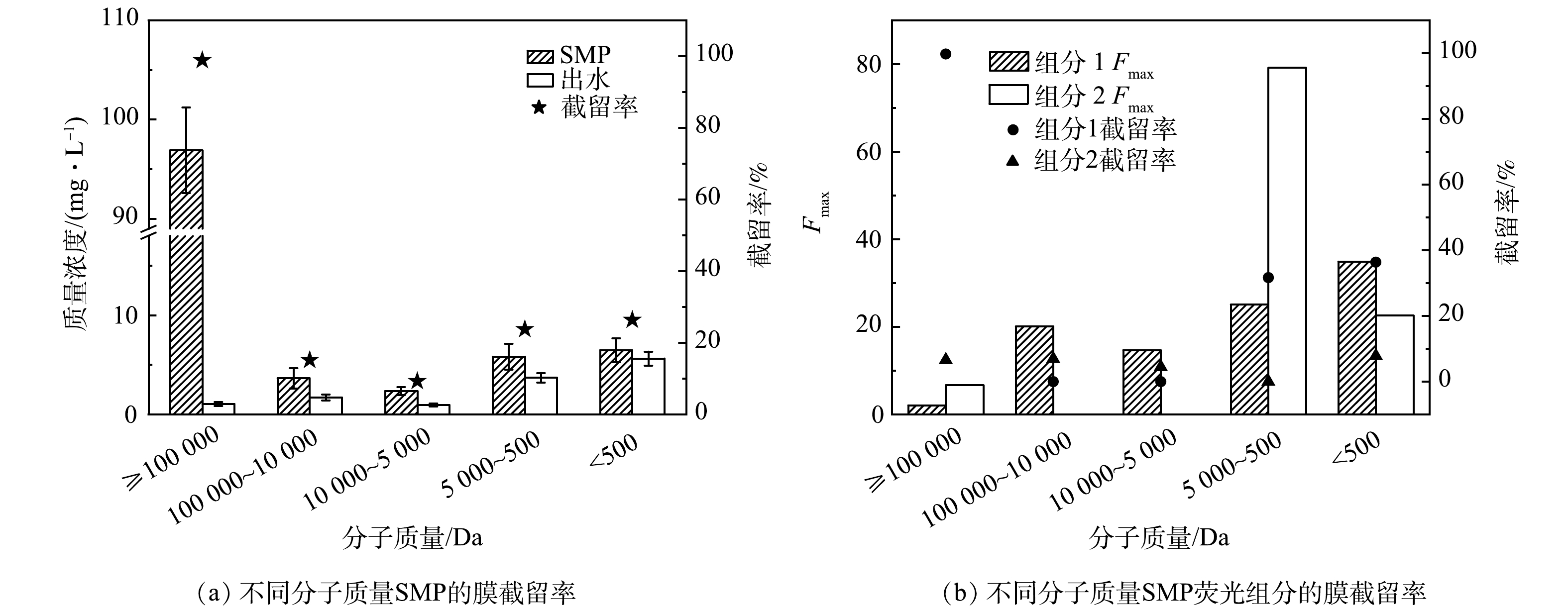
稳定运行时出水中SMP的质量浓度为(19.3±6.2) mg·L−1,AnMBR中SMP的截留率为(83.7±5.4)%,说明膜及膜上污染物对污泥混合液中SMP具有较好的截留效果。出水中PN和PS质量浓度分别为(32.7±8.9) mg·L−1和(32.5±9.6) mg·L−1,截留率分别为(54.0±19.3)%和(87.8±7.7)%。PS比PN具有更高的截留率,可能是PS黏性更大,更容易在膜表面吸附并形成沉积层[35]。
KIMURA等[36]发现分子质量分布对于SMP引起的膜污染影响显著,故本研究分析了污泥混合液及出水中SMP的分子质量分布及膜截留情况,结果如图7(a)所示。可以看出,膜及膜上污染物对大分子有较好的截留效果,其截留率高达98.8%,这些分子被膜截留并在膜表面累积形成污染层。膜及膜上污染物对中小分子也有一定截留效果(10%~26%),可能是由于低分子质量的糖、醇类、醛类、酮类和氨基酸等可以促进膜表面分子质量更大的物质如生物聚合物的形成[37],从而被膜截留。
出水中不同分子质量的SMP中荧光成分分析结果表明,类色氨酸中的大分子的截留率最高(图7(b));5 000 Da≤MW<100 000Da的中分子在出水中的质量浓度反而高于污泥混合液,这可能是这类物质由大分子被微生物降解产生;对500 Da≤MW<5 000 Da小分子也有一定的截留效果,这可能归因于类色氨酸广泛的亲水性[38]。类腐殖质的截留率较低,这与腐殖质由中、小分子组成可以较容易地通过膜孔有关,因此,可能不会明显的参与膜污染[39]。
-
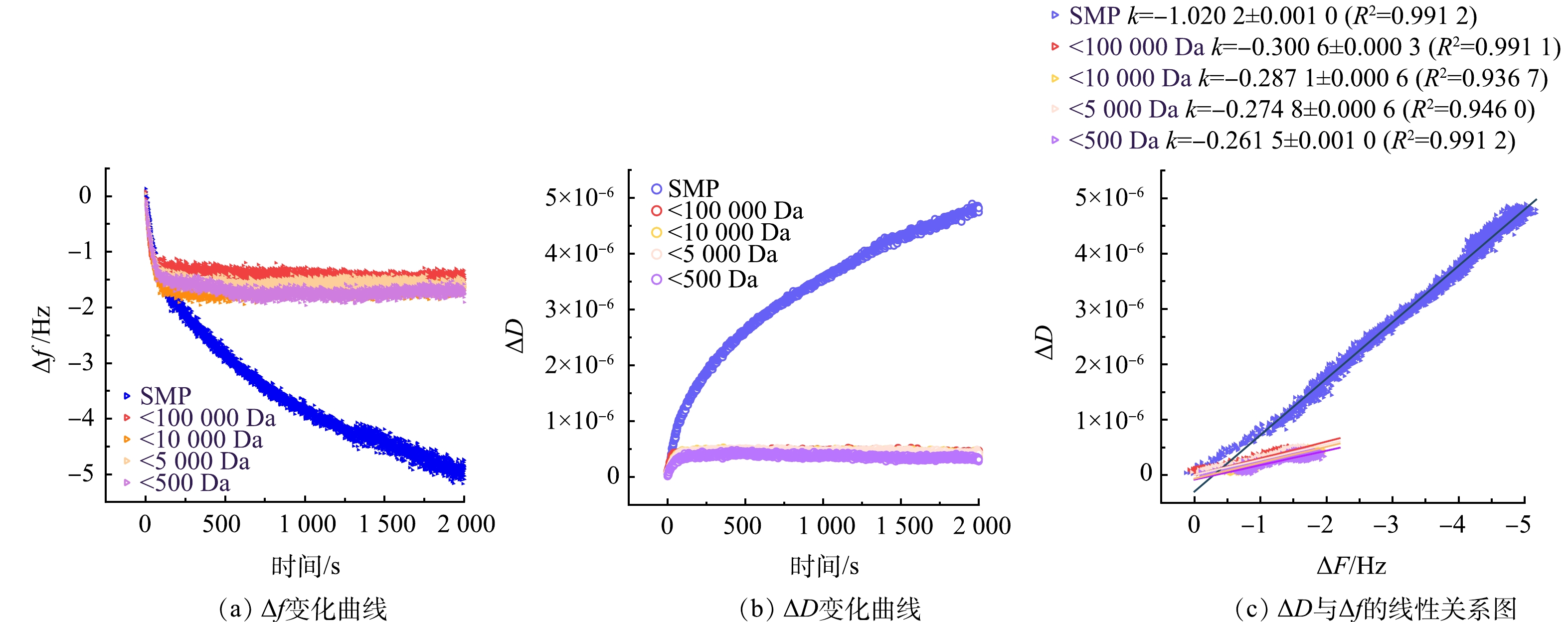
使用QCM-D考察不同分子质量SMP的膜污染行为及其污染层特征。图8(a)为不同分子质量SMP在PVDF膜表面吸附的Δf(振动频率变化量)变化曲线,可以看出大分子的Δf随时间变化较大,说明分布在该分子质量区间的SMP吸附量最多,而其他分子质量的组分的吸附量较少。由此,AnMBR中大分子物质是SMP的主要膜污染组分,从2.3节中不同分子质量SMP截留率也可以看出,大分子几乎被全部截留。本研究与KIMURA等[40]研究结果相似,大分子生物聚合物是SMP中引起膜污染的关键成分,具有较高的膜污染概率。
耗散变化量(ΔD)表征的是 QCM-D 测试过程中芯片振动所需能耗损失,ΔD的变化与吸附层的密实程度相关,图8(b)为不同分子质量的SMP在PVDF表面吸附的ΔD变化曲线。由于ΔD的变化也与吸附量相关,因此,可以使用单位吸附量的耗散变化量│ΔD/Δf│来评价吸附层的结构特征,结果如图8(c)所示,拟合直线斜率k的绝对值即可反应│ΔD/Δf│。综合图8(b)~(c)的结果,MW≥100 000 Da的分子对应的k值较大,其形成的污染层结构较为松散柔软,主要贴附在膜表面,是形成凝胶层的主要物质;MW<100 000 Da的分子对应的k值较小,其形成的污染层结构较为密实,导致膜的不可逆污染。污染层结构与膜通量衰减速率相关,过滤过程中若形成致密的污染层,膜孔很快被堵塞,膜通量将急剧下降;若形成疏松的污染层,膜通量衰减速度则相对较慢[41],故小分子SMP是极具膜污染潜力的。
-
1) SMP主要分布在MW≥100 000 Da,以木质素及富羧基脂环分子类、蛋白质及氨基糖类和脂质类为主,类色氨酸(88.8±0.8)%是其荧光物质的主要成分。
2)膜及膜上污染物对SMP具有较高的截留率(83.7±5.4)%,其中MW≥100 000 Da的大分子截留率最高(98.8%),类色氨酸的截留率显著高于类腐殖质。
3)耗散型石英晶体微量天平分析发现大分子在膜界面的吸附量最高,是SMP的主要膜污染组分,而中小分子形成的膜污染层更加密实,导致膜通量快速降低和不可逆污染。
厌氧膜生物反应器处理市政污水中试系统中溶解性微生物产物特性及膜污染行为
Characteristics of soluble microbial products and membrane fouling behavior in a pilot anaerobic membrane bioreactor for municipal wastewater treatment
-
摘要: 溶解性微生物产物(soluble microbial products,SMP)引起的膜污染是限制厌氧膜生物反应器(anaerobic membrane bioreactor,AnMBR)工程化应用的主要原因。基于大型中试AnMBR污水处理工程,考察了SMP的物质组成及荧光特性,解析了膜及膜上污染物对SMP的截留特征,揭示了SMP中不同有机组分的膜污染行为及污染层特征。结果表明:AnMBR高效稳定运行时SMP平均质量浓度为(119.3±10.0) mg·L−1(以溶解性有机碳计),主要是分子质量(molecular weight,MW)≥100 000 Da (77.3±8.1)%的大分子,组分为木质素及富羧基脂环分子类(45.2%)、蛋白质及氨基糖类(26.1%)和脂质类(14.0%)。膜及膜上污染物对SMP具有较高的截留率(83.7±5.4)%,其中MW≥100 000 Da的大分子截留率达到98.8%,其他中小分子截留率为10%~26%。耗散型石英晶体微量天平分析发现大分子在膜界面吸附量高,是SMP中引起膜污染的主要组分;中小分子(MW<100 000Da)形成的膜污染层更密实,导致了膜通量快速降低和不可逆污染。本研究深入揭示了AnMBR中SMP特性及膜污染行为,为高效膜污染控制方法开发提供参考。Abstract: The membrane fouling caused by soluble microbial products (SMP) is the main reason limiting the engineering application of anaerobic membrane bioreactor (AnMBR). Based on a large pilot-scale AnMBR for wastewater treatment, this study investigated the compositions and fluorescence characteristics of SMP, analyzed the SMP interception characteristics of the membrane and membrane foulants, and revealed the membrane fouling behaviors and characteristics of the fouling layer formed by different organic components of SMP. The results showed that the average concentration of SMP in AnMBR was (119.3±10.0) mg·L−1 (based on dissolved organic carbon) during the stable operation stage. Most of the SMP were macromolecules with molecular weights higher than 100 000 Da(77.3±8.1)%. The compositions of SMP contained lignin and carboxyl-rich alicyclic molecules (45.2%), protein and amino sugars (26.1%) and lipids (14.0%). The membrane and membrane foulants exhibited a high SMP interception rate (83.7±5.4)%, of which the macromolecules interception rate reached 98.8%, while that the low and medium molecules interception rates ranged from 10% to 26%. Quartz crystal microbalance with dissipation monitoring indicated that macromolecules with high adsorption capacity at the membrane interface were the main components of SMP that caused membrane fouling. The fouling layer formed by low and medium molecules was dense, leading to a rapid decline in membrane flux and irreversible membrane fouling. This study revealed the characteristics and membrane fouling behaviors of SMP in AnMBR and provides a reference for the development of efficient membrane fouling control methods.
-

-
-
[1] 王旭. 厌氧膜生物反应器强化污水能源回收研究进展[J]. 环境工程学报, 2020, 14(11): 2909-2911. doi: 10.12030/j.cjee.202009095 [2] HAO X D, BATSTONE D, GUEST J S. Carbon neutrality: An ultimate goal towards sustainable wastewater treatment plants[J]. Water Research, 2015, 87: 413-415. [3] SMITH A L, STADLER L B, LOVE N G, et al. Perspectives on anaerobic membrane bioreactor treatment of domestic wastewater: A critical review[J]. Bioresource Technology, 2012, 122: 149-159. [4] MAAZ M, YASIN M, ASLAM M, et al. Anaerobic membrane bioreactors for wastewater treatment: Novel configurations, fouling control and energy considerations[J]. Bioresource Technology, 2019, 283: 358-372. [5] NABI M, LIANG H, ZHOU Q X, et al. In-situ membrane fouling control and performance improvement by adding materials in anaerobic membrane bioreactor: A review[J]. Science of the Total Environment, 2023, 865: 161262. [6] Ni B J, BRUCE E R, Yu H Q. Soluble microbial products and their implications in mixed culture biotechnology[J]. Trends in Biotechnology, 2011, 29(9): 454-463. [7] 李士俊. 溶解性微生物产物对臭氧深度处理去除甲氧苄氨嘧啶的影响及机制研究[D]. 南京: 南京师范大学, 2020. [8] MARTIN-GARCIA I, MONSALVO V, PIDOU M, et al. Impact of membrane configuration on fouling in anaerobic membrane bioreactors[J]. Journal of Membrane Science, 2011, 382(1/2): 41-49. [9] 张雪宁. 可溶性微生物产物作为电子供体强化SBR脱氮的效能与机制[D]. 哈尔滨: 哈尔滨工业大学, 2020. [10] LIANG S, LIU C, SONG L. Soluble microbial products in membrane bioreactor operation: Behaviors, characteristics, and fouling potential[J]. Water Research, 2007, 41(1): 95-101. [11] 罗玲, 袁野, 钟常明. MBR过程溶解性微生物产物对膜污染影响研究进展[J]. 应用化工, 2021, 50(4): 1100-1106. doi: 10.3969/j.issn.1671-3206.2021.04.050 [12] 董滨, 段妮娜, 何群彪. 不同泥龄下溶解性微生物产物对膜污染的影响[J]. 同济大学学报(自然科学版), 2010, 38(3): 403-406. [13] ZHANG D Q, TRZCINSKI A P, KUNACHEVA C, et al. Characterization of soluble microbial products (SMPs) in a membrane bioreactor (MBR) treating synthetic wastewater containing pharmaceutical compounds[J]. Water Research, 2016, 102: 594-606. [14] 苗瑞. 溶解性有机物对超滤膜污染的微观作用力测试与机制解析[D]. 西安: 西安建筑科技大学, 2015. [15] 金鑫. 臭氧混凝互促增效机制及其在污水深度处理中的应用[D]. 西安: 西安建筑科技大学, 2016. [16] MURPHY K R, STEDMON C A, WENIG P, et al. OpenFluor- an online spectral library of auto-fluorescence by organic compounds in the environment[J]. Analytical Methods, 2014, 6(3): 658-661. [17] 易军, 杨光, 潘红卫, 等. 平行因子法和区域积分法优选可溶性有机物三维荧光提取方法及时间[J]. 光谱学与光谱分析, 2022, 42(8): 2444-2451. doi: 10.3964/j.issn.1000-0593(2022)08-2444-08 [18] DITTMAR T, KOCH B, HERTKORN N, et al. A simple and efficient method for the solid-phase extraction of dissolved organic matter (SPE-DOM) from seawater[J]. Limnology and Oceanography: Methods, 2008, 6(6): 230-235. [19] 张淼. 紫外/过氧化氢及活性炭工艺降解水中有机污染物研究[D]. 赣州: 江西理工大学, 2021. [20] LV J, ZHANG S, WANG S, et al. Molecular-scale investigation with ESI-FT-ICR-MS on fractionation of dissolved organic matter induced by adsorption on iron oxyhydroxides[J]. Environmental Science and Technology, 2016, 50(5): 2328-2336. [21] LIU T, ZHENG X, TANG G, et al. Effects of temperature shocks on the formation and characteristics of soluble microbial products in an aerobic activated sludge system[J]. Process Safety and Environmental Protection, 2022, 158: 231-241. [22] SHEN Y X, XIAO K, LIANG P, et al. Characterization of soluble microbial products in 10 large-scale membrane bioreactors for municipal wastewater treatment in China[J]. Journal of Membrane Science, 2012, 415-416: 336-345. [23] HUANG Z, ONG S L, NG H Y. Performance of submerged anaerobic membrane bioreactor at different SRTs for domestic wastewater treatment[J]. Journal of Biotechnology, 2013, 164(1): 82-90. [24] SHUTOVA Y, BAKER A, BRIDGEMAN J, et al. Spectroscopic characterisation of dissolved organic matter changes in drinking water treatment: From PARAFAC analysis to online monitoring wavelengths[J]. Water Research, 2014, 54: 159-169. [25] CATALÁN N, PASTOR A, BORREGO C M, et al. The relevance of environment vs. composition on dissolved organic matter degradation in freshwaters[J]. Limnology and Oceanography, 2021, 66(2): 306-320. [26] 张博, 王书航, 姜霞, 等. 太湖五里湖水体悬浮物中水溶性有机质(WSOM)的荧光光谱组分鉴别及其与氮形态的关系[J]. 湖泊科学, 2018, 30(1): 102-111. [27] PAINTER S C, LAPWORTH D J, WOODWARD E M S, et al. Terrestrial dissolved organic matter distribution in the North Sea[J]. Science of the Total Environment, 2018, 630: 630-647. [28] MAQBOOL T, QUANG V L, CHO J, et al. Characterizing fluorescent dissolved organic matter in a membrane bioreactor via excitation-emission matrix combined with parallel factor analysis[J]. Bioresource Technology, 2016, 209: 31-39. [29] MEDINA S C, ZAMORA-VACCA N, LUNA H J, et al. SMP production in an anaerobic submerged membrane bioreactor (AnMBR) at different organic loading rates[J]. Membranes, 2020, 10(11): 317. [30] SOH Y N A, KUNACHEVA C, MENON S, et al. Comparison of soluble microbial product (SMP) production in full-scale anaerobic/aerobic industrial wastewater treatment and a laboratory based synthetic feed anaerobic membrane system[J]. Science of the Total Environment, 2021, 754: 142173. [31] 何晨, 何丁, 陈春茂, 等. 傅里叶变换离子回旋共振质谱在溶解性有机质组成分析中的应用[J]. 中国科学: 地球科学, 2022, 52(12): 2323-2341. [32] XU S K, WU Y T, BU L J, et al. Molecular insights towards changing behaviors of organic matter in a full-scale water treatment plant using FTICR-MS[J]. Chemosphere, 2023, 330: 138731. [33] HERTKORN N, BENNER R, FROMMBERGER M, et al. Characterization of a major refractory component of marine dissolved organic matter[J]. Geochimica et Cosmochimica Acta, 2006, 70(12): 2990-3010. [34] XU B Y, NG T C A, HUANG S J, et al. Underestimation of extracellular lipid contribution to fouling in anaerobic membrane bioreactors[J]. ACS Sustainable Chemistry & Engineering, 2023, 11(7): 3036-3043. [35] KIMURA K, NISHIMURA S I, MIYOSHI R, et al. Application of glyco-blotting for identification of structures of polysaccharides causing membrane fouling in a pilot-scale membrane bioreactor treating municipal wastewater[J]. Bioresource Technology, 2015, 179: 180-186. [36] KIMURA K, TANAKA K, WATANABE Y. Microfiltration of different surface waters with/without coagulation: Clear correlations between membrane fouling and hydrophilic biopolymers[J]. Water Research, 2014, 49: 434-443. [37] LIU J B, ENG C Y, HO J S, et al. Quorum quenching in anaerobic membrane bioreactor for fouling control[J]. Water Research, 2019, 156: 159-167. [38] MAQBOOL T, SUN M M, CHEN L, et al. Exploring the fate of dissolved organic matter at the molecular level in the reactive electrochemical ceramic membrane system using fluorescence spectroscopy and FT-ICR MS[J]. Water Research, 2022, 210: 117979. [39] TIAN Y, LI Z P, LU Y B. Changes in characteristics of soluble microbial products and extracellular polymeric substances in membrane bioreactor coupled with worm reactor: Relation to membrane fouling[J]. Bioresource Technology, 2012, 122: 62-69. [40] KIMURA K, KUME K. Irreversible fouling in hollow-fiber PVDF MF/UF membranes filtering surface water: Effects of precoagulation and identification of the foulant[J]. Journal of Membrane Science, 2020, 602: 117975. [41] 王磊, 张静怡, 王旭东, 等. 天然有机物对PVDF超滤膜的污染行为及AFM表征[J]. 环境工程学报, 2016, 10(3): 1121-1125. doi: 10.12030/j.cjee.20160319 -



 下载:
下载: