-
随着工业的发展以及人类消耗的激增,经各种途径排放进入环境中的重金属和纳米材料大为增加[1-2]. 其中土壤和水体是重要的汇[3]. 同时使用纳米颗粒减少作物中重金属累积、去除水中重金属污染等的发展[4-6],也导致了环境中重金属和纳米颗粒的共存问题. 重金属可在不同营养级生物体内发生生物积累,还可影响生物的代谢活动和免疫能力,改变生物生理生化状态,诱发动物和人类多种疾病产生[7-8]. 纳米颗粒由于尺寸微小,相较于大颗粒更易进入生物体内且进入后更难清除. 另外,纳米颗粒可诱导DNA突变,损伤线粒体结构,产生氧化应激、炎症反应,破坏细胞和器官的正常功能[9-10]. 传统污染物Cd、Pb、Cu、As等金属和类金属元素,以及新型污染物金属和非金属纳米材料,都是当前毒理学的重要研究对象.
实际环境中,生物往往暴露于多种污染物,产生不同于单一污染物暴露的毒性效应. 首先,一种金属的存在可影响其他金属的生物效应. 如Cu可增强海洋浮游硅藻对Zn的吸收[11],而Zn与Ni对小麦毒性存在拮抗作用[12]. 其次,一种纳米颗粒可通过干扰其他纳米颗粒的分散稳定性、表面性质以及离子释放等[13],进而影响其生物效应. 最后,重金属与纳米颗粒之间也存在相互作用. 一方面,纳米颗粒可改变金属的生物吸收,如叶面喷洒TiO2纳米颗粒可减少玉米幼苗对Cd的吸收[14];另一方面,重金属的存在会影响纳米颗粒的团聚行为,同时重金属对生物生理(如细胞膜通透性、氧化损伤等)的影响也会改变纳米颗粒的生物转运与毒性[15]. 当有其它因素存在时,纳米颗粒与重金属的联合效应更为复杂,如TiO2 NPs与Cd的联合效应与水中Ca的浓度密切相关[16].
显然,研究污染物的联合毒性比研究单一污染物对生物的毒性效应更具实际意义. 然而由于污染物的联合毒性取决于其组成,对环境中各种污染物组成混合物的联合毒性均采用实验研究又不切实际[17-18],因此需要根据各种污染物的混合体系采用适合的数学模型进行毒性评价. 对于多元混合物的毒性评估经历了从定性到定量的发展阶段,出现了多种模型预测方法. 但由于环境中污染物种类多、性质差异大,对于不同类型污染物的评估方法差异较大. 鉴于重金属和纳米颗粒对生态环境和人类健康的不利作用,本文概述了重金属、纳米颗粒以及两者共存的联合毒性评价模型,总结了各评价方法的优缺点及其应用,旨在为这些混合物毒性的精确评估提供方法参考.
-
目前针对重金属混合物毒性的模型研究主要分为三大类:一是定性或半定量评价重金属之间是否存在相互作用,即对加和性的偏离,包括等效线图法、指数法、析因法等. 等效线图法适于二元混合物的毒性评估[19];指数法和析因法可用于三元以上混合物的联合作用评价[20-21]. 二是重金属之间无相作用或相互作用可忽略时的定量模型,包括浓度加和(concentration addition,CA)模型[22]、独立作用(independent action,IA)模型[23]以及在此基础上的改良模型. 三是针对重金属之间往往存在的协同或相加作用,近年来发展的一些生理学模型. 第一类模型可详见杨蓉等的综述[17],下面主要介绍第二、三类模型.
-
Loewe[22]和Bliss[23]最早提出了CA和IA模型,分别用于评估组分作用模式相似和不同的混合物毒性. CA模型认为混合物各组分结构类似或毒性行为相似,适用于各组分可引起相同的生物效应,其模型公式如下:
式中,ECx,i是第i组分单独产生x%效应时的浓度;Pi是第i个组分占混合物总浓度的比值.
IA模型认为混合物各组分独立地与不同位点发生作用,其公式如下:
式中,E(Cmix)为混合物的总影响;E(Ci)是由混合物中组分i引起的单独作用.
CA和IA模型的优点是计算相对简便,在混合物毒性评估方面适用性较强,对于已知各组分作用模式的混合物,其预测结果比较可靠(表1).
但也存在一些缺点,由于CA模型认为混合物各组分无论其浓度高低,均对联合作用有贡献,而IA模型认为混合物组分只有超过其未观察到作用剂量时才对联合毒性有贡献,因此两者无法准确预测低浓度效应区的联合作用[37];此外,对于重金属而言,作用模式完全相同或不同的情况很少发生,且重金属之间存在的相互作用,导致了CA和IA模型评估结果的偏差.
-
为了克服CA和IA模型存在的不足,充分结合两模型的优势,大量研究在两个模型基础上做了一些改进并提出了一些衍生模型:
(1)组合指数法(combination index, CI):是一种基于半数效应方程,不受作用模式影响的混合物联合毒性评估方法[38]. 其公式为:
式中,Pi是第i个组分占混合物总浓度的比值,Ci表示混合物产生x(%)效应时第i组分的浓度. ECx,i表示第i组分单独产生x%效应时的浓度.
方程的每一项均以比值形式表示,是一个无量纲,当CIX<1和>1时,分别表示组分之间存在协同和拮抗作用,而CIX=1时即为CA模型. 这与Marking[39]推广到用于混合物联合作用预测的毒性单位(toxic unit,TU)法,以及在此基础上发展的相加指数(additivity index,AI)法[35]、混合毒性指数(mixture toxicity index,MTI)法[40]等类似. 这类模型最大的优势在于不依赖混合物中组分的作用模式,不仅可以定量表示联合作用的大小,还可定性表示组分间的相互作用,同时适用于三元及以上混合物[41]. 但是这类模型也是在浓度加和基础上建立起来的,它们对于组分间发生相互作用的混合体系,评价结果具有不确定性[42].
(2)整合浓度加和-独立作用模型(integrated CA with IA model, ICIM)[43]:Mwense等[44-45]基于污染物的分子结构,不考虑作用模式,建立了整合模糊浓度加和-独立作用模型(integrated fuzzy concentration addition-independent action model, INFCIM),主要用于有机物的毒性预测. Qin等[43]在此基础上结合多元线性回归,提出了新的ICIM,并验证了其对于重金属混合物的适用性,其模型公式为:
其中,b0为常数,b1和b2为多元线性回归模型的回归系数.
ICIM模型不局限于某一效应水平而是对整个效应区域都有一定预测能力. 对于存在非相互作用的混合物而言,评价结果较好.
(3)两步预测模型(two-step prediction, TSP)[46]:TSP模型采用先分组、后分步方式,分别采用CA和IA模型进行毒性预测,适用于具有相似或不同作用模式的混合物. TSP模型对已知作用模式的混合物,毒性评估结果比较准确,但对于作用模式不确定的混合物,其预测结果存在不确定性. Olmstead和Leblanc[47]进一步发展了两步模型,他们在同一分组中引入参数p`. 根据优化后的综合加和模型(Integrated addition model,IAM),混合物导致的联合毒性计算公式为:
式中,Emix为混合物的拟合毒性;Ci是第i个组分的浓度;EC50i是第i组分单独引起50%效应的浓度;p,是同一分组内各组分的平均斜率或指数.
(4)共线性改进模型:为解决多重共线性问题(预测指标之间存在线性关系),Kim等[48]基于偏最小二乘法建立了PLS-IAM模型(Partial Least Squares-based IAM). 通过比较CA、IA、ICIM、PLS-IAM对不同混合物的毒性评价结果,发现PLS-IAM模型对混合物联合毒性的预测能力优于其它模型. 从应用范围来看,ICIM模型、PLS-IAM模型主要用于有机混合物或有机-重金属混合物的毒性评价. 邓杨等[26]也针对CA、IA模型预测结果共线性问题,提出了基于主成分回归的PCR-IAM模型(Principal component regression-based IAM),这一模型不但能够有效预测加和效应混合物的毒性,也可以准确预测重金属混合物的协同和拮抗作用.
(5)整合加和交互模型(integrated addition and interaction model, IAI):Rider 和Leblanc[49]在考虑了组分间存在的相互作用后,在IAM模型中引入了K函数,表达混合物组分间的相互作用,其模型公式为:
其中,Ka,i是描述a组分在混合物中,以浓度Ca影响第i组分在混合物中有效浓度程度的函数.
IAI模型的缺点在于需要进行实验确定K函数. Yuan等[25]将CA、IA、IAM、IAI模型用于预测多元重金属混合物的联合效应,结果显示IAI模型预测的准确度最高,这可能与金属之间存在的相互作用有关. 也有研究应用广义线性相加模型(Generalized linear model, GLM),通过增加相互作用项来反映污染物间的交互作用[50].
-
上述目前主流的混合物作用模型,均直接将金属暴露关联到毒性效应,相对忽视了重金属的生物累积过程. 除了在作用效应上存在相互影响,混合物组分间在生物吸收、分布、代谢、排出过程中也会存在相互作用,影响最终的联合毒性[51]:生物配体模型(biotic ligand model, BLM)是目前基于生物有效性最受关注的模型工具. 这一模型将位于生物表面的金属敏感位点(如转运蛋白)抽象为生物配体,金属(M)与生物配体(BL)结合形成络合物(MBL),当其浓度达到或超过某一阈值时,就会产生特定的毒性效应[50, 52-53]. 对于金属混合物,组分之间的相互作用表现为与生物配体结合过程中的竞争或非竞争性抑制. 理论上,使用BLM估算金属的有效浓度,再与其他模型结合,即可用于预测重金属的联合作用. 如BLM与TU模型结合,其模型公式为[50, 54-55]:
式中,KMBL、KIMBL和KXBL是游离金属离子(M)、无机金属络合物(IM)和阳离子X(如Mg2+)与BL位点结合的常数,括号{}表示离子活度. 对于金属混合物,将方程7中的f代入TU方程,可得:
式中,
$ \mathop f\nolimits_{{\rm{M1BL}}}^{50\% } $ 和$ \mathop f\nolimits_{{\rm{M2BL}}}^{50\% } $ 分别是在相对净增长50%条件下,单一金属暴露下M1或M2占据的BL位置的分数.BLM-TU模型已被用于预测Cu-Co混合物对小麦的毒性[50,55],Cu-Zn混合物对小麦的毒性[56],Cu-Ni、Cu-Zn、Cu-Ag混合物对莴苣的联合毒性[57]等,均显示了较小的预测偏差.
若考虑到暴露时间对混合物毒性作用的影响,可采用基于毒性发生过程的毒代-毒效动力学概念模型(toxicokinetictoxicodynamic,TK-TD)[58]. 模型毒代(TK)部分描述污染物的累积过程,BLM可看作一种TK模型,毒效(TD)部分进一步将生物累积转化为毒性效应. Gao等[59-60]的研究表明,BLM-TK-TD模型不仅在预测重金属混合物对斑马鱼幼鱼的毒性作用和体内积累方面效果良好,对于理解重金属的相互作用机制也提供了新的视角. 但是基于BLM的TK-TD模型需要大量实验数据,且BLM 并未考虑重金属进入生物体内后转运、解毒/固定过程中的相互作用,这种方法对于不同金属混合物、较为高等生物的适用性有待进一步验证.
另外,在毒理学研究中,毒性测试的终点选择与混合物的组分信息同样重要,诸多测试终点的结果无法统一,将会限制结论的外推. 在此情况下,动态能量平衡(dynamic energy budget, DEB)理论的提出为这一问题的解决提供了思路. 根据DEB,生物的所有生理活动均可量化为对能量的获得和分配,因此不同的测试终点均与能量流有关,污染物的毒性效应可归一为对能量分配的干扰. 在联合毒性预测方面DEB往往与CA、IA的模型概念相结合. 但由于不同生物生理特点的差异,DEB的公式形式与参数选择随生物种类变化很大,以大型蚤为例[61],若考虑生长通过生长稀释和改变生物体比表面积影响污染物的毒代动力学,污染物体内浓度cV可通过下式计算:
式中,cd为环境中污染物浓度,ke为消除率,L为体长,Lm是一个默认值.
通过引入参数——“应激水平s”,可将cV与DEB模型的代谢参数值联系起来[62]:
当cV小于阈值c0(无效应浓度)时,则s为零;大于c0时,s与高于阈值的浓度成正比,cT为耐受浓度.
对于混合物,若组分作用位点相同,它们被吸收后相当于彼此稀释,其毒代动力学可以通过对每一种组分应用公式1获得,ke值不同,但生长模式相同. 之后,将各组分的cV以权重因子(W)校正并求和:
式中,a(任意)作为化合物b和c权重因子的参考物质. 权重因子表示化合物被吸收、到达位点以及与位点相互作用的总体效率. 将以组分a为参考的cV+代入公式2,获得应激水平s+,最后计算s+对DEB中各代谢参数的影响. 若组分作用位点不同,则分别计算每一组分的cV、s值,再结合IA模型计算各组分对各代谢参数的联合作用.
Péry等[63]使用基于IA的DEB模型预测了Cu、Zn、Cd二元混合物对摇蚊幼虫的生长抑制. Xie等[64]使用基于CA的DEB模型预测了Cu-Cd对莱茵衣藻的生长毒性. Margerit等[65]的结果显示基于IA的DEB相比基于CA的DEB,可以更好地预测U-Cd对秀丽隐杆线虫的生长和繁殖毒性. 这一理论弥补了经典TD模型中只能选取质效应(有或无)终点的不足. 但是同样由于实验数据的缺乏,此类模型的应用还非常有限.
综上所述,对于重金属混合物的毒性评估,目前的应用主流仍是CA、IA及其改进模型,但是结合生物生理过程的衍生模型更能反映重金属间的相互作用及其毒理学机制,是联合毒性研究极具潜力的方向之一.
-
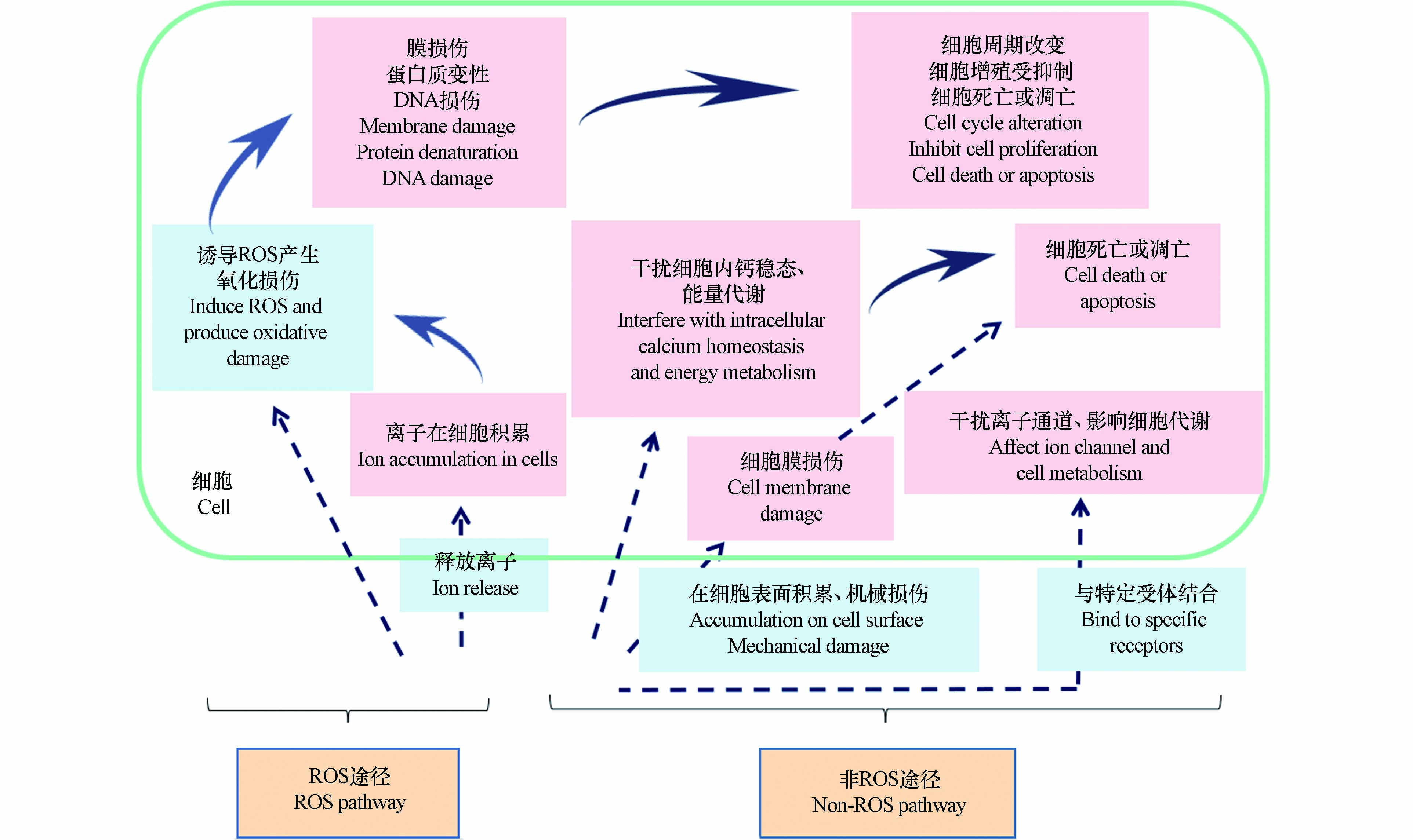
随着纳米材料在医药、电子、护肤品等领域的广泛应用,它们进入环境后不可避免会对各类生命造成危害[66]. 纳米颗粒的毒性机制包括活性氧(ROS)和非活性氧介导的两种途径:ROS介导途径是目前公认的纳米颗粒毒性机制之一,ROS导致的氧化应激,可诱发细胞膜损伤、蛋白质变性、线粒体膜通透性改变、DNA损伤等,最终导致细胞死亡或凋亡[67-69];非活性氧介导的机制包括纳米颗粒释放离子产生的影响、纳米颗粒在细胞表面过度积累、纳米颗粒和特定受体结合等[70-72](图1).
但是目前有关纳米材料的毒性研究主要集中于单种纳米颗粒,而真实环境中通常是多种纳米颗粒同时存在,由于不同纳米颗粒的作用方式相同或不同,且它们之间还可能存在相互作用,纳米颗粒混合物往往表现出不同于单种纳米颗粒的毒性:如SiO2 NPs 和TiO2 NPs 在巨噬细胞的炎性响应上表现为协同作用[73];而ZnO NPs和TiO2 NPs共同暴露时,ZnO NPs溶解释放的Zn2+由于被TiO2 NPs吸附,减少了对细菌ATP水平的影响[74-75]. 因此,研究纳米颗粒混合物的毒性效应更具现实指导意义.
已有少量研究使用模型方法(CA和IA模型),考虑纳米颗粒的作用机制(根据纳米颗粒类型),评估金属基纳米颗粒混合物的联合效应(表2). Ye等[76]研究了ZnO NPs和CuO NPs对斜生栅藻的联合效应,结果表明CA和IA模型对混合物EC50的预测值分别低于实验值的2倍和3倍,CA预测可产生16%的联合效应误差,低于IA预测(38%),因此这两种纳米颗粒可能具有相似的作用模式. 而Liu等[77]的研究则表明IA模型更能准确预测Cu NPs和ZnO NPs混合物对生菜根伸长的毒性,IA模型拟合曲线R2(0.82)显著高于CA模型拟合曲线R2(0.58). Wang等[78]研究了TiO2纳米球和TiO2纳米管二元混合物对蛋白核小球藻以及斜生栅藻的联合毒性,TU结果表明两者均表现为相加作用,CA和IA模型能分别有效地预测混合物对斜生栅藻和蛋白核小球藻的联合毒性. 由此可见,两种模型对于不同组成纳米混合物、不同种类生物的适用性不同.
CA、IA模型在评估纳米颗粒混合作用时产生的偏差,可能是受纳米颗粒之间相互作用的影响,或是由于对纳米颗粒中颗粒和溶解离子产生的联合效应以及各组分对毒性的贡献尚未完全了解[79]. 一些研究报道了单种金属基纳米颗粒的毒性贡献主要来自其离子释放[82-84],因此有必要论证是否能用纳米颗粒离子对应物的混合效应来表征纳米颗粒的混合效应. Lopes等发现ZnO NPs和Ag NPs 对大型蚤存在协同作用,而其对应离子Zn2+和Ag+混合物则存在拮抗作用,无法根据离子混合物的毒性来推断纳米混合物的毒性[79]. 对于纳米颗粒混合物释放离子对毒性的贡献问题,Ye等[85]使用TU法证明了ZnO NPs和氧化石墨烯(GO NPs) NPs混合物对不同营养级水生生物的毒性主要是由纳米颗粒引起,而非Zn2+,且GO NPs可通过吸附Zn2+影响Zn2+的毒性贡献. 现有少量研究表明对于金属基纳米混合物而言,颗粒物本身贡献了其主要毒性,可选择CA和IA模型进行拟合择优,但是金属离子的释放及其相互作用可能导致预测偏差[85].
考虑到纳米颗粒结构、性质、组成的复杂性,借鉴于有机物定量结构活性关系(Quantitative Structure-Activity Relationships,QSAR)的nano-QSAR,即定量纳米结构-活性关系(Quantitative Nanostructure-Activity Relationships,QNAR)模型,被提出用于预测纳米颗粒的生物效应[86-87]. 在这一模型中,使用描述符作为参数表征纳米颗粒的性质,如大小、形貌、zeta电位、表面积、化学组成等,通过统计方法(如多元线性回归、偏最小二乘法等)和机器学习算法(如人工神经网络、支持向量机、随机森林等)进行结构/性质-活性(毒性终点)建模[88-90],能够预测纳米颗粒的毒性效应. 现有的研究表明:对于金属纳米材料,纳米材料的表面性质是决定其细胞吸收的关键因素,同时纳米材料的离子释放能力与表面氧化还原特性也是影响毒性的重要描述符[91];对于金属氧化物纳米材料,气态阳离子的生成焓是构建17种纳米颗粒对大肠杆菌毒性预测模型的有效描述符[92];对于碳基纳米颗粒,由于其三维结构的复杂性和碳原子杂化状态的多样性,有研究建议使用量子化学描述符(如势能)来表示相互作用力,并结合结构描述符等建立多尺度描述符的nano-QSAR模型[93]. 现阶段而言,QNAR在单种纳米颗粒对生物毒性的研究方面较为深入[94-95],但是纳米颗粒混合后对描述符的影响及其是否能用于纳米混合物的毒性评估,仍有待数据支持和验证.
-
重金属、纳米材料的大量排放以及采用纳米材料处理重金属污染的发展应用[96-98],使得生物暴露在重金属和纳米材料共存环境中的概率大幅增加. 目前应用于重金属-纳米颗粒混合物毒性的模型研究也包括定性或半定量的等效线图法、指数法等,定量的CA、IA模型及其改进模型. Park等[99]使用毒性单位法研究了Ag+与ZnO NPs、TiO2 NPs混合物对大型蚤的联合效应,均表现为协同作用. Baek等[100]也研究了Ag+与ZnO NPs对大型蚤的联合作用,结果表明CA模型的残差平方和(SS)为534.7,而IA模型的SS为664.5,这主要是由于存在依赖于剂量比的偏差:ZnO NPs / Ag+比值高时,两者表现为协同效应;反之,表现为拮抗作用,因此依赖于剂量比的CA模型是描述这两种混合物的最佳模型. Liu等[77]研究了Cu2+-Cu NPs、Zn2+-ZnO NPs、Zn2+-Cu NPs以及Cu2+-ZnO NPs等4种混合物对生菜根伸长的影响,发现CA、IA模型能够很好地预测前三种混合物的联合作用,而IA模型在预测Cu2+-ZnO NPs混合物的毒性方面更为准确. 一般来说,CA模型是估计未知作用模式混合物的保守模型,但金属基纳米颗粒可释放离子,纳米颗粒与重金属之间、释放离子与重金属之间的相互作用,均会限制传统模型预测不同种类纳米颗粒(特别是金属基纳米颗粒)和重金属混合物联合毒性的准确性.
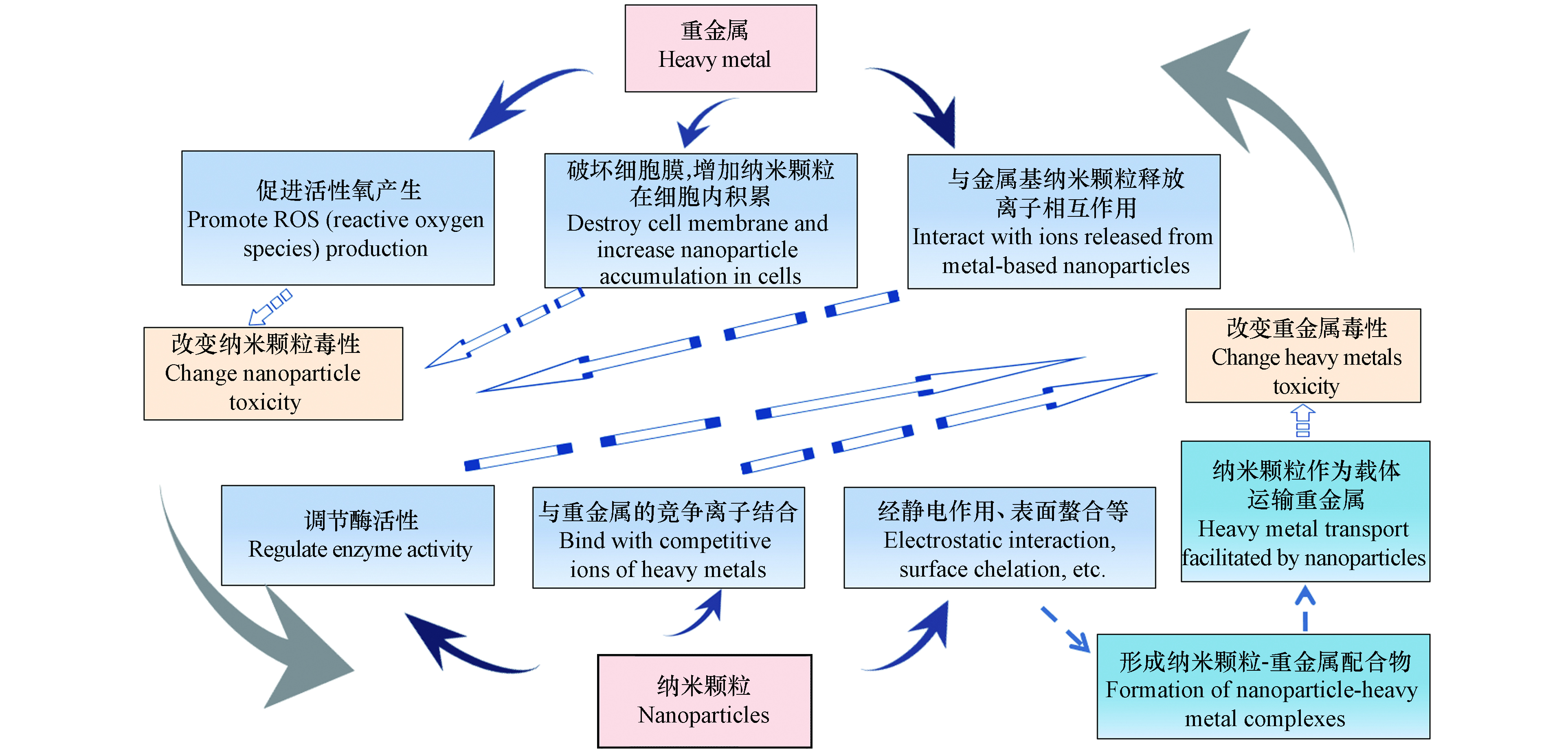
已有不少研究证明了纳米颗粒对重金属毒性效应的影响. 首先,通过静电作用、表面螯合等,纳米颗粒可与重金属形成复合物[101],纳米材料作为载体通过“特洛伊木马”效应,或通过与重金属的竞争离子结合等,增加了重金属的生物有效性:如TiO2 NPs可促使As在铜绿微囊藻和斜生栅藻中大量积累以及甲基化[74],多壁碳纳米管增加了Cd对铜锈环棱螺的氧化损伤[102]. 其次,重金属的吸收为自由态和颗粒态两部分之和,纳米颗粒-重金属复合物的形成降低了金属自由态的浓度,当复合物的颗粒大小不利于生物吸收时,则会降低重金属的生物累积和毒性[103]:如GO NPs通过吸附作用可降低Cd2+对种子根和芽的生长抑制[104],TiO2 NPs可降低Zn2+对斑马鱼胚胎的毒性效应[105]. 此外,纳米材料还可能通过影响生物的生理状态作用于重金属的毒性效应:一些纳米材料能够影响金属硫蛋白的诱导、抗氧化物酶水平、ATP酶活性、细胞膜的结构和通透性[106-108]等. 近来,也有研究开始关注重金属的存在对纳米颗粒生物效应的影响,并提出了一些假设,如重金属通过诱导ROS产生[109]、改变细胞膜性质[110]、影响纳米颗粒的zeta电位和聚集状态[111]、影响金属基纳米颗粒的离子释放等增加或减少纳米颗粒的生物累积,进而改变其毒性效应(图2). 总之,金属与纳米颗粒的相互作用较为复杂,受物质种类、浓度等因素的影响,厘清这些作用机制,对于准确评估纳米颗粒与重金属的联合效应具有重要意义.
若将金属的浓度等信息引入描述符,QNAR也可以用于研究纳米颗粒和重金属的联合作用. 使用与单种纳米颗粒QNAR类似的数据管理(如数据收集、标准化等)和模型方法(算法、验证等),通过引入纳米混合物的描述符(Dmix),拓展QNAR对于混合物的适用性[112-114],其最常见的公式形式如下:
式中,Rn和Dn分别是组分n的摩尔分数和量子化学描述符. 其假设条件为混合物中各组分为加和作用. Mikolajczyk等[112]使用多元线性回归和遗传算法,以锐钛矿相的衍射峰强度(XRDanatase )和钯含量(Pd%mol )为主要描述符,建立了用于评估Au/Pd修饰的TiO2 NPs的光催化活性的QNAR模型,模型拟合R2为0.89,表现出较好的预测效果. Mikolajczyk等[113]又使用多元线性回归方法,以银含量(%molAg) 和混合物绝对电负性(µmix)为描述符,建立了QNAR模型用于预测金属簇(Au、Ag、Pt)修饰的TiO2 NPs对中国仓鼠卵巢细胞系的细胞毒性. 考虑到描述符之间可能存在的共线性问题,也有研究开始使用适用于非线性关系的算法. Yuan等[114]使用多重偏最小二乘回归(PLS,线性)和随机森林回归(RF,非线性),以最高轨道能量、最低轨道能量、绝对电负性、绝对硬度、吸附能为描述符,并分别赋予权重,首次研究了TiO2 NPs和Cu、Zn、Cd、Ni混合物对人肾皮质近曲小管上皮细胞(HK-2)存活率的影响,发现RF建立的QNAR模型具有更佳的预测能力和稳定性. 现有的研究个例表明QNAR在纳米颗粒与重金属混合物联合作用上的预测潜力,但这仅仅只是一个开端,对于混合物而言,适用于混合物描述符的建立、描述符的选择、运算法则(特别是对于非线性关系)的构建,均需要大量的模型运算和实验验证.
近来,随着组学技术的发展,系统毒理学已成为毒理学的重要分支. 使用系统毒理学方法,包括基因组学(genomics)、表观基因组学(epigenomics)、转录组学(transcriptomics)、蛋白组学(proteomics)和代谢组学(metabolomics)技术,能够精确提示污染物(包括混合物)毒性效应的分子机制. 由于分析成本高昂、缺少非模式生物基因注释,目前全基因组学的应用非常有限,主要使用的是全基因组关联分析,即关注单核苷酸多态性来分析单一污染物的作用机制与效应[115-116]. 表观遗传组学主要关注DNA甲基化和转译后的组蛋白修饰,已被用于混合物(主要是有机物)的机制研究[117]. 转录组学与蛋白组学是目前毒理学中应用最多的组学技术. 对于模式生物已有很多商业化的微阵列芯片,被用于从单一到混合物的毒性机理研究. Martínez-Pacheco等[118]使用qRT-PCR阵列(“半组学”方法),分析了重金属混合物(Cd、Pb、As)对miRNA表达的影响,显示了与细胞死亡、炎症等相关的路径干扰. 基于RNA-Seq的转录组学方法能够提供更多的数据和路径信息,通过提高数据解析方法,可为今后混合物机理研究提供新的视野. 蛋白组学对基因组注释的依赖较低,因此可用于污染物及其混合物对环境中非模式生物的毒性机制研究[119]. 同样,代谢组学也经常被用于研究混合物对水生生物(由于其基因注释的缺失)的毒性机制. 如Wu和Wang[120]使用基于核磁共振(nuclear magnetic resonance, NMR)的代谢组学方法测定了Cu和Cd单一及混合暴露对贻贝的毒性,发现它们主要导致神经毒性、干扰能量代谢和渗透压调节. 综上,基于组学的联合毒性研究目前仍然集中于不良结局路径(adverse outcome pathways, AOPs),揭示污染物的作用模式及其相互影响,若与TD数据相关联,理论上可构建适用于混合物的定性定量毒性预测模型[121].
-
随着新型纳米材料的广泛使用以及人们对于单一污染物毒性剂量、作用机理的了解深入,越来越多的研究开始关注它们的联合毒性这一更具挑战性和现实性的问题:
(1)对于重金属联合毒性的评价,目前使用较多的仍是基于重金属间无相互作用或相互作用可忽略的CA、IA模型及其改进模型. 考虑到重金属生物累积过程中的相互作用,一些基于生物生理过程的概念模型,如BLM、TK-TD、DEB等,已开始应用于重金属的混合物研究,它们是揭示污染物相互作用机理、提高模型预测准确性的新型尝试和发展方向.
(2)对于纳米颗粒联合毒性的预测,目前的研究还处于起步阶段,通常使用CA、IA等模型判别颗粒物之间的联合作用类型,但这些模型对纳米颗粒联合毒性的预测还存在一定的不确定性,其适用性与纳米颗粒的种类有关. 鉴于颗粒物的结构性质对效应的决定作用,构建适用于颗粒混合物的QNAR模型可能是一个研究方向,但需要大量实验表征混合后颗粒物的结构性质.
(3)关于重金属-纳米颗粒混合物的联合毒性评价,现有研究也是主要使用CA、IA等模型定性定量判别混合物的联合作用,但是金属离子与颗粒物之间的相互作用限制了模型预测的准确性,今后需要进一步明确它们的相互作用机制. 近来,QNAR也开始被用于预测纳米颗粒与重金属混合物的联合作用,但这种模型的普适性、混合物描述符的建立、运算法则的选取等,都需要更多的数据验证.
随着新型纳米材料的不断研发,大数据与人工智能时代的机器学习技术在评价纳米材料及其混合物的毒性与安全方面表现出巨大优势,相较传统方法能够大幅节省人力、物力和财力. 但目前机器学习主要针对单种纳米颗粒,缺少混合物数据及其生理意义解释. 也有研究建议将机器学习与组学相结合,从而实现基于机理的高通量分析.
重金属-纳米颗粒联合毒性评价模型研究进展
Toxicity prediction models for heavy metal and nanoparticle mixtures
-
摘要: 基于单一污染物的毒性研究无法准确评估真实环境中多污染物共存的生态与健康风险,因此大量研究开始关注混合物联合毒性这一更具挑战性和现实性的课题. 本文围绕当前毒理学领域的主要研究对象——重金属、纳米材料,综述了重金属混合物、纳米颗粒混合物、以及两者混合物的联合作用评价方法,包括基于重金属间无相互作用或相互作用可忽略的浓度加和(concentration addition,CA)模型、独立作用(independent action,IA)模型及其改进模型,基于生物生理过程的生物配体模型(biotic ligand model,BLM)、毒代-毒效动力学模型(toxicokinetictoxicodynamic,TK-TD)、动态能量平衡(dynamic energy budget,DEB)理论,基于颗粒物结构性质的定量纳米结构-活性关系(quantitative nanostructure-activity relationships,QNAR,或nano-QSAR)模型等,介绍了各类模型的基本原理、适用条件和应用情况. 最后对重金属-纳米颗粒联合毒性的未来研究方向进行了展望.Abstract: Toxicity studies based on single pollutant can not exactly evaluate the ecological and health risks of multiple pollutants in environment, a large number of studies have focused on the joint toxicity of mixtures, a more challenging and realistic topic. Heavy metal and nanomaterial are two of the most notable pollutants in the field of toxicology, thus this paper summarizes the evaluation methods of heavy metal mixtures, nanoparticle mixtures and their combined effects, including models based on no interaction or negligible interaction between pollutants (e.g., the concentration addition model, CA; independent action model, IA; and their derived models), models based on physiological process (e.g., biological ligand model, BLM; toxicokinetictoxicodynamic, TK-TD; dynamic energy budget theory, DEB), models based on the structural properties of particles (quantitative nanostructure activity relationships, QNAR or nano QSAR), etc. The basic principles of these models and their applicable conditions are introduced first, and then perspectives for future research in combined toxicity of heavy metals and nanoparticles are discussed in the end.
-
Key words:
- heavy metal /
- nanoparticle /
- joint toxicity /
- toxicity prediction model.
-

-
表 1 联合毒性评价方法在重金属混合物研究中的应用
Table 1. Application of joint toxicity assessment methods for heavy metal mixtures
测试金属
Test metal受试生物
Test organism评价方法
Evaluation method模型评价效果
Result of model evaluation参考文献
ReferenceNi、Zn、Cr、Cd四元混合物 V. fischeri (费氏弧菌) CA、IA CA和IA模拟效果基本一致,对四元重金属混合物拟合效果较好 [20] Zn、Ni、Pb、Cr、As、Cu
二元混合物Scenedesmus obliquus
(斜生栅藻)CI CI方法可以较为准确地表示出污染物联合毒性随组分和比例变化时联合作用的转变 [24] Fe、Mn、Zn、Cu、Pb、Cr
多元混合物Human lung epithelial cells(A549) CA、IA、IAM、IAI模型 CA、IA、IAM模型的预测结果
与实验值存在偏差,IAI模型
模拟效果最好[25] Ni、Fe、Cr、Cd二元混合物 Chlorella pyrenoidosa(蛋白核小球藻)、Selenastrum capricornutum(羊角月牙藻) CA、IA、PCR-IAM CA和IA会高估或低估混合毒性,PCR-IAM可准确评估二元混合物的联合作用 [26] Cu、Zn、Cr、Cd二元混合物 Caenorhabditis elegans CA、IA 相较于IA模型,CA的预测能力更好 [27] Ni、Cu、Mn二元混合物 Paronychiuruskimi (Collembola) TU 对于低效应区评价结果较为可靠 [28] Ni、Zn、Cu、Cd、Pb
二元混合物Daphnia magna、Ceriodaphnia dubia、Hordeum vulgare CA、IA IA评价结果更为准确,CA结果比较保守. 在低效应水平下,CA高估了对Daphnids和H. vulgare
的混合毒性[29] Cd、Cu、Ni、Pb、Zn
二元混合物Phaeocystis antarctica、Cryothecomonas armigera CA、IA 适合重金属对这两种受试生物的毒性预测 [30] Ni、Cu、Cd三元混合物 Lemna minor CA 基于内剂量的CA可以在一定范围内准确评估毒性 [31] Cd、Cu、Ni、Zn三元混合物 Daphnia magna CA、IA CA模型预测Cd、Cu、Ni三元混合物的死亡率优于IA模型,总体预测结果表明CA预测较好 [32] Cd、Ni、Cr二元混合物 Chlorella pyrenoidosa、Selenastrum capricornutum CA、CI CA可描述混合物毒性作用. CI可定量表征二元混合物毒性效应大小,且能比较置信区间内任一效应水平下混合物的联合作用强度 [33] Y、La、Ce二元混合物 Triticum aestivum L. CA、IA CA与IA模型预测结果的准确性相当 [34] Ag、Cd、Cu、Ni、Pb、Zn
二元混合物Lymnaea stagnalis CA、IA 与CA相比,IA的预测偏差相对更小 [35] Hg、Cu、Ni二元混合物 Tetrahymena thermophila
(嗜热四膜虫)MTI 可判断1﹕1浓度比和1﹕1毒性比下金属混合物的联合毒性作用 [36] 表 2 联合毒性评价方法在纳米颗粒混合物研究中的应用
Table 2. Application of joint toxicity assessment methods for nanoparticles
纳米颗粒
Nanoparticle受试生物
Test organism评价方法
Evaluation method模型评价效果
Result of model evaluation参考文献
ReferenceZnO NPs和CuO NPs二元混合物 Scenedesmus obliquus CA、IA CA比IA模型更精确 [76] Cu NPs和ZnO NPs二元混合物 Lactuca sativa L CA、IA IA模型更适合评估Cu NPs和
ZnO NPs混合物的毒性[77] TiO2纳米球和TiO2纳米管二元混合物 Scenedesmus obliquus
Chlorella pyrenoidosaTU、CA、IA TU评估表明TiO2 NPs和TiO2 NTs混合物对藻类产生相加作用. CA和IA模型能分别有效的预测混合物对 S. obliquus 和 C. pyrenoidosa的联合毒性 [78] ZnO NPs和Ag NPs二元混合物 Daphnia magna CA、IA CA对二元纳米混合物的毒性预测
偏差较IA小[79] Zn NPs、Cu NPs、ZnO NPs、CuO NPs
二元混合物V. fischeri IA IA模型预测结果存在较大偏差 [80] ZnO NPs、NiO NPs、CuO NPs、TiO2 NPs、 Fe2O3 NPs的二元混合物 Chlorella vulgaris CA、IA CA比IA模型更精确 [81] -
[1] SENGUL A B, ASMATULU E. Toxicity of metal and metal oxide nanoparticles: A review [J]. Environmental Chemistry Letters, 2020, 18(5): 1659-1683. doi: 10.1007/s10311-020-01033-6 [2] 朱慧萍, 方凤满, 林跃胜, 等. 荻港镇某水泥厂周边不同介质中重金属含量、来源及潜在生态风险分析 [J]. 环境化学, 2017, 36(12): 2711-2718. doi: 10.7524/j.issn.0254-6108.2017032302 ZHU H P, FANG F M, LIN Y S, et al. Distribution, source apportionment and potential ecological risk assessment of heavy metals in different environmental media around a cement factory in Digang Town [J]. Environmental Chemistry, 2017, 36(12): 2711-2718(in Chinese). doi: 10.7524/j.issn.0254-6108.2017032302
[3] MEESTERS J A J, QUIK J T K, KOELMANS A A, et al. Multimedia environmental fate and speciation of engineered nanoparticles: A probabilistic modeling approach [J]. Environmental Science:Nano, 2016, 3(4): 715-727. doi: 10.1039/C6EN00081A [4] SHARIFAN H, MA X M, MOORE J M, et al. Zinc oxide nanoparticles alleviated the bioavailability of cadmium and lead and changed the uptake of iron in hydroponically grown lettuce (Lactuca sativa L. var. longifolia) [J]. ACS Sustainable Chemistry & Engineering, 2019, 7(19): 16401-16409. [5] LIU W Z, WENG C Z, ZHENG J Y, et al. Emerging investigator series: Treatment and recycling of heavy metals from nanosludge [J]. Environmental Science:Nano, 2019, 6(6): 1657-1673. doi: 10.1039/C9EN00120D [6] ABUHATAB S, EL-QANNI A, AL-QALAQ H, et al. Effective adsorptive removal of Zn2+, Cu2+, and Cr3+ heavy metals from aqueous solutions using silica-based embedded with NiO and MgO nanoparticles [J]. Journal of Environmental Management, 2020, 268: 110713. doi: 10.1016/j.jenvman.2020.110713 [7] 李梓萌, 李肖乾, 张文慧, 等. 重金属复合污染对生物影响的研究进展 [J]. 环境化学, 2021, 40(11): 3331-3343. doi: 10.7524/j.issn.0254-6108.2021033107 LI Z M, LI X Q, ZHANG W H, et al. Research progress on the effects of heavy metal compound pollution on organisms [J]. Environmental Chemistry, 2021, 40(11): 3331-3343(in Chinese). doi: 10.7524/j.issn.0254-6108.2021033107
[8] VARDHAN K H, KUMAR P S, PANDA R C. A review on heavy metal pollution, toxicity and remedial measures: Current trends and future perspectives [J]. Journal of Molecular Liquids, 2019, 290: 111197. doi: 10.1016/j.molliq.2019.111197 [9] HRISTOZOV D, MALSCH I. Hazards and risks of engineered nanoparticles for the environment and human health [J]. Sustainability, 2009, 1(4): 1161-1194. doi: 10.3390/su1041161 [10] HE H, ZOU Z, WANG B, et al. Copper oxide nanoparticles induce oxidative DNA damage and cell death via copper ion-mediated P38 MAPK activation in vascular endothelial cells [J]. International Journal of Nanomedicine, 2020, 15: 3291-3302. doi: 10.2147/IJN.S241157 [11] RUSTENBIL J W, POORTVLIET T C W. Copper and zinc in estuarine water: Chemical speciation in relation to bioavailability to the marine planktonic diatomDitylum brightwellii [J]. Environmental Toxicology and Chemistry, 1992, 11(11): 1615-1625. [12] XU X, LI Y, WANG Y, et al. Assessment of toxic interactions of heavy metals in multi-component mixtures using sea urchin embryo-larval bioassay [J]. Toxicology in Vitro, 2011, 25(1): 294-300. doi: 10.1016/j.tiv.2010.09.007 [13] BATLEY G E, KIRBY J K, MCLAUGHLIN M J. Fate and risks of nanomaterials in aquatic and terrestrial environments [J]. Accounts of Chemical Research, 2013, 46(3): 854-862. doi: 10.1021/ar2003368 [14] MIAO W, ZHU B R, XIAO X H, et al. Effects of titanium dioxide nanoparticles on lead bioconcentration and toxicity on thyroid endocrine system and neuronal development in zebrafish larvae [J]. Aquatic Toxicology, 2015, 161: 117-126. doi: 10.1016/j.aquatox.2015.02.002 [15] WANG J J, DAI H, NIE Y G, et al. TiO2 nanoparticles enhance bioaccumulation and toxicity of heavy metals in Caenorhabditis elegans via modification of local concentrations during the sedimentation process [J]. Ecotoxicology and Environmental Safety, 2018, 162: 160-169. doi: 10.1016/j.ecoenv.2018.06.051 [16] TAN L Y, HUANG B, XU S, et al. Aggregation reverses the carrier effects of TiO2 nanoparticles on cadmium accumulation in the waterflea Daphnia magna [J]. Environmental Science & Technology, 2017, 51(2): 932-939. [17] 杨蓉, 李娜, 饶凯锋, 等. 环境混合物的联合毒性研究方法 [J]. 生态毒理学报, 2016, 11(1): 1-13. YANG R, LI N, RAO K F, et al. Review on methodology for environmental mixture toxicity study [J]. Asian Journal of Ecotoxicology, 2016, 11(1): 1-13(in Chinese).
[18] 曾鸣, 林志芬, 尹大强, 等. 混合污染物联合毒性研究进展 [J]. 环境科学与技术, 2009, 32(2): 80-86. doi: 10.3969/j.issn.1003-6504.2009.02.021 ZENG M, LIN Z F, YIN D Q, et al. Progress on joint effect of mixture pollutants [J]. Environmental Science & Technology, 2009, 32(2): 80-86(in Chinese). doi: 10.3969/j.issn.1003-6504.2009.02.021
[19] BERENBAUM M C. A method for testing for synergy with any number of agents [J]. The Journal of Infectious Diseases, 1978, 137(2): 122-130. doi: 10.1093/infdis/137.2.122 [20] 莫凌云, 梁丽营, 覃礼堂, 等. 定性与定量评估4种重金属及2种农药混合物对费氏弧菌的毒性相互作用 [J]. 生态毒理学报, 2018, 13(1): 251-260. doi: 10.7524/AJE.1673-5897.20170115002 MO L Y, LIANG L Y, QIN L T, et al. Qualitative and quantitative assessment for the toxicity interaction of mixtures of four heavy metals and two pesticides on Vibrio fischeri [J]. Asian Journal of Ecotoxicology, 2018, 13(1): 251-260(in Chinese). doi: 10.7524/AJE.1673-5897.20170115002
[21] 李小朋, 张琛, 李娟, 等. 基于析因设计的多种重金属对发光菌联合毒性研究 [J]. 环境科学与技术, 2012, 35(12): 169-174. doi: 10.3969/j.issn.1003-6504.2012.12.036 LI X P, ZHANG C, LI J, et al. Joint toxicity of multi-heavy-metal to Photobacterium phosphoreum based on factorial design [J]. Environmental Science & Technology, 2012, 35(12): 169-174(in Chinese). doi: 10.3969/j.issn.1003-6504.2012.12.036
[22] LOEWE S. Die quantitativen probleme der pharmakologie [J]. Ergebnisse Der Physiologie, 1928, 27(1): 47-187. doi: 10.1007/BF02322290 [23] BLISS C I. The toxicity of poisons applied jointly1 [J]. Annals of Applied Biology, 1939, 26(3): 585-615. doi: 10.1111/j.1744-7348.1939.tb06990.x [24] 刘砥, 曾鸿鹄, 邓杨, 等. 二元重金属混合物联合胁迫斜生栅藻毒性研究 [J]. 科学技术与工程, 2019, 19(22): 374-383. doi: 10.3969/j.issn.1671-1815.2019.22.056 LIU D, ZENG H H, DENG Y, et al. Combined stress toxicity of binary heavy metal mixture to Scenedesmus obliquus [J]. Science Technology and Engineering, 2019, 19(22): 374-383(in Chinese). doi: 10.3969/j.issn.1671-1815.2019.22.056
[25] YUAN Y, WU Y, GE X L, et al. In vitro toxicity evaluation of heavy metals in urban air particulate matter on human lung epithelial cells [J]. Science of the Total Environment, 2019, 678: 301-308. doi: 10.1016/j.scitotenv.2019.04.431 [26] 邓杨, 覃礼堂, 曾鸿鹄, 等. 基于主成分回归的整合模型预测重金属混合物毒性 [J]. 中国环境科学, 2018, 38(5): 1970-1978. doi: 10.3969/j.issn.1000-6923.2018.05.043 DENG Y, QIN L T, ZENG H H, et al. Prediction of toxicity of heavy metal mixture by integrated model based on principal component regression [J]. China Environmental Science, 2018, 38(5): 1970-1978(in Chinese). doi: 10.3969/j.issn.1000-6923.2018.05.043
[27] CHEN J D, JIANG Y, XU C, et al. Comparison of two mathematical prediction models in assessing the toxicity of heavy metal mixtures to the feeding of the nematode Caenorhabditis elegans [J]. Ecotoxicology and Environmental Safety, 2013, 94: 73-79. doi: 10.1016/j.ecoenv.2013.04.026 [28] SON J, LEE Y S, KIM Y, et al. Joint toxic action of binary metal mixtures of copper, Manganese and nickel to Paronychiurus kimi (Collembola) [J]. Ecotoxicology and Environmental Safety, 2016, 132: 164-169. doi: 10.1016/j.ecoenv.2016.05.034 [29] NYS C, VERSIEREN L, CORDERY K I, et al. Systematic evaluation of chronic metal-mixture toxicity to three species and implications for risk assessment [J]. Environmental Science & Technology, 2017, 51(8): 4615-4623. [30] KOPPEL D J, ADAMS M S, KING C K, et al. Chronic toxicity of an environmentally relevant and equitoxic ratio of five metals to two Antarctic marine microalgae shows complex mixture interactivity [J]. Environmental Pollution, 2018, 242: 1319-1330. doi: 10.1016/j.envpol.2018.07.110 [31] GOPALAPILLAI Y, HALE B A. Internal versus External Dose for Describing Ternary Metal Mixture (Ni, Cu, Cd) Chronic Toxicity to Lemna minor [J]. Environmental Science & Technology, 2017, 51(9): 5233-5241. [32] TRAUDT E M, RANVILLE J F, MEYER J S. Acute toxicity of ternary Cd-Cu-Ni and Cd-Ni-Zn mixtures to Daphnia magna: Dominant metal pairs change along a concentration gradient [J]. Environmental Science & Technology, 2017, 51(8): 4471-4481. [33] MO L Y, ZHENG M Y, QIN M, et al. Quantitative characterization of the toxicities of Cd-Ni and Cd-Cr binary mixtures using combination index method [J]. BioMed Research International, 2016, 2016: 4158451. [34] GONG B, HE E K, QIU H, et al. Phytotoxicity of individual and binary mixtures of rare earth elements (Y, La, and Ce) in relation to bioavailability [J]. Environmental Pollution, 2019, 246: 114-121. doi: 10.1016/j.envpol.2018.11.106 [35] CRÉMAZY A, BRIX K V, WOOD C M. Chronic toxicity of binary mixtures of six metals (Ag, Cd, Cu, Ni, Pb, and Zn) to the great pond snail Lymnaea stagnalis [J]. Environmental Science & Technology, 2018, 52(10): 5979-5988. [36] 马正学, 王业秋, 宁应之, 等. Hg2+, Ni2+和Cu2+对嗜热四膜虫的急性及联合毒性效应 [J]. 环境科学研究, 2008, 21(4): 174-178. MA Z X, WANG Y Q, NING Y Z, et al. Acute and joint toxicities of Hg2+, Ni2+ and Cu2+ to Tetrahymena thermophila [J]. Research of Environmental Sciences, 2008, 21(4): 174-178(in Chinese).
[37] 刘树深, 刘玲, 陈浮. 浓度加和模型在化学混合物毒性评估中的应用 [J]. 化学学报, 2013, 71(10): 1335-1340. doi: 10.6023/A13040355 LIU S S, LIU L, CHEN F. Application of the concentration addition model in the assessment of chemical mixture toxicity [J]. Acta Chimica Sinica, 2013, 71(10): 1335-1340(in Chinese). doi: 10.6023/A13040355
[38] 李恺, 刘树深, 屈锐. 组合指数在环境混合物联合毒性研究中的初步应用 [J]. 生态毒理学报, 2017, 12(3): 62-71. LI K, LIU S S, QU R. Application of the combination index in the assessment of combined toxicity of environmental mixture [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 62-71(in Chinese).
[39] MARKING L L. Method for assessing additive toxicity of chemical mixtures[M]//Aquatic Toxicology and Hazard Evaluation. 100 Barr Harbor Drive, PO Box C700, West Conshohocken, PA 19428-2959: ASTM International, 2009: 99-99-10. [40] KÖNEMANN H. Fish toxicity tests with mixtures of more than two chemicals: A proposal for a quantitative approach and experimental results [J]. Toxicology, 1981, 19(3): 229-238. doi: 10.1016/0300-483X(81)90132-3 [41] WANG Y H, CHEN C, QIAN Y Z, et al. Ternary toxicological interactions of insecticides, herbicides, and a heavy metal on the earthworm Eisenia fetida [J]. Journal of Hazardous Materials, 2015, 284: 233-240. doi: 10.1016/j.jhazmat.2014.11.017 [42] HEYS K A, SHORE R F, PEREIRA M G, et al. Risk assessment of environmental mixture effects [J]. RSC Advances, 2016, 6(53): 47844-47857. doi: 10.1039/C6RA05406D [43] QIN L T, LIU S S, ZHANG J, et al. A novel model integrated concentration addition with independent action for the prediction of toxicity of multi-component mixture [J]. Toxicology, 2011, 280(3): 164-172. doi: 10.1016/j.tox.2010.12.007 [44] MWENSE M, WANG X Z, BUONTEMPO F V, et al. Prediction of noninteractive mixture toxicity of organic compounds based on a fuzzy set method [J]. Journal of Chemical Information and Computer Sciences, 2004, 44(5): 1763-1773. doi: 10.1021/ci0499368 [45] MWENSE M, WANG X Z, BUONTEMPO F V, et al. QSAR approach for mixture toxicity prediction using independent latent descriptors and fuzzy membership functions [J]. SAR and QSAR in Environmental Research, 2006, 17(1): 53-73. doi: 10.1080/10659360600562202 [46] RA J S, LEE B C, CHANG N I, et al. Estimating the combined toxicity by two-step prediction model on the complicated chemical mixtures from wastewater treatment plant effluents [J]. Environmental Toxicology and Chemistry, 2006, 25(8): 2107-2113. doi: 10.1897/05-484R.1 [47] OLMSTEAD A W, LEBLANC G A. Toxicity assessment of environmentally relevant pollutant mixtures using a heuristic model [J]. Integrated Environmental Assessment and Management, 2005, 1(2): 114-122. doi: 10.1897/IEAM_2004-005R.1 [48] KIM J, KIM S, SCHAUMANN G E. Development of a partial least squares-based integrated addition model for predicting mixture toxicity [J]. Human and Ecological Risk Assessment:an International Journal, 2014, 20(1): 174-200. doi: 10.1080/10807039.2012.754312 [49] RIDER C V, LEBLANC G A. An integrated addition and interaction model for assessing toxicity of chemical mixtures [J]. Toxicological Sciences, 2005, 87(2): 520-528. doi: 10.1093/toxsci/kfi247 [50] FENG J F, GAO Y F, JI Y J, et al. Quantifying the interactions among metal mixtures in toxicodynamic process with generalized linear model [J]. Journal of Hazardous Materials, 2018, 345: 97-106. doi: 10.1016/j.jhazmat.2017.11.013 [51] SPURGEON D J, JONES O A H, DORNE J L C M, et al. Systems toxicology approaches for understanding the joint effects of environmental chemical mixtures [J]. Science of the Total Environment, 2010, 408(18): 3725-3734. doi: 10.1016/j.scitotenv.2010.02.038 [52] CAMPBEL P. Interactions between trace metals and aquatic organisms: A critique of the Free-ion Activity Model [J]. Metal Speciation and Bioavailability in Aquatic Systems, 1995: 45-102. [53] NIYOGI S, WOOD C M. Biotic ligand model, a flexible tool for developing site-specific water quality guidelines for metals [J]. Environmental Science & Technology, 2004, 38(23): 6177-6192. [54] PLAYLE R C. Using multiple metal-gill binding models and the toxic unit concept to help reconcile multiple-metal toxicity results [J]. Aquatic Toxicology, 2004, 67(4): 359-370. doi: 10.1016/j.aquatox.2004.01.017 [55] WU M Y, WANG X D, JIA Z G, et al. Modeling acute toxicity of metal mixtures to wheat (Triticum aestivum L. ) using the biotic ligand model-based toxic units method [J]. Scientific Reports, 2017, 7: 9443. doi: 10.1038/s41598-017-09940-5 [56] WANG X D, JI D X, CHEN X L, et al. Extended biotic ligand model for predicting combined Cu-Zn toxicity to wheat (Triticum aestivum L. ): Incorporating the effects of concentration ratio, major cations and pH [J]. Environmental Pollution, 2017, 230: 210-217. doi: 10.1016/j.envpol.2017.06.037 [57] LIU Y, VIJVER M G, PEIJNENBURG W J G M. Comparing three approaches in extending biotic ligand models to predict the toxicity of binary metal mixtures (Cu-Ni, Cu-Zn and Cu-Ag) to lettuce (Lactuca sativa L. ) [J]. Chemosphere, 2014, 112: 282-288. doi: 10.1016/j.chemosphere.2014.04.077 [58] JAGER T, ALBERT C, PREUSS T G, et al. General unified threshold model of survival - a toxicokinetic-toxicodynamic framework for ecotoxicology [J]. Environmental Science & Technology, 2011, 45(7): 2529-2540. [59] GAO Y F, FENG J F, WANG C C, et al. Modeling interactions and toxicity of Cu-Zn mixtures to zebrafish larvae [J]. Ecotoxicology and Environmental Safety, 2017, 138: 146-153. doi: 10.1016/j.ecoenv.2016.12.028 [60] GAO Y F, FENG J F, HAN F, et al. Application of biotic ligand and toxicokinetic-toxicodynamic modeling to predict the accumulation and toxicity of metal mixtures to zebrafish larvae [J]. Environmental Pollution, 2016, 213: 16-29. doi: 10.1016/j.envpol.2016.01.073 [61] JAGER T, VANDENBROUCK T, BAAS J, et al. A biology-based approach for mixture toxicity of multiple endpoints over the life cycle [J]. Ecotoxicology, 2010, 19(2): 351-361. doi: 10.1007/s10646-009-0417-z [62] KOOIJMAN S A L M, SOUSA T, PECQUERIE L, et al. From food-dependent statistics to metabolic parameters, a practical Guide to the use of dynamic energy budget theory [J]. Biological Reviews of the Cambridge Philosophical Society, 2008, 83(4): 533-552. doi: 10.1111/j.1469-185X.2008.00053.x [63] PÉRY A R R, GEFFARD A, CONRAD A, et al. Assessing the risk of metal mixtures in contaminated sediments on Chironomus riparius based on cytosolic accumulation [J]. Ecotoxicology and Environmental Safety, 2008, 71(3): 869-873. doi: 10.1016/j.ecoenv.2008.04.009 [64] XIE M D, SUN Y X, FENG J F, et al. Predicting the toxic effects of Cu and Cd on Chlamydomonas reinhardtii with a DEBtox model [J]. Aquatic Toxicology, 2019, 210: 106-116. doi: 10.1016/j.aquatox.2019.02.018 [65] MARGERIT A, GOMEZ E, GILBIN R. Dynamic energy-based modeling of uranium and cadmium joint toxicity to Caenorhabditis elegans [J]. Chemosphere, 2016, 146: 405-412. doi: 10.1016/j.chemosphere.2015.12.029 [66] KUNHIKRISHNAN A, SHON H K, BOLAN N S, et al. Sources, distribution, environmental fate, and ecological effects of nanomaterials in wastewater streams [J]. Critical Reviews in Environmental Science and Technology, 2015, 45(4): 277-318. doi: 10.1080/10643389.2013.852407 [67] ARMSTRONG D, BHARALI D. Oxidative stress and nanotechnology: Methods and protocols [J]. Methods in Molecular Biology, 2013: 155-164. [68] MA H B, WALLIS L K, DIAMOND S, et al. Impact of solar UV radiation on toxicity of ZnO nanoparticles through photocatalytic reactive oxygen species (ROS) generation and photo-induced dissolution [J]. Environmental Pollution, 2014, 193: 165-172. doi: 10.1016/j.envpol.2014.06.027 [69] HAILAN W A, AL-ANAZI K M, FARAH M A, et al. Reactive oxygen species-mediated cytotoxicity in liver carcinoma cells induced by silver nanoparticles biosynthesized using Schinus molle extract [J]. Nanomaterials (Basel, Switzerland), 2022, 12(1): 161. doi: 10.3390/nano12010161 [70] RODRIGUEZ-YAÑEZ Y, MUÑOZ B, ALBORES A. Mechanisms of toxicity by carbon nanotubes [J]. Toxicology Mechanisms and Methods, 2013, 23(3): 178-195. doi: 10.3109/15376516.2012.754534 [71] GARCÍA-ALONSO J, KHAN F R, MISRA S K, et al. Cellular internalization of silver nanoparticles in gut epithelia of the estuarine polychaete Nereis diversicolor [J]. Environmental Science & Technology, 2011, 45(10): 4630-4636. [72] WU D, ZHANG J J, DU W C, et al. Toxicity mechanism of cerium oxide nanoparticles on cyanobacteria Microcystis aeruginosa and their ecological risks [J]. Environmental Science and Pollution Research, 2022, 29(23): 34010-34018. doi: 10.1007/s11356-021-18090-1 [73] TSUGITA M, MORIMOTO N, NAKAYAMA M. SiO2 and TiO2 nanoparticles synergistically trigger macrophage inflammatory responses [J]. Particle and Fibre Toxicology, 2017, 14(1): 11. doi: 10.1186/s12989-017-0192-6 [74] TONG T Z, FANG K Q, THOMAS S A, et al. Chemical interactions between nano-ZnO and nano-TiO2 in a natural aqueous medium [J]. Environmental Science & Technology, 2014, 48(14): 7924-7932. [75] TONG T Z, WILKE C M, WU J S, et al. Combined toxicity of nano-ZnO and nano-TiO2: From single- to multinanomaterial systems [J]. Environmental Science & Technology, 2015, 49(13): 8113-8123. [76] YE N, WANG Z, FANG H, et al. Combined ecotoxicity of binary zinc oxide and copper oxide nanoparticles to Scenedesmus obliquus [J]. Journal of Environmental Science and Health, Part A, 2017, 52(6): 555-560. doi: 10.1080/10934529.2017.1284434 [77] LIU Y, BAAS J, PEIJNENBURG W J G M, et al. Evaluating the combined toxicity of Cu and ZnO nanoparticles: Utility of the concept of additivity and a nested experimental design [J]. Environmental Science & Technology, 2016, 50(10): 5328-5337. [78] WANG Z, JIN S G, ZHANG F, et al. Combined toxicity of TiO2 nanospherical particles and TiO2 nanotubes to two microalgae with different morphology [J]. Nanomaterials, 2020, 10(12): 2559. doi: 10.3390/nano10122559 [79] LOPES S, PINHEIRO C, SOARES A M V M, et al. Joint toxicity prediction of nanoparticles and ionic counterparts: Simulating toxicity under a fate scenario [J]. Journal of Hazardous Materials, 2016, 320: 1-9. doi: 10.1016/j.jhazmat.2016.07.068 [80] ZHANG H J, SHI J H, SU Y L, et al. Acute toxicity evaluation of nanoparticles mixtures using luminescent bacteria [J]. Environmental Monitoring and Assessment, 2020, 192(8): 484. doi: 10.1007/s10661-020-08444-6 [81] KO K S, KOH D C, KONG I C. Toxicity evaluation of individual and mixtures of nanoparticles based on algal chlorophyll content and cell count [J]. Materials (Basel, Switzerland), 2018, 11(1): 121. doi: 10.3390/ma11010121 [82] ROUBEAU DUMONT E, ELGER A, AZÉMA C, et al. Cutting-edge spectroscopy techniques highlight toxicity mechanisms of copper oxide nanoparticles in the aquatic plant Myriophyllum spicatum [J]. Science of the Total Environment, 2022, 803: 150001. doi: 10.1016/j.scitotenv.2021.150001 [83] HOLMES A M, SONG Z, MOGHIMI H R, et al. Relative penetration of zinc oxide and zinc ions into human skin after application of different zinc oxide formulations [J]. ACS Nano, 2016, 10(2): 1810-1819. doi: 10.1021/acsnano.5b04148 [84] KADRI O, KARMOUS I, KHARBECH O, et al. Cu and CuO nanoparticles affected the germination and the growth of barley (Hordeum vulgare L. ) seedling [J]. Bulletin of Environmental Contamination and Toxicology, 2022, 108(3): 585-593. doi: 10.1007/s00128-021-03425-y [85] YE N, WANG Z, WANG S, et al. Toxicity of mixtures of zinc oxide and graphene oxide nanoparticles to aquatic organisms of different trophic level: Particles outperform dissolved ions [J]. Nanotoxicology, 2018, 12(5): 423-438. doi: 10.1080/17435390.2018.1458342 [86] PUZYN T, LESZCZYNSKA D, LESZCZYNSKI J. Toward the development of â Nano-QSARsâ: Advances and challenges [J]. Small, 2009, 5(22): 2494-2509. doi: 10.1002/smll.200900179 [87] FOURCHES D, PU D, TROPSHA A. Exploring quantitative nanostructure-activity relationships (QNAR) modeling as a tool for predicting biological effects of manufactured nanoparticles [J]. Combinatorial Chemistry & High Throughput Screening, 2011, 14(3): 217-225. [88] SIFONTE E P, CASTRO-SMIRNOV F A, JIMENEZ A A S, et al. Quantum mechanics descriptors in a nano-QSAR model to predict metal oxide nanoparticles toxicity in human keratinous cells [J]. Journal of Nanoparticle Research, 2021, 23(8): 161. doi: 10.1007/s11051-021-05288-0 [89] ROY J, ROY K. Assessment of toxicity of metal oxide and hydroxide nanoparticles using the QSAR modeling approach [J]. Environmental Science:Nano, 2021, 8(11): 3395-3407. doi: 10.1039/D1EN00733E [90] THWALA M M, AFANTITIS A, PAPADIAMANTIS A G, et al. Using the Isalos platform to develop a (Q)SAR model that predicts metal oxide toxicity utilizing facet-based electronic, image analysis-based, and periodic table derived properties as descriptors [J]. Structural Chemistry, 2022, 33(2): 527-538. doi: 10.1007/s11224-021-01869-w [91] CHEN G C, VIJVER M G, XIAO Y L, et al. A review of recent advances towards the development of (quantitative) structure-activity relationships for metallic nanomaterials [J]. Materials (Basel, Switzerland), 2017, 10(9): 1013. doi: 10.3390/ma10091013 [92] PUZYN T, RASULEV B, GAJEWICZ A, et al. Using nano-QSAR to predict the cytotoxicity of metal oxide nanoparticles [J]. Nature Nanotechnology, 2011, 6(3): 175-178. doi: 10.1038/nnano.2011.10 [93] WANG Z, VIJVER M G, PEIJNENBURG W J G M. Multiscale coupling strategy for nano ecotoxicology prediction [J]. Environmental Science & Technology, 2018, 52(14): 7598-7600. [94] KOVALISHYN V, ABRAMENKO N, KOPERNYK I, et al. Modelling the toxicity of a large set of metal and metal oxide nanoparticles using the OCHEM platform [J]. Food and Chemical Toxicology, 2018, 112: 507-517. doi: 10.1016/j.fct.2017.08.008 [95] ZHANG F, WANG Z, VIJVER M G, et al. Prediction of the joint toxicity of multiple engineered nanoparticles: The integration of classic mixture models and In silico methods [J]. Chemical Research in Toxicology, 2021, 34(2): 176-178. doi: 10.1021/acs.chemrestox.0c00300 [96] XU W H, YANG T, LIU S B, et al. Insights into the Synthesis, types and application of iron Nanoparticles: The overlooked significance of environmental effects [J]. Environment International, 2022, 158: 106980. doi: 10.1016/j.envint.2021.106980 [97] DIBYANSHU K, CHHAYA T, RAYCHOUDHURY T. A review on the fate and transport behavior of engineered nanoparticles: Possibility of becoming an emerging contaminant in the groundwater [J]. International Journal of Environmental Science and Technology, 2022: 1-24. [98] de BENI E, GIURLANI W, FABBRI L, et al. Graphene-based nanomaterials in the electroplating industry: A suitable choice for heavy metal removal from wastewater [J]. Chemosphere, 2022, 292: 133448. doi: 10.1016/j.chemosphere.2021.133448 [99] PARK C B, JUNG J W, BAEK M, et al. Mixture toxicity of metal oxide nanoparticles and silver ions on Daphnia magna [J]. Journal of Nanoparticle Research, 2019, 21(8): 166. doi: 10.1007/s11051-019-4606-2 [100] BAEK M J, SON J, PARK J, et al. Quantitative prediction of mixture toxicity of AgNO 3 and ZnO nanoparticles on Daphnia magna [J]. Science and Technology of Advanced Materials, 2020, 21(1): 333-345. doi: 10.1080/14686996.2020.1766343 [101] KUMAR R, KHAN M A, HAQ N. Application of carbon nanotubes in heavy metals remediation [J]. Critical Reviews in Environmental Science and Technology, 2014, 44(9): 1000-1035. doi: 10.1080/10643389.2012.741314 [102] 王萌, 刘珊珊, 龙奕, 等. 沉积物中不同浓度多壁碳纳米管对Cd和BDE-47生态毒性的影响 [J]. 环境科学学报, 2015, 35(12): 4150-4158. doi: 10.13671/j.hjkxxb.2015.0570 WANG M, LIU S S, LONG Y, et al. Impacts of multi-walled carbon nanotubes on ecotoxicity of Cd and BDE-47 in sediments [J]. Acta Scientiae Circumstantiae, 2015, 35(12): 4150-4158(in Chinese). doi: 10.13671/j.hjkxxb.2015.0570
[103] YANG W W, LI Y, MIAO A J, et al. Cd2+ toxicity as affected by bare TiO2 nanoparticles and their bulk counterpart [J]. Ecotoxicology and Environmental Safety, 2012, 85: 44-51. doi: 10.1016/j.ecoenv.2012.08.024 [104] YIN L Y, WANG Z, WANG S G, et al. Effects of graphene oxide and/or Cd2+ on seed germination, seedling growth, and uptake to Cd2+ in solution culture [J]. Water, Air, & Soil Pollution, 2018, 229(5): 151. [105] HUA J, PEIJNENBURG W J G M, VIJVER M G. TiO2 nanoparticles reduce the effects of ZnO nanoparticles and Zn ions on zebrafish embryos (Danio rerio) [J]. NanoImpact, 2016, 2: 45-53. doi: 10.1016/j.impact.2016.06.005 [106] BIGORGNE E, FOUCAUD L, LAPIED E, et al. Ecotoxicological assessment of TiO2 byproducts on the earthworm Eisenia fetida [J]. Environmental Pollution, 2011, 159(10): 2698-2705. doi: 10.1016/j.envpol.2011.05.024 [107] FEDERICI G, SHAW B J, HANDY R D. Toxicity of titanium dioxide nanoparticles to rainbow trout (Oncorhynchus mykiss): Gill injury, oxidative stress, and other physiological effects [J]. Aquatic Toxicology, 2007, 84(4): 415-430. doi: 10.1016/j.aquatox.2007.07.009 [108] VENKATACHALAM P, JAYARAJ M, MANIKANDAN R, et al. Zinc oxide nanoparticles (ZnONPs) alleviate heavy metal-induced toxicity in Leucaena leucocephala seedlings: A physiochemical analysis [J]. Plant Physiology and Biochemistry, 2017, 110: 59-69. doi: 10.1016/j.plaphy.2016.08.022 [109] MOUSSA H, MERLIN C, DEZANET C, et al. Trace amounts of Cu2+ ions influence ROS production and cytotoxicity of ZnO quantum dots [J]. Journal of Hazardous Materials, 2016, 304: 532-542. doi: 10.1016/j.jhazmat.2015.11.013 [110] CUI X J, WAN B, GUO L H, et al. Insight into the mechanisms of combined toxicity of single-walled carbon nanotubes and nickel ions in macrophages: Role of P2X7 receptor [J]. Environmental Science & Technology, 2016, 50(22): 12473-12483. [111] WANG L, LIU J H, SONG Z M, et al. Interaction of multi-walled carbon nanotubes and zinc ions enhances cytotoxicity of zinc ions [J]. Science China (Chemistry), 2016, 59(7): 910-917. doi: 10.1007/s11426-016-5591-2 [112] MIKOLAJCZYK A, MALANKOWSKA A, NOWACZYK G, et al. Combined experimental and computational approach to developing efficient photocatalysts based on Au/Pdâ TiO2 nanoparticles [J]. Environmental Science:Nano, 2016, 3(6): 1425-1435. doi: 10.1039/C6EN00232C [113] MIKOLAJCZYK A, GAJEWICZ A, MULKIEWICZ E, et al. Nano-QSAR modeling for ecosafe design of heterogeneous TiO2-based nano-photocatalysts [J]. Environmental Science:Nano, 2018, 5(5): 1150-1160. doi: 10.1039/C8EN00085A [114] YUAN B L, WANG P F, SANG L Q, et al. QNAR modeling of cytotoxicity of mixing nano-TiO 2 and heavy metals [J]. Ecotoxicology and Environmental Safety, 2021, 208: 111634. doi: 10.1016/j.ecoenv.2020.111634 [115] GIACOMINI K M, YEE S W, MUSHIRODA T, et al. Genome-wide association studies of drug response and toxicity: An opportunity for genome medicine [J]. Nature Reviews Drug Discovery, 2017, 16(1): 70. doi: 10.1038/nrd.2016.234 [116] WAMUCHO A, UNRINE J M, KIERAN T J, et al. Genomic mutations after multigenerational exposure of Caenorhabditis elegans to pristine and sulfidized silver nanoparticles [J]. Environmental Pollution, 2019, 254: 113078. doi: 10.1016/j.envpol.2019.113078 [117] DESAULNIERS D, XIAO G H, LIAN H, et al. Effects of mixtures of polychlorinated biphenyls, methylmercury, and organochlorine pesticides on hepatic DNA methylation in prepubertal female Sprague-Dawley rats [J]. International Journal of Toxicology, 2009, 28(4): 294-307. doi: 10.1177/1091581809337918 [118] MARTÍNEZ-PACHECO M, HIDALGO-MIRANDA A, ROMERO-CÓRDOBA S, et al. mRNA and miRNA expression patterns associated to pathways linked to metal mixture health effects [J]. Gene, 2014, 533(2): 508-514. doi: 10.1016/j.gene.2013.09.049 [119] MARIA V L, GOMES T, BARREIRA L, et al. Impact of benzo(a)pyrene, Cu and their mixture on the proteomic response of Mytilus galloprovincialis [J]. Aquatic Toxicology, 2013, 144/145: 284-295. doi: 10.1016/j.aquatox.2013.10.009 [120] WU H F, WANG W X. NMR-based metabolomic studies on the toxicological effects of cadmium and copper on green mussels Perna viridis [J]. Aquatic Toxicology, 2010, 100(4): 339-345. doi: 10.1016/j.aquatox.2010.08.005 [121] MARTINS C, DREIJ K, COSTA P M. The state-of-the art of environmental toxicogenomics: Challenges and perspectives of omics approaches directed to toxicant mixtures [J]. International Journal of Environmental Research and Public Health, 2019, 16(23): 4718. doi: 10.3390/ijerph16234718 -



 下载:
下载: