-
农药在农产品生产,以及林业、草原和卫生害虫防控等方面发挥着重要作用。根据中国农药工业协会数据显示,截至2019年底,我国农药生产企业约1 800家,农药产量151.6×104 t,其中杀虫剂农药占比42.2%,而杀虫剂75%以上为有机磷类农药 (organophosphorus pesticides, OPPs) 。OPPs多为油状液体、微溶于水、难以自然降解,且50%以上OPPs为高毒品种,对人体具有不同程度的致癌性[1]。在农药开发和生产等活动过程中如发生泄漏,会对土壤和地下水造成长期、潜在的危害。当前甲胺磷、对硫磷等毒性较高的OPPs已被农业农村部列入禁限农药[2-3]。
近年来,OPPs在流域水体、土壤、生物体等环境介质中均有不同程度检出[4-5],因其在环境中的持久性、生物累积性及毒性,具有较强生态风险。研究证实OPPs可能会导致神经发育障碍、生殖功能降低以及胎儿出生体重降低等人体危害[6] 。
目前,有关OPPs的研究多集中在表层土壤,对地层剖面污染分布及空间污染羽研究相对较少 [7-13]。不同剖面地层岩性存在不均质性,对OPPs污染物的缓冲、净化作用存在差异。表层土壤岩性单一,不能准确刻画污染物在地层剖面的空间分布特征,影响后续风险评估及治理修复,导致污染治理不完全或过度治理。
本研究以农药生产场地4种OPPs为目标污染物,按照污染质量分数分类,将污染羽划分为质量分数高值和质量分数低值,以确定污染源位置。采用三维空间插值方法,将OPPs污染羽按地层岩性划分,分析不同岩性中OPPs的分布及扩散规律,以为污染源识别和修复治理提供依据。
-
研究地块为我国第一家开发和生产OPPs的重点企业,占地32×104 m2,有50多年的农药生产历史。年生产能力2×104 t,产品为甲拌磷、对硫磷、特丁硫磷、辛硫磷和杀螟硫磷等。由于老工业区改造原因,2010年该企业停产搬迁。经现场勘探,地块局部区域土壤有明显污染痕迹,并伴随刺激性气味。
根据地质勘探结果,构建研究区地层概念模型 (图1) ,将地层按岩性划分[14-15],地块最大勘探深度范围内 (30 m) 地层结构为杂填土层 (0~1.39 m) 、粉土层① (1.39~2 m) 、粉质黏土层① (2~6.12 m) 、粉土层② (6.12~6.8 m) 、粉质黏土层② (6.8~8.1 m) 、粉土层③ (8.1~11 m) 和粉质黏土层③ (>11 m) 共7层。地下水水位埋深约1.0 m,含水层厚度约9 m,分布在以黏性土为主的隔水顶板 (11~12 m) 以上,流向主要为自西北向东南,受大气降水而波动。各土层相关特征参数见表1。
-
如图2所示,依据国家标准《建设用地土壤污染状况调查技术导则》 (HJ25.1-2019) [16],结合生产功能区分布,采用系统布点法,对生产区等潜在污染区加密布设采样点,采样单元面积不大于1 600 m2 (40 m×40 m网格) 。土壤样品按岩性进行采集,同一土层厚度超过3 m时,每2~3 m采集1个样品,相同岩性的至少1个样品。现场共布设土壤采样点202个钻孔,钻孔深度22 m,采集土壤样品2 175个。
采用Geoprobe直推式方式进行岩心采样,土壤样品用250 ml广口玻璃瓶和聚四氟乙烯密封垫的瓶盖完成收集与密封,所有样品采集完成后置于低温保温箱 (4 ℃) 内保存,并送至有检验检测资质的实验室,检测指标涵盖4种OPPs。土壤中OPPs的测定方法及质量控制参考USEPA 8270D-2014 [17]。
-
采用Excel和ArcGIS10.2软件进行数据处理与图件绘制,利用克里金空间插值方法对4种OPPs质量分数进行插值分析,使用EVS-Pro (Version 9.93) 软件绘制OPPs质量分数空间分布。
-
4种OPPs污染物性质和质量分数的统计数据见表2和表3。甲拌磷、乙硫磷、对硫磷、特丁硫磷质量分数最高分别为25 300、8 873、193 000、563 mg·kg−1,平均值分别为697、356、19 102、63 mg·kg−1。根据《EPA 区域筛选值》 (RSL-2017) [18]中标准质量分数,4种OPPs质量分数最高超标100倍以上,平均质量分数超标10倍以上,表明土壤中OPPs污染严重。研究表明,一些农药厂遗留搬迁场地及周边土壤中农药类物质质量分数较高,主要是农药产品生产及其化学废物的堆积造成的污染残留[19]。农药在环境中的降解、迁移、转化由其理化性质决定,其中影响最大的是农药的蒸汽压、水溶解度、分配系数和农药在环境中的降解速率。蒸汽压与水溶解度是决定农药分配系数的主要参数,分配系数则影响场地生物富集性,分配系数大的农药易透过皮肤进入人畜体内[20]。由表2可知,4种OPPs均具有较大的分配系数值 (大于10) ,极易在土壤中吸附。特丁硫磷在土壤中质量分数最低,这可能与蒸气压有关,蒸气压越高,挥发性越强。特丁硫磷蒸气压最高为3.95 Pa,其他3种OPPs蒸气压均小于1 Pa,表明特丁硫磷挥发性最强,易从土壤表面向大气中扩散。
本研究结果发现4种OPPs中超标率最高为甲拌磷 (26.2%) ,其次为乙硫磷 (16.8%) 、特丁硫磷 (15.4%) 和对硫磷 (5.5%) 。这与张春玲等[19]研究结果一致,该研究中,甲拌磷属于国内土壤中普遍检出的高毒性OPPs,平均检出率为13.7%,质量分数在0~0.45 mg·kg−1之间,因其水溶解性和蒸气压接近OPPs类物质的平均值,被普遍认为是OPPs的代表物质[21]。本场地土壤中甲拌磷质量分数及超标率均高于国内普遍水平,表明土壤中OPPs污染严重,对人体健康和环境具有较强潜在风险和危害,应作为特征污染物从环境介质中去除[2]。
-
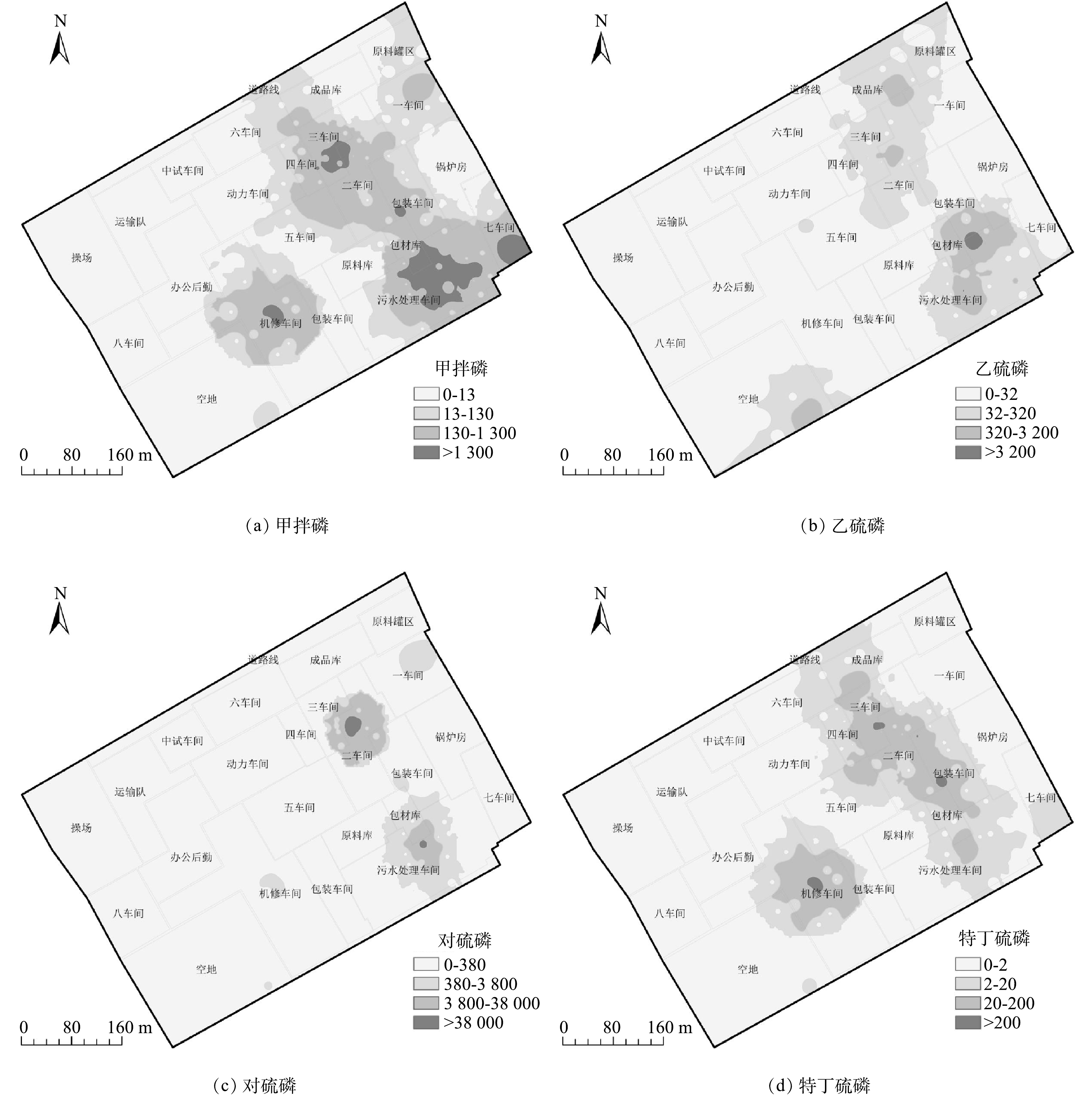
按《EPA 区域筛选值》 (RSL-2017) [18]标准质量分数值将4种OPPs划分为4个梯度,即不超标0~1倍、超标1~10倍、超标10~100倍、超标>100倍。由图3可知,场地土壤中4种OPPs质量分数局部均超标10倍以上,其中甲拌磷、乙硫磷、对硫磷、特丁硫磷质量分数分别超过130、320、3 800、20 mg·kg−1。质量分数高值 (超标>10倍) 区重点分布在生产车间、包装贮存车间及污水处理车间等生产区域。OPPs在生产区域的质量分数是其他区域的10~170倍。污染可能来源于生产罐体、各类水池、管线等,这些装置内溶剂通过污水管道泄露,污水管线埋深多大于2 m,受长期地质作用及腐蚀等影响导致装置下部土壤更易遭受污染,而降雨淋滤作用使污染多限定在污染源周边[22]。4种OPPs污染分布规律相似,由污染源向周围扩散。该结果与刘艳茹等[23]在某在产农药厂土壤污染调查结果一致,即农药污染以原生产车间为中心向周围扩散。
4种OPPs的空间分布特征一致,即质量分数高值区域出现在二、三车间和污水处理车间附近,污染羽呈现西北-东南方向分布,与地下水流方向一致。根据周艳等[24]对某农药污染场地4年的监测可知,污染物随着地下水流向可能发生稀释扩散作用,地下水中的氧化还原电位会加速污染物自然衰减,但污染物质量分数较高时,衰减作用受到抑制。本研究区地下水上游 (二、三车间) 甲拌磷、乙硫磷、对硫磷、特丁硫磷质量分数最高分别为11 600、1 500、193 000、563 mg·kg−1,下游 (污水处理车间) 质量分数最高分别为25 300、8 873、50 200、533 mg·kg−1;同种OPPs上下游污染质量分数降低趋势不明显,由此推断由于OPPs污染质量分数较高,地下水对污染物的迁移及衰减作用较小。4种OPPs污染面积按大小排序为甲拌磷>特丁硫磷>乙硫磷>对硫磷,表明甲拌磷在土壤中迁移能力更强。
-
OPPs作为酯类化合物,具有疏水性,容易被土壤吸附和结合,在土层中富集[25-26]。由图4可知,本研究区4 种OPPs质量分数均随深度增加呈先减小后增加再减少的趋势。甲拌磷、乙硫磷、对硫磷、特丁硫磷质量分数最高值位于杂填土层 (0~1.39 m) 和粉质黏土层③ (>11 m) 中,这可能与地层渗透系数的大小有关。本研究区土层垂向及水平渗透系数为10−6~10−8 cm·s−1,其垂向分布表现为随深度的增加先降低后升高再降低的趋势,该结果与OPPs质量分数垂向分布规律一致。
污染物在环境介质中的迁移规律与污染物种类及降解速率有关[27],王迎菲等[28]研究发现,环境中残余农药在土壤中降解速率随种类及性质而变化。本研究区OPPs垂向分布以迁移深度大小顺序为乙硫磷 (17.9 m) >甲拌磷 (17.6 m) >特丁硫磷 (15.7 m) >对硫磷 (10.8 m) 。根据胡枭等[29]实验证明,对硫磷在氧气不足时可快速分解,甲拌磷、特丁硫磷在好氧条件下可发生氧化反应。本研究区土层孔隙比约0.75~1.06,结构密实,透气性差,近似厌氧条件,对硫磷可能发生降解作用,因此垂向迁移深度小于其他3种OPPs。瞿程凯等[30]在分析土壤-水环境系统中农药迁移特征时发现,污染物可沿着优势通道快速迁移至土层深处,但在孔隙较小的土壤中,污染物被吸附在土壤中或被土壤基质所约束,迁移能力明显降低。本研究区土层分布以粉质黏土层为主,粒径较小,连通性差,具有良好的持水性能,这可能是造成OPPs在不同深度黏土层富集的主要原因。
-
由图5可知,OPPs在地层的垂向分布具有连续性,污染羽以体积大小排序,表现为甲拌磷>特丁硫磷>乙硫磷>对硫磷。4种OPPs的质量分数在场地土壤中均存在高值 (超标>10倍) 和低值 (超标≤10倍) ,整体表现为局部质量分数较高,逐渐向四周扩散的趋势。该结果与肖丽珍等[31]的研究一致,即污染物空间分布特征表现为以质量分数高值区为中心向四周递减。
OPPs在垂向迁移的过程中,若遇到致密且连续的黏性土,可能会横向迁移[32]。分析OPPs在不同深度的水平污染分布可知,甲拌磷、乙硫磷、对硫磷、特丁硫磷局部污染较重,质量分数高值区可能为污染源排放区。本研究区OPPs的质量分数高值与低值分布范围在表层 (0~3 m) 与深层 (>3 m) 土壤中相似,表明经长时间渗透和淋滤作用,OPPs不断向深层迁移。这与刘敏等[33]的研究结果一致,该研究在分析农药生产企业场地污染物插值结果时得出,地下5 m处土样中污染物质量分数空间分布与表层基本一致,且质量分数高值处与表层高值处相对应。
将OPPs插值结果按地层概念模型划分为7层,使污染羽与地层岩性垂向分布相对应。分析污染插值结果可知,甲拌磷、乙硫磷、对硫磷、特丁硫磷在第1层至第7层土样中均有检出,表明4种OPPs在垂向上的迁移能力均较强。OPPs质量分数高值 (超标>10倍) 在第1~4层随深度增加变化不大,在第5~7层中随深度增加逐渐降低,而OPPs质量分数低值 (超标≤10倍) 在第1~7层中随深度增加变化不大。其可能的原因是OPPs质量分数高值超标孔位距离污染源较近,浅层土壤受污染垂向渗透和淋滤作用时间较长所致。在取样深度大于10 m的土壤样品中,甲拌磷、乙硫磷、对硫磷、特丁硫磷质量分数高值 (超标>10倍) 分别为4 700、2 774、272、84.2 mg·kg−1,高于《EPA 区域筛选值》 (RSL-2017) [18],但与本场地土壤中OPPs质量分数最高值对比,降低了68.74%~99.86%,说明OPPs在土层阻隔和吸附作用下发生部分衰减,这与张涛等[26]的研究结果一致。此外,以往研究结果[34]同样表明,农药类污染物在土壤中的半衰期长达20~30年,具有环境持久性与难降解特征,仅依靠自然衰减短时间内无法使OPPs恢复至安全水平。
-
1) 该农药生产地块土壤中存在4种OPPs,即甲拌磷、乙硫磷、对硫磷、特丁硫磷,平均质量分数分别为697、356、19 102、63 mg·kg−1,高于国内农药普遍检出水平。OPPs污染主要集中在生产车间及污水处理车间,表现为以原生产车间为中心向周围扩散。
2) OPPs以污染面积为大小顺序为甲拌磷>特丁硫磷>乙硫磷>对硫磷,迁移能力以深度大小顺序为乙硫磷 (17.9 m) >甲拌磷 (17.6 m) >特丁硫磷 (15.7 m) >对硫磷 (10.8 m) ,表明甲拌磷在土壤中迁移能力更强。
3) 同种OPPs在表层 (0~3 m) 与深层 (>3 m) 土壤中污染分布规律类似,即甲拌磷、乙硫磷、对硫磷、特丁硫磷污染范围随深度增加变化不大。4种OPPs质量分数高值 (超标>10倍) 在土层的阻隔和吸附作用下逐渐降低,但OPPs质量分数低值 (超标≤10倍) 变化不明显。
有机磷农药生产场地污染分布特征分析
Analysis on Distribution Characteristics of Soil Organophosphorus Pesticides (OPPs) in The Production Site
-
摘要: 针对有机磷农药 (OPPs) 生产场地存在污染的环境问题,以某农药生产企业污染地块为研究对象,分析了OPPs在土层中的空间分布和扩散规律。通过三维空间插值表征4种OPPs (甲拌磷、乙硫磷、对硫磷、特丁硫磷) 的污染分布。结果表明,土壤中甲拌磷、乙硫磷、对硫磷、特丁硫磷平均质量分数分别为697、356、19 102、63 mg·kg−1。根据《EPA 区域筛选值》 (RSL-2017) 标准,4种OPPs质量分数均超标10倍以上。随着深度增加,4种OPPs呈现为先减小后增加再减少的趋势,与地层渗透系数变化规律一致。根据插值结果,污染羽面积大小排序为甲拌磷>特丁硫磷>乙硫磷>对硫磷,说明甲拌磷在土壤中的迁移能力最强。同一种OPPs质量分数在表层 (0~3 m) 与深层 (>3 m) 土壤中分布规律相似,局部出现质量分数高值 (超标>10倍) 。OPPs质量分数高值在土层阻隔和吸附作用下出现降低趋势。本研究结果可为农药污染地块调查及修复工程提供参考。Abstract: Aiming at the environmental problem of organophosphorus pesticides (Opps) in the production site, the spatial distribution and diffusion of Opps in the soil layer were analyzed by taking the contaminated site of a pesticide production enterprise as the research object. In this study, the three-dimensional spatial interpolation was used to characterize the pollution distribution of four Opps (phorate, ethiophos, parathion and terbuthion) in soil of a pesticide production site. The average concentrations of phorate, ethiophos, parathion and terbuthion were 697, 356, 19 102 and 63 mg·kg−1, respectively. According to the standard content of EPA Regional Screening Value (RSL-2017), the concentrations of four Opps exceeded the standard values by a factor of > 10. As depth increases, four Opps exhibited a similar trend which first increased, and then decreased and again increased. Such variation was consistent with the permeability coefficient. The rank of pollution plume area was phorate > terbuthion > ethiophos > parathion, which indicated that the migration ability of phorate was the strongest in soil. The distribution trend of Opps concentration was similar in both surface layer (0~3 m) and deep layer (> 3 m) of soil with local high-concentration values (more than 10 times above the standard values). The concentration of high-concentrations Opps decreased under the action of soil barrier and adsorption. Results from the study could provide a scientific basic for the remediation of pesticides in the contaminated sites.
-

-
表 1 农药污染地块不同土层特征参数
Table 1. Characteristic parameters in different soil layers of the pesticide-contaminated site
分层 岩性 孔隙比 天然含水率/% 有机质/% 垂向渗透系数/(cm·s−1) 水平渗透系数/(cm·s−1) 第1层 填土层 1.06 36.3 6 4.98×10-7 5.57×10-7 第2层 粉土① 0.8 25.1 4.2 2.50×10-6 2.00×10-6 第3层 粉质黏土① 0.9 30.95 6.35 1.10×10-8 3.90×10-7 第4层 粉土② 0.8 25.8 2.5 6.60×10-6 8.50×10-6 第5层 粉质黏土② 1 34.8 6.6 7.20×10-8 9.50×10-8 第6层 粉土③ 0.8 26.4 3.1 4.40×10-6 1.80×10-6 第7层 粉质黏土③ 0.75 26.45 4.55 1.00×10-8 4.70×10-8 表 2 OPPs污染物性质
Table 2. Properties of Organophosphorus Pesticide Pollutants
污染物 分子式 蒸气压/
Pa水中溶解度/
(mg·L−1)分配系数 甲拌磷 C7H17O2PS3 0.173 50 2.33×103 乙硫磷 C9H22O4P2S4 2×10-4 2 5.57×104 对硫磷 C10H14NO5PS 2.3×10-3 11 5.38×103 特丁硫磷 C9H21O2PS3 3.95 5.07 1.57×104 表 3 土壤中OPPs检测结果描述性统计
Table 3. Descriptive statistics of OPPs content in soil
污染物 EPA筛选值/
(mg·kg−1)质量分数/ (mg·kg−1) 超标率/% 最大值 平均值 中值 甲拌磷 13 25 300 697 18.6 26.24 乙硫磷 32 8 873 356 5.7 16.83 对硫磷 380 193 000 19 102 0.1 5.45 特丁硫磷 2 563 63 0.1 15.35 -
[1] 国研智库、《中国发展观察》杂志社联合课题组. 我国农药行业存在的主要问题及相关政策建议[J]. 中国发展观察, 2021(5): 51-52+58. doi: 10.3969/j.issn.1673-033X.2021.05.018 [2] 包一翔, 苏琛, 陈君, 等. 禁限用有机磷农药持久性、生物累积性和毒性评估[J]. 现代农药, 2021, 20(3): 33-38. doi: 10.3969/j.issn.1671-5284.2021.03.008 [3] 何小玲, 聂艳, 王念, 等. 有机磷农药污染现状与防治对策[J]. 环境生态学, 2021, 3(10): 38-43. [4] 刘帆, 孔昊玥, 刘红玲. 基于权重敏感度分布研究太湖有机磷农药单一和复合风险[J]. 生态毒理学报, 2020, 15(2): 130-140. doi: 10.7524/AJE.1673-5897.20190521003 [5] RASHID S, RASHID W, TULCAN R, et al. Use, exposure, and environmental impacts of pesticides in Pakistan: a critical review[J]. Environmental science and pollution research international, 2022, 29(29): 1-15. [6] CEQUIER E, SAKHIi A K, HAUG L S, et al. Exposure to organophosphorus pesticides in Norwegian mothers and their children: Diurnal variability in concentrations of their biomarkers and associations with food consumption[J]. Science of the Total Environment, 2017, 590(15): 655-662. [7] 朱国繁, 应蓉蓉, 叶茂, 等. 我国农药生产场地污染土壤修复技术研究进展[J]. 土壤通报, 2021, 52(2): 462-473. doi: 10.19336/j.cnki.trtb.2020073102 [8] JAYARAJ R, MEGHA P, SREEDEV P. Review Article. Organochlorine pesticides, their toxic effects on living organisms and their fate in the environment[J]. Interdisciplinary Toxicology, 2016, 9(3-4): 90-100. doi: 10.1515/intox-2016-0012 [9] 马文洁, 何江涛, 金爱芳, 等. 北京市郊再生水灌区土壤有机氯农药垂向分布特征[J]. 生态环境学报, 2010, 19(7): 1675-1681. doi: 10.3969/j.issn.1674-5906.2010.07.028 [10] 翟美静, 叶雅丽. 化工污染场地土壤污染特征及修复方案分析[J]. 化工管理, 2021(32): 48-49. doi: 10.19900/j.cnki.ISSN1008-4800.2021.32.022 [11] 魏语宁, 刘春光, 付海燕, 等. 有机磷类农药微生物修复研究进展[J]. 中国农学通报, 2022, 38(12): 131-137. doi: 10.11924/j.issn.1000-6850.casb2021-0548 [12] AKASH S, SIVAPRAKASH B, RAJAMOHAN N, et al. Pesticide pollutants in the environment-A critical review on remediation techniques, mechanism and toxicological impact[J]. Chemosphere, 2022, 301: 134754. doi: 10.1016/j.chemosphere.2022.134754 [13] LIU L, BAI L P, MAN C G, et al. DDT vertical migration and formation of accumulation layer in pesticide-producing sites[J]. Environmental Science & Technology, 2015, 49(15): 9084-9091. [14] 贾琳, 夏天翔, 张丽娜, 等. 基于不同空间插值的污染场地土壤锑修复范围预测研究[J]. 土壤, 2022, 54(3): 1-10. [15] 郭甲腾, 代欣位, 刘善军, 等. 一种三维地质体模型的隐式剖切方法[J]. 武汉大学学报(信息科学版), 2021, 46(11): 1766-1773. [16] 生态环境部. 建设用地土壤污染状况调查技术导则: HJ 25.1-2019[S]. 北京: 中国环境出版集团, 2019. [17] EPA. Method 8270D semivolatile organic compounds by gas chromatography/mass spectrometry. [EB/OL].(2014-07)[2022-7-4].https://19january2017snapshot.epa.gov/sites/production/files/2015-12/documents/8270d.pdf [18] EPA. Regional screening levels (RSLs): USA. RSL-2017[S]. EPA, 2017. [19] 张春玲, 杨晓文, 谷中鸣, 等. 农药生产企业废弃场地浅层土壤污染情况调查[J]. 农药, 2014, 53(6): 460-462. doi: 10.16820/j.cnki.1006-0413.2014.06.022 [20] 丁浩东, 万红友, 秦攀, 等. 环境中有机磷农药污染状况、来源及风险评价[J]. 环境化学, 2019, 38(3): 463-479. doi: 10.7524/j.issn.0254-6108.2018051405 [21] MARICAN A, DURAN-LARA E F. A review on pesticide removal through different processes.[J]. Environmental science and pollution research international, 2018, 25(3): 2051-2064. doi: 10.1007/s11356-017-0796-2 [22] 陈锐. 基于建设用地土壤调查分析历史农用地农药潜在污染特征[J]. 环保科技, 2020, 26(6): 57-64. doi: 10.3969/j.issn.1674-0254.2020.06.012 [23] 刘艳茹. 某在产农药厂土壤污染调查与阿特拉津分布特征及风险评估研究[D]. 山东大学, 2021. [24] 周艳, 姜登登, 孔令雅, 等. 典型农药污染场地地下水中苯系物监控自然衰减研究[J]. 环境科学学报, 2022, 42(7): 380-388. [25] 王艳. 不同有机物料对有机磷农药污染土壤酶活性及土壤微生物量的影响[J]. 生态环境学报, 2014(7): 1205-1209. doi: 10.3969/j.issn.1674-5906.2014.07.018 [26] 张涛, 蔡五田, 刘雪松, 等. 某农药厂废弃场地土壤中甲拌磷垂向分布特征[J]. 地球与环境, 2015, 43(4): 445-450. doi: 10.14050/j.cnki.1672-9250.2015.04.010 [27] LV H, SU X S, WANG Y, et al. Effectiveness and mechanism of natural attenuation at a petroleum hydrocarbon contaminated site[J]. Chemosphere, 2018, 206: 293-301. [28] 王迎菲, 张莹, 赵梓彤, 等. 环境中残余农药降解行为的研究[J]. 云南化工, 2020, 47(8): 34-36+40. [29] 胡枭, 樊耀波, 王敏健. 影响有机污染物在土壤中的迁移、转化行为的因素[J]. 环境科学进展, 1999, 7(5): 14-22. [30] 瞿程凯, 邢新丽, 刘佳, 等. 土壤-水环境系统有机氯农药垂直分布与迁移特征[J]. 环境科学与技术, 2013, 36(11): 44-48. [31] 肖丽珍, 张兵, 徐世光. 基于EVS的汞污染物空间分布模拟[J]. 有色金属工程, 2022, 12(5): 149-156. doi: 10.3969/j.issn.2095-1744.2022.05.19 [32] 门晓晔, 杨宗政, 刘肖, 等. 基于三维空间插值技术的某场地中总石油烃污染分布确定[J]. 安全与环境学报, 2017, 17(2): 713-718. doi: 10.13637/j.issn.1009-6094.2017.02.059 [33] 刘敏, 马运. 典型污染场地中滴滴涕浓度空间变异性研究[J]. 环境污染与防治, 2010, 32(11): 12-17. doi: 10.3969/j.issn.1001-3865.2010.11.004 [34] GRUNG M, LIN Y, ZHANG H, et al. Pesticide levels and environmental risk in aquatic environments in China - A review[J]. Environment International, 2015, 81: 87-97. doi: 10.1016/j.envint.2015.04.013 -




 下载:
下载: