-
菌丝球是一种由真菌孢子在特定水力剪切力条件下萌发的菌丝体不断生长缠绕所自发形成的微生物颗粒,具有生物活性良好、沉降速度快和易于分离等特点[1]。在以往水处理研究领域,菌丝球被广泛用于染料和重金属废水的处理[2],对染料和重金属离子具有良好的脱除效能[3]。
铁磁性纳米材料目前已广泛应用于医学、食品等领域。在水处理领域,磁性纳米颗粒仍处于探索和研究阶段。目前,也有研究人员尝试将磁性纳米颗粒材料引入生化系统,对传统活性污泥系统进行改进[4-5]。由于磁性纳米颗粒具有比表面积大、吸附活性强和在磁场作用下易分离的特点,仅在污染物的去除方面是具有一定优点的。但是,磁性纳米颗粒对于微生物的影响作用还不明确。
近年来,环境领域对于污水中出现的新型微污染物越来越重视。雌激素类物质是新兴污染物的代表之一,其在水环境中的含量低,但仍会对人类和动物造成影响和危害[6-7]。常规的水处理技术和手段往往难以将雌激素有效的去除。因此,在该研究中,尝试采用菌丝球作为优质生物质吸附材料,对代表性雌激素(17α-乙炔雌二醇,EE2)进行吸附去除效果的研究,并在吸附过程中加入铁磁纳米颗粒,研究其对菌丝球吸附效果的影响作用。
-
培养菌丝球所用的药品均购自国药集团化学试剂有限公司(优级纯),试验时所用EE2及预处理和分析样品时所用的甲醇、乙腈、乙酸乙酯均购自Sigma公司(色谱纯)。EE2使用甲醇配制标准储备液,试验时根据不同浓度需要稀释加入反应容器中。
-
培养菌丝球所用的真菌采用城市水资源国家重点实验室保存的黑曲霉Aspergillus niger Y3,培养基成分为葡萄糖10 g/L,NH4Cl 1 g/L,KH2PO4·3H2O 1 g/L,MgSO4·7H2O 0.5 g/L,110 ℃,20 min条件下灭菌。
接种方式采用孢子悬液接种法,接种量为:0.025×0.10%×液体培养基体系/孢子悬液吸光度。接种后放入摇床中,在30 ℃,150 r/min条件下进行培养[8]。
-
将100 mL、2 mol/L的FeCl2和400 mL、1 mol/L的FeCl3置于烧杯中,加入转子置于磁力搅拌器上,用碱式滴定管滴加500 mL、5 mol/L的氨水,控制滴加速度,缓慢滴加,待反应完毕后将转子取出反复冲洗,洗液收集在原烧杯中,烧杯下部放置磁铁,倒出上清液,移开磁铁反复清洗3~4次,最后取500 mL去离子水于冲洗完毕后的铁磁纳米颗粒中,超声5 min后倒出密封保存[9]。
-
在pH对菌丝球吸附EE2影响作用试验中,称取2 g菌丝球(湿重)放入若干100 mL三角瓶中,共分为4组,分别加入用0.1 mol/L的磷酸缓冲液调至预定pH的去离子水溶液,pH分别为2.5、3.8、4.7、5.6、6.5和7.8共6组,根据采样时间顺序进行标记,并加入50 μL的1 g/L EE2标准储备液,使稀释后的EE2浓度为1 mg/L。另在各pH条件下均设置一组在90 ℃,30 min下的灭活菌丝球平行试验,定时取样检测。
在不同底物浓度下菌丝球对EE2的吸附作用试验中,在之前确定的最优pH条件下,于EE2浓度分别10、7.5、5、2.5和1 mg/L条件下进行吸附试验。定时取样检测。
在铁磁纳米颗粒对菌丝球吸附EE2影响作用试验中,于pH为4.7、5.6、6.5和7.8条件下加入10 mL铁磁纳米颗粒储备液。EE2浓度为1 mg/L,定时取样检测。
-
吸取10 mL在预定时间下取出的水样到玻璃离心管中,加入2 mL乙酸乙酯,盖紧管塞振荡萃取5 min,静置5 min待液面分层后洗出上层有机相到KD浓缩瓶中,再次向水样加入0.5 mL乙酸乙酯进行二次萃取,振荡5 min,静置5 min待液面分层后再次吸出上层有机相与第1次萃取的液体合并,旋转蒸发至乙酸乙酯全部挥发后,用甲醇定容至1 mL,使用0.45 μm滤膜过滤后装入液相小瓶,放入4 ℃冰箱保存等待检测。
-
预处理后样品采用HPLC法检测。流动相为乙腈:水=50:50,C18柱,柱温30 ℃,进样量25 μL,保留时间5 min。
-
经孢子悬液接种培养72 h后形成的菌丝球SEM图像,见图1。
图1可知,经过72 h培养后形成的菌丝球,其整体呈完整的球体,结构紧实,菌丝相互缠绕团聚。表面疏松,提供了大量的附着空间和结合位点。
-
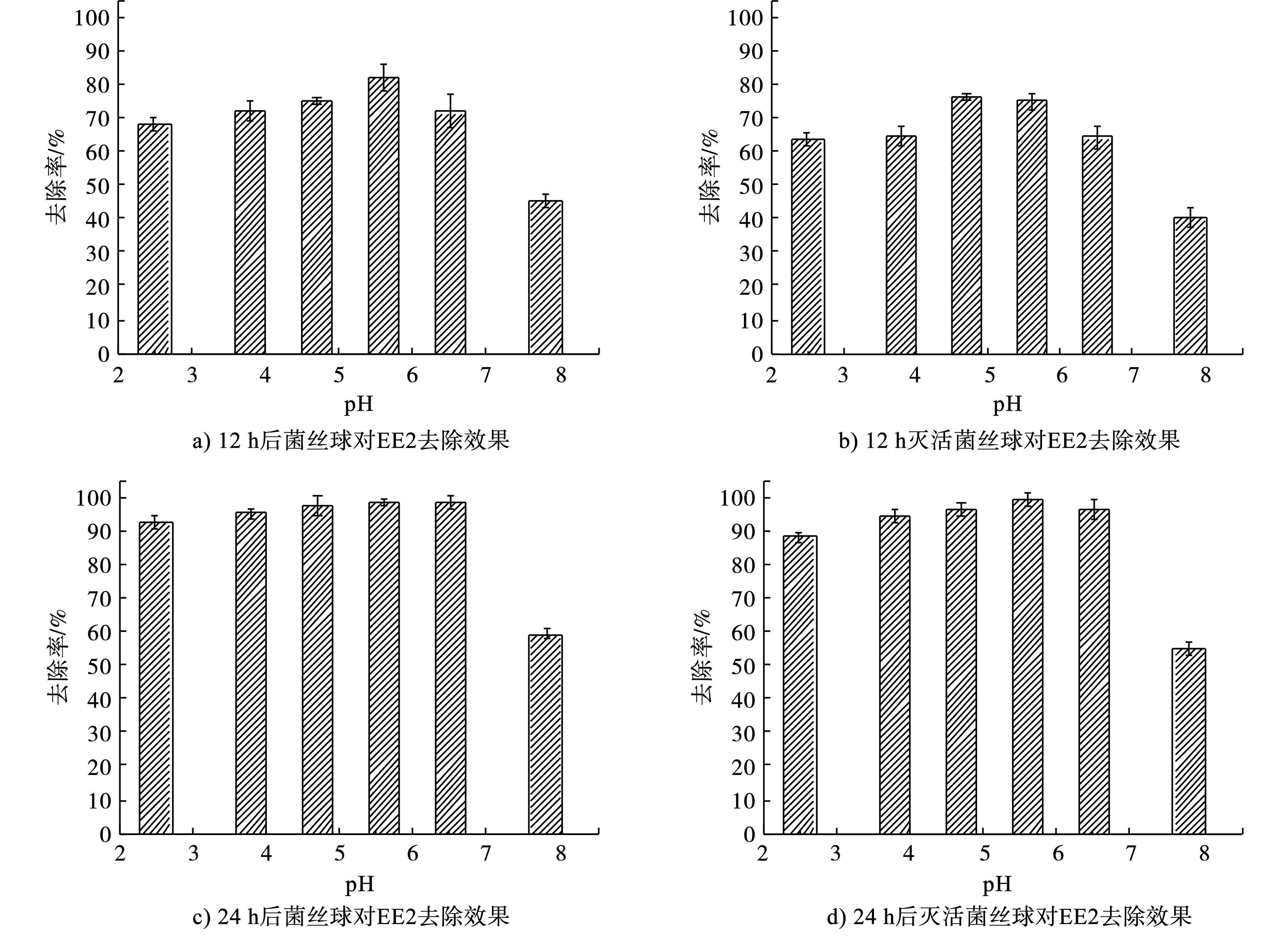
菌丝球与灭活后的菌丝球在不同pH条件下对EE2的静态吸附结果,见图2。
菌丝球是由真菌孢子具有充足的氧和营养时,在特定水流剪切力条件下,所萌发的菌丝体不断生长和缠绕所形成的球形颗粒。图2可知,菌丝球在具有活性和灭活条件下,分别在12 h和24 h时对EE2的去除作用几乎没有差别,因此菌丝球本身对EE2的降解作用可忽略不计,对EE2的去除主要为吸附作用。
图2还可知,pH的变化对菌丝球吸附EE2有较为明显的影响。当pH在2.5~6.5范围区间内,可以发现菌丝球对EE2均具有比较明显的吸附作用,当pH为5.6和6.5时,在24 h内菌丝球对EE2的吸附去除作用可达到99%,在pH<5.6时,菌丝球对EE2的吸附去除也可达到90%以上,而pH=5.6时,菌丝球对EE2吸附速率明显高于其他pH条件。而当pH>6.5,即pH=7.8时,EE2的吸附去除速率明显下降,在24 h时,菌丝球对EE2的去除仅能达到53.23%。由此可见,菌丝球对EE2的最佳吸附pH为5.6左右。此前,王昌稳等[10]在pH为6~7条件下采用颗粒活性炭对EE2进行吸附去除,在EE2初始浓度为500 ng/L,颗粒活性炭5 g/L的条件下,10 min可达到吸附平衡,45 min吸附结果后,EE2的去除率为82.88%。段姝悦[11]考察了初始pH对复合絮凝剂改性后的菌丝球吸附雌酮、17β-雌二醇和雌三醇效能影响,发现当初始pH接近7的时候,菌丝球对以上3种物质的吸附能力较强,而当pH降低或升高时,菌丝球的吸附能力逐渐减弱,且酸性条件下的吸附能力要优于碱性条件下。林胜红等[12]在研究pH对复合菌丝球对孔雀绿的吸附脱色时发现,在碱性条件下,多糖溶解度升高,复合菌丝球的胞外聚合物稳定性下降,菌丝球会出现一定的自溶现象,因此对染料的吸附性也会下降。
-
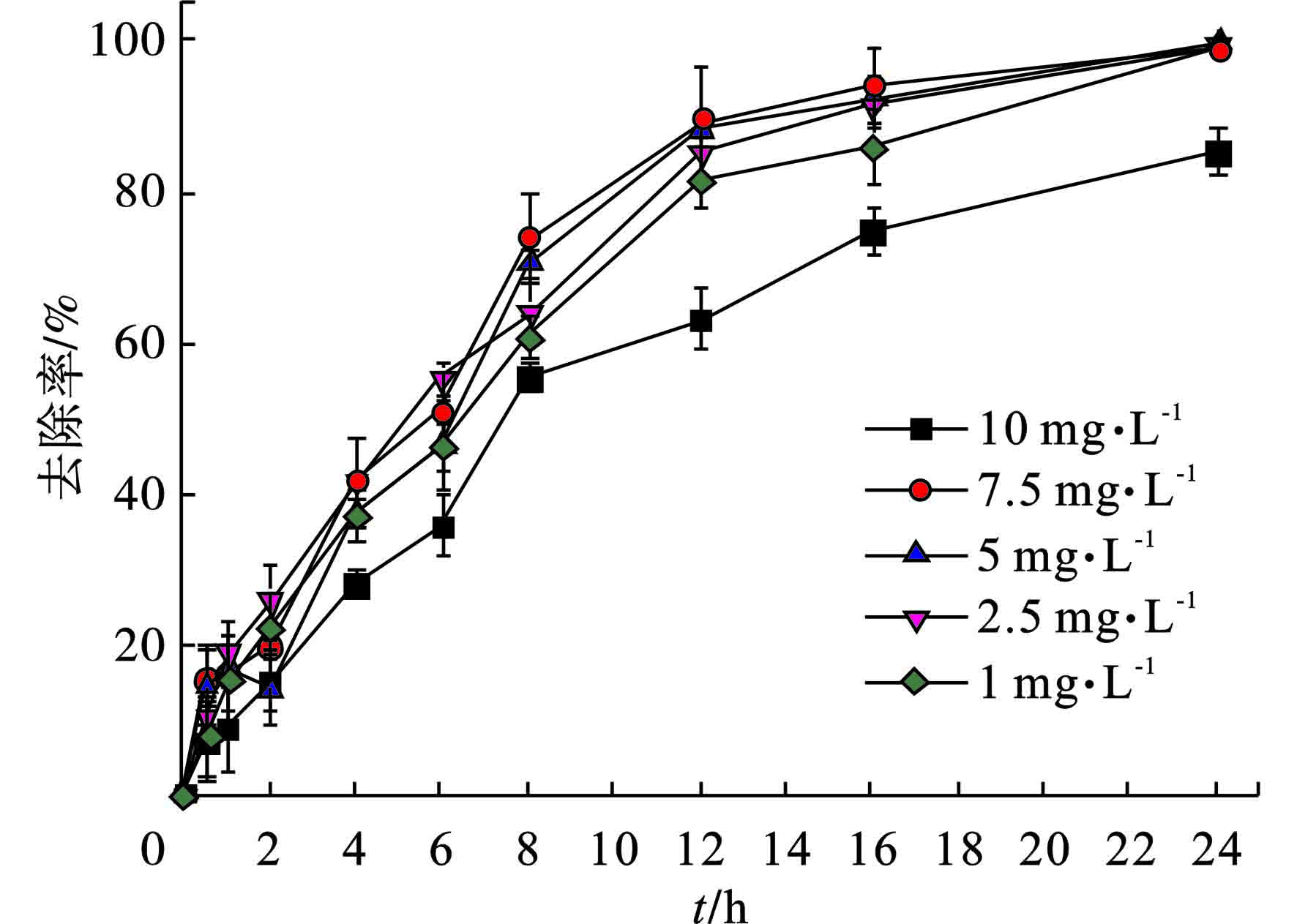
不同EE2初始浓度下菌丝球对其吸附效果,见图3。
图3可知,在1~7.5 mg/L范围内,随着浓度升高,菌丝球对EE2的吸附效率呈现上升趋势。这一结果是由于EE2初始浓度上升导致的传质驱动力增加,这一驱动力的增加可以使得EE2从溶液中向菌丝球转移的速率升高。当EE2初始浓度高于7.5 mg/L,达到10 mg/L时,菌丝球对其去除效率有明显的下降,这是由于EE2的初始浓度过高,使得菌丝球对其的吸附容量很快就趋向于饱和,同时传质驱动力降低的较为迅速,若要进一步提升去除效率,则需要进一步提高传质驱动力。此外,EE2从溶液中转移到固相中被吸附在菌丝球表面,是否会被进一步从表面吸附至内部的多孔网状结构内,需要进一步的探究。
-
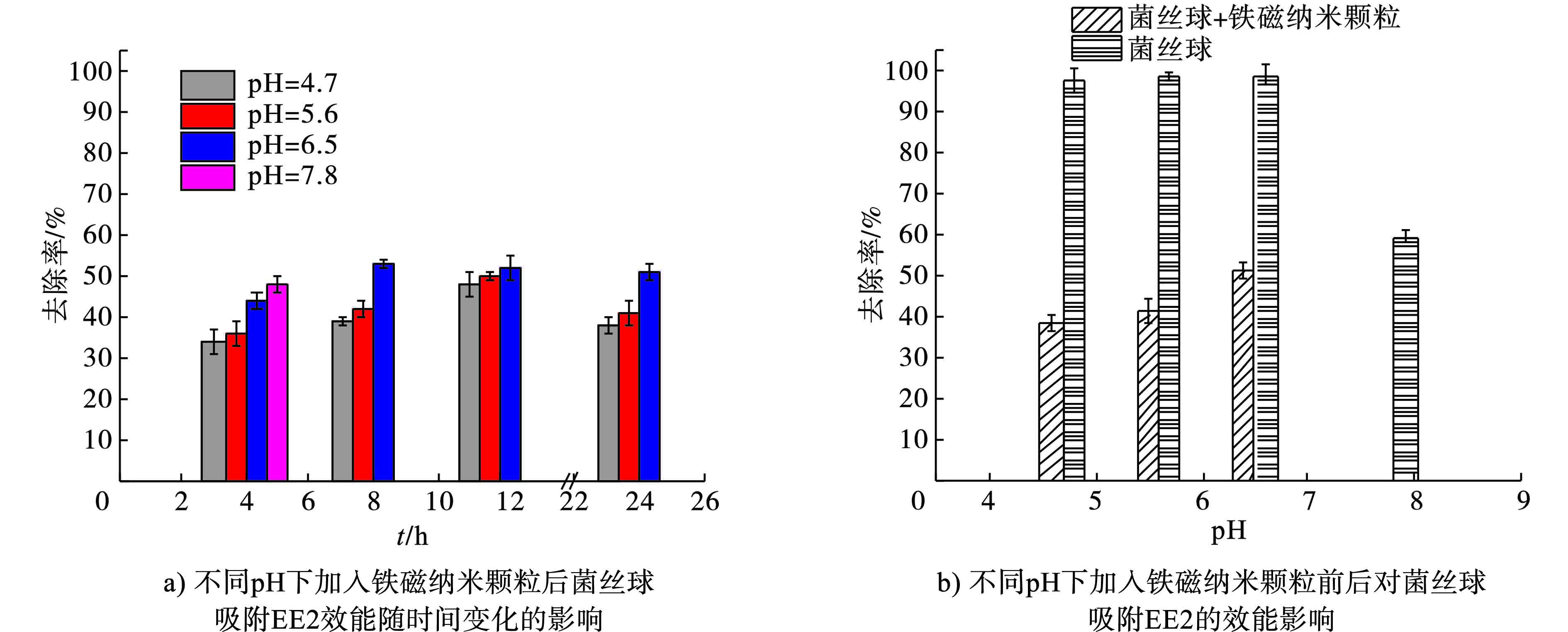
铁磁纳米颗粒在不同pH条件下对菌丝球吸附EE2的影响效果,见图4。
相比于2.2的结果,图4a)可知,铁磁纳米颗粒的加入对菌丝球吸附EE2产生了较为明显的抑制作。当pH=5.6时,在24 h时的EE2吸附效率相比不加入铁磁纳米颗粒由99%降低至40.91%;当pH=6.5时,在前8 h的EE2去除率最高可达到53.44%,此后随着吸附时间的延长又有明显下降。而当pH=7.8时,在前4 h菌丝球混合铁磁纳米颗粒对EE2去除率还可达到48.52%,而在8 h后,去除率急剧下降直至降低到几乎为0%。
菌丝球在形成的过程中,可分泌胞外聚合物,主要由多糖和蛋白组成,含有大量的羟基、羧基等基团,提供了丰富的吸附位点。同时,成熟菌丝球的表面带正电荷[13]。EE2的化学结构具有1个苯环,2个六元环和1个五元环,在3号位和17号位上各有1个羟基,并在17号位上有1个3键。通过对EE2结构的分析,菌丝球对EE2的吸附作用应当是通过对其羟基的吸附来达成。而铁磁纳米颗粒在水中极易与水发生配位作用而使表面羟基化,形成—FeOH[14],使其在结构上与EE2在菌丝球进行吸附的过程中形成竞争,降低了菌丝球吸附EE2的效率。同时,铁磁纳米颗粒的零电点在6.5左右[15],当pH>6.5时,磁性纳米颗粒表面带负电荷,与表面带正电荷的菌丝球可形成静电吸引。当pH=7.8时,铁磁纳米颗粒与菌丝球产生了静电吸引作用,在前4 h,菌丝球对EE2还有一定的吸附效果,而随着吸附时间的延长,由于菌丝球与铁磁纳米颗粒的静电吸引和竞争作用,已被吸附的EE2被水溶液中的铁磁纳米颗粒从吸附位点上置换出来,使得菌丝球对EE2的吸附效率明显下降直至降至为0%,见图4b)。
-
菌丝球对EE2的去除作用主要通过吸附作用实现,菌丝球本身对EE2的降解作用几乎为零。pH的变化对菌丝球吸附EE2有明显影响,当水溶液pH为中性偏酸性时,吸附效果最好,pH=5.6是其最佳吸附pH。当pH高于中性时,菌丝球吸附EE2的效率有明显下降。
菌丝球吸附EE2的效率随着EE2初始浓度的升高而提高,当EE2初始浓度超过一定浓度时,由于传质驱动力的降低,使得菌丝球吸附EE2的效率有明显下降。
菌丝球对EE2的吸附作用应当是通过对EE2的羟基吸附来达成,磁纳米颗粒在水溶液中与水的配位作用形成—FeOH与EE2产生吸附位点的竞争,当pH>6.5时,铁磁纳米颗粒的表面带负电荷,与表面带正电荷的菌丝球相互之间产生静电吸引,并随着吸附时间的延长,由于菌丝球与铁磁纳米颗粒的静电吸引和竞争作用,已被菌丝球吸附的EE2被铁磁纳米颗粒从吸附位点上置换出来,使得菌丝球对EE2的吸附效率明显下降。
pH和铁磁纳米颗粒对菌丝球吸附EE2的影响研究
Effect of ferromagnetic nanoparticles and pH on adsorption of EE2 by mycelial pellets
-
摘要: 以菌丝球作为生物质吸附剂,对17α-乙炔雌二醇(EE2)进行去除效果实验,研究了pH变化和铁磁纳米颗粒的加入对菌丝球吸附EE2的效果影响。结果表明:在pH为5.6时,菌丝球吸附EE2的效果最好,去除率可达99%;菌丝球吸附EE2的效率随着EE2初始浓度的升高而提高,当EE2初始浓度超过一定范围时,由于传质驱动力的降低,使得菌丝球吸附EE2的效率有明显下降;铁磁纳米颗粒的加入对菌丝球吸附EE2有十分明显的抑制作用。Abstract: Mycelial pellets were used to absorb 17α-ethynylestradiol as the biomass absorbent, and experiments were conducted to investigate the influence of variation of pH and addition of ferromagnetic nanoparticles on removal effects. The results showed that the adsorption effect of EE2 by mycelial pellets was optimal and the removal efficiency could reach 99% at the pH of 5.6. The adsorption efficiency increased with the initial EE2 concentration increasing. However when the initial EE2 concentration exceeded the certain range, the adsorption efficiency of EE2 by mycelial pellets decreased obviously with the dcreasing mass transfer driving force. The addition of ferromagnetic nanoparticles inhibited the adsorption efficiency of EE2 by mycelial pellets drastically.
-
Key words:
- mycelial pellets /
- estrogen /
- pH /
- ferromagnetic nanoparticles /
- 17α-ethynylestradiol
-

-
[1] 赵立军, 马放, 山丹, 等. 曲霉菌丝球 Y3对细菌的固定化效能[J]. 江苏大学学报 (自然科学版), 2007, 28(5): 446 − 449. [2] KAUSHIK P, MALIK A. Fungal dye decolourization: recent advances and future potential[J]. Environment International, 2009, 35: 127 − 141. doi: 10.1016/j.envint.2008.05.010 [3] TASTAN BE, ERTUGRUL S, DONMEZ G. Effective bioremoval of reactive dye and heavy metals by Aspergillus versicolor[J]. Bioresource Technology, 2010, 101(3): 870 − 876. doi: 10.1016/j.biortech.2009.08.099 [4] TUNGITTIPLAKORN W, COHEN C, LION L W. Engineered polymeric nanoparticles for bioremediation of hydrophobic contaminants[J]. Environmental Science & Technology, 2005, 39(5): 1354 − 1358. [5] HU J, LO IMC, CHEN G. Comparative study of various magnetic nanoparticles for Cr(VI) removal[J]. Separation & Purification Technology, 2007, 56(3): 249 − 256. [6] JJEMBA P K. Excretion and ecotoxicity of pharmaceutical and personal care products in the environment[J]. Ecotoxicology and Environmental Safety, 2006, 63(1): 113 − 130. doi: 10.1016/j.ecoenv.2004.11.011 [7] CALDWELL D J, MASTROCCO F, HUTCHINSON T H, et al. Derivation of an aquatic predicted no-effect concentration for the synthetic hormone, 17 alpha-ethinyl estradiol[J]. Environmengtal Science & Technology, 2008, 42(19): 7046 − 7054. [8] WANG J N, LI A, YANG J X, et al. Mycelial pellet as the biomass carrier for semi-continuous production of bioflocculant[J]. RSC Advances, 2013, 3(40): 18414 − 18423. doi: 10.1039/c3ra41725e [9] 马放, 周家晖, 郭海娟, 等. 磁性活性炭的制备及其吸附性能[J]. 哈尔滨工业大学学报, 2016, 48(2): 50 − 56. doi: 10.11918/j.issn.0367-6234.2016.02.009 [10] 王昌稳, 李军, 赵白航, 等. 颗粒活性炭吸附去除水中雌激素的试验研究[J]. 北京工业大学学报, 2014, 40(4): 607 − 612. [11] 段姝悦. 絮凝剂对菌丝球的改性研究[D]. 沈阳: 辽宁大学, 2012. [12] 林胜红, 田永强, 刘振飞, 等. 复合菌丝球对孔雀绿的吸附脱色研究[J]. 化学与生物工程, 2018, 35(5): 59 − 62. doi: 10.3969/j.issn.1672-5425.2018.05.013 [13] 张斯. 菌丝球生物载体的构建及其强化废水处理效能研究[D]. 哈尔滨: 哈尔滨工业大学, 2011. [14] 张松. Fe3O4磁性纳米粒子对黄酮类化合物的选择性吸附研究[D]. 长沙: 湖南师范大学, 2012. [15] 刘冰, 王德平, 黄文旵, 等. 柠檬酸在磁性纳米粒子上的吸附及性能表征[J]. 功能材料, 2007, 38(7): 1074 − 1077. doi: 10.3321/j.issn:1001-9731.2007.07.010 -




 下载:
下载: