-
我国是世界上抗生素生产、消费和出口大国,年产量约占世界总产量的70%[1-2]。在生产抗生素的过程中,会产生大量的抗生素菌渣。据估算,每生产1 t抗生素,约产生8~10 t的抗生素菌渣,我国每年产生的抗生素菌渣约为2×106 t,产量巨大[3-4]。抗生素菌渣主要由剩余培养基、残留的抗生素、微生物代谢产物以及发酵菌丝体组成。其中,残留的抗生素会对生态环境和人群健康造成潜在的危害[5-6]。根据我国2020年发布的《国家危险废物名录》[7],抗生素菌渣属于化学原料药生产过程中产生的废弃品及中间体,全过程须按危险废物进行管理,不可随意处置。抗生素菌渣处理技术有焚烧、填埋、堆肥等。这些处理技术存在不能完全消除菌渣危害、成本高、会造成二次污染等问题。抗生素菌渣中含有丰富的蛋白质,是一种潜在的生物质能,如能将其回收利用,可较好地实现菌渣中氮源的资源化[8-9]。
菌渣中蛋白质的回收主要包括菌渣中蛋白质溶出和菌渣水解液中蛋白质的分离纯化2个过程。由于菌渣的蛋白质主要存在于菌丝体中,为了获得更多的蛋白质,就需要对菌渣进行水解[10-11]。常用的菌渣水解方法有物理法(热水解、超声波、高压均质等)、化学法(酸碱处理、臭氧氧化处理等)和生物法(酶制剂和嗜热溶胞法)。与化学、物理水解技术相比,生物法中的嗜热溶胞法是利用优势嗜热溶胞菌分泌的胞外酶(蛋白酶和淀粉酶)进行生物溶胞作用,使菌渣中的有机物溶出。该方法具有操作简单、经济环保和水解效果好等优点[12-14]。菌渣经水解后,需要从混合溶液中进一步沉淀分离出蛋白质。常用的蛋白质沉淀分离方法有等电点沉淀法、盐析法、有机溶剂沉淀法、非离子多聚物沉淀法等[15-17]。
本实验采用嗜热溶胞法水解青霉素菌渣,以青霉素菌渣水解液为研究对象,采用等电点沉淀法、盐析法(硫酸铵)、有机溶剂沉淀法(乙醇、丙酮)、选择性变性沉淀法(TCA)和非离子多聚物沉淀法(聚乙二醇)对水解液沉淀分离,并通过比较不同沉淀法的蛋白质沉淀率,选出最优的蛋白质沉淀法;然后对最优沉淀法进行单因素实验,以确定蛋白质沉淀率的影响因素及取值范围;之后,用响应曲面法选取最优沉淀法分离蛋白质的最佳工艺条件;最后,用最优工艺条件对青霉素菌渣水解液进行蛋白质分离实验验证。本实验研究结果可为菌渣的资源化处理提供参考。
全文HTML
-
青霉素菌渣取自石家庄某制药厂。其主要理化性质见表1。
嗜热溶胞菌是从混合堆肥基质中分离出的嗜热菌DF7(保藏于中国普通微生物菌种保藏管理中心,保藏号:CGMCC No.16459)。该菌属嗜热芽孢杆菌(Bacillus thermophilus)属,革兰氏染色呈阳性;呈细杆状、产芽孢、能够分泌蛋白酶和淀粉酶;最适生长温度为60 ℃、最适生长pH为7.0。
-
1)蛋白质的溶出。取一定量的青霉素菌渣于1 000 mL的锥形瓶中,调节pH至7.0后,添加15%的嗜热菌(体积分数),于60 ℃恒温振荡培养12 h;然后,再将其在5 000 r·min−1转速下离心10 min,离心清液为水解液。水解液中蛋白质的质量浓度为62.22 g·L−1,pH为6.72。
2)蛋白质沉淀法的筛选。采用等电点沉淀法、硫酸铵沉淀法、乙醇沉淀法、丙酮沉淀法、TCA沉淀法和聚乙二醇沉淀法对青霉素菌渣中蛋白质进行沉淀分离,根据蛋白质的沉淀效果,确定最优沉淀方法。
分别取20 mL水解液,用NaOH或HCl调节水解液pH为1.5、2.5、3.5、4.5、5.5、6.5、7.5和8.5,静置8 h。分别取20 mL水解液,然后加入硫酸铵,使其饱和度为30%、40%、50%、60%、70%、80%和90%,静置8 h。分别取20 mL水解液,然后加入一定量的乙醇/丙酮/TCA/聚乙二醇,使其与水解液的体积比为1∶2、3∶4、1∶1、5∶4和3∶2,静置8 h。对沉淀后的水解液进行离心,取上清液测蛋白质浓度,计算蛋白质沉淀率。
3)蛋白质沉淀法的优化实验。对筛选出的沉淀法进行单因素实验,以确定蛋白质沉淀率的影响因素及取值范围,然后以蛋白质沉淀率为响应值,进行响应曲面优化实验;再用Design-Expert软件对实验数据进行分析,预测沉淀蛋白质的最优条件。
4)验证实验。用模型预测的最优工艺条件对青霉素菌渣水解液进行3次蛋白质分离实验,取平均值,与预测值进行比较,以验证模型的可靠性。
-
TSS、VSS用重量法测定;TCOD、SCOD用重铬酸钾法测定;氨氮用纳氏试剂分光光度法测定;蛋白质浓度用福林酚试剂法测定,采用(1)式计算蛋白质沉淀率。
式中:C1为水解液中蛋白质浓度,mg·L−1;C2为沉淀后水解液中蛋白质浓度,mg·L−1。
1.1. 实验原料
1.2. 实验方法
1.3. 分析方法
-
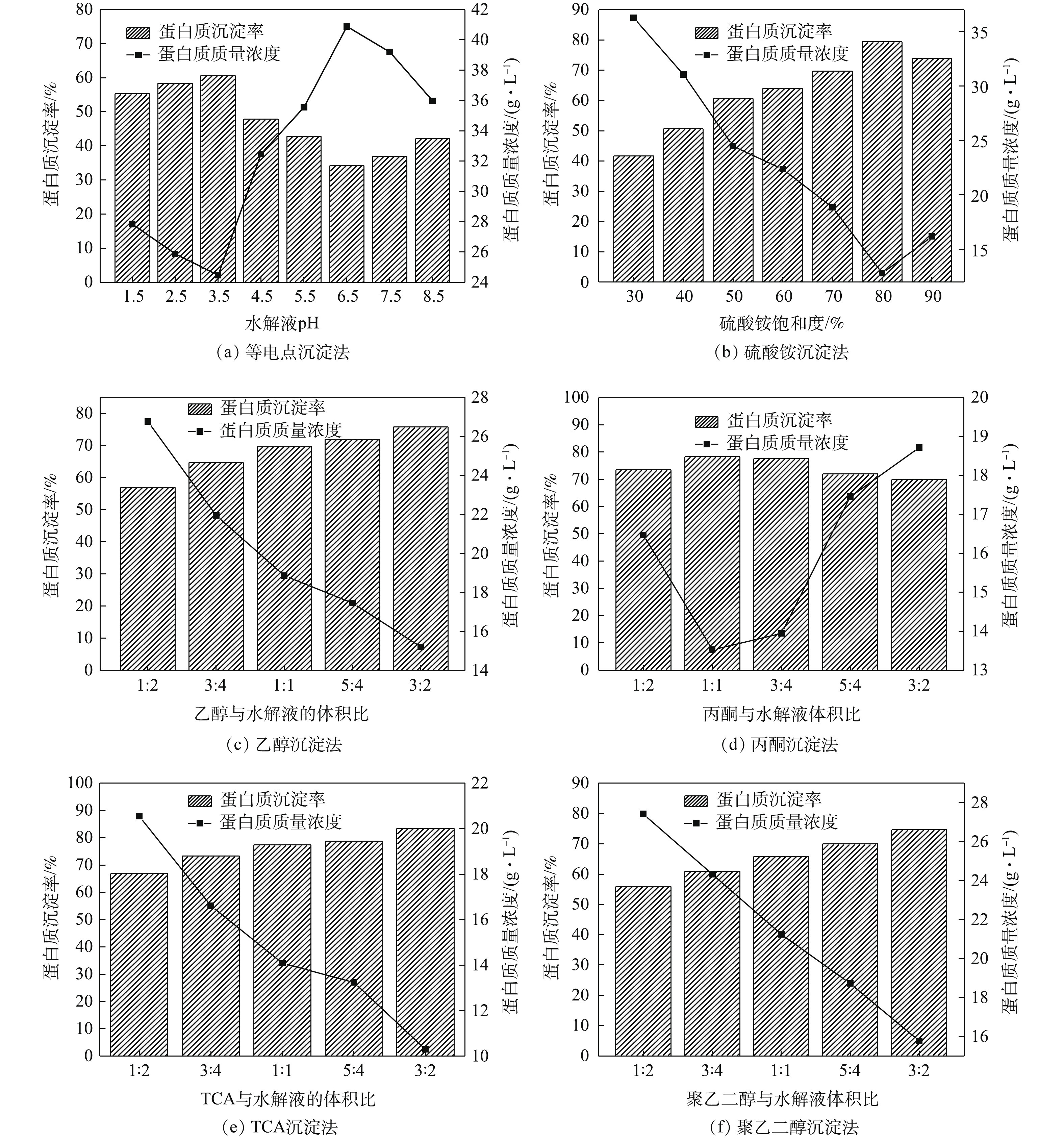
由图1(a)可知,当水解液pH为3.5时,蛋白质的沉淀率最大为60.67%。蛋白质水溶液呈两性电离状态。改变水溶液pH会使蛋白质的电荷性质发生改变,从而使蛋白质的溶解度下降,进而使蛋白质沉淀析出。当达到等电点时,蛋白质净电荷为零,蛋白质分子间的电荷排斥力消失,蛋白质的溶解度最低,沉淀效果最好[11,18]。
由图1(b)可知,蛋白质的沉淀率随硫酸铵饱和度的增加呈先上升后下降的趋势。其原因是,硫酸铵能够压缩蛋白质周围的溶剂化层,使蛋白质表面疏水相互作用增大,从而使蛋白质聚集沉淀。当盐浓度比较高时,会产生共沉淀现象,导致蛋白质的沉淀率下降[19]。因此,当硫酸铵饱和度为80%时,蛋白质沉淀率最大,为79.39%。
由图1(c)可知,随着乙醇体积的增大,蛋白质沉淀率逐渐升高,当体积比为3∶2,蛋白质沉淀率最大为75.78%。由图1(d)可知,随着丙酮体积增大,蛋白质沉淀率呈现先增大后下降的趋势;当体积比为1∶1时,蛋白质沉淀率最大为78.27%。这是因为,乙醇和丙酮属于有机溶剂,会降低蛋白质水溶液介电常数,蛋白质之间静电引力变大,从而使蛋白质聚集沉淀[16]。
由图1(e)可知,蛋白质沉淀率随着TCA体积的增大,蛋白质沉淀效率呈上升趋势。当TCA与水解液体积比为3∶2时,蛋白质沉淀率最大为83.45%。其原因是,TCA能与蛋白质形成不溶性盐,从而使蛋白质构象发生改变,暴露出较多的疏水性基团,从而使蛋白质聚集沉淀[20]。
由图1(f)可知,随着聚乙二醇体积的增大,蛋白质沉淀率越来越大,当聚乙二醇与水解液的体积比为3∶2时,蛋白质沉淀率最大为74.66%。这是因为,聚乙二醇能使蛋白质分子水合膜脱水,改变蛋白质的介电常数,从而导致蛋白质分子亲水基的位阻关系发生改变,最终使蛋白质沉淀[21]。
-
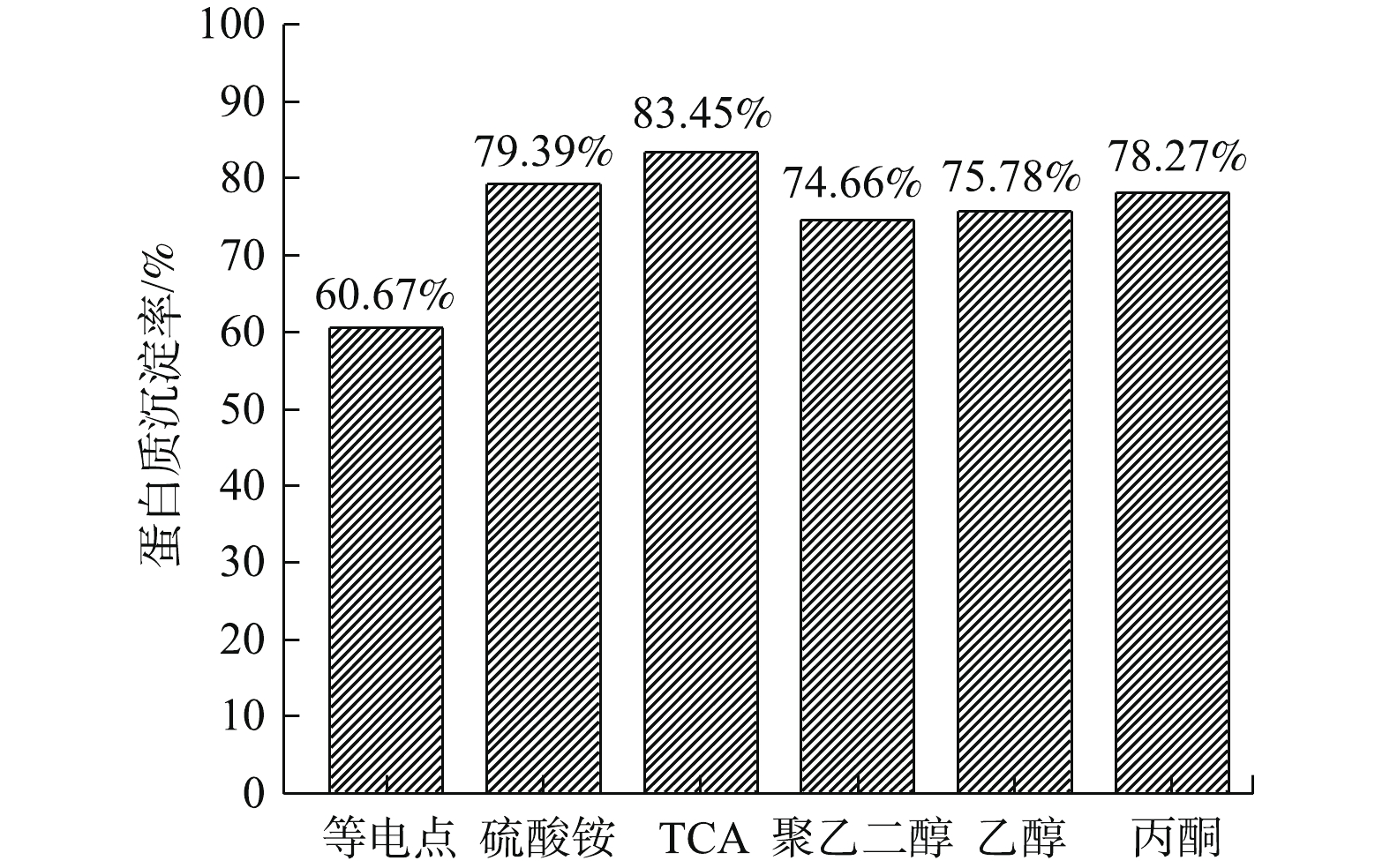
由图2可知,蛋白质沉淀率的排序为:TCA沉淀法>硫酸铵沉淀法>丙酮沉淀法>乙醇沉淀法>聚乙二醇沉淀法>等电点沉淀法。等电点沉淀法操作简单,但是沉淀能力不强,常与其它沉淀法结合使用。硫酸铵盐析法操作简便,但纯度较低,沉淀剂不易脱除,常用于粗蛋白的分离。乙醇和丙酮沉淀属于有机溶剂沉淀法,分辨能力高,溶剂易脱除,但易引起蛋白质变性,并且操作要求在低温下进行。聚乙二醇沉淀法沉淀效果较好,但沉淀剂比较难去除[16]。相比之下,TCA沉淀法对蛋白质的沉淀效果最好;故下一步研究采用TCA沉淀法来分离青霉素菌渣中的蛋白质。
-
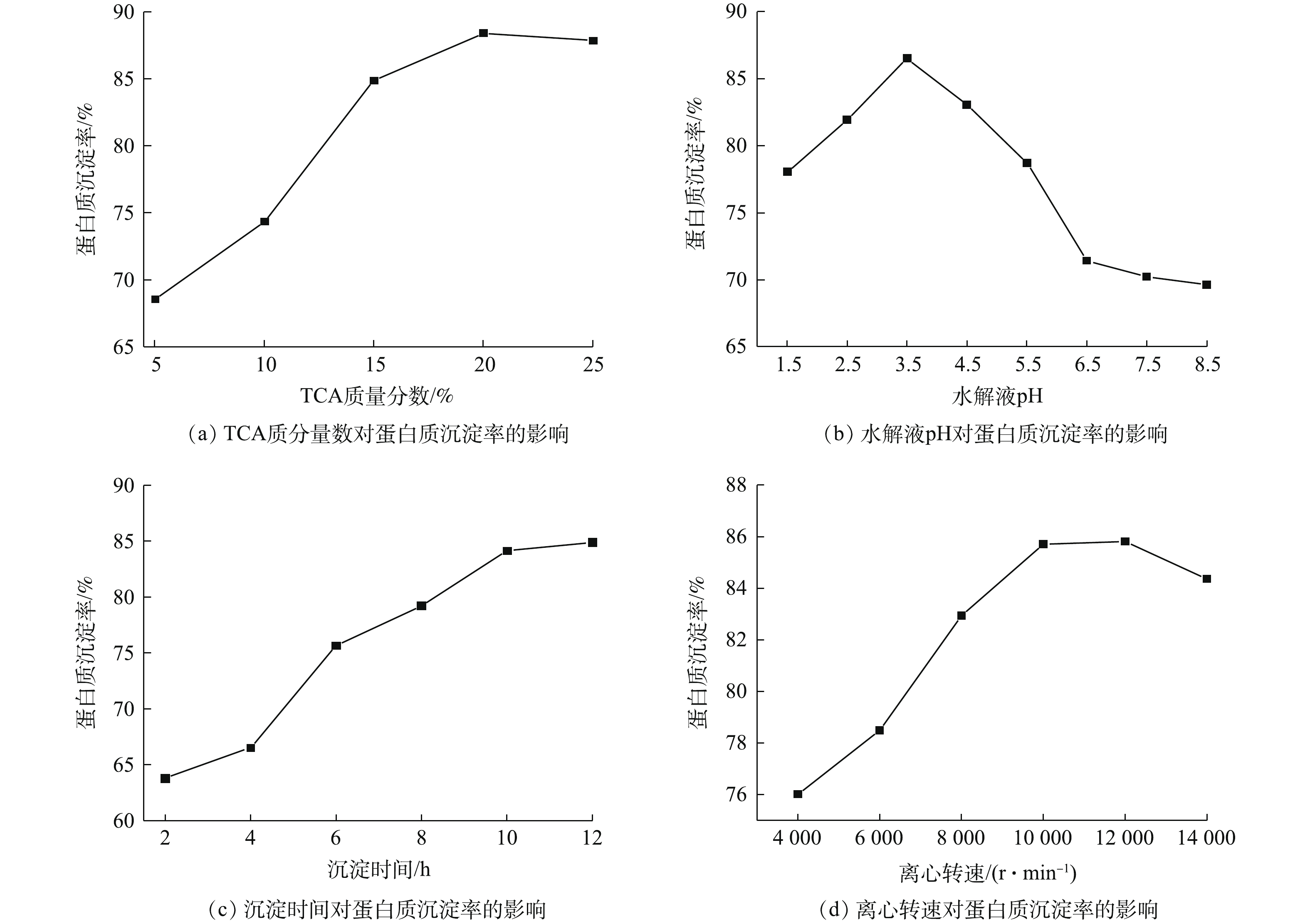
TCA的质量分数、水解液pH、沉淀时间、离心转速对蛋白质沉淀率的影响如图3所示。由图3(a)可知,随TCA质量分数的增大,蛋白质的沉淀率呈先上升后出现略微下降的趋势。其原因是,TCA是有机酸,随着TCA质量分数的增大,会使水解液中的酸性逐渐加强,蛋白质可能会在适宜的酸性条件下水解,从而使蛋白质沉淀率降低。
由图3(b)可知,随着水解液pH的增大,蛋白质的沉淀率呈现先上升后下降的趋势;pH在3.5时蛋白质的沉淀率达到峰值。这是因为,蛋白质沉淀和变性关系密切,但是变性的蛋白质不一定沉淀,变性蛋白质只有在等电点附近才可以沉淀[17]。因此,水解液pH对蛋白质沉淀率有一定的影响。
由图3(c)可知,当沉淀时间小于10 h时,蛋白质的沉淀率明显上升;当沉淀时间大于10 h时,蛋白质的沉淀率变化不大,所以沉淀时不宜太长。
由图3(d)可知,随着离心转速的增加,蛋白质的沉淀率呈先上升后下降的趋势,当离心转速为12 000 r·min−1时蛋白质的沉淀率最高。
综上所述,在响应曲面优化实验中,TCA的质量分数取15%、20%和25%,水解液pH取2.5、3.5和4.5,沉淀时间取8、10和12 h,离心转速取8 000、10 000和12 000 r·min−1。
-
1)实验设计结果及回归模型分析。以蛋白质沉淀率作为响应值,TCA质量分数(A)、水解液pH(B)、沉淀时间(C)、离心转速(D)为自变量,进行响应曲面优化实验,实验设计及结果如表2所示。用Design Expert对表2所列实验结果进行分析,得到的回归方程如式(2)所示。
由表3可知,F为63.86,P<0.000 1,这说明回归方程是显著的;R2 = 0.984 6 > 0.9,这说明该模型与实验结果拟合良好;决定系数R2Adj = 0.969 2,这说明该模型能够解释96.92%的响应值变化,模型具有较好的回归性。信噪比Adeq Precision 27.522 > 4,这表明方程的拟合度和可信度极高;失拟项(P > 0.05)不显著,这说明实验误差很小。通过比较F值可得各因素对蛋白质沉淀率影响次序为:TCA质量分数>沉淀时间>水解液pH>离心转数。
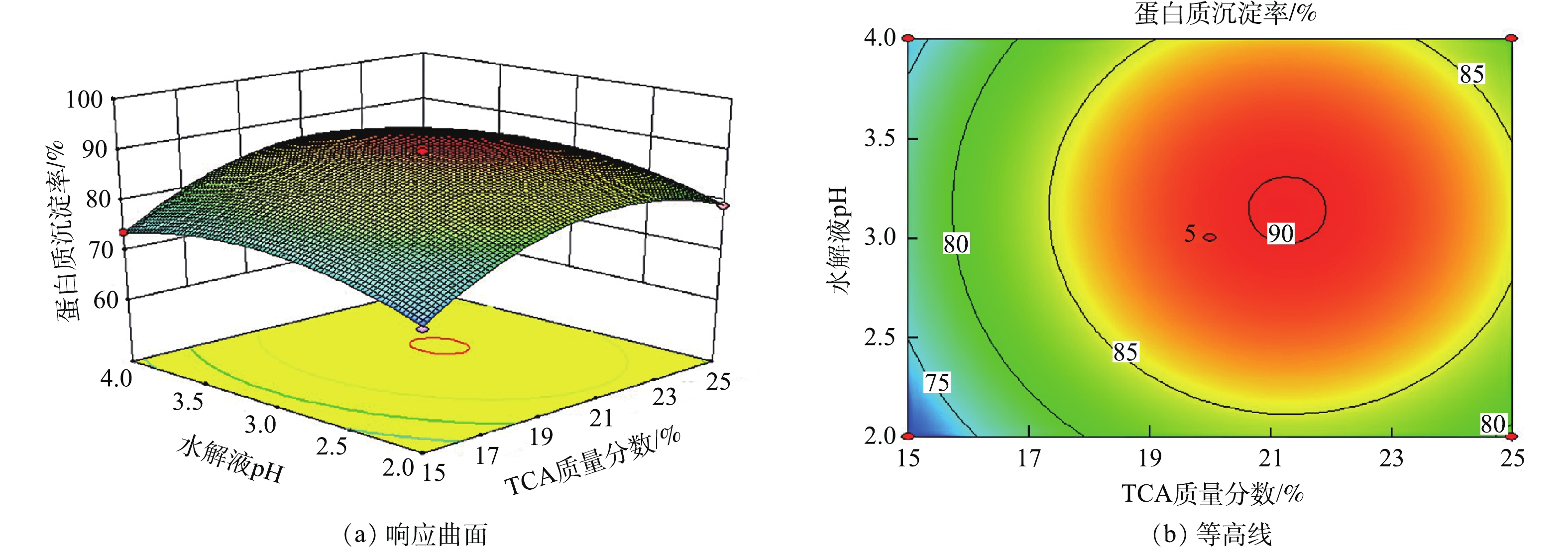
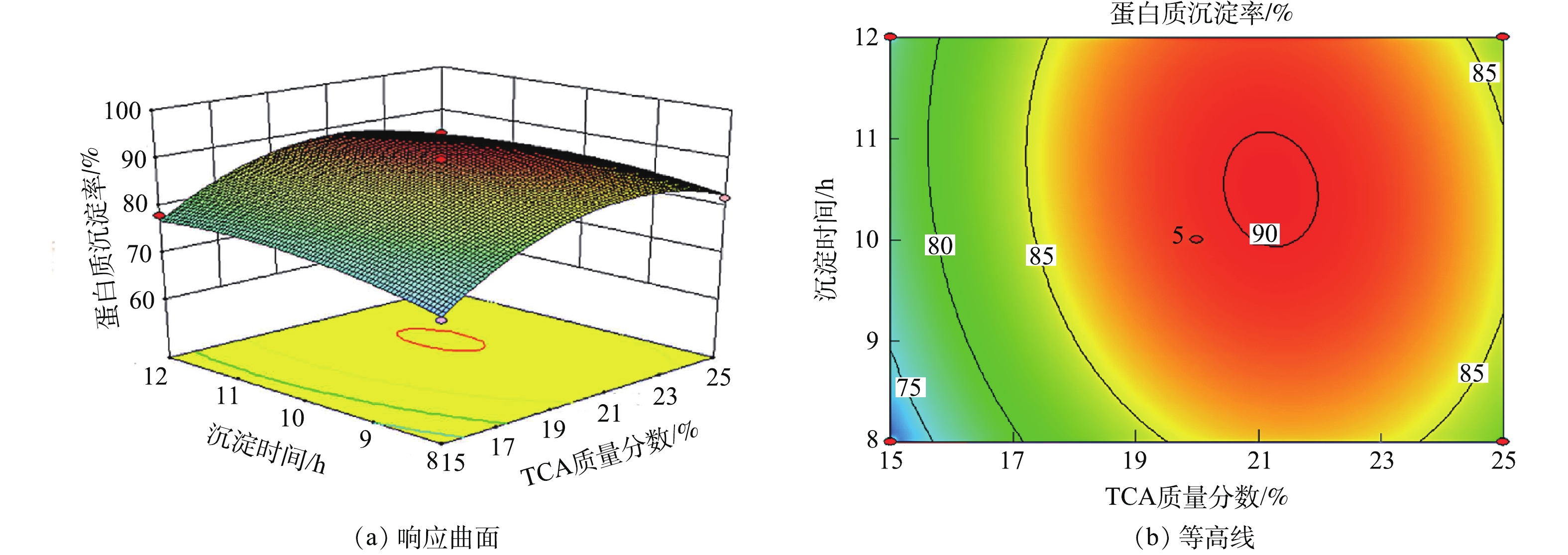
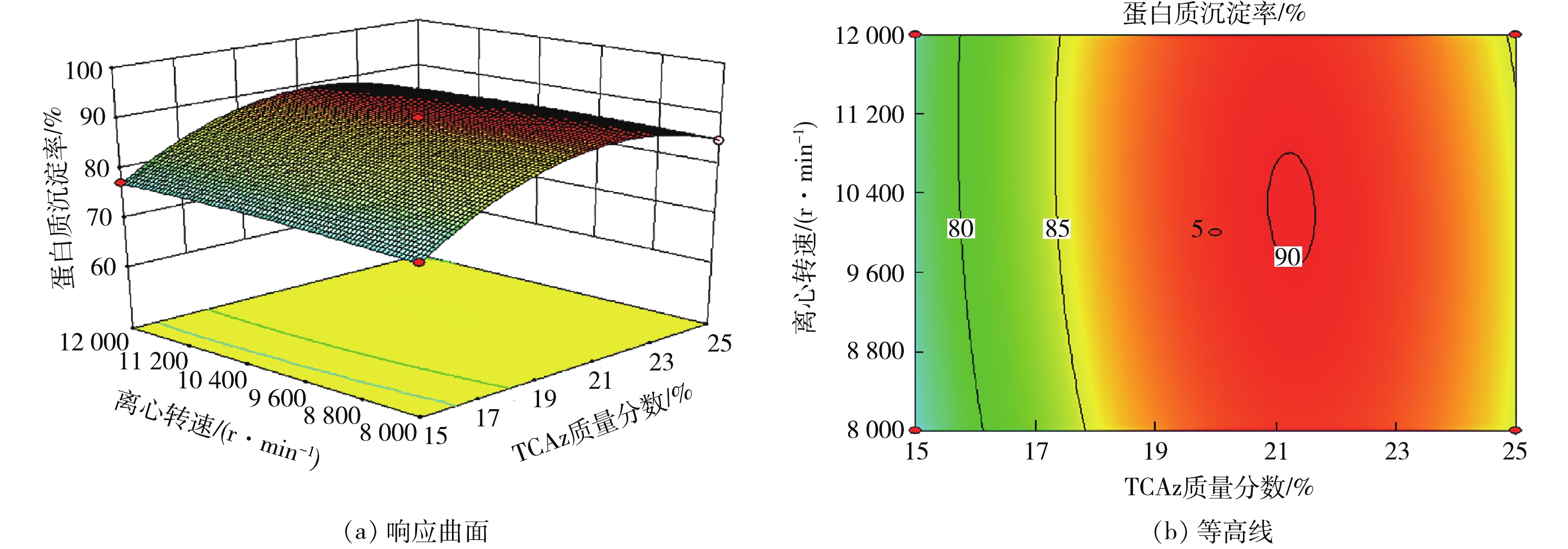
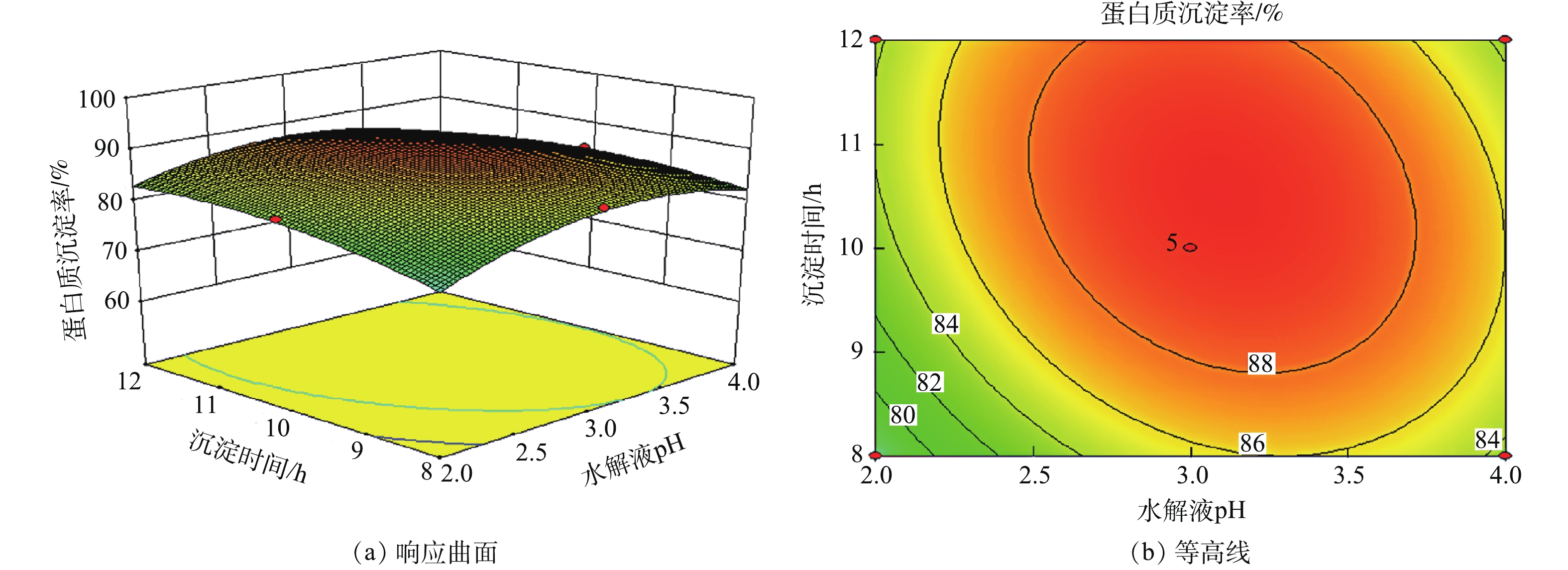
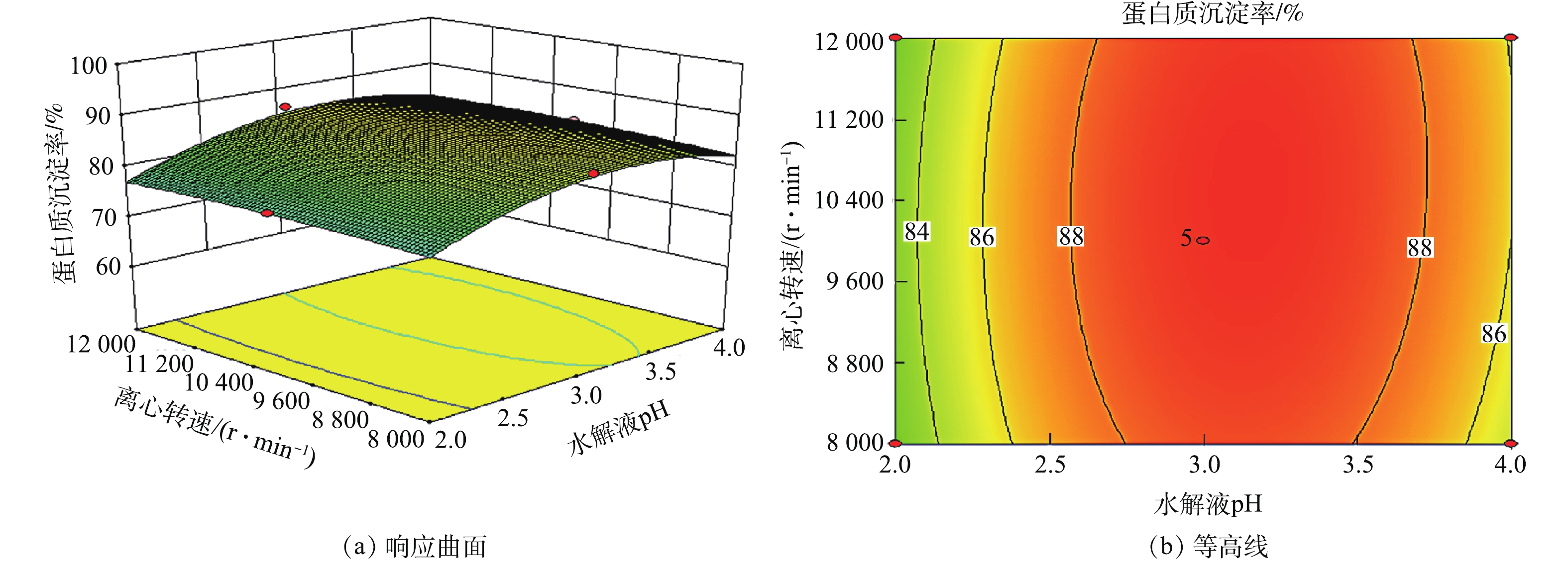
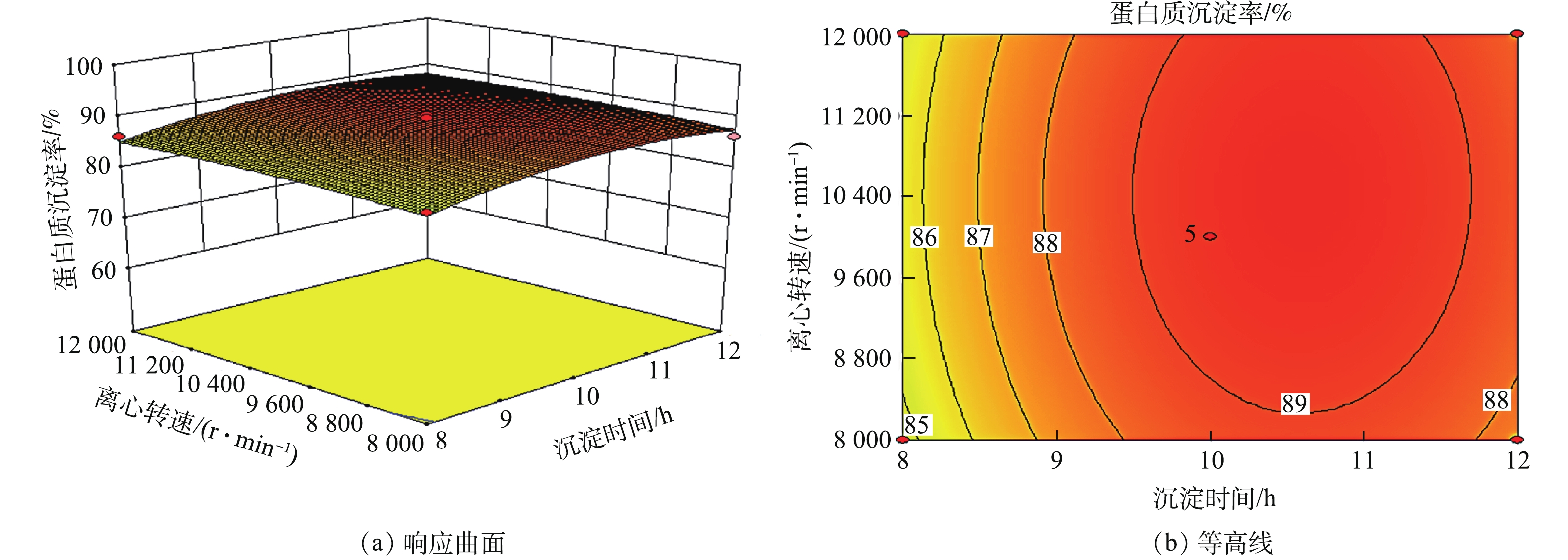
2)响应曲面分析。响应曲面的坡度和等高线的形状可反映各因素之间交互作用的强弱。响应曲面坡度陡峭且等高线形状是椭圆形说明各因素之间交互作用明显,反之不明显。用Design expert软件作响应曲面图和等高线图,见图4~图9。
由图4可知,响应曲面中蛋白质沉淀随着TCA的质量分数和水解液pH的增大呈先上升后下降的趋势,曲面中心较高,其他位置较低,且等高线的形状接近圆形。这说明,TCA的质量分数和水解液pH交互作用不明显。
由图5可知,随着TCA的质量分数和沉淀时间的增加,蛋白质沉淀率呈上升的趋势,且等高线的形状接近椭圆形。这说明,TCA的质量分数与沉淀时间交互作用明显。这是因为,TCA能够使蛋白质构象发生改变,从而使蛋白质沉淀,TCA使蛋白质变性需要一定反应时间,变性蛋白质才能充分的析出。
由图6响应面可知,随着TCA质量分数的增加,蛋白质沉淀率呈上升趋势;而离心转速增加蛋白质的沉淀率并没有明显的变化。这说明,离心转速对蛋白质的沉淀率的影响较小。由响应曲面图和等高线图可知,TCA质量分数与离心转速对蛋白质沉淀率交互作用不明显。
由图7可知,随着沉淀时间的增加蛋白质沉淀率呈上升的趋势,随着水解液pH的增加蛋白质沉淀率呈先上升后趋于平缓的趋势,且响应曲图中曲面整体左后角较高,其他位置较低,其等高线比较密集且形状为椭圆形。这说明,水解液pH与沉淀时间对蛋白质沉淀率交互作用显著。这是因为,蛋白质是两性物质,调节水解液pH,可改变蛋白质的电荷性质,使分子间的引力增大,使蛋白会的溶解度降低,从而使蛋白质聚集沉淀。蛋白质沉淀析出需要时间一定的时间,所以水解液pH与沉淀时间对蛋白质沉淀率交互作用显著。
由图8可知,蛋白质沉淀率随着水解液pH的增加略微上升,而随着离心转速的增大,蛋白质沉淀率变化不大,且响应面曲面坡度趋于平缓。这说明,水解液pH和离心转速之间交互作用不明显。
图9响应曲面图中曲面接近平面,随着沉淀时间和离心转速的增加蛋白质沉淀率没有明显变化。这说明,沉淀时间与离心转速之间交互作用不明显。
综合上述信息可知,TCA的质量分数与沉淀时间和水解液pH与沉淀时间对蛋白质沉淀率的交互作用显著,与模型分析结果一致。
-
利用Design Expert软件对实验条件进行预测,得出的最优条件为:TCA质量分数为20%、水解液pH为3.0、沉淀时间为10 h、离心转速为10 000 r·min−1,蛋白质沉淀率为89.5%。为了验证该模型的准确性,用模型预测的最优条件对青霉素菌渣水解液进行3次蛋白质分离实验,测得蛋白质沉淀率的平均值为89%。该结果与预测值相差0.5%,表明预测模型与实际情况拟合较好,说明响应曲面法模拟得到的优化条件准确可靠。
2.1. 不同沉淀法对蛋白质沉淀率的影响
2.2. 不同沉淀法中蛋白质沉淀率的比较
2.3. TCA沉淀法的单因素实验结果
2.4. 基于响应曲面法优化蛋白质沉淀实验
2.5. 验证实验
-
1) TCA沉淀法对青霉素菌渣中蛋白质的沉淀分离效果最好,要优于等电点沉淀法、硫酸铵沉淀法、乙醇沉淀法、丙酮沉淀法和聚乙二醇沉淀法。
2) TCA沉淀法中各因素对蛋白质沉淀率影响次序为:TCA质量分数>沉淀时间>水解液pH>离心转速。
3) TCA沉淀法对青霉素菌渣中蛋白质沉淀分离的最佳工艺条件为:TCA质量分数为20%、水解液pH为3.0、沉淀时间为10 h、离心转速为10 000 r·min−1;此条件下的蛋白质沉淀率为89.5%。
4)最优条件下对青霉素菌渣进行蛋白质分离实验得到的蛋白质的沉淀率与响应曲面的预测值接近,表明响应曲面法模拟得到的优化条件准确可靠。



 下载:
下载: