-
己烯雌酚(DES)是一种典型的人工合成非甾体类雌激素, 是环境水体中常被检出的内分泌干扰物之一[1 − 2]. 由于对胎儿生殖器官的致畸作用和可能导致肿瘤[3],己烯雌酚已被禁止用于孕期妇女,但是在临床中仍是治疗雌激素分泌不足所导致的妇科疾病及乳腺癌的药物之一[4]. 随着生活及养殖废水的排放,己烯雌酚最终会进入环境水体,并可能污染饮用水水源. 例如,在我国某些饮用水水源或环境水体中,仍可以检出一定浓度(≤ 2.52 ng·L−1)的己烯雌酚[2,5]. 己烯雌酚常用的检测方法有气相色谱-质谱法、液相色谱-质谱法、酶联免疫吸附法(ELISA)等[6]. 但这些方法或需要利用价格高昂的仪器,对试验人员的专业技术手段要求较高,或耗时较长,无法用于对己烯雌酚的现场快速检测.
胶体金免疫层析检测试纸由于具有简单、快速、易于解读的优势而在临床检测[7]、动物疫病[8]、食品安全[9]、环境监测[10]等领域得到广泛应用,是一种适用于现场快速检测的技术. 该技术的原理是基于目标物与由胶体金标记的抗体或抗原相互作用,在固定有用于捕获抗体或抗原的反应区和控制区,通过目视或使用读取装置读取测试结果[11]. 利用胶体金免疫层析试纸获取目标物含量信息的方式主要有以下三种. 最常见的一种方式是根据检测线(T线)出现与否判断目标物是否超过一定浓度. 在环境检测或食品安全检测中常用来判定目标物含量是否超标,是一种定性检测方式;第二种类型,检测线上包被的反应物设计成只能结合一定量的分析物,过量的分析物会与下一条检测线结合,产生一个条带梯度[12];第三种是用特定仪器读取检测卡显色情况,并将显色情况转换为数字信号达到定量的目的[13].
研究发现[14],利用传统方法制备的己烯雌酚胶体金免疫层析检测卡受温度、湿度影响很大,不适于野外现场检测. 为克服这一问题,我们在金标垫上增加偶联IgY的胶体金做为第二金标物,在NC膜上包被3种不同浓度的羊抗IgY作为参考线,在检测反应中这3条参考线的颜色分别对应3个DES的浓度,通过检测线与3条参考线的颜色对比实现对样品中的DES残留所处浓度区间的确定. 这种体系使得检测线反应和参考线反应处于相同的反应条件,使其很大程度不受环境干扰,通过半定量参考线与检测线的结合,实现了不依赖检测仪器的己烯雌酚可视化检测. 本文研究并验证了基于半定量参考线方法对水中己烯雌酚残留进行现场检测的可行性.
-
己烯雌酚单克隆抗体、DES-BSA购于广东优抗多生物技术有限公司,羊抗鼠抗体、牛血清白蛋白(BSA)购自杭州索莱尔博奥生物技术有限公司,鸡免疫球蛋白IgY、羊抗IgY购自洛阳佰奥通实验材料中心,己烯雌酚、Tween-20购自Merck公司(德国),氯金酸购自于国药集团化学试剂有限公司. 硝酸纤维素膜(VIVID170)购自美国PALL公司. 玻璃纤维膜、PVC底板、吸水纸购于上海金标生物科技有限公司. 己烯雌酚ELISA检测试剂盒购自北京普赞生物技术有限公司.
喷金划膜仪购自上海捷宁生物技术有限公司,可编程切条机(HGS201)购于杭州峰航科技有限公司.
-
胶体金的制备参考Sun等报道的方法[15]. 主要步骤如下:将2 mL氯金酸溶液(1%,W/V)加入到100 mL超纯水中,加热使溶液沸腾. 然后,在不断搅拌下加入1.3 mL柠檬酸钠溶液(2%,W/V). 待溶液颜色变为酒红色后,继续保持沸腾10 min. 然后,停止搅拌及加热,待溶液冷却至室温后加入超纯水将溶液体积补足至100 mL. 4 ℃冰箱中储存待用. 制备的胶体金平均粒径为30 nm. 分别将DES单克隆抗体和IgY标记在胶体金上,方法简述如下:用0.1 mol·L−1的K2CO3将胶体金溶液调节至最适pH值,加入计算好的最适稳定量的蛋白质,轻摇混匀1 min,静置30 min. 用10% BSA溶液(pH7.2)封闭30 min后,将离心管于4 ℃、
12000 r·min−1离心30 min;弃去上清液. 用 1% BSA(pH7.2)溶液洗涤沉淀,于4 ℃、12000 r·min−1离心30 min;弃去上清液. 加入100 μL胶体金复溶液(10 mmol·L−1磷酸盐缓冲液、pH 7.2、含1% BSA、10%蔗糖、5%海藻糖、0.05%叠氮钠)复溶沉淀. -
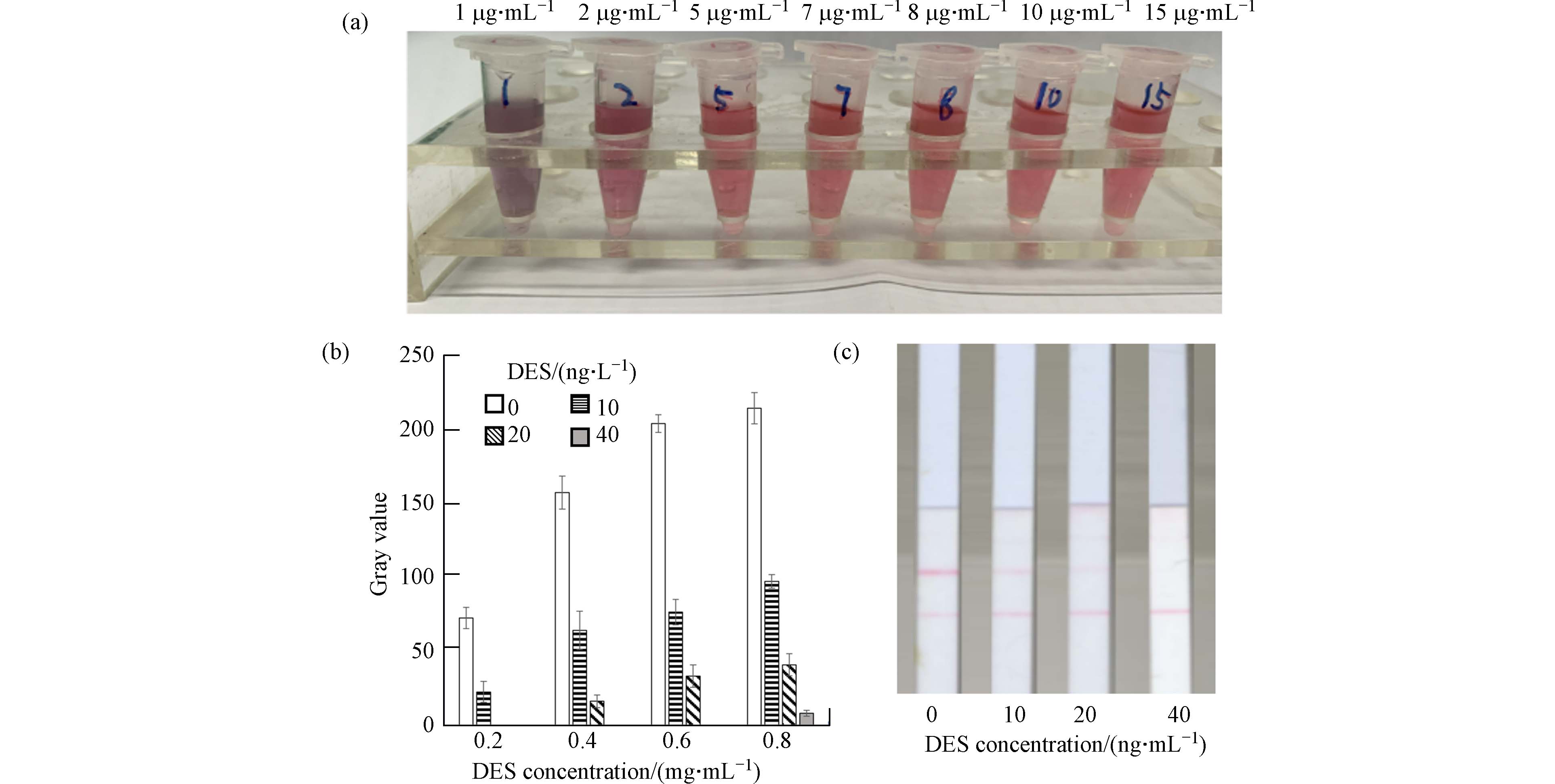
用喷金划膜仪以3 μL·cm−1的速度,将上一步制备的标记了DES单抗的胶体金结合物溶液喷到玻璃纤维素膜上,37 °C烘干24 h,制成DES金标结合物垫. 用喷金划膜仪,以0.8 μL·cm−1的速度,将一系列不同浓度的DES-BSA溶液(0.2、0.4、0.6、0.8 mg·mL−1)和羊抗鼠IgG溶液(0.5 mg·mL−1)划在NC膜上,37 °C烘干24 h;将玻璃纤维膜在样品垫处理液(20 mmol·L−1磷酸盐缓冲液,pH7.2,含1% Tween-20,1% BSA)中浸泡5s,取出后,37 °C烘干24 h,制成样品垫. 按照图1a所示组装己烯雌酚试纸条,分别将80 μL浓度为0、10、20、40 ng·mL−1 的DES溶液滴加到试纸条的样品垫上,反应5min后,目视观察,并利用ImageJ对试纸条的T线和C线灰度值进行分析. 以T线对不同浓度DES的显色区分度选择最适DES-BSA包被浓度.
-
用喷金划膜仪以3 μL·cm−1的速度,将上一步制备的标记了IgY的胶体金结合物溶液喷到玻璃纤维素膜上,37 °C烘干24 h,制成IgY金标结合物垫. 用喷金划膜仪,以0.8 μL·cm−1的速度,将优化浓度的DES-BSA溶液划到NC膜T线位置. 将不同浓度羊抗IgY溶液(0.1、0.2、0.3、0.4 mg·mL−1)划在NC膜C线位置,37 °C烘干24 h;然后按照样品垫、DES金标垫、IgY金标垫、NC膜、吸水纸的顺序组装检测试纸,考察试纸对浓度为0、5、10、20、40 ng·mL−1 DES溶液的响应,目视观察,分别考察在DES浓度为5、10、20 ng·mL−1时T线与C线显色相近的羊抗IgY包被浓度. 如图1b所示,将选出的3个浓度的羊抗IgY按浓度由低到高顺序,依次包被到NC膜上,制备图1b所示检测试纸,并用ImageJ分析试纸对不同上述浓度DES的显色情况,根据分析结果对参考线浓度进行微调,直到阴性条件下该区间中3条半定量参考线中最深显色不超过T线显色,并且3条半定量参考线由低到高分别与5、10、20 ng·mL−1时T线显色相近.
-
将样品垫、金标垫、硝酸纤维素膜和吸水纸依次贴在底板上,彼此间以搭接方式连接(如图1),用切条机切成4 mm宽试纸条,装入塑料卡壳,加干燥剂密封保存.
-
为研究温度对试纸条检测结果的影响,在实验室用空调将实验室温度分别调节至16、25 °C,实验期间室内湿度为30%—35%. 在恒温恒湿箱中将温度调为35 °C、湿度35%. 将试纸放在上述环境中平衡30 min后,考察其对不同浓度DES的响应.
为研究湿度对试纸条检测结果的影响,分别将试纸条放在实验室内(温度25 °C、湿度30%—35%)以及恒温恒湿箱中(温度25 °C、湿度55%)平衡及反应,考察其对不同浓度DES的响应.
-
在山东省王屋水库黄水河入库口、水库中心、大坝位置取3个水样,经0.45 μm滤膜过滤后,分别用本文制备的检测卡及市售的己烯雌酚酶联免疫试剂盒检测水样中己烯雌酚的含量. 在不含己烯雌酚的水样中添加5、10、20 ng·mL−1的己烯雌酚,分别用本文制备的检测卡及己烯雌酚ELISA试剂盒检测,比较二者的检测结果.
-
首先对DES单克隆抗体在胶体金上的标记浓度进行了优化. 由图2a可见,当DES单克隆抗体的标记浓度为5 μg·mL−1胶体金及以上时,向胶体金中加入饱和NaCl不会导致胶体金颜色的变化,提示5 μg·mL−1胶体金为DES抗体的稳定标记浓度. 为保证DES抗体对胶体金的充分结合,在此标记浓度基础上增加20%,即6 μg·mL−1胶体金作为DES单克隆抗体的标记浓度. 图2b是以不同浓度DES-BSA包被NC膜得到的检测试纸T线在不同浓度DES下的显色,可以看到,随DES-BSA浓度增加,T线显色呈加深的趋势. 由于DES-BSA浓度为0.6 mg·mL−1时对阴性样本显色较深(灰度值>200),且在40 ng·mL−1DES样本完全消线,所以将其作为最优DES-BSA包被浓度.
-
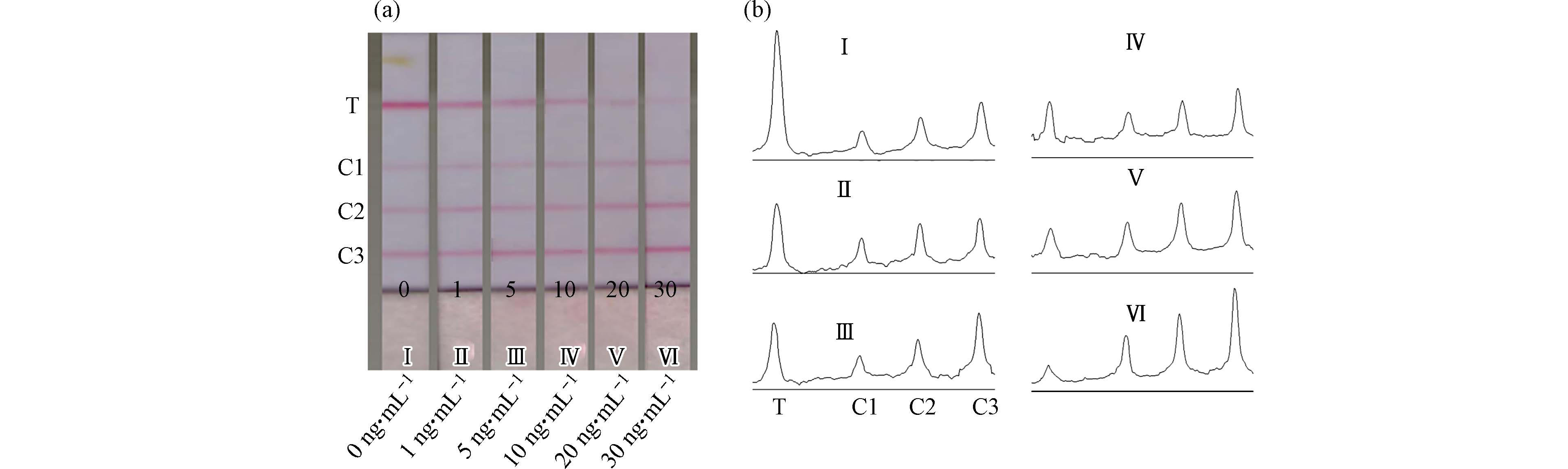
首先用” 2.1”所述的方法优化出IgY的标金浓度为5 μg·mL−1胶体金. 然后,按照”1.4”所述方法,确定了3条定量参考线的羊抗IgY包被浓度在0.1、0.2、0.3 mg·mL−1附近,然后经进一步微调,最终确定3条定量参考线(C1、C2、C3)的羊抗IgY包被浓度依次为0.1、0.17、0.25 mg·mL−1.
在优化条件下制备的试纸条如图3a所示,目视观察可以看到,当样品中不含DES或DES含量低于5 ng·mL−1时,T线显色比三条定量参考线深,当DES浓度为5、10、20 ng·mL−1时,T线显色分别与C3、C2、C1相近,当样品中DES含量大于20 ng·mL−1时,T线显色比C1浅. 利用ImageJ软件对试纸进行分析,可以看到当DES浓度为5、10、20 ng·mL−1时,T线灰度值分别与C3、C2、C1的灰度值相近(图3b). 因此试纸条对DES残留的半定量检测区间为≤5、5—10、10—20、≥20 ng·mL−1.
-
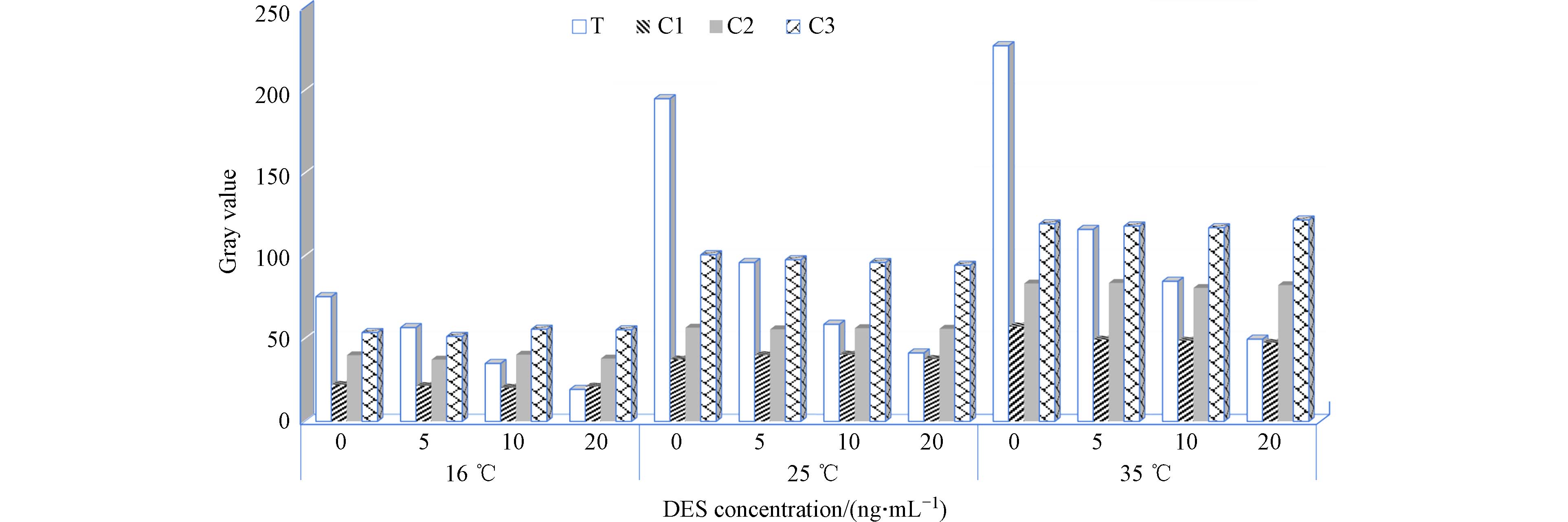
首先考察了16、25、35°C 3个温度对DES半定量试纸检测结果的影响,结果如图4所示. 由图4可见,随环境温度升高,试纸条的显色逐渐加深,尤其在16°C和25°C之间显色变化最为显著,这可能是温度影响了抗体与抗原的免疫反应速度所导致的.
考察了35%和55%两个湿度条件对DES试纸检测的影响,实验温度为25°C. 结果显示,在高湿度条件下,DES的显色显著低于低湿度条件. 图4和图5的结果说明,如果采用固定色卡与T线显色做对比来进行半定量测定会产生很大的偏差. 温度、湿度会显著影响胶体金的释放速度及在NC膜上的扩散速度,并且温度还会影响抗体与抗原的分子热运动进而影响免疫反应速度,所以不同温湿度下,胶体金免疫层析试纸上T、C线的显色速度会受到较大影响. 而由于金标DES抗体和DES-BSA反应体系以及组成“动态色卡”体系的金标IgY与羊抗IgY反应体系是在同一条检测试纸上受到相同的温湿度的影响,因此,T线和参考线的显色速度变化趋势则是基本相同的. 本实验结果证明了在检测试纸上集成“动态色卡”这种设计的可行性,它有助于消除温湿度变化对于胶体金侧向流免疫层析试纸显色结果判定的不利影响,从而提高目视检测的准确度.
-
分别用本文制备的DES检测卡及市售的DES酶联免疫试剂盒(检测限为0.1 ng·mL−1)检测了山东省王屋水库采集的3个水样,均未检出己烯雌酚. 在水库中心水样中添加了己烯雌酚,使其终浓度分别为5、10、20 ng·mL−1,然后分别用本文制备的检测卡及己烯雌酚ELISA试剂盒对加标样品进行了检测,二者的检测结果如表1所示. 结果表明本研究所制备的DES检测卡对加标水样的检测结果与市售ELISA试剂盒的实测结果一致.
-
本研究通过将不同浓度的羊抗IgY包被在NC膜上,与金标IgY结合,在DES检测试纸上构建了一个独立于检测线免疫反应的“动态色卡”,由于受相同温湿度的影响,色卡的半定量参考线在不同温度和湿度下的显色与DES检测线基本一致,因此可以在不同温度和湿度的环境中实现对DES的半定量检测. 制备的试纸条对DES残留的半定量检测区间为≤5 ng·mL−1;5—10 ng·mL−1,10—20 ng·mL−1,≥20 ng·mL−1,对地表水样品中DES的目视半定量检测结果与ELISA试剂盒检测结果一致. 本研究克服了传统免疫层析试纸条的检测结果易受环境温湿度等因素影响的缺点,能够在野外环境中实现对己烯雌酚的现场检测. 同时,由于组成“动态色卡”的反应体系独立于DES的反应体系,本研究所提出的“动态色卡”设计思路可以应用于其它抗原的免疫层析试纸检测,在环境监测、体外诊断、食品安全等对现场快速检测有较大需求的领域有可观的应用前景.
基于“动态比色卡”的胶体金免疫层析试纸检测地表水中己烯雌酚残留
A colloidal gold immunochromatographic test strip based on “dynamic colorimetric card” for the detection of diethylstilbestrol residues in surface water
-
摘要: 胶体金免疫层析技术可以快速方便的实现目标化合物的可视化检测,因此被认为特别适合现场快速筛查. 但胶体金免疫层析试纸检测线的显色受环境温度及湿度影响显著,从而影响了现场可视化检测结果的准确性. 为减轻温度、湿度对检测结果的影响,本文以己烯雌酚(DES)单克隆抗体标记胶体金,与NC膜上包被的DES-BSA反应,作为检测线;以鸡免疫球蛋白(IgY)标记胶体金,与NC膜上以3个不同浓度包被的羊抗IgY多克隆抗体反应,作为3条半定量参考线,制备了DES半定量免疫层析检测试纸. 该试纸条对DES残留的半定量检测区间为≤5 ng·mL−1、5—10 ng·mL−1、10—20 ng·mL−1、≥ 20 ng·mL−1,在测试的温度、湿度范围内判读结果无显著变化. 对地表水样品中DES半定量检测结果与ELISA试剂盒检测结果一致. 本研究思路可望用于开发更适合现场检测需求的胶体金免疫层析检测卡.Abstract: Due to its convenient visual detection of target compounds, colloidal gold immunochromatography technology is particularly suitable for on-site rapid screening; yet, the color development of the colloidal gold immunochromatographic test strip detection line can be significantly impacted by environmental temperature and humidity, thus affecting the accuracy of the on-site visualization detection. To minimize the effects of temperature and humidity on the detection results, a diethylstilbestrol (DES) semi-quantitative immunochromatographic assay strip was prepared by labeling colloidal gold with DES monoclonal antibody and reacting with DES-BSA coated on NC membrane as the detection line; Additionally, three semi-quantitative reference lines were created by labeling colloidal gold with chicken immunoglobulin (IgY) and reacting with sheep anti IgY polyclonal antibodies coated on NC membrane at three different concentrations. This test strip is capable of semi-quantitative analysis of DES concentrations in four ranges: ≤ 5 ng·mL−1, 5—10 ng·mL−1, 10—20 ng·mL−1, and ≥ 20 ng·mL−1, with no significant discrepancies in the results within the tested temperature and humidity ranges. The semi-quantitative detection results of DES in surface water samples are in agreement with the detection results from the ELISA kit. This method is expected to be used to create colloidal gold immunochromatographic detection cards that are more suitable for on-site testing requirements.
-

-
表 1 DES半定量检测试纸和ELISA检测试剂盒对实际样品的检测结果
Table 1. The detection results of DES semi-quantitative test strip and ELISA kit on actual samples
采样位置
Sample collection site加标浓度/ (ng·mL−1)
Spiked concentration试纸检测值/ (ng·mL−1)
Results from test stripELISA试剂盒检测值/ (ng·mL−1)
Results from ELISA kit黄水河入库口
Reservoir mouth— ND* ND 水库中心
Reservoir center— ND ND 5 ≤5 4.18 10 5-10 8.49 20 10-20 17.30 水库大坝
Reservoir Dam— ND ND *ND., 未检出. ND., not detected. -
[1] ZENG W P, QIU J A, CHEN W, et al. Determination of diethylstilbestrol in environmental water based on co(II)-sensitized electrochemical sensing[J]. Journal of the Electrochemical Society, 2022, 169(11): 117503. doi: 10.1149/1945-7111/ac9ee9 [2] NIE M H, YAN C X, DONG W B, et al. Occurrence, distribution and risk assessment of estrogens in surface water, suspended particulate matter, and sediments of the Yangtze Estuary[J]. Chemosphere, 2015, 127: 109-116. doi: 10.1016/j.chemosphere.2015.01.021 [3] GASPARI L, SOYER-GOBILLARD M O, PARIS F, et al. Multigenerational endometriosis: Consequence of fetal exposure to diethylstilbestrol?[J]. Environmental Health, 2021, 20(1): 96. doi: 10.1186/s12940-021-00780-5 [4] 付臣丽. 滋肾调冲汤联合己烯雌酚片治疗月经不调的临床疗效[J]. 临床研究, 2022, 30(8): 112-114. FU C L. Clinical efficacy of zishen tiaochong decoction combined with diethyistilbestrol tablets in the treatment of irregular menstruation[J]. Clinical Research, 2022, 30(8): 112-114 (in Chinese).
[5] JIANG W W, YAN Y, MA M, et al. Assessment of source water contamination by estrogenic disrupting compounds in China[J]. Journal of Environmental Sciences, 2012, 24(2): 320-328. doi: 10.1016/S1001-0742(11)60746-8 [6] 金丽琼, 张睿, 刘妤, 等. 水产品中己烯雌酚残留检测方法[J]. 中南农业科技, 2023, 44(1): 226-228. JIN L Q, ZHANG R, LIU Y, et al. Method for detect diethylstilbestrol residues in aquatic product[J]. South-Central Agricultural Science and Technology, 2023, 44(1): 226-228 (in Chinese).
[7] 姚栩, 陈智伟, 张彩云, 等. 一种新型胶体金免疫层析双抗体夹心法新型冠状病毒抗原检测试剂的研制[J]. 中国病毒病杂志, 2023, 13(2): 115-119. YAO X, CHEN Z W, ZHANG C Y, et al. Development of a novel gold immunochromatographic double-antibody sandwich assay for detection of SARS-CoV-2 antigen[J]. Chinese Journal of Viral Diseases, 2023, 13(2): 115-119 (in Chinese).
[8] 荣光, 徐向东, 彭维祺, 等. 胶体金免疫层析技术及其在畜禽疫病诊断中的应用[J]. 中国畜禽种业, 2022, 18(12): 27-30. RONG G, XU X D, PENG W Q, et al. Colloidal gold immunochromatography and its application in the diagnosis of livestock and poultry diseases[J]. The Chinese Livestock and Poultry Breeding, 2022, 18(12): 27-30 (in Chinese).
[9] 宋姣, 何婷婷, 齐冬琴. 胶体金免疫层析技术在食品快速检测中的应用[J]. 现代食品, 2022, 28(21): 75-77. SONG J, HE T T, QI D Q. Application of colloidal gold immunochromatography in rapid detection of food[J]. Modern Food, 2022, 28(21): 75-77 (in Chinese).
[10] 杨波, 刘志平, 姬培, 等. 胶体金免疫层析试纸条检测环境样品中的镉(Ⅱ)[J]. 环境科学与技术, 2017, 40(5): 119-125. YANG B, LIU Z P, JI P, et al. Determination of cadmiumin(Ⅱ) in river water and rice samples by colloidal gold immunochromatography test strip[J]. Environmental Science & Technology, 2017, 40(5): 119-125 (in Chinese).
[11] BAHADıR E B, SEZGINTÜRK M K. Lateral flow assays: Principles, designs and labels[J]. TrAC Trends in Analytical Chemistry, 2016, 82: 286-306. doi: 10.1016/j.trac.2016.06.006 [12] LATTANZIO V M T, NIVARLET N, LIPPOLIS V, et al. Multiplex dipstick immunoassay for semi-quantitative determination of Fusarium mycotoxins in cereals[J]. Analytica Chimica Acta, 2012, 718: 99-108. doi: 10.1016/j.aca.2011.12.060 [13] MAO X Y, WU Y X, CHEN H T, et al. A mix-and-detect method based on colloidal gold immunochromatographic assay for on-site detection of Zearalenone in edible oils[J]. Analytical Methods:Advancing Methods and Applications, 2020, 12(46): 5628-5634. [14] HRISTOV D R, RODRIGUEZ-QUIJADA C, GOMEZ-MARQUEZ J, et al. Designing paper-based immunoassays for biomedical applications[J]. Sensors (Basel), 2019, 19(3):554. [15] SUN Q, ZHU Z, DENG Q M, et al. A “green” method to detect aflatoxin B1 residue in plant oil based on a colloidal gold immunochromatographic assay[J]. Analytical Methods, 2016, 8(3): 564-569. doi: 10.1039/C5AY02779A -




 下载:
下载: