-
近年来,土壤重金属污染问题引起了公众的广泛关注[1]. 重金属的累积不仅导致土壤质量恶化、降低农业生产力,更因其可致癌、可沿食物链富集等特点对人类健康形成巨大隐患[2 − 3]. Shi等[1]调查评估了1977年至2020年期间中国土壤污染现状,结果表明重金属为土壤主要污染物,占土壤污染物的82.4%,其中Pb、Cd、Ni、Cu等重金属超标率分别达到了1.5%、7.0%、4.8%和2.1%. Zhang等[4]通过对中国31个省份不同土壤类型进行重金属污染评估,得出了重金属对全国土壤生态风险的平均总体概率为2.42%(Cd)、2.82%(Pb)、12.17%(Zn)、14.89%(As)、10.42%(Cu)、32.20%(Cr)和8.88%(Ni). 重金属的危害不仅与其浓度有关,还和其形态有关,而重金属的形态、迁移率及生物利用度主要受到土壤矿物、有机物表面吸附和沉淀等相互作用影响[1]. 在土壤氧化还原、老化和微生物活动下,土壤矿质、有机质及其关联的动态变化使重金属的命运进一步复杂化. 因此,全面了解重金属离子与土壤有机物质的相互作用机制对环境风险评估和污染修复治理至关重要[5].
与其他环境有机物不同,转Bt基因作物生长过程中所分泌的Bt毒素内部结构含有丰富的酸性氨基酸基团,对重金属离子具有较强的络合能力,可能对重金属离子在土壤多介质体系中的迁移行为造成重大影响[6]. 至2019年全球已有1.904亿Hm2土地种植转基因作物,其中苏云金芽孢杆菌(Bacillus Thuringiensis,Bt)抗虫转基因技术对鳞翅目类昆虫等农作物常见害虫的杀灭具有高效显著性,故而普及程度最高,常用于棉花、大豆、玉米等多种经济作物[7 − 8]. 经过长期调查,人们发现转Bt基因作物所产生的Bt毒素能通过根际分泌物、花粉以及作物残留物等方式进入环境,并与土壤活性颗粒结合保持活性[9 − 11].当前的诸多研究均表明Bt毒素对非靶向生物无法产生直接毒害,但长期种植转Bt基因作物后Bt毒素残留对环境生物是否具有间接影响却饱受争议[12 − 14]. Wang等[15]通过荧光技术分析Bt毒素单体与过渡金属Cd2+、Zn2+之间的猝灭情况证实了Bt毒素能与重金属离子产生络合,且揭示了Cd2+、Zn2+与Cry1Ac蛋白的确切结合位点. Zhou等[16]通过探究Bt毒素进入土壤环境后对土壤吸附重金属离子的影响,发现Bt毒素能与红壤和黑壤结合抢占Pb2+结合位点,导致其流动性加强,环境风险增加. 由此可知,转Bt基因作物向环境中大量分泌的Bt毒素不仅能直接络合重金属离子,还能通过抢占重金属结合位点影响重金属离子的迁移转化,导致重金属离子行为复杂化. 近年来诸多学者研究发现,荧光光谱结合分子对接模拟可用于补充与阐明不同分子间的确切结合模式并取得了显著成果[17 − 18]. 当前Cu2+、Pb2+与Bt毒素的相互作用机制尚未明了,本研究采用荧光光谱法结合分子对接模拟对二者的相互作用机制进行剖析,更有利于从分子水平层面理解Bt基因作物种植环境中重金属离子的迁移转化行为.
为进一步了解重金属离子与Bt毒素之间的相互作用机制,本研究选择了Cu2+、Pb2+作为重金属离子代表,Cry1Ac毒素作为Bt毒素代表,通过荧光光谱法和分子对接模拟的方法,探究了不同环境条件下Cu2+、Pb2+与Bt毒素的相互作用机理,以期为转Bt基因作物种植环境中重金属离子的迁移转化行为提供一定的理论依据.
-
仪器:Hitachi F-
7000 型荧光分光光度计(日本,日立公司);立式低速离心机DD5H(赫西仪器装备有限公司,湖南).试剂:Cry1Ac毒素(纯度>90%)购自佑隆生物公司(上海),分子量= 69 kDa,粉末状态于−80 ℃超低温冰箱冷藏,溶液状态于−20 ℃冰箱冷藏;无水磷酸氢二钠、一水合柠檬酸和氯化钠均购自国药集团化学试剂有限公司(上海),纯度均为分析级;铜、铅单元素标准溶液购自国家有色金属及电子材料分析测试中心(北京),标准值:
1000 μg·mL−1;其它化学试剂均为分析纯,实验所用超纯水均通过Kertone Lab MINI-D系列实验室纯水系统,电阻率为18 MΩ·cm. -
制备柠檬酸-磷酸氢二钠缓冲溶液(pH8)模拟不同离子强度条件(I=0.05 mol·L−1,0.1 mol·L−1),分别取1 mL的Cry1Ac毒素(浓度为10 mg·L−1)储备液与1 mL相应浓度的铜/铅金属离子储备液加入Eppendorf 蛋白低吸附管中,加入1 mL去离子水,用相应离子强度的柠檬酸-磷酸氢二钠缓冲液定容至10 mL,在所需开尔文温度环境下(T=298 K,308 K)反应24 h后测定各溶液的荧光光谱. 二维荧光测定的激发波长Ex=282 nm,发射波长范围Em=300—500 nm,同步荧光扫描过程中固定激发波长与发射波长差Δλ=60 nm,激发狭缝和发射狭缝宽度均为2.5 nm,扫描速度为
1200 nm·min−1,以0.05 mol·L−1或0.1 mol·L−1的柠檬酸-磷酸氢二钠缓冲溶液作为空白校正. -
Cry1Ac毒素的晶体结构(PDB: 4ARX)由RCSB蛋白银行提供(http://www.rcsb.org/pdb). 使用watvina进行分子对接(https://www.github.com/biocheming/watvina),模拟受体蛋白(4ARX)与配体(Cu2+、Pb2+)之间的相互作用. 在以坐标(31.082, 31.361, 36.688)为中心的立方体网格(118 × 84 × 126 Å3点立方体覆盖)内进行对接,对接运行了50次. 用PyMol软件导出Cry1Ac毒素与金属离子构象的复合体,并用LigPlus软件对其进行可视化分析.
-
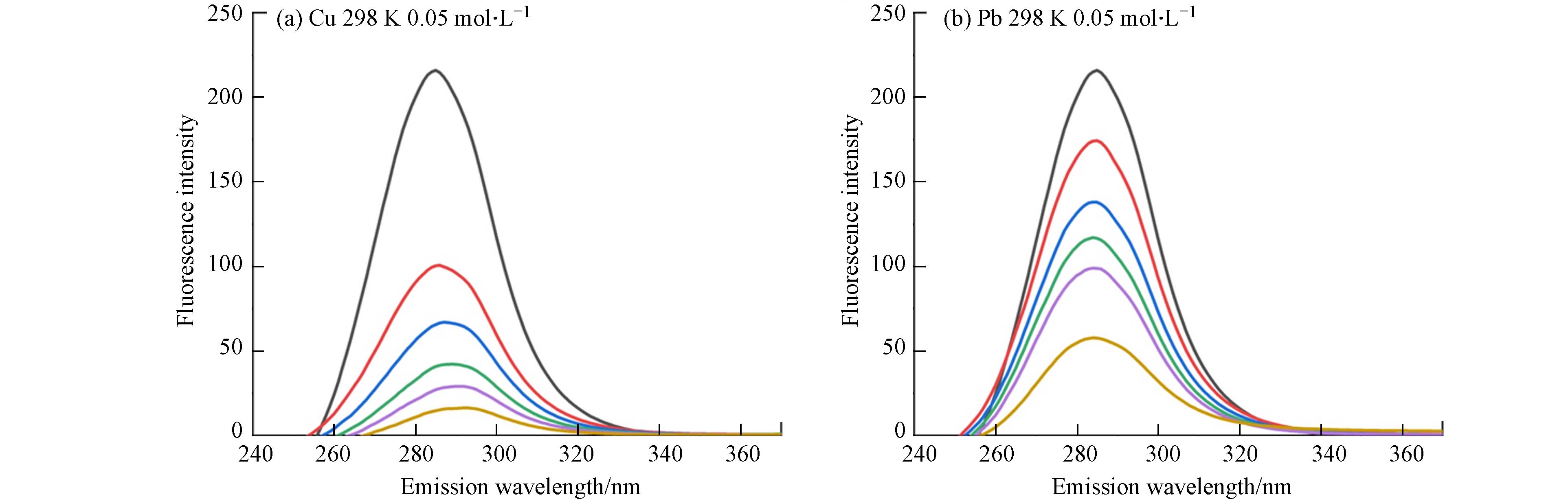
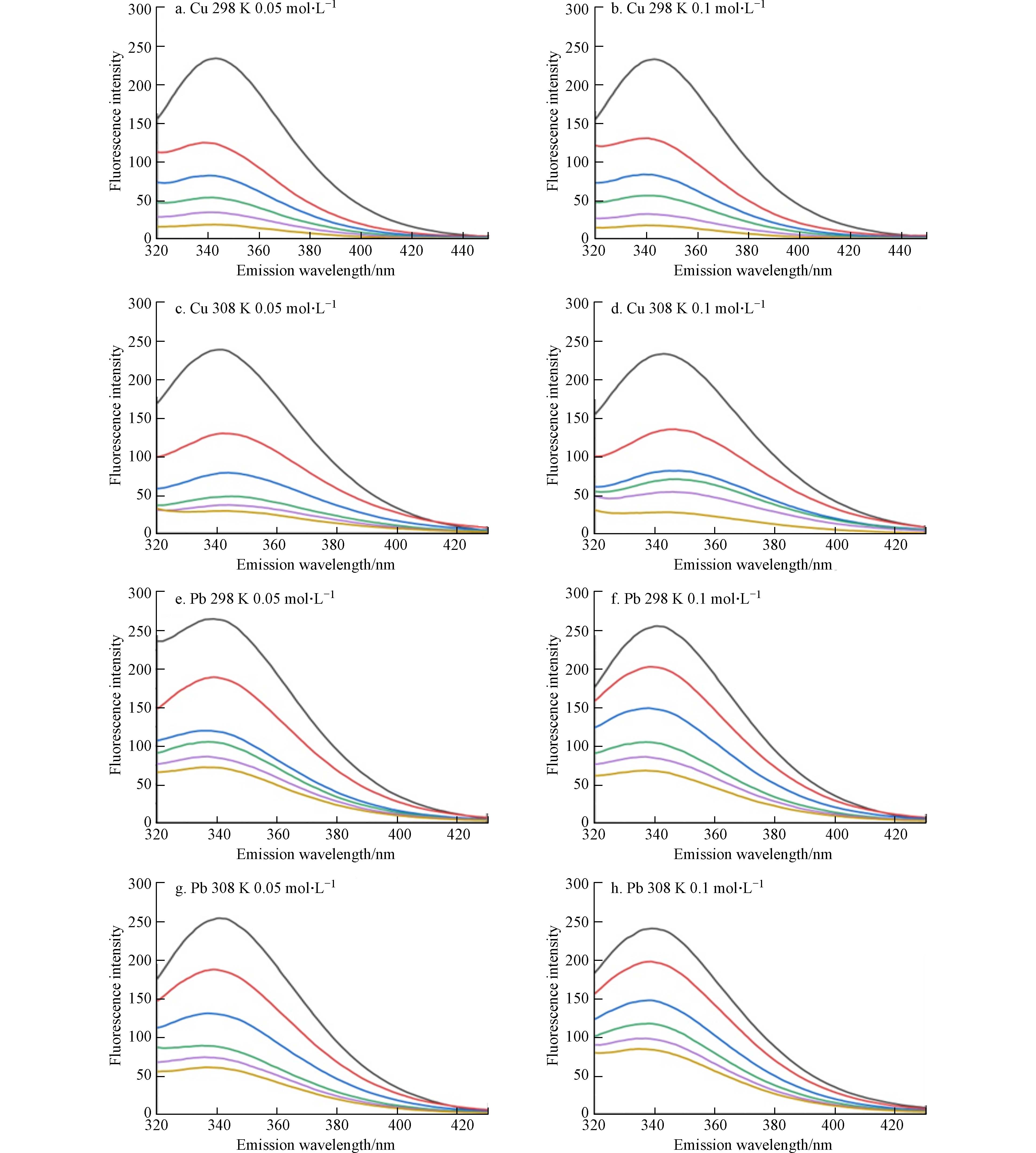
芳香氨基酸残基中具有内源荧光的特性,色氨酸(Trp)、苯丙氨酸(Phe)和酪氨酸(Tyr)是作为自然界中Cry1Ac毒素的固有荧光来源,其中色氨酸为主要荧光发色团[19]. 因此可利用Cry1Ac毒素固有的荧光性质及不发光的金属离子,两者相互作用后产生的荧光强度降低现象来探究金属离子与Cry1Ac毒素相互作用. 图1为在激发波长下282 nm下,不同温度和离子强度下Cu2+、Pb2+与Cry1Ac毒素的荧光发射图谱. 由图1可知在激发波长下282 nm时,Cry1Ac毒素荧光最强峰出现在340 nm附近,说明荧光峰主要来源于色氨酸残基Trp,且通过测定单一Cu2+、Pb2+溶液发现重金属Cu2+、Pb2+在图谱范围内无荧光发射[20]. 而随着Cu2+、Pb2+浓度增加,Cry1Ac毒素的荧光强度也逐渐减弱,这表明Cu2+、Pb2+浓度是导致Cry1Ac毒素荧光猝灭的主要因素. 通过对比图1(a、e)可知,当Cu2+浓度为50 mg·L−1时,Cry1Ac毒素的荧光几乎被完全猝灭,说明Cu2+对于Cry1Ac毒素具有较好的猝灭效果. 且Cu2+、Pb2+的加入使荧光峰所在的最大发射波长出现了红移,随着重金属离子浓度的增加,红移的现象愈加明显,这说明Cu2+、Pb2+浓度的增加可能使Cry1Ac毒素荧光团所处环境更亲水或使Trp残基的芳香环产生堆叠[20].
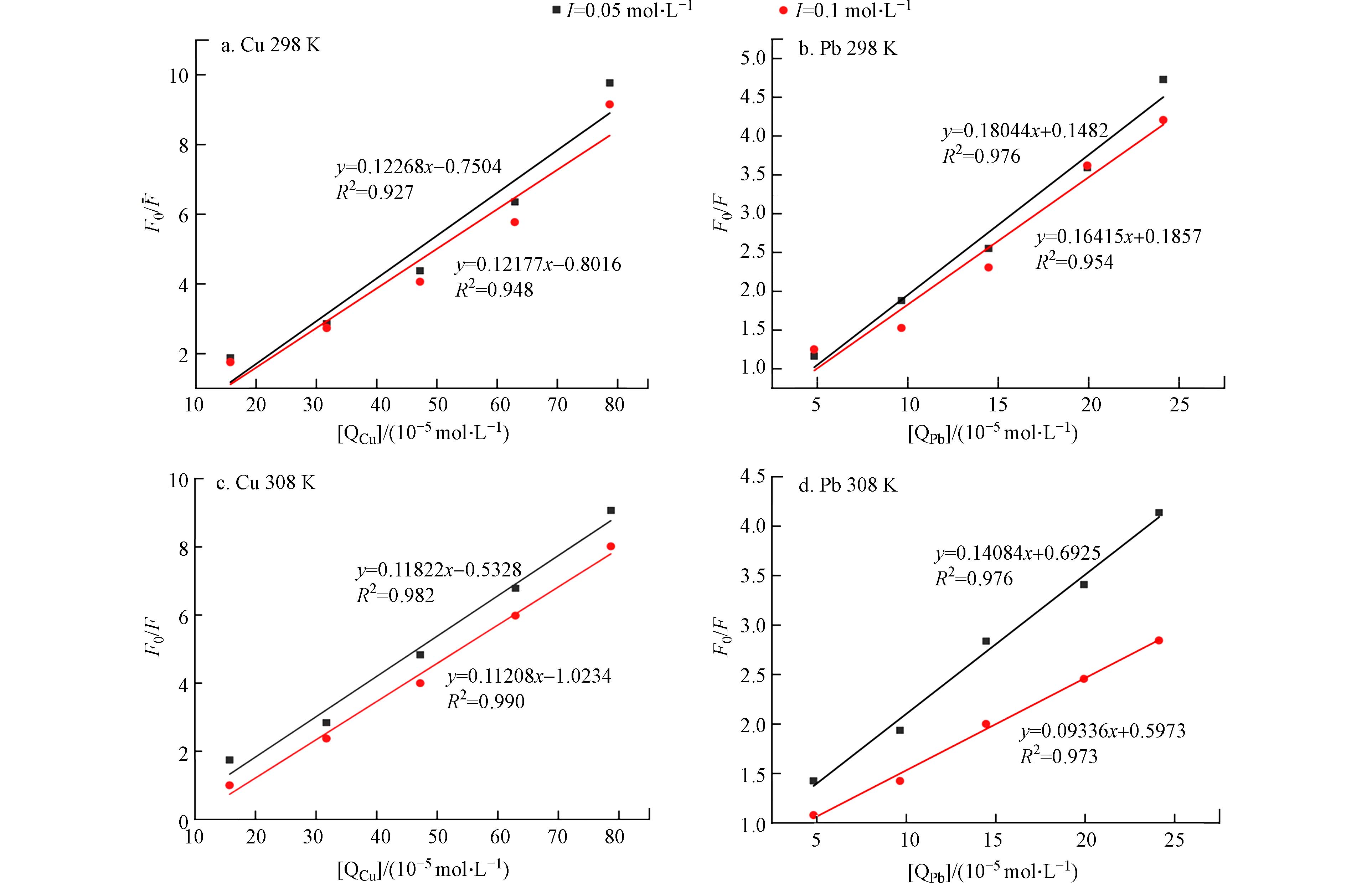
生物大分子与化学小分子相互作用产生的猝灭类型可分为动态猝灭和静态猝灭,主要源于他们对温度的依赖性不同[21 − 22]. 随着温度的升高,两种相互作用的物质之间产生加速扩散和大量碰撞的猝灭机制为动态猝灭,淬灭常数随温度的升高而增加;而静态猝灭则相反,当猝灭剂猝灭荧光团并形成基态复合物时为静态猝灭,淬灭常数将随温度的升高而降低[23 − 24]. 为了进一步判断Cry1Ac毒素的猝灭行为,使用了Stern-Volmer猝灭方程(1)对Cry1Ac毒素的荧光猝灭量与不同温度及离子强度下金属离子Cu2+、Pb2+浓度之间的关系进行了计算:
式(1)中,F0为猝灭体不存在时Cry1Ac毒素的荧光强度;F为加入猝灭体后Cry1Ac毒素的荧光强度;Kq为双分子猝灭常数(约为2.0×1010);[Q]为猝灭体的浓度;τ0为猝灭体不存在时的荧光寿命,其值约为10−8 s; Ksv为Stern-Volmer常数.
以F0/F为纵轴,[Q]为横轴作线性拟合,所得线性回归斜率即为猝灭常数Ksv. 图2为不同温度和离子强度下Cu2+和Pb2+与Cry1Ac毒素的Stern-Volmer荧光猝灭曲线图. 由图2可知不同条件下金属离子浓度对Cry1Ac毒素猝灭量与Stern-Volmer方程均具有良好的线性关系.
不同温度和离子强度下重金属离子与Cry1Ac毒素相互作用的Stern-Volmer方程和双分子猝灭常数具体值如表1所示,通过对比发现Cu2+、Pb2+与Cry1Ac毒素相互作用的双分子猝灭常数Ksv随着温度的升高而降低,说明了Cu2+和Pb2+对Cry1Ac毒素的猝灭可能是形成不发光基态化合物的静态猝灭过程[25]. 且已知生物分子所能达到的极限扩散速率常数为2.0×1010 L·mol−1·s−1,若Kq的值大于2.0×1010 L·mol−1·s−1,即判定其体系荧光猝灭机制为形成基态复合物产生的静态猝灭[26]. 本研究中不同温度及离子强度条件下金属离子与Cry1Ac毒素反应的Kq值均等于或大于1.0×1012 L·mol−1·s−1,比生物分子的极限扩散速率常数大1—2个数量级,进一步说明引起体系荧光强度减弱的过程是静态猝灭. 通过对比Cu2+、Pb2+的Ksv值可知,Ksv(Cry1Ac-Cu2+)普遍小于Ksv(Cry1Ac-Pb2+)表明Pb2+对Cry1Ac毒素的猝灭速率更快[15]. 但对比Ksv值的变化趋势可知Cu2+与Cry1Ac毒素的相互作用更加稳定,受温度与离子强度的影响较小,而Pb2+与Cry1Ac毒素的相互作用受温度和离子强度的影响稍强,温度和离子强度的升高都在一定程度上降低了猝灭强度,其中离子强度增加猝灭强度降低可能为静电屏蔽作用[16].
-
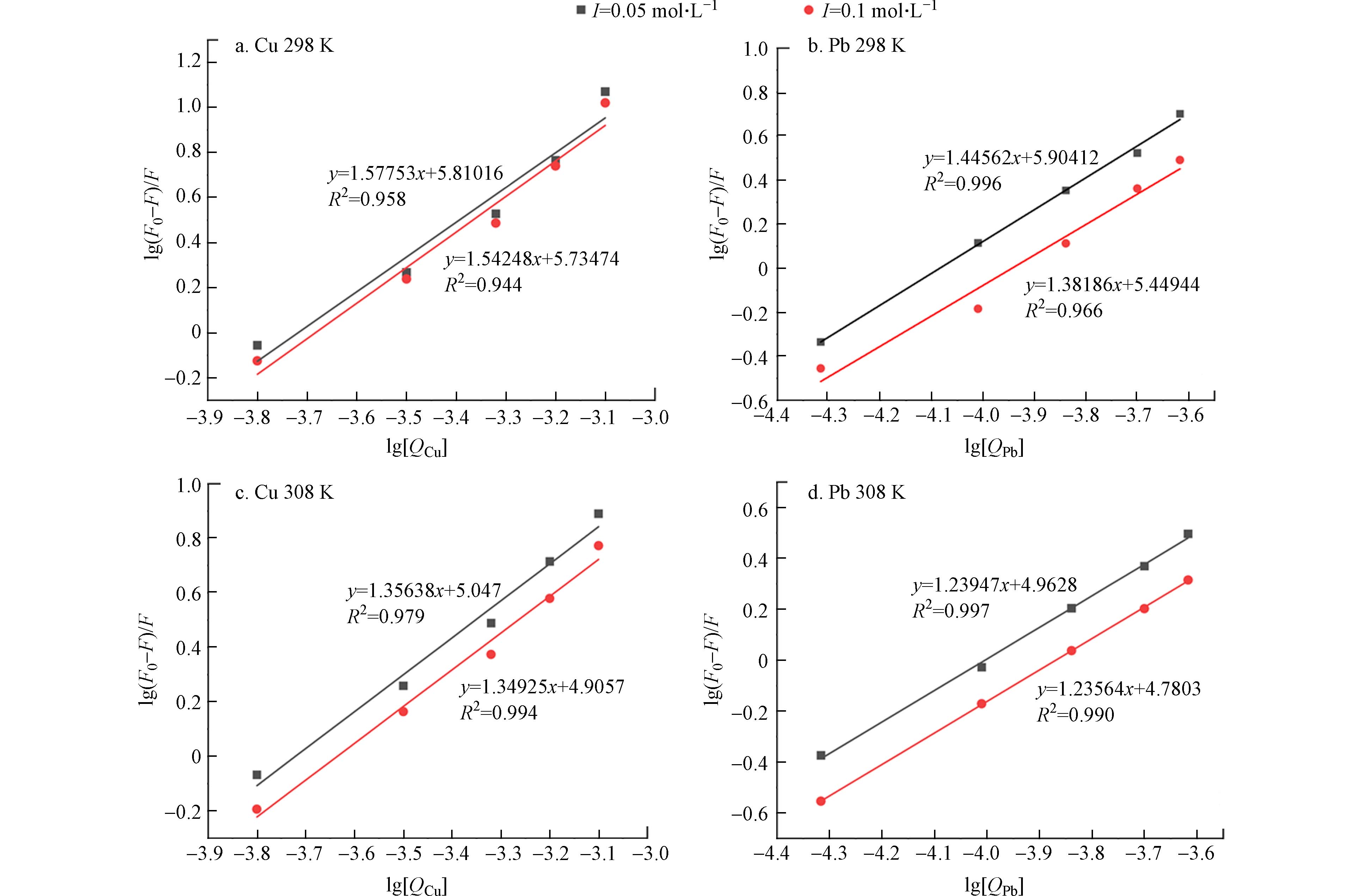
通过Stern-Volmer方程确定了其猝灭过程为静态猝灭之后,将数据进行修正Stern-Volmer方程分析,可了解反应体系的结合常数(KA)和结合位点数(n)[17],有助于进一步探究Cu2+、Pb2+与Cry1Ac毒素相互作用的内在机理. 为了确定各体系的结合常数KA和结合位点数n,使用了静态猝灭双对数公式(2)对Cu2+、Pb2+与Cry1Ac毒素相互作用的结合常数KA和结合位点数n进行了计算:
式(2)中,KA为可见荧光团的有效猝灭常数,代表金属离子与Cry1Ac毒素的结合常数,n是结合化学计量数,代表结合位点数. 以lg(F0−F)/F为纵坐标,lg[Q]为横坐标,代入荧光发射强度最大处的数值进行线性拟合,得到的斜率即为结合位点数(n). 图3为不同温度和离子强度下lg[(F0−F)/F]对lg[Q]的关系图,由图中可知各体系存在良好的线性拟合关系,具体结果见表2.
由表2可知,在不同环境条件下,Cu2+、Pb2+与Cry1Ac毒素相互作用的结合位点数(n)均大于1,其中n(Cry1Ac-Cu2+)普遍大于n(Cry1Ac-Pb2+),说明重金属离子与Cry1Ac毒素间存在很强的相互作用,形成了一个结合位点,且与Pb2+相比,Cu2+在Cry1Ac中的分布更广泛,结合更强[18]. 而当结合位点数(n)大于1时,说明结合体系存在一个复杂的猝灭过程[27]. 结合位点数(n)随着温度升高而呈现降低趋势,表明重金属离子与Cry1Ac毒素的相互作用也随着温度的升高而减缓,这再次证明了猝灭类型为静态猝灭. 结合常数(KA)在一定程度上可表现出重金属离子在蛋白质中的分布情况[28],通过表2可知在同一温度及离子强度下KA(Cry1Ac-Cu2+)>KA(Cry1Ac-Pb2+),再次证明Cu2+相较于Pb2+与Cry1Ac毒素具有更好的结合能力,且在蛋白质中的分布更广,这可能由于Cu2+半径(71 pm)小于Pb2+半径(133 pm).
-
化学小分子(Cu2+、Pb2+金属离子)与生物大分子(Cry1Ac毒素)之间相互作用主要通过氢键、静电引力、范德华力和疏水等作用力[15, 29]. 通过热力学参数如ΔG自由能;ΔS熵变;ΔH焓变的反应前后变化推测反应的主要驱动力,是荧光光谱法中解释结合模式机理的重要手段[30]. 为了进一步阐明Cry1Ac毒素与Cu2+、Pb2+两种重金属离子的相互作用机制,本研究通过设置298 K和308 K两个温度分析了Cu2+、Pb2+两种重金属离子与Cry1Ac毒素的热力学参数随温度的变化规律. 焓变ΔH和熵变ΔS以及自由能变ΔG可通过Van’t Hoff方程(3)、(4)来计算:
式(3)—(4)中R为热力学常数,数值近似于8.314 J·(mol·K−1);T是实验温度K;KA为相应温度下的静态猝灭结合常数. 在温度为298 K和308 K的环境下,Cu2+、Pb2+与Cry1Ac毒素的热力学参数计算结果见表3,可知在298 K和308 K下Cu2+、Pb2+与Cry1Ac毒素自由能ΔG< 0,表明Cry1Ac毒素与Cu2+、Pb2+两种重金属离子的结合过程为自发进行. 一般认为,由热力学参数判断,ΔH > 0和ΔS >0表明主要作用力为疏水相互作用力;ΔH< 0和ΔS < 0表示范德华力或氢键形成,ΔH < 0和ΔS > 0表示静电作用力[15, 31],可知ΔH焓变< 0、ΔS熵变> 0说明静电作用力在Cu2+、Pb2+与Cry1Ac毒素结合过程中为主要作用力.
-
同步荧光光谱通过对芳香族残基中重叠激发峰的特征进行识别,可探究荧光发射强度的升降或偏移所代表发色团微环境的极性变化,是荧光光谱法中检测蛋白构象变化的重要手段[32 − 33]. 已知Δλ值稳定在60 nm时仅显示Trp残基的荧光[20],本研究中固定扫描激发波长与发射波长差Δλ=60 nm,测定了298 K下离子强度为0.05 mol·L−1时Cu2+、Pb2+与Cry1Ac毒素相互作用下的同步荧光光谱.
从图4中可知Trp残基在激发波长=285 nm处出现荧光峰,且随着重金属离子浓度的增加,Cry1Ac毒素所携带Trp残基的荧光猝灭程度也随之增加,这与二维荧光发射光谱的结果相吻合,表明Trp残基参与了Cu2+、Pb2+与Cry1Ac毒素的相互作用过程. 从图中显示的色氨酸残基的特征信息中发现:重金属离子的加入不仅使色氨酸残基的荧光强度减弱,也使最大发射波长的位置发生了红移,这个现象说明与重金属离子的结合使色氨酸残基暴露于更亲水的环境,溶液的环境变得更具极性,且毒素结构开始变得疏松[34 − 35].
-
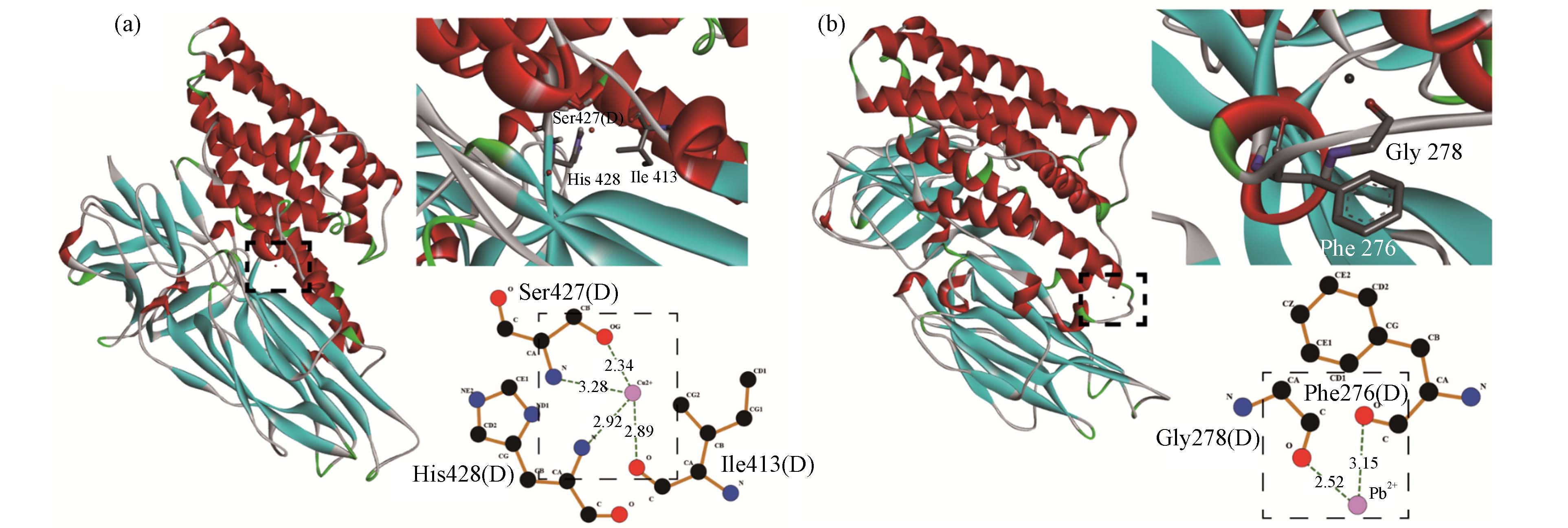
分子对接已广泛应用于小分子与蛋白质相互作用的研究,以直观探究小分子与蛋白质的结合位点和作用力类型[36 − 37]. 对接得分绝对值越大,表明配体与毒素的结合越紧密[15]. 由表4可知,Cu2+、Pb2+与Cry1Ac毒素的结合能分别为−4.02 kJ·mol−1和−1.93 kJ·mol−1,即可知Cu2+与Cry1Ac毒素结合更加紧密. 如图5所示,Cu2+与Cry1Ac毒素上关键氨基酸残基IIe413,Ser427和His428紧密结合. 其完全嵌入毒素活性口袋中,与残基IIe413(2.89 Å)和Ser427(2.34 Å)中的O原子形成氢键,与残基Ser427(3.28 Å)和His428(2.92 Å)中的N原子形成氢键. 此外如图5b所示,在Cry1Ac- Pb2+复合体中,Pb2+能与残基Phe276(3.15 Å)和Gly278(2.52 Å)中的O原子形成氢键. 因此,氢键作用力可能是Cu2+、Pb2+与Cry1Ac毒素相互作用之一.
-
利用荧光光谱法以及分子对接模拟的实验技术,研究了Cu2+、Pb2+与 Cry1Ac毒素的相互作用机制. 证实了Cu2+、Pb2+能有效猝灭Cry1Ac毒素的内源荧光,猝灭类型为静态猝灭;同时计算了两种重金属离子对 Cry1Ac毒素的结合常数和结合位点数,结合位点数均大于1,表明两者之间存在较强的结合作用力,其中Cu2+与Cry1Ac毒素的结合常数更高,这一现象可能与金属离子半径大小有关. 通过荧光热力学结果ΔH< 0、ΔS > 0得知结合猝灭过程主要作用力为静电作用力,且由ΔG < 0可知结合过程为自发进行;通过同步荧光分析可知Cu2+、Pb2+与Cry1Ac毒素的结合使Cry1Ac毒素构象发生了改变,Trp残基周围环境极性变强,发光效率降低;分子对接分析可知Cu2+、Pb2+与Cry1Ac毒素结合模式相似,氢键可能是结合驱动力之一,且Cu2+与Cry1Ac毒素结合稍强于Pb2+. 本研究有助于了解Cu2+、Pb2+与 Cry1Ac毒素的结合机制,对分析重金属污染区域转Bt作物种植可能存在的生态安全及环境影响等研究方面具有参考价值和借鉴意义.
荧光光谱结合分子对接探究Cu2+、Pb2+与Cry1Ac毒素的相互作用
Fluorescence spectroscopy combined with molecular docking to probe the interaction of Cu2+, Pb2+ and Cry1Ac toxins
-
摘要: 随着全球土壤重金属污染问题日益严峻,转Bt基因作物生长过程中所分泌的Bt抗虫毒素与土壤重金属离子的协同作用逐渐被重视. 本文采用荧光光谱法与分子对接法,研究了Cu2+、Pb2+与Cry1Ac毒素的相互作用机制. 结果表明,根据Stern-volmer方程分析可知重金属离子能通过静态猝灭过程有效地猝灭Cry1Ac毒素的内源荧光. 静态猝灭双对数公式计算得知结合位点数n均大于1表明Cu2+、Pb2+与Cry1Ac毒素有较强的结合能力且存在一个强力的结合位点. 并根据Van’t Hoff热力学方程计算结果判断出这是一个以静电作用力为主导的自发吸热过程. 此外,重金属离子与Cry1Ac毒素的相互作用会使Try残基暴露在亲水环境中,从而使毒素结构变得更加松散. 此外,分子对接结果进一步验证了Cu2+、Pb2+分别通过氢键与Cry1Ac毒素在IIe413、Ser427、His428位置和Phe276、Gly278位置结合良好,且Cu2+结合能力更强. 因此,本研究不仅揭示了Cu2+、Pb2+与Cry1Ac毒素的相互作用机制,而且为重金属离子-Bt毒素复合物的风险评估以及土壤生态安全维护提供了理论依据.Abstract: With the increasingly serious problem of soil heavy metal pollution in the world, the synergistic effect between Bacillus Thuringiensis (Bt) secreted by transgenic crops and heavy metal ions has been gradually emphasized. In this paper, the interaction mechanisms of Cu2+, Pb2+ and Cry1Ac toxin were investigated by fluorescence spectroscopy and molecular docking method. The results showed that heavy metal ions can effectively quench the endogenous fluorescence of Cry1Ac toxin through a static burst process according to Stern-volmer theory. As the calculated number of binding sites n from double logarithmic equation of static burst is greater than 1, the Cu2+ and Pb2+ could strongly bind to Cry1Ac toxin with multiple binding site. Also, it was determined to be a spontaneous endothermic process by Van't Hoff thermodynamic formula that is dominated by electrostatic interaction forces. Moreover, the interactions between heavy metal ions and Cry1Ac toxin could cause the external exposure of Cry1Ac toxin’s Try residual group in hydrophilic environment, and thus the toxin structure became more loose. Besides, the molecular docking further verified that Cu2+ and Pb2+ were well bound to IIe413, Ser427, His428 and Phe276, Gly278 of Cry1Ac toxin through hydrogen bond, respectively, while the Cu2+ had stronger binding ability. Therefore, this study not only revealed the interaction mechanism between Cu2+, Pb2+ and Cry1Ac toxin, but also provided a theoretical basis for the risk assessment and soil ecological security maintenance of heavy metal ions-Cry1Ac toxin complex pollution.
-
Key words:
- Cu2+ /
- Pb2+ /
- Bt toxin /
- fluorescence spectra /
- molecular docking.
-

-
图 1 不同温度(298 K,308 K)和离子强度(0.05 mol·L−1,0.1 mol·L−1)下Cu2+、Pb2+(从上到下浓度=0,10,20,30,40,50 mg·L−1)与Cry1Ac毒素的荧光发射光谱
Figure 1. Fluorescence emission spectra of Cu2+,Pb2+ (from top to bottom concentration = 0, 10, 20, 30, 40, 50 mg·L−1) and Cry1Ac toxin at different temperatures(298 K,308 K)and ionic strength(0.05 mol·L−1,0.1 mol·L−1)
表 1 Cry1Ac毒素与金属离子相互作用的Stern-Volmer方程和双分子猝灭常数
Table 1. Stern-Volmer equation and bimolecular quenching constants for the interaction between Cry1Ac toxin and metal ions
体系
System离子强度/(mol·L−1)
Ion strengthT/K Ksv/( L·mol−1) Kq/(L·mol−1·s−1) 相关系数
R2Cry1Ac-Cu2+ 0.05 298 1.22×104 1.0×1012 0.927 308 1.18×104 1.0×1012 0.948 0.1 298 1.21×104 1.0×1012 0.982 308 1.12×104 1.0×1012 0.990 Cry1Ac-Pb2+ 0.05 298 1.80×104 2.0×1012 0.976 308 1.40×104 1.0×1012 0.954 0.1 298 1.64×104 2.0×1012 0.976 308 0.93×104 1.0×1012 0.973 表 2 不同温度和离子强度下Cu2+和Pb2+对Cry1Ac毒素相互作用的结合常数和结合位点
Table 2. Binding constants and binding sites of Cu2+ and Pb2+ interaction with Cry1Ac toxin at different temperatures
体系
System离子强度/(mol·L−1)
Ion strengthT/K KA/(L·mol−1) n 相关系数
R2Cry1Ac-Cu2+ 0.05 298 6.458×105 1.57 0.958 308 1.114×105 1.35 0.979 0.1 298 5.429×105 1.54 0.944 308 0.804×105 1.34 0.994 Cry1Ac-Pb2+ 0.05 298 8.018×105 1.44 0.996 308 0.917×105 1.23 0.997 0.1 298 2.814×105 1.38 0.966 308 0.602×105 1.23 0.990 表 3 两种体系的热力学参数
Table 3. Thermodynamic parameters of the two systems
体系
System离子强度/(mol·L−1)
Ion strengthT/K ΔH/(kJ·mol−1·K−1) ΔS/(J·mol−1·K−1) ΔG/(kJ·mol−1) Cry1Ac-Cu2+ 0.05 298 −15.23 32.493 −96.98 308 −10.02 0.1 298 −81.41 1.392 −85.57 308 −85.70 Cry1Ac-Pb2+ 0.05 298 −43.95 3.942 −55.69 308 −56.09 0.1 298 −29.89 7.330 −51.73 308 −52.46 表 4 重金属离子与毒素的对接得分
Table 4. The docking score of heavy metal ions with proteins.
受体
Receptor配体
Ligand对接打分/(kJ·mol−1)
Docking scoreCry1Ac Cu2+ −4.02 Cry1Ac Pb2+ −1.93 -
[1] SHI J D, ZHAO D, REN F T, et al. Spatiotemporal variation of soil heavy metals in China: The pollution status and risk assessment[J]. Science of the Total Environment, 2023, 871: 161768. doi: 10.1016/j.scitotenv.2023.161768 [2] 杨静雯, 赵培丽, 冉凤维, 等. 基于多元统计方法的东洞庭湖沉积物重金属时空分布特征与来源变化[J]. 环境化学, 2024, 43(3): 920-932. YANG J W, ZHAO P L, RAN F W, et al. Evaluating the influence of upstream inflow in flood season on the overlying water of the Xinbian River based on EEM-PARAFAC and SOM[J]. Environmental Chemistry, 2024, 43(3): 920-932(in Chinese).
[3] RIZWAN M S, IMTIAZ M, ZHU J, et al. Immobilization of Pb and Cu by organic and inorganic amendments in contaminated soil[J]. Geoderma, 2021, 385: 114803. doi: 10.1016/j.geoderma.2020.114803 [4] ZHANG J W, LIU Z T, TIAN B, et al. Assessment of soil heavy metal pollution in provinces of China based on different soil types: From normalization to soil quality criteria and ecological risk assessment[J]. Journal of Hazardous Materials, 2023, 441: 129891. doi: 10.1016/j.jhazmat.2022.129891 [5] QU C C, CHEN W L, HU X P, et al. Heavy metal behaviour at mineral-organo interfaces: Mechanisms, modelling and influence factors[J]. Environment International, 2019, 131: 104995. doi: 10.1016/j.envint.2019.104995 [6] 张志昆, 袁龙飞, 刘庆菊, 等. 基于手性D-氨基酸的毒理性对转基因食品安全性的研究[J]. 中国科学:化学, 2015, 45(1): 98-108. doi: 10.1360/N032014-00048 ZHANG Z K, YUAN L F, LIU Q J, et al. Biosafety assessment of genetically modified foods based on the toxicology of the chiral D-amino acid[J]. Scientia Sinica Chimica, 2015, 45(1): 98-108 (in Chinese). doi: 10.1360/N032014-00048
[7] BRIEFS I. Global status of commercialized biotech/GM crops in 2017: Biotech crop adoption surges as economic benefits accumulate in 22 years[J]. ISAAA brief, 2017, 53: 25-26. [8] ISAAA. Global status of commercialized biotech/GM crops in 2019: Biotech crops drive socio-economic development and sustainable environment in the new frontier [M]. ISAAA Ithaca, NY, USA. 2019. [9] LIU J, LIANG Y S, HU T, et al. Environmental fate of Bt proteins in soil: Transport, adsorption/desorption and degradation[J]. Ecotoxicology and Environmental Safety, 2021, 226: 112805. doi: 10.1016/j.ecoenv.2021.112805 [10] TOMASZEWSKI J E, MADLIGER M, PEDERSEN J A, et al. Adsorption of insecticidal Cry1Ab protein to humic substances. 2. Influence of humic and fulvic acid charge and polarity characteristics[J]. Environmental Science & Technology, 2012, 46(18): 9932-9940. [11] PARKER K M, SANDER M. Environmental fate of insecticidal plant-incorporated protectants from genetically modified crops: Knowledge gaps and research opportunities[J]. Environmental Science & Technology, 2017, 51(21): 12049-12057. [12] GE L, SONG L L, WANG L Y, et al. Evaluating response mechanisms of soil microbiomes and metabolomes to Bt toxin additions[J]. Journal of Hazardous Materials, 2023, 448: 130904. doi: 10.1016/j.jhazmat.2023.130904 [13] GUTIERREZ-VILLAGOMEZ J M, PATEY G, TO T A, et al. Frogs respond to commercial formulations of the biopesticide Bacillus thuringiensis var . israelensis, especially their intestine microbiota[J]. Environmental Science & Technology, 2021, 55(18): 12504-12516. [14] KRANTHI K R, STONE G D. Long-term impacts of Bt cotton in India[J]. Nature Plants, 2020, 6(3): 188-196. doi: 10.1038/s41477-020-0615-5 [15] WANG L, LIANG Y S, WU Z B, et al. Exploring the interaction between Cry1Ac protein and Zn2+, Cd2+ metal ions by fluorescence quenching and molecular docking approaches[J]. Chemosphere, 2022, 297: 134105. doi: 10.1016/j.chemosphere.2022.134105 [16] ZHOU X Y, LI H, LIU D Y, et al. Effects of toxin from Bacillus thuringiensis (Bt) on sorption of Pb (Ⅱ) in red and black soils: Equilibrium and kinetics aspects[J]. Journal of Hazardous Materials, 2018, 360: 172-181. doi: 10.1016/j.jhazmat.2018.07.114 [17] 任国艳, 孙贺, 樊金玲, 等. 荧光光谱法和分子对接模拟技术研究白藜芦醇与胃蛋白酶的相互作用[J]. 光谱学与光谱分析, 2019, 39(4): 1103-1108. REN G Y, SUN H, FAN J L, et al. Study on interaction between resveratrol and pepsin by fluorescence spectroscopy and molecular modeling[J]. Spectroscopy and Spectral Analysis, 2019, 39(4): 1103-1108 (in Chinese).
[18] 王军, 王周利, 程晶晶. 多光谱法结合分子对接研究柠檬黄与牛血清白蛋白的相互作用[J]. 光谱学与光谱分析, 2022, 42(3): 904-909. WANG J, WANG Z L, CHENG J J. Interaction between tartrazine and bovine serum albumin using multispectral method and molecular docking[J]. Spectroscopy and Spectral Analysis, 2022, 42(3): 904-909 (in Chinese).
[19] MOUNIER S, REDON R, NICOLODELLI G, et al. Front-face fluorescence spectroscopy of tryptophan and fluorescein using laser induced fluorescence and excitation emission matrix fluorescence[J]. RSC Advances, 2017, 7(88): 56117-56122. doi: 10.1039/C7RA08775F [20] JOYE I J, DAVIDOV-PARDO G, LUDESCHER R D, et al. Fluorescence quenching study of resveratrol binding to zein and gliadin: Towards a more rational approach to resveratrol encapsulation using water-insoluble proteins[J]. Food Chemistry, 2015, 185: 261-267. doi: 10.1016/j.foodchem.2015.03.128 [21] RAMAMURTHY K, PONNUSAMY K, CHELLAPPAN S. Excitation-resolved area-normalized emission spectroscopy: A rapid and simple steady-state technique for the analysis of heterogeneous fluorescence[J]. RSC Advances, 2020, 10(2): 998-1006. doi: 10.1039/C9RA10154C [22] KITTLE D S, VASEFI F, PATIL C G, et al. Real time optical biopsy: Time-resolved fluorescence spectroscopy instrumentation and validation[J]. Scientific Reports, 2016, 6: 38190. doi: 10.1038/srep38190 [23] XIAO C Q, LAI L, ZHANG L, et al. Spectroscopic and isothermal titration calorimetry studies of binding interactions between carbon nanodots and serum albumins[J]. Journal of Solution Chemistry, 2018, 47(9): 1438-1448. doi: 10.1007/s10953-018-0792-2 [24] RABBANI G, LEE E J, AHMAD K, et al. Binding of tolperisone hydrochloride with human serum albumin: Effects on the conformation, thermodynamics, and activity of HSA[J]. Molecular Pharmaceutics, 2018, 15(4): 1445-1456. doi: 10.1021/acs.molpharmaceut.7b00976 [25] 王晓霞, 聂智华, 马力通, 等. 多光谱法和分子对接模拟法研究美满霉素与牛血清白蛋白的相互作用[J]. 光谱学与光谱分析, 2020, 40(5): 1503-1508. WANG X X, NIE Z H, MA L T, et al. Study on the interaction between minocycline and bovine serum albumin by multi spectral method and molecular docking simulation[J]. Spectroscopy and Spectral Analysis, 2020, 40(5): 1503-1508 (in Chinese).
[26] 姜晓满, 文武, 俞盈. 结合高分辨质谱法、荧光光谱法及分子对接研究全氟化合物与白蛋白的相互作用[J]. 环境化学, 2020, 39(6): 1634-1641. doi: 10.7524/j.issn.0254-6108.2019041102 JIANG X M, WEN W, YU Y. Interactions of perfluorinated compounds with serum albumins by high resolution mass spectrometry, fluorescence spectroscopy and molecular docking[J]. Environmental Chemistry, 2020, 39(6): 1634-1641 (in Chinese). doi: 10.7524/j.issn.0254-6108.2019041102
[27] PANDA M, CHANDEL T I, KAMIL M, et al. Fluorescence quenching of chloroquine by Cu2+ in micelles[J]. Journal of Molecular Liquids, 2020, 306: 112763. doi: 10.1016/j.molliq.2020.112763 [28] XU L, HU Y X, LI Y C, et al. Study on the interaction of tussilagone with human serum albumin (HSA) by spectroscopic and molecular docking techniques[J]. Journal of Molecular Structure, 2017, 1149: 645-654. doi: 10.1016/j.molstruc.2017.08.039 [29] YU X Y, JIANG B F, LIAO Z X, et al. Study on the interaction between 21-(Ph-NN)-NCTPP and bovine serum albumin by spectroscopic techniques[J]. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy, 2015, 142: 260-265. doi: 10.1016/j.saa.2015.01.121 [30] BORDENAVE N, HAMAKER B R, FERRUZZI M G. Nature and consequences of non-covalent interactions between flavonoids and macronutrients in foods[J]. Food & Function, 2014, 5(1): 18-34. [31] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions: Forces contributing to stability[J]. Biochemistry, 1981, 20(11): 3096-3102. doi: 10.1021/bi00514a017 [32] CHEN Y S, ZHOU Y F, CHEN M, et al. Isorenieratene interaction with human serum albumin: Multi-spectroscopic analyses and docking simulation[J]. Food Chemistry, 2018, 258: 393-399. doi: 10.1016/j.foodchem.2018.02.105 [33] GHOSH K, RATHI S, ARORA D. Fluorescence spectral studies on interaction of fluorescent probes with Bovine Serum Albumin (BSA)[J]. Journal of Luminescence, 2016, 175: 135-140. doi: 10.1016/j.jlumin.2016.01.029 [34] GU H Y, SUN Y H, LIU S L, et al. A feasibility study of the rapid evaluation of oil oxidation using synchronous fluorescence spectroscopy[J]. Food Analytical Methods, 2018, 11(12): 3464-3470. doi: 10.1007/s12161-018-1315-x [35] WANG T H, YAN Y, LUO Y S. Determination of norfloxacin content using bovine serum albumin as a fluorescence probe by synchronous fluorescence spectroscopy[J]. Optik, 2017, 144: 393-396. doi: 10.1016/j.ijleo.2017.06.066 [36] 金丽虹, 王梦欣, 周雅静, 等. 光谱法及分子模拟研究青蒿素与小牛胸腺DNA的相互作用[J]. 发光学报, 2018, 39(12): 1765-1771. doi: 10.3788/fgxb20183912.1765 JIN L H, WANG M X, ZHOU Y J, et al. Binding interaction of artemisinin and DNA: Spectroscopic methodologies and molecular docking[J]. Chinese Journal of Luminescence, 2018, 39(12): 1765-1771 (in Chinese). doi: 10.3788/fgxb20183912.1765
[37] BHATT P, JOSHI T, BHATT K, et al. Binding interaction of glyphosate with glyphosate oxidoreductase and C-P lyase: Molecular docking and molecular dynamics simulation studies[J]. Journal of Hazardous Materials, 2021, 409: 124927. doi: 10.1016/j.jhazmat.2020.124927 -



 下载:
下载: