-
纳米银颗粒(silver nanoparticles, AgNPs)以其高导电率、强抗菌性以及小尺寸效应等特点,在生物医学、电子产品和日用品等领域得到了广泛应用[1]。特别是AgNPs对多种致病微生物具有强烈的抑制和杀灭作用,并且不易产生耐药性,在食品包装材料、服装、玩具等日用品中的应用量不断增加,导致进入污水和地表水体的数量也在上升。因此,AgNPs对水环境微生物活性的潜在影响引起了广泛关注。AgNPs的粒径、浓度等物理化学特性是决定其在水环境中的归趋和毒性的关键因素[2]。较小粒径的AgNPs展现出更强的毒性作用,这归因于小粒径AgNPs具有更大的比表面积,从而增强了其与生物分子相互作用的概率,易于穿透细胞膜进入生物体内,进而损害细胞功能[3]。有研究[4]表明,不同浓度的AgNPs对微生物的毒性不同,高浓度AgNPs对微生物有抑制作用,低浓度AgNPs对微生物没有明显抑制效应,甚至还有刺激作用。然而,AgNPs的抑菌性能还与其存在形态密切相关。AgNPs进入环境水体后因为氧化和溶解转化为各种形态的银(如Ag+、可溶AgNPs/Ag+复合物等)[5-7],AgNPs在水中的聚集、溶解和稳定性与AgNPs的抑菌活性密切相关[8-10],可能导致其抑菌效应降低甚至消失。NAVARRO等[11]发现AgNPs对莱茵衣藻光合作用的抑制效应主要源于AgNPs释放的Ag+;AgNPs对硝化细菌的毒性效应取决于AgNPs粒径和表面包被的化学性质、溶液中存在的Ag+配体种类[12-15];二价阳离子(Mg2+、Ca2+)会诱导AgNPs聚集,使AgNPs溶解释放的Ag+减少,并减弱AgNPs吸附到微生物表面的能力[9]。大量研究表明,水中化学成分的变化与水环境中AgNPs的反应活性、生物利用度和毒性差异等性能密切相关[16-17],但这些研究往往采用在模拟水样或培养液中加入AgNPs,缺少对环境水样包括污水中的研究,也未能充分考虑AgNPs在水样中的形态转变。因此,研究AgNPs在环境水样中的赋存形态对全面评价其对水生环境微生物的毒性效应非常重要。
在水生生态系统中,氮循环是维持生态平衡的关键过程,而氨氧化是氮循环中的限速步骤。这一步骤主要由氨氧化细菌完成,其在将氨氮转化为亚硝酸盐氮的过程中发挥着至关重要的作用[18]。在众多氨氧化细菌中,欧洲亚硝化单胞杆菌(Nitrosomonas europaea ATCC19718)是一种广泛存在于自然水体和污水处理系统中的氨氧化细菌,由于其具有对环境变化的敏感性和在氮循环中的功能,故成为研究AgNPs对氨氧化过程的理想菌株[19]。本研究以N.europaea为模式菌株,分别在景观湖湖水、校园生活污水、化工废水等水样及N.europaea培养液中外源添加AgNPs,对比研究了N.europaea氧化的NH4+-N性能,并探究水中离子强度和种类对AgNPs生物毒性的影响机制,可为全面评估AgNPs在地表水体的环境风险提供依据。
-
菌株N.europaea由东南大学能源与环境学院余冉教授课题组赠与。N.europaea为革兰氏阴性菌,细胞呈椭圆状或短杆状,利用NH4+-N进行化能自养代谢。
N.europaea培养液组成为:1.32 g·L−1硫酸铵、0.2 g·L−1七水合硫酸镁、0.02 g·L−1二水合氯化钙、0.087 g·L−1磷酸氢二钾、2.52 g·L−1N-2-羟乙基哌嗪-N’-3-丙磺酸、
0.0025 g·L−1酚红等,用20% KHCO3溶液调节pH至7.20。实验用水为超纯水(电阻率为18 MΩ·cm, Milli-Q, 美国)。 -
将100 mL N.europaea培养液装入250 mL锥形瓶中,在121 ℃、100 kPa下灭菌20 min(SQ810C,重庆雅马拓科技有限公司),冷却至室温待用。将保存于−80 ℃冰箱(FDE60086FV, Thermoscientific,美国)中的N.europaea接入灭菌后的培养液中,并置于28 ℃、145 r·min−1摇床(HYL-C3,太仓市强乐试验设备公司)避光培养72 h,保存于4 ℃冰箱,作为后续实验的N.europaea接种液。
-
AgNPs购自北京德科岛金科技有限公司,采用热熔胶法制备,AgNPs颗粒呈球形,平均粒径12 nm,表面包被聚乙烯吡咯烷酮(polyvinyl pyrrolidone, PVP),比表面积为42 m2·g−1,体积密度为1.01 g·cm−3。AgNO3和AgCl购自国药集团化学试剂有限公司,Ag2O和Ag2S购自上海麦克林生物科技有限公司,Ag2SO4和Ag2CO3购自美国西格玛公司。Ag试剂均为分析纯,AgNPs和各类Ag试剂均避光保存。
-
按照1.1配制N.europaea培养液,分装到250 mL锥形瓶中,每瓶装液量为100 mL,121 ℃、100 kPa下灭菌20 min,冷却至室温后,按5%接菌量接入1.2中的N.europaea。AgNPs、Ag+(以AgNO3为计)、Ag2SO4、Ag2CO3、Ag2S和Ag2O等不同形态Ag均通过无菌操作(用灭菌后的0.22 μm滤膜过滤不同形态的Ag溶液),并按照预实验设定的质量浓度梯度分别加入装有N.europaea的锥形瓶中,每个浓度设置3组重复,设置不添加任何形态Ag、仅接种N.europaea培养液为对照组即CK,在28 ℃、145 r·min−1条件下摇床振荡培养。根据预实验结果,AgNPs及不同形态Ag的质量浓度梯度分别为:10~
1000 μg·L−1 AgNPs;1~100 μg·L−1 Ag+;0.1~10 μg·L−1 Ag2SO4;0.1~100 μg·L−1 Ag2CO3;5~50 mg·L−1 Ag2S;0.1~50 μg·L−1 Ag2O及0.1~1000 μg·L−1 AgCl。AgNPs及不同形态银对N.europaea急性毒性的测试时间终点为120 h,测试指标为培养液中NH4+-N的转换率。对横坐标进行对数转换,以外源添加Ag质量浓度的lg值为横坐标,以NH4+-N的去除浓度作为纵坐标,采用Origin 2018在非线性拟合功能下选择函数dose resp分别进行拟合计算AgNPs、Ag+、Ag2SO4、Ag2CO3、Ag2S、Ag2O和AgCl对N.europaead的20%效应浓度(20% effect concentration, EC20)、50%效应浓度(50% effect concentration, EC50)和80%效应浓度(80% effect concentration, EC80)。 -
采用电感耦合等离子质谱仪(NexION 300, PerkinElmer, USA)检测N.europaea培养液、月牙湖水、校园生活污水、化工废水中的Ca2+、Mg2+、Na+、K+浓度;使用离子色谱仪(ICS-600,赛默飞世尔(上海)仪器有限公司)检测Cl−、SO42−、CO32−浓度。培养液和水样中离子强度根据式(1)计算[20]。
式中:I为离子强度;c为离子组分;z为离子价态。
-
将适量AgNPs分别加入50 mL超纯水、N.europaea培养液、月牙湖水、校园生活污水、化工废水中,AgNPs质量浓度为84.4 μg·L−1即AgNPs对N.europaea的EC80,避光保存5 d后,采用紫外分光光度计(Shimadzu, UV-1800, Japan)在300~600 nm内扫描不同水样的AgNPs吸收光谱。
-
采用Visual MINTEQ 3.0模型模拟计算不同离子强度水样(超纯水、N.europaea培养液、月牙湖水、校园生活污水、化工废水)中AgNPs可能的赋存形态,各水样中所含的离子浓度测试结果见表2。Visual MINTEQ 3.0模型的假设条件为:不考虑气相、氧化还原反应以及吸附反应,温度为25 ℃,pH=8。分别将EC20、EC50和EC80值设为模型中Ag+的输入总量。
-
选取氯化铵(NH4Cl)为外加氮源,根据水样初始NH4+-N浓度精确计算NH4Cl添加量来调节月牙湖水、校园生活污水、化工废水的NH4+-N含量与1.1 N.europaea培养液中NH4+-N质量浓度相同。在250 mL锥形瓶中分别装入100 mL的N.europae培养液、月牙湖湖水、校园生活污水、化工废水,在121 ℃、100 kPa下灭菌20 min,冷却至室温。在各锥形瓶中按5%接菌量接入1.2中N.europaea,并分别加入对N.europaea活性有不同影响的AgNPs,即锥形瓶中AgNPs质量浓度分别为EC20、EC50和EC80。每个浓度设置3组重复,为每种水样设置不添加AgNPs的空白对照组(CK),评估水样对N.europaea活性的影响。28 ℃、145 r·min−1条件下,摇床振荡培养120 h ,每隔24 h取2 mL水样,水样过0.45 μm滤膜(MCE Syringe Filter,ASD)后,采用可见-紫外分光光度计测定NH4+-N、NO2−-N和NO3−-N浓度,其中NH4+-N测定采用纳氏试剂分光光度法(HJ 535-2009);NO2−-N测定采用N-(1-萘)-乙二胺光度法(GB
7493 -87);NO3−-N测定采用紫外分光光度法(HJ/T 346-2007)。 -
采用Microsoft Excel 2016分析实验数据,数据用平均值±标准误差(Mean±SE)表示;采用SPSS Statistics 25软件对实验数据进行单因素方差分析并检验显著性,P<0.05代表处理间存在显著性差异;采用Origin 2018软件绘图。
-
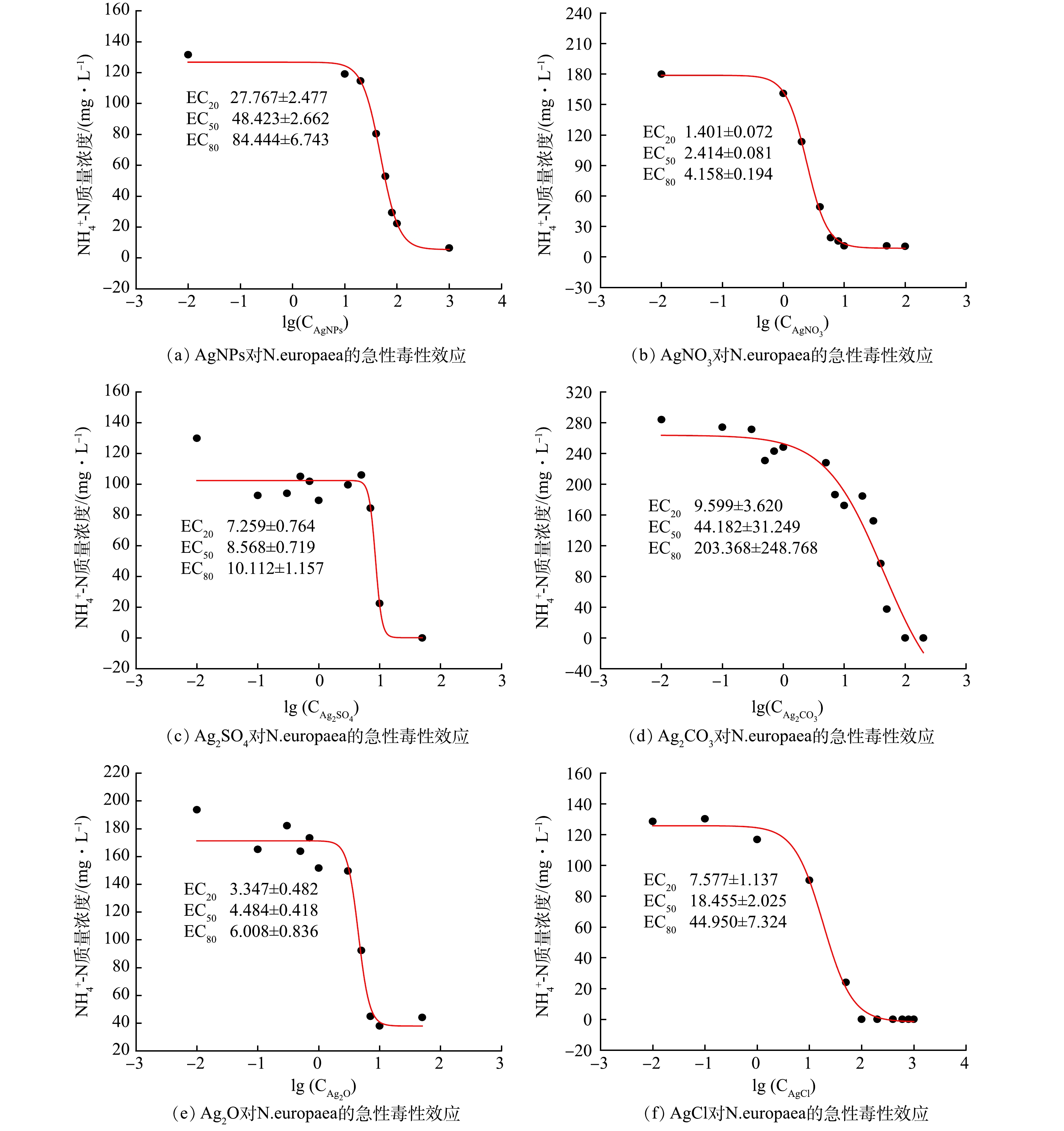
除Ag2S外,AgNPs、Ag+、Ag2SO4、Ag2CO3、Ag2O和AgCl对N.europaea的急性毒性实验结果见图1。以上含银化合物均为AgNPs在水中可能的赋存形态。除Ag2S外,不同形态的银对N.europaea活性均有抑制效应,但抑制程度因形态而不同。AgNPs对N.europaea氧化NH4+-N有影响的EC20、EC50和EC80分别为(27.77±2.48)、(48.42±2.66)、(84.44±6.74) μg·L−1,这些浓度接近国内外报道的污水中AgNPs浓度[21]。Ag+对N.europaea氧化NH4+-N有影响的EC20、EC50和EC80分别为(1.40±0.07)、(2.41±0.08)、(4.16±0.19) μg·L−1。同样剂量下,Ag+对N.europaea的生物毒性比AgNPs强,Ag+生物毒性更高的原因是其具有更高的生物利用度和吸收潜力[22]。
Ag2SO4、Ag2CO3、Ag2O和AgCl对N.europaea的毒性效应依次为Ag2O>Ag2SO4>AgCl>Ag2CO3,Ag2S对N.europaea没有表现出毒性效应,故未参与计算。这可能是由于Ag2SO4、Ag2CO3、Ag2O、AgCl和Ag2S的沉淀平衡常数pKsp分别为4.84、11.09、7.72、9.75和49.20[23-24],而pKsp越高,该沉淀物越稳定,因此,水中存在S2−且生成稳定的Ag2S通常被认为是AgNPs抑菌效应消失的重要途径[25]。有研究[26]表明,Ag2SO4的溶解度高于AgNPs,故更易使细菌细胞受损,这与本研究结果一致:Ag2SO4严重抑制N.europaea的活性。CO32−是N.europaea可利用的碳源,能促进其生长,因此Ag2CO3对N.europaea的生物毒性较弱。
-
表1为超纯水、N.europaea培养液和月牙湖水、校园生活污水和化工废水的离子组分以及根据各离子组分浓度计算出的离子强度。其中N.europaea培养液的离子强度为26.17 mmol·L−1,生活污水的离子强度高达45.78 mmol·L−1,约为培养液的1.7倍,其Ca2+含量为8.42 mmol·L−1,也远高于其他水样,而月牙湖水和N.europaea培养液的离子强度几乎相同,均低于生活污水和化工废水,化工废水的离子强度为31.42 mmol·L−1,Cl−含量极高,是生活污水的4倍左右,Na+含量达到6.16 mmol·L−1,这符合化工废水高盐度,氯盐含量往往超标的特点[27]。
-
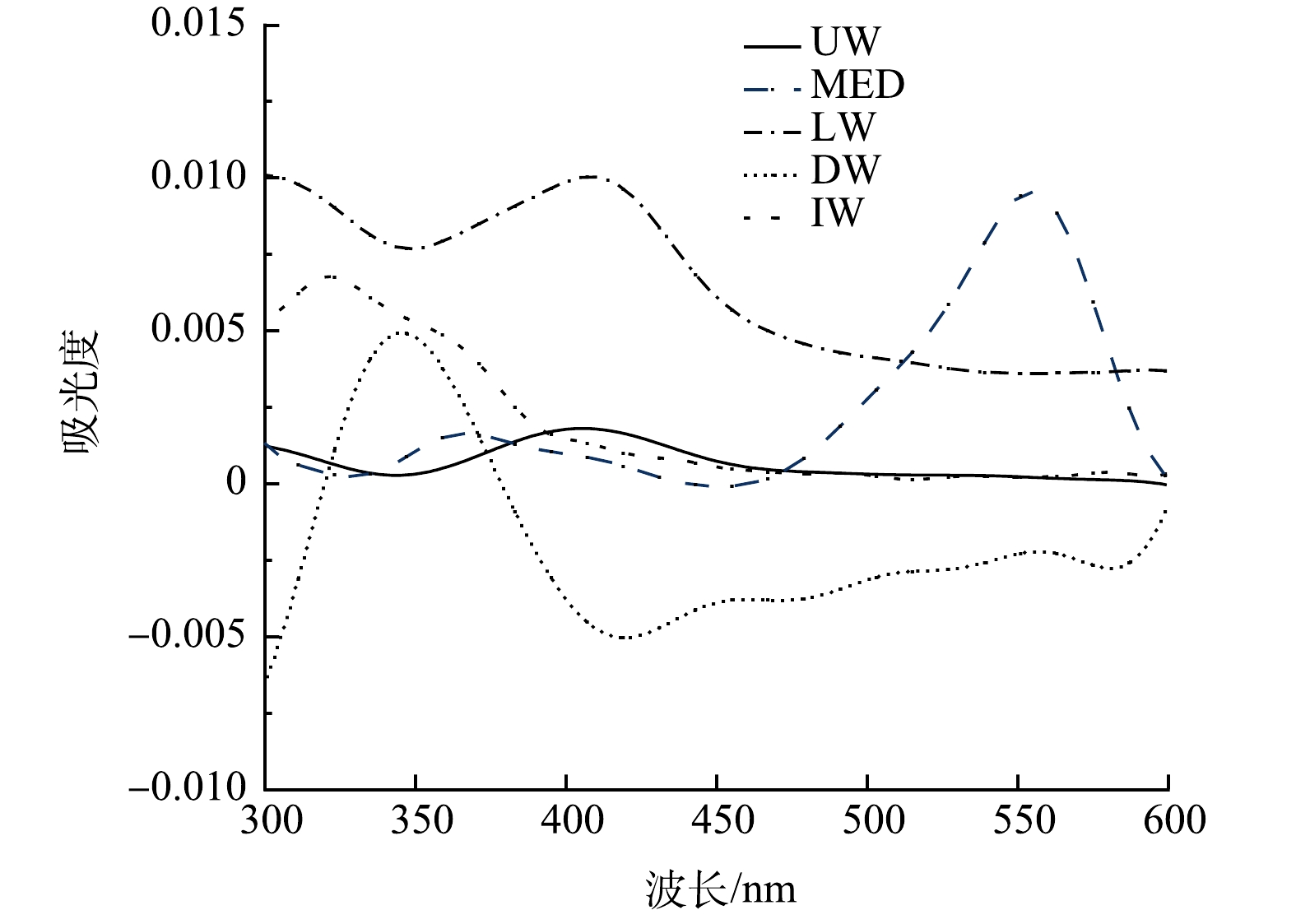
由于量子尺寸效应,纳米粒子具有独特的、由粒子尺寸和形状决定的非线性光学效应。AgNPs在水样中的紫外可见特征吸收光谱是衡量其化学形态和粒径的重要参考[28]。在不同离子强度的环境水样中AgNPs存在形态可能发生变化,从而导致其对N.europae不同的生物毒性效应。AgNPs在超纯水(以UW表示)、N.europaea培养液(以MED表示)、月牙湖水(以LW表示)、校园生活污水(以DW表示)、化工污水(以IW表示)中的紫外可见吸收光谱如图2所示。超纯水中AgNPs的特征吸收峰出现在402 nm,AgNPs在N.europae培养液、月牙湖水、生活污水、化工废水中的特征吸收峰分别出现在561、412、355、309 nm。与超纯水相比,AgNPs在N.europaea培养液和月牙湖水的特征吸收峰向长波长方向移动,发生红移;在校园生活污水和化工废水中的AgNPs特征吸收峰向短波长方向移动。这是由于AgNPs的粒径分布与离子强度有关,随着离子强度的增大,小粒径AgNPs的颗粒数目增加[29-30],也与杨亚宁[31]等认为AgNPs在高离子强度溶液中会出现蓝移现象的结果一致。由表1可知N.europaea培养液和月牙湖水的离子强度低于生活污水和化工废水,但与超纯水相比,培养液中含有较高浓度的SO42−、PO4−以及月牙湖水中含有的Cl−、CO32−等离子,可能中和AgNPs表面的电荷,减少AgNPs间的静电排斥力,促进水样中的AgNPs发生团聚,导致吸收峰红移[32]。
-
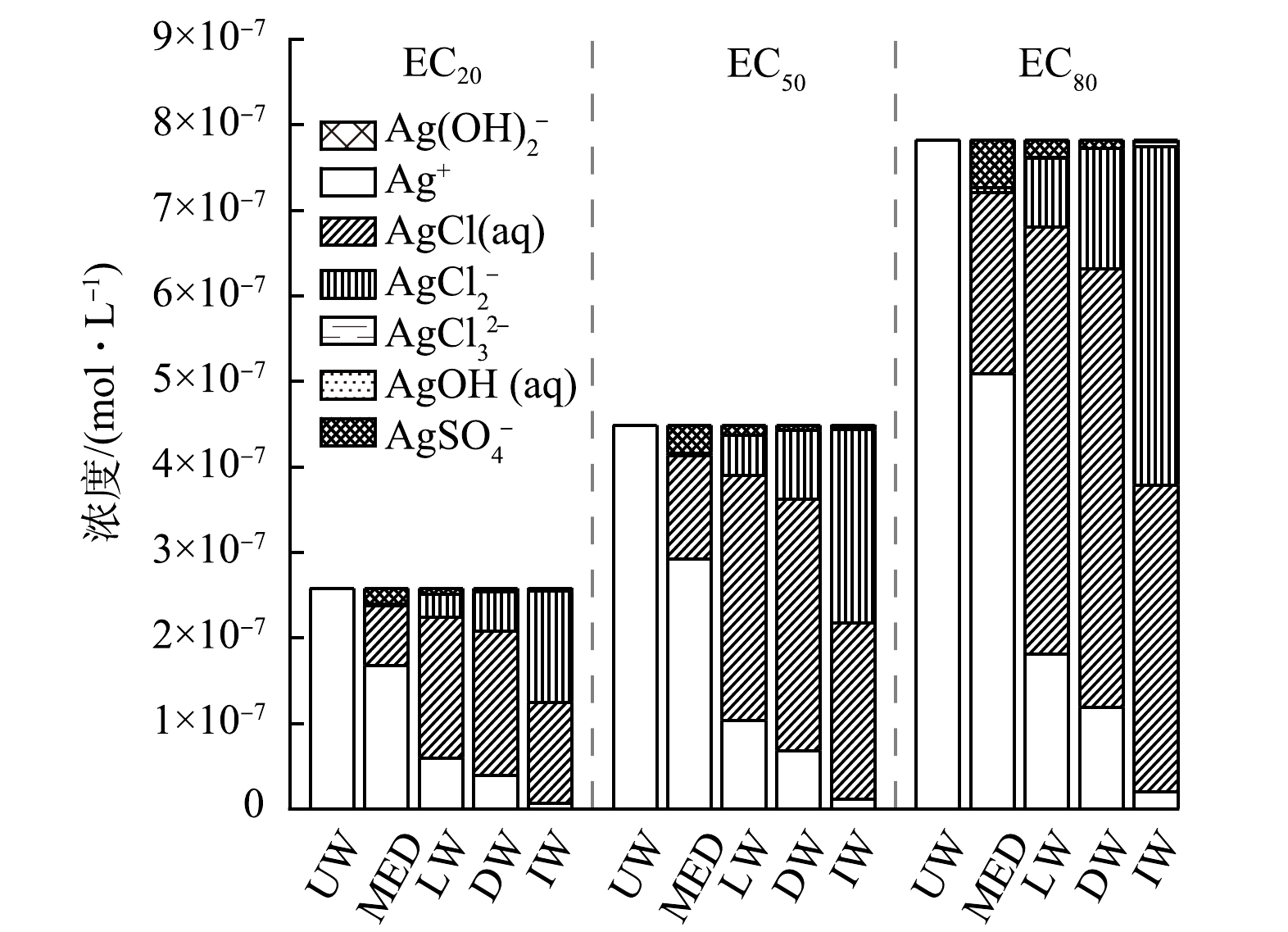
Visual MINTEQ以化学平衡常数和热力学数据如吉布斯自由能等预测化学反应变化,并以质量函数研究物质的形态和分布[33]。利用Visual MINTEQ模型分析AgNPs在不同离子强度水样(超纯水UW、N.europaea培养液MED、月牙湖水LW、校园生活污水DW、化工废水IW)中的化学形态分布,结果见图3。除超纯水外,4种水样中银的主要形态类型相同,均含有Ag+、AgCl(aq)、AgCl2−、AgCl32−、AgSO4−等离子形态,这是由于AgNPs是活泼金属单质,极易氧化溶解释放出Ag+,与水中阴离子结合,形成不同的银赋存状态[34]。但在不同水样中的分布比例不同,N.europae培养液中Ag+占比最高,而化工废水中AgCl2−和AgCl(aq)的比例较高,且含有少量AgCl32−。生活污水和月牙湖湖水中都含有较多的AgCl(aq),但生活污水中AgSO4−的浓度低于月牙湖水,这与BAALOUSHA等[35]研究一致,没有观察到硫酸盐(SO42−)的特定离子效应。
水化学性质的变化强烈影响AgNPs的物理和化学特性,导致其在环境水体中团聚、溶解或稳定[8, 10, 12, 36-38],水中离子如Cl−、SO42−、NO3−、Ca2+等会显著影响AgNPs的聚集和赋存状态[8, 10, 36-37, 39],并进而影响其抑菌性能。化工废水中Cl−浓度约是N.europae培养液的44倍,研究表明Cl−可能导致AgCl0(s)壳层的形成以及AgNPs之间的桥接,因而减少AgNPs有效表面积并显著改变其表面特性[37]。但也有研究指出Cl−和AgNPs的相互作用复杂,体系中的Cl/Ag比率(总Cl浓度/总Ag浓度)不同,可能会形成可溶性和不溶性Ag-Cl物质[40]。
-
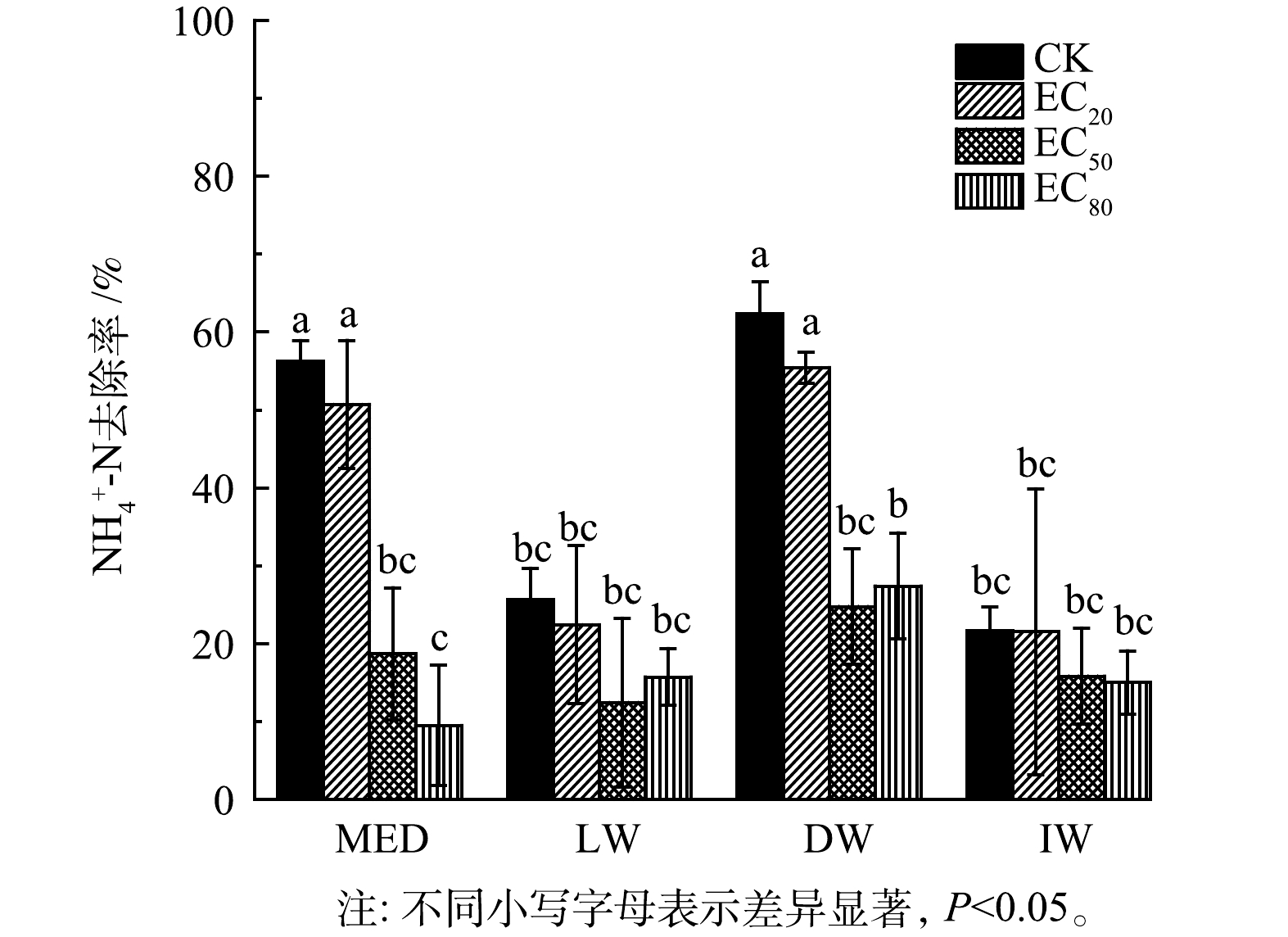
分别在N.europaea培养液、月牙湖湖水、校园生活污水、化工废水中加入相当EC20、EC50、EC80值的AgNPs,各水样中NH4+-N去除率见图4。在CK组中,月牙湖湖水和化工废水水质对N.europaea活性影响较大,N.europaea对NH4+-N去除率分别为25.66%和21.66%,显著低于培养液(56.31%)和校园生活污水(62.36%)中对NH4+-N的去除率(P<0.05)。N.europaea培养液组分有利于菌株生长和保持活性,校园生活污水中Cl−、Na+浓度远低于化工废水,因此,N.europaea培养液和校园生活污水对N.europaea活性的影响较小。
与CK组相比,在培养液和校园生活污水中分别添加EC50、EC80的AgNPs导致N.europae对NH4+-N去除率显著降低(P<0.05);在月牙湖水和化工废水中,随着添加AgNPs浓度的增加,NH4+-N去除率也呈降低趋势但无显著差异(P>0.05)。外源添加的AgNPs浓度越高,释放的Ag+越多,增强了其对氨氧化细菌N.europaea活性的抑制[11],但其释放的Ag+可能与水中的离子结合,形成不同形态的银,从而表现出AgNPs对N.europaea的剂量效应与水质相关。由表1可知,校园生活污水的离子强度最高,高离子强度溶液中,AgNPs的粒径较小,比表面积大,AgNPs生物毒性可能升高,但另一方面,生活污水中Ca2+、Mg2+含量高,二价阳离子可与AgNPs表面的吸附位点发生竞争,从而减少AgNPs表面的活性位点,这种竞争吸附减少了AgNPs与水中的溶解氧或其他氧化剂接触的机会,降低了AgNPs氧化溶解过程的发生,可以降低其生物毒性[41-42]。月牙湖水中的AgNPs导致N.europaea对NH4+-N去除率降低,这可能与水中较高的SO42−浓度有关。研究表明向AgNPs溶液中添加MgSO4,观察到AgNPs对P.chrysosporium活性抑制作用增强[41],研究者认为SO42−通过静电屏蔽作用防止AgNPs聚集,从而导致其抑菌性能增强。化工废水的离子强度高于N.europae培养液,但该化工废水中的Cl−含量为12.56 mmol·L−1。在该化工废水中分别添加EC50、EC80的AgNPs,与CK相比,其对NH4+-N去除率呈降低趋势,但无显著性差异。基于Visual MINTEQ模型的计算结果,在较高Cl/Ag比率下,AgClx1-x可溶性物质在不溶性AgCl中占主导地位,从而导致更高的AgNPs溶解速率[43],这增强了Ag+的生物可利用性,并因此提升其毒性效应,导致N.europaea对NH4+-N的氧化性能下降。
-
1)急性毒性实验结果表明,同样剂量下,Ag+、Ag2SO4、Ag2CO3、Ag2O和AgCl对N.europaea的生物毒性均强于AgNPs,Ag2S对N.europaea没有毒性抑制现象。
2)AgNPs的粒径分布与离子强度有关,随着离子强度的增大,小粒径AgNPs的颗粒数目有所增加。与超纯水相比,AgNPs在N.europaea培养液和月牙湖水的特征吸收峰向长波方向移动,而在校园生活污水和化工废水中的AgNPs特征吸收峰出现蓝移现象。
3)外源AgNPs在水体中的赋存形态受其离子组分及离子强度影响。4种水样中Ag的主要赋存形态类型相同,但在不同水样中各形态所占比例不同。N.europae培养液中Ag+占比最高,化工废水中AgCl2−和AgCl(aq)的比例较高,且含有少量AgCl32−,生活污水和月牙湖水都含有较多AgCl(aq),但生活污水中AgSO4−的比例低于月牙湖水。
4)随着水样中外源添加AgNPs浓度的增加,培养液和校园生活污水中AgNPs对N.europaea活性的抑制呈现剂量效应。月牙湖水中的SO42−以及化工废水中高浓度的Cl−与AgNPs相互作用,对N.europaea的活性有抑制效应。环境水体中AgNPs的毒性效应需要考虑水中共存离子种类和强度的影响。
离子强度对外源纳米银形态转化和氨氧化细菌Nitrosomonas europaea活性的影响
Effect of ionic strength on the form transformation of exogenous silver nanoparticles and the activity of ammonia-oxidizing bacteria Nitrosomonas europaea
-
摘要: 以氨氧化细菌—欧洲亚硝化单胞杆菌(Nitrosomonas europaea)为模式菌株,研究纳米银(silver nanoparticles,AgNPs)在不同离子强度水样中的赋存形态及对N.europaea氧化NH4+-N性能的影响。在N. europaea培养液、月牙湖水、生活污水、化工废水4种水样中分别添加AgNPs及不同形态Ag化合物,测试其对N.europaea的急性毒性,得到AgNPs及不同形态银对N.europaea的毒性效应浓度EC20、EC50和EC80。采用紫外可见吸收光谱法分析AgNPs在不同离子强度水样中的粒径变化。利用Visual MINTEQ模型预测AgNPs在4种水样中的主要化学形态分布,发现水样的离子组分及离子强度显著影响AgNPs的聚集和Ag的赋存状态。在4种水样中分别添加不同浓度(EC20、EC50和EC80)的AgNPs,探究不同离子强度水样中的AgNPs对N.europaea活性的影响,结果表明随着水样中外源添加AgNPs浓度的增加,N.europaea氧化NH4+-N的效率降低,特别在培养液和校园生活污水中,呈现较明显的剂量效应;但在月牙湖水和化工废水中,由于其含有高浓度SO42−、Cl−等离子组分,影响AgNPs对N.europaea的毒性效应。评价AgNPs在环境水体或污水中的生物毒性,应考虑水中离子组成和离子强度对其毒性的影响。Abstract: With the ammonia-oxidizing bacterium Nitrosomonas europaea as a model strain, the study investigated the chemical transformation of silver nanoparticles (AgNPs) in water samples with varying ionic strengths and their impact on the ammonia oxidation ability of N.europaea. Initially, AgNPs and various silver compounds were added into the culture medium of N.europaea, as well as water samples from Yueya Lake, domestic sewage, and chemical wastewater, respectively, to assess their acute toxicity towards N.europaea. The toxic effect concentrations, namely EC20, EC50 and EC80 of AgNPs and different forms of silver compounds on N.europaea were determined. The particle size of AgNPs in water samples with different ionic strengths was analyzed using UV-vis absorption spectroscopy. The Visual MINTEQ model was used to predict the distribution of the main chemical forms of AgNPs in four water samples, it was found that the ion composition and ion strength of the water samples significantly affected the distribution of different forms of silver compounds in the water samples. Different concentrations of AgNPs (EC20, EC50, and EC80) were added to four different water samples to investigate the effect of AgNPs on the activity of N.europaea in water samples under different ionic strengths. The results showed that as the concentration of AgNPs added externally to the water samples increased, the efficiency of N.europaea oxidation of NH4+-N decreased, especially in the culture medium and domestic sewage, showing a significant dose effect; However, in the Yueya Lake water and chemical wastewater, due to the high concentration of SO42− and Cl−, the toxic effects of AgNPs on N.europaea were alleviated. To evaluate the biological toxicity of AgNPs in environmental water bodies or sewage, the influence of ion composition and ion strength in water on their toxicity should be considered.
-
Key words:
- silver nanoparticles /
- Nitrosomonas europaea /
- speciation /
- toxic effect /
- ammoximation
-

-
表 1 超纯水、培养液、月牙湖水、生活污水和化工废水中的离子组分和离子强度
Table 1. Ionic composition and ionic strength in UW, MED, LW, DW and IW mmol·L−1
溶液 离子强度 Cl− Ca2+ Mg2+ Na+ K+ SO42− CO32− 超纯水 — — — — — — — — N.europae
培养液26.17 0.28 0.13 0.76 0.03 5.27 10.80 — 月牙湖水 27.87 1.87 1.20 0.39 0.80 0.11 11.40 0.25 生活污水 45.78 3.15 8.42 0.90 2.23 0.98 11.61 0.37 化工废水 31.42 12.56 0.21 0.01 6.16 0.03 10.80 — -
[1] GITHALA C K, TRIVEDI R. Review on synthesis method, biomolecules involved, size affecting factors and potential applications of silver nanoparticles[J]. Biocatalysis and Agricultural Biotechnology, 2023, 54: 102912. doi: 10.1016/j.bcab.2023.102912 [2] BANU A N, KUDESIA N, RAUT A M, et al. Toxicity, bioaccumulation, and transformation of silver nanoparticles in aqua biota: A review[J]. Environmental Chemistry Letters, 2021, 19(6): 4275-4296. doi: 10.1007/s10311-021-01304-w [3] LEE W S, KIM E, CHO H J, et al. The Relationship between Dissolution Behavior and the Toxicity of Silver Nanoparticles on Zebrafish Embryos in Different Ionic Environments[J]. Nanomaterials, 2018, 8(9): 10. [4] GUO Z, ZENG G M, CUI K P, et al. Toxicity of environmental nanosilver: mechanism and assessment[J]. Environmental Chemistry Letters, 2019, 17(1): 319-333. doi: 10.1007/s10311-018-0800-1 [5] GUO Z, CHEN G, ZENG G, et al. Are silver nanoparticles always toxic in the presence of environmental anions?[J]. Chemosphere, 2017, 171: 318-323. doi: 10.1016/j.chemosphere.2016.12.077 [6] XIU Z M, ZHANG Q B, PUPPALA H L, et al. Negligible Particle-Specific Antibacterial Activity of Silver Nanoparticles[J]. Nano Letters, 2012, 12(8): 4271-4275. doi: 10.1021/nl301934w [7] ZUO Y, CHEN G, ZENG G, et al. Transport, fate, and stimulating impact of silver nanoparticles on the removal of Cd(II) by Phanerochaete chrysosporium in aqueous solutions[J]. Journal of Hazardous Materials, 2015, 285: 236-244. doi: 10.1016/j.jhazmat.2014.12.003 [8] DEONARINE A, LAU B L T, AIKEN G R, et al. Effects of Humic Substances on Precipitation and Aggregation of Zinc Sulfide Nanoparticles[J]. Environmental Science & Technology, 2011, 45(8): 3217-3223. [9] JIN X, XUE X. Computational fluid dynamics analysis of solid oxide electrolysis cells with delaminations[J]. International Journal of Hydrogen Energy, 2010, 35(14): 7321-7328. doi: 10.1016/j.ijhydene.2010.04.158 [10] TEJAMAYA M, RöMER I, MERRIFIELD R C, et al. Stability of Citrate, PVP, and PEG Coated Silver Nanoparticles in Ecotoxicology Media[J]. Environmental Science & Technology, 2012, 46(13): 7011-7017. [11] NAVARRO E, PICCAPIETRA F, WAGNER B, et al. Toxicity of silver nanoparticles to chlamydomonas reinhardtii[J]. Environmental Science & Technology, 2008, 42(23): 8959-8964. [12] ARNAOUT C L, GUNSCH C K. Impacts of Silver Nanoparticle Coating on the Nitrification Potential of Nitrosomonas europaea[J]. Environmental Science & Technology, 2012, 46(10): 5387-5395. [13] MARAMBIO-JONES C, HOEK E M V. A review of the antibacterial effects of silver nanomaterials and potential implications for human health and the environment[J]. Journal of Nanoparticle Research, 2010, 12(5): 1531-1551. doi: 10.1007/s11051-010-9900-y [14] MUMPER C K, OSTERMEYER A K, SEMPRINI L, et al. Influence of ammonia on silver nanoparticle dissolution and toxicity to Nitrosomonas europaea[J]. Chemosphere, 2013, 93(10): 2493-2498. doi: 10.1016/j.chemosphere.2013.08.098 [15] RADNIECKI T S, STANKUS D P, NEIGH A, et al. Influence of liberated silver from silver nanoparticles on nitrification inhibition of Nitrosomonas europaea[J]. Chemosphere, 2011, 85(1): 43-49. doi: 10.1016/j.chemosphere.2011.06.039 [16] LI M H, POKHREL S, JIN X, et al. Stability, bioavailability, and bacterial toxicity of ZnO and iron-doped ZnO nanoparticles in aquatic media[J]. Environmental Science & Technology, 2011, 45(2): 755-761. [17] LIU X, JIN X, CAO B, et al. Bactericidal activity of silver nanoparticles in environmentally relevant freshwater matrices: Influences of organic matter and chelating agent[J]. Journal of Environmental Chemical Engineering, 2014, 2(1): 525-531. doi: 10.1016/j.jece.2013.10.008 [18] 罗晴, 甄毓, 彭宗波, 等. 三亚河红树林表层沉积物中好氧氨氧化微生物的分布特征及潜在硝化速率[J]. 环境科学, 2020, 41(8): 3787-3796. [19] HUIJIE L, ULANOV A V, MASARU N, et al. Global metabolomic responses of Nitrosomonas europaea 19718 to cold stress and altered ammonia feeding patterns[J]. Applied microbiology and biotechnology, 2020, 100(4): 1843-1852. [20] 周慧, 王中慧, 晋卫军. 分析化学教材中关于离子活度系数计算公式的讨论[J]. 化学教育(中英文), 2022, 43: 82-85. [21] JOHNSON A C, JüRGENS M D, LAWLOR A J, et al. Particulate and colloidal silver in sewage effluent and sludge discharged from British wastewater treatment plants[J]. Chemosphere, 2014, 112: 49-55. doi: 10.1016/j.chemosphere.2014.03.039 [22] XIU Z M, MA J, ALVAREZ P J J. Differential effect of common ligands and molecular oxygen on antimicrobial activity of silver nanoparticles versus silver ions[J]. Environmental Science & Technology, 2011, 45(20): 9003-9008. [23] 李玉萍, 盛玉敏. 微库仑法测定原油盐含量影响因素探讨[J]. 河南化工, 2014, 31: 52-56. [24] 王小锋, 嵇黎茜, 陈昌云, 等. 基于电化学方法测定沉淀溶解平衡常数的实验探究[J]. 南京晓庄学院学报, 2017, 33: 43-46. [25] LEVARD C, REINSCH B C, MICHEL F M, et al. Sulfidation processes of PVP-coated silver nanoparticles in aqueous solution: Impact on dissolution rate[J]. Environmental Science & Technology, 2011, 45(12): 5260-5266. [26] BEDDOW J, STOLPE B, COLE P, et al. Effects of engineered silver nanoparticles on the growth and activity of ecologically important microbes[J]. Environmental Microbiology Reports, 2014, 6(5): 448-458. doi: 10.1111/1758-2229.12147 [27] 徐忠强. 化工废水治理研究及应用现状[J]. 炼油与化工, 2023, 34: 9-12. [28] 庄爱娟. 纳米银溶胶的制备及其性能研究[D]. 青岛: 青岛科技大学, 2011. [29] 林辰昕, 缪爱军. 银纳米颗粒在秀丽隐杆线虫体内的累积及毒性效应研究进展[J]. 南京大学学报(自然科学), 2023, 59: 722-730. [30] 张朝涛, 王春慧, 李雪, 等. 酶提取-单颗粒电感耦合等离子质谱法分析樱桃番茄纳米银颗粒及其吸收规律研究[J]. 中国无机分析化学, 2023, 13: 1271-1281. doi: 10.3969/j.issn.2095-1035.2023.12.001 [31] 杨亚宁. 环境中离子强度对纳米银物化特性及其毒理学效应的影响[D]. 合肥: 中国科学技术大学, 2019. [32] 张甲赓. 不同水质条件中纳米银对大型溞的急性毒性效应及其影响机理[D]. 徐州: 中国矿业大学, 2023. [33] 苗芳芳. 基于形态模拟的污染场地重金属溯源风险评价方法研究与应用[D]. 北京: 华北电力大学, 2022. [34] 卢雪蓉, 冯晓丽, 刘朝莹, 等. 纳米银的迁移转化对环境微生物毒性的影响[J]. 生态毒理学报, 2018, 13: 9. doi: 10.7524/AJE.1673-5897.20180615003 [35] BAALOUSHA M, NUR Y, RöMER I, et al. Effect of monovalent and divalent cations, anions and fulvic acid on aggregation of citrate-coated silver nanoparticles[J]. Science of the Total Environment, 2013, 454-455: 119-131. doi: 10.1016/j.scitotenv.2013.02.093 [36] CUMBERLAND S A, LEAD J R. Particle size distributions of silver nanoparticles at environmentally relevant conditions[J]. Journal of Chromatography A, 2009, 1216(52): 9099-9105. doi: 10.1016/j.chroma.2009.07.021 [37] LI X A, LENHART J J, WALKER H W. Dissolution-Accompanied Aggregation Kinetics of Silver Nanoparticles[J]. Langmuir, 2010, 26(22): 16690-16698. doi: 10.1021/la101768n [38] NOWACK B, BUCHELI T D. Occurrence, behavior and effects of nanoparticles in the environment[J]. Environmental Pollution, 2007, 150(1): 5-22. doi: 10.1016/j.envpol.2007.06.006 [39] LEVARD C, HOTZE E M, LOWRY G V, et al. Environmental Transformations of Silver Nanoparticles: Impact on Stability and Toxicity[J]. Environmental Science & Technology, 2012, 46(13): 6900-6914. [40] LEVARD C, MITRA S, YANG T, et al. Effect of Chloride on the Dissolution Rate of Silver Nanoparticles and Toxicity to E. coli[J]. Environmental Science & Technology, 2013, 47(11): 5738-5745. [41] HUANG Z Z, ZENG Z T, SONG Z X, et al. Antimicrobial efficacy and mechanisms of silver nanoparticles against Phanerochaete chrysosporium in the presence of common electrolytes and humic acid[J]. Journal of Hazardous Materials, 2020, 383: 10. [42] ANDERSON J W, SEMPRINI L, RADNIECKI T S. Influence of water hardness on silver ion and silver nanoparticle fate and toxicity toward Nitrosomonas europaea[J]. Environmental Engineering Science, 2014, 31(7): 403-409. doi: 10.1089/ees.2013.0426 [43] LI Y, ZHAO J, SHANG E X, et al. Effects of chloride ions on dissolution, ROS generation, and toxicity of silver nanoparticles under UV irradiation[J]. Environmental Science & Technology, 2018, 52(8): 4842-4849. -



 下载:
下载: