-
为减少外部营养输入,缓解水体的富营养化问题,污水处理厂(water treatment plant, WWTP)氮排放标准日益严格 [1-2]。而常规生物处理工艺出水中的TN质量浓度较高,通常在10~20 mg·L−1。并且在实际运行中,由于污水厂进水普遍存在碳氮比低的问题,反硝化能力差,导致其二级出水的硝态氮浓度往往较高[3-4]。在这种情况下,需考虑进一步消减WWTP二级出水中的硝态氮含量,以满足污染物排放标准和水环境质量改善的需求。
WWTP二级出水中碳源消耗殆尽,采用异养反硝化方法深度脱氮需额外补充碳源,存在运行成本高、管理难度大以及二次污染风险高等问题[5]。自养反硝化则是对高氮低碳污水进行深度脱氮的一种绿色替代方法,可同步实现减污降碳的目标,并避免二次污染的发生[6]。由于硫单质价格低廉、易于应用,硫自养反硝化体系受到了研究人员的广泛关注,但目前多是以硫颗粒构建固定床反应器,颗粒较小的比表面积导致其处理负荷低下。若能采用粉态硫单质与膜分离技术耦合,则在防止硫元素流失的同时,还有望提高硫自养反硝化体系的传质效率,进而强化其脱氮能力[7-8]。另外,膜的截留作用也可将生长速度相当缓慢的自养反硝化菌保持在反应器内而不被冲脱,形成高效的膜生物反应器(membrane bioreactor, MBR)系统[9]。而在MBR系统中,水力停留时间(hydraulic retention time, HRT)和膜通量是2个关键运行参数,会对除污染效能和膜污染产生重要影响。
基于此,本研究面向WWTP二级出水的深度脱氮构建了粉态硫自养反硝化膜生物反应器 (powder sulfur autotrophic denitrification membrane bioreactor, p-SMBR) 系统,系统研究了反应器HRT对硫自养反硝化效率与混合液微生物胞外聚合物(extracellular polymeric substances, EPS)特性的影响,评估了运行通量对跨膜压(transmembrane pressure, TMP)增长趋势与膜污染阻力分布的影响,并从微生物群落结构组成角度进行了机理分析。研究成果可为p-SMBR深度脱氮系统的构建与优化调控提供借鉴与参考。
-
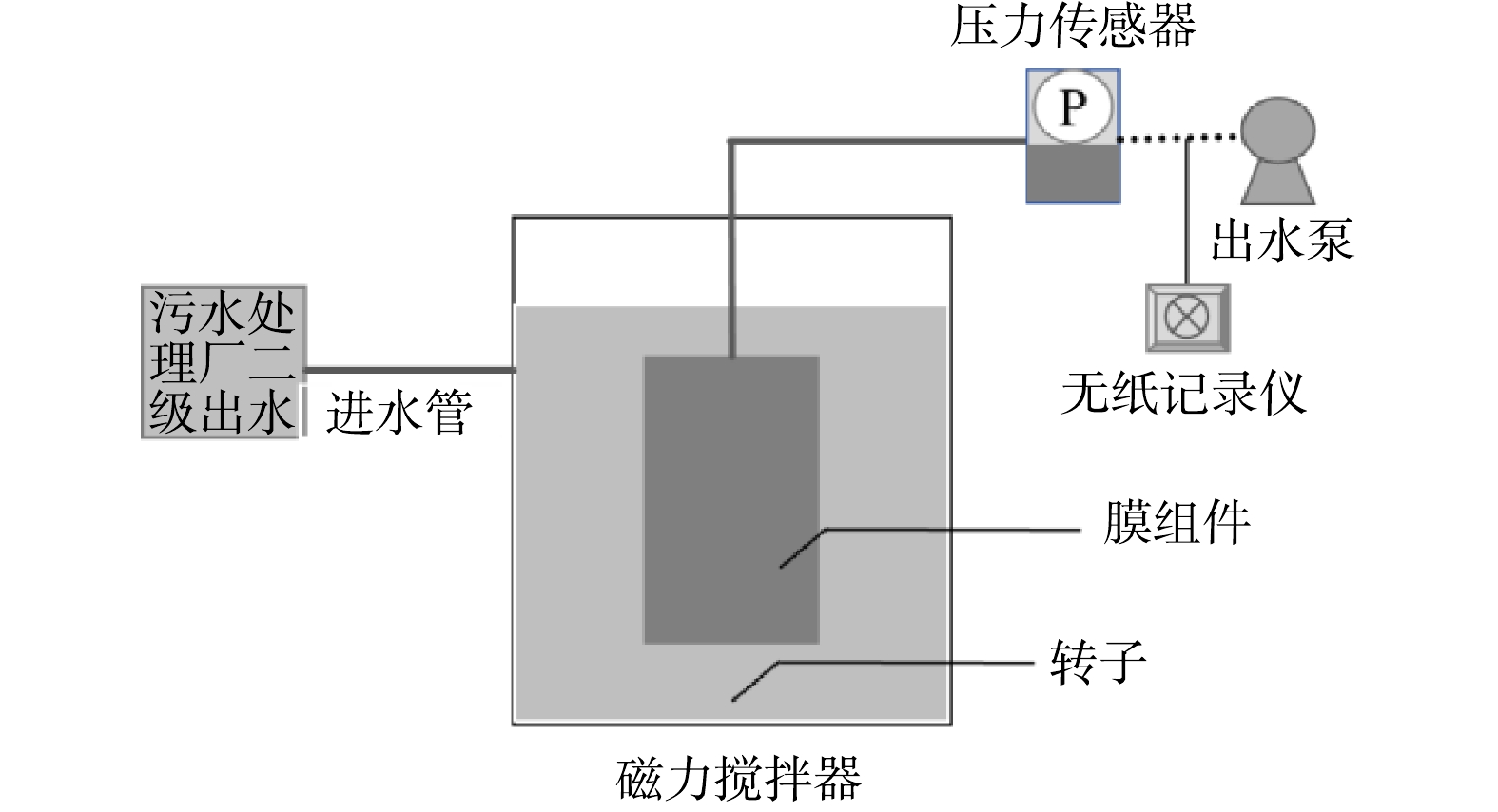
如图1所示,在厌氧条件下,同时并联运行3个由有机玻璃制成的粉态硫自养反硝化膜生物反应器(p-SMBR)进行长期的连续流实验,每个p-SMBR的总体积和有效体积分别为1.15 L和0.8 L。膜采用实验室自制的6.8 cm×7.4 cm×0.5 cm平板双面陶瓷膜(总面积为0.01 m2),该陶瓷膜材质为白刚玉,平均孔径约为0.6 µm,其制备方法与性能在文献中进行了详细叙述[10]。将陶瓷膜完全浸没在p-SMBR中,通过高位水箱将合成进水注入反应器,合成废水组成:自来水,20 L;KNO3,0.145 g·L−1;KH2PO4,0.006 6 g·L−1;NaHCO3,0.3 g·L−1;微量元素,20 mL,微量元素溶液是通过将以下化合物溶解在溶液中制备(每升):FeCl3·6H2O,1.5 g·L−1;CuSO4·5H2O,0.3 g·L−1;MnSO4,0.3 g·L−1;CoCl2·6H2O,0.4 g·L−1;MgCl2,5 g·L−1;CaCl2,5 g·L−1。反应器安装浮球阀保持水位恒定,并由蠕动泵控制膜出水,通量分别控制在10、20和40 L·(m2·h)−1,由于反应器体积相同,3个p-SMBR (S1、S2和S3)对应的水力停留时间(HRT)则分别为8、4和2 h。p-SMBR接种的污泥来自天津北仓污水处理厂二沉池,接种污泥浓度均为500 mg·L−1。通过间歇方式向反应器中投加粉态硫,其单质粒径为200~400目,各反应器投加量保持相等,均为5 g·5 d−1,并利用磁力搅拌器实现泥水和硫粉的充分混匀。硫粉投加量高于自养反硝化脱氮理论要求的硫粉剂量,因此可排除电子供体不足的限制。
-
1) 水质分析。实验期间,每1~2 d采集膜出水,经0.45 μm的滤膜过滤后,采用紫外-可见分光光度计(UV-5800,上海元析仪器有限公司)测定NO3−-N,SO42−质量浓度则由离子色谱仪(883 Basic IC plus,瑞士万通股份有限公司)测定。
2)膜污染分析。采用串联阻力模型计算膜污染阻力分布。首先根据清洁膜的纯水通量计算Rm;将污染膜浸入纯水中测定通量Jt,经计算得到总污染阻力Rt(式(1));采用海绵擦拭膜表面并反冲洗后,再次测通量J1并计算得到污染阻力R1;最后进行化学清洗,测定通量J2后计算得到污染阻力R2。Rt和R1的差值代表物理可逆污染阻力Rpr(式(2)),R1和R2的差值代表化学可逆污染阻力Rcr(式(3)),不可逆污染阻力Rir(式(4))则可由R2和Rm之差表示。
式中:Jt是渗透通量,L·(m2·h)−1;Rt 是污染膜的总过滤阻力,m−1;Rm是固有膜阻力,m−1;Rpr为物理可逆污染阻力,m−1; Rcr为化学可逆污染阻力,m−1;Rir为不可逆污染阻力,m−1。
3)SEM分析。对污染膜的表面和截面采用扫描电子显微镜(SEM)(EVO LS15 SEM,德国)进行观察。测试前将膜样品室温真空干燥 24 h,再用导电胶将样品固定于样品台上。将贴有样品的样品台置于离子溅射仪中,对膜表面进行喷金处理。然后采用扫描电镜观察污染膜的形态。
4)微生物群落分析。对p-SMBR中混合液和膜表面的污泥进行 Illumina MiSeq 测序分析(生工生物科技有限公司,中国)。使用引物 341 F(5'-CCTACGGGNGGCWGCAG-3')和 805 R (5'-GACTACHVGGGTATCTAATCC-3')在 16 S rRNA 基因 V3 和 V4 区域对 PCR 进行扩增和测序。
-
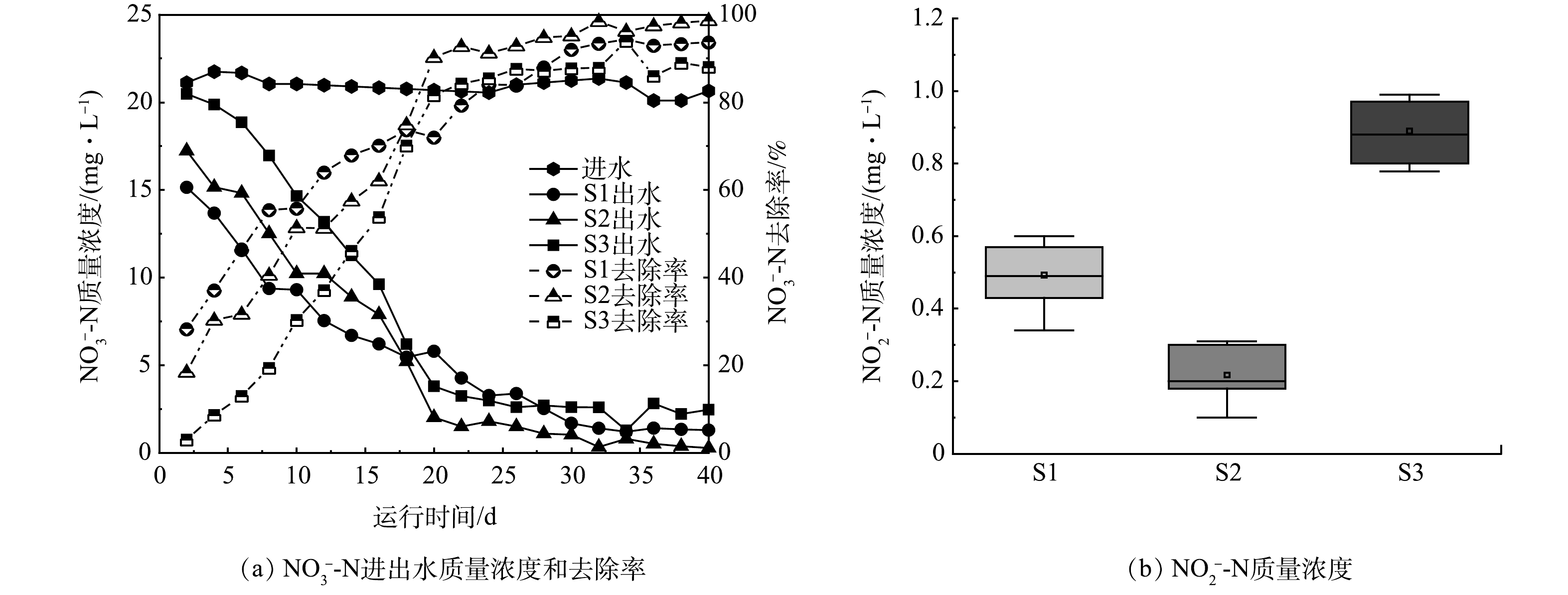
1)脱氮性能分析。如图2(a)所示,在不同HRT下,3个p-SMBR出水的NO3−-N浓度总体变化规律基本一致,均呈现出先逐渐降低后保持稳定的趋势。S1的HRT较长,其在运行初期展现出最高的NO3−-N去除效率,这主要是由于S1的硝酸盐处理负荷较低(S1、S2、S3分别为0.048、0.096和0.192 g·(L·d) -1),导致进水中的NO3−-N与电子受体和反硝化菌之间的接触反应时间更为充分[11, 12]。但在反应器运行达到稳定状态之后(20 d),具有适中HRT的S2反硝化速率超越了S1和S3,并一直维持到实验结束。此阶段,S2出水NO3−-N质量浓度稳定在1 mg·L−1以下,脱氮效率达到95%以上,远高于S1(93%)和S2(86%)的脱氮效率。S2之所以表现出最为优异的硝酸盐去除能力,推测是由于在适宜的硝酸盐处理负荷条件下,硫自养反硝化功能菌群及其代谢活性得以有效强化,2.3部分对此进行了详细分析。此外,如图2(b)所示,实验中还发现各反应器出水的NO2−-N质量浓度存在较大差异,S1、S2、S3的平均出水NO2−-N质量浓度分别为0.5、0.25、0.9 mg·L−1。有研究表明,亚硝酸盐积累是硫基脱氮过程负荷过高的标志[13]。S3的HRT短,进水硝酸盐负荷相应较高 ,因此,产生了更为严重的NO2−-N积累问题。但尽管S2 的HRT低于S1,其出水NO2−-N浓度也明显低于S2,可能也与由于适度的硝酸盐负荷可改善反应器内功能菌群结构及其生物活性。
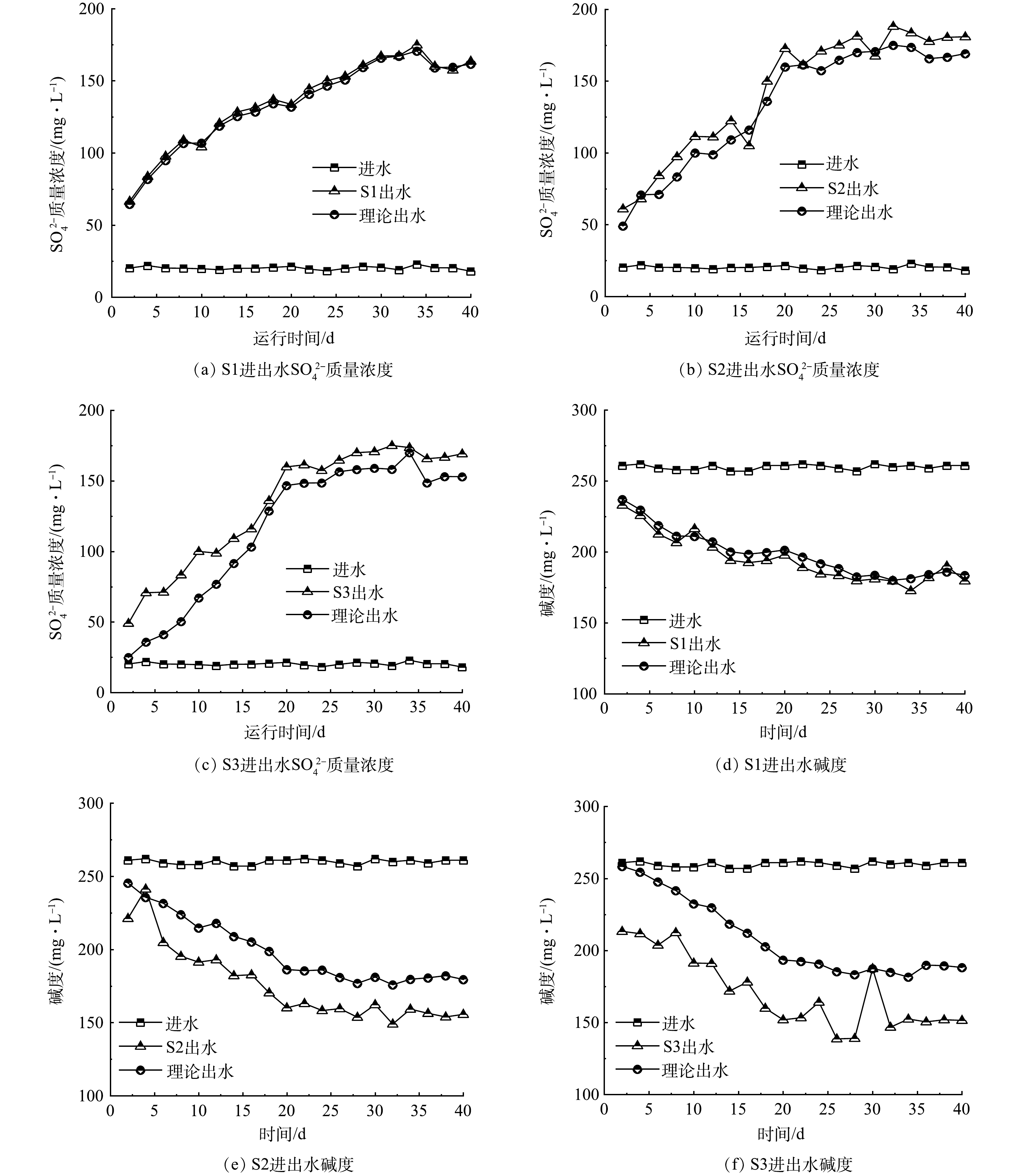
2) SO42−生成和碱度消耗。根据硫自养反硝化的反应方程(式(5))可知,硫单质作为电子供体还原NO3−-N主要生成SO42−副产物,因此,在实验期间检测了各反应器出水SO42−质量浓度的变化情况。如图3(a)~(c)所示,反应器进水SO42−质量浓度约为20 mg·L−1,主要来自自来水本身和配制合成废水的试剂。实验期间,S1、S2和S3出水的SO42−质量浓度随运行时间的延长而逐渐升高,这是由于p-SMBR内的硫氧化细菌逐渐富集,硫单质在其自养反硝化反应中被氧化为硫酸盐。尽管出水SO42−质量浓度始终在200 mg·L−1以内,但从图中可以发现实际SO42−出水质量浓度均高于理论质量浓度,且S3的实际出水质量浓度与理论质量浓度相差最大。好氧硫氧化和硫歧化是导致硫自养反硝化系统SO42−质量浓度偏高的主要原因,S3的运行通量高、进水速率快,可能造成更多空气被带入到混合液当中,进而促进了好氧硫氧化和硫歧化等副反应的发生,生成了更多的SO42−。自养反硝化过程需要消耗碱度,图3(d)~(f)显示了各反应器进出水的碱度(mg·L−1,以CaCO3计)变化情况。研究中进水碱度维持在260 mg·L−1左右,随着实验的进行,出水碱度逐渐降低,其消耗值与NO3−-N的消减呈相同的趋势。但即便是在稳定阶段,出水碱度仍维持在150 mg·L−1以上的水平,因此可排除碱度限制对不同p-SMBR自养反硝化的不利影响。此外,与SO42−的情况类似,实际出水碱度和理论值存在差值,尤其是S3反应器,其实际出水碱度明显低于理论出水碱度,这可能是缘于好氧硫氧化和硫歧化反应中酸的形成,导致了碱度的额外消耗[14]。
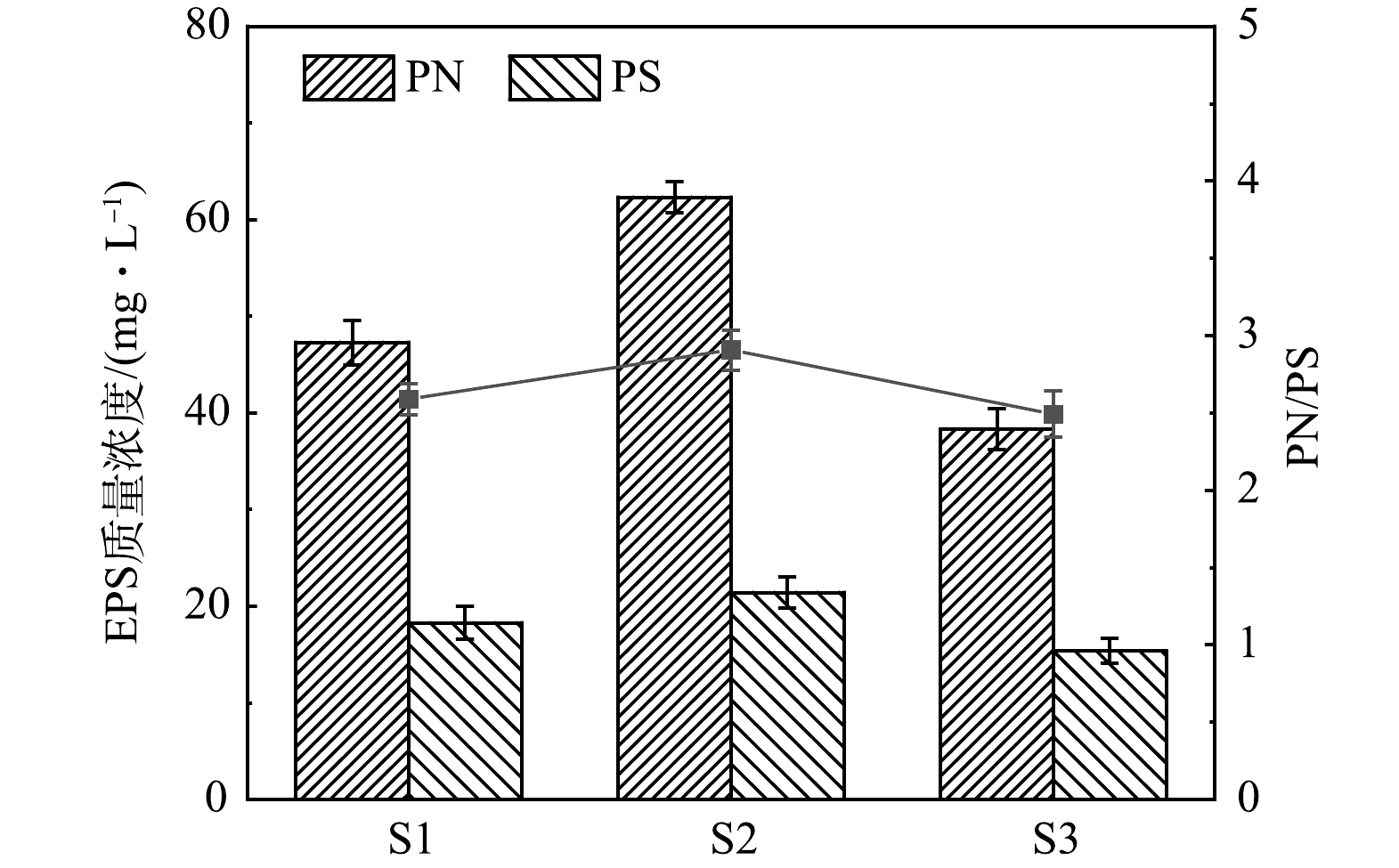
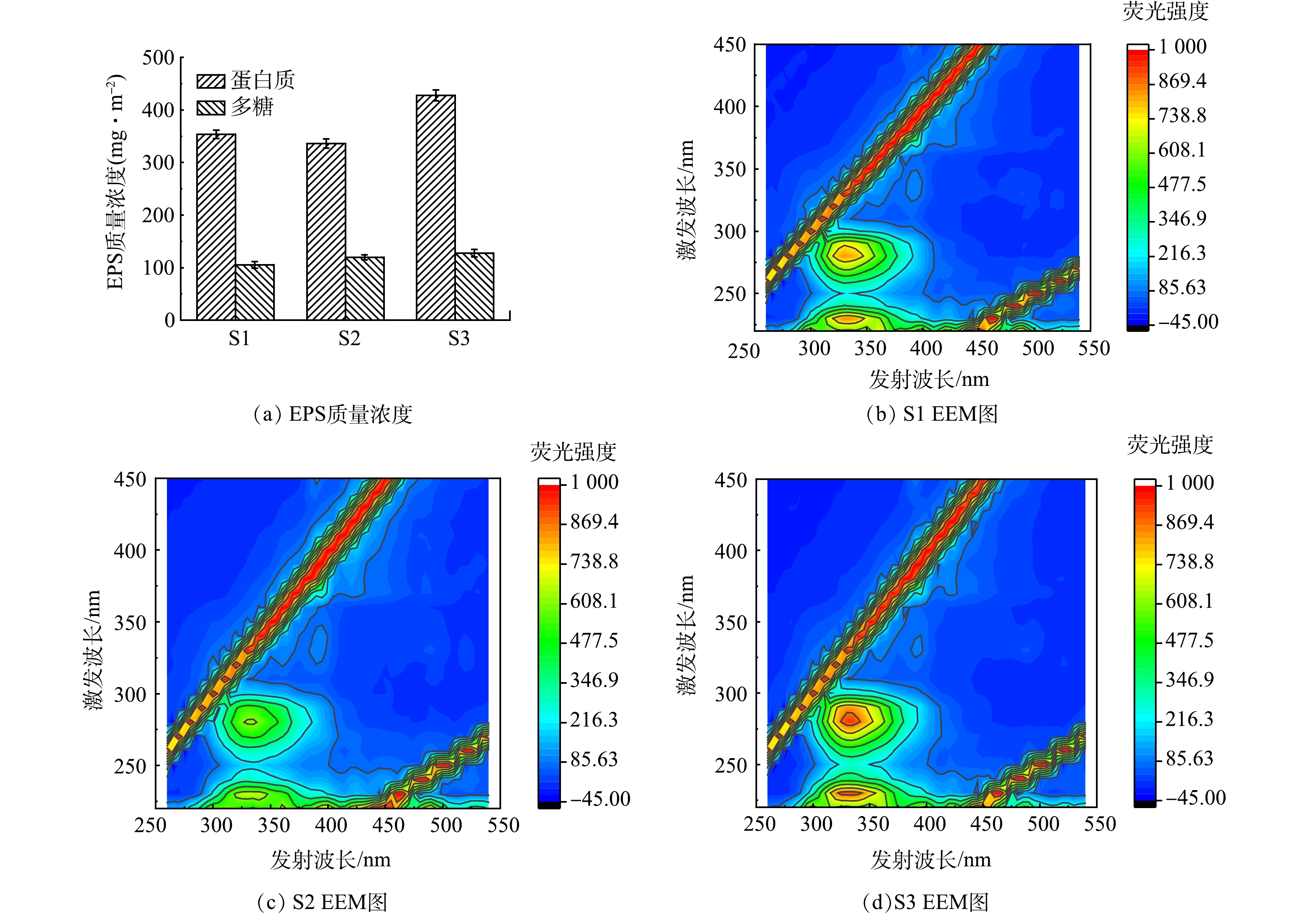
3)EPS分析。EPS作为重要的微生物代谢产物[15],一方面会对膜污染产生严重影响,另一方面EPS中也含有一定量的氧化还原介体,其可作为电子传递通道降低电子传导阻力,加速电子转移,从而促进硫自养反硝化反应。图4为不同p-SMBR中活性污泥的EPS含量。可以看出,S2中的EPS含量明显高于S1和S3。此外,由图4还可以看出,EPS中的PN含量显著高于PS,表明PN是EPS的主要成分。这可能是因为PN比PS更易受到反应器进水硝态氮的影响,硝酸盐负荷应激诱导微生物分泌了更多的PN,特别是脱氮效果最佳的S2反应器,展现了出最高的PN/PS比例。与此同时,较高的PN/PS比值也可导致EPS结构发生变化,使得EPS更有利于维持微生物适宜的生长环境[16],进一步强化自养反硝化效果。另一方面,在自养反硝化体系中,EPS作为微生物的营养来源之一,还可促进异养微生物的适量生长,进而在一定程度上提高脱氮效率[17]。在本研究中, S2的EPS含量和PN/PS比值与S1、S3相比均大幅提高,可为其优异的自养反硝化效果提供充分的理论依据。
-
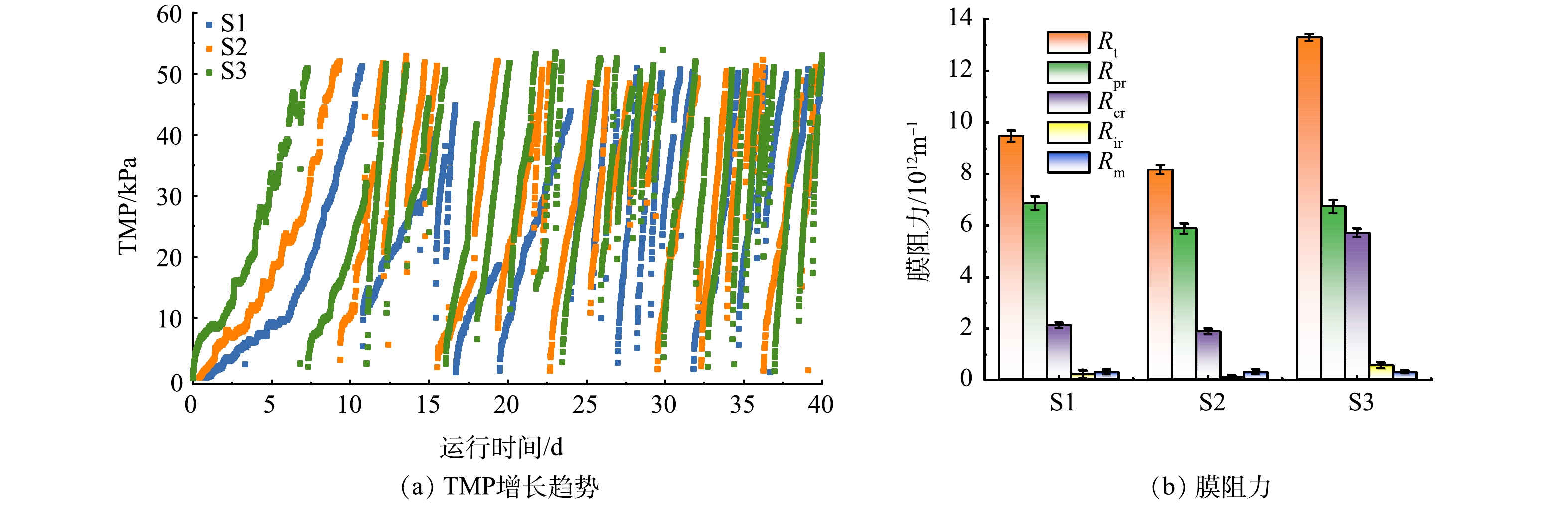
1) TMP和膜污染阻力分布分析。图5(a)为3组p-SMBR中平板陶瓷膜的TMP增长情况,其运行通量分别为10、20和40 L·(m2·h)−1。在整个运行期间,S1和S2的TMP增长均较为缓慢,增长速率相差不大,分别为4.8 kPa·d−1和5.3 kPa·d−1。而对于通量更高的S3,TMP增长则表现出明显的阶段性差异,在运行的前20 d,TMP以5.01 kPa·d−1的速率增加;此后,当反应器处于稳态运行时,TMP增加速率急剧上升至7.65 kPa·d−1,比初始阶段增加了53%。因此,对于硫自养反硝化膜生物反应器而言,膜通量的优化选择具有重要意义,适宜的运行通量既可充分发挥膜系统的效能,又能避免膜污染的快速形成。
图5(b)为S1、S2和S3的膜污染阻力分布情况。本研究中的膜阻力是对第10、20和30天的污染膜进行膜阻力测试,并取平均值得到。S2的总污染阻力Rt为8.17×1012 m−1,低于S1(9.48×1012 m−1)和S3 (13.3×1012 m−1)。另外,可以明显看出,S1和S2中的Rt主要由Rpr组成,Rcr和Rir占比较小;随着通量的增加,S3中的Rcr占比显著增加,达到了几乎与Rpr相当的程度。这意味着S3内膜孔堵塞污染的加剧,可能是由于通量的过度升高导致更多污染物进入到了膜孔内部。
2)膜表面污染物分析。滤饼层的形成是传统膜生物反应器中膜污染的关键因素,针对本研究面向自养反硝化脱氮所构建的p-SMBR,实验中也分析了因运行通量所引起的滤饼层差异。EPS通常被认为是滤饼层形成的重要物质基础,其可优先粘附在膜表面,为微生物的聚集与生长繁殖创造有利条件[18]。此外, EPS还可通过填充滤饼层中的空隙来提高滤饼层的致密性,进一步加大污染阻力。如图6(a)所示,S3滤饼层中的蛋白和多糖含量分别为428.1 mg·m−2和127.7 mg·m−2,而在S1和S2中其对应的含量则分别仅为353.7 mg·m−2和 105.3 mg·m−2、336.2 mg·m−2和 119.7 mg·m−2。由2.1.3部分可知,S2反应器混合液中的EPS含量在3组反应器中最高,而其膜表面滤饼层中的EPS含量较S3明显降低,混合液中较高的EPS含量可改善自养反硝化效果,而滤饼层中较低的EPS含量则可降低膜污染速率,该结果表明通过对p-SMBR进行适宜的水力停留时间和运行通量优化调控,可同步实现强化脱氮和减缓膜污染的目标。另外,从图5(b)中可以发现所有反应器滤饼层EPS中的蛋白含量高于多糖,这与反应器混合液中EPS的组成情况相一致。
进一步采用3维EEM光谱分析了滤饼层EPS的组成情况。如图6(b)~(d)所示,在所有膜滤饼层的EPS中,均在220 nm/340 nm和270~280 nm/340 nm的Ex/Em处检测到2个主峰,分别对应于芳香族蛋白质(以酪氨酸类蛋白质为代表)和色氨酸类蛋白质。现有研究已证明蛋白类有机物是引起膜污染的关键性物质[19],特别是其中的色氨酸和酪氨酸类物质具有强疏水侧链和更多的吸附位点,可导致滤饼层结构更加致密[20],同时酪氨酸类蛋白质也更易堵塞膜孔[21]。由图可以看出,S3滤饼层中2种蛋白类物质的峰强最高,S1、S2则显著降低,进一步印证了上述膜污染趋势以及膜表面污染物的定量分析结果。
3) 膜表面滤饼层形貌分析。通过SEM观察了p-SMBR运行过程中膜表面形成的滤饼层形貌。如图7所示,运行40 d以后,S1、S2和S3的膜表面均被一层滤饼层所覆盖,但滤饼层的致密性并不相同。可以明显看出S2表面的滤饼层较为疏松,存在较多的孔隙与裂隙,而S1和S3的滤饼层则十分致密,尤其是S3,从表面几乎难以观察到孔隙的存在。S2膜表面疏松的滤饼层结构以及丰富的孔隙和裂隙可以提供更多的水流通道,减少过水阻力,进而提高膜的过水效率。
由断面图可以看出,尽管S2的运行通量为S1的2倍,但其滤饼层厚度最低,仅为19.3 μm,而S1和S3滤饼层的厚度显著增大,分别达到了28.6 μm和45.5 μm。此滤饼层观察结果与上述膜表面污染物分析结果具有良好的一致性,再次证明对p-SMBR中HRT进行优化调控,不仅可通过改善混合液污泥特性强化其脱氮性能,还可通过改变滤饼层结构起到缓解膜污染的作用。而S3在高达40 L·(m2·h)−1的运行通量下,在膜表面形成了孔隙率低、透水性差的致密滤饼层,膜污染速率显著增大。由此可见,通过对p-SMBR运行通量进行优化调控,有望在不显著影响膜污染的前提下,有效提供系统的产水能力。
-
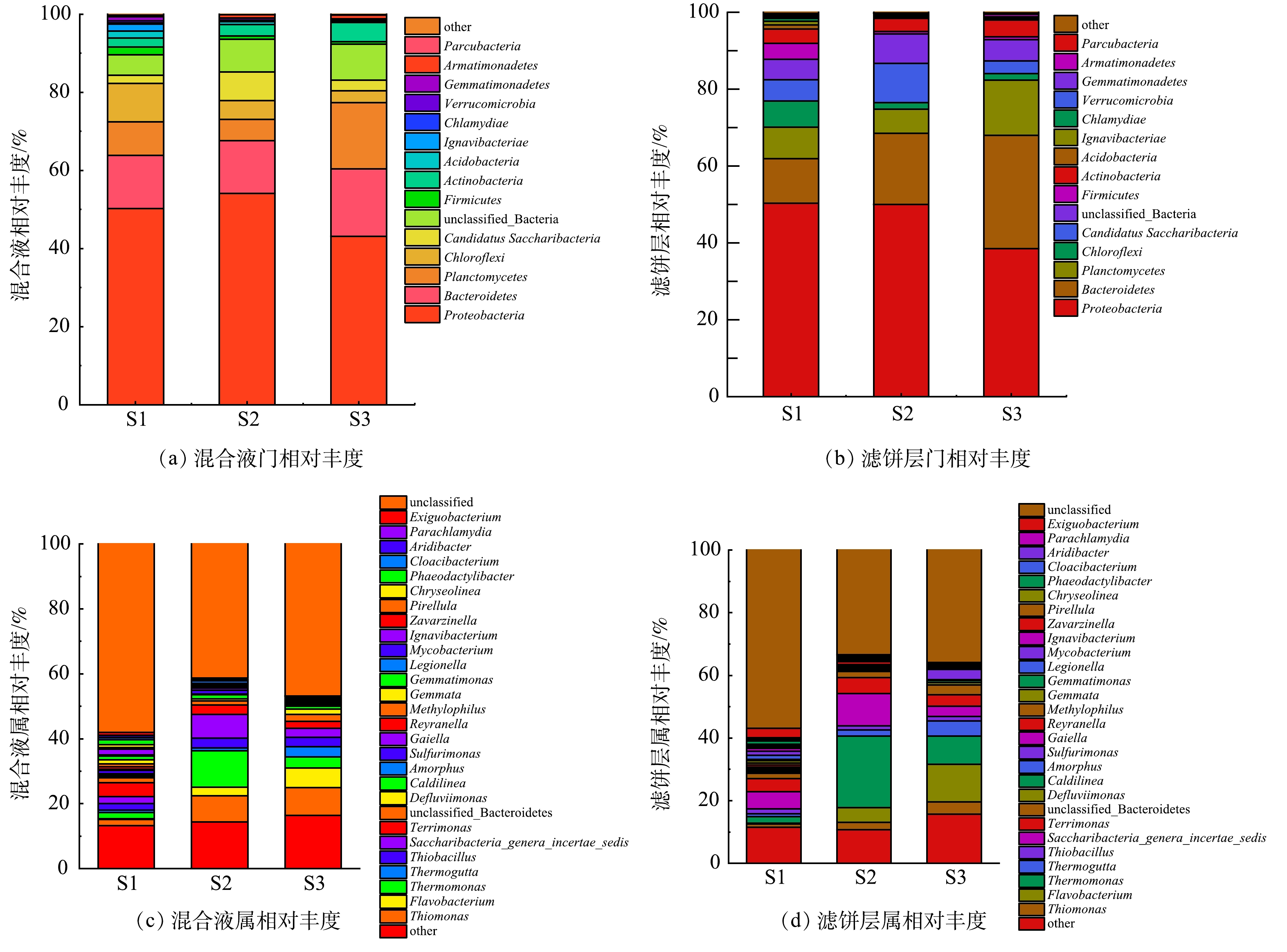
图8(a)~(b)为3个p-SMBR微生物群落结构在门水平上的组成情况。可以看出,反应器混合液中最丰富的菌门是Proteobacteria和Bacteroidetes。其中,Proteobacteria在S1、S2和S3中的相对丰度分别为50.2%、54.1%和43.2%。已有研究表明,Proteobacteria在NO3−-N的自养反硝化去除过程中发挥着重要作用[22]。此外,大量的Bacteroidetes门成员也已被确定为反硝化细菌[23],主要生活在缺氧环境并可参与自养反硝化反应[24],其在S1、S2和S3中的丰度分别为13.6%、13.5%和17.2%。可见,p-SMBR中丰富的反硝化菌是导致其呈现良好自养反硝化脱氮效果的主要原因。与混合液相对应,Proteobacteria和Bacteroidetes也是反应器滤饼层中的优势菌门,Bacteroidetes门下一部分细菌可以通过其菌毛附着在膜表面,并分泌多种膜污染物如EPS等。此外,滤饼层中还出现了较为丰富的Planctomycetes门微生物,具有自养能力且适宜在缺氧的环境中生存,这与滤饼层的环境一致;同时由于其茎从细胞体的非生殖端延伸出来,有助于其附着在其他微生物表面,由此可推断Planctomycetes也可能在膜污染中发挥了重要作用[25]。S3中Bacteroidetes和Planctomycetes的相对丰度(29.4%和14.3%)显著高于S1 (11.7% 和8.1%)和S2 (18.5%和6.3%),表明S3发生了更为严重的膜污染。
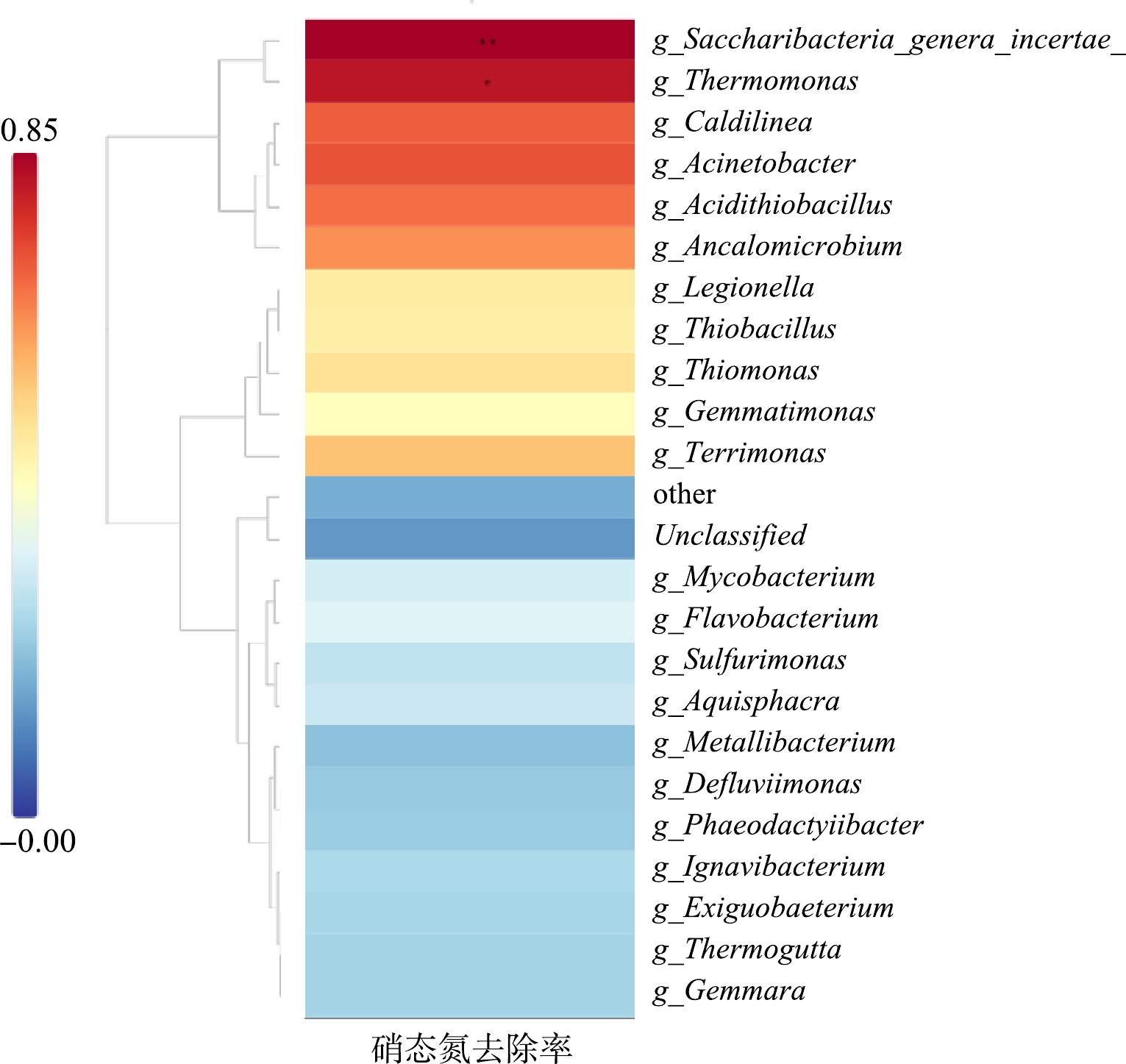
在属水平上,如图8(c)~(d), S1、S2和S3中的微生物组成也呈现出明显差异,S1、S2和S3混合液中最丰富的菌属分别为Terrimonas (4.3%)、Saccharibacteria_genera_incertae_sedis (2.2%)和Thiobacillus (2.0%);Thermomonas (11.2%)、Thiomonas (8.1%)和Saccharibacteria_genera_incertae_sedis (7.4%)以及Thiomonas (8.6%)、Flavobacterium (6.0%)和 Thermomonas (3.4%)。据报道, Thermomonas、Thiomonas和Saccharibacteria_genera_incertae_sedis均可通过自养反硝化作用将水中硝酸盐氮转化为氮气脱除[26]。如图9所示,Thermomonas和Saccharibacteria_genera_incertae_sedis与p-SMBR的硝态氮去除率呈现出最为显著的正相关关系,而该2个菌属在S2中的相对丰度明显高于S1和S3,可能是导致其自养反硝化脱氮效率最高的主要原因。在滤饼层中,S1、S2和S3最丰富的属分别为Saccharibacteria_genera_incertae_sedis (5.5%)和Terrimonas (4.1%)、Thermomonas (22.9%)和Saccharibacteria_genera_incertae_sedis (10.2%)以及Flavobacterium (12.0%)和Thermomonas (9.0%)。研究发现,Terrimonas属具有通过分泌疏水EPS来加速聚集的能力[27],而疏水性EPS物质是膜污染层中的重要组分;Flavobacterium与胞外多糖的产生有关,可诱导膜污染的发生,恶化膜的过滤性能[28]。S1滤饼层中较高的Terrimonas丰度为其尽管运行通量低于S2、但膜污染速率几乎与S2持平的现象提供了解释;而S3滤饼层中较高的Flavobacterium丰度则可能是造成其膜污染速率显著高于S1和S2的微生物学原因。
-
1) HRT为4 h的S2出水NO3−-N质量浓度稳定在1 mg·L−1以下,脱氮率达到95%以上,高于S1和S3反应器。
2)运行通量为20 L·(m2·h)−1的S2表面所形成的滤饼层最为疏松,厚度最小,膜污染阻力也低于S1 (10 L·(m2·h)−1)和S3 (40 L·(m2·h)−1)。
3)微生物群落结构分析结果表明,反硝化功能菌如Thiomonas、Thermomonas和Saccharibacteria_genera_incertae_sedis在S2混合液中最为丰富,这是导致其脱氮效果优异的主要原因;而S1和S3滤饼层中分别存在较高丰度的Terrimonas和Flavobacterium菌,与其滤饼层的高EPS含量具有较强的一致性,是造成膜污染加重的重要因素。
粉态硫自养反硝化膜生物反应器 (p-SMBR) 的优化调控:水力停留时间和膜通量的影响
Optimal regulation of powder sulfur autotrophic denitrification membrane bioreactor (p-SMBR): effect of hydraulic retention time/membrane flux
-
摘要: 面向污水厂二级出水深度脱氮的需求,构建了粉态硫自养反硝化膜生物反应器(p-SMBR),探究了水力停留时间(HRT)和膜通量对系统脱氮效果以及膜污染特性的影响。研究结果表明,在HRT为4 h时,p-SMBR表现出最佳的反硝化脱氮能力(98%),出水硝酸盐质量浓度< 1 mg·L−1;同时可改善滤饼层结构,进而缓解膜污染,运行通量为20 L·(m2·h)−1时跨膜压增长速率仅为5.3 kPa·d−1。微生物测序结果表明,Thermomonas和Thiomonas是反应器混合液中相对丰度最高的自养反硝化相关菌属,而Terrimonas和Flavobacterium则是滤饼层中造成膜污染的主要菌属。对p-SMBR的HRT和运行通量进行优化调控,可改变相关菌属的相对含量,进而起到同步高效脱氮与缓解膜污染的作用。Abstract: Facing the demand of deep nitrogen removal in the secondary effluent of wastewater plant, powdered sulfur autotrophic denitrification membrane bioreactor (p-SMBR) was constructed, and the influences of hydraulic retention time (HRT) and membrane flux on the nitrogen removal effect as well as membrane fouling characteristics of p-SMBR were investigated. The results showed that the p-SMBR exhibited the best denitrification denitrification capacity (98%) with effluent nitrate concentration lower than 1 mg·L−1 at a HRT of 4 h. Meanwhile, the structure of the filter cake layer was ameliorated, and in turn the membrane fouling was alleviated. At the operating flux of 20 L·(m2·h)−1, the trans-membrane pressure growth rate was only 5.3 kPa·d−1. The results of microbial sequencing showed that Thermomonas and Thiomonas were the most relatively abundant autotrophic denitrification-associated genus in the mixture of p-SMBR, whereas Terrimonas and Flavobacterium were the main genus contributing to membrane fouling in the filter cake layer. Optimizing and regulation of the HRT and operating flux of p-SMBR can change the relative abundance of the relevant genus, which in turn serves to synchronouly realize an efficient nitrogen removal and membrane fouling mitigation.
-

-
-
[1] WANG W, WEI D, LI F C, et al. Sulfur-siderite autotrophic denitrification system for simultaneous nitrate and phosphate removal: From feasibility to pilot experiments[J]. Water Research, 2019, 160: 52-59. doi: 10.1016/j.watres.2019.05.054 [2] CHEN Z Q, PANG C, WEN Q X. Coupled pyrite and sulfur autotrophic denitrification for simultaneous removal of nitrogen and phosphorus from secondary effluent: feasibility, performance and mechanisms[J]. Water Research, 2023, 243: 120422. doi: 10.1016/j.watres.2023.120422 [3] 张志剑, 周林强, 李慧, 等. 市政污水处理厂生物除磷运行效能与机理分析. 中国环境科学[J]. 2010, 30(12): 1614-1621. [4] 云玉攀. Pd-Cu催化剂协同零价铁处理污水厂二级出水中硝态氮的研究 [D]. 北京: 北京科技大学, 2018. [5] 张浩, 鲍立宁, 黄显怀, 等. 低碳氮比条件下外加铁源对生物脱氮性能与机理的研究[J]. 工业用水与废水, 2021, 52(02): 24-29. doi: 10.3969/j.issn.1009-2455.2021.02.005 [6] 刘绪振, 赵长盛, 刘婷, et al. 硫自养反硝化工艺的研究现状及展望[J]. 工业水处理, 2023, 43(7): 21-31. [7] FABBRICINO M, PETTA L G. Drinking water denitrification in membrane bioreactor/membrane contactor systems[J]. Desalination, 2007, 210(1): 163-174. [8] MCADAM E J, JUDD S J. Denitrification from drinking water using a membrane bioreactor: Chemical and biochemical feasibility[J]. Water Research, 2007, 41(18): 4242-4250. doi: 10.1016/j.watres.2007.05.059 [9] JEFFERSON B, LAINE A L, JUDD S J, et al. Membrane bioreactors and their role in wastewater reuse[J]. Water Science & Technology, 2000, 41(1): 197-204. [10] HUANG R, PAN H, ZHENG X, et al. Effect of membrane pore size on membrane fouling of corundum ceramic membrane in MBR[J]. International Journal of Environmental Research and Public Health, 2023, 20(5): 45-58. [11] DI CAPUA F, MASCOLO M C, PIROZZI F, et al. Simultaneous denitrification, phosphorus recovery and low sulfate production in a recirculated pyrite-packed biofilter (RPPB)[J]. Chemosphere, 2020, 255: 126977. doi: 10.1016/j.chemosphere.2020.126977 [12] ZHAO Y, FENG C, WANG Q, et al. Nitrate removal from groundwater by cooperating heterotrophic with autotrophic denitrification in a biofilm–electrode reactor [J]. 2011, 192(3): 1033-1039. [13] SIERRA-ALVAREZ R, BERISTAIN-CARDOSO R, SALAZAR M, et al. Chemolithotrophic denitrification with elemental sulfur for groundwater treatment[J]. Water Research, 2007, 41(6): 1253-1262. doi: 10.1016/j.watres.2006.12.039 [14] YıLMAZ T, SAHINKAYA E. Performance of sulfur-based autotrophic denitrification process for nitrate removal from permeate of an MBR treating textile wastewater and concentrate of a real scale reverse osmosis process[J]. Journal of Environmental Management, 2023, 326: 116827. doi: 10.1016/j.jenvman.2022.116827 [15] GUO H, CHEN Z, GUO J, et al. Enhanced denitrification performance and biocatalysis mechanisms of polyoxometalates as environmentally-friendly inorganic redox mediators[J]. Bioresource Technology, 2019, 291: 121816. doi: 10.1016/j.biortech.2019.121816 [16] NI B-J, FANG F, XIE W-M, et al. Characterization of extracellular polymeric substances produced by mixed microorganisms in activated sludge with gel-permeating chromatography, excitation–emission matrix fluorescence spectroscopy measurement and kinetic modeling[J]. Water Research, 2009, 43(5): 1350-1358. doi: 10.1016/j.watres.2008.12.004 [17] ZHAN M, ZENG W, WU C, et al. Impact of organic carbon on sulfide-driven autotrophic denitrification: Insights from isotope fractionation and functional genes[J]. Water Research, 2024, 255: 121507. doi: 10.1016/j.watres.2024.121507 [18] SUN L, MA J, LI L, et al. Exploring the essential factors of performance improvement in sludge membrane bioreactor technology coupled with symbiotic algae[J]. Water Research, 2020, 181: 115843. doi: 10.1016/j.watres.2020.115843 [19] ZHENG Y, ZHOU Z, JIANG L, et al. Evaluating influence of filling fraction of carriers packed in anaerobic side-stream reactors on membrane fouling and microbial community of the coupled membrane bioreactors[J]. Journal of Hazardous Materials, 2020, 388: 122030. doi: 10.1016/j.jhazmat.2020.122030 [20] CHEN Y, WANG M, ZHOU X, et al. Sorption fractionation of bacterial extracellular polymeric substances (EPS) on mineral surfaces and associated effects on phenanthrene sorption to EPS-mineral complexes[J]. Chemosphere, 2021, 263: 128264. doi: 10.1016/j.chemosphere.2020.128264 [21] HU Y, WANG X C, YU Z Z, et al. New insight into fouling behavior and foulants accumulation property of cake sludge in a full-scale membrane bioreactor[J]. Journal of Membrane Science, 2016, 510: 10-17. doi: 10.1016/j.memsci.2016.02.058 [22] SONG Y, LI H, HAN Y, et al. Landfill leachate as an additional substance in the Johannesburg-Sulfur autotrophic denitrification system in the treatment of municipal wastewater with low strength and low COD/TN ratio[J]. Bioresource Technology, 2020, 295: 122287. doi: 10.1016/j.biortech.2019.122287 [23] ZHANG L, ZHANG C, HU C, et al. Denitrification of groundwater using a sulfur-oxidizing autotrophic denitrifying anaerobic fluidized-bed MBR: performance and bacterial community structure[J]. 2015, 99: 2815-2827. [24] YAMADA T, SEKIGUCHI Y, HANADA S, et al. Anaerolinea thermolimosa sp. nov. , Levilinea saccharolytica gen. nov. , sp. nov. and Leptolinea tardivitalis gen. nov. , sp. nov. , novel filamentous anaerobes, and description of the new classes Anaerolineae classis nov. and Caldilineae classis nov. in the bacterial phylum Chloroflexi[J]. 2006, 56(6): 1331-1340. [25] LIU Y, LIU Q, LI J, et al. Effect of magnetic powder on membrane fouling mitigation and microbial community/composition in membrane bioreactors (MBRs) for municipal wastewater treatment[J]. 2018, 249: 377-385. [26] YAN C, CHEN Q, WANG C, et al. Mixotrophic denitrification driven by plant carbon sources and influent sulphate for enhancing nitrogen removal in constructed wetlands[J]. Journal of Water Process Engineering, 2023, 53: 103908. doi: 10.1016/j.jwpe.2023.103908 [27] ZHAO Y, JIANG B, TANG X, et al. Metagenomic insights into functional traits variation and coupling effects on the anammox community during reactor start-up[J]. Science of the Total Environment, 2019, 687: 50-60. doi: 10.1016/j.scitotenv.2019.05.491 [28] OKEKE B C, FRANKENBERGER W T. Use of starch and potato peel waste for perchlorate bioreduction in water[J]. Science of the Total Environment, 2005, 347(1): 35-45. -



 下载:
下载: