-
饮用水安全问题对人类健康至关重要[1-2]。近些年饮用水安全方面的挑战涵盖了微生物的方方面面,通常细菌在饮用水管网输配系统(drinking water distribution systems,DWDSs)的生物膜中自然定殖,并形成稳定的微生物生态系统[3-4],这种稳态环境有利于细菌的生长并能够给其在面对消毒过程时提供一定的庇护作用,进而带来包括致病菌、抗性基因等微生物风险问题[5]。因此,探究长期运行的DWDSs生物膜的细菌群落组成对于控制饮用水微生物风险具有重要意义。
抗生素抗性基因(antibiotic resistance genes,ARGs)会增强细菌宿主对抗生素的抵抗能力[6-7],细菌产生ARGs通常需要一个稳定的环境,而生物膜恰恰能提供这种“温床”[8-9],因此长期运行的DWDSs生物膜最终可能导致微生物的ARGs风险。此外,包括磺胺甲恶唑在内的抗生素在临床上的广泛使用,不可避免地导致抗生素污染[10-11]。抗生素不仅会影响细菌的生长过程,还会对ARGs的传播造成影响[12-13]。低剂量的抗生素(0.5 mg·L−1),如土霉素和磺胺甲恶唑,会加速活性氧的生成并促进ARGs的传播[14]。因此,探究微量抗生素对长期运行的DWDSs生物膜中ARGs的影响十分重要。饮用水处理和消毒被认为是20世纪最伟大的公共卫生成就之一[15],消毒工艺通常被认为能够抑制微生物的生长以及控制ARGs传播[16]。但同样有研究报道消毒对ARGs的形成存在促进作用[17-20]。因此,探究消毒是否对长期运行的DWDSs生物膜中的ARGs起到有效控制将有助于控制管网微生物风险。此外,消毒过程作为细菌遭受到的一种环境胁迫压力,往往会影响与细菌新陈代谢有关的功能基因[21]。但是关于功能基因与ARGs之间是否存在关系,目前研究报道不多。
因此,本研究的目的是利用模拟不同处理条件下的DWDSs,研究微量磺胺甲恶唑对细菌群落组成和ARGs的影响;通过长期模拟运行探究次氯酸钠消毒对ARGs的控制效果;最后通过相关性分析探讨功能基因与ARGs之间可能存在的关系,探讨消毒过程通过改变细菌的代谢过程从而影响细菌的生长进而控制ARGs传播。
-
实验用水来自于中国东部一个饮用水处理厂(drinking water treatment plant,DWTP)。出水经过混凝、沉淀、砂滤处理。该原水的pH为7.89±0.05,浊度为(1.24±0.10) NTU,耗氧量CODMn为(3.00±0.14) mg·L−1,余氯质量浓度为0,异养菌平板计数为(120±5) CFU·mL−1,没有检测到总大肠菌群。
-
实验在1.50 m长全新的PE管材(DN 60 mm)中进行。管道进水为每日从DWTP处理后获取的60.0 L砂滤(SF)出水,并通过蠕动泵以1.50 mL·s−1的流速在各管中缓慢流过,运行为期1 a。
共采用9根管道来模拟饮用水管网输配系统(DWDSs),共设计3种实验条件,各条件有3个平行。条件A1,不使用消毒剂的SF出水作为实验进水;条件A2,在不使用消毒剂的SF出水添加2.00 μg·L−1的磺胺甲恶唑作为实验进水。条件B1,SF出水添加2.00 μg·L−1的磺胺甲恶唑并使用次氯酸钠(NaClO)消毒剂进行消毒作为实验进水。其中,磺胺甲恶唑的添加质量浓度是考虑到了可能发生的磺胺类抗生素污染情况[22];而以游离氯消毒的出厂水质量浓度一般控制在0.3~0.8 mg·L−1[23-24],因此,实验模拟管网进水游离氯质量浓度控制在0.50 mg·L−1。
-
在模拟的DWDSs运行1 a后,将每根PE管切成3段,每段长约50.0 cm。使用无菌金属刮刀从管段内部采集生物膜,刮刀距离切口至少40.0 cm,以尽量减少污染的风险[25]。使用FastDNA Spin Kits for Soil (MP Biomedicals Co., USA)试剂盒的说明进行DNA提取。用NanoDrop 2000(Thermo Fisher Scienrific., USA)和TBS-380(YPH-Bio., China)分别测量DNA质量浓度和纯度,并进行凝胶测试以验证其完整性(1%琼脂糖凝胶电泳)。每根管道3个DNA样品混合为1个样品,每个条件3个平行共3个DNA样品进行送样。
-
Illumina高通量测序是用HiSeq 2000平台进行的。宏基因组序列库由美吉生物公司构建。使用Fastp软件(http://github.com/OpenGene /fastp)对原始fastq文件进行了过滤。使用IDBA-UD/Megahit(https://github.com/voutcn/megahit)和Newbler(https://ngs.csr.uky.edu/Newbler)对序列进行多重混合拼接组装。使用Prodigal对拼接结果中的contigs进行基因预测。使用CD-HIT软件(http://www.bioinformatics.org/cd-hit/)构建非冗余基因集。
微生物群落组成分析利用NR数据库进行比对(参数blastp;E≤10−5),并通过NR库对应的分类学信息数据库获得物种注释结果,然后使用物种对应的基因丰度总和计算该物种的丰度。功能基因与京都基因与基因组百科全书(KEGG)的基因数据库进行比对(参数blastp;E≤10−5),再根据对应的基因丰度总和计算该功能类别的丰度。抗生素抗性基因(ARGs)与抗性基因数据库(CARD)进行比对(参数blastp;E≤10−5),将目标基因与其耐药功能注释信息结合,获得注释结果。以上基因丰度是用TPM(trans per million),即基因丰度以该基因通过基因长度标准化后的基因丰度在该样本中所有基因长度标准化后的基因丰度总和中占比的百万倍表示。
-
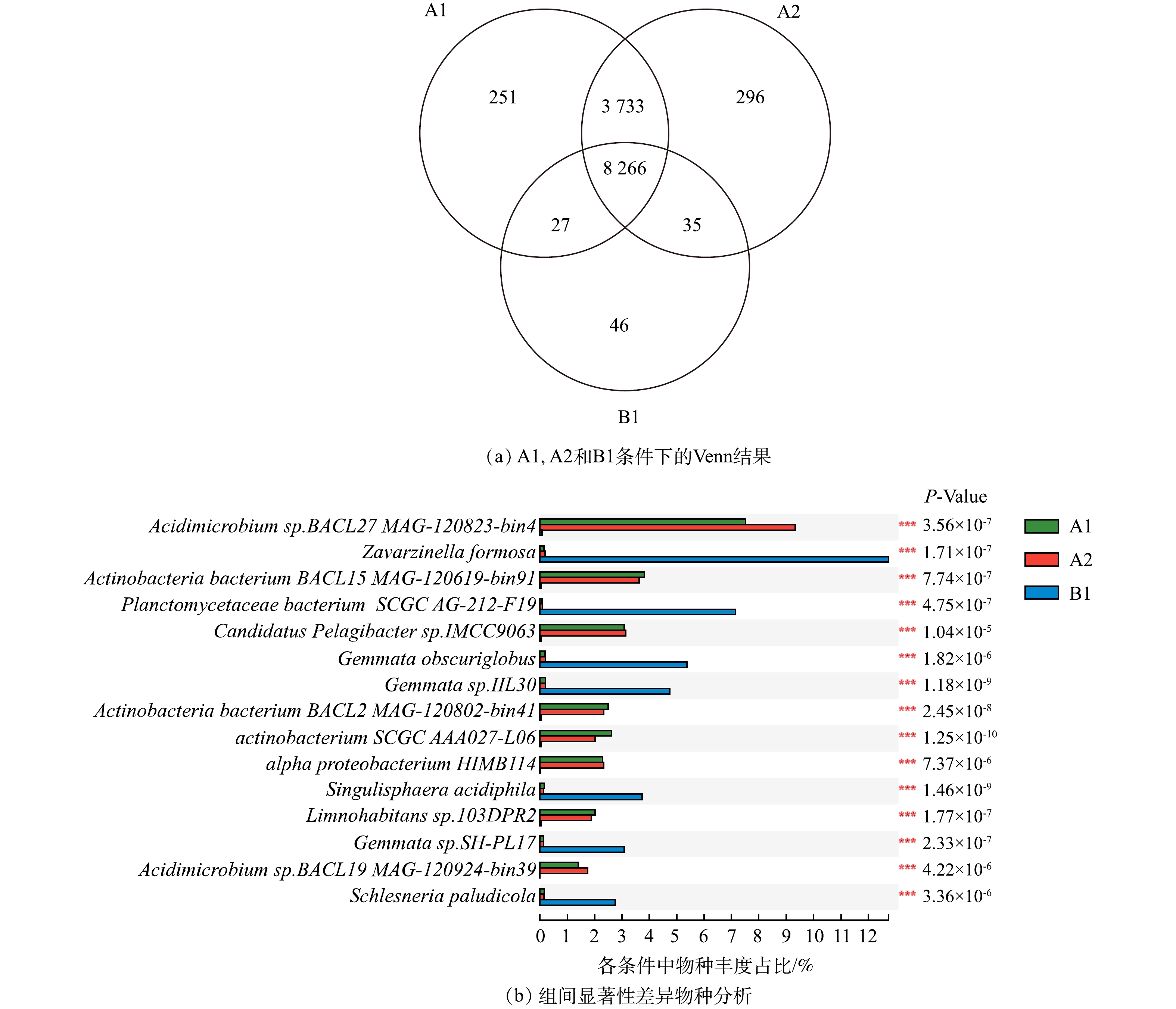
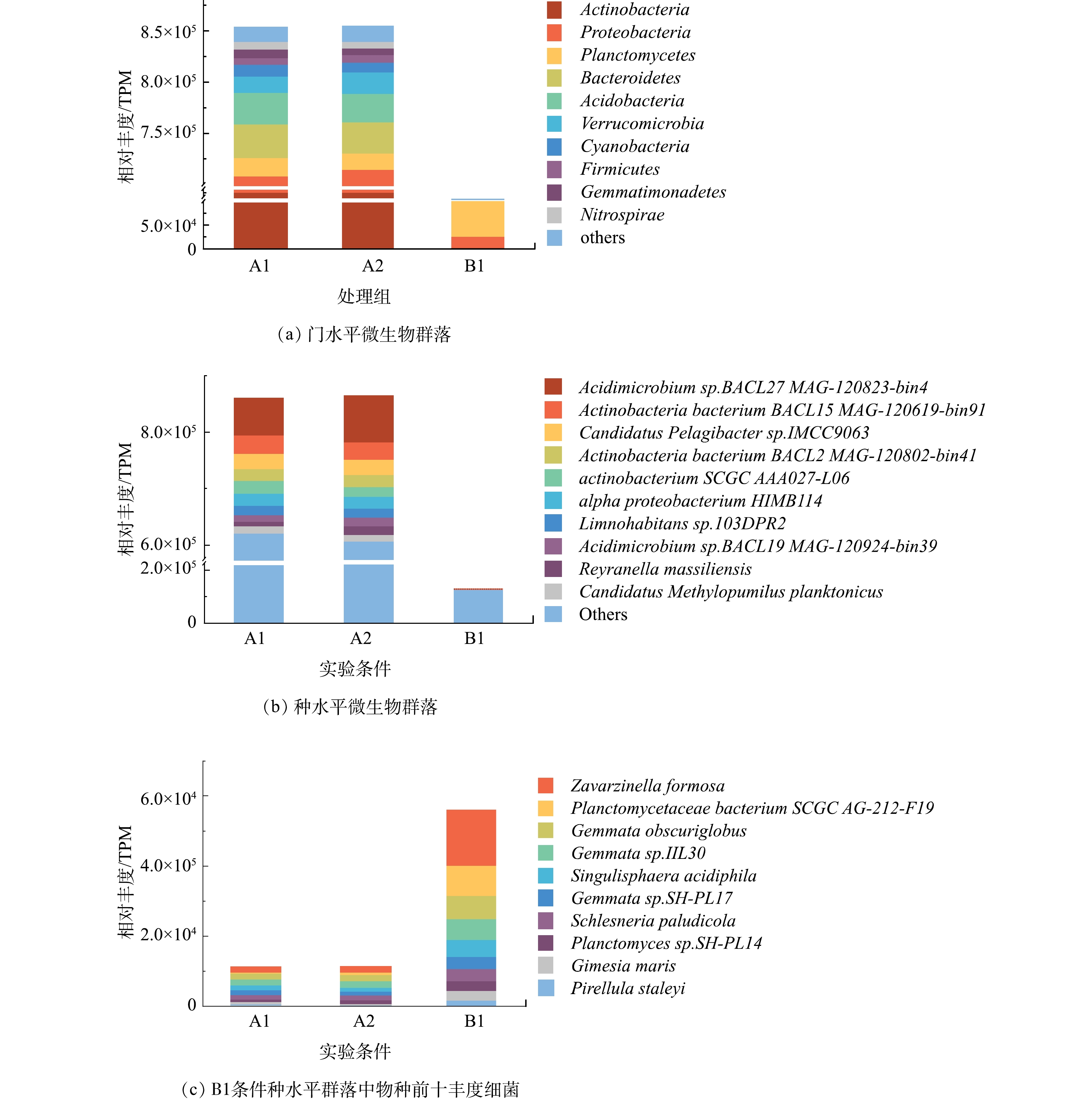
1)微生物群落组成。如图1(a)所示,当在DWDSs的进水中加入磺胺甲恶唑时,由TPM计算的生物膜中门分类水平微生物群落的总丰度仅改变了0.09%。丰度前十的门分别为放线菌门、变形菌门、浮霉菌门、拟杆菌门、酸酐菌门、疣微菌门、蓝藻门、厚壁菌门、芽单胞菌门以及硝化螺旋菌门。在不添加消毒剂的情况下,放线菌门和变形菌门的细菌在条件A1和A2的生物膜中占主导地位,丰度总和占总细菌的比例分别为83.1%和83.7%。许多研究表明,这2个门类是不同管道生物膜中的主要的细菌类型[26-27]。而他们在B1中仅占比24.5%,因此,消毒可以明显降低放线菌门与变形菌门的细菌在细菌群落中的比例。但同时,浮霉菌门细菌无论是占比(58.1%)还是相对丰度(TPM=70 099.6),均远远高于未消毒条件A1和A2,表明浮霉菌门具有较强的抗次氯酸钠消毒能力。厚壁菌门的细菌在3种条件(A1、A2、B1)中的丰度依次为6 839.6、6 607.8和6 802.1 TPM,消毒剂的加入并没有显著影响其丰度变化,因此,厚壁菌门的细菌也具有一定的抗消毒能力,这一结果与之前的研究结果类似[26]。
种水平上未消毒条件下(A1、A2)的优势种中(图1(b)),酸微菌Acidimicrobium sp.BACL27 MAG-120823-bin4在加入磺胺甲恶唑后其相对丰度值由64 879.8 TPM(A1)升高至80 593.3 TPM(A2),相应地其相对丰度占比由7.52%上升至9.34%。因此,微量磺胺甲恶唑对生物膜中该物种丰度产生影响。而消毒条件下(B1),酸微菌Acidimicrobium sp.BACL27 MAG-120823-bin4丰度仅占B1条件生物膜中所有细菌的0.07%,酸微菌属于放线菌门,而该条件下丰度前10的细菌均属于浮霉菌门(图1(c))。因此,消毒可以很好的控制包括酸微菌在内的放线菌门细菌生长,而浮霉菌门的细菌能够更好地适应消毒环境,对消毒表现出一定的抗性。
2)物种的相似性与差异性。A1与A2条件下的群落物种不仅在丰度上差异很小,在物种种类相似程度也很高,相同的物种占到了总物种的97%以上(图2(a))。因此,添加磺胺甲恶唑对微生物群落组成的改变非常小。这一结果与之前的一项研究类似,即磺胺甲恶唑在环境相关质量浓度(< 4 μg·L−1)下没有明显影响河流沉积物中的细菌群落组成[28]。但消毒剂的加入改变了群落的组成,物种数量由12 330种下降至8 374种,因此,次氯酸钠消毒在水处理中确实对微生物生长能够起到一定的控制效果。
如图2(b)所示,在群落的差异性物种中,消毒条件B1与其他2种条件表现出的显著差异性物种均为浮霉菌纲细菌,包括Zavarzinella formosa,Planctomycetaceae bacterium SCGC AG-212-F19,Gemmata_obscuriglobus,Gemmata sp.IIL30,Singulisphaera acidiphila,Gemmata sp.SH-PL17,Schlesneria paludicola,这进一步证实浮霉菌纲细菌抗次氯酸钠消毒能力强。根据研究表明,浮霉菌在面对臭氧的胁迫时也体现了强适应能力,凭借出芽繁殖的方式保障细菌的正常繁殖生长[29]。而其余物种均属于放线菌与变形门细菌,这些物种在A1、A2中生长良好,但一旦长期暴露在次氯酸钠消毒条件中,则会遭到抑制。因此,次氯酸钠消毒对于放线菌与变形门类细菌控制有效[30],但对于浮霉菌几乎没有控制效果。
-
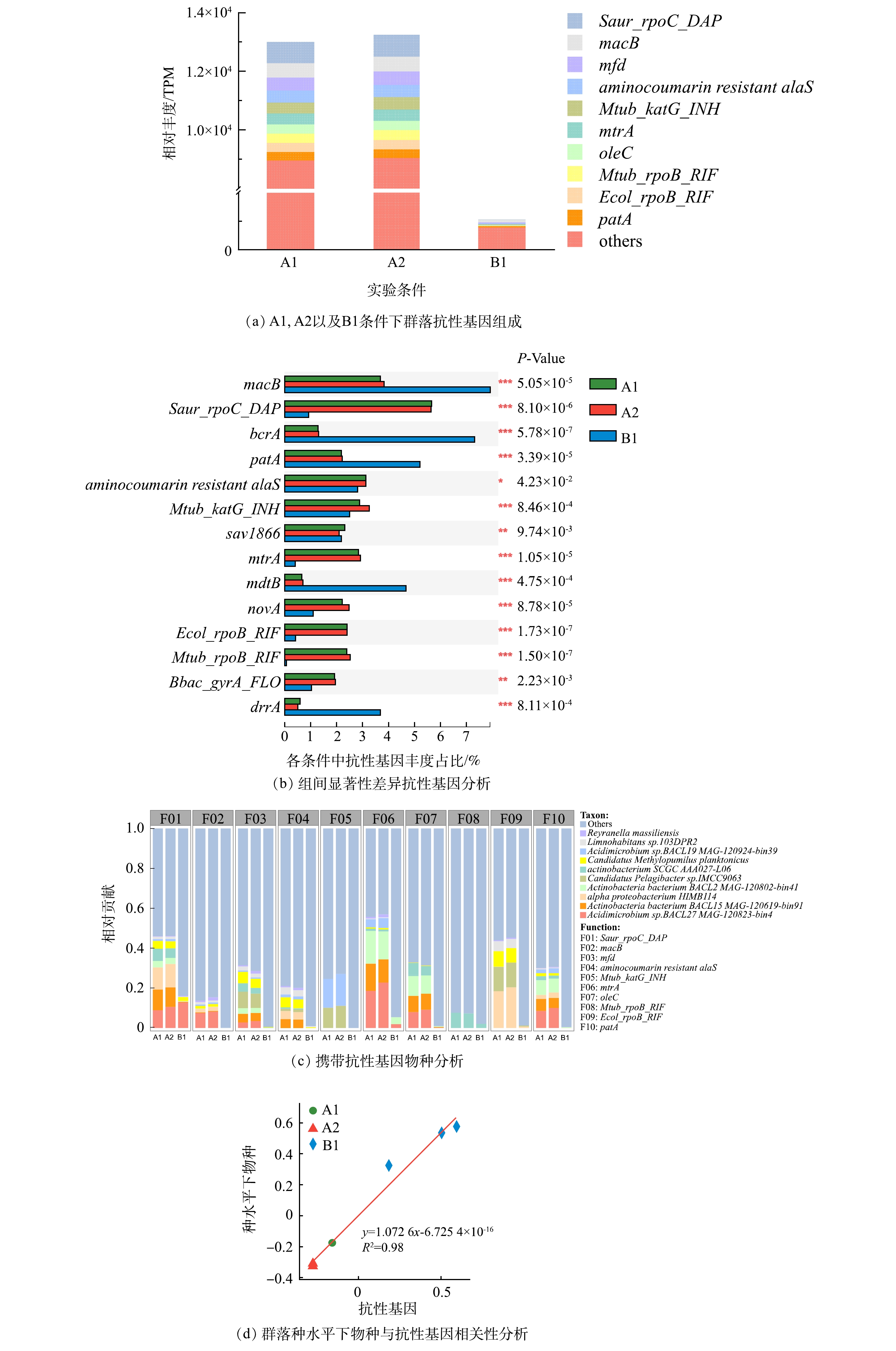
1)群落的抗性基因。与群落组成类似,添加2 μg·L−1磺胺甲恶唑对生物膜上抗性基因丰度影响不明显(图3(a))。在生物膜细菌群落的抗性基因中,Saur_rpoC_DAP、macB、mfd、aminocoumarin resistant alaS、Mtub_katG_INH、mtrA、oleC、Mtub_ropB_RIF、Ecol_ropB_RIF、patA是主要的ARGs类型(图3(a))。在同样添加磺胺甲恶唑的管道中,采取次氯酸钠消毒使得ARGs总量下降了91.9%,这表明消毒对于抗性基因有很好的控制效果。在差异性基因中,消毒条件中丰度占比较高的抗性基因分别是macB、bcrA、patA、mdtB与drrA(图3(b))。而携带抗性基因的细菌主要是Acidimicrobium sp. BACL27 MAG-120823-bin4、Actinobacteria bacterium BACL15 MAG-120619-bin91、alpha proteobacterium HIMB114、Actinobacteria bacterium BACL2 MAG-120802-bin41、actinobacterium SCGC AAA027-L06(图3(c))。这些细菌在各条件中的丰度也处于一个较高的水平,因此,产生抗性基因的一个原因可能是细菌本身能很好的适应生存环境。这一点在携带差异性基因的物种上也有很好的体现,例如未消毒条件中携带差异性抗性基因(macB、patA)的细菌Acidimicrobium sp.BACL27 MAG-120823-bin4和Actinobacteria bacterium BACL15 MAG-120619-bin91在消毒后数量明显下降(图1(b)),该2种抗药基因消毒后同样下降明显。同时,抗性基因与物种的相关性分析也进一步表明物种与抗性基因在不同条件下的变化存在很好的相关性(R2 > 0.8)( 图3(d))。因此,以上结果说明消毒对抗性基因的控制效果很大程度体现在对细菌的控制上。
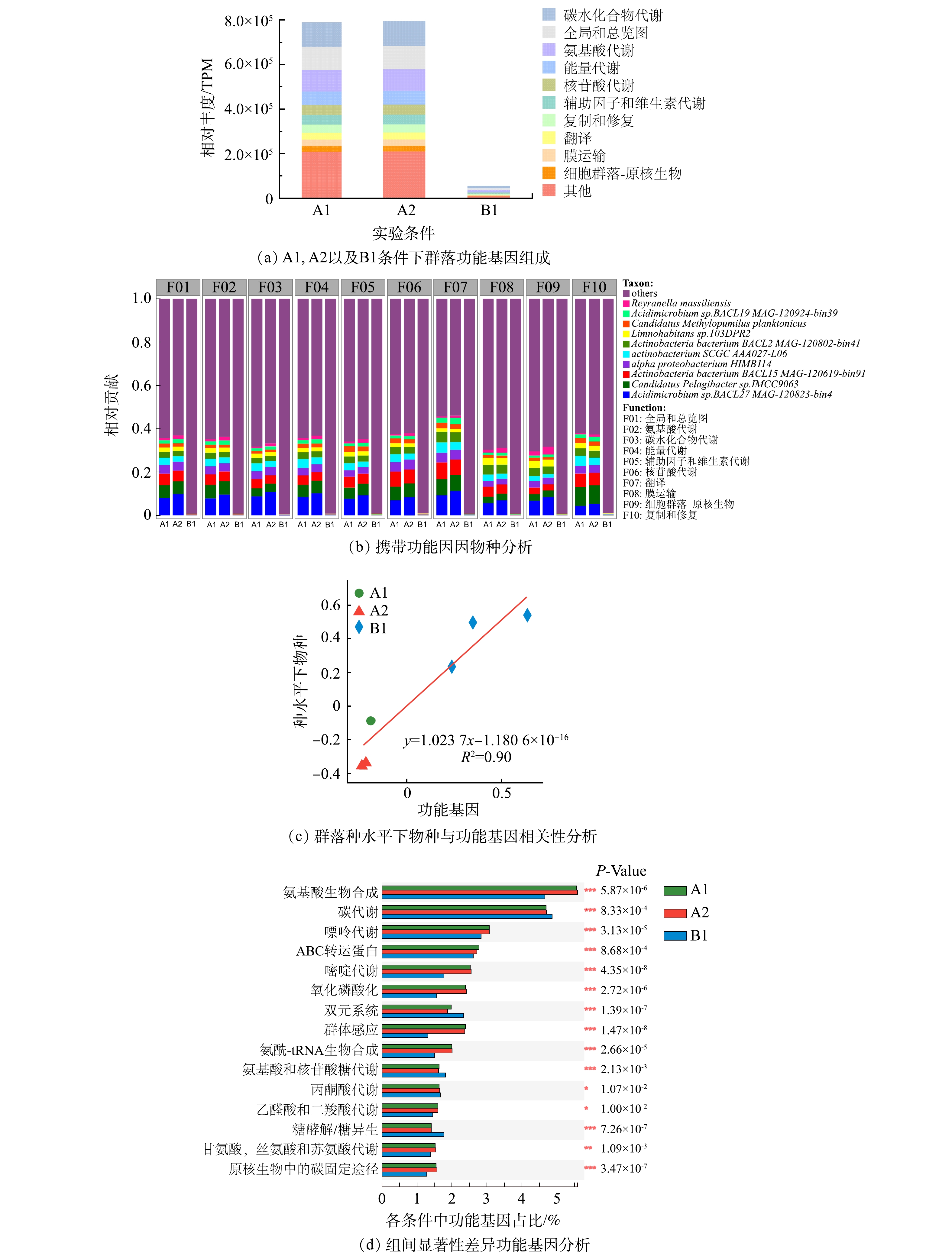
2)群落功能基因。微生物群落的功能基因包括碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子和维生素的代谢、核苷酸代谢、脂质代谢、信号转导、复制和修复以及翻译等(图4(a))。除信号转导外,部分功能基因的占比在加入磺胺甲恶唑后略有上升。而NaClO消毒使这些功能基因明显减少,这一结果与以前的研究结果一致[31]。
另外,对不同功能基因贡献度靠前的细菌与携带耐药性基因的细菌几乎一致(图4(b))。在A1、A2与B1群落的功能基因组成中,碳水化合物代谢类的功能基因占比分别为13.8%、13.9%和15.8%,在消毒处理后细菌的碳水化合物代谢基因水平出现了上升,说明面对消毒带来的环境胁迫压力时,生物膜中细菌可以通过调整碳水化合物相关过程的代谢来进行响应;与此类似的还有辅助因子与维生素相关的代谢,群落在面临消毒时同样出现了上调的现象,A1、A2和B1条件下该功能基因占比分别为5.47%、5.45%和6.75%。与此同时,功能基因与物种的相关性分析同样说明不同条件下物种丰度与功能基因变化表现出很好的相关性 (R2>0.8)(图4(c))。因此,细菌抗性基因的变化极有可能是与功能基因的变化趋势一致。
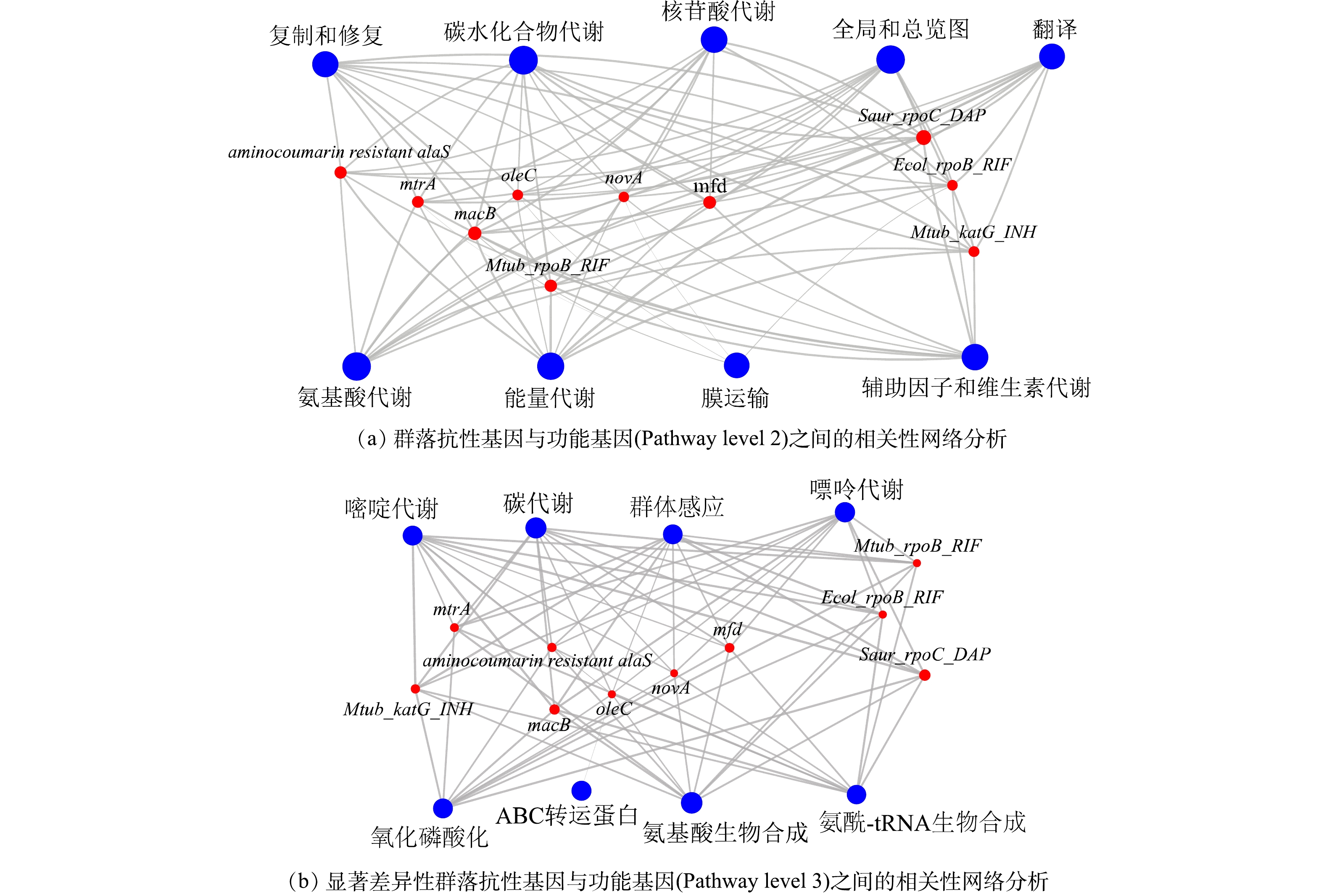
3)群落功能基因与抗性基因之间的关系。对丰度前十的群落功能基因在KEGG二级通路上与抗性基因进行相关性网络分析后,我们发现抗性基因与每一大类的功能基因之间存在不同程度的正相关性(图5(a))。在对显著性差异的ARGs与KEGG三级通路的功能基因进一步分析后,发现存在显著性差异的抗性基因与功能基因((图3(d)与(图4(d))之间仍然存在相似结果,即每一种抗性基因均与各种的功能基因有着不同程度的正相关关系(图5(b))。这一结果表明次氯酸钠是通过改变物种并影响其功能基因进而改变抗性基因的丰度。很多研究中都报道了功能基因对于耐药性基因的形成存在影响,例如中心碳代谢功能影响结核分枝杆菌的耐药性[32],群体感应影响耐药性基因的产生[33]。与此同时,当环境压力改变细菌群落组成时[34],物种功能基因往往也会进行改变[35]。因此,当次氯酸钠消毒显著引起生物膜群落变化时,群落中微生物的功能基因也发生了相应的变化,最终也会影响其耐药性基因的形成。
在图5(b)中,抗性基因oleC是唯一与ABC转运蛋白功能基因呈正相关关系。细菌在某些应激条件下产生细菌素和微毒素会对周围物种产生一定的抗菌活性以便自身生存,而ABC转运蛋白能够帮助细菌通过免疫蛋白或者转运等方式保护自己[36]。在A1、A2中oleC主要存在于放线菌门的细菌中,在添加磺胺后oleC的丰度占比上升了0.14%(图3(b)),但放线菌门的细菌的丰度却出现了下降(图1(a))。因此,磺胺甲恶唑可能作为外源性刺激物质造成ABC转运蛋白功能水平的上升,进而赋予携带oleC抗性基因物种更强的生存优势并最终使得oleC抗性基因保持更高的丰度水平,同时研究证明由oleC的抗生素抗性效果源自ABC-转运体的外排转运系统[37]。但由于放线菌门的细菌并不能适应长期的消毒,导致其细菌丰度下降,进而使得功能基因与抗性基因也出现相同的趋势。因此,oleC抗性基因的产生与细菌功能基因的关系紧密。除oleC外,其他抗性基因均与各类功能基因存在正相关性,包括氨基酸生物合成,碳代谢,嘌呤代谢,嘧啶代谢,氧化磷酸化,群体感应以及氨基酸-tRNA的生物合成等。早先的研究证明了不同的输配水系统条件所施加的选择压力影响群落结构以及功能特性和代谢潜力水平的变化[38],因此,当群落处于长期消毒时,群落的组成发生变化,上述类型的功能基因与抗性基因也随之变化。
-
1) 2 μg·L−1磺胺甲恶唑的添加对生物膜细菌群落结构组成无明显影响,次氯酸钠消毒对不同细菌包括变形菌门和放线菌门有很好的控制效果,但浮霉菌门与厚壁菌门细菌表现出很强的抗次氯酸钠消毒能力。
2)在未消毒条件中丰度前10的抗性基因(包括Saur_rpoC_DAP、macB、mfd、aminocoumarin resistant alaS、Mtub_katG_INH、mtrA、oleC、Mtub_ropB_RIF、Ecol_ropB_RIF、patA)在次氯酸钠消毒后含量下降明显,ARGs总量下降了91.9%,同时携带差异性抗性基因(macB、patA)的细菌在消毒后数量也出现明显下降,因此,次氯酸钠消毒通过控制携带抗性基因物种从而有效控制抗性基因传播。
3)抗性基因的形成与细菌功能代谢变化有关。组间显著性差异的功能基因(包括氨基酸生物合成、碳代谢、嘌呤代谢、嘧啶代谢、氧化磷酸化、群体感应以及氨基酸-tRNA的生物合成)与组间显著性差异的抗性基因存在良好的正相关关系。因此,长期消毒改变了细菌群落组成及其功能,并最终影响抗性基因传播。
微量磺胺甲恶唑对饮用水管网生物膜群落及抗性基因的影响与控制
Influence of micro-sulfamethoxazole on the biofilm bacterial communities and antibiotic resistance genes in drinking water distribution systems and its control
-
摘要: 针对饮用水管网系统可能存在的微生物风险问题,采用模拟不同处理条件下的输配水管道系统,通过宏基因组学分析探究微量磺胺甲恶唑以及次氯酸钠消毒对管道中生物膜与抗性基因组成的影响。结果表明,2 μg·L−1磺胺甲恶唑的添加对微生物群落以及抗性基因组成无明显影响,而浮霉菌门细菌表现出很强的抗次氯酸钠消毒能力。在未消毒条件下丰度前十的抗性基因与携带差异性抗性基因的细菌在消毒后丰度均明显有所下降,次氯酸钠消毒使ARGs总量下降了91.9%,因此,次氯酸钠消毒通过控制携带抗性基因物种从而有效控制群落抗性基因的传播。同时,通过组间显著性差异的功能基因与组间显著性差异的抗性基因相关性分析,功能基因的变化情况与抗性基因变化情况一致,因此,长期消毒改变了细菌群落组成及其功能,并最终影响抗性基因传播。这项研究有助于控制长期运行的饮用水管网输配系统中可能存在的包括抗药基因在内的微生物相关风险问题。Abstract: For the microbial risk in the water of drinking water distribution systems (DWDSs), metagenomic analysis was used to investigate the effects of micro-sulfamethoxazole and NaClO disinfection on biofilm bacterial communities and antibiotic resistance genes (ARGs) in the simulated DWDSs under different treatments. The experimental results showed that the bacterial communities and ARGs did not change significantly with addition of 2 μg-L−1 sulfamethoxazole, while the bacteria of Planctomycetes at phylum level showed a strong resistance to NaClO. The abundance of top ten ARGs and the bacteria carrying differential ARGs detected before disinfection both decreased significantly after disinfection. The total abundance of ARGs decreased by 91.9% due to the influence of NaClO. Therefore, the spread of ARGs was controlled by the NaClO disinfection because of its inhibition on the bacterial species carrying ARGs growth. Meanwhile, the correlation analysis between function genes and ARGs with significant differences among groups showed that the changes in function genes were consistent with changes in ARGs. Therefore, long disinfection changed the bacterial communities and their function, which affected the propagation of different ARGs. This study was contributed to the control of possible microbial risk including the ARGs in the water of long-running DWDSs.
-

-
-
[1] HOZALSKI R M, LAPARA T M, ZHAO X, et al. Flushing of stagnant premise water systems after the COVID-19 shutdown can reduce infection risk by Legionella and Mycobacterium spp[J]. Environmental Science & Technology, 2020, 54(24): 15914-15924. [2] 张明露, 周贺, 关磊等. 饮用水配水系统中微生物研究方法的进展[J]. 环境与健康杂志, 2015, 32(5): 458-462. doi: 10.16241/j.cnki.1001-5914.2015.05.024 [3] TANG W, LI Q, CHEN L, et al. Biofilm community structures and opportunistic pathogen gene markers in drinking water mains and the role of pipe materials[J]. ACS ES& T. Water, 2021, 1(3): 630-640. [4] 祝泽兵, 裴云燕, 单莉莉等. 供水管网生物膜中微生物种间相互作用及其影响因素综述[J/OL]. 环境工程: 1-15[2023-03-17]. http://kns.cnki.net/kcms/detail/11.2097.X.20221123.0807.002.html. [5] SIDHU J P S, GUPTA V V S R, STANGE C, et al. Prevalence of antibiotic resistance and virulence genes in the biofilms from an aquifer recharged with stormwater[J]. Water Research, 2020, 185: 0043-1354. [6] LIANG J, MAO G, YIN X, et al. Identification and quantification of bacterial genomes carrying antibiotic resistance genes and virulence factor genes for aquatic microbiological risk assessment[J]. Water Research, 2020, 168: 115160. doi: 10.1016/j.watres.2019.115160 [7] CIOFU O, MOSER C, JENSEN P Ø, et al. Tolerance and resistance of microbial biofilms[J]. Nature Reviews Microbiology, 2022, 20: 621-635. doi: 10.1038/s41579-022-00682-4 [8] 钟丹, 周子仪, 马文成等. 供水管网中抗生素抗性基因环境风险浅析[J]. 给水排水, 2020, 56(S2): 59-63. doi: 10.13789/j.cnki.wwe1964.2020.S2.010 [9] LI J, ZHAO L, FENG M, et al. Abiotic transformation and ecotoxicity change of sulfonamide antibiotics in environmental and water treatment processes: A critical review[J]. Water Research, 2021, 202: 117463. doi: 10.1016/j.watres.2021.117463 [10] YIN R, GUO W, REN N, et al. New insight into the substituents affecting the peroxydisulfate nonradical oxidation of sulfonamides in water[J]. Water Research, 2020, 171: 115374. doi: 10.1016/j.watres.2019.115374 [11] ZHANG B, QIN S, GUAN X, et al. Distribution of antibiotic resistance genes in Karst River and its ecological risk[J]. Water Research, 2021, 203: 117507. doi: 10.1016/j.watres.2021.117507 [12] ZHANG Z, WANG Y, CHEN B, et al. Xenobiotic pollution affects transcription of antibiotic resistance and virulence factors in aquatic microcosms[J]. Environmental Pollution, 2022, 306: 119396. doi: 10.1016/j.envpol.2022.119396 [13] LIN Q, LI L, FANG X, et al. Substrate complexity affects the prevalence and interconnections of antibiotic, metal and biocide resistance genes, integron-integrase genes, human pathogens and virulence factors in anaerobic digestion[J]. Journal of Hazardous Materials, 2022, 438: 129441. doi: 10.1016/j.jhazmat.2022.129441 [14] TANG T, CHEN Y, DU Y, et al. Effects of functional modules and bacterial clusters response on transmission performance of antibiotic resistance genes under antibiotic stress during anaerobic digestion of livestock wastewater[J]. Journal of Hazardous Materials, 2023, 441: 129870. doi: 10.1016/j.jhazmat.2022.129870 [15] WANG H, EDWARDS M. A, FALKINHAM J. O 3RD, et al. Probiotic approach to pathogen control in premise plumbing systems? A review[J]. Environmental Science & Technology, 2013, 47(18): 10117-10128. [16] LU Z, SUN W, LI C, et al. Bioremoval of non-steroidal anti-inflammatory drugs by Pseudoxanthomonas sp. DIN-3 isolated from biological activated carbon pro`cess[J]. Water Research, 2019, 161: 459-472. doi: 10.1016/j.watres.2019.05.065 [17] 陈蕾. 污水中抗生素抗性菌及抗性基因的去除技术. 污水中抗生素抗性菌及抗性基因的去除技术[J]. 生态环境学报, 2018, 27(11): 2163-2169. [18] LI B, QIU Y, ZHANG J, et al. Real-time study of rapid spread of antibiotic resistance plasmid in biofilm using microfluidics[J]. Environmental Science & Technology, 2018, 52(19): 11132-11141. [19] FARHAT N, KIM L, MINETA K, et al. Seawater desalination based drinking water: Microbial characterization during distribution with and without residual chlorine[J]. Water Research, 2022, 210: 117975. doi: 10.1016/j.watres.2021.117975 [20] 付树森, 王艺, 王肖霖, 等. 氯和紫外消毒过程中胞外抗性基因的产生特征[J]. 中国环境科学, 2021, 41(10): 4756-4762. doi: 10.3969/j.issn.1000-6923.2021.10.032 [21] LU Z, JING Z, HUANG J, et al. Can we shape microbial communities to enhance biological activated carbon filter performance?[J]. Water Research, 2022, 212: 118104. doi: 10.1016/j.watres.2022.118104 [22] 李晓明, 王飞, 李建勇等. 饮用水中抗生素污染现状及降解技术研究进展[J]. 食品安全导刊, 2016, 144(21): 94-95. doi: 10.16043/j.cnki.cfs.2016.21.069 [23] 钟文辉, 曹一鸣, 肖露等. 自来水厂次氯酸钠消毒技术应用总结[J]. 清洗世界, 2022, 38(6): 93-96. [24] 漆文光. 自来水厂采用次氯酸钠替代液氯消毒效果研究[J]. 供水技术, 2019, 13(3): 43-47. [25] GOMEZ-SMITH C K, LAPARA T M, HOZALSKI R M. Sulfate reducing bacteria and Mycobacteria dominate the biofilm communities in a chloraminated drinking water distribution system[J]. Environmental Science & Technology, 2015, 49(14): 8432-8440. [26] POTGIETER S, DAI Z, HAVENGA M, et al. Reproducible microbial community dynamics of two drinking water systems treating similar source waters[J]. ACS. ES& T. Water, 2021, 1(7): 1617-1627. [27] THOM C, SMITH C J, MOORE G, et al. Microbiomes in drinking water treatment and distribution: A meta-analysis from source to tap[J]. Water Research, 2022, 212: 118106. doi: 10.1016/j.watres.2022.118106 [28] BORSETTO C, RAGUIDEAU S, TRAVIS E, et al. Impact of sulfamethoxazole on a riverine microbiome[J]. Water Research, 2021, 201: 117382. doi: 10.1016/j.watres.2021.117382 [29] CHEN J, YANG Y, LIU Y, et al. Bacterial community shift in response to a deep municipal tail wastewater treatment system[J]. Bioresource Technology, 2019, 281: 195-201. doi: 10.1016/j.biortech.2019.02.099 [30] 韩雪, 孙坚伟, 张力等. 紫外氯胺组合消毒供水系统中病毒微生物的分布特征[J]. 环境科学, 2021, 42(2): 860-866. doi: 10.13227/j.hjkx.202007039 [31] WANG Y H, WU Y H, LUO L W, et al. Metagenomics analysis of the key functional genes related to biofouling aggravation of reverse osmosis membranes after chlorine disinfection[J]. Journal of Hazardous Material, 2021, 410: 124602. doi: 10.1016/j.jhazmat.2020.124602 [32] EOH H, LIU R, LIM J, et al. Microbial characterization during distribution with and without residual chlorine[J]. Frontiers in Cellular and Infection Microbiology, 2022, 12: 958240. doi: 10.3389/fcimb.2022.958240 [33] WANG M, LIAN Y, WANG Y, et al. The role and mechanism of quorum sensing on environmental antimicrobial resistance[J]. Environmental Pollution, 2023, 322: 121238. doi: 10.1016/j.envpol.2023.121238 [34] ZOU S, ZHANG Q, ZHANG X, et al. Environmental factors and pollution stresses select bacterial populations in association with protists[J]. Frontiers in Marine Science, 2020, 7: 659. doi: 10.3389/fmars.2020.00659 [35] MORRISSEY K, IVESA L, DELVA S, et al. Impacts of environmental stress on resistance and resilience of algal-associated bacterial communities[J]. Ecology and Evolution, 2021, 11: 15004-15019. doi: 10.1002/ece3.8184 [36] SMITS S H J, SCHMITT L, BEIS K. Self-immunity to antibacterial peptides by ABC transporters[J]. FEBS Letters, 2020, 594: 3920-3942. doi: 10.1002/1873-3468.13953 [37] AHMED M S, LAUERSEN K J, IKRAM S, et al. Efflux transporters' engineering and their application in microbial production of heterologous metabolites[J]. ACS Synthetic Biology, 2021, 10,4: 646-669. [38] GOMEZ-ALVAREZ, SIPONEN S, KAUPPINEN A, et al. A comparative analysis employing a gene- and genome-centric metagenomic approach reveals changes in composition, function, and activity in waterworks with different treatment processes and source water in Finland[J]. Water Research, 2023, 229: 119495. doi: 10.1016/j.watres.2022.119495 -



 下载:
下载: