-
作为新型脱氮工艺,anammox因其无需外加碳源和曝气、负荷高等优点而受到广泛关注[1-2]。颗粒污泥沉降性能好、生物活性高、抗冲击负荷强。但anammox菌的生长容易受到温度、pH、底物浓度等外界环境因素干扰,从而导致anammox工艺启动难度较大。Anammox颗粒污泥反应器的快速启动是其工程化应用的重要前提。
群体感应(quorum sensing,QS)是指微生物自发合成并释放信号分子,浓度达阈值后被细胞感知并调控相关基因的表达[3],如生物膜的形成、毒力因子的表达、生物发光[4]等。Anammox菌代谢过程中合成并分泌AHLs信号分子,通过调控相关功能基因的表达、胞外聚合物 (extracellular polymeric substance,EPS) 合成等生理行为,最终影响微生物聚集体形成,即AHLs介导QS以调控EPS含量和组成,从而诱导anammox体系中的污泥颗粒化[5]。
LIU等[6]发现anammox菌释放的信号分子中C6-HSL和C8-HSL浓度最高。C6-HSL可改善颗粒的活性,C8-HSL对颗粒的稳定性和沉降性起着关键作用[7]。ZHANG[8]通过在UASB反应器中添加150 μmol·L−1 C6-HSL,使得anammox颗粒污泥的活性提高了16%,达到了1.08 kg·kg−1·d−1 (以每天每千克悬浮物消耗N的质量计) 。HAN等[9]发现C8-HSL在总氮容积负荷为1.68 kg·m−3·d−1的条件下,促进了紧密结合型EPS的蛋白质 (protein,PN) 分泌,提高了污泥的沉降性。张向晖等[10]向升流式厌氧污泥床 (upflow anaerobic sludge blanket,UASB) 反应器中分别添加C6-HSL和C8-HSL,发现质量浓度为0.5 g·L−1的AHLs会抑制anammox菌群生长,但能提高其脱氮性能,并显著促进hzs A的表达。目前,较多研究集中在C6-HSL或C8-HSL单独投加对anammox工艺脱氮性能等方面的影响。但在实际体系中,C6-HSL和C8-HSL同时存在,因此,本研究选择联合投加C6-HSL和C8-HSL以探究其对anammox颗粒污泥工艺启动的影响。
本研究在UASB反应器中接种污水厂剩余污泥和anammox污泥以启动anammox颗粒污泥系统,再联合投加外源信号分子C6-HSL和C8-HSL,通过定期检测并分析进出水氮的质量浓度、沉降指标、EPS质量浓度、污泥粒径、功能基因相对丰度、AHLs质量浓度等以探究外加AHLs对anammox污泥颗粒化过程的作用及其对anammox菌活性和富集的影响,以期为anammox颗粒污泥工艺的启动提供参考。
-
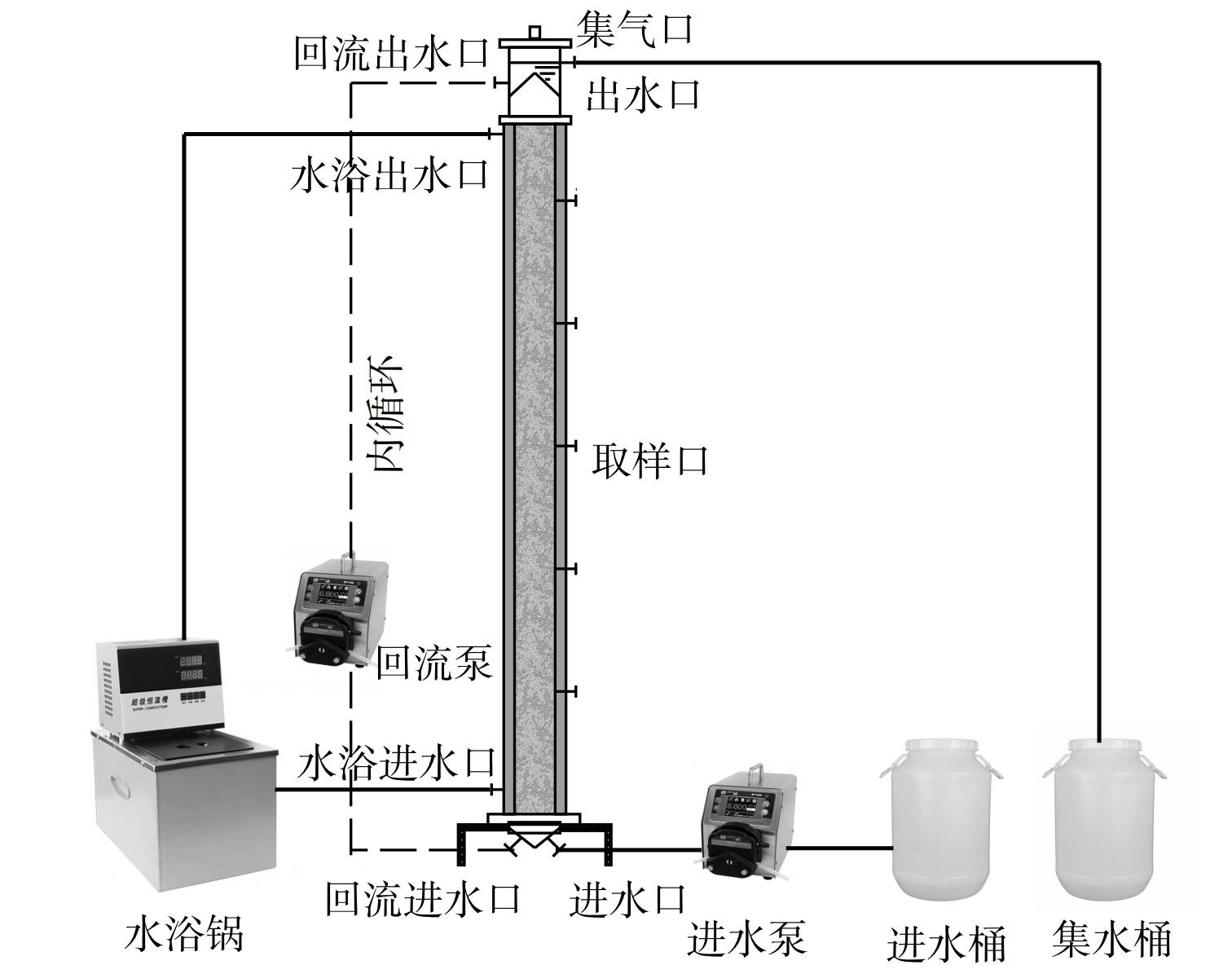
本实验系统主要由UASB反应器、蠕动泵、水浴加热装置、进水箱、集水箱等组成 (图1) 。UASB反应器主体为有机玻璃材质,内径9 cm,高径比15∶1,体积10 L,有效体积8.6 L。从下至上每24 cm设置一个取样口。整套装置气密性良好,三相分离器与反应器顶盖为一体。反应器外有水浴层,水浴控制在 (35±1) °C。利用蠕动泵进水和内循环控制上升流速在6 m·h−1。
-
本实验的接种污泥为污水厂剩余污泥和anammox污泥的混合污泥,两者质量比为2∶1。剩余污泥取自天津市津南污水处理厂,anammox污泥取自1 m3的厌氧序批式反应器 (anaerobic sequencing batch reactor,ASBR) 。接种后混合液污泥浓度 (MLSS) 为3.0 g·L−1,混合液挥发性悬浮固体浓度 (MLVSS) 为1.6 g·L−1,MLVSS/MLSS为0.53。
-
实验所用模拟废水采用自来水人工配置,氨氮 (NH4+-N) 和亚硝氮 (NO2−-N) 分别来源于硫酸铵 ((NH4)2SO4) 和亚硝酸钠 (NaNO2) 。NO2−-N与NH4+-N质量浓度之比为1.3,按需进行配制。矿物成分为碳酸氢钠 (NaHCO3) 0.5 g·L−1、磷酸二氢钾 (KH2PO4) 0.027 g·L−1、氯化钙 (CaCl2) 0.18 g·L−1、七水合硫酸镁 (MgSO4·7H2O) 0.1 g·L−1。此外,加入微量元素Ⅰ、Ⅱ溶液[11],体积浓度为1 mL·L−1,用高纯氮气吹扫配水至少10 min,以除去溶解氧,并用1 mol·L−1盐酸 (HCl) 调节pH至7.5~8.0。
-
UASB反应器共运行92 d,分为4个阶段。氨氮去除率增长至稳定后即可进入下一阶段。从第13天开始,向反应器R1投加0.1 μmol·L−1的C6-HSL和0.1 μmol·L−1的C8-HSL,向反应器R2投加0.2 μmol·L−1的甲醇做对照[12]。不同阶段的时间、进水TN、水力停留时间 (HRT) 如表1所示。反应器R1和R2运行工况相同。
-
1) 常规项目及测试方法。每天取1次出水水样,经0.45 μm滤膜过滤后,放入4°C冰箱保存。按《水和废水监测分析方法》[13]中的分析方法测定水质指标:采用纳氏试剂-紫外分光光度比色法测定氨氮质量浓度;采用N - (1-萘基) -乙二胺分光光度法测定亚硝氮质量浓度;采用紫外分光光度法测定硝氮质量浓度;采用重量法测定MLSS;采用马弗炉燃烧-重量法测定MLVSS。污泥体积指数 (SVI5) 根据污泥的MLSS和污泥沉降比 (SV5) 计算得出。
2) 污泥粒径。颗粒污泥粒径采用湿氏筛分法测定。取50 mL泥水混合物,依次通过孔径为2.00、0.90、0.45、0.15 mm的不锈钢网筛,利用MLSS的测定方法分别测定不同粒径范围的质量,并计算其所占的百分比[11]。
3) EPS提取及测定。对污泥中EPS进行提取,提取后的EPS进行PN、多糖 (polysaccharide,PS) 的测定[14]。PN采用Lowry法试剂盒测定,以牛血清蛋白为标准物质,于550 nm波长下用紫外分光光度计进行测定,根据样品的吸光度和标准曲线计算PN浓度。PS采用苯酚-浓硫酸法测定,以葡萄糖为标准物质,在490 nm波长处测定吸光度,根据样品的吸光度和标准曲线计算PS浓度。
4) 群体感应物质的测试。在各阶段末期进行泥相的群体感应物质的测试,对泥相进行预处理。预处理步骤为:取一定量污泥在-80 ℃下冷冻干燥24 h。称一定量干污泥于50 mL离心管中,每次加入10 mL乙酸乙酯,振荡20 min,离心,取上清液过0.45 μm滤膜 (重复3次) ,加入1 mL 1 mol·L−1 HCl,分装至500 mL试剂瓶中,进行固相萃取,浓缩至1 mL,过0.22 μm滤膜后用超高效液相色谱质谱联用 (UPLC-MS) 测定其浓度[6]。
5) 污泥DNA提取。为探究微生物群落的变化,在不同阶段末取污泥样品提取DNA。将冻存的样品在室温下化冻后,于转速3 000 r·min−1离心10~20 min后,弃去上清液作为提取DNA的基质样品,采用E.Z.N.A. Soil DNA Kit试剂盒 (Omega, Norcross,GA,USA) 提取污泥总DNA。将所得DNA提取物-20 ℃冻存。
6) 实时定量PCR (qPCR) 反应。提取的DNA样品为待测样品,通过qPCR测定16S rRNA基因与功能基因的相对丰度,用荧光染料SYBR-GreenⅡ检测qPCR。qPCR程序在95 ℃变性2 min后开始,然后进行40个循环,每个循环包括变性95 ℃ 5 s,退火温度60 s和72 ℃延伸30 s。不同基因的引物和退火温度见表2。该反应在型号为BIO-RAD MJ MiniTM的机器上运行,联机以CFX Manager Software进行实时数据采集与分析。
7 )高通量测序。提取完的DNA样品为待测样品,以16S V4区引物 (515F和806R) 经过PCR扩增,产物纯化,文库制备及库检后进行HiSeq上机测序。通过对Reads拼接过滤、OTUs (Operational Taxonomic Units) 聚类进行物种注释及丰度分析,揭示样品物种构成。
-
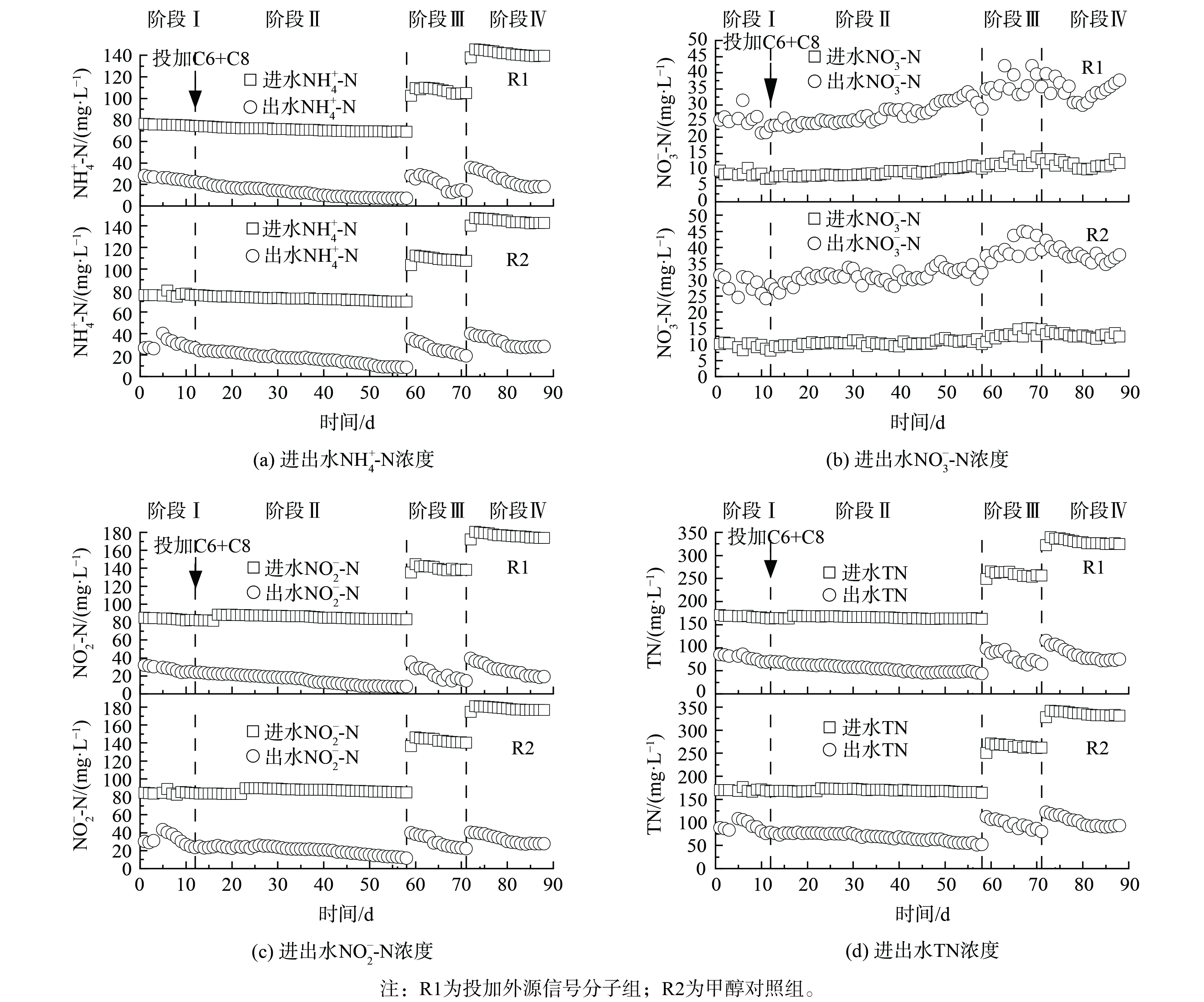
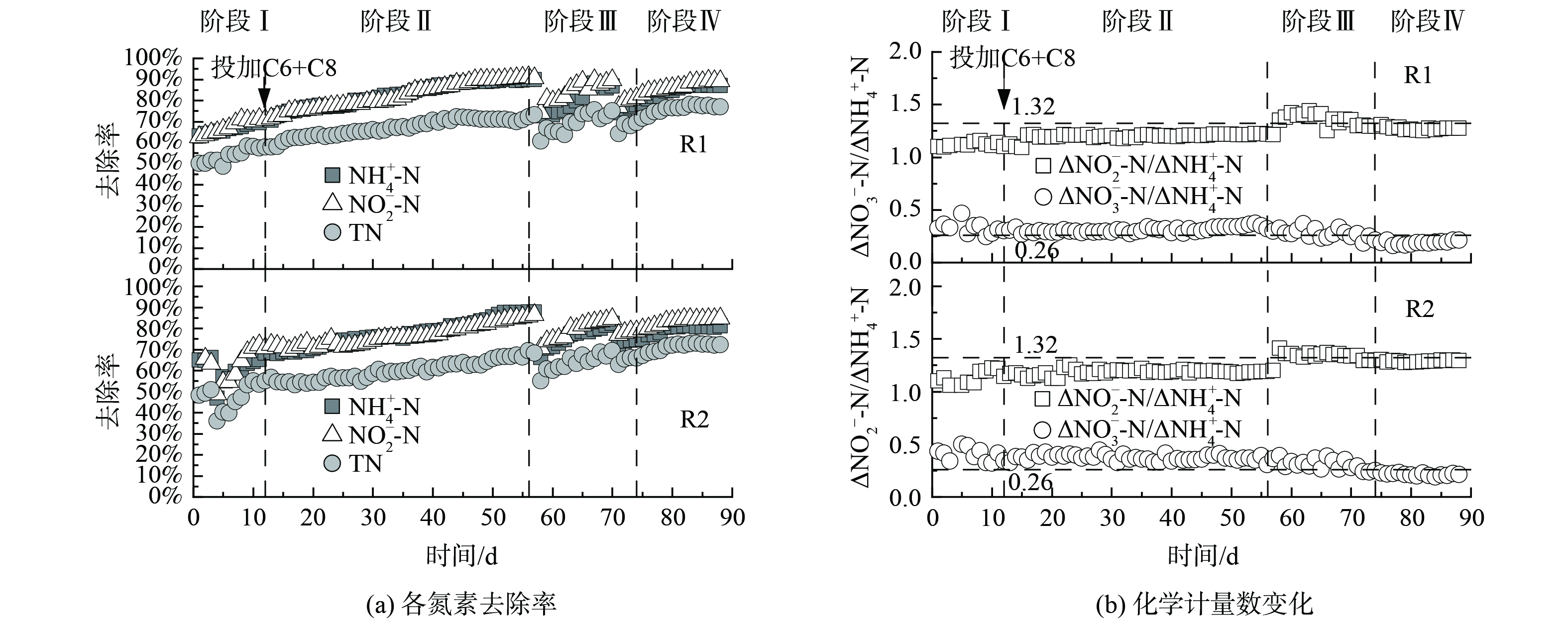
在阶段Ⅰ,进水TN为165 mg·L−1。由图2可知,R1中NH4+-N、NO2−-N和TN去除率逐渐增加,R2由于反应器故障,在第4天NH4+-N、NO2−-N出水质量浓度突然增加,之后NH4+-N、NO2−-N和TN去除率逐渐增加。在阶段Ⅰ,R1的TN去除率高于R2,对R1和R2的TN去除率进行独立样本T分析,得出R1有显著的脱氮优势 (p<0.05) 。
从阶段Ⅱ开始R1投加0.1 μmol·L−1 C6-HSL和0.1 μmol·L−1 C8-HSL,R2投加等量的甲醇,进水TN为232 mg·L−1 (实际反应器周期初始质量浓度165 mg·L−1) 。随着反应器的持续运行,脱氮性能逐渐增强,R1、R2中NH4+-N、NO2−-N和TN去除率显著增加 (p<0.05) 。在阶段Ⅱ末,R1的NH4+-N、NO2−-N和TN去除率分别达到89.88%、90.50%和73.15%,NO3−-N生成量为18.48 mg·L−1;R2的NH4+-N、NO2−-N和TN去除率分别达到87.75%、86.33%和68.22%,NO3−-N生成量为22.07 mg·L−1。图3表明,该过程中R1、R2的化学计量数ΔNO2−-N/ΔNH4+-N均值分别为1.18、1.16,ΔNO3−-N/ΔNH4+-N均值分别为0.31、0.38。投加信号分子后,NH4+-N的去除量以及NO3−-N的生成量均高于理论值。这可能是由于当反应器出水DO为1.04~1.56时,硝化细菌利用DO和基质发生硝化作用,消耗了部分NH4+-N,从而生成NO3−-N[12]。
在阶段Ⅲ,提升进水TN至270 mg·L−1。在该阶段初期,反应器脱氮性能下降,随着反应器的持续运行,脱氮性能逐渐恢复。R1、R2中化学计量数ΔNO2−-N/ΔNH4+-N和TN去除率逐渐增加。在阶段Ⅲ末,R1的NH4+-N、NO2−-N和TN去除率分别达到86.86%、89.55%和75.07%,NO3−-N的生成量为22.47 mg·L−1;R2的NH4+-N、NO2−-N和TN去除率分别达到82.37%、84.39%和69.49%,NO3−-N的生成量为24.62 mg·L−1。该过程中R1的化学计量数ΔNO2−-N/ΔNH4+-N均值为1.37,高于理论值 (1.32) ,ΔNO3−-N/ΔNH4+-N均值为0.29,高于理论值 (0.26) ;R2的化学计量数ΔNO2−-N/ΔNH4+-N均值为1.36,ΔNO3−-N/ΔNH4+-N均值为0.32。由此可见,投加信号分子更有利于体系脱氮主反应向anammox方向发展。R1的TN去除率可达到70%以上,提高进水TN之后,在13 d内可恢复,而R2的TN去除率仍在70%以下,这说明投加C6-HSL和C8-HSL有利于体系脱氮性能的恢复。
在阶段Ⅳ,继续提升进水TN至350 mg·L−1,R1、R2中NH4+-N、NO2−-N和TN去除率显著增加 (p<0.05) 。在阶段Ⅳ末,R1的NH4+-N、NO2−-N和TN去除率分别达到87.09%、89.13%和76.83%,NO3−-N的生成量为25.68 mg·L−1;R2的NH4+-N、NO2−-N和TN去除率分别达到81.07%、84.70%和72.18%,NO3−-N的生成量为24.68 mg·L−1。该过程中R1和R2的化学计量数ΔNO2−-N/ΔNH4+-N均值分别为1.28、1.29,ΔNO3−-N/ΔNH4+-N均值分别为0.20、0.22,均低于理论值。这可能是系统存在少量的硝化菌和反硝化菌降解NH4+-N和NO3−-N造成的。在投加C6-HSL和C8-HSL期间,R1中NH4+-N、NO2−-N、TN去除率均高于R2,故联合投加C6-HSL和C8-HSL有助于提高启动期氮的去除率。
-
在每个阶段末取一定量污泥检测其沉降性能和粒径分布。R1和R2的污泥质量浓度在3 g·L−1以下,R1和R2的MLSS均呈先下降后上升的趋势。呈下降的原因是启动期初期污泥没有形成稳定的颗粒,在上升流速形成的选择压力下,絮状污泥随出水流失。R1的SVI5从96.70降至44.10,R2的SVI5从104.90降至56.65。R1中污泥的SVI5低于R2,说明R1污泥的沉降性能更优[19]。这表明联合投加C6-HSL和C8-HSL有助于污泥沉降性能的改善 (p<0.05) ,且对污泥浓度有显著促进作用 (p<0.005) 。
一般来说,把颗粒粒径大于0.2 mm的污泥称为颗粒污泥[20]。颗粒污泥占比达到55%时,可认为颗粒污泥系统启动成功[21]。图4表明,在阶段Ⅱ末,R1中粒径>0.15 mm的污泥达到57.44%,这说明R1在第56天完成了anammox颗粒污泥系统启动。在启动期末,R2中粒径>0.15 mm的污泥所占比例仅为53.37%,这说明R2尚未完成anammox颗粒污泥系统启动。
粒径为0.45~0.90 mm时污泥脱氮效果及物理、生化性能最佳[22]。R1中粒径在0.45~0.90 mm的污泥占比从4.93%增至17.05%,增加了13.88%,而R2中粒径在0.45~0.90 mm的污泥占比从7.67%增至15.42%,增加了8.45%。随着各阶段进水基质浓度的提高,大颗粒污泥占比有所增加。这可能是由EPS的分泌及微生物群落结构变化而引起的。TANG[23]研究了外源添加信号分子对anammox颗粒污泥的影响,发现外源添加2 μmol·L−1的C6-HSL、C8-HSL使污泥的中位直径分别增加了8%、24%,从而促进了anammox污泥的颗粒化进程。该结果与本研究结果一致。R1中颗粒污泥的比例明显大于R2,故联合投加C6-HSL和C8-HSL可促进颗粒污泥的比例增加,从而加快了anammox污泥颗粒化进程。
-
本实验中EPS成分主要以PN为主,外源投加C6-HSL和C8-HSL可促进污泥EPS的分泌,特别是PN分泌,增加细胞表面的相对疏水性,可促进微生物的聚集生长。表3表明,随着进水TN逐渐增加,R1和R2的EPS质量浓度均逐渐增加。文献[24]指出EPS质量浓度的增加有利于anammox菌细胞间的互相粘附聚集及细胞交流进而促进颗粒污泥的形成,这与粒径分布的变化情况一致。PN为疏水性物质,PN/PS的提高可增强污泥的相对疏水性,从而触发污泥颗粒化的进程[25],使得微生物细胞更易于从水相中脱离出来并互相聚集[26]。
-
在每个阶段末取样检测AHLs的质量分数,启动期检测到4种AHLs信号分子,分别是C6-HSL、C8-HSL、C14-HSL、3-oxo-C14-HSL。图5表明,AHLs信号质量分数呈升高的趋势。R1中的C6-HSL在阶段Ⅰ末质量分数为248.90 ng·g−1。而在从阶段Ⅱ至阶段Ⅳ,C6-HSL质量分数分别为1 071.50、984.80、952.40 ng·g−1,虽稍有下降,但均比阶段Ⅰ增加近4倍,R1中的C8-HSL质量分数在阶段Ⅰ至阶段Ⅳ呈升高趋势。这说明通过联合投加C6-HSL和C8-HSL使水相中AHLs质量分数的增加达到QS系统的阈值,激活相关基因如编码AHLs合成酶[27]的基因LuxI的表达,进而释放出更多的AHLs。R2中C6-HSL质量分数在阶段Ⅰ至阶段Ⅳ分别为184.00、286.81、292.20、681.80 ng·g−1,其增加归因于内源C6-HSL合成并扩散到细胞外;R2中的C8-HSL质量分数始终保持在较低水平。AHLs从不同的方面影响anammox反应,如C6-HSL和C8-HSL会影响anammox反应的电子传输载体并促进EPS的分泌[23]。
C14-HSL和3-oxo-C14-HSL在R1和R2中均呈升高趋势,且R1中的质量分数高于R2,这说明外源投加的C6-HSL和C8-HSL可诱导其他信号分子在颗粒中持续内源性释放。
-
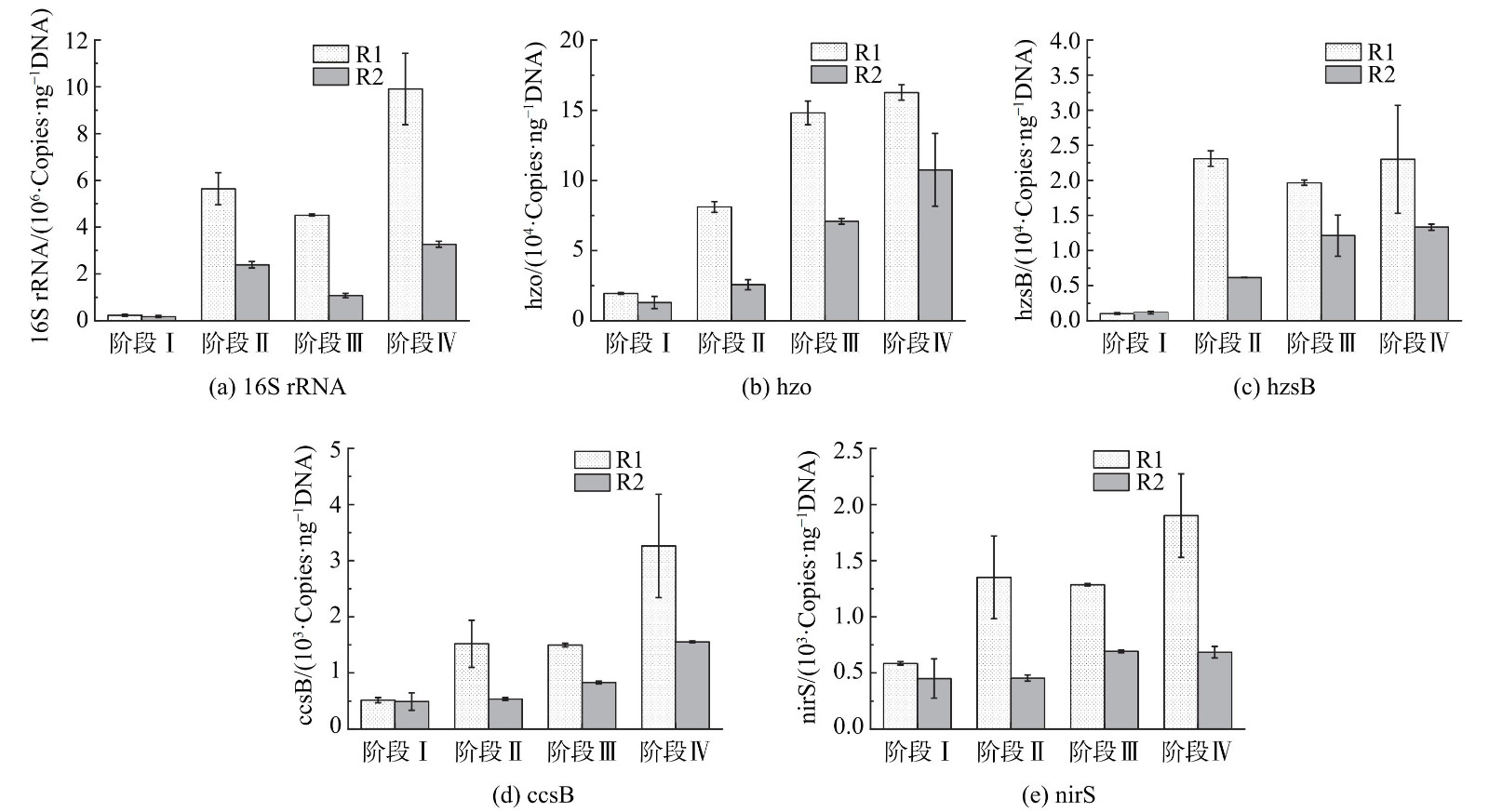
在不同的阶段末期取适量污泥提取DNA为待测样品进行qPCR反应,由标准曲线得各样品的16S rRNA、hzo、hzsB、ccsB、nirS基因拷贝数,如图6所示。16S rRNA基因的拷贝数均在106 copies·g−1数量级内,且R1中的基因拷贝数均高于R2。这表明R1中有更高的菌群丰度,更有利于脱氮性能的提高。投加信号分子后R1中hzo、nirS的基因拷贝数显著增加 (p<0.05) ,hzsB的基因拷贝数变化趋势不明显;R2中hzo、hzsB、nirS的基因拷贝数逐渐增加,但明显低于R1。R1和R2中的ccsB基因拷贝数均随着进水浓度的增加呈现逐渐增加的趋势,且R1高于R2。这说明联合投加C6-HSL和C8-HSL可促进anammox功能基因相对丰度的增加。
-
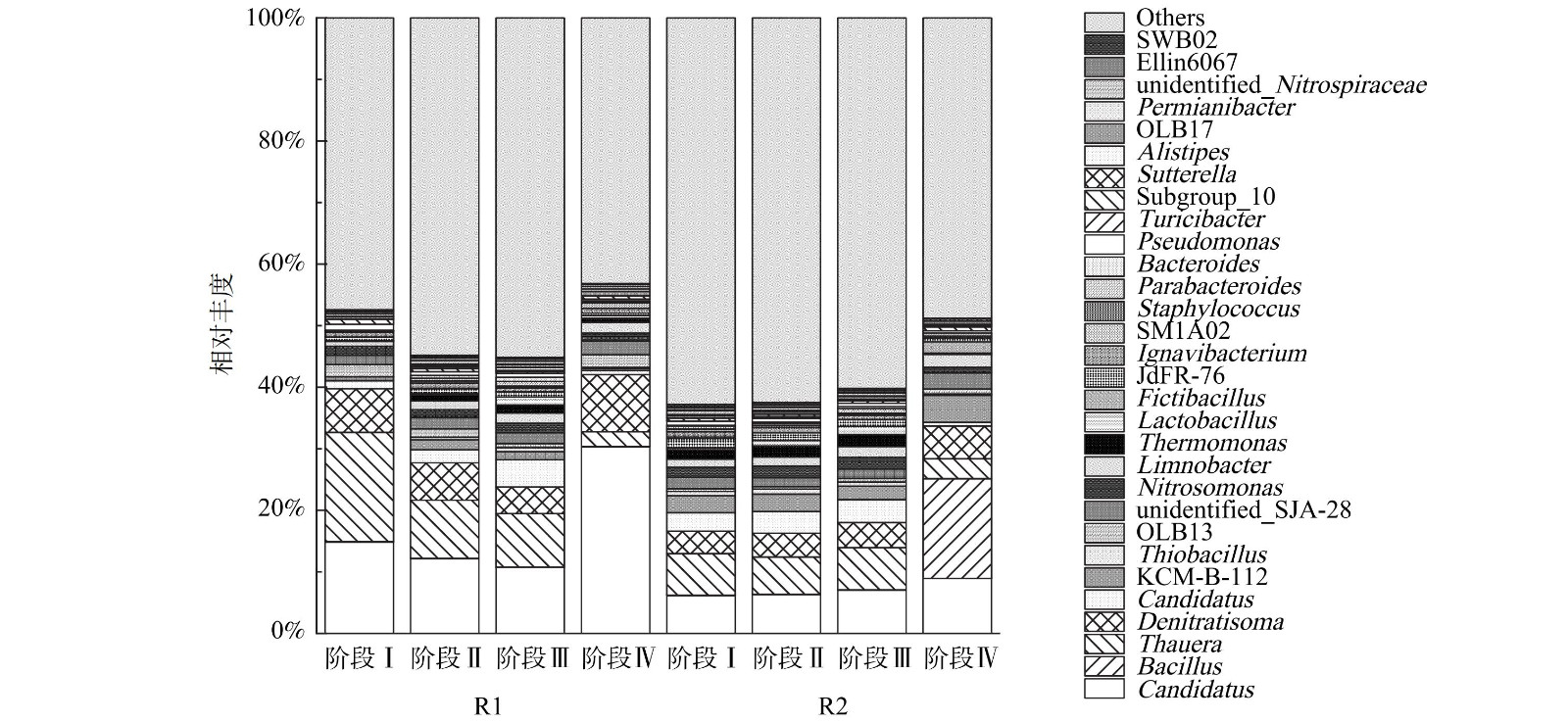
1) 门水平微生物物种。在不同阶段末取适量污泥提取DNA为待测样品进行高通量测序,结果如图7所示。在门水平上,浮霉菌门 (Planctomycetes) 、变形菌门 (Proteobacteria) 、厚壁菌门 (Firmicutes) 、拟杆菌门 (Bacteroidetes) 、绿弯菌门 (Chloroflexi) 是主要的菌群。Anammox菌属于浮霉菌门,R1和R2中浮霉菌门相对丰度均呈上升趋势,阶段Ⅰ至阶段Ⅲ的变化不明显,阶段Ⅳ,R1和R2中的浮霉菌门分别为36.01%和19.11%,较阶段Ⅰ分别增加了17.30%和5.28%,但R1中的浮霉菌门相对丰度高于R2。这说明逐步提高进水基质浓度和外源联合投加C6-HSL和C8-HSL均有利于Anammox菌的富集和生长。其他门类的细菌在系统中呈现下降的趋势,变形菌门在R1和R2中分别从36.25%、31.56%降至26.50%、28.76%;拟杆菌门在R1和R2中分别从11.75%、10.58%降至6.66%、5.61%。这可能是由于外源投加的信号分子促进作用,以及利于anammox菌生长的环境条件使得anammox菌具有更好的竞争优势。
2) 属水平微生物物种。Anammox菌属主要以Candidatus Brocadia为主,如图8所示,Candidatus Brocadia在R1中的相对丰度先降低后增加,在阶段Ⅰ至阶段Ⅳ的相对丰度分别为14.80%、9.75%、10.11%和30.30%。阶段Ⅱ至阶段Ⅳ,随着进水TN的增加,R1和R2中Candidatus Brocadia的丰度逐渐增加,该菌属逐渐富集。VAN DER STAR[28]发现高浓度含氮废水更适合Candidatus Brocadia生存,这与本研究的结果一致。Candidatus Jettenia是anammox菌属,在R1和R2中的相对丰度先增加后降低,这可能是因为阶段Ⅱ、Ⅲ中C6-HSL和C8-HSL质量分数增加有利于Candidatus Jettenia的富集;阶段Ⅳ,Candidatus Brocadia的丰度高,占据生长优势,而Candidatus Jettenia的竞争能力较弱,故丰度有所下降。
R1和R2中具有反硝化作用的菌群为反硝化菌 (Denitratisoma) 、陶厄氏菌属 (Thauera) 、硫杆菌属 (Thiobacillus) 、假单胞菌属 (Pseudomonas) ,总丰度分别从25.86%、11.90%降至12.19%、9.08%。R1和R2中具有硝化作用的菌群为亚硝化单胞菌属 (Nitrosomonas) 和假单胞菌属 (Pseudomonas) ,总丰度分别从2.42%、2.28%降至1.56%、1.27%。这说明体系的主反应向着anammox方向进行。
-
C6-HSL和C8-HSL的联合投加提高了氮的去除率。联合投加C6-HSL和C8-HSL促进污泥分泌EPS,诱导其他信号分子的内源释放,进一步促进污泥之间形成聚集体及颗粒化过程,增大了颗粒污泥占比,加快了anammox污泥的颗粒化进程。 R1中16S rRNA、hzo、hzsB、ccsB、nirS基因拷贝数均增加且Candidatus Brocadia菌属的丰度明显高于R2。投加C6-HSL和C8-HSL有利于功能基因相对丰度的提高及anammox菌属的生长和富集。
外加AHLs对厌氧氨氧化颗粒污泥UASB启动的影响
Effect of AHLs addition on start-up of anammox granular sludge-based UASB reactor
-
摘要: 厌氧氨氧化 (anammox) 颗粒污泥反应器的启动是其工程化应用的重要前提。选用升流式厌氧污泥床反应器 (UASB) ,投加外源信号分子N-酰基高丝氨酸内酯 (AHLs) ,探究其对anammox污泥颗粒化过程的影响,以此考察anammox颗粒污泥工艺启动方式。结果表明,联合投加N-DL-己酰基高丝氨酸内酯 (C6-HSL) 和N-DL-辛酰基高丝氨酸内酯 (C8-HSL) 信号分子组 (R1) 和甲醇对照组 (R2) 中NH4+-N、NO2−-N和TN的去除率分别为87.09%、89.13%、76.83%和82.37%、84.39%、69.49%。R1和R2中粒径>0.45 mm的污泥占比为50.67%和35.05%,R1中污泥颗粒化程度高于R2。胞外聚合物 (EPS) 质量浓度 (以每克可挥发性悬浮物) 分别为138.31、116.95 mg·g−1。Anammox功能基因hzo、hzsB基因拷贝数呈增长趋势,且R1高于R2。Anammox菌属Candidatus Brocadia的相对丰度分别为30.30%、8.90%。这表明联合投加C6-HSL和C8-HSL后可促进EPS分泌及其他信号分子的内源释放,进而刺激了anammox菌的富集,加快了anammox污泥的颗粒化进程。本研究可为anammox颗粒污泥工艺的快速启动提供参考。Abstract: The start-up of anaerobic ammonia oxidation(anammox) granular sludge reactor is an important challenge for its engineering application. In this study, the exogenous signal molecule N-acyl homoserine lactone (AHLs) was added to UASB reactor to explore its influence on the granulation process of anammox sludge and provide a basis for the start-up of anammox granular sludge process. It was found that the removal rates of NH4+-N, NO2−-N and TN in signal molecule group (R1) added with N-DL-hexanoyl homoserine lactone (C6-HSL) and N-DL-octanoyl homoserine lactone (C8-HSL) together were 87.09%, 89.13% and 76.83% respectively, and in methanol control group (R2) were 82.37%, 84.39% and 69.49%. The sludge with particle size > 0.45 mm in R1 accounted for 50.67%, and that in R2 accounted for 35.05%. The granulation degree of sludge in R1 was higher than that in R2. The extracellular polymeric substances (EPS) concentrations of R1 and R2 were 138.31 mg·g−1VSS and 116.95 mg·g−1VSS, respectively. The copy numbers of functional genes hzo and hzsB of anammox showed an increasing trend, and R1 was higher than R2. The relative abundance of anammox genus Candidatus Brocadia was 30.30% and 8.90% respectively. Therefore, the addition of C6-HSL and C8-HSL can promote the accumulation of anammox bacteria and accelerate the granulation process of anammox sludge by promoting the secretion of EPS and the endogenous release of other signal molecules.
-
Key words:
- anaerobic ammonia oxidation /
- granular sludge /
- signal molecule /
- C6-HSL /
- C8-HSL
-

-
表 1 UASB反应器不同阶段的运行工况
Table 1. Operating conditions of UASB reactor at different stages of startup period
阶段 时间/d 进水TN/ (mg·L−1) HRT/h Ⅰ 12 165 24 Ⅱ 44 165 24 Ⅲ 18 270 24 Ⅳ 18 350 24 表 2 qPCR扩增引物序列及其条件
Table 2. qPCR amplification primer sequence and conditions
目的基因 引物 引物序列 退火温度/ ℃ 碱基数目 参考文献 anammox 16S A438f GTCRGGAGTTADGAAATG 58 250 [15] A648r ACCAGAAGTTCCACTCTC hzsB hzsB364f TGYGCVAGYTGYCAYTAYGARAG 54 301 [16] hzsB640r CTGAAHGGACTYCCBGTRAAYTC nirS nirS-cd3aF GTSAACGTSAAGGARACSGG 59 478 [17] nirS-R3cd GASTTCGGRTGSGTCTTGA hzo hzoclF1 TGTGCATGGTCAATTGAAAG 55 473 [18] hzoclR1 CAACCTCTTCWGCAGGTGCATG ccsB ccsB1189f AYAATCCWGCYGTWMWVGTDGA 57 451 [16] ccsB1589r GCWARRTTRTTRTCDKKATACCA 表 3 不同阶段R1和R2的EPS质量浓度、PN/PS
Table 3. EPS concentration, PN/PS of R1 and R2 at different stages
阶段 EPS/(mg·g−1) PN/PS R1 R2 R1 R2 阶段Ⅰ 79.78 80.97 2.62 2.77 阶段Ⅱ 129.12 104.05 2.14 2.02 阶段Ⅲ 163.99 146.39 2.26 2.09 阶段Ⅳ 184.74 179.68 2.64 2.34 -
[1] MADEIRA C L, ARAÚJO J C D. Inhibition of anammox activity by municipal and industrial wastewater pollutants: A review[J]. Science of The Total Environment, 2021, 799(10): 149449. [2] CAO Y S, VAN LOOSDRECHT M C M, DAIGGER G T. Mainstream partial nitritation-anammox in municipal wastewater treatment: Status, bottlenecks, and further studies[J]. Applied Microbiology and Biotechnology, 2017, 101(4): 1365-1383. doi: 10.1007/s00253-016-8058-7 [3] FENG Z L, GU M Q, SUN Y P, et al. Potential microbial functions and quorum sensing systems in partial nitritation and anammox processes[J]. Water Environment Research, 2021, 93(9): 1562-1575. doi: 10.1002/wer.1538 [4] PAPENFORT K, BASSLER B L. Quorum sensing signal-response systems in Gram-negative bacteria[J]. Nature Reviews Microbiology, 2016, 14(9): 576-588. doi: 10.1038/nrmicro.2016.89 [5] HU H, HE J, LIU J, et al. Role of N-acyl-homoserine lactone (AHL) based quorum sensing on biofilm formation on packing media in wastewater treatment process[J]. Rsc Advances, 2016, 6(14): 11128-11139. doi: 10.1039/C5RA23466B [6] LIU L J, JI M, WANG F, et al. N-acyl-l-homoserine lactones release and microbial community changes in response to operation temperature in an anammox biofilm reactor[J]. Chemosphere, 2020, 262: 127602. [7] 刘长远, 韩蕊, 衣隆强等. 群体感应信号分子AHLs强化厌氧氨氧化过程综述[J/OL]. 环境工程: 1-11[2023-04-11]. http://kns.cnki.net/kcms/detail/11.2097.X.20221219.1615.002.html. [8] ZHANG J, LI J, ZHAO B H, et al. Long-term effects of N-acyl-homoserine lactone-based quorum sensing on the characteristics of ANAMMOX granules in high-loaded reactors[J]. Chemosphere, 2019, 218: 632-642. doi: 10.1016/j.chemosphere.2018.11.170 [9] HAN H, LI J, ZHANG J, et al. Enhancing the treatment performance of partial denitrification/Anammox process at high nitrogen load: Effects of immobilized strain HFQ8C/N; on the sludge characteristics[J]. Bioresource Technology, 2021, 341: 125870. doi: 10.1016/j.biortech.2021.125870 [10] 张向晖, 彭永臻, 贾方旭, 等. 外源自诱导物对厌氧氨氧化的影响[J]. 中国环境科学, 2018, 38(5): 1727-1733. doi: 10.19674/j.cnki.issn1000-6923.2018.0201 [11] 王衫允. 低氨氮浓度厌氧氨氧化工艺强化及颗粒污泥菌群特性研究[D]. 哈尔滨: 哈尔滨工业大学, 2016. [12] LIU L J, XU S H, WANG F, et al. Effect of exogenous N-acyl-homoserine lactones on the anammox process at 15 ℃: Nitrogen removal performance, gene expression and metagenomics analysis[J]. Bioresource Technology, 2021, b,341: 125760. [13] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [14] 操沈彬. 基于短程反硝化的厌氧氨氧化脱氮工艺与菌群特性[D]. 哈尔滨: 哈尔滨工业大学, 2018. [15] HUMBERT S, ZOPFI J, TARNAWSKI S E. Abundance of anammox bacteria in different wetland soils[J]. Environment Microbiology Reports, 2012, 4(5): 484-490. doi: 10.1111/j.1758-2229.2012.00347.x [16] SCHMID M C, HOOPER A B, KLOTZ M G, et al. Environmental detection of octahaem cytochrome c hydroxylamine/hydrazine oxidoreductase genes of aerobic and anaerobic ammonium‐oxidizing bacteria[J]. Environment Microbiology, 2008, 10(11): 3140-3149. doi: 10.1111/j.1462-2920.2008.01732.x [17] THROBACK I, ENWALL K A, HALLIN S. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE[J]. FEMS Microbiology Ecology, 2010, 49(3): 401-417. [18] ZHOU Z, CHEN J, MENG H, et al. New PCR primers targeting hydrazine synthase and cytochrome c biogenesis proteins in anammox bacteria[J]. Applied Microbiology Biotechnology, 2017, 101(3): 1-21. [19] 李海玲, 李冬, 张杰, 等. 调控温度和沉降时间实现 ANAMMOX 颗粒快速启动及其稳定运行[J]. 环境科学, 2019, 40(2): 837-844. [20] KREUK M D, KISHIDA N, LOOSDRECHT M V. Aerobic granular sludge–state of the art[J]. Water Science& amp; Technology, 2007, 55(8): 75-81. [21] 范骏洋, 张善林, 邹海晴, 等. 乳品废水厌氧反应器快速启动及颗粒污泥形成[J]. 工业水处理, 2020, 40(11): 66-69. [22] ZHU G B, WANG Y S, MA B, et al. Anammox granular sludge in low-ammonium sewage treatment: Not bigger size driving better performance[J]. Water Research, 2018, 142: 147-158. doi: 10.1016/j.watres.2018.05.048 [23] TANG X, GUO Y Z, CHEN S S, et al. Metabolomics uncovers the regulatory pathway of acyl-homoserine lactones based quorum sensing in anammox consortia[J]. Environmental Science & Technology, 2018, 52(4): 2206-2216. [24] HOU X L, LIU S T, ZHANG Z T. Role of extracellular polymeric substance in determining the high aggregation ability of anammox sludge[J]. Water Research, 2015, 75: 51-62. doi: 10.1016/j.watres.2015.02.031 [25] LIU Y Q, LIU Y, TAY J H. The effects of extracellular polymeric substances on the formation and stability of biogranules[J]. Applied Microbiology and Biotechnology, 2004, 65(2): 143-148. [26] SHENG G P, YU H Q, LI X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: a review[J]. Biotechnology Advances, 2010, 28(6): 882-894. doi: 10.1016/j.biotechadv.2010.08.001 [27] WATERS C M, LU W Y, RABINOWITZ J D, et al. Quorum sensing controls biofilm formation in Vibrio cholerae through modulation of cyclic Di-GMT levels and repression of vpsT[J]. Journal Of Bacteriology, 2008, 190(7): 2527-2536. doi: 10.1128/JB.01756-07 [28] VAN DER STAR W R L, MICLEA A I, VAN DONGEN U G J M, et al. The membrane bioreactor: A novel tool to grow anammox bacteria as free cells[J]. Biotechnology and Bioengineering, 2008, 101(2): 286-294. doi: 10.1002/bit.21891 -



 下载:
下载: