-
近年来,我国海水养殖业发展迅速。在养殖过程中投加的饲料和抗生素仅有少部分被生物吸收,而约有75%的营养物质[1]和60%~90%的抗生素[2]未被吸收利用而溶解或悬浮于海产养殖废水中。由此产生的海产养殖废水具有高盐含氮的特点,还含有各类抗生素。海产养殖废水总体上属于中低浓度氨氮废水,其过量排放会导致海洋生态系统的富营养化,并破坏水生动植物的生存环境[3]。海产养殖废水的高盐含量还会使渗透压急剧增加,从而导致细胞死亡[4]。废水中的抗生素还会抑制微生物的生长和活性,对污水处理系统的性能造成冲击。
恩诺沙星(enrofloxacin,ENR)、土霉素(oxytetracycline,OTC)和磺胺甲恶唑(sulfamethoxazole,SMX)分别属于喹诺酮类(quinolones,QNs)、四环素类(tetracyclines,TCs)和磺胺类(sulfonamides,SAs)抗生素[5]。这些抗生素在海产养殖业中被广泛应用于预防和治疗疾病,以促进鱼类的生长[6]。在海产养殖废水及海洋环境中,抗生素已被广泛检出。在济州岛(韩国)和海陵岛(中国)的海产养殖区,海产养殖废水中土霉素的质量浓度最高达到了9.46和15.13 mg·L−1 [7]。由于含抗生素海水养殖废水的排放,在海水和海底沉积物中经常检测到高质量浓度(mg·L−1水平)的抗生素[8]。中国是世界上海产养殖规模最大的国家[9]。含抗生素高盐海产养殖废水的处理是我国海产养殖业的重要环节。在采用生物脱氮工艺处理海产养殖废水时,抗生素对工艺处理效果的影响是一个重要的考量。
厌氧氨氧化(anammox)是一种将氨氮和亚硝酸盐转化为氮气的高效生物脱氮工艺,具有耗氧少、产生污泥量小、废水处理成本低等优点[10]。海洋厌氧氨化菌(marine anammox bacteria,MAB)是厌氧氨氧化菌所在浮霉菌门(Planctomycetes)中一个独特的分支,其仅存在于海洋环境中[11]。而浮霉菌门其余的厌氧氨氧化菌则为淡水厌氧氨氧化菌(fresh anammox bacteria,FAB)。MAB在海洋氮循环中起重要作用,其氮气产量约为整个海洋系统总量的50%[12]。FAB无法耐受高盐环境[13],而在盐度(质量分数,即溶解物质质量与海水质量之比)为0.5%~3.5%时,MAB仍能维持较高的生物活性[14],因此,MAB在高盐含氮废水的处理中具有独特优势。
本研究采用批试实验考察在高盐环境下(3.5%盐度)恩诺沙星、土霉素和磺胺甲恶唑3种抗生素的短期冲击对MAB脱氮性能的影响,并比较3种抗生素对MAB脱氮过程抑制程度的强弱,通过动力学模型拟合并分析抗生素胁迫下MAB脱氮性能的变化,为MAB处理含抗生素的海产养殖废水提供参考。
-
MAB颗粒污泥取自本实验室已稳定运行多年的序批式反应器(7 L)[15]。在批试实验中,用100 mL血清瓶作为反应器,血清瓶外用铝箔包裹以避免光照对MAB和抗生素的影响。每组反应器中取12 g 湿重的MAB颗粒污泥,污泥的污泥浓度(SS)为17.46 kg·m−3,挥发性污泥浓度(VSS)为11.48 kg·m−3。将血清瓶置于(25±2)℃的摇床中,摇床转速为105 r·min−1。每种抗生素设5个梯度(0、250、500、750、1 000 mg·L−1),水力停留时间为4 h,每隔0.5 h取样1次。
-
模拟海产养殖废水采用盐度为3.5%的海水(青岛市胶州湾(120°28´E,36°18´N))配置。每升废水添加的成分和含量为:KH2PO4 0.029 g;CaCl2 0.136 g;KHCO3 1.2 g;MgSO4·7H2O 1.2 g;微量元素Ⅰ和Ⅱ各1 mL[16]。底物中的NH4+-N和NO2−-N分别由NH4Cl和NaNO2提供,其进水质量浓度分别控制在约100和132 mg·L−1。通过滴加1 mol·L−1的NaOH和HCl将进水pH调节至(7.5±0.1)。实验使用的恩诺沙星、土霉素和磺胺甲恶唑均为生物技术级(上海麦克林生化科技有限公司),将其配置为高浓度溶液使用,在实验中按设定浓度定量添加。
-
水质指标测定方法:NH4+-N为纳氏试剂光度法;NO2−-N为N-(1-萘基)-乙二胺分光光度法;NO3−-N为麝香草酚分光光度法; SS和VSS为重量法[17]。
抑制率(inhibition percentage,IP)的计算公式见式(1)。
式中:TNRR0为不添加抗生素组的总氮去除速率,kg·(m3·d)−1;TNRRt为添加抗生素组的总氮去除速率,kg·(m3·d)−1。
-
为了解批试实验所用污泥的微生物群落组成,将从母反应器取出的MAB污泥在实验前进行高通量测序。细菌组DNA首先使用Power Soil DNA分离试剂盒进行提取,随后对提取的DNA进行定量检测。使用通用引物扩增细菌基因的V3~V4区,通用引物序列和PCR扩增步骤与先前研究[18]一致。高通量测序在Illumina HiSeq平台上进行,并通过数据库比对和分析测序结果获得微生物群落结构。
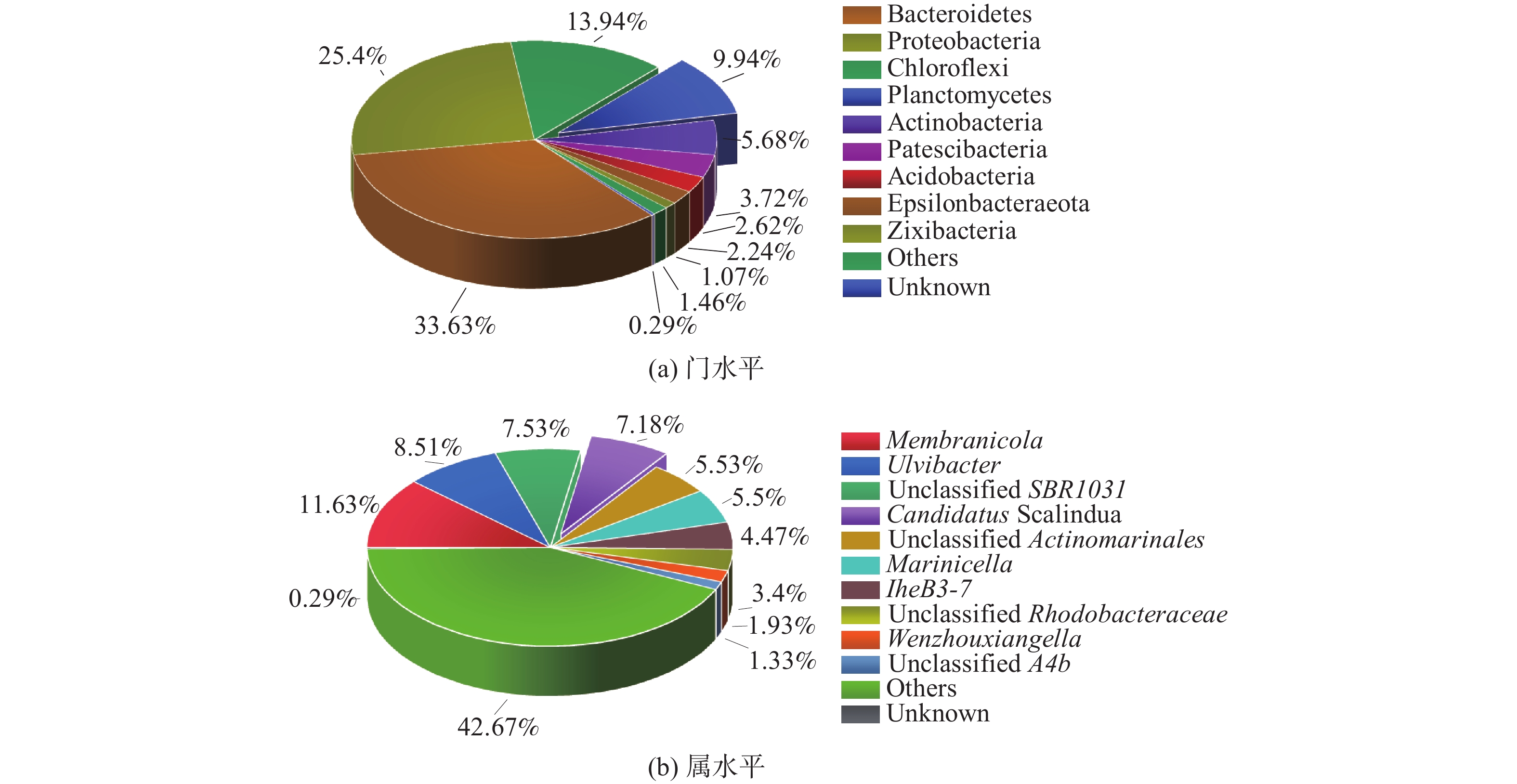
MAB颗粒污泥的微生物在门水平上分布如图1(a)所示,浮霉菌门为厌氧氨氧化菌所在的门,占比为9.94%。此外,拟杆菌门(33.63%)和绿弯菌门(13.94%)有助于厌氧氨氧化菌污泥的颗粒化,并且对增强颗粒污泥结构的稳定有重要作用[19-20]。微生物群落在属水平上分布如图1(b)所示。Candidatus Scalindua(7.18%)为MAB,是反应器中厌氧氨氧化反应的最主要菌种。此外,Membranicola(11.63%)通常在海洋生态系统中存在[21],而Unclassified SBR1031(7.53%)常见于厌氧氨氧化系统中[22],可能与厌氧氨氧化菌具有协同作用。
-
为分析不同浓度下3类抗生素对脱氮和微生物活性的影响,采用了2种动力学模型进行拟合分析。Remodified Logistic模型最初用于描述批量实验中的产氢过程[23],而Modified Gompertz模型被广泛用于研究微生物代谢中基质降解和细菌生长[24]。已有研究证明,Remodified Logistic模型和Modified Gompertz模型适用于描述厌氧氨氧化的脱氮过程[16]。其中,Remodified Logistic模型的计算公式为式(2),Modified Gompertz的为式(3)。
式中:TNRE表示脱氮过程的总氮去除效率,%;TNREmax表示最大TNRE,%;Rmax表示最大基质去除速率,%·h−1;λ表示反应的迟滞时间,h;t表示反应时间,h。
-
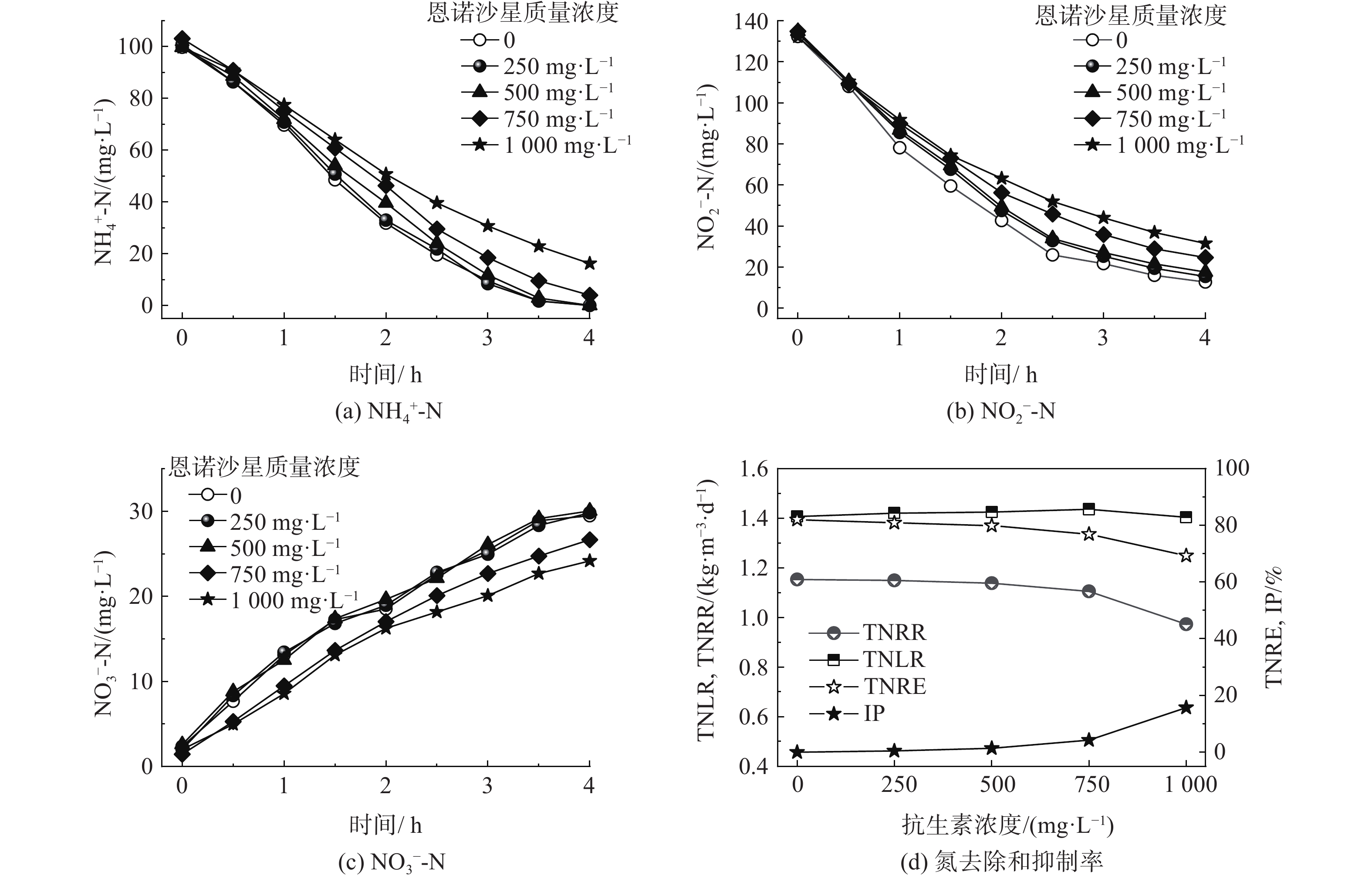
如图2所示,所有实验组的进水总氮负荷(total nitrogen loading rate,TNLR)稳定在约1.42 kg·(m3·d)−1。在未添加抗生素时,MAB污泥的总氮去除率(total nitrogen removal efficiency,TNRE)为82%,总氮去除速率(total nitrogen removal rate,TNRR)为1.15 kg·(m3·d)−1。在NH4+-N和NO3−-N快速消耗的过程中伴随着NO3−-N的产生,此时化学计量比△[NH4+-N]/ △[NO2−-N]=1.20,△[NH4+-N]/ △[NO3−-N]=0.27,与LOTTI等[11]研究的理论化学计量比(1.32和0.26)接近。这证明厌氧氨氧化反应是反应器中主导的脱氮反应。
当恩诺沙星的质量浓度为250和500 mg·L−1时,反应器的TNRR分别为1.15和1.14 kg·(m3·d)−1,此时的抑制率分别为0.42%和1.41%。恩诺沙星属于氟喹诺酮类抗生素(第三代喹诺酮类药物),其通过抑制细菌的DNA旋回酶和拓扑异构酶,破坏细菌的正常代谢和繁殖,起到杀菌作用。李晶[25]研究了氟喹诺酮类药物诺氟沙星和左氧氟沙星对淡水厌氧氨氧化菌(FAB)的影响。结果表明:2种氟喹诺酮类抗生素在短期内均对厌氧氨氧化过程产生了明显抑制;诺氟沙星对FAB的半抑制质量浓度为227.39 mg·L−1;左氧氟沙星对厌氧氨氧化污泥的半抑制浓度为386.75 mg·L−1。相比之下,MAB对恩诺沙星具有较高的抗性,质量浓度为500 mg·L−1以内的恩诺沙星对MAB的脱氮性能几乎没有抑制。
当恩诺沙星质量浓度增至750 mg·L−1时,NH4+-N不再被完全去除,出水NH4+-N和NO2−-N的质量浓度分别为3.97和24.66 mg·L−1,同时NO3−-N的产生也相应降低。当恩诺沙星质量浓度增至1 000 mg·L−1时,抑制进一步加重,出水NH4+-N和NO2−-N分别增至16.23和31.50 mg·L−1,TNRR降至0.99 kg·(m3·d)−1。质量浓度为500和1 000 mg·L−1的恩诺沙星对厌氧氨氧化过程的抑制率为4.25%和15.68%。在盐度为3.5%的高盐废水中,恩诺沙星对MAB颗粒污泥的脱氮性能影响不大,其质量浓度高至1 000 mg·L−1也并未到达MAB的半抑制浓度。恩诺沙星对MAB抑制微弱的主要原因在于厌氧氨氧化菌的倍增时间长(10~14 d)[26],故恩诺沙星在4 h的水力停留时间中未能体现出对细菌DNA复制的抑制。因此,在短期内没有对MAB的代谢造成明显损害。恩诺沙星对细菌DNA链的破坏,以及对MAB的杀菌作用还需进行长期深入研究。
-
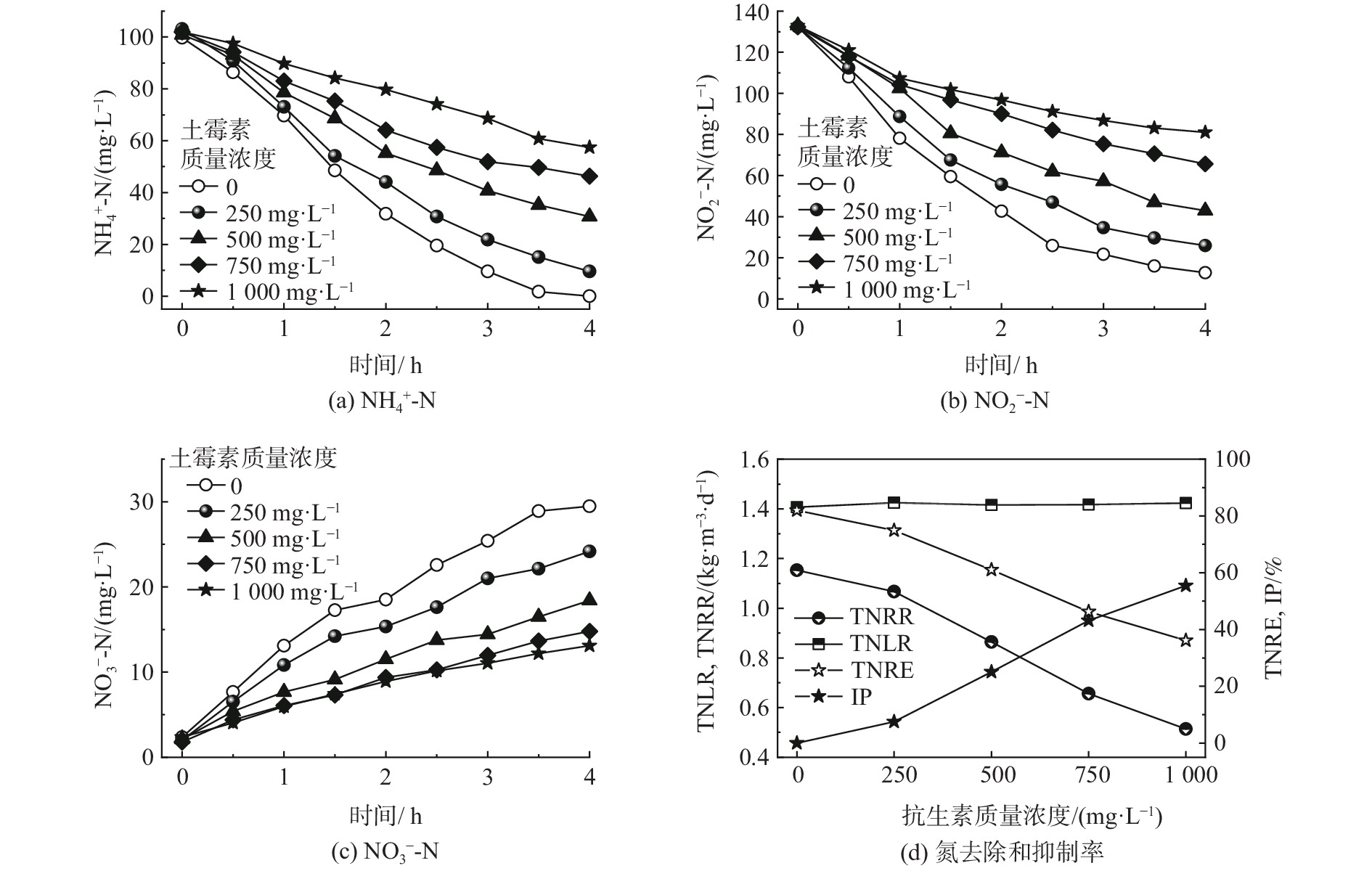
如图3所示,土霉素对MAB脱氮过程的抑制比较严重。根据斜率的变化可知,随着土霉素质量浓度的增加,MAB的基质降解速率明显降低,而NO3−-N的生成速率也相应降低了。在土霉素质量浓度为250 mg·L−1时,观察到其对MAB的抑制,出水[NH4+-N]和[NO2−-N]分别从对照组的0和12.72 mg·L−1分别增至9.54和25.90 mg·L−1。TNRR从对照的1.15 kg·(m3·d)−1降至1.07 kg·(m3·d)−1,此时IP为7.49 %,抑制程度较低。随着土霉素质量浓度的提高,在500、750和1 000 mg·L−1时,TNRR进一步降至0.86、0.66和0.51 kg·(m3·d)−1,而TNRE也分别降至61.01%、46.31%和36.13%。土霉素对厌氧氨氧化过程影响抑制强烈,当土霉素质量浓度为1 000 mg·L−1时,IP已超过了50%。
在盐度3.5%的高盐条件下,土霉素质量浓度和IP之间有良好的线性关系。IP与土霉素质量浓度的拟合方程为IP=0.0586c− 3.0760(c为土霉素质量浓度,mg·L−1;R2=0.980 1)。当IP=50%时,可得出土霉素对MAB的短期半抑制浓度(IC50)为905.73 mg·L−1。YANG等[24]研究了土霉素对FAB的短期抑制特性,发现在土霉素的短期冲击下细菌裂解死亡,且FAB污泥的沉降性能明显变差。最终得出土霉素对FAB菌落的短期IC50为517.5 mg·L−1。此外,马静等[27]的短期抑制研究表明,FAB在土霉素质量浓度为400 mg·L−1的胁迫下,NH4+-N和NO2−-N的降解速率对比对照组分别下降了75.40%和81.70%。该结果表明土霉素对Candidatus Brocadia的IC50要低于400 mg·L−1。由此可见,Candidatus Scalindua(MAB)相比于Candidatus Brocadia(FAB)在土霉素的短期冲击下有更高的脱氮效率及耐受性。此外,本实验所采用的MAB污泥为颗粒污泥,厌氧氨氧化颗粒污泥表面存在大量胞外聚合物(extracellular polymeric substances,EPS)[28],可起到吸附抗生素及阻碍传质的作用[29],对于缓解土霉素对MAB的毒性有重要作用。
-
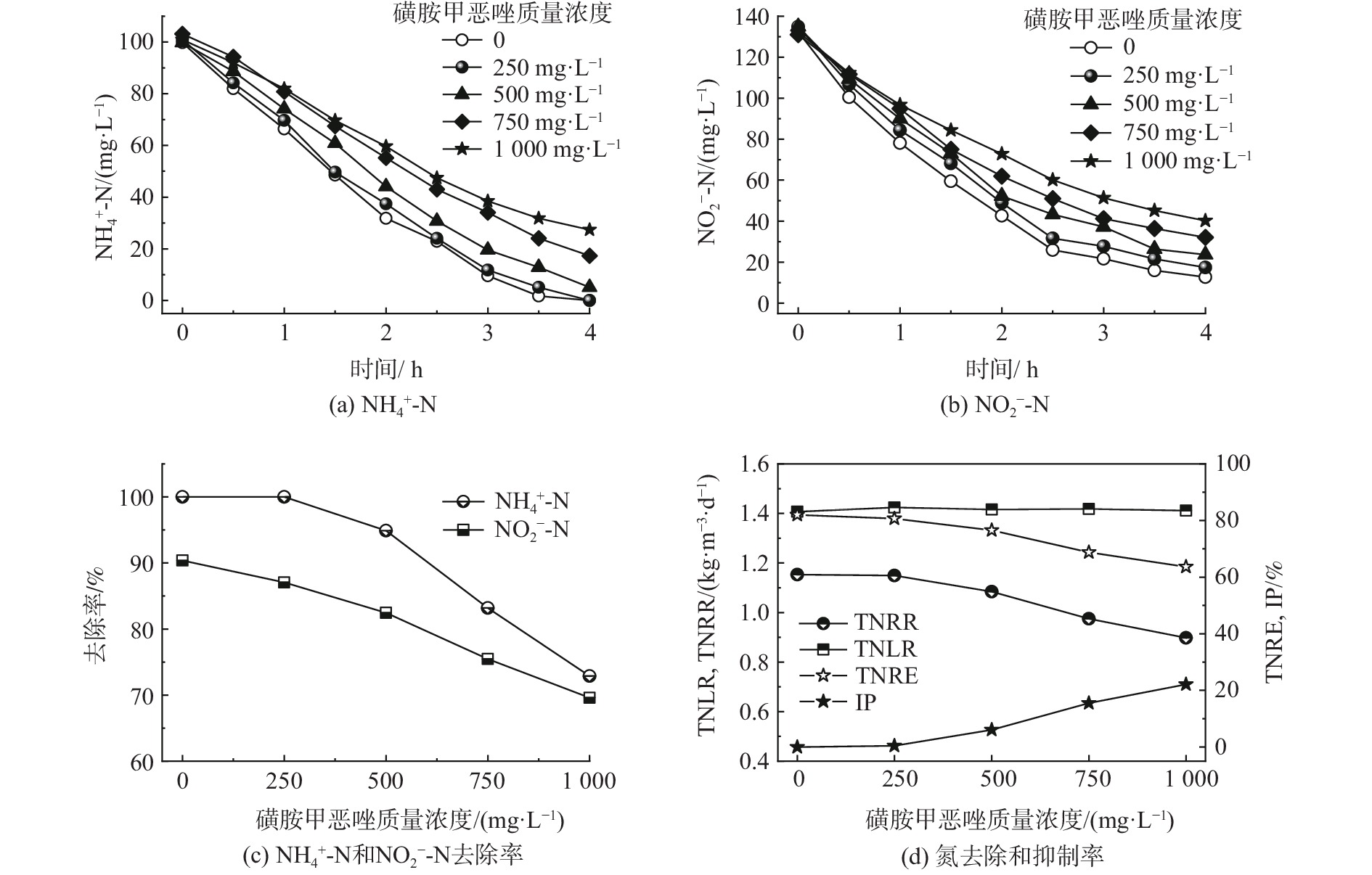
当磺胺甲恶唑质量浓度为250 mg·L−1及以上时,在测定NO3−-N时会生成橙色沉淀且测定结果严重偏离正常值。推测是由于高浓度的磺胺甲恶唑无法被掩蔽或与试剂发生了反应,麝香草酚分光光度法不再适用。在本部分只探究磺胺甲恶唑对MAB基质降解(NH4+-N和NO2−-N)的影响。如图4所示,质量浓度为250 mg·L−1的磺胺甲恶唑对MAB的脱氮效果几乎没有影响。NH4+-N在4 h内仍可完全去除,而出水中的NO2−-N略有上升。此时,TNRR为1.15 kg·(m3·d)−1,与对照组接近。类似的,ZHANG等[30]长期实验表明,30 mg·L−1以内的磺胺甲恶唑并未对FAB的脱氮性能造成明显抑制。同时观察到FAB在磺胺甲恶唑压力下分泌的EPS明显增加,EPS的蛋白质屏障有效吸附了抗生素并有效阻止了磺胺类抗生素进入细胞。因此,在低浓度抗生素压力下,MAB颗粒污泥中存在的EPS对于细菌维持内部环境的相对稳定起到了关键作用。
随着抗生素浓度的进一步增加,当磺胺甲恶唑质量浓度为500、750和1 000 mg·L−1时,NH4+-N去除率依次降至94.90%、83.18%和72.87%,而NO2−-N去除率降至82.45%、75.48%和69.59%。由此说明,磺胺甲恶唑对MAB的抑制首先体现在对NO2−-N去除的抑制上;随着磺胺甲恶唑质量浓度的升高,NH4+-N去除率也迅速下降。磺胺甲恶唑是一种广谱抑菌剂,其通过阻止细菌二氢叶酸的合成,达到抑制细菌的生长繁殖的目的[31]。姚芳[32]发现在磺胺类抗生素的胁迫下,厌氧氨氧化过程关键酶的生成受到了抑制和破坏,导致反应器脱氮效率下降。因此,磺胺甲恶唑对于厌氧氨氧化关键酶活性的抑制是MAB脱氮能力下降的直接原因。在盐度为3.5%的高盐废水中,质量浓度为250 mg·L−1的磺胺甲恶唑对MAB的脱氮过程几乎没有影响;质量浓度分别为500、750和1 000 mg·L−1的磺胺甲恶唑IP依次升高,分别为6.17%、15.85%和24.55%。由此可见,在本实验中,磺胺甲恶唑对MAB的抑制程度介于恩诺沙星和土霉素之间。由于尚缺少磺胺甲恶唑对FAB的短期抑制研究,MAB和FAB对磺胺类药物的抗性强弱还有待深入研究。
-
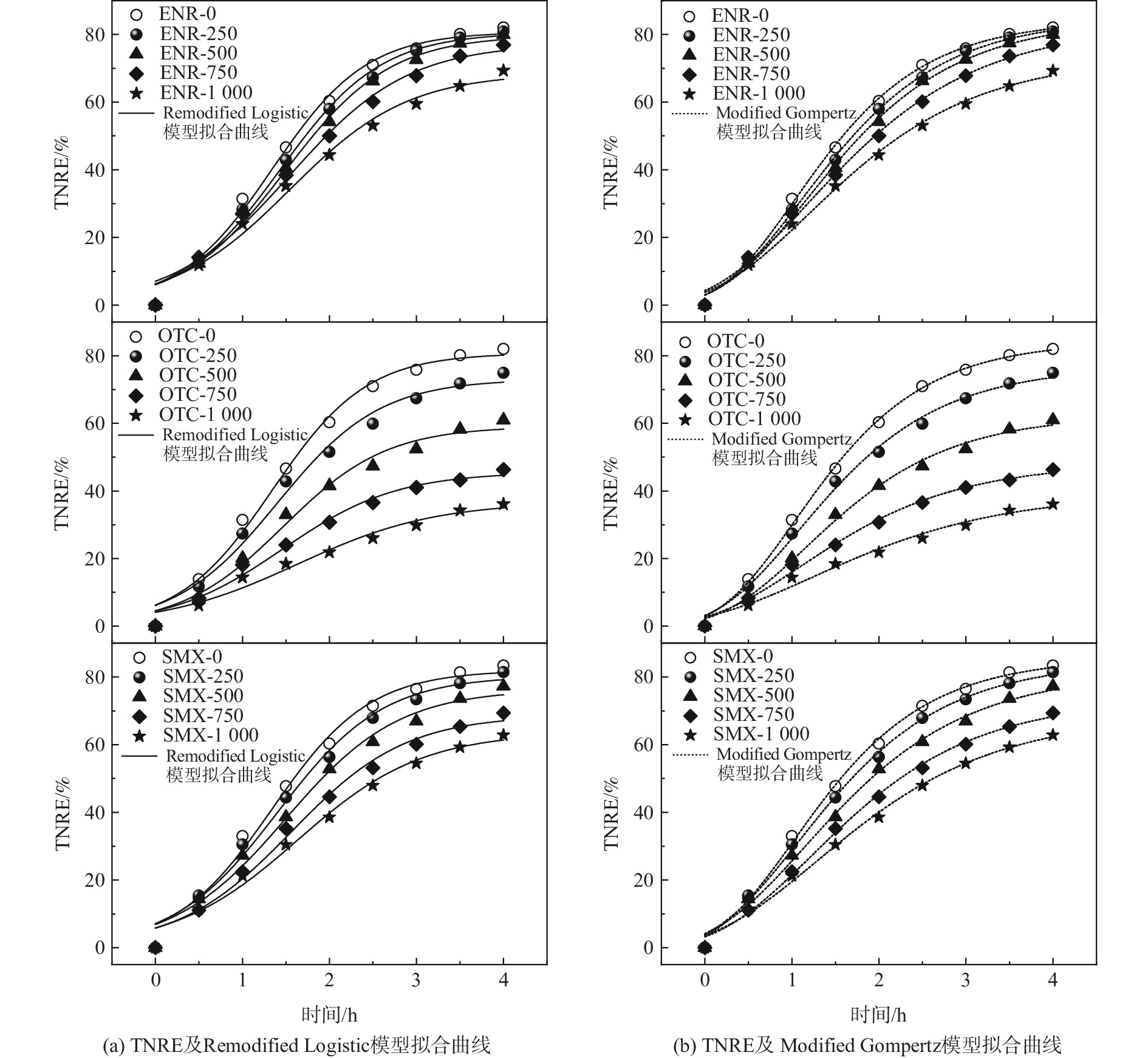
动力学模型常用于研究和分析基质去除效应的机理。本实验采用Remodified Logistic模型和Modified Gompertz模型分析了不同抗生素剂量下MAB的氮去除过程。其中,在磺胺甲恶唑组,按△[NO3−-N]=0.26△[NH4+-N]进行分析。图5和表1分别为拟合曲线和动力学参数。Remodified Logistic模型拟合后所得的相关系数R2均高于0.96,而Modified Gompertz模型拟合后的相关系数R2均高于0.97。由此可见,2个模型与MAB的氮去除过程有很好的相关性,可用于分析抗生素冲击下MAB的氮去除过程。
恩诺沙星的质量浓度为500 mg·L−1及以下时,对MAB的TNREmax几乎没有抑制。随着质量浓度的进一步增大,拟合所得的TNREmax降低,这与实验的结果一致。Remodified Logistic模型和Modified Gompertz模型的相对误差为0.74%和5.31%,前者更接近实验结果。土霉素抑制下MAB脱氮拟合曲线分散程度表明了MAB脱氮性能受土霉素的抑制强烈。Remodified Logistic模型和Modified Gompertz模型与实验结果的相对误差分别为2.10%和4.33%。模型预测的TNREmax随土霉素质量浓度增加而降低,且在1 000 mg·L−1时取得最低值。根据磺胺甲恶唑抑制下MAB脱氮拟合曲线的斜率和表1中模型预测的TNREmax,磺胺甲恶唑对MAB的抑制程度介于土霉素和磺胺甲恶唑之间,与实验所得结论相符。
综上所述,Remodified Logistic模型和Modified Gompertz模型拟合结果均与实验结果相符,而在TNRE值的预测上,Remodified Logistic模型更接近实验结果。除了脱氮效率的降低外,抗生素对MAB脱氮性能的抑制还体现在单位时间最大氮去除的降低。模型预测的Rmax随着抗生素质量浓度提高而持续降低,单位时间内最大氮去除从初始的37.24%·h−1和36.35%·h−1分别降至25.28%·h−1和24.51%·h−1。在土霉素组和恩诺沙星组中,Rmax的变化趋势与恩诺沙星相同,这表明抗生素的添加明显抑制了MAB的基质降解速率。LI等[33]的研究发现,厌氧氨氧化过程存在迟滞时间。YU等[16]则认为迟滞时间的差异与反应器的结构和条件有关。在质量浓度分别为1 000 mg·L−1的恩诺沙星和磺胺甲恶唑冲击下,厌氧氨氧化过程的迟滞时间λ减少了,表明高浓度抗生素在使基质转化速率降低的同时也缩短了基质转化的迟滞时间。
-
1)在高盐海产养殖废水(质量分数为3.5%)的处理中,250 mg·L−1的土霉素最先对MAB脱氮性能造成抑制,而此浓度的磺胺甲恶唑和恩诺沙星对MAB的基质降解过程没有明显影响。当磺胺甲恶唑和恩诺沙星浓度分别达到500 mg·L−1和750 mg·L−1时,MAB的脱氮过程出现了较为明显的抑制。在质量分数为3.5%的高盐环境下,土霉素对MAB的半抑制浓度为905.73 mg·L−1。当抗生素质量浓度为1 000 mg·L−1时,恩诺沙星、磺胺甲恶唑和土霉素对MAB的抑制程度分别为15.68%、22.13%和55.44%。3种抗生素对MAB的抑制程度:土霉素> 磺胺甲恶唑> 恩诺沙星。
2) Remodified Logistic模型和Modified Gompertz模型均可分析不同浓度下3种抗生素对MAB基质抑制过程。动力学模型中预测的TNREmax值与实验结果接近,而Rmax值表明了抗生素的添加均会降低厌氧氨氧化的最大基质去除速率,λ值则表明高浓度抗生素在使基质转化速率降低的同时也缩短了基质转化的迟滞时间。动力学分析可为MAB应用于含抗生素的高盐海产养殖废水处理提供理论支持。
3) MAB在高盐环境和高浓度抗生素的短期冲击下仍能保持良好的脱氮能力,并且相比于FAB对土霉素有更高的耐受能力。因此,MAB具有无需盐度驯化和抗生素耐受能力强的优点,可为含抗生素的高盐海产养殖废水处理提供新思路。
抗生素对海洋厌氧氨氧化菌处理海产养殖废水的短期冲击及脱氮动力学
Short-term impact of antibiotics on mariculture wastewater treament by marine anammox bacteria and the denitrification kinetics
-
摘要: 为解决海产养殖废水中含有的高浓度盐分及多种抗生素对生物脱氮系统稳定性的冲击,研究了3种抗生素(恩诺沙星、土霉素和磺胺甲恶唑)短期冲击下,海洋厌氧氨氧化菌(MAB)处理海产养殖废水(盐度3.5%)时的脱氮抑制特性。结果表明:当抗生素质量浓度为250 mg·L−1时,首先观察到土霉素对MAB活性的明显抑制,总氮去除负荷从1.153 kg·(m3·d)−1降至1.067 kg·(m3·d)−1,而此时磺胺甲恶唑和恩诺沙星没有对MAB产生明显抑制;当磺胺甲恶唑和恩诺沙星的质量浓度为500 mg·L−1和750 mg·L−1时,MAB脱氮过程出现了抑制,抑制程度分别为6.05%和4.25%;当质量浓度为1 000 mg·L−1时,恩诺沙星、土霉素和磺胺甲恶唑的抑制程度分别为15.68%、22.13%和55.44%。在盐度3.5%的高盐环境中,3种抗生素对MAB的短期抑制程度为:土霉素>磺胺甲恶唑>恩诺沙星。其中,土霉素对MAB的半抑制浓度为905.73 mg·L−1。Remodified Logistic模型和Modified Gompertz模型可用于分析抗生素胁迫下的MAB抑制过程。模型拟合预测的TNREmax值与实验结果一致,预测的Rmax值表明添加不同浓度的抗生素后都会降低MAB的最大基质去除速率。本研究可为厌氧氨氧化技术在海产养殖废水处理中的应用提供参考。Abstract: In order to solve the impact of high salinity in marine aquaculture wastewater and various antibiotics on the stability of biological nitrogen removal system on the stability of the biological nitrogen removal system, the denitrification inhibition characteristics of marine anaerobic ammonia oxidizing bacteria (MAB) in the treatment of marine aquaculture wastewater (salinity 3.5%) under short-term stress of three antibiotics (enrofloxacin (ENR), oxytetracycline (OTC) and sulfamethoxazole (SMX)) were studied. The results showed that when the antibiotic concentration was 250 mg·L−1, MAB was siginificantly inhibited by OTC, and the total nitrogen removal rate decreased from 1.153 kg·(m3·d) −1 to 1.067 kg·(m3·d) −1,while ENR and SMX did not significantly inhibit MAB. The inhibition of denitrificaion process of MAB was observed with 500 mg·L−1 SMX and 750 mg·L−1 ENR, and the inhibition degree was 5% and 6%, respectively. When the concentration was 1 000 mg·L−1, the inhibition degree of ENR, SMX and OTC was 15.68%, 22.13% and 55.44%, respectively. In the high salinity environment of 3.5%, the short-term inhibition degree of three antibiotics on MAB was as follows: OTC> SMX> ENR, and the semi-inhibitory concentration of OTC on MAB was 905.73 mg·L−1. The Remodified Logistic model and Modified Gompertz could be used to analyze the inhibition of MAB under antibiotics stress. The fitted TNREmax values were consistent with the experimental results, and fitted Rmax values indicated the maximum removal rates of MAB were suppressed by antibiotics. This study can provide reference for the application of anammox technology in the treatment of Marine aquaculture wastewater.
-

-
表 1 Remodified Logistic模型和Modified Gompertz模型拟合所得的动力学参数
Table 1. Kinetic parameters fitted by Remodified Logistic model and Modified Gompertz model
抗生素质量浓度/
(mg·L−1)Remodified Logistic模型 Modified Gompertz模型 TNREmax/% Rmax/(%·h−1) λ/h R2 TNREmax/% Rmax/(%·h−1) λ/h R2 ENR-0 80.78 37.24 0.26 0.988 8 84.29 36.35 0.18 0.997 5 ENR-250 80.57 35.03 0.29 0.990 2 84.87 33.76 0.19 0.997 3 ENR-500 79.70 33.27 0.30 0.989 1 84.39 32.01 0.19 0.996 8 ENR-750 77.23 28.56 0.20 0.983 8 82.75 27.56 0.09 0.994 0 ENR-1 000 68.49 25.28 0.19 0.980 8 73.36 24.51 0.10 0.993 3 OTC-0 80.78 37.24 0.26 0.988 8 84.29 36.35 0.18 0.997 5 OTC-250 73.06 31.05 0.23 0.980 9 78.79 30.48 0.15 0.994 3 OTC-500 59.10 24.92 0.29 0.980 8 62.58 24.16 0.20 0.994 1 OTC-750 45.54 17.39 0.15 0.978 0 48.23 17.07 0.07 0.991 1 OTC-1 000 36.69 11.68 0.64 0.960 6 39.46 11.55 −0.02 0.977 8 SMX-0 82.01 36.56 0.22 0.989 2 85.63 35.89 0.14 0.996 2 SMX-250 80.31 33.18 0.20 0.988 7 84.58 32.37 0.11 0.995 1 SMX-500 76.35 29.44 0.20 0.987 3 81.48 28.40 0.10 0.993 6 SMX-750 68.69 26.18 0.25 0.988 3 73.60 25.21 0.15 0.995 5 SMX-1 000 63.60 22.28 0.21 0.987 2 68.90 21.37 0.09 0.992 9 -
[1] CRAB R, AVNIMELECH Y, DEFOIRDT T, et al. Nitrogen removal techniques in aquaculture for a sustainable production[J]. Aquaculture, 2007, 270(1): 1-14. [2] ZHANG Q Q, BAI Y H, WU J, et al. Microbial community evolution and fate of antibiotic resistance genes in anammox process under oxytetracycline and sulfamethoxazole stresses[J]. Bioresource Technology, 2019, 293: 122096. doi: 10.1016/j.biortech.2019.122096 [3] LANG Z H, ZHOU M H, ZHANG Q Z, et al. Comprehensive treatment of marine aquaculture wastewater by a cost-effective flow-through electro-oxidation process[J]. Science of the Total Environment, 2020, 722: 137812. doi: 10.1016/j.scitotenv.2020.137812 [4] BAI L J, LI J, BISWAL B K, et al. Enhanced performance of “Candidatus Brocadia sinica” treating nitrogen-laden saline wastewater resulting from sorbitol addition: Enzyme activities and kinetics[J]. Desalination, 2020, 478: 114304. doi: 10.1016/j.desal.2019.114304 [5] 彭艳, 丁世敏, 刘蕖, 等. 水环境中抗生素的光化学降解研究进展[J]. 广州化工, 2016, 44(10): 14-17. [6] LULIJWA R, RUPIA E J, ALFARO A C. Antibiotic use in aquaculture, policies and regulation, health and environmental risks: a review of the top 15 major producers[J]. Reviews in Aquaculture, 2020, 12(2): 1-24. [7] WANG X T, LIN Y F, ZHENG Y, et al. Antibiotics in mariculture systems: A review of occurrence, environmental behavior, and ecological effects[J]. Environmental Pollution, 2022, 293: 118541. doi: 10.1016/j.envpol.2021.118541 [8] HAN Q F, ZHAO S, ZHANG X R, et al. Distribution, combined pollution and risk assessment of antibiotics in typical marine aquaculture farms surrounding the Yellow Sea, North China[J]. Environment International, 2020, 138: 105551. doi: 10.1016/j.envint.2020.105551 [9] 包樱钰, 李菲菲, 温东辉. 我国海水养殖业的抗生素污染现状[J]. 海洋环境科学, 2021, 40(2): 294-302. [10] PANG J X, LI J, CHEN R, et al. Synergistic biological removal of nitrogen and sulfide from saline mariculture wastewater by halophilic consortia[J]. Chemical Engineering Journal, 2021, 423: 130280. doi: 10.1016/j.cej.2021.130280 [11] VOSSENBERG J V D, WOEBKEN D, MAALCKE W J, et al. The metagenome of the marine anammox bacterium ‘ Candidatus Scalindua profunda’ illustrates the versatility of this globally important nitrogen cycle bacterium[J]. Environmental Microbiology, 2013, 15(5): 1275-1289. doi: 10.1111/j.1462-2920.2012.02774.x [12] SCHMID M C, RISGAARD PETERSEN N, VOSSENBERG J V D, et al. Anaerobic ammonium‐oxidizing bacteria in marine environments: widespread occurrence but low diversity[J]. Environmental Microbiology, 2007, 9(6): 1476-1484. doi: 10.1111/j.1462-2920.2007.01266.x [13] LU H F, LI Y Y, SHAN X Y, et al. A holistic analysis of ANAMMOX process in response to salinity: From adaptation to collapse[J]. Separation and Purification Technology, 2019, 215: 342-350. doi: 10.1016/j.seppur.2019.01.016 [14] AWATA T, KINDAICHI T, OZAKI N, et al. Biomass Yield Efficiency of the Marine Anammox Bacterium, “Candidatus Scalindua sp. ”, is Affected by Salinity[J]. Microbes and Environments, 2015, 30(1): 86-91. doi: 10.1264/jsme2.ME14088 [15] 白丽静. 相容性溶质强化厌氧氨氧化脱氮效能及其动力学研究 [D]. 青岛: 青岛大学, 2019. [16] YU H, LI J, DONG H Y, et al. Nitrogen removal performance of marine anammox bacteria treating nitrogen-rich saline wastewater under different inorganic carbon doses: High inorganic carbon tolerance and carbonate crystal formation[J]. Bioresource Technology, 2019, 288: 121565. doi: 10.1016/j.biortech.2019.121565 [17] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002 [18] LI J, CHEN X Q, LIU W Z, et al. Biostimulation of a marine anammox bacteria-dominated bioprocess by Co(II) to treat nitrogen-rich, saline wastewater[J]. Science of the Total Environment, 2020, 749: 141489. doi: 10.1016/j.scitotenv.2020.141489 [19] CAO Y, LOOSDRECHT M C M, DAIGGER G T. Mainstream partial nitritation–anammox in municipal wastewater treatment: status, bottlenecks, and further studies[J]. Applied Microbiology and Biotechnology, 2017, 101(4): 1365-1383. doi: 10.1007/s00253-016-8058-7 [20] CHO S, TAKAHASHI Y, FUJII N, et al. Nitrogen removal performance and microbial community analysis of an anaerobic up-flow granular bed anammox reactor[J]. Chemosphere, 2010, 78(9): 1129-1135. doi: 10.1016/j.chemosphere.2009.12.034 [21] FLOOD B E, JONES D S, BAILEY J V. Sedimenticola thiotaurini sp. nov. , a sulfur-oxidizing bacterium isolated from salt marsh sediments, and emended descriptions of the genus Sedimenticola and Sedimenticola selenatireducens [J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 54(Pt 5): 1477-1482. [22] XU L Z J, ZHANG Q, FU J J, et al. Deciphering the microbial community and functional genes response of anammox sludge to sulfide stress[J]. Bioresource Technology, 2020, 302: 122885. doi: 10.1016/j.biortech.2020.122885 [23] WANG J L, WAN W. Kinetic models for fermentative hydrogen production: A review[J]. International Journal of Hydrogen Energy, 2009, 34(8): 3313-3323. doi: 10.1016/j.ijhydene.2009.02.031 [24] YANG G F, ZHANG Q Q, JIN R C. Changes in the nitrogen removal performance and the properties of granular sludge in an Anammox system under oxytetracycline (OTC) stress[J]. Bioresource Technology, 2013, 129: 65-71. doi: 10.1016/j.biortech.2012.11.022 [25] 李晶. 氟喹诺酮抗生素对厌氧氨氧化菌活性抑制研究 [D]. 大连: 大连理工大学, 2015. [26] JIN R C, YANG G F, YU J J, et al. The inhibition of the Anammox process: A review[J]. Chemical Engineering Journal, 2012, 197: 67-79. doi: 10.1016/j.cej.2012.05.014 [27] 马静, 郑照明, 王朝朝, 等. 抗生素对厌氧氨氧化颗粒污泥脱氮性能的影响[J]. 中国环境科学, 2017, 37(04): 1315-1321. [28] TANG C J, ZHENG P, CHEN T T, et al. Enhanced nitrogen removal from pharmaceutical wastewater using SBA-ANAMMOX process[J]. Water Research, 2011, 45(1): 201-210. doi: 10.1016/j.watres.2010.08.036 [29] FAN N S, FU J J, HUANG D Q, et al. Resistance genes and extracellular proteins relieve antibiotic stress on the anammox process[J]. Water Research, 2021, 202: 117453. doi: 10.1016/j.watres.2021.117453 [30] ZHANG X J, ZHANG N, WEI D H, et al. Inducement of denitrification and the resistance to elevated sulfamethoxazole (SMX) antibiotic in an Anammox biofilm system[J]. Biochemical Engineering Journal, 2021, 176: 108171. doi: 10.1016/j.bej.2021.108171 [31] 杨腾飞. 磺胺甲噁唑和甲氧苄啶在污水处理系统中的归趋及其对生物脱氮系统的影响研究 [D]. 广州: 华南理工大学, 2018. [32] 姚芳. 厌氧氨氧化快速启动及磺胺类抗生素对其稳定运行影响的研究 [D]. 南京: 南京大学, 2017. [33] LI J, FENG L, QIANG Z M, et al. Enhanced performance and kinetics of marine anammox bacteria (MAB) treating nitrogen-rich saline wastewater with Mn(II) and Ni(II) addition[J]. Bioresource Technology, 2018, 249: 1085-1091. doi: 10.1016/j.biortech.2017.10.101 -



 下载:
下载: