-
厌氧氨氧化(anaerobic ammonium oxidation, anammox)工艺相较于传统硝化-反硝化脱氮工艺,具有曝气量少、不消耗有机物及污泥产率低等特点[1-3],并已成功应用于城市污水处理厂污泥水及与此类似的含有高浓度氨氮废水[4-6]。在厌氧氨氧化技术成功应用于处理高浓度含氮废水后,研究重点则从处理水量小、浓度高的污泥水(侧流)转变到处理水量大、浓度低的城镇污水(主流)处理[7-10]。
厌氧氨氧化反应的功能菌为厌氧氨氧化菌(AnAOB),而温度是AnAOB生长和代谢的一个重要参数,大多数厌氧氨氧化菌的最适生长温度为30~35 ℃[11]。而在实际污水处理厂主流的水温基本处于10~25 ℃。有研究[12-13]表明,温度每降低5 ℃,厌氧氨氧化菌的比生长速率下降30%~40%,从而影响反应器的脱氮效能。MA等[14]在利用厌氧氨氧化UASB反应器在中低温条件下处理低浓度废水时发现,当反应器温度由30 ℃降至16 ℃时,总氮去除率下降62%。因此,研究厌氧氨氧化菌活性随温度变化的规律对anammox技术应用于城市污水主流处理具有重要意义。
近年来,相比于传统活性污泥工艺,基于生物膜或颗粒污泥的主流工艺表现突出[15]。有研究表明,相较于活性污泥,在温度低于15 ℃的条件下,好氧颗粒污泥可长期稳定进行亚硝化过程并表现出0.63~0.7 kg·(m3·d)−1(以氮素计)的处理能力[16-17]。这说明不同形态的污泥在遭受温度变化时微生物响应特征存在差异。LOTTI等[18]在温度为10~30 ℃条件下,研究了以游离态和颗粒态存在的厌氧氨氧化菌的反应活化能,结果表明,以游离态存在的厌氧氨氧化菌对温度变化的敏感程度大于厌氧氨氧化颗粒污泥。这说明厌氧氨氧化菌的存在形态影响其对温度的适应性。随着以颗粒污泥和生物膜形式的厌氧氨氧化技术拟在城市污水处理厂主流工艺应用中的推进,厌氧氨氧化菌在不同温度和污泥形态条件下的反应活性和特性亟需了解和研究。
本研究以培养成熟的厌氧氨氧化颗粒污泥和生物膜为研究对象,通过测定anammox菌在不同温度(15~35 ℃)和不同形态下(游离态、颗粒污泥和生物膜)的活性,探讨了厌氧氨氧化反应的活化能和温度系数的变化,以期为厌氧氨氧化技术在主流系统脱氮的应用提供参考。
-
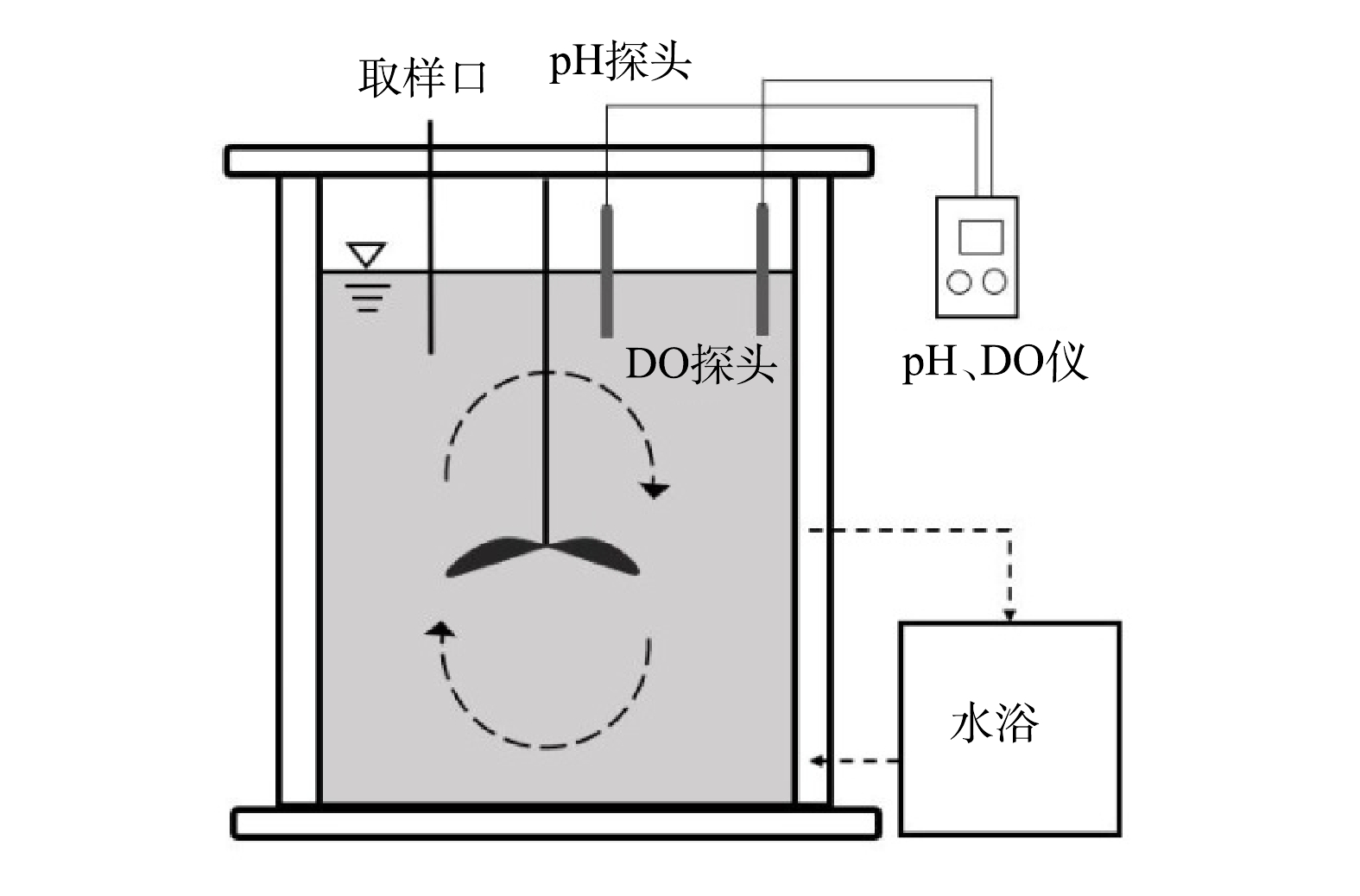
厌氧氨氧化活性(specific anammox activity, SAA)采用基质消耗速率法进行测定,测定装置如图1所示。反应器有效容积为7 L,内置推进器且在顶部设置进出水及取样口,温度由外部水浴控制,pH控制为7.5~8.1,DO控制在0.1 mg·L−1以下。活性测定过程中NH4+-N和NO2−-N由NH4Cl和NaNO2提供,质量浓度分别为30 mg·L−1和40 mg·L−1,每隔15~50 min(根据不同温度进行设定)取样并测定NH4+-N、NO2−-N和NO3−-N质量浓度,按式(1)计算厌氧氨氧化菌活性。
式中:ki为颗粒污泥、生物膜或游离状态厌氧氨氧化菌的厌氧氨氧化活性,g·(g·d)−1;ci为氮浓度变化(NH4+-N、NO2−-N及NO3−-N),mg·L−1;X为污泥浓度(mixed liquid volatile suspended solid,MLVSS),g·L−1。
厌氧氨氧化颗粒污泥取自实验室已稳定运行的厌氧氨氧化反应器,温度控制为35℃,进水负荷(nitrogen loading rate, NLR)为2.508 g·(L·d)−1,总氮(total nitrogen,TN)去除率为(87.77±1.59)%,MLVSS为(12.45±0.37) g·L−1,MLVSS/MLSS比值为0.67±0.04。厌氧氨氧化颗粒污泥呈红棕色且颗粒形态良好,直径为2 mm左右,SAA颗粒污泥为0.129 g·(g·d)−1。
厌氧氨氧化生物膜取自实验室已稳定运行的移动床生物膜反应器(moving bed biofilm reactor, MBBR),反应器温度控制为35 ℃,NLR为5.446 g·(L·d)−1,TN去除率为(73.15±5)%,填料型号为K3(比表面积为500 m2·m−3),生物膜厚度为2~3 mm,外观呈现红棕色,SAA生物膜为0.117 g·(g·d)−1 。
游离状态的厌氧氨氧化菌为实验所用颗粒污泥和生物膜通过磁力搅拌分散,以1 000 r·min−1搅拌时间3 min。由Microtrac Sync粒度仪(SYNC,美国)测定分散后的污泥粒径约为7.02~30.36 μm(≤30 μm),此时可认为污泥中的anammox处于游离态[19]。
-
NH4+-N、NO2−-N和NO3−-N的测定参照标准方法[20]进行。NH4+-N使用纳氏试剂分光光度法测定;NO2−-N使用N-(1-萘基)-乙二胺光度法测定;NO3−-N使用紫外分光光度法测定。MLSS和MLVSS使用标准重量法测定;pH使用雷磁PH-3C pH计测定;DO使用便携式溶氧仪测定。
-
厌氧氨氧化菌的生物反应速率(活性)和温度的关系通过Arrhenius方程(式(2))表示,对式(2)进行积分可得式(3)。
式中:k为厌氧氨氧化活性,g·(g·d)−1;Ea为反应所需活化能,J·mol−1;T为热力学温度,K;R为气体常数,8.314 J·(K·mol)−1。
式中:A为Arrhenius常数。通过测定不同温度下的k,做lnk与1/T的关系图,直线的斜率为-Ea/R,由此可确定相应形态下的厌氧氨氧化活化能Ea。若温度分别为T1和T2时,反应速率分别为k1和k2,将其分别代入式(3),得式(4)和式(5)。将式(4)和式(5)相减可得式(6),再进一步换算可得式(7)。
令Ea/(R·T1·T2)=KT (温度影响因子),e^(KT)=θ (温度系数),则(7)式可改为式(8)
根据不同温度下的Ea,计算温度影响因子KT,从而确定温度系数θ。
-
对实验污泥采用高通量测序,确定污泥中anammox菌的种群结构。取一定数量的生物膜及颗粒污泥,经去离子水淘洗离心后按照试剂盒E.Z.N.A.® soil DNA Kit (Omega Bio-tek,Norcross GA, U.S.)规定的方法对DNA进行提取。以提取的DNA为PCR模板,采用V3-V4引物(序列为338F:5'-ACTCCTACGGGAGGCAGCAG-3'和806R:5'-GGACTACHVGGGTWTATAAT-3'),在ABI Gene Amp® 9700 PCR thermo-cycler(ABI, CA,USA)上进行PCR反应。将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™ Fluorometer (Promega,USA)对回收产物进行检测定量。使用NEXTflexTM Rapid DNA-Seq Kit (Bioo Scientific,美国)进行建库,利用Illumina公司的Miseq PE300/NovaSeq PE250平台进行测序(上海美吉生物医药科技有限公司,www.majorbio.com)。
-
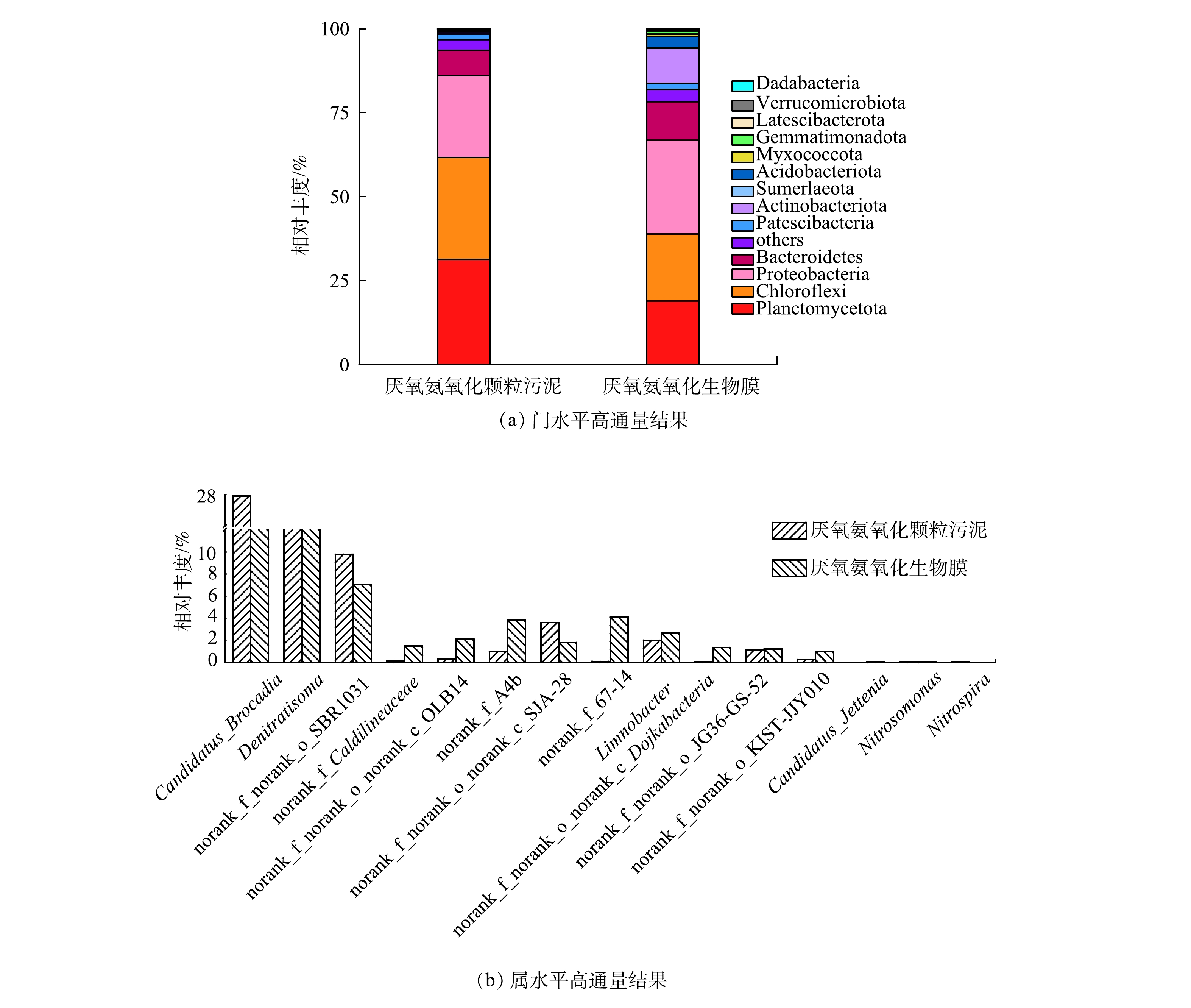
由图2可见,从门水平上来看,Planctomycetes门的微生物相对丰度分别为31.36%和18.86%,而Planctomycetes门中包含所有已知的anammox菌[21-22]。在属水平上,颗粒污泥和生物膜上探明的主要anammox菌属为Ca. Brocadia,此结果和主流系统内已探明的典型种属相同[23-24],相对丰度达到27.96%和17.52%。该结果表明anammox菌在颗粒污泥上和生物膜上均占据主导地位。除此之外,污泥中还含有Chloroflexi、Proteobacteria、Bacteroidetes。这些微生物的存在对颗粒污泥颗粒化及颗粒形态维持的过程中具有重要的作用[25]。因此,以上述2种污泥样品进行不同温度条件下的厌氧氨氧化活性特性研究是可行的。
-
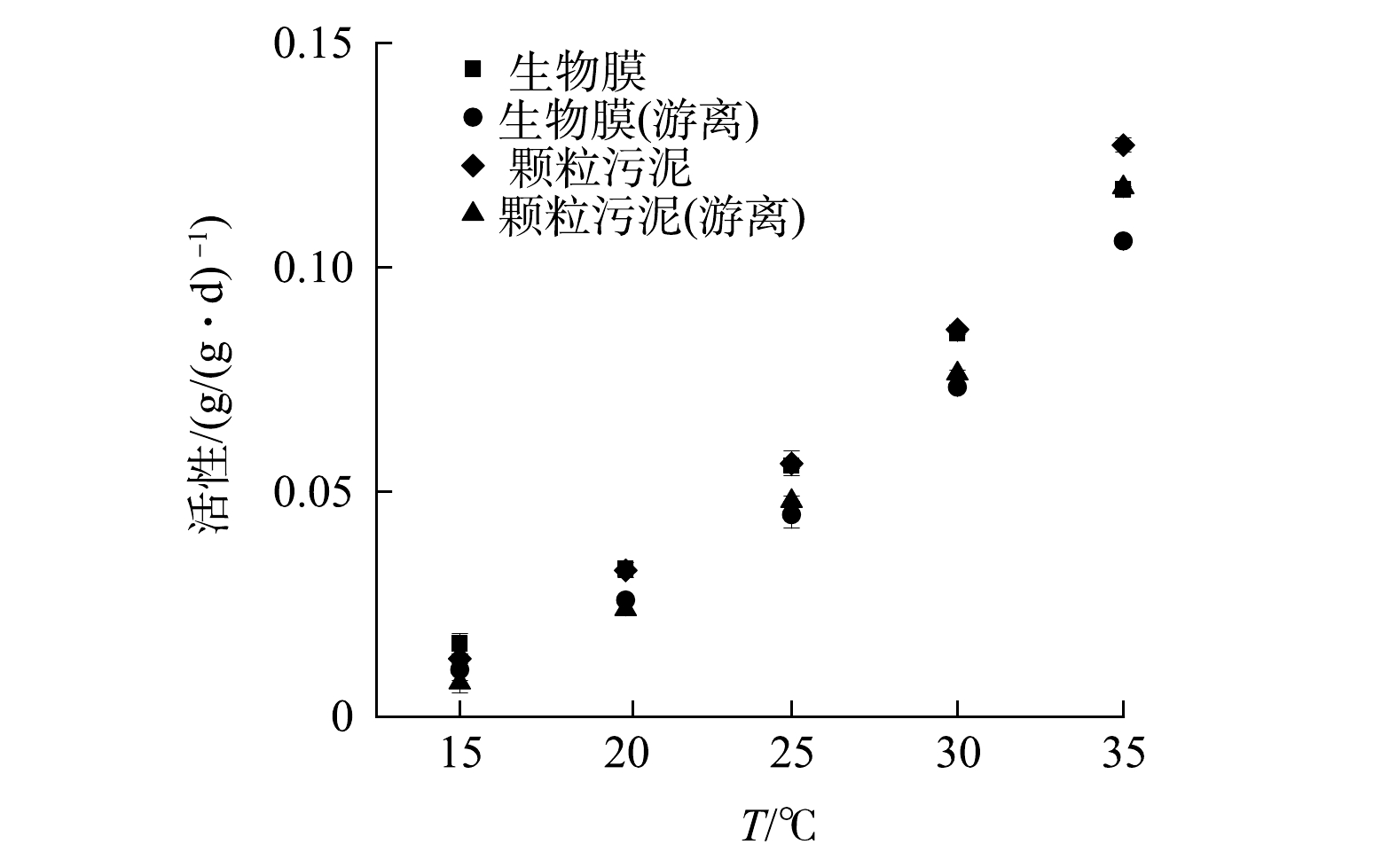
图3为不同温度条件下SAA的测定结果。SAA颗粒污泥随温度的下降而下降,当温度由35 ℃降至15 ℃时,SAA颗粒污泥由0.128 g·(g·d)−1下降至0.013 g·(g·d)−1,活性损失了89.89%。在对颗粒污泥进行分散处理后,SAA颗粒污泥(游离)由0.118 g·(g·d)−1(35 ℃)下降至0.008 g·(g·d)−1(15 ℃),活性损失增至93.58%。同样,当温度由35 ℃降至15 ℃时,SAA生物膜由0.117 g·(g·d)−1下降至0.016 g·(g·d)−1,活性损失为86.19%。在对生物膜进行分散处理后,SAA生物膜(游离)由0.106 g·(g·d)−1(35 ℃)下降至0.010 g·(g·d)−1(15 ℃),活性损失升至90.17%。由此可见,随着温度降低,SAA颗粒污泥和SAA生物膜均有不同程度的减小,但生物膜抵抗温度变化的能力较强。
-
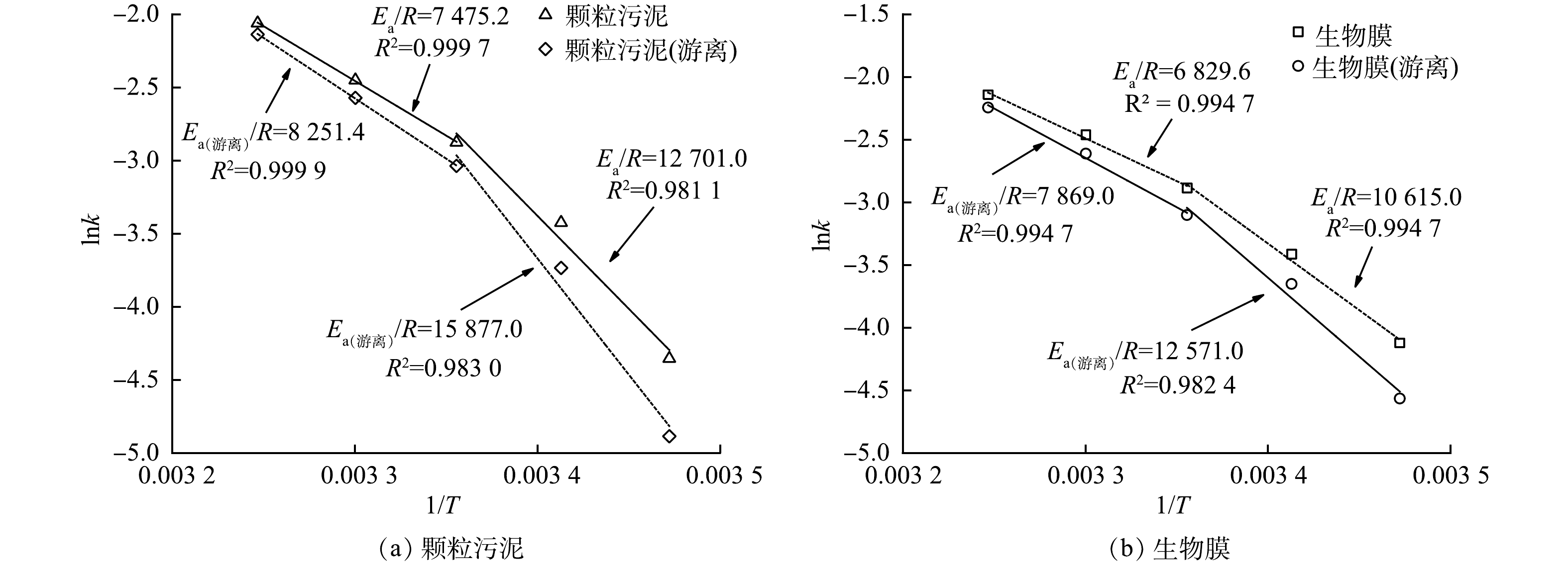
Ea值越大,说明反应过程中要跨越的能垒越大,该反应越难进行;反之,Ea值越小,则说明反应过程中要跨越的能垒越小,反应则越容易进行。由图4可见,不论颗粒污泥还是生物膜,若以15~35 ℃进行拟合,lnk和1/T线性关系较差,而若分别以15~25 ℃和25~35 ℃拟合,则能取得较好的线性关系。这表明颗粒污泥和生物膜的厌氧氨氧反应在不同温度范围内的活化能不同。谭锡诚等[26]在运行厌氧氨氧化反应器时也有相同发现。针对厌氧氨氧化活性存在拐点这一现象,ISAKA等[27]认为可能是由于厌氧氨氧化反应在不同温度区间酶活性存在差异所致。因此,将15~35 ℃分为15~25 ℃和25~35 ℃ 2个区间更符合anammox对温度的效应。由图4(a)可见,在15~25 ℃和25~35 ℃的活化能Ea-颗粒污泥分别为105.60 kJ·mol−1和62.15 kJ·mol−1;在15~25 ℃和25~35 ℃ Ea-颗粒污泥(游离)分别为132.00 kJ·mol−1和68.60 kJ·mol−1。由图4(b)可见,对生物膜而言,在15~25 ℃和25~35 ℃的活化能Ea-生物膜分别为88.25 kJ·mol−1和56.78 kJ·mol−1;在15~25 ℃和25~35 ℃ Ea-生物膜(游离)分别为104.52 kJ·mol−1和65.42 kJ·mol−1。以上数据说明不同形态的厌氧氨氧化菌活化能在不同温度区间有明显差异,温度较高时(25~35 ℃)的活化能明显小于温度较低时(15~25 ℃)的活化能。因此,厌氧氨氧化反应在温度较高时更容易进行。LOTTI等[18]的研究结果也证实了这一点。颗粒污泥和生物膜在进行分散处理后,Ea值均有不同程度的升高,说明Anammox菌的Ea与其存在状态有关。当Anammox菌以颗粒污泥和生物膜形态存在时,Anammox菌被胞外聚合物(EPS)包裹,这有助于抵抗外界温度变化[28];而当anammox菌以游离态存在时,由于缺少EPS的保护,anammox菌对温度变化就变得敏感。王淑莹等[29]研究温度对硝化反应的影响时也发现,同一温度范围内颗粒污泥的硝化反应Ea值低于絮状污泥。这说明颗粒污泥或生物膜空间结构的确有助于微生物抵抗外界的温度变化。除分散前后Ea发生变化外,生物膜所得Ea值与颗粒污泥所得Ea值两者存在差异,推测其原因可能是颗粒污泥与生物膜内EPS的含量不同。有研究表明,厌氧氨氧化颗粒污泥EPS含量为71.82~140.3 mg·g−1[30-34](以EPS计),而生物膜中EPS含量可高达300.84 mg·g−1[35]。此外,郭静[36]发现厌氧氨氧化生物膜中的EPS总量略高于颗粒污泥。这可能是造成生物膜Ea值与颗粒污泥Ea值存在差异的主要原因,但还需进一步研究。
表1比较了本研究与文献报道的厌氧氨氧化反应Ea值。本研究颗粒污泥和生物膜中的厌氧氨氧化菌在25~35 ℃下的反应活化能分别为62.15 kJ·mol−1和56.78 kJ·mol−1,上述数值与STROUS等[13]报道的Ca. Brocadia在20~43 ℃下的Ea为70 kJ·mol−1 相近。此外,LOTTI等[18]报道,厌氧氨氧化菌活化能为68 kJ·mol−1(25~30 ℃),这也与本研究获得的Ea值相近。颗粒污泥中的厌氧氨氧化菌在15~25 ℃下的反应活化能为105.60 kJ·mol−1。PARK等[37]利用厌氧氨氧化颗粒污泥在13~23 ℃下获得Ea为89.6 kJ·mol−1,略低于本研究的结果。这可能是因为实验所用anammox菌不同而存在差异。本研究中Anammox菌为Ca. Brocadia菌,而PARK等[37]研究的anammox菌是Ca. Kuenenia菌。
-
依据各温度区间所得Ea,可得出不同形态下anammox污泥的温度系数θ。结果表明,颗粒污泥在15~25 ℃和25~35 ℃下的温度系数θ分别为1.14和1.09;生物膜在15~25 ℃和25~35 ℃的θ分别1.12和1.08。
在污水处理中,温度系数可以衡量系统温度对反应速率和净化能力的影响,θ值越大,表明温度变化对该微生物活性的影响越大。我国城市污水处理厂生物池中温度通常为15~25 ℃,且厌氧氨氧化过程必须与亚硝化或部分反硝化配合使用,因此,对比15~25 ℃厌氧氨氧化工艺中各功能微生物的KT和θ是必要的。表2为本研究和文献报道的厌氧氨氧化工艺中功能微生物的KT和θ值。可见,当温度为15~25 ℃时,各功能微生物的θ值大致为θ反硝化<θAOB<θanammox。这可能与3种功能菌的最适温度有关。Anammox菌、氨氧化菌(ammonium oxidizing bacteria, AOB)和反硝化菌的适宜温度依次为30~40、20~30和15~35 ℃,使得anammox菌的θ值较大,即anammox菌对低温环境的适应性弱于其他2种微生物。相比于反硝化菌,AOB温度系数θ值略小,这表明AOB抵抗温度变化的能力较强。因此,在主流系统内采用亚硝化厌氧氨氧化工艺比部分反硝化厌氧氨氧化工艺更有优势。
-
1)当温度由35 ℃降至15 ℃时,以颗粒污泥形态存在的anammox菌活性由0.128 g·(g·d)−1下降至0.013 g·(g·d)−1,以生物膜形态存在的anammox菌活性由0.117 g·(g·d)−1下降至0.016 g·(g·d)−1。
2)以颗粒污泥形态存在的anammox菌在15~25 ℃和25~35 ℃的Ea分别为105.60 kJ·mol−1和62.15 kJ·mol−1;以生物膜形态存在的anammox菌在15~25 ℃和25~35 ℃的活化能分别为88.25 kJ·mol−1和56.78 kJ·mol−1。这表明以生物膜形态存在的anammox菌对于温度变化的抵抗能力较强。
3)以颗粒污泥形态存在的anammox菌在15~25 ℃和25~35 ℃的θ分别为1.14和1.09;以生物膜形态存在的anammox菌在15~25 ℃和25~35 ℃的θ分别为1.12和1.08。与硝化菌或反硝化菌相比,本实验所获得的厌氧氨氧化菌的温度系数θ偏大。这表明,厌氧氨氧化菌对温度的变化更为敏感,使得厌氧氨氧化在低温条件下首先将成为限制步。
温度变化对不同污泥形态厌氧氨氧化菌活性的影响
Effect of temperature change on anammox activities with different sludge morphology
-
摘要: 以Ca. Brocadia为主要种属的厌氧氨氧化颗粒污泥和生物膜为研究对象,通过测定不同温度下厌氧氨氧反应活化能以探讨温度对以不同污泥形态存在的厌氧氨氧化菌的短期影响。结果表明,在15~25 ℃和25~35 ℃,以颗粒污泥及生物膜形态存在的厌氧氨氧化菌的反应活化能不同。在15~25 ℃,颗粒污泥和生物膜中的厌氧氨氧化反应活化能分别为105.60 kJ·mol−1和88.25 kJ·mol−1,而在25~35 ℃,对应的活化能分别为62.15 kJ·mol−1和56.78 kJ·mol−1,均低于同温度条件下以游离态存在的厌氧氨氧化菌的反应活化能。这说明不同污泥形态对Anammox菌的温度效应不同,以生物膜和颗粒污泥形态存在的厌氧氨氧化菌具有较强抵抗温度变化的能力。在15~25 ℃,颗粒污泥和生物膜中厌氧氨氧化菌的温度系数θ分别为1.14和1.12,在25~35 ℃,对应的温度系数θ分别为1.09和1.08。与硝化菌或反硝化菌相比,厌氧氨氧化菌的温度系数
$ \theta $ 偏大。这表明厌氧氨氧化菌对温度的变化更为敏感,使得厌氧氨氧化在低温条件下首先将成为限制步。Abstract: To investigate the short-term effects of temperature on Ca. Brocadia anammox bacteria with granular sludge and biofilm, ex-situ batch experiments were conducted to test the reaction activation energy (Ea) of anammox. The results showed that the Ea of granular sludge and biofilm increased with decreasing temperature. The Ea values of granular sludge and biofilm were 105.60 kJ·mol−1 and 88.25 kJ·mol−1 between 15~25 ℃ and 62.15 kJ·mol−1 and 56.78 kJ·mol−1 between 25~35 ℃, respectively, they were lower than that of anammox existed in suspended state at the same temperature. This result indicated that the temperature effect was dependent on the sludge morphology. Anammox bacteria in granular sludge and biofilm had a better ability to resist temperature changes than that of anammox bacteria in suspended state. Notably, at 15~25 ℃ and 25~35 ℃, the temperature coefficient (θ) of anammox bacteria in granular sludge and biofilm were 1.14, 1.12 and 1.09, 1.08, respectively. Compared to nitrifying bacteria or denitrifying bacteria, the obtained θ values of anammox bacteria were relatively higher, indicating that anammox bacteria were more sensitive to temperature changes. Therefore, anammox process will be the limiting step when the temperature drops. -

-
表 1 不同实验厌氧氨氧化反应Ea值
Table 1. Ea values for anaerobic ammonia oxidation reactions in different tests
污泥形态 anammox种属 Ea/(kJ·mol−1) 参考文献 生物膜 Ca. Brocadia 88.25(15~25 ℃);56.78(25~35 ℃) 本研究 生物膜(游离) 104.52(15~25 ℃);65.42(25~35 ℃) 颗粒污泥 Ca. Brocadia 105.60(15~25 ℃); 62.15(25~35 ℃) 本研究 颗粒污泥(游离) 132.00(15~25 ℃);68.60(25~35 ℃) 颗粒污泥 Ca. Kuenenia
Ca.Jettenia93~94(6~28 ℃);33(28~37 ℃) [27] 颗粒污泥 Ca.Brocadia 230(10~15 ℃);105(15~20 ℃)
68(20~25 ℃);46(25~30 ℃)[18] 颗粒污泥 Ca. Kuenenia 89(20~43 ℃) [37] 颗粒污泥 Ca. Kuenenia. 72.8(10~30 ℃) [37] 颗粒污泥 Ca.Brocadia 89.6(13~23 ℃);16.4(23~33 ℃) [37] 活性污泥 Ca. Brocadia 107.4(10~25 ℃) [37] 活性污泥 Ca. Brocadia 70(20~43 ℃) [13] 活性污泥 Ca.Brocadia 293(10~15 ℃);131(15~20 ℃)
79(20~25 ℃);68(25~30 ℃)[18] 表 2 厌氧氨氧化工艺中功能微生物的KT和θ
Table 2. KT and θ of functional microorganisms in anammox process
-
[1] ZHANG L, NARITA Y, GAO L, et al. Microbial competition among anammox bacteria in nitrite-limited bioreactors[J]. Water Research, 2017, 125: 249-258. doi: 10.1016/j.watres.2017.08.052 [2] MA B, WANG S, CAO S, et al. Biological nitrogen removal from sewage via anammox: Recent advances[J]. Bioresource Technology, 2016, 200: 981-990. doi: 10.1016/j.biortech.2015.10.074 [3] WANG G, XU X, ZHOU L, et al. A pilot-scale study on the start-up of partial nitrification-anammox process for anaerobic sludge digester liquor treatment[J]. Bioresource Technology, 2017, 241: 181-189. doi: 10.1016/j.biortech.2017.02.125 [4] AZARI M, WALTER U, REKERS V, et al. More than a decade of experience of landfill leachate treatment with a full-scale anammox plant combining activated sludge and activated carbon biofilm[J]. Chemosphere, 2017, 174: 117-126. doi: 10.1016/j.chemosphere.2017.01.123 [5] SCHAUBROECK T, CLIPPELEIR D, WEISSENBACHER N, et al. Environmental sustainability of an energy self-sufficient sewage treatment plant: Improvements through DEMON and co-digestion[J]. Water Research, 2015, 2015(74): 166-179. [6] WANG C, LEE P H, KUMAR M, et al. Simultaneous partial nitrification, anaerobic ammonium oxidation and denitrification (SNAD) in a full-scale landfill-leachate treatment plant[J]. Journal of Hazardous Materials, 2014, 175: 622-628. [7] KARTAL B, KUENEN J G, LOOSDRECHT M C M V. Sewage treatment with anammox[J]. Science, 2010, 328(5979): 702-703. doi: 10.1126/science.1185941 [8] AKABOCI T R V, GICH F, RUSCALLEDA M. Assessment of operational conditions towards mainstream partial nitritation-anammox stability at moderate to low temperature: Reactor performance and bacterial community[J]. Chemical Engineering Journal, 2018, 350: 192-200. doi: 10.1016/j.cej.2018.05.115 [9] KAMP A, OTTOSEN L D M, THøGERSEN N B, et al. Anammox and partial nitritation in the mainstream of a wastewater treatment plant in a temperate region (Denmark)[J]. Water Science & Technology, 2019, 79: 1397-1405. [10] CAO Y, LOOSDRECHT M C M V, DAIGGER G T. Mainstream partial nitritation–anammox in municipal wastewater treatment: Status, bottlenecks, and further studies[J]. Applied Microbiology and Biotechnology, 2017, 101(4): 1365-1383. doi: 10.1007/s00253-016-8058-7 [11] 郑平, 胡宝兰. 厌氧氨氧化菌混培物生长及代谢动力学研究[J]. 生物工程学报, 2001(02): 193-198. doi: 10.3321/j.issn:1000-3061.2001.02.018 [12] DOSTA J, FERNANDEZ I, VAZQUEZ-PADIN J R, et al. Short- and long-term effects of temperature on the Anammox process[J]. Journal of Hazardous Materials, 2008, 154(1/2/3): 688-693. [13] STROUS M M, KUENEN J, JETTEN M. Key physiology of anaerobic ammonium oxidation[J]. Applied and Environmental Microbiology, 1999, 65(7): 3248-3250. doi: 10.1128/AEM.65.7.3248-3250.1999 [14] MA B, PENG Y, ZHANG S, et al. Performance of anammox UASB reactor treating low strength wastewater under moderate and low temperatures[J]. Bioresource Technology, 2013, 129(2): 606-611. [15] ALBERT B, JULIO P, JULIáN C. Applying ratio control in a continuous granular reactor to achieve full nitritation under stable operating conditions[J]. Environmental Science & Technology, 2010, 44(23): 8930-8935. [16] ISANTA E, REINO C, CARRERA J, et al. Stable partial nitritation for low-strength wastewater at low temperature in an aerobic granular reactor[J]. Water Research, 2015, 80(sep.1): 149-158. [17] REINO C, SUáREZ-OJEDA M, PéREZ J, et al. Kinetic and microbiological characterization of aerobic granules performing partial nitritation of a low-strength wastewater at 10°C[J]. Water Research, 2016, 101: 147-156. doi: 10.1016/j.watres.2016.05.059 [18] LOTTI T, KLEEREBEZEM R, LOOSDRECHT M V. Effect of temperature change on anammox activity[J]. Biotechnology & Bioengineering, 2015, 112(1): 98-103. [19] LOTTI T, KLEEREBEZEM R, LUBELLO C, et al. Physiological and kinetic characterization of a suspended cell anammox culture[J]. Water Research, 2014, 60(14): 1-14. [20] 国家环境保护局. 水和废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社, 2002. [21] KUENEN J G. Anammox bacteria: From discovery to application[J]. Nature Reviews Microbiology, 2008, 6(4): 320-326. doi: 10.1038/nrmicro1857 [22] CAO S, DU R, PENG Y, et al. Novel two stage partial denitrification (PD)-Anammox process for tertiary nitrogen removal from low carbon/nitrogen (C/N) municipal sewage[J]. Chemical Engineering Journal, 2019, 362: 107-115. doi: 10.1016/j.cej.2018.12.160 [23] LAURENI M, FALAS P, ROBIN O, et al. Mainstream partial nitritation and anammox: Long-term process stability and effluent quality at low temperatures[J]. Water Research, 2016, 101: 628-639. doi: 10.1016/j.watres.2016.05.005 [24] CLARACREINO, SUáREZ-OJEDA M E, PéREZ J, et al. Stable long-term operation of an upflow anammox sludge bed reactor at mainstream conditions[J]. Water Research, 2018, 128: 331-340. doi: 10.1016/j.watres.2017.10.058 [25] FERNáNDEZ-GóMEZ B, RICHTER M, SCHüLER M, et al. Ecology of marine Bacteroidetes: A comparative genomics approach[J]. The International Society for Microbial Ecology Journal, 2013, 7(5): 1026-1037. [26] 谭锡诚. Anammox系统对温度变化的响应规律研究[D]. 徐州: 中国矿业大学, 2017. [27] KAZUICHI I, YASUHIRO D, YUYA K, et al. Nitrogen removal performance using anaerobic ammonium oxidation at low temperatures[J]. FEMS Microbiology Letters, 2008, 282(1): 32-38. doi: 10.1111/j.1574-6968.2008.01095.x [28] MA H, ZHANG Y, XUE Y, et al. Relationship of heme c, nitrogen loading capacity and temperature in anammox reactor[J]. Science of The Total Environment, 2019, 659: 568-577. doi: 10.1016/j.scitotenv.2018.12.377 [29] 王淑莹, 刘旭, 吴蕾. 温度和游离氨对颗粒与絮状污泥硝化性能影响的对比研究[J]. 北京工业大学学报, 2013, 39(2): 297-303. [30] LI Z, XU X, SHAO B, et al. Anammox granules formation and performance in a submerged anaerobic membrane bioreactor[J]. Chemical Engineering Journal, 2014, 254: 9-16. doi: 10.1016/j.cej.2014.04.068 [31] NI B J, HU B L, FANG F, et al. Microbial and physicochemical characteristics of compact anaerobic ammonium-oxidizing granules in an upflow anaerobic sludge blanket reactor.[J]. Applied and Environmental Microbiology, 2010, 76(8): 2652-2656. doi: 10.1128/AEM.02271-09 [32] TANG C-J, ZHENG P, WANG C H, et al. Performance of high-loaded ANAMMOX UASB reactors containing granular sludge[J]. Water Research, 2010, 45(1): 135-144. [33] 李惠娟. 部分亚硝化/厌氧氨氧化处理高氨氮废水试验研究[D]. 西安: 西安建筑科技大学, 2017. [34] 杨明明. 厌氧氨氧化颗粒污泥胞外聚合物(EPS)及表面特性研究[D]. 重庆: 重庆大学, 2019. [35] 彭永臻, 王锦程, 李翔晨, 等. 氮负荷对短程反硝化耦合厌氧氨氧化生物膜系统脱氮性能的影响[J]. 北京工业大学学报, 2021, 47(12): 1367-1376. [36] 郭静. 胞外聚合物对厌氧氨氧化污泥性能的影响研究[D]. 徐州: 中国矿业大学, 2017. [37] PARK G, TAKEKAWA M, SODA S, et al. Temperature dependence of nitrogen removal activity by anammox bacteria enriched at low temperatures[J]. Journal of Bioscience & Bioengineering, 2016, 123(4): 505-511. [38] GUO J, PENG Y, HUANG H, et al. Short- and long-term effects of temperature on partial nitrification in a sequencing batch reactor treating domestic wastewater[J]. Journal of Hazardous Materials, 2010, 179(1/2/3): 471-479. [39] 包毅, 宋家俊, 阴方芳, 等. 低温对亚硝化颗粒污泥系统的影响特性[J]. 环境工程, 2020, 38(12): 32-37. [40] SALVETTI R, AZZELLINO A, CANZIANI R, et al. Effects of temperature on tertiary nitrification in moving-bed biofilm reactors[J]. Water Research, 2006, 40(15): 2981-2993. doi: 10.1016/j.watres.2006.05.013 [41] SEUNTJENS D, HAN M, KERCKHOF F M, et al. Pinpointing wastewater and process parameters controlling the AOB to NOB activity ratio in sewage treatment plants[J]. Water Research, 2018, 138(JUL.1): 37-46. [42] 马娟, 彭永臻, 王丽, 等. 温度对反硝化过程的影响以及pH值变化规律[J]. 中国环境科学, 2008(11): 1004-1008. doi: 10.3321/j.issn:1000-6923.2008.11.009 [43] KAZMI A. A, FURUMAI H. Field investigations on reactive settling in an intermittent aeration sequencing batch reactor activated sludge process[J]. Water Science and Technology, 2000, 41(1): 127-135. doi: 10.2166/wst.2000.0021 -




 下载:
下载: