-
在地球生物化学循环中,微生物对有机物分解、转化和营养物质再利用起着关键作用[1]。在细菌含量丰富、物质交换频繁的高活性沉积物中,细菌控制着营养元素的形态和去向[2],因此,研究沉积物中细菌群落结构的组成对阐明湖泊的物质循环及其生态系统功能具有重要的指导意义。
有关微生物多样性研究,已有较多文献报道。薛银刚等[3]发现,不同湖区表层沉积物细菌的物种丰富度和均匀度有差异,表现为水草区>湖心区>河口区;不同湖区优势细菌群落组成存在差异。赵大勇等[4]通过T-RFLP技术比较了太湖梅梁湾不同深度沉积物中细菌群落结构组成及多样性,结果表明,相邻近的沉积物分层中细菌群落结构的相似度较高;随着沉积物深度的增加,沉积物中优势菌属发生了一定的变化;表层沉积物与底层沉积物的细菌群落结构相差较大。寄博华等[5]通过高通量测序技术考察了滇池斗南湿地菖蒲、芦苇和美人蕉3种代表性挺水植物根区沉积物的细菌群落结构特征,结果表明,相同植物不同采样区沉积物细菌群落结构较相似,但不同植物区菌群结构差异较大。不同的人类活动对湖泊沉积物细菌群落组成有一定影响。JIN等[6]以鄱阳湖为研究对象,发现在干扰区,细菌群落多样性高于未干扰区,但主要的细菌门相似。WAN等[7]研究了5种不同营养状态湖泊底泥于冬季和夏季的细菌群落,结果表明,细菌群落的时空变化较为明显,夏季细菌多样性高于冬季,且随湖区营养状况的下降而增加。
白洋淀作为雄安新区的重要生态水体,其生态环境状况受到社会各界广泛关注。2016—2018年夏秋季,河北省监测白洋淀淀区及入淀河流水质为劣Ⅴ类,由营养盐超标导致的富营养化程度加剧[8]。自雄安新区成立以来,白洋淀流域实施了一系列污染综合整治措施,基本上遏制了水体污染加重趋势[9]。目前,富营养化湖泊底泥微生物多样性的研究已有一些报道,但多见于研究典型富营养化湖泊垂直向或水平向的微生物群落结构特征及其与环境因子之间的相关性。本研究以白洋淀6个不同富营养化程度的湖区为研究对象,应用高通量测序技术研究不同富营养化水平湖泊底泥中细菌群落结构和多样性。本研究获得的结果有利于认识白洋淀沉积物中微生物生长状况、影响因素及其与富营养化程度的关系。
全文HTML
-
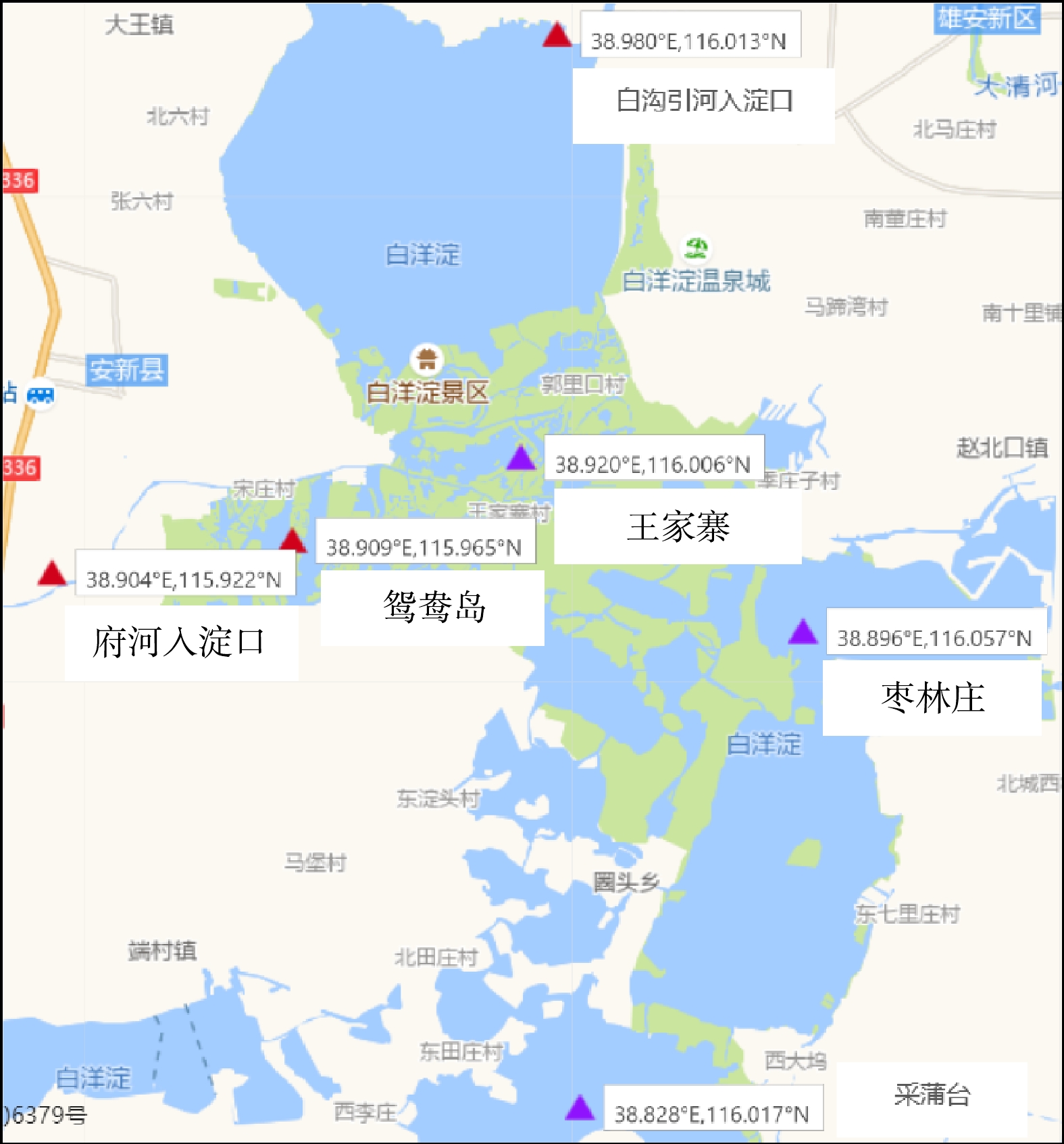
于白洋淀选取6个采样点位(图1),由北向南依次为白沟引河入淀口、王家寨、鸳鸯岛、府河入淀口、枣林庄、采蒲台采样点。选择水流平缓且远离岸边的位点,于2018年8月在各采样位点分别采集表层0 ~ 5 cm沉积物样品,每个采样点取3个平行样并充分混合,将混合样品放入灭菌的聚乙烯自封袋并尽快运回实验室,在−80 ℃冰箱保存。取一小部分沉积物新鲜样品用于测定氨氮(
${\rm{NH}}_4^ + $ -N)、硝氮(${\rm{NO}}_3^ - $ -N);一部分样品自然风干后研磨,用于测定总氮(TN)、总磷(TP)及总有机碳(TOC)含量。上覆水样品于水面下约80 cm处采集,尽快运回实验室用于上覆水化学需氧量(COD)、高锰酸盐指数(CODMn)、TN、${\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N、TP及TOC含量测定。 -
应用水质多功能测定仪现场测定各采样点水体的温度(T)、溶解氧(DO)和pH,其余指标均在实验室测定。上覆水COD采用快速消解分光光度法(HJ/T 399-2007)[10]测定;TN采用碱性过硫酸钾消解紫外分光光度法(HJ 636-2012)[11]测定;
${\rm{NH}}_4^ + $ -N采用纳氏试剂分光光度法(HJ 535-2009)[12]测定;${\rm{NO}}_3^ - $ -N采用紫外分光光度法(HJ/T 346-2007)[13]测定;TP采用钼酸铵分光光度法(GB 11893-1989)[14]测定。沉积物TN采用凯氏法(HJ 717-2014)[15]测定;${\rm{NH}}_4^ + $ -N和${\rm{NO}}_3^ - $ -N采用氯化钾溶液提取-分光光度法(HJ 634-2012)[16]测定;TP采用碱熔-钼锑抗分光光度法(HJ 632-2011)[17]测定。TOC含量采用总有机碳分析仪(HJ/T 104-2003)[18]测定。 -
评价因子选择透明度(SD)、叶绿素a含量(Chla)、TN、TP、CODMn共5个指标进行评价。综合营养状态指数TLI(∑)[7]计算公式为:
式中:TLI(∑)为综合营养状态指数;Wj为第j种参数的营养状态指数的相关权重;TLI(j)代表第j种参数的营养状态指数。贫营养TLI(∑)<30;中营养30≤TLI(∑)≤50;富营养TLI(∑)>50;轻度富营养50<TLI(∑)≤60;中度富营养60<TLI(∑)≤70;重度富营养TLI(∑)>70。
-
在对样品预处理之后,通过E.Z.N.A.WaterDNAKit(OTUMEGA,美国)试剂盒,进行不同富营养化水平水体底泥样品基因组DNA提取、测定浓度,并将提取的DNA样品置于−80 ℃冷冻储存。采用16S rRNA通用引物对341F(CCTACGGGNGGCWGCAG), 805R(GACTACHVGGGTATCTAATCC)进行V3~V4区目的基因PCR扩增。在Miseq平台上对16S rRNA的V3-V4高变区进行高通量测序。每个样品均重复测定3次。来自该研究的所有RNA-seq数据可通过NCBI序列阅读档案(SRA)下载(http://www.ncbi.nlm.nih.gov/sra),登录号为SRP268032。
-
将Miseq测序所得的原始数据进行拼接,同时对拼接后的序列进行质控和过滤,得到优化序列。将相似性>97%的优化序列划分为一个操作分类单元(operational taxonomic units,OTUs)。计算Chao1指数、observed_species指数评估菌群丰度;用香农指数(Shannon)、辛普森指数(Simpson)和PD_whole_tree指数表征菌群的多样性。基于R语言的ggplot2包绘制物种丰度柱状图。使用1-cor函数计算样本间的相关距离,并基于R的pheatmap包绘制样本间距离热图;计算菌属和环境因子之间的Spearman相关性系数,并基于R的pheatmap包绘制相关性热图。
1.1. 研究区域与样品采集
1.2. 水质、沉积物理化指标测定
1.3. 综合营养状态指数的计算
1.4. MiSeq高通量测序
1.5. 测序数据分析
-
各采样位点水体富营养化评价结果如表1所示。白沟引河入淀口、府河入淀口、鸳鸯岛是重度富营养化采样点,其综合营养状态指数TLI为78.12~81.33;王家寨、枣林庄、采蒲台是中度富营养化采样点,其TLI为65.05~67.76。
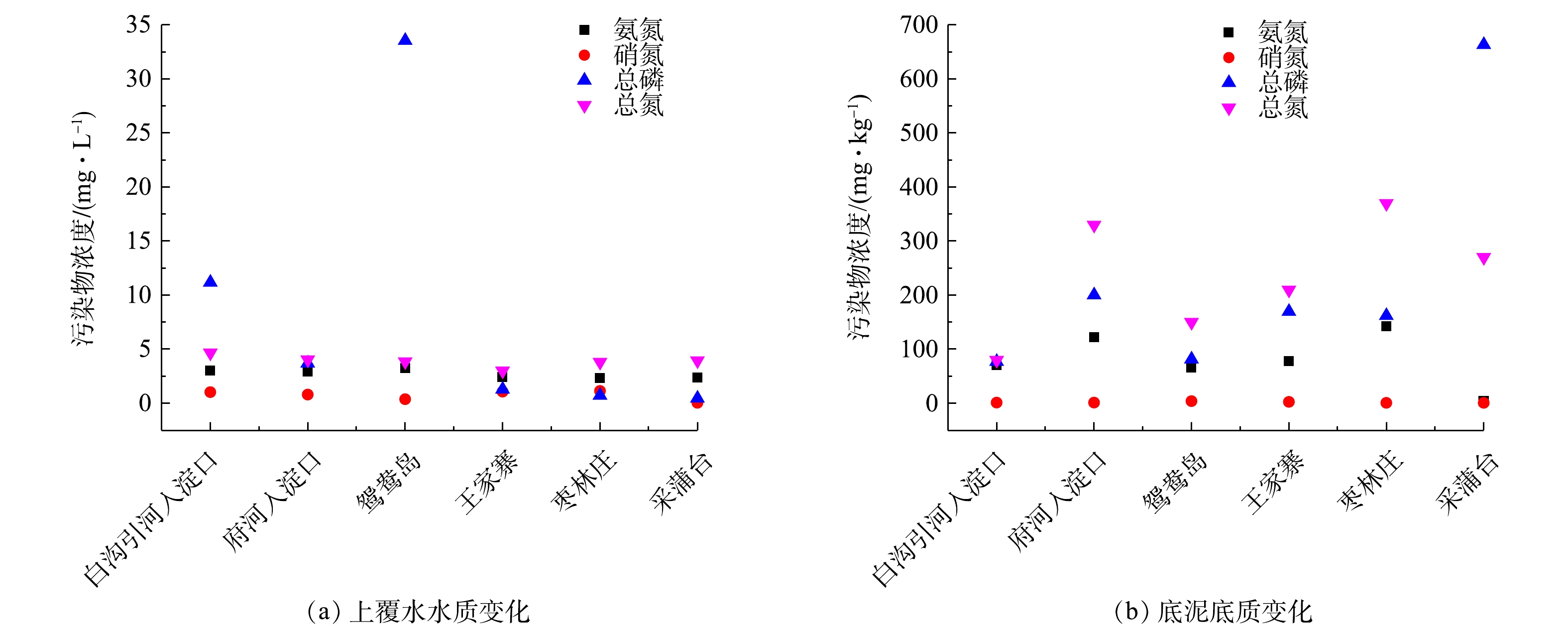
表2为不同采样位点的温度、pH、DO、Chla量。图2为各采样位点上覆水和沉积物的氮磷水平。夏季白洋淀各采样点水体温度变化不明显,维持在29.5~32.2 ℃。除采蒲台以外,其余采样点的上覆水DO含量相对较低,在3.13~5.60 mg·L−1,这是因为富营养化严重的湖区藻类等水生植物大量繁殖,阻碍了空气中氧气进入水体,也与水体中好氧微生物的分解消耗有关。各采样点pH为6.85~8.13,整体上呈中性偏碱性。Chla变化规律为重度富营养化区域>中度富营养化区域,其浓度代表湖泊藻类含量,是评价水体富营养化程度的重要指标,白洋淀水体中Chla含量均达到10 μg·L−1以上。
由图2可知,重度富营养化采样点上覆水的TOC、TN和TP含量高于中度富营养化采样点,而沉积物TOC、TN和TP含量低于中度富营养化采样点。鸳鸯岛和采蒲台上覆水TP含量分别为最高和最低,其沉积物TP含量也分别为最低和最高。白沟引河入淀口的上覆水TN含量最高和最低分别出现在白沟引河入淀口和王家寨,他们沉积物TN含量分别为最低及最高。枣林庄采样点的上覆水
${\rm{NH}}_4^ + $ -N含量最低,${\rm{NO}}_3^ - $ -N含量最高,沉积物${\rm{NH}}_4^ + $ -N含量最高。采蒲台采样点的上覆水${\rm{NO}}_3^ - $ -N、沉积物${\rm{NH}}_4^ + $ -N和${\rm{NO}}_3^ - $ -N含量均最低。府河入淀口采样点的上覆水和沉积物中均有较高的${\rm{NH}}_4^ + $ -N含量,这可能和保定市区生活污水排放有关[8]。 -
本研究测序共获得204 320条序列,共检测到16 005个OTUs。单个测样点OTUs数为2 455~2 895个。不同富营养化水平水体底泥细菌群落α多样性指数如表3所示。Observed_species和chao1指数用来评估样本中被检测到的OTUs量,而Shannon指数、Simpson指数以及PD_whole_tree综合考虑群落中物种的丰富度和均匀度。不同采样点的α多样性指数表明,中度富营养化区域细菌群落的丰富度和均匀度均高于重度富营养化区域,因此可认为,富营养化水体沉积物中细菌群落多样性随营养水平升高而降低。WAN等[7]对太湖夏季综合营养状态指数为48.6~61.3的5个湖区沉积物的微生物多样性进行了研究,结果表明,细菌群落多样性随湖区营养程度减轻而增加,本研究结果与之一致。在极度贫营养条件下,水体中微生物种类相对较少,随着营养水平的逐渐升高,微生物由于营养物质等生存条件的改变,多样性增加,超富营养和接近超富营养湖区的水体中细菌群落多样性表现为减少的趋势[19]。
-
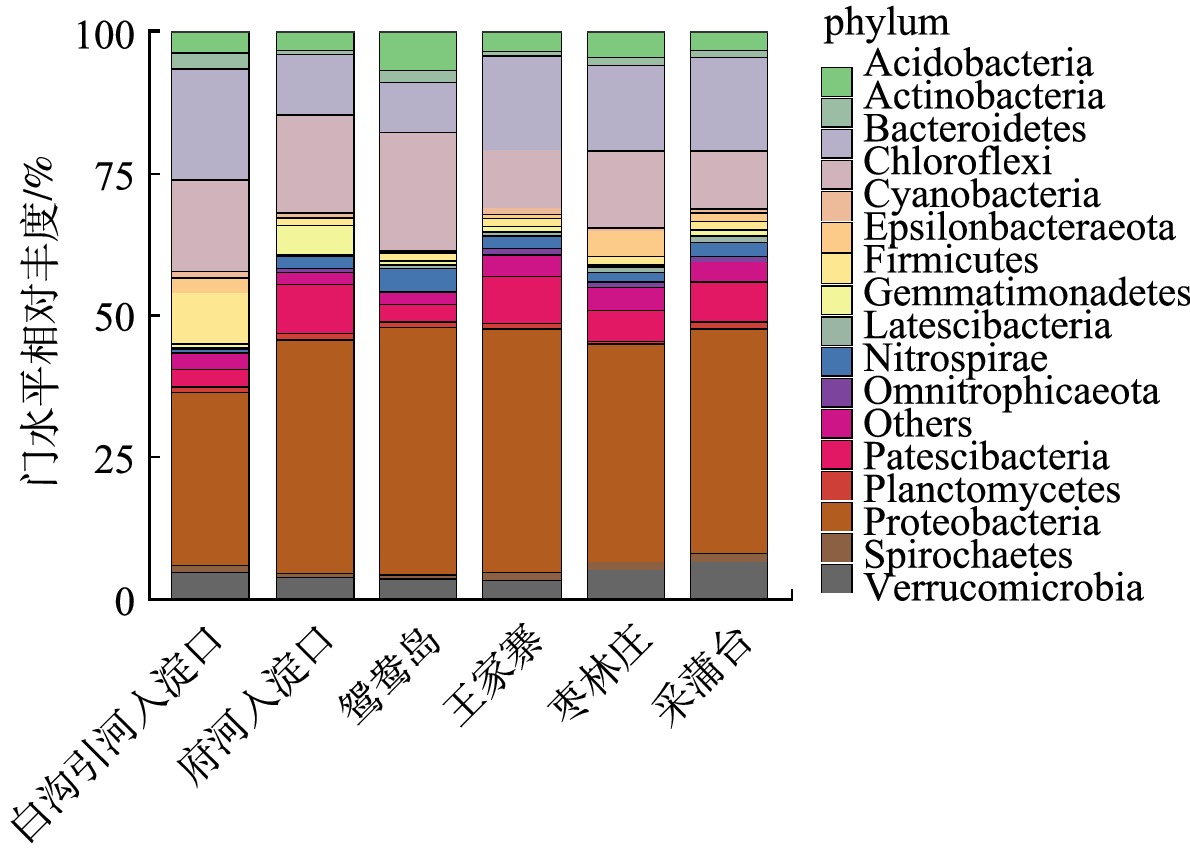
将白洋淀不同富营养化水平底泥样品进行数据库比对,同时分析各个水平上的细菌群落结构组成。将门水平上相对丰度≥1%的菌种绘制柱形图,结果如图3所示。白洋淀沉积物细菌群落结构在门分类水平上具有较高的多样性,各采样点位细菌组成差异不大,优势菌门为变形菌门(Proteobacteria) 31%~43%、绿弯菌门(Chloroflexi) 10%~21%、拟杆菌门(Bacteroidetes) 9%~20%、浮霉菌门(Patescibacteria) 3%~9%、疣微菌门(Verrucomicrobia) 3%~7%、酸杆菌门(Acidobacteria) 3%~7%、硝化螺旋菌门(Nitrospirae) 1%~4% 等;在大多数沉积物样品中,变形菌门(34%~47%)、酸杆菌门(3%~8%)、绿弯菌门(3%~10%)和拟杆菌门(3%~13%)为优势种类[20-21]。Nitrospirae也多次被发现在淡水沉积物中为优势菌群[22]。在变形菌门中发现的主要菌种有α-变形菌纲(α-Proteobacteria)1.47%~6.11%、γ-变形菌纲(γ-Proteobacteria)12.80%~32.99% 和δ-变形杆菌纲(δ-Proteobacteria)8.50%~11.73%。白沟引河入淀口的α-Proteobacteria丰度和δ-Proteobacteria高于其他采样点,分别为6.11%、11.73%,而γ-Proteobacteria丰度却远低于其他采样点,为12.80%。有研究[23]表明,α-Proteobacteria、β-Proteobacteria 和γ-Proteobacteria中含有许多反硝化细菌,可进行自养或异养反硝化,δ-Proteobacteria包含了以其他细菌为食的细菌,对沉积物氮、磷、硫和有机质循环有重要作用[24]。据报道[25],Chloroflexi为光能自养型细菌,可在各种条件下较好生存,其多数种类是涉及有机污染物降解的细菌,白洋淀水体不同程度的富营养化状态使得Chloroflexi具有显著生存优势,成为白洋淀水体底泥的第二大优势菌门。Chloroflexi在重度富营养化采样点白沟引河入淀口、府河入淀口、鸳鸯岛的占比分别为16%、17%、21%,而在中度富营养化采样点王家寨、枣林庄、采蒲台的占比分别为10%、14%、10%,这间接说明了重度富营养化区域的COD含量高于中度富营养化区域,和水质分析结果一致。Verrucomicrobia是革兰氏阴性细菌,在海洋动物、南极沿岸沉积物和海水等环境中存在[26],在厌氧条件下进行亚硝化作用。
除此之外,放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)等的平均相对丰度也达到1%以上。据报道[27],Actinobacteria和Acidobacteria是重要的根际细菌,鸳鸯岛采样点的Acidobacteria相对丰度远高于其它采样点,为6.76%,Actinobacteria的相对丰度为2.26%,仅次于白沟引河入淀口,这可能与鸳鸯岛是白洋淀旅游区,种植了大量观赏性植物有关。有研究[28]称Gemmatimonadetes是一类光合细菌,能利用水体中氮源,在氮循环过程中起重要作用;本研究中,Gemmatimonadetes在府河入淀口采样点占比为5.26%,在除采蒲台(1.38%)以外的其他采样点占比均<1%,因此推断,这可能与府河入淀口氮含量高有关。Firmicutes可参与多种物质和元素的降解和转化[29],Firmicutes在白沟引河入淀口采样点的相对丰度为9.01%,在其它采样点的相对丰度为1.21%~2.52%。
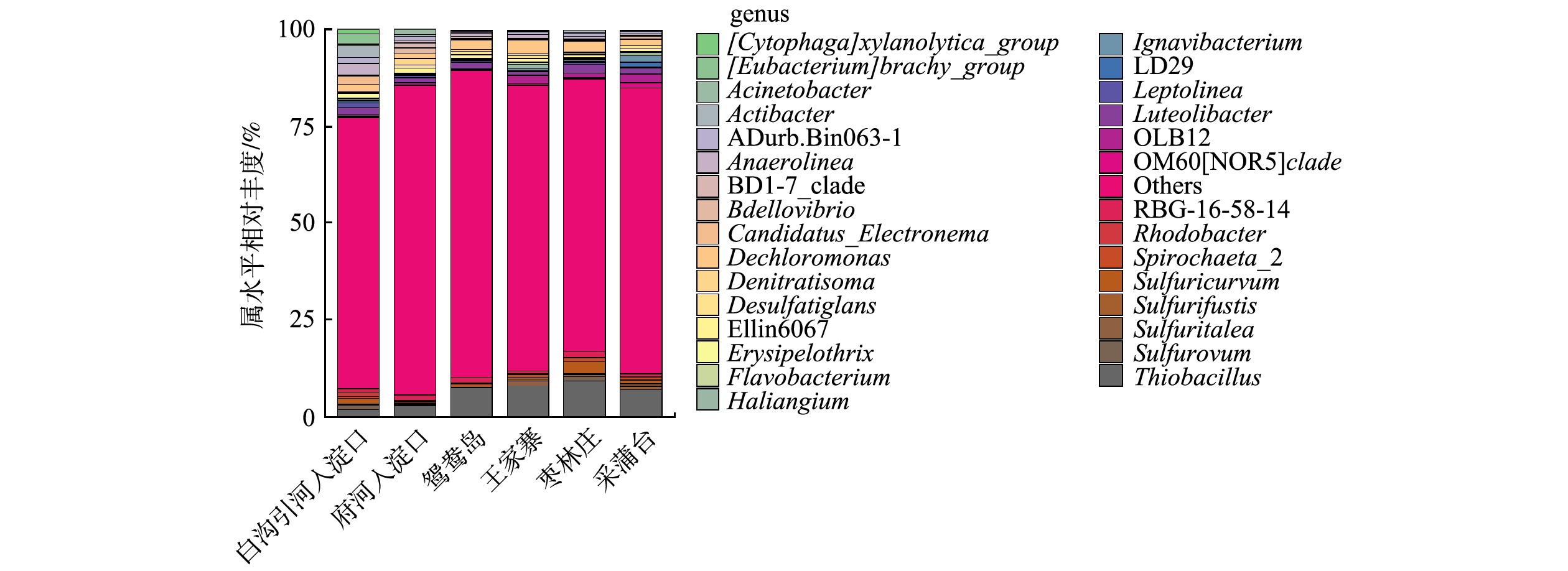
由图4可知,不同富营养化水平采样点属水平上细菌群落结构有差异,且物种丰度小于1%的菌属较多。这也说明不同富营养化水平底泥的物种丰富度较高,与α多样性较高一致。有研究[30]表明,这些沉积物细菌群落的丰富性和多样性使沉积物在营养盐循环、有机物降解、重金属形态转化等方面起着重要的生态功能。重度富营养化水体底泥的优势菌属是硫杆菌属(Thiobacillus)、脱氯单胞菌属(Dechloromonas)、厌氧绳菌属(Anaerolinea)、Luteolibacter、RBG-16-58-14;中度富营养化水体底泥的优势菌属是硫杆菌属(Thiobacillus)、脱氯单胞菌属(Dechloromonas)、OLB12、Luteolibacter、Sulfuricurvum。
Thiobacillus是白洋淀水体底泥中相对丰度最高的菌属,一些种类的Thiobacillus可直接将有机硫分解为无机硫。多数Thiobacillus可利用H2、硫化物等为电子供体,以硝态氮、亚硝态氮为电子受体实现反硝化及硫酸盐的还原,生成H2S;另外,还原态硫化物(H2S、
${{\rm{S}}_2}{\rm{O}}_3^{2 - }$ )或单质硫也可被Thiobacillus氧化为硫酸。因此,硫杆菌属对白洋淀底泥氮硫污染物去除有一定积极作用,并且参与了白洋淀水体的自净过程。但要防止富余的H2S气体与水体中Fe2+、Mn2+等形成金属硫化物,被水体中悬浮颗粒吸附而对水体的黑度有一定的影响;剩余H2S气体容易随水体上升,形成难闻气味[31]。Dechloromonas是白洋淀水体底泥的第二大优势菌属,是一种反硝化细菌,在王家寨采样点的相对丰度最高,为3.45%,这可能是由于王家寨上覆水和底泥中均有较高的硝氮含量。不动杆菌属(Acinetobacter)在白沟引河入淀口的相对丰度最高,为3.14%,具有反硝化、异养硝化功能。Spirochaeta_2是一种厌氧细菌。黄杆菌属(Flavobacterium)在白洋淀水体底泥的相对丰度为0.09% ~ 0.41%,Flavobacterium大多为具有脱氮与除磷功能的反硝化菌和异养硝化-好氧反硝化菌[32]。 -
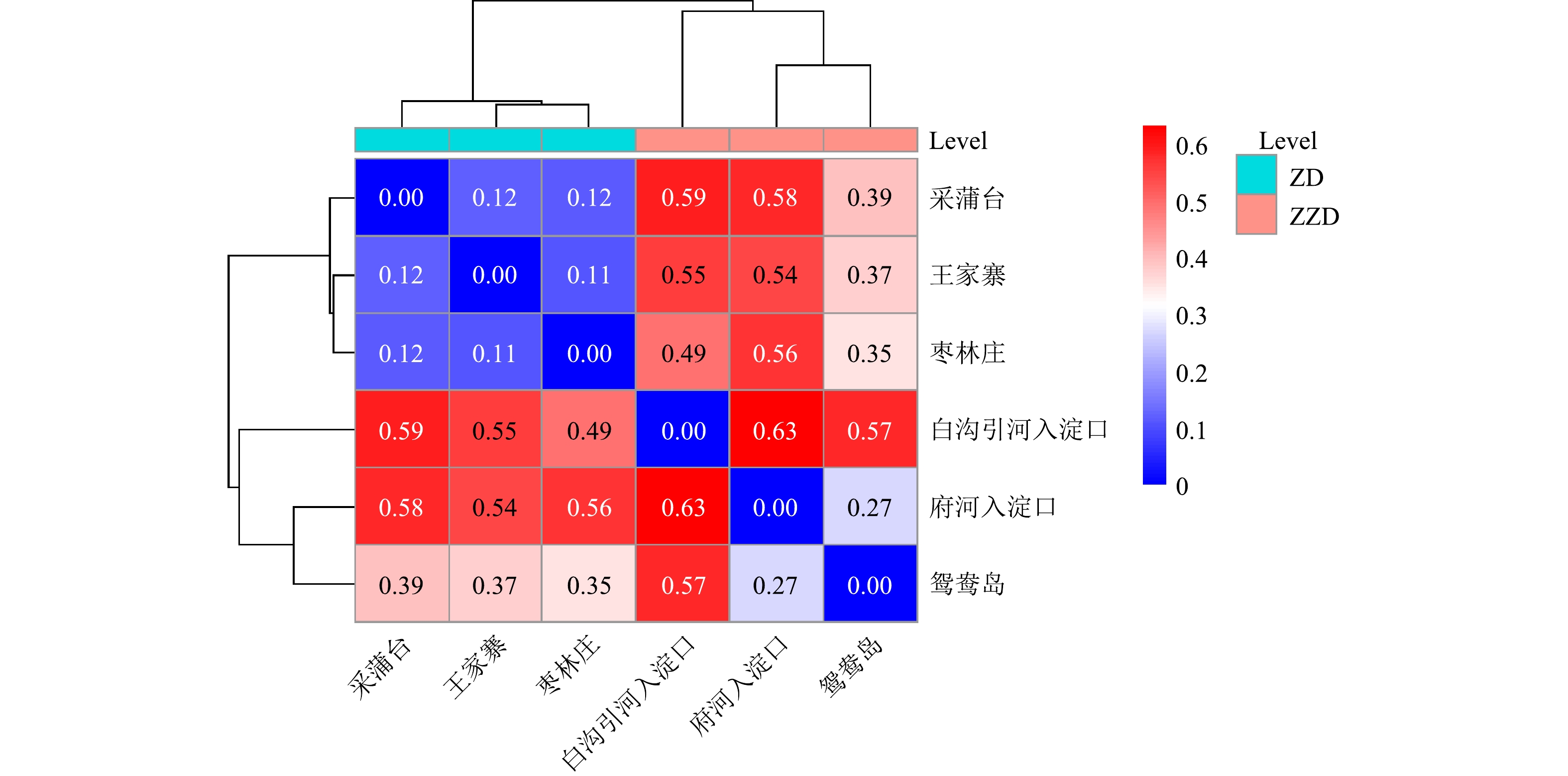
β多样性可反映不同富营养化程度组沉积物样品细菌群落结构差异。从样本相关距离热图(图5)可以看出,样本分为两大簇:一簇为重度富营养化区域白沟引河入淀口、府河入淀口、鸳鸯岛;另一簇为中度富营养化区域枣林庄、王家寨、采蒲台。这说明湖泊富营养化水平对沉积物细菌群落结构有一定影响,重度和中度富营养化水平水体沉积物细菌群落结构有明显差异,同一营养水平下的底泥细菌群落结构更相似。中度富营养化采样点王家寨和枣林庄的距离最近,为0.11,说明王家寨和枣林庄的细菌群落具有较高的相似度;府河入淀口和白沟引河入淀口的距离最远,为0.63。二者虽然都属于重度富营养化区域,但其细菌群落结构差异明显,可能和不同地理位置、人文条件及有机物组分差异有关。
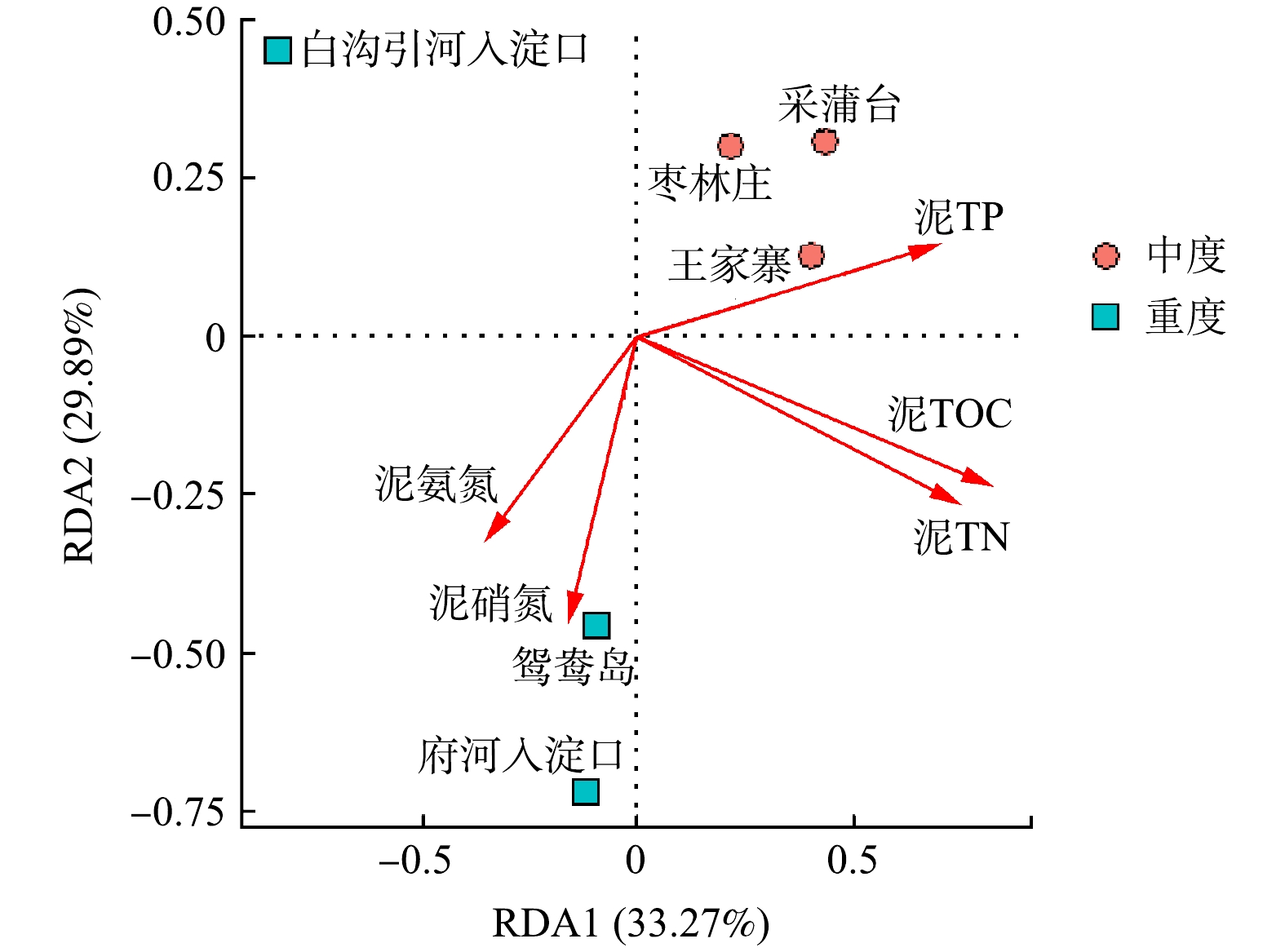
β多样性用于反映不同样品间细菌群落的差异性,冗余分析则可解释这种差异在多大程度上来源于环境因子的影响[5]。对各采样点底泥样品所有检测到的OTU和沉积物性质之间做冗余分析(图6)。RDA分析结果显示,RDA1和RDA2共同解释了总体变化的63.16%,表明沉积物5个化学指标对细菌群落多样性及组成有一定影响。泥氨氮、泥硝氮与第一主轴呈负相关,对重度富营养化采样点菌群影响大,泥TOC、泥TN、泥TP与第一主轴呈正相关,对轻度富营养化采样点的菌群影响较大。
-
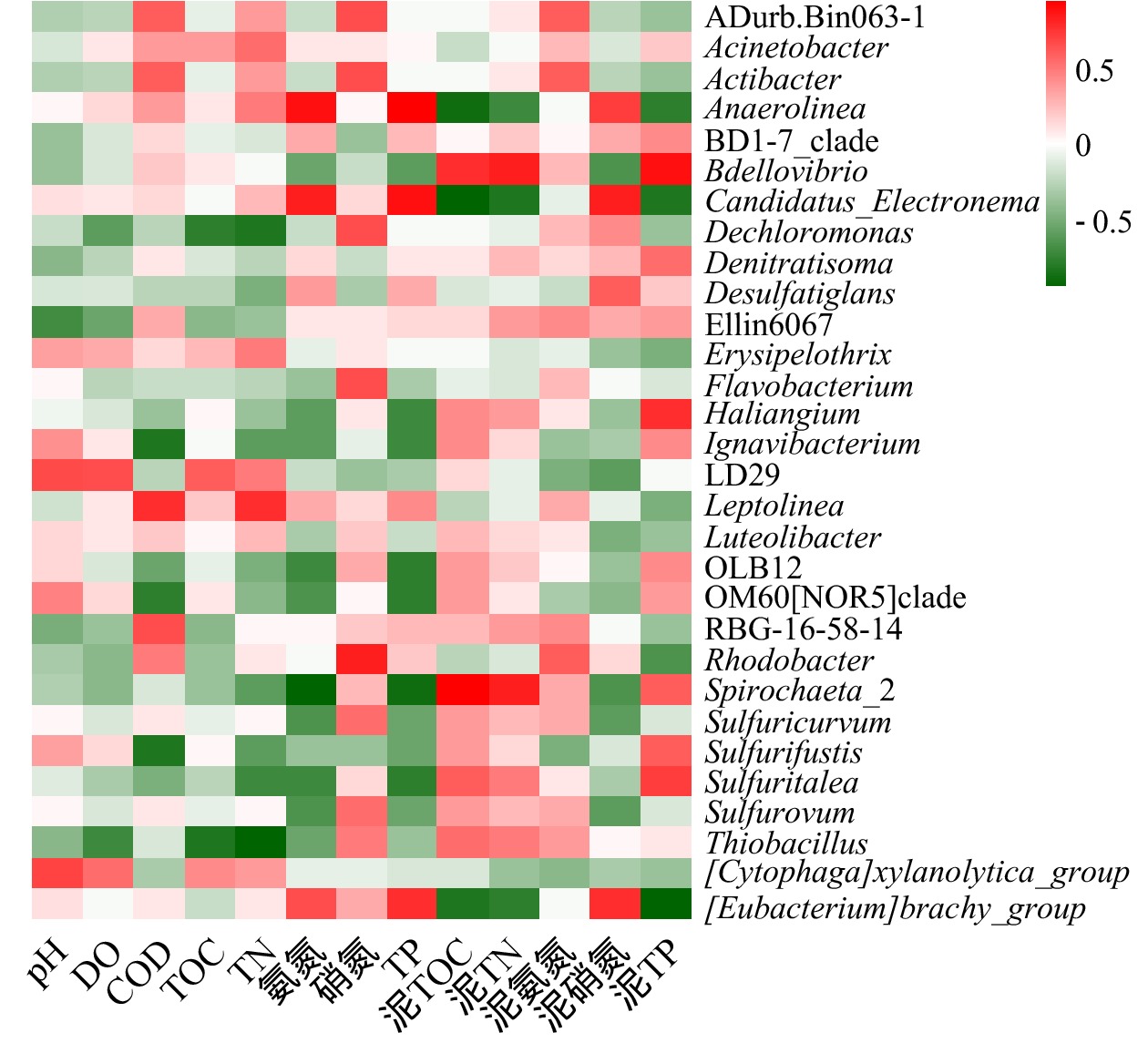
环境因子对底泥细菌群落结构有重要影响。选取表层底泥细菌物种相对丰度>1%的菌属,对5个沉积物化学指标(泥TOC、泥TN、泥氨氮、泥硝氮、泥TP),8个上覆水水质指标(pH、DO、COD、TOC、TN、
${\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N、TP)进行Spearman相关性分析(p<0.05),并作出热图,结果如图7所示。由图7可知,上覆水pH、DO、COD、TOC、TN、${\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N和TP、底泥TOC、TN、${\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N和TP对沉积物细菌群落结构均有一定影响,但氮磷营养物质对白洋淀富营养化水体底泥细菌群落结构影响显著。优势菌属Thiobacillus、Dechloromonas、OLB12、Sulfuricurvum、Anaerolinea的相对丰度受多种因素影响;而RBG-16-58-14等受环境因素影响很小。Anaerolinea和上覆水TP、上覆水${\rm{NH}}_4^ + $ -N、泥${\rm{NO}}_3^ - $ -N显著正相关,相关系数分别为0.94、0.89、0.71;而和泥TOC、泥TP、泥TN显著负相关,相关系数分别为−0.89,−0.75,−0.71;而由细菌群落结构分析和水质调查结果得知,重度富营养化区域Anaerolinea的相对丰度明显高于中度富营养化区域,其TP、${\rm{NH}}_4^ + $ -N、泥${\rm{NO}}_3^ - $ -N含量均高于中度富营养化区域,泥TOC、泥TP、泥TN含量低于中度富营养化区域。该结论再次验证了细菌种群丰度与环境因子之间的相关性关系。上覆水TP和${\rm{NH}}_4^ + $ -N、底泥TP和${\rm{NO}}_3^ - $ -N对白洋淀水体沉积物中的细菌群落结构有较大影响,磷含量是白洋淀水体底泥细菌群落结构的制约因素。
2.1. 水体水质分析
2.2. 微生物α多样性分析
2.3. 细菌群落结构组成及功能
2.4. β多样性分析
2.5. 细菌群落结构与环境因子相关性
-
1)不同富营养化水平水体底泥α多样性存在差异。重度富营养化水体沉积物细菌群落的丰富度和均匀度均高于中度、富营养化水体沉积物;污染水体沉积物细菌群落多样性随营养水平升高而下降。
2)不同富营养化水体沉积物中细菌群落在门分类水平上没有明显差异,在属水平上有差异。重度富营养化区域的优势菌属为Thiobacillus、Dechloromonas、Anaerolinea、Luteolibacter、RBG-16-58-14,他们主要与含碳氮污染物的降解和循环有关;中度富营养化水体底泥的优势物种为Thiobacillus、Dechloromonas、OLB12、Luteolibacter、Sulfuricurvum,这些微生物大多参与了硫循环活动。
3)从样本距离热图可看出,重度和中轻度富营养化采样点细菌群落结构有差异,同一营养水平水体的沉积物中细菌群落结构相似性高。底泥氨氮和硝氮对重度富营养化采样点细菌群落影响大,沉积物TOC、TN和TP对中度富营养化采样点细菌群落影响大。
4)上覆水TP和
${\rm{NH}}_4^ + $ -N、底泥TP和${\rm{NO}}_3^ - $ -N对白洋淀水体底泥属水平细菌群落结构影响大。磷含量是白洋淀水体底泥细菌群落结构的制约因素。







 下载:
下载: