-
生物质能源的开发利用有助于减少温室气体排放,完善能源结构,促进农业发展,因而引起国内外的广泛重视及大力扶持,其中生物乙醇是目前生物质能源开发的研究热点[1-2]。虽然以玉米、甘蔗、大豆等传统农作物为原料的生物乙醇制备技术具有巨大的市场潜力,但会对粮食安全造成影响,并存在主要依赖补贴的问题。鉴于此,我国出台了不再允许以粮食作物为原料生产生物乙醇的政策[3],以缓解生物能源的开发与人争粮和与粮争地的严重问题[4]。我国人口众多,耕地有限,粮食安全一直存在隐患并面临严峻挑战,以粮食作物为原料生产生物乙醇所带来的经济效益和社会效益有限[4]。因此,以木质纤维素为代表的非粮生物质为原料制取生物乙醇的研究成为了重点发展趋势,生物乙醇生产原料的非粮化有助于减少生物乙醇行业发展对国家粮食安全带来的负面影响。
木质纤维素是自然界中存量最大的碳水化合物[5]。有研究[6-7]表明,全世界范围内纤维素年产量约200×109 t,占全球总生物量的90%以上。纤维素中人类可直接利用的部分占4%~10%[8]。相较于粮食生物乙醇原料,木质纤维素原料必须经预处理后才能进入随后的酶解糖化过程,具有更多的生产环节和更长的工艺流程;传统发酵工艺下,木质纤维素生物质的糖化率偏低,进一步降低了乙醇的产率。而纤维素和半纤维素酶的价格远高于粮食原料通常使用的淀粉酶,每生产3.784 L(一加仑)生物乙醇,纤维素乙醇需要负担1.05~1.40元的酶成本,而淀粉乙醇酶的成本只有0.14~0.21元[9],这进一步增加了纤维素乙醇的生产成本。目前,世界各地研究者均对纤维素水解还原糖进一步发酵生成乙醇的方法进行了系统的优化研究[10]。
目前,纤维素生产生物乙醇技术的2个主要研究方向是:1) 借助当下相对成熟的生物科学技术,如基因工程、微生物菌株筛选等技术,培养具有较强针对性的菌种用于酶解发酵,由此改善糖化率及乙醇产率不足的问题[11];2) 针对各生产单元进行深入研究,寻找更优的工况参数,进一步降低生产成本[12]。而原材料预处理会是降低成本的重点单元[13]。在原有的预处理手段基础上,改良工艺或研究新的预处理手段是降低预处理成本的主要研究方向。
预处理方法主要分为酸法、碱法、液态热水法、机械破碎、蒸汽爆破、微波、超声波等[14]。其中酸法预处理是所有预处理方法中研究最多且使用最为广泛的一种方法,具有产糖率较高、处理速率和后续酶解程度高的优点[14-16]。酶解发酵方法主要有分步水解发酵法(separate hydrolysis fermentation,SHF)、同步酶解发酵法(simultaneous saccharification fermentation,SSF)和直接微生物转化法(direct microbial conversion,DMC)[17]。同步酶解发酵法的水解和发酵过程在同一个容器中进行,这样可以很好地解决分步水解发酵法中糖的反馈抑制作用,酶解过程中产生的葡萄糖会被同一容器中的微生物所利用,直接进行发酵转化为乙醇,提高了酶解效率[17]。
基于以上分析,针对目前纤维素乙醇生产技术面临的预处理成本高、酶解发酵过程转化率低的难点,本研究选取水稻秸秆、小麦秸秆、高粱秸秆、毛竹4种典型生物质,进行基于酸催化和同步酶解发酵法的制纤维素乙醇工艺条件的优化,设计出最佳的生物质制乙醇工艺路线,从而降低纤维素乙醇生产成本,减少纤维素乙醇生产技术的推广障碍,既解决了燃料用乙醇的来源问题,又解决了木质纤维素材料无法被充分利用的问题。
全文HTML
-
本研究选取水稻秸秆、小麦秸秆、高粱秸秆及林业废弃物中具有较高的纤维素含量的毛竹(均通过网络购物方式购得) 4种生物质为研究对象,使用纤维素酶(夏盛,型号SPE-007)、酿酒酵母(Saccharomyces cerevisiae)(BYB072)辅助进行酶解发酵过程。
-
新鲜秸秆放入烘箱干燥24 h。将秸秆用剪刀剪成约15 cm长的小段,放入粉碎机。粉碎20 min,过40目分样筛,得到3 mm以下颗粒。将粉末放入烘箱,于55 ℃干燥至恒重。根据李雅丽等[18]和THAMMASOUK等[19]提出的方法,测试4种生物质中木质素、半纤维素和纤维素等组分的含量,具体测试结果见表1。
配置体积分数为0.75%的硫酸溶液250 mL,在5个50 mL碘量瓶中分别加入0.2、0.6、1.0、1.4、1.8 g秸秆粉末,再加入20 mL配置好的硫酸溶液并混匀加盖,使瓶中的固体装载量分别为1%、3%、5%、7%和9%。于121 ℃高温高压条件下处理秸秆20 min。以3, 5-二硝基水杨酸(3,5-dinitrosalicylic aci,DNS)还原糖测定法测定还原糖浓度,从而确定最适固体装载量。在最适固体装载量下,处理温度和酸浓度不变,然后分别以10、20、30、40、50、60 min处理秸秆,以DNS还原糖测定法测定还原糖浓度,确定最佳的处理时间。在最佳处理时间和最适固体装载量下,保持酸浓度不变,然后分别在105、110、120、125、130、135 ℃处理秸秆,确定最佳处理温度。在最佳处理时间、温度和最适固体装载量下,以浓度分别为0.25%、0.5%、0.75%、1%、1.25%、1.5%、1.75%和2%的稀硫酸溶液处理秸秆,确定最佳硫酸溶液浓度。预处理过程在高压灭菌锅中进行。
在进行酶解发酵时,将秸秆粉预处理后过滤并加入中性洗涤剂洗涤至粉末中性,再次过滤,干燥至恒重后,分别称取2 g水稻、小麦、高粱、毛竹秸杆于1 000 mL锥形瓶中,各加入200 mL无机盐营养液(KH2PO4 2 g,(NH4)2SO4 1.4 g,MgSO4·7H2O 0.3 g,CaCl2 0.3 g,FeSO4·7H2O 5 mg,MnSO4 1.6 g,ZnCl2 1.7 mg,CoCl2 1.7 mg,蒸馏水1 000 mL),于120 ℃灭菌20 min,配得水稻、小麦、高粱、毛竹液体培养基各200 mL,酶解固体加载量均为1%。将20个50 mL碘量瓶分为4组,在第1组中的5个碘量瓶中各加入20 mL水稻秸秆液体培养基;在第2组中加入小麦秸秆液体培养基;在第3组中加入高粱秸秆液体培养基;在第4组中加入毛竹秸秆液体培养基。在每组的5个碘量瓶中分别加入0.2、0.4、0.6、0.8、1.0 g纤维素酶。接入酿酒酵母,接种量为10%。于37 ℃下发酵72 h,测定乙醇最终产量,取定最佳酶投加量。再次配制4种不同种类秸秆粉末的液体培养基,以之前取定的最佳酶投加量投加纤维素酶,接入酿酒酵母,接种量为10%,4组培养基分别于37 ℃培养24、48、72、96、120 h,测定乙醇最终产量,从而确定最高效发酵时间。
-
本实验使用DNS还原糖测定法测定还原糖含量[20-21]。按表2中的投加量,分别吸取葡萄糖标准使用溶液、磷酸缓冲液和DNS试剂于试管中。将所有试管放入消解仪中,于100 ℃下消解10 min,随后迅速冷却至室温,稀释5倍,振荡摇匀,用紫外分光光度计于波长540 mL处测量吸光度。以葡萄糖浓度(mg·mL−1)为横坐标,吸光度(ABS)为纵坐标绘制标准曲线,得线性回归方程,R2>0.999时即可使用。将紫外分光光度计测得的吸光度代入葡萄糖标准曲线,即得到还原糖浓度。
在采用气相色谱法测定乙醇[22-23]时,用洁净、干燥的容量瓶准确量取100 mL样品(液温20 ℃)于500 mL蒸馏瓶中,用50 mL水冲洗3次容量瓶,冲洗水并入蒸馏瓶中,再加几颗玻璃珠,连接冷凝器,以取样用的原容量瓶作接收器(外加冰浴)。开启冷却水,缓慢加热蒸馏。收集馏出液接近刻度,取下容量瓶,盖塞。于20 ℃水浴中保温30 min,补加水至刻度,混匀,备用。吸取10 mL溶液准确稀释4倍,然后吸取10 mL于容量瓶中,准确加入0.50 mL正丙醇内标溶液,混匀。设置柱温为200 ℃,气化室和检测器温度为240 ℃,载气流量:氦气40 mL·min−1;氢气40 mL·min−1;空气流量500 mL·min−1。通过实验选择最佳操作条件,使乙醇和正丙醇获得完全分离,并使乙醇在1 min左右流出。分别吸取0.3 μL乙醇标准溶液,快速从进样口注入色谱仪(Aiglent 6890N,美国Aiglent公司),以标样峰面积和内标峰面积比值对酒精浓度作标准曲线,得到线性回归方程,R2>0.999时方可使用。试样的测定:吸取0.3 μL的试样,按照上述步骤和方法测定样品峰面积和内标峰面积比值,通过标准曲线求得的线性回归方程解出试样的乙醇浓度。用试样组分峰面积与内标峰面积的比值依据回归方程计算出的值乘以稀释倍数,即为酒样中的酒精含量。
-
产糖率、产糖速率和乙醇转化率依次根据式(1)~式(3)进行计算。
式中:η为产糖率;C为还原糖浓度,mg·mL−1;ω为预处理前秸秆的固体装载量;ρ为溶液密度,mg·mL−1;v为产糖速率,%·min−1;t为预处理时间,min;η0为乙醇转化率;C0为乙醇浓度,mg·mL−1;V为溶液体积,mL;ω0为预处理后秸秆的固体装载量;m为投加的秸秆质量,mg。
1.1. 实验原料
1.2. 样品制备
1.3. 测定方法
1.4. 计算方法
-
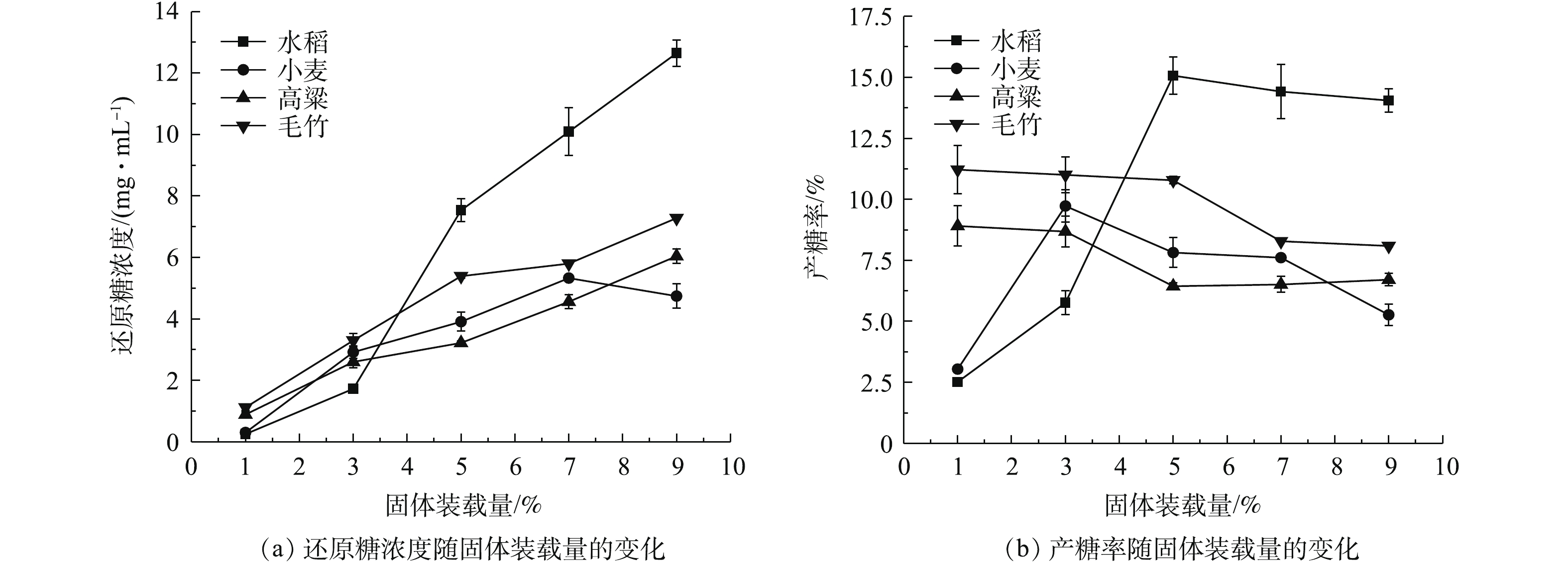
1)固体装载量。在120 ℃下,以0.75%稀硫酸处理已经过40目分样筛筛选的4种生物质粉末各20 min。经滤纸过滤,固体装载量分别为1%、3%、5%、7%、9%的水稻秸秆、小麦秸秆、高粱秸秆、毛竹的预处理液测得其还原糖浓度(图1(a))。如图1(a)所示,在水稻秸秆、高粱秸秆、毛竹的预处理液中的还原糖浓度均随着固体装载量的上升而增加,在小麦秸秆的预处理液中的还原糖浓度在固体装载量为7%时达到最高,在9%处略有下降,这可能是因为原有酸液浓度保持不变,随着底物浓度增加,硫酸的量相较于底物变得不足,因此,降低了预处理效果。
结合预处理过程中的固体装载量与预处理液中还原糖浓度,可得各生物质的产糖率变化。如图1(b)所示,水稻秸秆在固体装载量为5%时转化率最高;小麦秸秆的固体装载量为3%时转化率最高;高粱秸秆和毛竹的最高转化率均产生在固体装载量为1%时。这可能是由于水稻秸秆粉末较为蓬松,空间结构最松散,与酸的接触最充分,所以在酸浓度不变的前提下可以负担较高的固体装载量,以上表明水稻秸秆在节省预处理成本上有不可忽视的优势。
2)预处理时间。在120 ℃下,以0.75%稀硫酸分别处理于最佳固体装载量的经40目分样筛筛选的4种生物质粉末,时间分别为10、20、30、40、50、60 min。经滤纸过滤后,测定水稻秸秆、小麦秸秆、高粱秸秆、毛竹的预处理液中的还原糖浓度(图2(a)),结合已知的固体装载量得到对应产糖率的变化规律(图2(b))。此外,结合产糖率与预处理时间得到产糖速率随时间的变化(图2(c))。
由图2(a)和2(b)可知,在水稻秸秆、小麦秸秆、高粱秸秆、毛竹的预处理液中,还原糖浓度均随着时间的推移而上升,产糖率也随之增长。但在预处理时间超过20 min后,除水稻秸秆外,其余3种生物质的预处理液中的还原糖浓度的增长均较为缓慢,进入平台期。毛竹在处理10 min后的还原糖含量为0.006 mg·mL−1,几乎没有还原糖产生。在毛竹预处理初期,还原糖含量上升缓慢的原因可能是由于其结构较水稻等更为致密,需要更长时间才能被酸破坏[24],以至于前10 min几乎没有还原糖生成。但在10~20 min,毛竹的产糖率出现了极大的提升,这可能是因为其致密的结构延缓了木质纤维素的暴露时间[25],在酸破坏其空间结构后,还原糖便迅速产生。
由图2(c)可知,水稻秸秆、高粱秸秆在10 min达到最大产糖速率,小麦秸秆和毛竹则在20 min时达到最大产糖速率。随着时间的推移,已产生的还原糖在稀酸作用下会被降解为糠醛,从而影响产糖率[26],这可能是各生物质产糖速率在20 min后不断降低的原因。因此,得出水稻秸秆、高粱秸秆的最佳预处理时间均为10 min,小麦秸秆、毛竹的最佳预处理时间均为20 min。
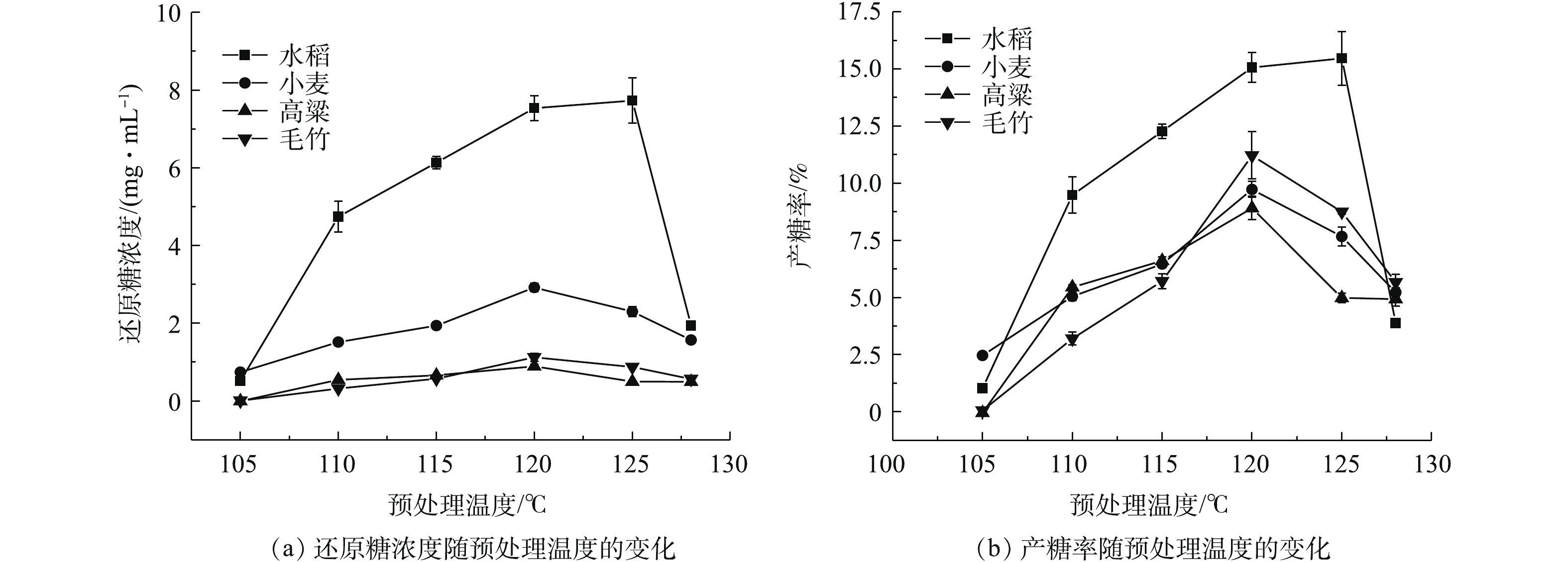
3)预处理温度。基于前2组实验确定的最佳固体装载量和最佳处理时间,以0.75%稀硫酸分别在不同温度下处理已经过40目分样筛筛选的4种生物质粉末。经滤纸过滤,得到水稻秸秆、小麦秸秆、高粱秸秆、毛竹的预处理液,并测得其中的还原糖浓度(图3(a)),结合已知的固体装载量得到产糖率变化规律(图3(b))。由图3(a)可知,水稻的预处理液中还原糖浓度在105~110 ℃有一个较大的提升,这可能是由升温带来的加压导致的,高压有助于改善预处理效果[27]。随后水稻秸秆的产糖率随温度升高迅速提升,于125 ℃达到最大值;在温度继续升高至128 ℃过程中,其浓度则显著降低,这可能是由于过高的温度对纤维素结构造成了一定破坏[28],进而影响了其产糖率。
由图3(b)可知,小麦、高粱、毛竹的产糖率高峰均出现在120 ℃。随着预处理温度进一步升高,产糖率都呈下降趋势。值得一提的是,虽然小麦的预处理液还原糖浓度高于高粱和毛竹,但因为小麦的固体装载量是高粱、毛竹的3倍,计算得到的产糖率是毛竹高于小麦,小麦高于高粱,所以毛竹、高粱可能比小麦具有更高的还原糖生产价值。此外,考虑到我国每年产生的小麦秸秆数量远高于高粱、毛竹[29],小麦秸秆生产纤维素乙醇仍然不失为一个有效的废物资源化途径。除此之外,虽然水稻在120 ℃并未达到最佳预处理温度,但其产糖率仍高于其他3种原料。综上所述,水稻的最佳预处理温度为125 ℃,小麦、高粱、毛竹的最佳预处理温度为120 ℃。
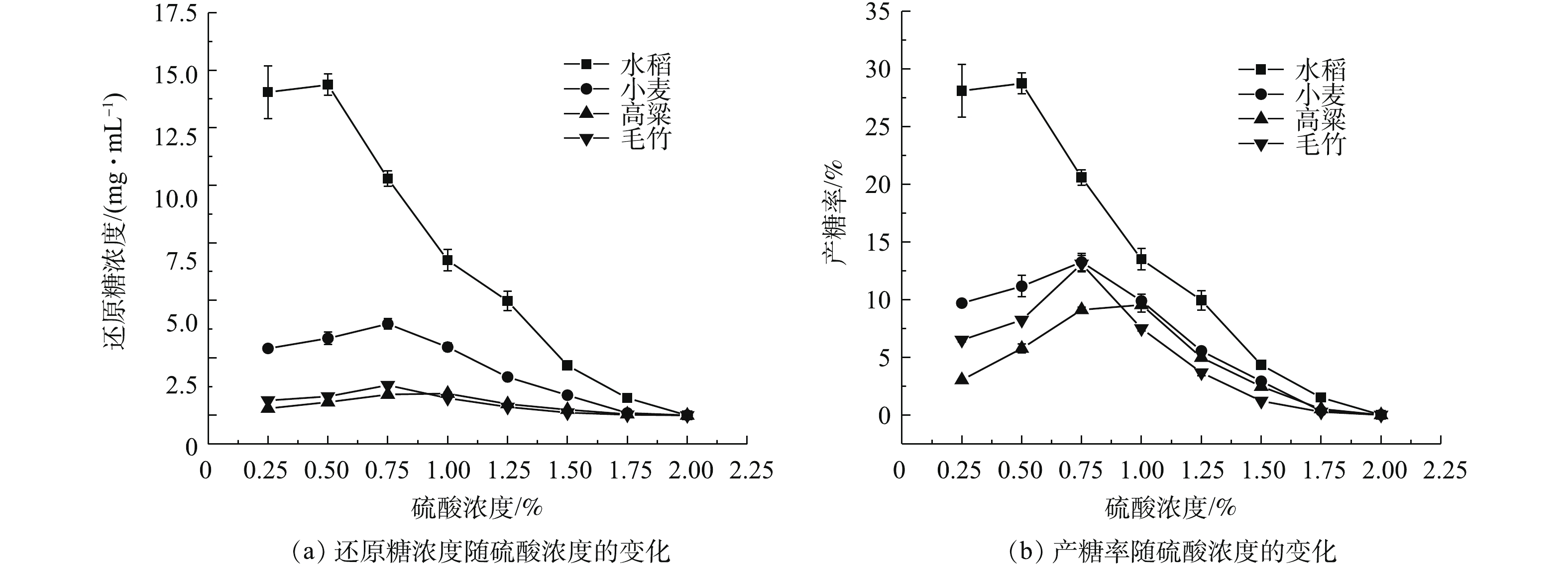
4)预处理酸浓度。硫酸在水解纤维素的过程中起到催化剂的作用,硫酸预处理法在破坏纤维素空间结构的同时[26],还可以显著提升产糖率[30],因此,研究选择硫酸作为酸法预处理的主要试剂。基于上述实验确定的最佳固体装载量和最佳处理时间、最佳预处理温度,分别以不同体积分数的稀硫酸水溶液处理经40目分样筛筛选的4种秸秆粉末。经滤纸过滤,测量水稻、小麦、高粱、毛竹的预处理液还原糖浓度(图4(a)),结合已知的固体装载量得其产糖率变化规律(图4(b))。由图4可知,水稻秸秆预处理液中还原糖浓度在硫酸浓度为0.5%时达到最高值,小麦秸秆和毛竹均在硫酸浓度为0.75%时产糖率最高,高粱秸秆则是在硫酸浓度为1%时获得最高产糖率。在硫酸浓度超过1%后,4种生物质材料的产糖率均迅速下降。原因是在一定浓度的硫酸溶液中,H+浓度越高,木质纤维素的水解速率越快,生成的葡萄糖越多;但在更高浓度的硫酸溶液中,其氧化作用也越加显著,甚至会对木质纤维素原料产生了腐蚀,改变了其理化性质,甚至使其碳化而造成的[31-32]。
可以看出,水稻秸秆的最佳硫酸处理浓度为0.50%,小麦秸秆和毛竹的最佳硫酸处理浓度为0.75%,高粱秸秆的最佳硫酸处理浓度为1%;但鉴于0.75%的硫酸处理效果与1%也十分接近,考虑到酸的成本以及浓酸可能产生的、不利于后续酶解发酵的产物,0.75%体积分数的硫酸溶液可能更具工业实际应用的可行性。
-
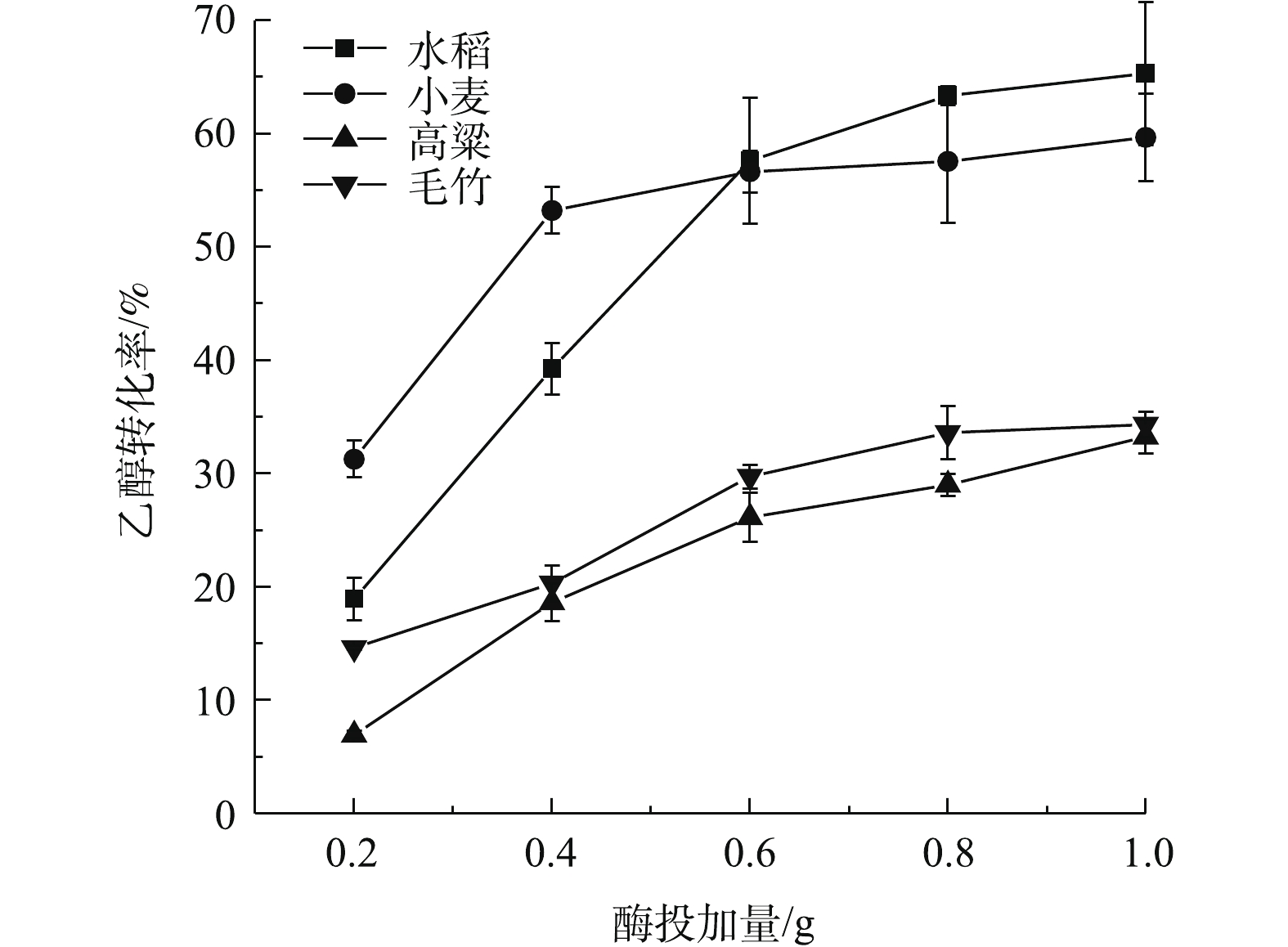
酿酒酵母(Saccharomyces cerevisiae)是一种可以利用C6糖生产乙醇的单细胞微生物,该酵母菌具有繁殖速度快,发酵能力强等优点[33]。因此,以不同生物质的最优预处理条件处理秸秆粉末,在液体培养基固体装载量1%,酿酒酵母接种量10%的条件下,分别投加0.2、0.4、0.6、0.8、1.0 g的纤维素酶,在37 ℃下培养3 d,成功将经预处理的秸秆粉末中所含的纤维素部分转化为乙醇,获得的各生物质乙醇转化率如图5所示。由图5可知,水稻、小麦、高粱、毛竹的乙醇产量都随酶投加量的增加而增加。水稻、小麦、高粱、毛竹的乙醇产量在投加量达到0.6 g以前都保持着较高速的增长速率,在0.6 g之后进入平台期,乙醇产量基本稳定,增幅不大。原因可能是酵母在整个反应体系中的生长空间减小,反而不利于酵母菌株的生长[34-35]。但是,当酵母菌含量较低时,产生的酶类物质也较少,因此不能将葡萄糖进行有效的转化。此外,由于酶的高成本是制约纤维素乙醇生产的一个重要因素[36],酶投加量应在保障一定纤维素转化率的前提下控制在尽可能低的水平。综合考虑上述因素,酶的最佳投加量为0.6 g,在选取的4种生物质中,水稻和小麦的乙醇转化率明显高于高粱与毛竹,达到56%以上。而高粱与毛竹的转化率十分接近,均在33%~35%。
在以上优化条件的基础上,考察不同发酵时间(1~5 d)对秸秆粉末乙醇转化率的影响(图6)。由图6可知,在发酵前期,水稻秸秆、小麦秸秆、高粱秸秆、毛竹的乙醇产量都随发酵时间的增加而提高。水稻秸秆和小麦秸秆的乙醇转化率均在1~2 d呈现出较显著的提升,分别由17%和45%增至51%和53%,在2~5 d均保持在60%以下,增幅不大。随着发酵时间的增长,高粱秸秆、毛竹的乙醇产量以较稳定的速率增长,可能是因为这2种生物质的秸秆粉末结构致密,纤维素与酶的接触不够充分[37],使酶促反应能够以相对平稳的速度进行,平台期出现较晚。随着发酵时间的延长,乙醇产率增加较为减缓,可能是因为部分酵母菌陆续死亡,不再生成乙醇所致。
综上所述,水稻秸秆、小麦秸秆的最适发酵时间均为2 d,高粱秸秆与毛竹在发酵5 d时仍保持着较高的乙醇转化速率,因此,其最适发酵时间可能长于5 d。
2.1. 预处理条件筛选
2.2. 酶解发酵条件筛选
-
1)在预处理阶段,水稻秸秆以5%固体装载量,温度为125 ℃,经0.50%稀硫酸处理10 min的产糖率最高,达到了28.74%,在4种生物质中处理效果最好。小麦秸秆以3%固体装载量,温度为120 ℃,经0.75% 稀硫酸处理20 min的产糖率为13.25%,次于水稻秸秆。高粱秸秆以1%固体装载量,温度为120 ℃,经1.00% 稀硫酸处理10 min的产糖率为9.54%,产率最低。毛竹以1%固体装载量,温度为120 ℃,经0.75% 稀硫酸处理20 min的产糖率为13.10%,次于水稻秸秆和小麦秸秆。
2)在发酵阶段,4种生物质所需的酶投加比例的差异不大,最适条件均为0.3%,即每200 mL液体培养基投加0.6 g纤维素酶。但在发酵时间上,水稻秸秆、小麦秸秆经过2 d即可大致完成发酵,第2天产生的乙醇浓度与第5天的乙醇浓度的比值分别为87.7%和92.1%,均大于85%,而高粱秸秆、毛竹在前期的乙醇转化率较低,5 d内的乙醇转化率均保持一定的增速。因此,水稻秸秆、小麦秸秆的最适发酵时间均为2 d;高粱秸秆、毛竹的最适发酵时间均为5 d。



 下载:
下载: