-
能源危机和环境污染是当今人类社会发展面临的2大突出难题。通过生物的方法从污水中获得新能源,从可持续发展的角度解决水污染问题已成为众多研究者关注的领域。微生物燃料电池(microbial fuel cell,MFC)是一种以微生物为催化剂将有机物中的化学能转化为电能的装置[1],以反硝化微生物作为阴极催化剂的生物阴极MFC可以利用微生物还原废水中的氮,同时产生电能。在阳极室厌氧环境下,有机物在微生物作用下分解并释放出电子和质子,电子依靠合适的电子传递介体在生物组分和阳极之间进行有效传递,并通过外电路传递到阴极形成电流;在阴极室中,硝酸盐、亚硝酸盐等的氮在阴极反硝化菌作用下获得电子,被还原为氮气[2]。CLAUWAERT等[3]首次构建了双室生物阴极反硝化MFC,利用好氧厌氧混合污泥接种阴极室,实现了阴极还原硝酸盐的同时产生电能。VIRDIS等[4]将生物阴极MFC与好氧硝化反应器相结合,增大了硝酸盐去除速率和产电能力。XIE等[5-6]将MFC与AA/O污水处理工艺相结合,构建MFC-AA/O反应器,可以将反应器的有机物和总氮去除率平均提高15.93%和9.25%,平均输出电压约为(168.8±8.2) mV,实现了在增强污水脱氮效率的同时产生电能。因此,反硝化生物阴极MFC技术有望帮助解决城市污水处理行业既要求处理效率高又要求节能降耗的矛盾,在含氮污水处理领域具有极佳的应用前景[7]。
在反硝化生物阴极MFC中,微生物作为阴极还原反应的催化剂,起着决定性作用[8]。目前,关于生物阴极反硝化微生物的研究多集中在混菌MFC的生物阴极群落结构上。PARK等[9]通过PCR-DGGE分析了接种污水厂厌氧污泥的反硝化阴极生物膜的群落结构,发现α-proteobacteria,β-proteobacteria,γ-proteobacteria和flavobacteria是阴极主要的菌群。XIAO等[10]通过454测序,确认了proteobacteria为反硝化生物阴极生物膜上主要的门,同时猜测Alphaproteobacteria、Anaerolineae、Phycisphaerae可能是同步产电反硝化菌。VIRDIS等[11-12]通过FISH技术确认了电极生物膜内层大量富集了Paracoccus和Pseudomonas,并猜测其参与产电。XIE等[6]的研究也表明,MFC-AA/O反应器缺氧区阴极板上大量定植了Proteobacteria、Bacteroidetes和Chloroflexi,并且发现Pseudomonas、Thauera、Emticicia等菌属丰度大大超过了悬浮液中丰度,猜测可能与产电相关。
对于MFC区别于其他燃料电池最核心的微生物催化过程,尤其是产电微生物与电极之间的电子传递机制,目前的了解尚十分有限,降低由其引起的非欧姆阻力是进一步降低内阻,提高输出功率,使MFC走向实用的关键。分离获得高效产电微生物纯菌,并以纯菌作为对象进行MFC产电机理解析是可行的途径[13]。然而,目前关于纯菌生物阴极MFC的报道很少,而产电同步反硝化阴极细菌的分离纯化也尚未见报道。本研究从稳定运行的MFC-AA/O反应器缺氧区阴极板上分离纯化出1株同步产电反硝化菌株,以此构建纯菌生物阴极MFC,研究其产电同步反硝化能力,优化其脱氮条件,探究其电子传递机制,为反硝化生物阴极MFC的实际应用提供参考。
-
菌株来源:菌株分离源来自连续稳定运行至少半年以上的MFC-AA/O生物反应器缺氧区电极上的生物膜,缺氧区活性污泥来自北京某污水处理厂回流污泥。
富集培养基(enrichment medium,EM):KNO3 2 g·L−1、柠檬酸钠5 g·L−1、K2HPO4 1 g·L−1、MgSO4·7H2O 0.2 g·L−1、微量元素2 mL·L−1[14];溴百里酚蓝(bromothymol blue,BTB)培养基:L-天冬氨酸10 g·L−1、KNO3 1 g·L−1、FeCl2·6H2O 0.05 g·L−1、CaCl2·2H2O 2 g·L−1、MgSO4·7H2O 1 g·L−1、BTB 1 mL·L−1(1%量溶于乙醇)、琼脂20 g·L−1;分离培养基(screen medium,SM)由EM加入20 g·L−1琼脂组成;反硝化性能测试培养基(denitrification ability test medium,DATM):KNO3 0.5 g·L−1、柠檬酸钠5 g·L−1、K2HPO4 1 g·L−1、MgSO4·7H2O 0.2 g·L−1、NH4Cl 0.6 g·L−1、矿物质溶液12 mL·L−1、维他命溶液12 mL·L−1。
PBS缓冲液(phosphate buffer saline,PBS):NaH2PO4·2H2O 6.08 g·L−1、Na2HPO4·12H2O 21.83 g·L−1、NaCl 5.85 g·L−1;阳极液(anode solution,AS):NaAc 0.64 g·L−1、KCl 0.13 g·L−1、NH4Cl 0.31 g·L−1、PBS缓冲液、矿物质溶液12.5 mL·L−1、维他命溶液12.5 mL·L−1;阴极液(cathode solution,CS):KNO3 0.5 g·L−1、NaHCO3 2.0 g·L−1、PBS缓冲液、矿物质溶液12.5 mL·L−1、维他命溶液12.5 mL·L−1[15]。
-
如图1所示,本研究中的电池壳体采用聚碳酸酯(PC)材质,单室尺寸均为10 cm×10 cm×5 cm,中间通过预处理后的阳离子交换膜隔开,阳离子交换膜有效面积为40 cm2。阳极电极材料统一采用3 cm×5 cm碳布[16];非生物阴极电极材料采用1 cm×3 cm载铂碳纸,载铂量为0.5 mg·cm−2,生物阴极则采用3 cm×5 cm氨化处理的碳布为电极材料;以钛丝连接阴阳极,并在2个电极之间加载外电阻2 000 Ω。
-
取本实验室运行良好的MFC-AA/O生物反应器缺氧区阴极碳布样品,在PBS溶液中超声处理吸取上清液,接种至EM培养基摇床,培养5 d,反复富集3次。之后,将富集液连续稀释并均匀涂布在BTB培养基上,28 ℃恒温倒置培养24 h。挑选BTB培养基中出现蓝色晕圈的单菌落,在SM培养基上划线分离至单菌落,再接种至EM富集,随后再重复挑取单菌落富集以纯化菌种。最后在EM富集筛选所得纯菌的对数生长期,按照10%的比例接种到DATM中摇床培养,每24 h取样,测试其还原硝酸盐的能力[17]。
同时,将筛选得到的菌种通过16S rDNA测序鉴定。利用引物27F、1492R得到目标片段,使用50 μL PCR扩增体系扩增。PCR产物测序工作由上海生物工程股份有限公司完成,测序结果在NCBI的Genbank数据库与已有序列进行同源性分析比对。
-
使用分离鉴定得到的多株反硝化纯菌接种到阴极室,构建多组双室MFC。其中,1组电池不接种阴极微生物,作为对照。采用改良版2阶段法启动MFCs[10],进入阶段1,驯化阳极微生物;待电池有稳定电压输出后,进入阶段2,将阴极更换为3 cm×5 cm碳布,以30%的比例接种分离纯化的纯菌。MFCs输出电压通过数据采集卡(USB-1608FS,美国MCC公司)实时采集,当电压下降至50 mV时,更换阳极液和阴极液,通过比较各纯菌生物阴极MFC产电及反硝化性能,筛选获得1株同步产电反硝化性能最佳的菌株。
随后通过研究pH和温度对纯菌生物阴极MFC反硝化速率的影响,进一步优化反硝化条件。将对比筛选得到的产电反硝化性能最佳的1株纯菌接种到EM培养基中富集。取富集液接种到pH为4.5、5.5、6.5、7.5、8.5和9.5的NIM反硝化性能测试培养基中,培养24 h后(0 h时NO2−-N浓度为0),取样测试硝酸盐和亚硝酸盐的浓度,通过比较各组硝酸盐去除率和亚硝酸盐积累量确定pH对纯菌生物阴极MFC反硝化的影响。同样,取活化后的富集液接种到NIM反硝化性能测试培养基中,调节pH为上述实验所得最适值,分别于15、20、25、30、35、40 ℃不同温度下培养24 h,取样测试硝酸盐和亚硝酸盐的浓度,以确定温度的影响。每个实验均进行3个生物学重复。
-
为研究筛选得到的阴极产电菌形态特征及其与电极材料间的结合关系,在双室生物阴极MFC产电稳定运行阶段,将阴极室电极取出,切取5 mm×5 mm大小的样品,使用扫描电子显微镜(SEM,Quanta 600,美国FEI公司)观察其表面形貌。
-
利用电化学工作站(Zennium,德国Zahner公司)进行循环伏安曲线的测试。三电极体系分别以未挂膜的碳布作工作电极,饱和Ag/AgCl电极作参比电极,铂丝作对电极;以MFC的生物阴极液作为溶液介质;电压设定为−1~1 V,速率设为20 mV·s−1,根据扫描结果,综合比较后,初步确定推测产电菌电子传递机制。
-
${\rm{NO}}_3^{-} $ -N测试采用紫外分光光度法,$ {\rm{NO}}_2^{-}$ -N测试采用N-(1-萘基)-乙二胺分光光度法[18]。NO3−-N去除率计算方法见式(1)。式中:η为去除率;c1为阴极室初始硝酸盐浓度,mg·L−1;c2为产电一个周期后阴极室硝酸盐浓度,mg·L−1。
-
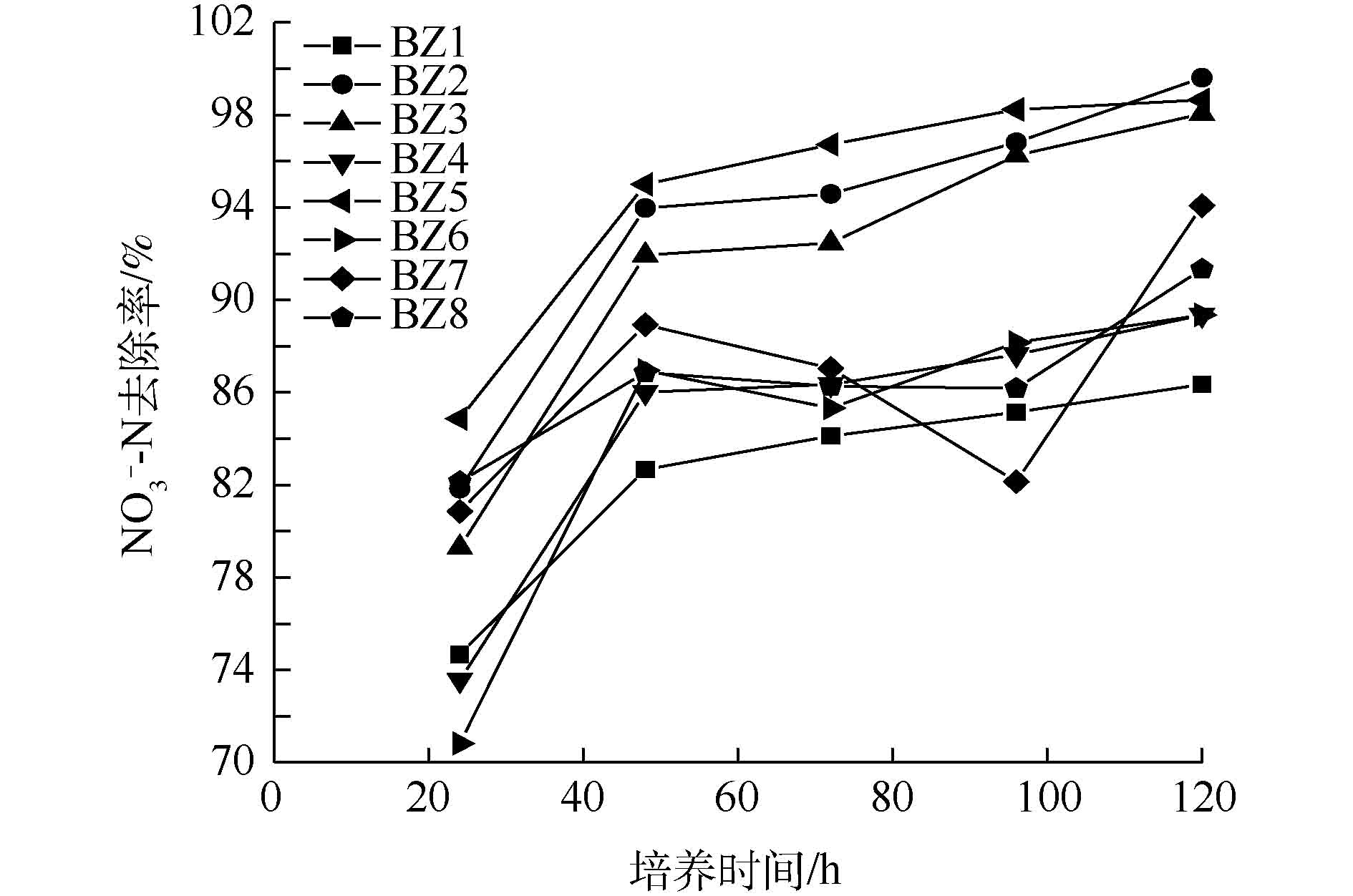
阴极生物膜经BTB培养基3次富集培养纯化后,共得到36株BTB平板阳性菌。通过反硝化能力测试后,共得到8株具有硝酸盐还原能力的菌株,命名为BZ1~BZ8,经16S rDNA序列测定后发现同属于假单胞菌属(表1)。测得8株菌对硝酸盐的去除率如图2所示。由图2可知,8株菌反硝化效率均在70%以上。其中,BZ2、BZ3和BZ5菌株在培养120 h后,对NO3−-N的去除率均高于95%,说明其具有较强的反硝化能力。
假单胞菌属是污水处理中最常见的反硝化细菌之一,同时分离的8种菌BZ1~BZ8均可以还原硝酸盐,因此,可以推断这8株菌是反硝化菌株。Pseudomonas sp.在之前的研究中被猜测为潜在产电反硝化菌株。VIRDIS等[12]研究发现,Pseudomonas sp.在生物阴极能够接收电子还原硝酸盐,产生氮气。RABAEY等[19-21]研究发现,Pseudomonas aeruginosa能够分泌绿脓菌素、吩嗪甲酰胺等化合物,其可以作为中介体,协助自身或其他产电微生物完成电子从细胞到电极的转移,实现物质的氧化。产中介体微生物的发现有效避免了外源中介体的添加,降低成本的同时也提高了MFC的产电性能。因此,将这8株鉴定为假单胞菌属的菌株,均接种至MFC阴极,以确认其是否具有产电能力。
-
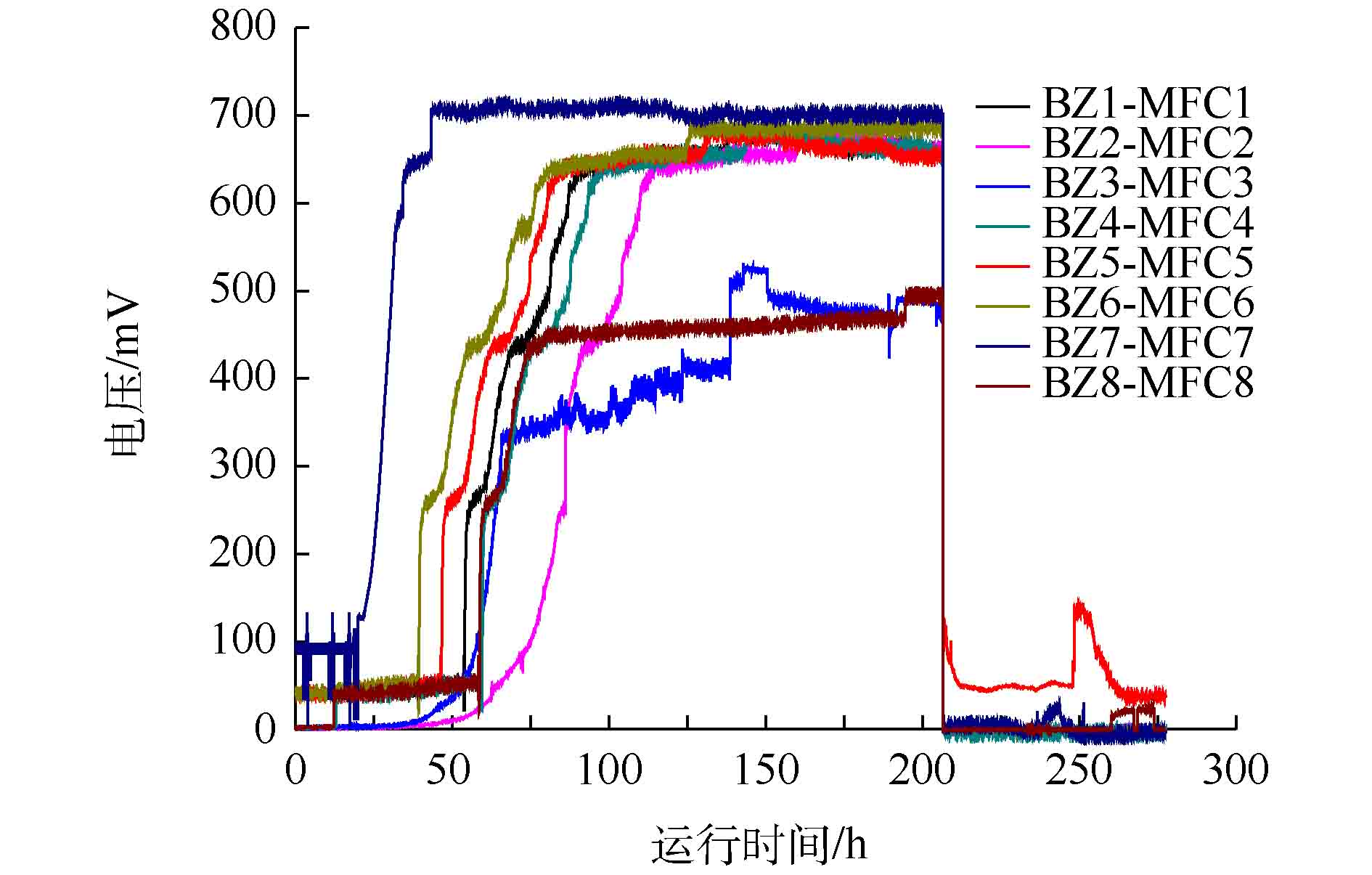
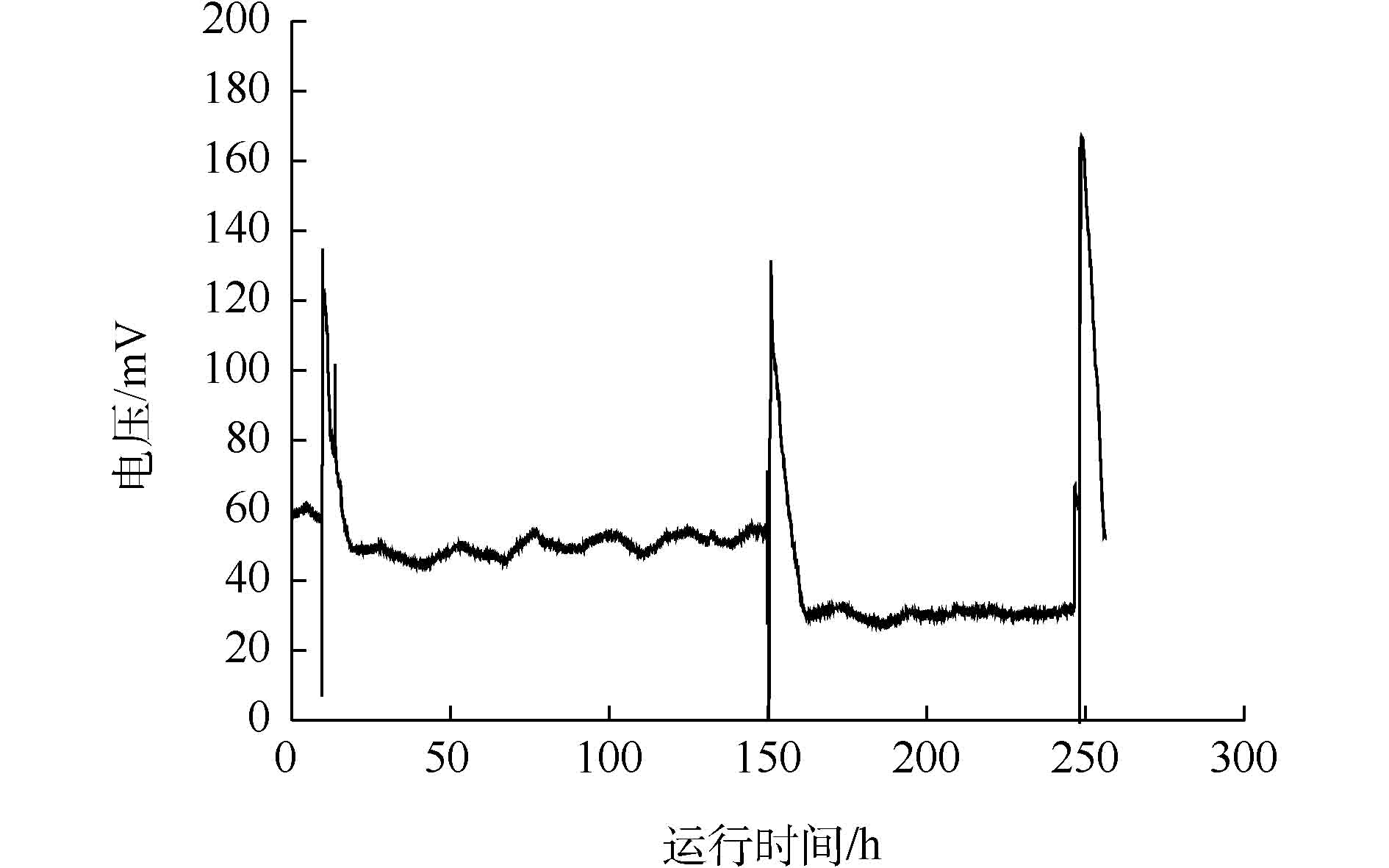
采用两段法接种纯菌生物阴极MFC,待阶段1(空气阴极)中的各MFC输出电压平稳(图3)后,将8株分离得到的反硝化菌株分别接种阴极,分别标记为BZ1-MFC1至BZ8-MFC8。然而,接种24 h内除了接种BZ5 (Pseudomonas aeruqinosa)的MFC5可以监测到产电外,其余MFC均没有电压输出(图3)。待MFC5输出电压下降至50 mV后,所有电池更换阴极液,重复3次后,仍然是除MFC5外,其余电池均没有电压输出。MFC5接种后,3个周期电压曲线图如图4所示,当MFC5阴极接种后,电压迅速上升至50 mV,第1个周期最高电压约130 mV。此后,每次换液峰值电压均有上升,经过3个周期后,其输出电压趋于稳定,峰值电压达到168 mV。因此,可认为筛选得到的1株铜绿假单胞杆菌(Pseudomonas aeruqinosa)BZ5为同步产电反硝化菌。
-
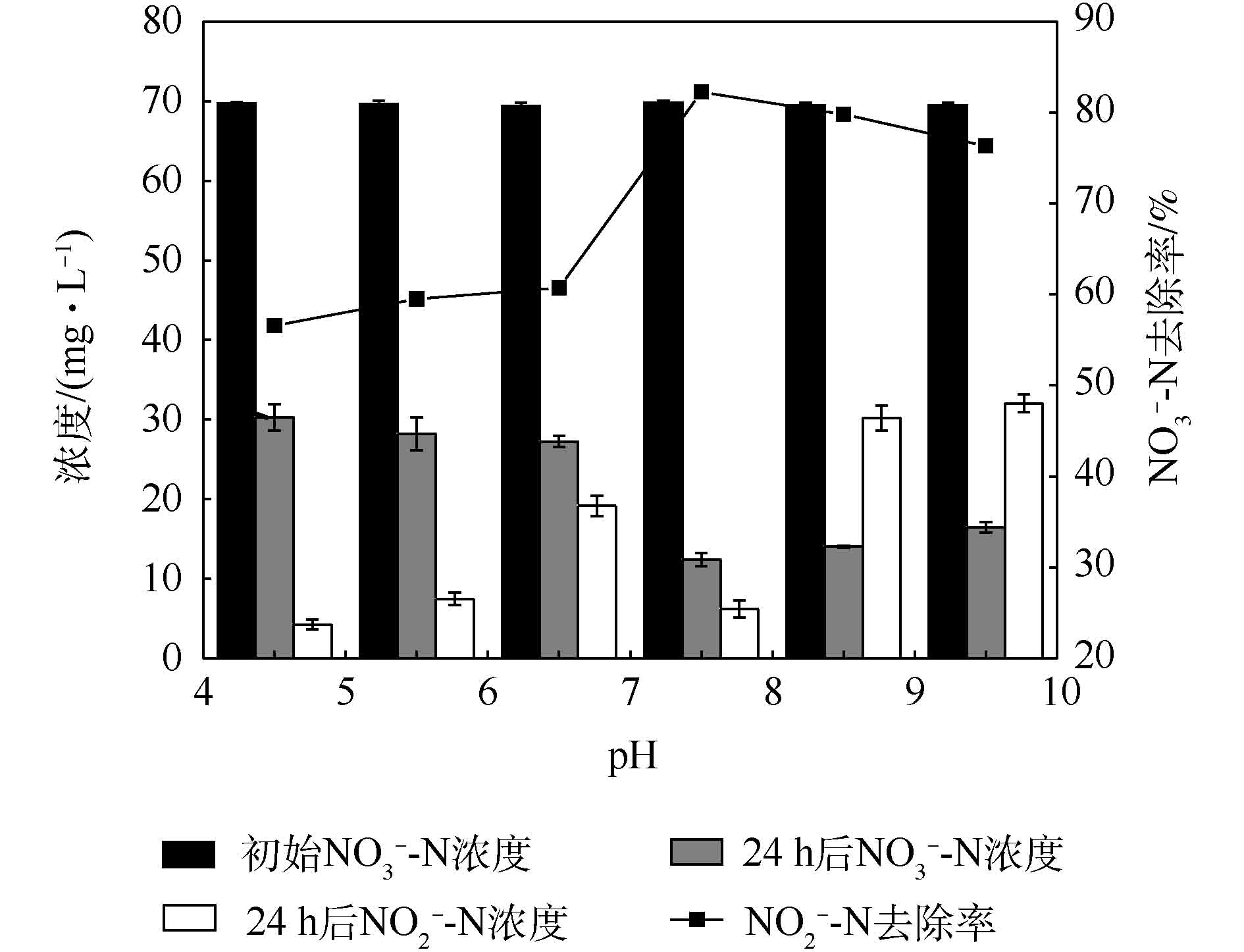
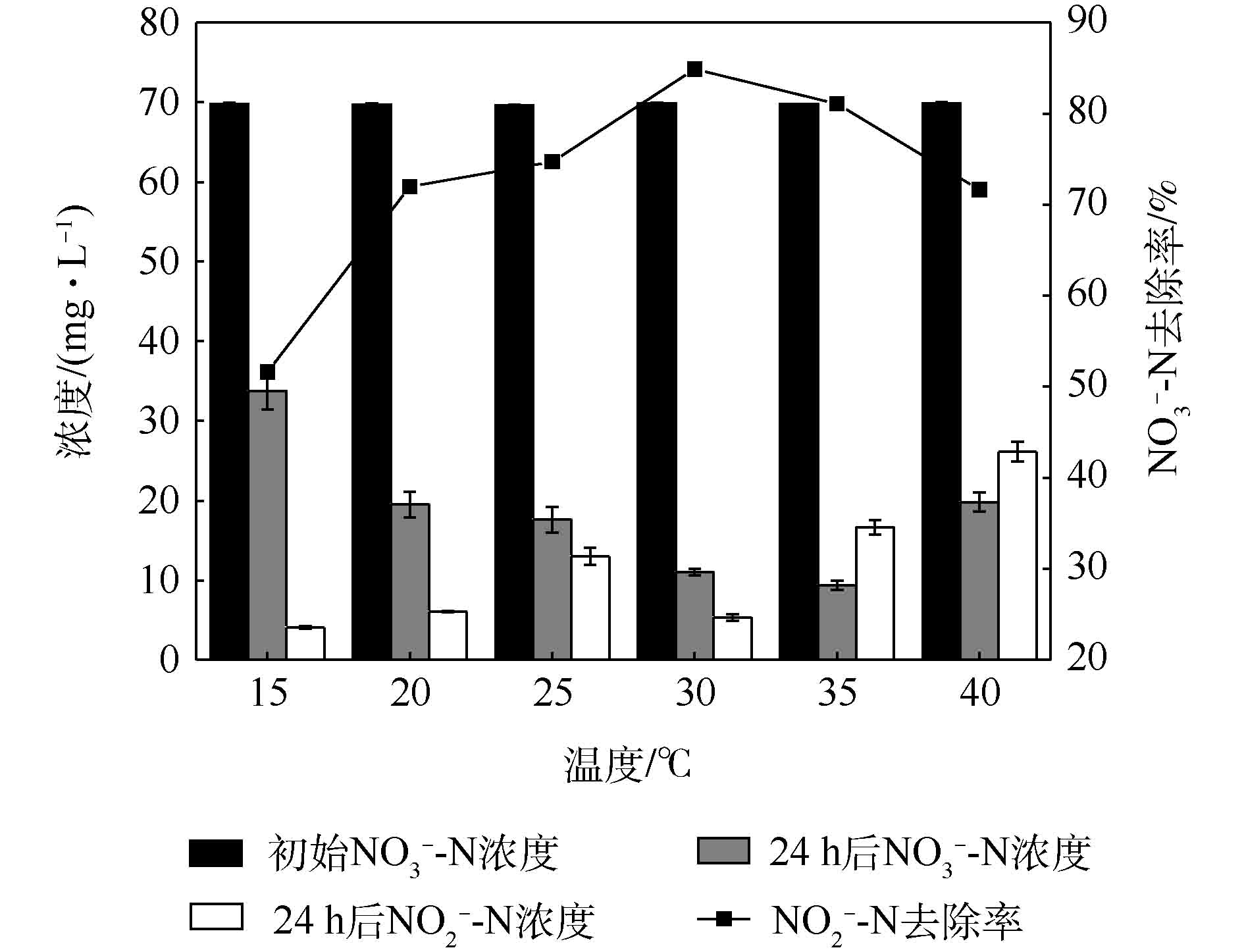
过酸或过碱的环境都会损害反硝化菌的活性,pH对Pseudomonas aeruginosa硝酸盐去除率及亚硝酸盐积累的影响如图5所示。由图5可以看出,pH对Pseudomonas aeruginosa的硝酸盐去除率有明显的影响。当pH为7.5时,Pseudomonas aeruginosa具有最快的硝酸盐还原速率,此时亚硝酸盐的积累量仅为6 mg·L−1;随着pH的降低或升高,Pseudomonas aeruginosa的反硝化能力均明显降低。图6是温度对Pseudomonas aeruginosa还原硝酸盐和亚硝酸盐积累的影响。从图6可以看出,其最优反硝化温度为30 ℃,硝酸盐去除率为84%,此时,亚硝酸盐累积量进一步降低至5.33 mg·L−1。这一结果与LI等[22]有关混菌生物阴极MFC的研究结果类似。已有研究[23]发现,当温度低于15 ℃时,以硫代硫酸盐为电子供体的自养反硝化速率可以忽略不计。而在本研究中,温度为15 ℃时,反硝化作用仍可发生,说明本研究所筛选菌株以阴极为电子供体所进行的自养反硝化反应可在更为广阔的温度范围内进行。值得注意的是,当温度或pH不合适时,亚硝酸盐积累增加,表明亚硝酸盐还原是反硝化过程中的限速步骤,这一发现与SUN等[24]的研究结果一致。
-
图7是培养稳定的同步产电反硝化菌Pseudomonas aeruginosa在电极材料上的生长情况。由此可知,该菌能够在阴极电极材料上均匀挂膜,有利于接收阴极电子,促进硝酸盐的还原;此外,电极材料经多次冲洗后,微生物仍旧能够紧密结合在电极上,这也可能是菌株能参与产电过程相关的直观证据。
-
以初始生物阴极液作为三电极体系中电化学反应溶液介质,以未挂膜的碳布作为工作电极,接种同步产电反硝化菌Pseudomonas aeruginosa,分别得到反应0 h和48 h时的循环伏安曲线,如图8(a)和图8(b)所示。比较并分析同步产电反硝化菌Pseudomonas aeruginosa在不同时间点的循环伏安曲线的特性,结果表明:随着反应的进行,0 h时的循环伏安曲线上出现了1个很明显的氧化峰,其位置在−0.5 V左右,对应的电流为1.5×10−3 A左右,说明初始生物阴极液中存在添加的氧化还原介体,负责阴极电极与微生物间的电子传递;运行48 h时的循环伏安曲线上出现多对氧化还原峰,说明随着反应的进行,该菌的新陈代谢产生的分泌物中的某种物质可以作为氧化还原介体,负责在微生物和电极之间进行电子的传递,同时也证明了生物阴极MFC体系中存在电子穿梭传递机制。结合文献报道的结果和本研究结果可知,本研究中分离获得的Pseudomonas aeruginosa作为生物阴极催化剂的产电机制可能是:此过程中所分泌的化合物(如绿脓菌素、吩嗪-1-甲酰胺等[19-21])可作为中介体,从电极获得电子,完成硝酸盐的还原,但其捕获电子的具体传递通道,还有待进一步的研究证明。
-
1)本研究从稳定运行的MFC-AA/O反应器阴极上取样,在BTB富集培养基上培养分离出1株具有反硝化产电功能的细菌,经16S rRNA鉴定为环境微生物铜绿假单胞杆菌Pseudomonas aeruginosa。
2)将Pseudomonas aeruginosa接种至双室MFC生物阴极,其峰值电压可达到168 mV左右,对阴极室硝酸盐去除率可达95%以上;进一步对其反硝化条件进行优化,发现其反硝化最优pH为7.5,最适温度为30 ℃。通过SEM测试结果分析,Pseudomonas aeruginosa能够与阴极紧密结合。
3)循环伏安特性曲线结果表明,Pseudomonas aeruginosa作为生物阴极催化剂的产电机制可能是:其分泌的化合物可作为中介体,从电极获得电子,从而完成硝酸盐的还原。
生物阴极微生物燃料电池中同步产电反硝化菌的分离鉴定与性能
Isolation and identification of a simultaneous electricity production and denitrification strain in a microbial fuel cell with biocathode and its characteristics
-
摘要: 利用反硝化筛选培养基从稳定运行的MFC-AA/O反应器阴极板上分离纯化反硝化细菌,经16S rRNA鉴定后,接种于双室MFC的阴极,测试其产电能力以筛选同步产电反硝化细菌,之后对MFC的运行温度和pH进行优化,最后通过扫描循环伏安曲线分析其产电机理。结果表明:分离获得的一株反硝化菌经鉴定为铜绿假单胞杆菌(Pseudomonas aeruginosa),该菌可实现同步产电脱氮,最高输出电压可达168 mV左右,其脱氮反应的最优pH为7.5,最适温度为30 ℃;在生物阴极起催化产电反硝化作用的可能是Pseudomonas aeruginosa的分泌物,其作为中介体,可从电极获得电子,完成硝酸盐的还原。上述结果说明,Pseudomonas aeruginosa作为接种MFC生物阴极的纯菌,可以实现同步产电反硝化,为反硝化生物阴极MFC的实际应用奠定基础。Abstract: Multiple denitrification screening mediums were used to isolate and purify denitrifying bacteria from the biocathode of a stably operated MFC-AA/O reactor, and 16S rRNA sequence analysis was conducted to identify the pure strains. The electricity production capacity was tested by inoculating the pure bacterial strains into cathodic chambers of MFCs to screen simultaneous electricity production and denitrification strains. Then, operation temperature and pH of MFC were further optimized. Finally, the electricity production mechanism was analyzed by scanning cyclic voltammetry curve. The results indicated that one isolated strain, identified as Pseudomonas aeruginosa, could achieve simultaneous electricity production and denitrification. The maximum output voltage could reach about 168 mV, and the optimum pH and temperature for denitrification were 7.5 and 30 ℃, respectively. Electrochemical analysis indicated that the simultaneous electricity production and denitrification might be catalyzed by some secretions of Pseudomonas aeruginosa, which could act as mediators to obtain electrons from the electrode and complete nitrates reduction. This study demonstrated that Pseudomonas aeruginosa as a pure electricigen inoculated in cathode chamber of MFC could achieve simultaneous electricity production and denitrification, which might lay a foundation for the practical application of MFC with denitrifying biocathode.
-

-
表 1 分离获得的反硝化菌类型
Table 1. Types of isolated denitrifying bacteria
样品编号 最相似菌种名称 登录号 相似度/% BZ1 Pseudomonas sp. KP462872.1 100 BZ2 Pseudomonas sp. KP979538.1 100 BZ3 Pseudomonas sp. KF791346.1 100 BZ4 Pseudomonas sp. KT368822.1 100 BZ5 Pseudomonas aeruqinosa NC002516.2 100 BZ6 Pseudomonas sp. KF544922.1 100 BZ7 Pseudomonas indoloxydans strain KP462871.1 99 BZ8 Pseudomonas stutzeri strain NZ-CP007441.1 100 -
[1] LOGAN B E, HAMELERS B, ROZENDAL R, et al. Microbial fuel cells: Methodology and technology[J]. Environmental Science & Technology, 2006, 40(17): 5181-5192. [2] THAUER R K, JUNGERMANN K, DECKER K. Energy conservation in chemotrophic anaerobic bacteria[J]. Bacteriological Reviews, 1977, 41(1): 100-180. [3] CLAUWAERT P, RABAEY K, AELTERMAN P, et al. Biological denitrification in microbial fuel cells[J]. Environmental Science & Technology, 2007, 41(9): 3354-3360. [4] VIRDIS B, RABAEY K, YUAN Z, et al. Microbial fuel cells for simultaneous carbon and nitrogen removal[J]. Water Research, 2008, 42(12): 3013-3024. doi: 10.1016/j.watres.2008.03.017 [5] XIE B, DONG W, LIU B, et al. Enhancement of pollutants removal from real sewage by embedding microbial fuel cell in anaerobic-anoxic-oxic wastewater treatment process[J]. Journal of Chemical Technology & Biotechnology, 2014, 89(3): 448-454. [6] XIE B, LIU B, YI Y, et al. Microbiological mechanism of the improved nitrogen and phosphorus removal by embedding microbial fuel cell in anaerobic-anoxic-oxic wastewater treatment process[J]. Bioresource Technology, 2016, 207: 109-117. doi: 10.1016/j.biortech.2016.01.090 [7] GREGORY K B, BOND D R, LOVLEY D R. Graphite electrodes as electron donors for anaerobic respiration[J]. Environmental Microbiology, 2004, 6(6): 596-604. doi: 10.1111/emi.2004.6.issue-6 [8] MOHAN S V, VELVIZHI G, MODESTRA J A, et al. Microbial fuel cell: Critical factors regulating bio-catalyzed electrochemical process and recent advancements[J]. Renewable and Sustainable Energy Reviews, 2014, 40: 779-797. doi: 10.1016/j.rser.2014.07.109 [9] PARK H I, KIM J S, KIM D K, et al. Nitrate-reducing bacterial community in a biofilm-electrode reactor[J]. Enzyme and Microbial Technology, 2006, 39(3): 453-458. doi: 10.1016/j.enzmictec.2005.11.028 [10] XIAO Y, ZHENG Y, WU S, et al. Bacterial community structure of autotrophic denitrification biocathode by 454 pyrosequencing of the 16S rRNA gene[J]. Microbial Ecology, 2015, 69(3): 492-499. doi: 10.1007/s00248-014-0492-4 [11] VIRDIS B, RABAEY K, ROZENDAL R A, et al. Simultaneous nitrification, denitrification and carbon removal in microbial fuel cells[J]. Water Research, 2010, 44(9): 2970-2980. doi: 10.1016/j.watres.2010.02.022 [12] VIRDIS B, READ S T, RABAEY K, et al. Biofilm stratification during simultaneous nitrification and denitrification (SND) at a biocathode[J]. Bioresource Technology, 2011, 102(1): 334-341. doi: 10.1016/j.biortech.2010.06.155 [13] MIN B, CHENG S, LOGAN B E. Electricity generation using membrane and salt bridge microbial fuel cells[J]. Water Research, 2005, 39(9): 1675-1686. doi: 10.1016/j.watres.2005.02.002 [14] LI P, ZHENG Y, CHEN S, et al. Identification of an aerobic denitrifying bacterium and its potential application in wastewater treatment[J]. Chinese Journal of Applied and Environmental Biology, 2005, 11(5): 600-603. [15] BALCH W, FOX G, MAGRUM L, et al. Methanogens: Reevaluation of a unique biological group[J]. Microbiological Reviews, 1979, 43(2): 260-293. [16] CHENG S, LOGAN B E. Ammonia treatment of carbon cloth anodes to enhance power generation of microbial fuel cells[J]. Electrochemistry Communications, 2007, 9(3): 492-496. doi: 10.1016/j.elecom.2006.10.023 [17] DINESHKUMAR N, SARAVANAKUMAR C, VASANTH M, et al. Genetic and physiological characterization of denitrifying bacteria from brackishwater shrimp culture ponds of India[J]. International Biodeterioration & Biodegradation, 2014, 92: 49-56. [18] 国家环境保护总局, 水和废水监测分析方法 [M]. 4版 北京: 中国环境科学出版社, 2009. [19] RABAEY K, BOON N, SICILIANO S D, et al. Biofuel cells select for microbial consortia that self-mediate electron transfer[J]. Applied and Environmental Microbiology, 2004, 70(9): 5373-5382. doi: 10.1128/AEM.70.9.5373-5382.2004 [20] RABAEY K, BOON N, H FTE M, et al. Microbial phenazine production enhances electron transfer in biofuel cells[J]. Environmental Science & Technology, 2005, 39(9): 3401-3408. [21] RABAEY K, LISSENS G, SICILIANO S D, et al. A microbial fuel cell capable of converting glucose to electricity at high rate and efficiency[J]. Biotechnology Letters, 2003, 25(18): 1531-1535. doi: 10.1023/A:1025484009367 [22] LI C, REN H, XU M, et al. Study on anaerobic ammonium oxidation process coupled with denitrification microbial fuel cells (MFCs) and its microbial community analysis[J]. Bioresource Technology, 2015, 175: 545-552. doi: 10.1016/j.biortech.2014.10.156 [23] YAMAMOTO-IKEMOTO R, KOMORI T, NOMURI M, et al. Nitrogen removal from hydroponic culture wastewater by autotrophic denitrification using thiosulfate[J]. Water Science and Technology, 2000, 42(3/4): 369-376. [24] SUN Y, LI A, ZHANG X, et al. Regulation of dissolved oxygen from accumulated nitrite during the heterotrophic nitrification and aerobic denitrification of Pseudomonas stutzeri T13[J]. Applied Microbiology and Biotechnology, 2015, 99(7): 3243-3248. doi: 10.1007/s00253-014-6221-6 -




 下载:
下载: