塑料因耐用、轻便等优点在日常生活中应用广泛,包括电子、汽车、建筑、服装、化妆品、玩具、包装、器皿和一次性塑料制品等[1]。据统计,塑料的年产量从1950年的200万t增加到2020年的近3.7亿t[2]。然而,在环境中的塑料制品难以有效回收,会在长期冲刷、腐蚀和光照等物理、化学等作用下破碎成更小的颗粒或碎片,并随风、径流等方式进入海洋生态系统中,形成微塑料污染。微塑料(MPs)是指粒径或长度<5 mm的塑料碎片或颗粒,在自然栖息地中无处不在[3],对海洋生物和环境造成的风险受到越来越广泛的关注[4-5]。据Science报道[6],海洋环境中的塑料垃圾会降解成数百万个微塑料碎片,导致海洋环境中的微塑料数量不可避免地增加。目前,微塑料在海洋表层、海滩、海底沉积物、深海沉积物、极地等介质中均有检出[7]。
海草(seagrass)是生长在海洋中的显花植物,与陆生高等植物相比其种类极其稀少,全球仅有72种[8],现存海草植物是70~100百万年前由单子叶植物进化而来的4个独立支系[9],海草广泛分布在世界各地的温带和热带海岸线上[10]。Short等[10]根据海草群落的组成及分布等将全球的海草划分为六大区系:温带北大西洋区系、温带北太平洋区系、地中海区系、温带南大洋区系、热带大西洋区系和热带印度-太平洋区系。据统计,在全球范围内海草覆盖面积约为325 178 km2,其中印度洋-太平洋区域约占全球的52%[11]。我国海草床主要分布在南海海草床区和黄渤海海草床区,文献记载海草床总面积约为87.65 km2[12-13]。中国确定有分布的海草种类为22种,约占世界海草总数(72种)的30%。海草种类一共有2科10属22种,在北方地区海草有2属7种,通常以鳗草为主;南方地区有8属14种,通常以海菖蒲、泰来草、卵叶喜盐草为主。其中,海南省是中国海草分布面积最大和种类最多的区域[12],拥有天然海草床,海草种类为2科8属13~14种[14],海草床主要分布在高隆湾、新村港、东寨港以及大洲岛等,主要的海草种类包括泰来草(Thalassia hemprichii)、海菖蒲(Enhalus acoroides)、卵叶喜盐草(Halophila ovalis)、贝克喜盐草(Halophila beccarii)、小喜盐草(Halophila minor)、圆叶丝粉草(Cymodocea rotundata)、齿叶丝粉草(Cymodocea serrulata)、单脉二药草(Halodule uninervis)、羽叶二药草(Halodule pinifolia)和针叶草(Syringodium isoetifolium)[15],其中海菖蒲、卵叶喜盐草和泰来草为优势种。
海草床是世界上生产力最高的生态系统之一,为大量海洋生物提供栖息地,在养分循环、侵蚀控制和改善水质等方面发挥着重要作用[16],在全球和地方范围内具有重要的生态和经济效益。同时,海草床生态系统是高效的天然碳汇[17-18],每年对碳的固定量可以高达每平方米数百克,约占海洋每年固定有机碳的10%[17]。然而,由于拖网、水产养殖、废水排放、城市生活污水排放、除草剂和杀虫剂的大量使用等人为活动的存在以及水体的富营养化使得海草床生态系统出现了严重的退化,相比于过去的40年面积缩小了约9/10,成为了全球性危机之一[19-20]。自1990年以来,全球海草床以每年7.0%的速度在减少,约有29.0%的海草床已经面临消失[12,20-21]。研究发现,我国海南陵水县新村港南岸的3个海草分布点从1991年到2006年退化迅速,其中位于西部的2个分布点是由一个大的海草场退化、面积逐渐缩小为2个完全独立的分布点而形成,而位于东部的分布点却在这17年里逐渐退化直至消失[22],同时在海南省高隆湾人工岛的建设导致人工岛周边500 m左右区域出现无海草分布的情况,海草面积减少了4.93 km2[23]。据2015—2019年我国海南岛海草床监测数据表明,海草床平均盖度(19.7%~26.0%)随年份的增加整体呈下降趋势,海草床由成片分布退化为斑块状、再变成零星状[24]。从历年的资料分析可知,陆源污染、海洋工程及极端天气等是造成我国海南岛海草床生态系统退化的主要原因[25]。然而近年来,微塑料被发现是海草床生态系统的另一种潜在威胁[21]。海草床生态系统已被确定为微塑料的长期汇集地,在沉积物和海草叶片表面均有检出,对整个海草床生态系统构成了潜在威胁[26-27]。据报道,微塑料的存在会抑制海草及其附生植物以及浮游植物的光合作用,并可能诱导根系退化和氧化应激[28]。同时,可能对海草床栖息生物的生长、发育和繁殖造成威胁[29]。因此,深入研究海草床生态系统中微塑料具有非常重要的现实意义。本文通过梳理分析国内外海草床生态系统中微塑料的最新研究进展,归纳总结了海草床生态系统微塑料的检测方法、赋存特征以及毒理效应,并提出了未来的研究前景,为海草床生态系统微塑料污染的生态风险评估与控制提供了理论支撑。
1 海草床生态系统微塑料提取和检测方法研究进展(Advances in the extraction and detection methods of microplastics in seagrass bed ecosystems)
1.1 海草叶片中微塑料的采样及提取
1.1.1 采样方法
海草叶片特有的物理结构可使得微塑料黏附其表面,同时微塑料表面生物膜的存在进一步促进其对海草的黏附,使得海草具有一定的微塑料捕获效应,导致微塑料在海草床生态系统中不断积累[30],但相关研究报道相对欠缺。海草叶片中微塑料的取样方法主要采用样方法[27]、装置法[27](取芯器)和随机取样[31](采样时海草间距至少1 m)。与海洋水体中微塑料采样方法不同的是,由于海草分布于低潮带,需要在采样时考虑潮汐情况[32],于退潮时采集海草样品,将采集的样品带回实验室后,经灭菌海水清洗后,转移至事先清洗过后的玻璃容器中保存,以防二次污染。然而,目前海草中微塑料的采样方法难以统一:(1)退潮时间无法一致导致采样周期和频率也各不相同;(2)各地海草面积不一致且分布比较分散,无法统一确定样方面积。
1.1.2 微塑料的提取
在对海草捕获的微塑料进行鉴别与定量之前,需对海草进行前处理提取微塑料,以便后续分析鉴定更加准确、方便。海草中微塑料样品的前处理方法一般包含消解和浮选2个过程。具体过程如下。将准备好的植株叶片加入消解液去除海草样品中的有机物,从而提高叶片中微塑料的检测效率,常用的消解液包括酸、碱、氧化剂和酶4类,其中H2O2最常用于环境样品中有机物的去除。消解之后进行浮选,浮选是利用微塑料与盐溶液密度的差异达到分离的目的。一般常用的浮选液主要有饱和氯化锌(ZnCl2) (1.6 g·cm-3)、饱和氯化钠(NaCl) (1.2 g·cm-3)和饱和碘化钠(NaI) (1.8 g·cm-3),其中饱和ZnCl2因成本较低、密度大和可浮选大部分的微塑料成为最常用的浮选剂。目前已有报道通过使用30%过氧化氢(H2O2)对鳗草叶片进行处理以消化有机物,然后使用饱和的ZnCl2对叶片中的微塑料进行密度浮选,获得较好分离效果[33]。然而,利用30% H2O2对富含有机物进行处理时经常会形成致密的泡沫,使得大部分样品悬浮在试剂上方,进而阻碍样品的过滤效果,不利于进一步处理,造成微塑料的回收率偏低[34]。同时,ZnCl2具有很强的腐蚀性,具有一定的危害性,因此,有必要进一步深入研究更高效且无干扰的微塑料分离与纯化方法。
1.2 沉积物中微塑料的采样及提取
1.2.1 采样方法
环境中的微塑料少部分黏附于海草叶片,大部分由于冠层内减缓的水流速度和波浪或者随叶片枯萎积聚于海草床沉积物中。海草床沉积物中微塑料的取样方法主要采用抓斗采集器[32]、柱状采样器[24]、装置法[27](取芯器)和不锈钢铲[33],在有海草和裸露的地区对沉积物样本进行收集,将表面沉积物样品收集在无菌袋中并储存在4 ℃直至分析。在强风或降雨期间,沉积物可能重新悬浮在水中,因此要避开此阶段采样。此外,为了考虑海洋流入的湍流可能造成的沉积物微塑料潜在污染,需在水流最低时的退潮时收集样品。
1.2.2 微塑料的提取
目前,已报道的海草床沉积物中微塑料的提取方法及其优缺点如表1所示。由表1可知,海草床沉积物中微塑料提取方法包括密度分离法、消解法及其他方法(静电作用等)。最常使用的提取微塑料的方法是密度分离法,常用试剂包括饱和NaCl、NaI、ZnCl2等。NaCl用于提取海草床沉积物中微塑料时,具有量少,无毒、无害、廉价易得等优点,但是对于高密度微塑料提取效率较低,因此一般建议当处理组量较多时使用。NaI具有提取效率高、可多次使用的优点,但在配制溶液时所需要的量大且价格高。使用ZnCl2作为浮选液时,微塑料的回收效率高、成本低,但具有很强的腐蚀性。据报道,目前还研制出了一种专用的沉积物微塑料隔离(SMI)单元可以从底部的沉积物中提取微塑料[35-36],但该处理单元目前还不成熟,需深入研究。针对海草床生态系统沉积物组成复杂且富含有机质时,一般可能需先利用消解液(H2O2、硝酸(HNO3)、盐酸(HCl)等)进行预消化以去除沉积物中含有的有机物成分,该过程不仅对微塑料的含量产生影响很小,同时也可提高微塑料的分离和鉴定效率;消解后添加一定量的浮选液实现微塑料的分离。
1.3 栖息生物中微塑料的采样及提取
1.3.1 采样方法
海草床是海洋生物重要的栖息地和重要的食物链,其中包括底栖动植物、深海动植物、浮游生物、附生生物、细菌和寄生生物。海草床栖息生物样品的采样方法有横断面搜索法[27]和随机采样法。横断面搜索法即在研究区域选定100 m横断面,在横断面两侧每10 m点的1 m2区域中搜索海草上和沉积物上或沉积物内的食草生物,用手小心地从搜索区域内的海草叶片上清除食草生物,同时对海草正下方的沉积物进行物理搜索,通过目视和使用50 mL微型取样器来识别任何活生物体,将发现的生物均单独存储在干净的离心管中[27]。目前,关于海草床生态系统中栖息生物采样方法的相关报道非常匮乏,没有形成比较成熟的方法。
1.3.2 微塑料的提取
针对海草床栖息生物,需要对生物样品进行消化,以便更好对生物体内的微塑料进行视觉分析。目前缺乏从生物组织中提取微塑料的标准化方法,主要采用化学消化(10%氢氧化钾(KOH))和酶消化(蛋白酶-K)[27]。据报道,相比于更昂贵的蛋白酶-K(50 ℃下消化18 h),10% KOH(50 ℃下消化2 h)在完全消化生物样品方面效率更高[27]。特别地,对于海草床栖息的腹足动物需要先将其从壳中取出,并用蒸馏水冲洗壳内部以去除任何松散的生物组织[27]。关于栖息生物中微塑料提取研究比较有限,未来可深入研究。
1.4 海草生态系统微塑料的检测方法
海草床生态系统微塑料的定性定量技术主要包括光学检测、扫描电子显微镜分析(SEM)、傅里叶变换红外光谱分析(FTIR)、拉曼光谱分析(Raman)和热分析。各类技术检测范围、作用以及优缺点如表2所示。光学检测一般用于检测0.5~5 mm的微塑料颗粒,具有成本低、操作简单等优点,但光学检测耗费人力,且可能存在计数错误的情况。研究表明,利用光学检测分析沉积物微塑料错误率高达20%~70%,且无法进行微塑料化学组分的鉴别[37],需要结合其他分析方法进行确定与验证,因此光学检测一般只作为微塑料的初步鉴定方法。与光学显微镜相比,扫描电子显微镜有较高的放大倍数,扫描后图像分辨率高、立体感强,可以观察到微塑料细微结构,但无法实现精准定量。 FTIR扫描速率快,重现性好,可以对微塑料的官能团进行表征,但无法识别不规则的微塑料,且不可测含水样品。拉曼光谱可以分析1~20 μm的微塑料样品,测定痕量元素组成,进行定性定量分析时不会对微塑料造成损伤,但耗费人力和时间。热分析检测微塑料的范围在毫米之内,检测时不需要消除背景污染问题,具有可靠性和准确性,但检测效率和分辨率较低。在已有报道中,扫描电子显微镜和FTIR在海草床生态系统微塑料的检测中应用最为普遍。整体而言,生态系统中微塑料的检测方法研究仍处于初始阶段,如何精准识别与定量微塑料,在未来的海草床生态系统研究中至关重要。
表1 海草床沉积物中常用微塑料的提取方法
Table 1 Extraction methods of microplastics commonly used in seagrass bed sediments

提取方法Extraction methods溶液/装置Solutions/devices优点Advantages缺点Disadvantages参考文献References密度分离法Density separation method氯化钠NaCl所需试剂量少,无毒、无害、廉价易得Low reagent requirement, non-toxic, non-hazardous, cheap and easy to obtain高密度微塑料提取效率低Low extraction efficiency of high-density microplastics[38-39]碘化钠NaI提取效率高,可多次使用High extraction efficiency and reusability试剂量大且价格高Large quantities of reagents at high prices[40]氯化锌ZnCl2回收率高,成本低High recovery rate and low cost腐蚀性强Highly corrosive[39]密度分离浮选装置Density separation flotation unit便捷Convenient and fast处理单元还不成熟,不能大面积推广Treatment units are not mature enough for large-scale rollout[35-36]消解法Digestion method过氧化氢H2O2消解有机质,受温度影响大Disintegration of organic matter, highly influenced by temperature对聚合物降解能力弱Weak polymer degradability[40]硝酸HNO3酸性消解Acid digestion残留量较高,容易使聚合物损失或变色Higher residue levels tend to cause polymer loss or discoloration[38]其他方法Other methods静电作用Electrostatic reaction回收率较高Higher recovery rate不适用于少量样品Not applicable to small samples[30-31]
2 海草床生态系统微塑料来源和赋存特征(Sources and characteristics of microplastics in seagrass bed ecosystems)
2.1 海草床生态系统微塑料来源
海草床生态系统微塑料的污染源主要分为陆源、大气沉降和海源(图1)。陆源污染包括市政污水处理厂、工业污水排放以及地表径流等方式。生活中使用的护肤品、洗涤剂以及工业原料中的微塑料成分由于颗粒小难以在污水处理过程中被去除,从而会随着污水处理厂或者工业污水的排放进入海洋,进一步输入到海草床生态系统[44]。同时,人类使用过程中无意或有意丢弃的塑料废弃物,在暴雨等的冲刷作用下随着地表径流进入海草床。大气物质沉降入海后,通过影响海草床上层中营养盐(氮、磷)等微量元素的含量,改变海草床生态系统氮循环路径和速率,影响群落结构与初级生产过程,促进海草床生态系统对大气CO2的吸收和碳的埋藏,海草生态系统中的叶片也可吸附一定量的微塑料。因此,与其他生态系统相比海草床生态系统具有很强的固碳能力。
表2 海草床生态系统中微塑料检测的常见方法
Table 2 Common methods for detecting microplastics in seagrass bed ecosystems

分析方法Analytical methods检测范围Detection range功能Function优点Advantages缺点Disadvantages参考文献Reference光学检测Optical detection>500 μm微塑料>500 μm microplastics微塑料大小、颜色和类型手动分离Manual separation of microplastic size, color and type便捷、廉价Convenient and inexpensive耗人力,计数错误率高Labor-intensive, high counting error rate[37]扫描电子显微镜(SEM)Scanning electron microscope (SEM)纳米级微塑料Nanoscale microplastics研究微塑料表面形貌Study the surface morphology of microplastics分辨率高High resolution无法精准定量Unable to accurately quantify[37]傅里叶变换红外光谱(FTIR)Fourier transform infrared spectroscopy (FTIR)样品厚度150 nm,空间分辨率5 μmSample thickness 150 nm, spatial resolution 5 μm分析微塑料表面特性和组成Analyze microplastic surface properties and composition可识别较小微塑料Identify smaller microplastics不可测含水样品Not available for detecting water samples[37,41]拉曼光谱Raman spectroscopy空间分辨率低于1 μm的颗粒Particles with a spatial resolution of less than 1 μm痕量元素组成Trace element composition分析1~20 μm样品Analyze 1~20 μm samples耗费人力和时间;造成光谱干扰Labor-intensive and time-consuming; causes spectral interference[37,42]热分析Thermal analysis毫米之内Within millimetres识别聚合物类型及检测复杂配方中有机化合物Identification of polymer types and detection of organic compounds in complex formulations一次运行完成无需乙醇等溶剂消除背景污染;可靠性和准确性高One run is completed without the need for solvents such as ethanol to eliminate background contamination; high reliability and accuracy效率和分辨率低;微塑料和复杂样品之间在一定温度下发生反应Low efficiency and resolution; reactions between microplastics and complex samples occurs at certain temperatures[37,43]
海源主要包括近海养殖、滨海旅游以及船舶航运丢弃的塑料废弃物等。近年来,近岸海域的水产养殖业发展迅速,在养殖过程中大量使用的泡沫聚苯乙烯漂浮装置的老化、破损以及饲料垃圾袋的丢弃是海草床生态系统微塑料的一个重要来源[45-46]。据调研发现,海草床附近高位池养殖(鱼、鸭、虾等)分布集中,大量丢弃的塑料制品以及未经妥善处理任意排放的养殖废水随着海水流动直接进入海草床生态系统。同时,游客在海滩上或海洋随意丢弃的塑料袋、塑料瓶等塑料废弃物通过风、环流等的媒介进入到海草床生态系统中。其次,海上捕鱼活动由于更新渔具导致大量破旧废弃塑料渔网遗弃在海洋中或海上钻探期间意外丢失或非法处置的塑料垃圾也是导致海草床微塑料污染增加的另一个主要原因。据报道,船舶每年向海洋丢弃6万t塑料垃圾(包括渔网、绳索等)[47]。此外,海上钻探期间的意外丢失或非法处置以及突发的海上航运事故也可能导致大量的塑料进入海草床生态系统。一些诸如台风、暴雨的极端天气更是加剧了陆源污染物向海传输的速率[48]。相比于其他的微塑料来源,高位池养殖以及近岸垃圾的丢弃可能是海草床生态系统微塑料的主要来源。总体来看,目前学术界对海草床生态系统中微塑料污染的源解析还很欠缺,不同来源的具体贡献也不明确,亟待加强相关研究。
2.2 海草床生态系统微塑料的赋存特征
海草在沿海地区繁衍栖息,这些地方经常受到人类活动的严重影响,并从陆地接收大量的微塑料输入。由于洋流和潮汐的作用,微塑料可以在沿海区域积累。海草床的存在可有效降低海水流速,进一步促进微塑料的积累。而海草叶片上的附生细菌在生长、繁殖和代谢过程中会分泌黏性物质,会增强微塑料对海草的黏附。目前,海草床生态系统微塑料的赋存特征已成为国内外研究的热点,在图2中揭示了海草床生态系统中微塑料的赋存特征。
2.2.1 海草叶片上微塑料的赋存
现阶段海草叶片中微塑料的检测方法尚未标准化,导致海草叶片中微塑料污染现状调查工作无法充分开展。根据有限的研究结果,可知微塑料污染可能广泛存在于海草叶片中。在鹿尼斯湾区域的海草叶片上发现微塑料的平均数量为(4.25±0.59)个(n=60),主要形状为纤维、薄片和碎片,颜色以白色为主[27]。也有学者对伯利兹图尔内夫环礁海洋保护区的泰来草叶片上微塑料赋存特征进行研究,发现75%的叶片上存在微塑料,微纤维(81%)比微珠(16%)和碎片(3%)多,颜色主要是黑色、蓝色和红色[26]。中国山东省威海、烟台和青岛,同样在采集的大鳗草叶片上检测出黏附的微塑料,并且随着鳗草浓度(0.5~2.0 g·L-1)的增加,单位质量的微塑料数量逐渐减少,从(152.4±42.3) 个·(0.1 g)-1降低到(48.5±9.2) 个·(0.1 g)-1[32]。鳗草叶上的附生细菌可以在微塑料表面快速繁殖,形成生物膜,促进微塑料聚集体的形成以及微塑料对鳗草叶和白色絮状物的黏附[32]。
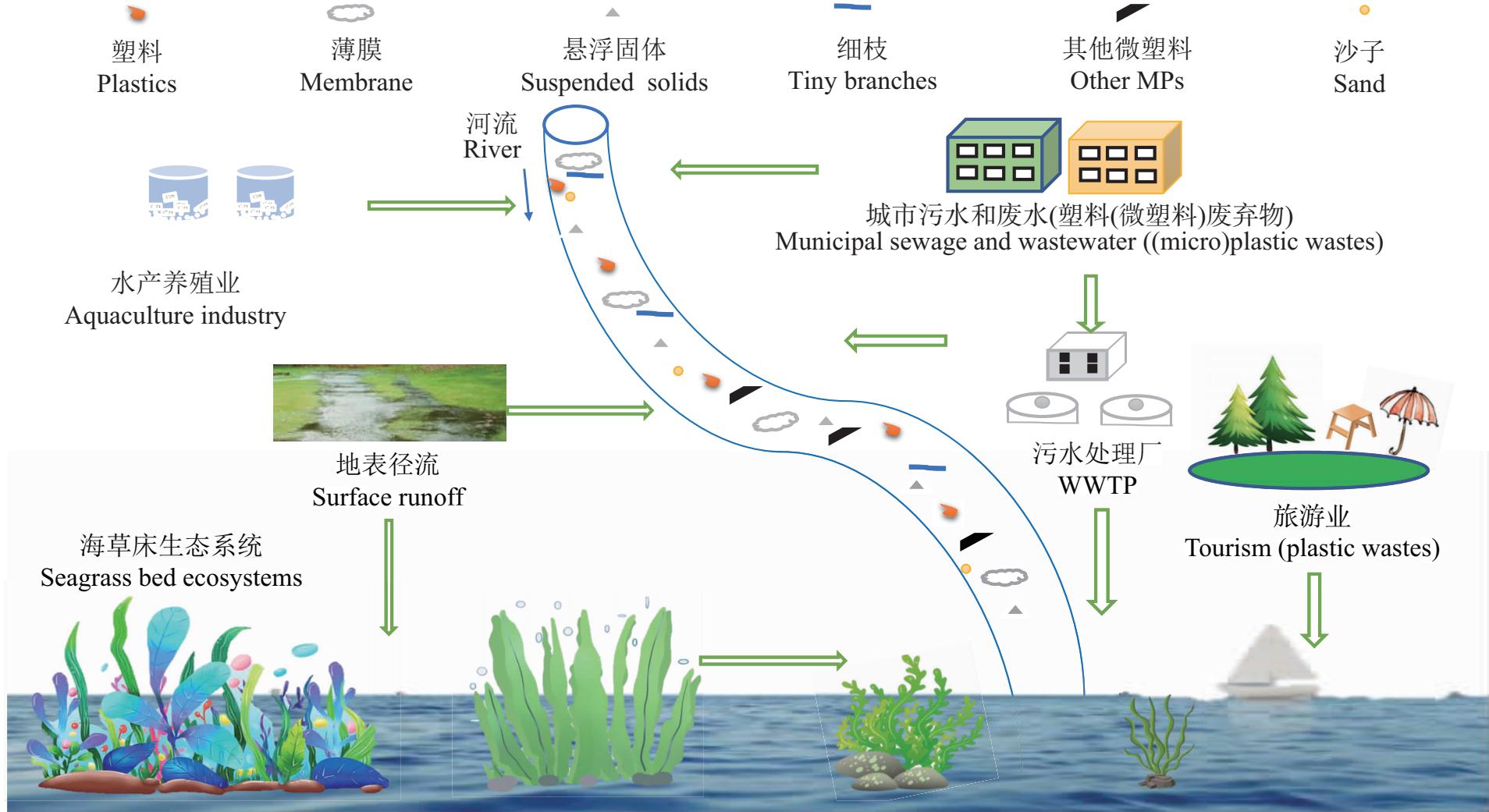
图1 海草床微塑料(MPs)的来源
Fig. 1 Sources of microplastics (MPs) in seagrass bed ecosystems
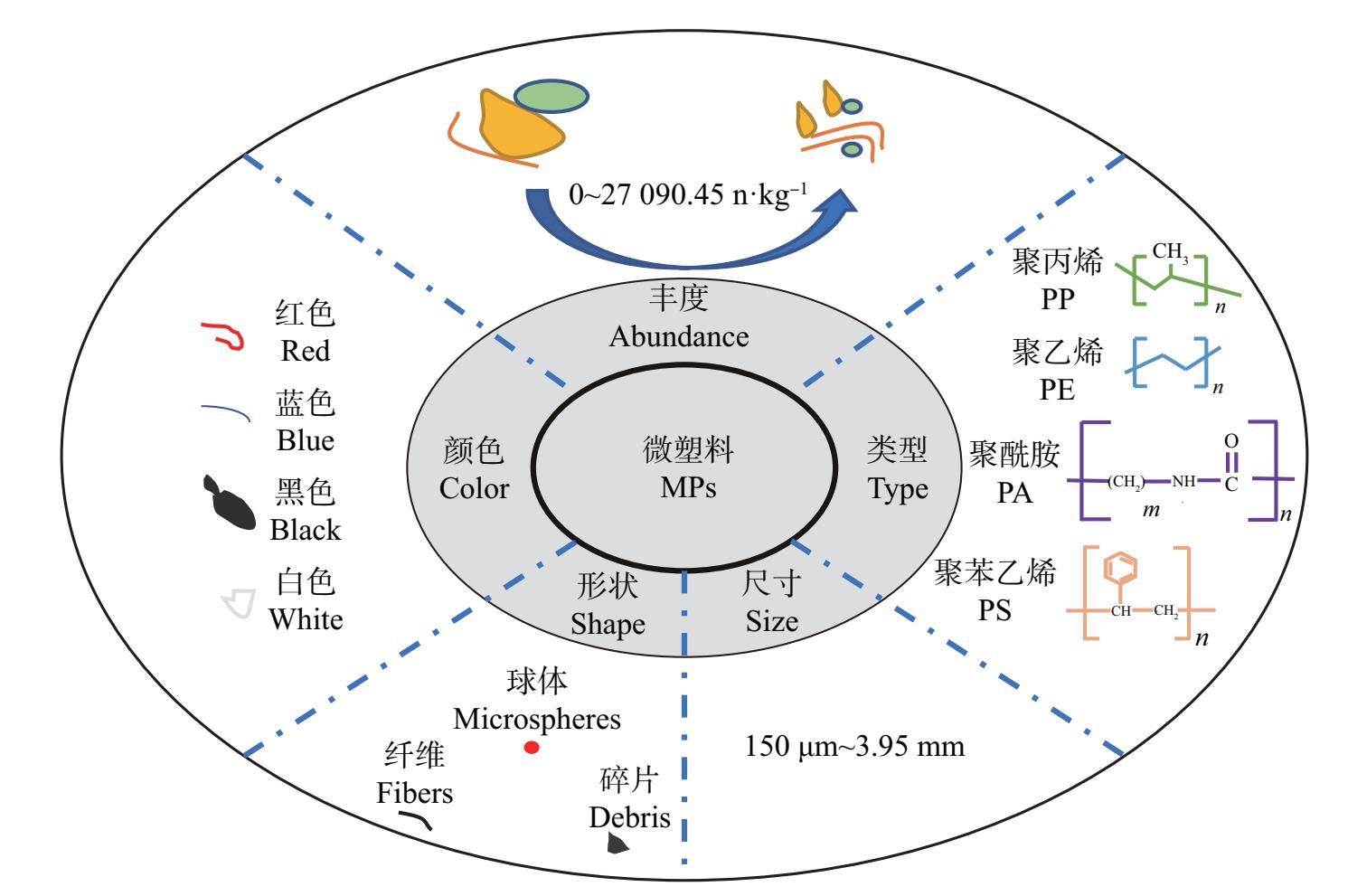
图2 海草床生态系统中微塑料的赋存特征
Fig. 2 Characteristics of microplastics in seagrass bed ecosystems
2.2.2 海草沉积物中微塑料的赋存
海草床对微塑料的捕获效应可能取决于塑料大小、栖息地水动力状况和潮汐位置等因素[49]。除海草叶片外,沉积物是微塑料在海草床生态系统中另一个重要的“汇”。目前全球多地海草床沉积物及其栖息生物中均检出微塑料,如表3所示。由表3可知,目前大部分海草床沉积物中微塑料的检出率高达90%以上,微塑料粒径普遍在150 μm~3.95 mm之间,主要聚合物类型为聚乙烯(PE)、聚丙烯(PP)、聚丙乙烯(PS)和聚酰胺(PA),其中PP和PE类检出率最高,这可能是因为海水养殖的渔网和编织袋的材质主要是以PE和PP为主。同时,可以看出微塑料的形态主要以纤维和碎片为主,其中纤维占主导地位,主要原因是海边居民排放的生活污水、渔网和编织袋中含有大量的纤维,与PE材质微塑料占比高的结果相呼应。检出的微塑料颜色主要以浅颜色为主,如蓝色。这可能是由于阳光暴晒、海水盐度和沉积物中动物、微塑料等综合作用的结果。地中海[50]、印度尼西亚[51]、英国[36]、波罗的海[52]的海草床沉积物中微塑料丰度分别为68~3 819 n·kg-1、18 368.11~27 090.45 n·kg-1、215 n·kg-1、0~1 817 n·kg-1(表3),在我国南部的新村港、黎安港以及潟湖周边海草床沉积物中同样检测出微塑料,其丰度分别为93.3~196.7 n·kg-1、267.1~780.2 n·kg-1和26.67~277.3 n·kg-1,高于附近无海草区域。微塑料在海草床生态系统中的赋存特征存在着显著差异,主要与区域人为活动(如农业生产活动、污水排放、海洋水产养殖、海滩管理等)和自然条件(沉积物性质、水文条件、气象条件等)有关[33,50-51]。
2.2.3 海草床栖息生物中微塑料的赋存
在海草床中常见的栖息生物,如海参、沙元等体内发现了微塑料的存在(表4),其形状主要以纤维为主,颜色以黑色和蓝色为主[53]。吸附在沉积物中的微塑料不易降解且稳定存在,不利于沉积物中其他生物的生存。与沉积物和海草中发现的微塑料相比,生物体内微塑料的平均尺寸相对较小。
表3 海草床沉积物微塑料污染分布
Table 3 Distribution of microplastic pollution in seagrass bed sediments

研究区域Study area海草类型Seagrass types微塑料检出率/%Microplastic detection rates/%微塑料丰度Microplastic abundances微塑料类型Types of microplastics微塑料颜色Microplastic colors微塑料形状Microplastic shapes微塑料粒径Microplastic particle size参考文献References中国海南省新村水产养殖区Xincun Aquaculture Zone, Hainan Province, China海草Seagrass-(277.3±26.6) 个·kg-1(277.3±26.6) particles·kg-1PE、PP、PS、PET、PA浅颜色为主、蓝色、黑色Mainly light colors, blue, and black纤维、碎片、颗粒、泡沫、薄膜状Fibers, debris, particles, foam and film<200 μm占比最高<200 μm with the highest proportion[24]英国苏格兰Scotland, United Kingdom大叶草Gunnera perpensa100(300±30) kg·kg-1PE、PP、PA、PS蓝色Blue纤维、薄片碎片Fibers, flakes, and debris0.04~3.95 mm[27]中国威海、烟台和青岛等沿海地Coastal areas such as Weihai, Yantai, andQingdao in China鳗草Zostera marina-汇泉湾:(440±39.2) 个·kg-1桑沟湾:(208±33.3) 个·kg-1双岛湾:(238±31.2) 个·kg-1长岛:(159±17.9)个·kg-1Fountain Valley: (440±39.2) particles·kg-1; Sanggou Bay: (208±33.3) particles·kg-1; Twin Island Bay: (238±31.2) particles·kg-1; Long Island: (159±17.9) particles·kg-1PS--0.5~5 mm[32]中国海南省新村湾和利安湾Xincun Bay and Li’an Bay, Hainan Province, China海草Seagrass-新村湾(Xincun Bay)裸地:(93.3±15.3) 个·kg-1;植被:(196.7±16.1) 个·kg-1Bare ground: (93.3±15.3) particles·kg-1;Plant cover: (196.7±16.1) particles·kg-1利安湾(Li’an Wan)裸地:(267.1±60.5) 个·kg-1;植被:(780.2±147.0) 个·kg-1Bare ground: (267.1±60.5) particles·kg-1;Plant cover: (780.2±147.0) particles·kg-1PE(48.7%)、PP(33.3%)、PA(10.3%)、PS(7.7%)红色、蓝色、透明、白色、黑色Red, blue, transparent, white and black纤维、碎片、颗粒、泡沫Fibers, debris, particles and foam125~250 μm (26.3±8.9)%[33]英国United Kingdom大叶草Gunnera perpensa98(215±163) 个·kg-1(215±163) particles·kg-1-蓝色为主Blue纤维91.8%、碎片6.6%、薄膜1% Fibers 91.8%, debris 6.6%, and film 1%-[36]地中海Mediterranean海草Seagrass-68~3 819 个·kg-168~3 819 particles·kg-1PU、PS、PVC、PE、PTFE透明、白色、绿色为主Mainly transparent,white, and green纤维Fibers500~1 000 μm (29%)、300~500 μm (23%)、150~300 μm (22%)[50]印度尼西亚Indonesia海菖蒲 Enhalus acoroides泰来草 Thalassia hemprichii丝粉草 Cymodocea针叶草Syringodium isoetifolium卵叶喜盐草 Halophila ovalis-18 368.11~27 090.45 个·kg-118 368.11~27 090.45 particles ·kg-1-蓝色为主Blue纤维、碎片Fibers and debris-[51]波罗的海Baltic Sea鳗草Zostera marina-0~1 817 个·kg-10~1 817 particles ·kg-1PA蓝色为主Blue纤维、碎片Fibers and debris72~27 635 μm[52]
注:PU表示聚氨酯;PS表示聚苯乙烯;PA表示聚酰胺;PP表示聚丙烯;PE表示聚乙烯;PVC表示聚氯乙烯;PTFE表示聚四氟乙烯;PET表示聚对苯二甲酸乙二酯;“-”表示未给出。
Note: PU is polyurethane; PS is polystyrene; PA is polyamide; PP is polypropylene; PE is polyethylene; PVC is polyvinyl chloride; PTFE is polytetrafluoroethylene; PET is polyethylene terephthalate; “-” is not given.
表4 海草床栖息生物的微塑料污染分布
Table 4 Distribution of microplastic pollution by seagrass bed dwelling organisms

研究区域Study area生物类型Organism type微塑料检出率/%Microplastics detection rate/%微塑料丰度Microplastic abundance微塑料类型Types of microplastics微塑料颜色Microplastic colours微塑料形状Microplastic shapes微塑料粒径/mmMicroplastic particle size/mm参考文献Reference英国苏格兰奥克尼迪尔内斯湾Orkney Dinesh Bay, Scotland, UK栉水母物种Chaetogammarus species-1个·种-11 particles·species-1--纤维Fibers2伽马鲁斯物种Gammarus species-1个·种-11 particles·species-1--纤维Fibers2.7赤霉菌Trichoderma reesei-5个·种-15 particles·species-1--纤维Fibers4网状铠Bittium reticulatum-2个·种-12 particles·species-1--纤维Fibers8.5膜裂口虫Rissostomia membranacea-4个·种-14 particles·species-1--纤维Fibers3.9Nephtys物种Nephtys species-3个·种-13 particles·species-1--纤维Fibers46[27]美国佛罗里达群岛Florida Keys, USA海参Sea cucumbers---蓝色、黑色Blue and black纤维Fibers-美国佛罗里达州Florida, USA沙元Sand dollars---蓝色、黑色Blue and black纤维、薄膜Fibers and film-[53]
注:“-”未给出。
Note:“-” is not given.
尽管海草床微塑料污染已引起关注,但目前尚未报道微塑料野外调研与定性定量分析的标准化流程,现有文献的微塑料提取、采样、统计以及检测技术都存在一定的差异,对全球范围内海草床生态系统中微塑料的分布与丰度数据造成不同程度的影响。因此有必要深入研究微塑料在海草床生态系统的标准化野外调研方法和检测分析、统一化的计量单位以及进一步对微塑料赋存的研究,以便为海草床生态系统中微塑料的研究提供更好的参考依据。
3 海草床生态系统微塑料的毒理效应(Toxicological effects of microplastics in seagrass bed ecosystems)
本文总结了微塑料对海草床中海草、浮游植物及其栖息生物的毒理效应以及微塑料与复合污染物的联合毒理效应的研究。整体而言,目前对于海草床生态系统中微塑料毒性效应的系统性研究仍然相对不足。
3.1 微塑料对海草及附生植物的毒理效应
微塑料可能会通过海草叶片从水柱中过滤出来,过滤出的微塑料下沉到沉积物中,使得海草床充当微塑料的水槽或水库[54]。研究表明,海草可以充当微塑料的过滤器,捕获并保留了多种微塑料[27,29,52]。当海草叶片与微塑料接触时,微塑料会黏附在海草叶片的表面,其中一部分微塑料融入到海草叶片中,叶片细胞失去叶绿素,光合作用下降。此外,海草长期暴露于微塑料可能会改变海草结构,阻止根茎垂直生长,并增加海草对入侵和沉积的脆弱性[28]。有证据表明,生长在海草叶上的附生植物的存在可以在促进微塑料积累方面发挥作用[26,55]。微塑料一旦进入海草床生态系统沉积物中,微塑料就会影响微生物群落,导致养分循环改变[56],并在局部增加沉积物污染物的浓度,作为重金属和残留单体的载体[57]。但微塑料是含有C、H等元素的高分子聚合物,叶片携带着微塑料掉落到沉积物中有利于碳的封存,最终使得海草床生态系统中CO2含量减少,有利于缓解全球范围内气候的变化,因此,需要辩证看待微塑料对海草产生的效应,未来可以考虑微塑料对海草床碳库的影响。
3.2 微塑料对海草床生态系统中浮游植物的毒理效应
浮游植物是海草床生态系统中最重要的初级生产者,同时也是水体质量要的溶解氧供应者,浮游植物启动了海草床生态系统中的食物网,在海草床生态系统的能量流动、物质循环和信息传递中起着至关重要的作用,还可作为水质监测的指标[58]。目前,微塑料作为一种新污染物对浮游植物的生长和繁殖产生了巨大的影响。Wu等[59]研究发现,PVC和PP对海草床中蛋白核小球藻和水华微囊藻的光合作用均产生明显的抑制作用,且PVC抑制效果高于PP。
3.3 微塑料对海草床生态系统栖息生物的毒理效应
3.3.1 微塑料的单一毒理效应
海草床是鱼类、贝类、甲壳类、海星类、海参类等许多海洋生物繁殖与繁衍栖息地,微塑料的存在对这些栖息生物的生长、发育和繁殖造成威胁[29]。研究发现,在海草床生态系统中,鱼类体内微塑料的含量与它们体质量有关,相比于质量轻的鱼,较重的鱼体内可能含有更多的微塑料[60]。出现这种现象可能是因为较重的鱼往往具有较发达的消化系统,需要消耗更多的食物,食物中的微塑料会更多地进入鱼体内[60];也可能是通过食物链的富集导致大型鱼类中微塑料含量较高[61]。然而,一些实地调查表明,微塑料不易在动物肠道内积累,因此,滞留在鱼类体内的微塑料含量非常少,对野生鱼类,特别是顶级捕食性鱼类的影响有限[61-62]。对于海草床沉积物中的虾类而言,幼虾阶段以海草床中浮游生物为食。食物中存在有一定量的微塑料,从而对虾的生长和繁殖产生影响。此外,塑料在生产过程中会投入多种添加剂(如增塑剂、阻燃剂、抗氧化剂等)以提高产品规格,如延展性、硬度等[63],这些添加剂通常是以物理作用与塑料结合,因此容易从塑料本体中溶出并释放到海草床环境中,进而对栖息生物造成潜在危害[64]。
3.3.2 微塑料与复合污染物的联合毒理效应
与微塑料的单一毒性相比,复合污染物的毒性程度更大,传播范围更广。通常,海草床生态系统微塑料与其他污染物共存,微塑料由于具有粒径小、比表面积大的特性,具有吸附其他污染物的能力。同时,微塑料表面定殖的生物膜极有可能使其成为其他污染物吸附的载体,最终形成复合污染,携带污染物的微塑料进入生物体内产生复合毒性效应[65-66]。
如图3所示,微塑料复合污染主要集中在与重金属(heavy metals)、抗生素(antibiotics)和持久性有机污染物(POPs)的复合污染等方面,复合污染的形成对海洋生物产生联合毒理效应。据报道,微塑料在一定程度上增强鱼体内重金属Cu、Cd与Pb的累积效应,并可能产生复合污染效应[67]。同时,观察到微塑料和其他多重压力物(例如纳米颗粒、温度)对鱼类的负面综合影响[68]。目前对于微塑料与其他污染物的复合毒性研究还较为缺乏,具体毒性机制尚未明确,需深入研究微塑料载携作用对生物的毒性效应。
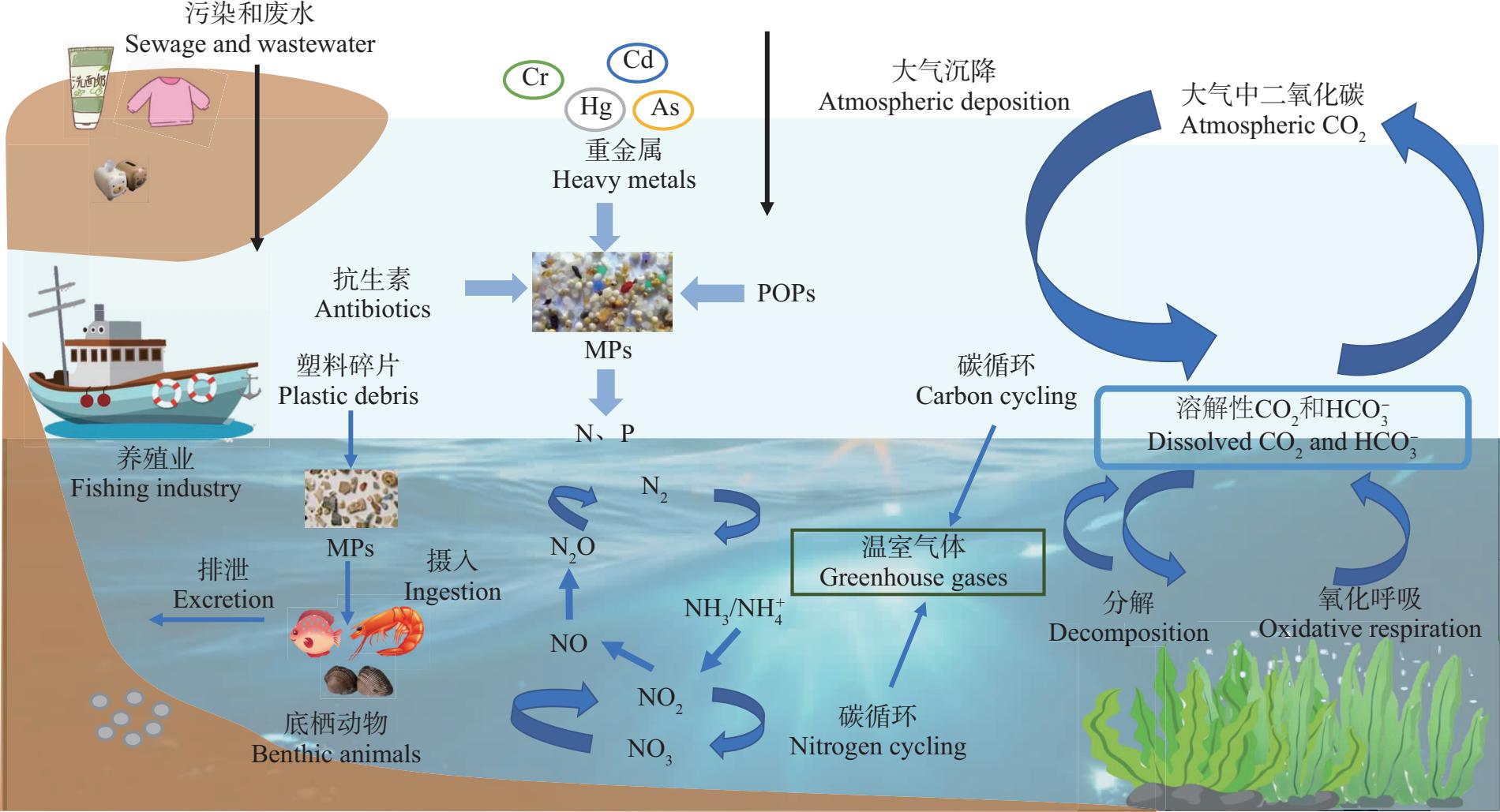
图3 海草床生态系统中微塑料与复合污染物的联合毒理效应
Fig. 3 Joint toxicological effects of microplastics and composite pollutants in seagrass bed ecosystems
4 结论与展望(Conclusions and perspectives)
微塑料作为一种新污染物,在海草床生态系统中的研究是近几年国内外研究热点。本综述通过文献调研,对海草床生态系统中微塑料的研究现状进行了详细阐述。
(1)对海草床生态系统中(包括海草叶片、沉积物、栖息生物)的微塑料采样方法、提取方法以及检测方法进行了系统的梳理,为海草床生态系统的进一步研究奠定了理论基础。但目前海草床生态系统中微塑料的采样方法难度较大,且缺乏统一的标准,相关研究区域内微塑料的各研究结果之间无法进行系统比较。
(2)海草床生态系统微塑料的主要来源包括即陆源、大气沉降和海源。其中高位池养殖以及近岸垃圾的丢弃可能是海草床生态系统微塑料的主要来源,但各种来源的贡献还未可知。
(3)虽然已经在海草床生态系统中广泛检出微塑料,但仅是对部分区域的海草床生态系统中的微塑料污染进行了初步调查,未能全面了解全球范围内海草床生态系统微塑料的污染水平及其分布特征。
(4)目前已报道微塑料会对海草床中的海草、附生植物、浮游植物和栖息生物产生一定的毒理效应,但对其系统性研究仍然相对不足,其可能带来的健康风险尚不清晰。
整体而言,目前人们对于海草床生态系统中微塑料的了解与认知仍十分有限,存在一系列问题有待解决。
(1)为了快速、准确且全面得分析海草床生态系统中微塑料的污染特征,需要建立相关样品中(海草、沉积物、栖息生物)微塑料取样、分离与检测的统一操作规范和标准化方法,同时微塑料检测仪器的检测效率与质量,统一丰度表达方式,使研究成果更具有可比性。
(2)加强全球海草床生态系统中微塑料的赋存特征及其影响因素、以及海草、沉积物与栖息生物三者中微塑料赋存的关联性研究。
(3)加强对海草床生态系统中微塑料的潜在来源分析,比如陆源排放的微塑料可能还包括合成橡胶和合成纤维,水产养殖排放可能还包括网箱和拖网,同时评估各来源的贡献比例。
(4)以海草床生态系统中微塑料的赋存水平数据为基础,加强评估模型研究,建立科学、系统的环境评价体系,准确评估微塑料污染相关的生态风险。
(5)海草床生态系统中微塑料被栖息生物摄入以及通过食物链进入人体后产生的健康风险研究尚不多见,其对植物生长的影响研究也缺乏系统性,这些方面需要进一步研究。在未来需要构建模拟实验,深入探究微塑料单一或与其他有毒污染物结合的毒理学机制。
[1] Filho W L, Havea P H, Balogun A L, et al. Plastic debris on Pacific Islands: Ecological and health implications [J]. The Science of the Total Environment, 2019, 670: 181-187
[2] Paletta A, Leal Filho W, Balogun A L, et al. Barriers and challenges to plastics valorisation in the context of a circular economy: Case studies from Italy [J]. Journal of Cleaner Production, 2019, 241: 118149
[3] Cózar A, Echevarría F, González-Gordillo J I, et al. Plastic debris in the open ocean [J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(28): 10239-10244
[4] Luo H W, Liu C Y, He D Q, et al. Environmental behaviors of microplastics in aquatic systems: A systematic review on degradation, adsorption, toxicity and biofilm under aging conditions [J]. Journal of Hazardous Materials, 2022, 423(Pt A): 126915
[5] Sun Y Z, Duan C X, Cao N, et al. Biodegradable and conventional microplastics exhibit distinct microbiome, functionality, and metabolome changes in soil [J]. Journal of Hazardous Materials, 2022, 424(Pt A): 127282
[6] Law K L, Thompson R C. Oceans. microplastics in the seas [J]. Science, 2014, 345(6193): 144-145
[7] 李道季, 董旭日. 海洋环境中的微塑料及其附着生物研究进展[J]. 华东师范大学学报(自然科学版), 2022(3): 1-7
Li D J, Dong X R. Research progress of microplastics and attached organisms in marine environment [J]. Journal of East China Normal University (Natural Science), 2022(3): 1-7 (in Chinese)
[8] Short F T, Polidoro B, Livingstone S R, et al. Extinction risk assessment of the world’s seagrass species [J]. Biological Conservation, 2011, 144: 1961-1971
[9] Les D H, Cleland M A, Waycott M. Phylogenetic studies in Alismatidae Ⅱ. Evolution of marine angiosperms (seagrasses) and hydrophily [J]. Systematic Botany, 1997, 22: 443-463
[10] Short F, Carruthers T, Dennison W, et al. Global seagrass distribution and diversity: A bioregional model [J]. Journal of Experimental Marine Biology and Ecology, 2007, 350(1-2): 3-20
[11] Unsworth R K F, McKenzie L J, Collier C J, et al. Global challenges for seagrass conservation [J]. Ambio, 2019, 48(8): 801-815
[12] 郑凤英, 邱广龙, 范航清, 等. 中国海草的多样性、分布及保护[J]. 生物多样性, 2013, 21(5): 517-526
Zheng F Y, Qiu G L, Fan H Q, et al. Diversity, distribution and conservation of Chinese seagrass species [J]. Biodiversity Science, 2013, 21(5): 517-526 (in Chinese)
[13] Den H C, Yang Z D. A catalogue of the seagrasses of China [J]. Chinese Journal of Oceanology and Limnology, 1990, 8: 74-91
[14] 黄小平, 江志坚, 范航清, 等. 中国海草的“藻”名更改[J]. 海洋与湖沼, 2016, 47(1): 290-294
Huang X P, Jiang Z J, Fan H Q, et al. The nomenclature of the “algae” name of seagrasses in China [J]. Oceanologia et Limnologia Sinica, 2016, 47(1): 290-294 (in Chinese)
[15] 蔡泽富, 陈石泉, 吴钟解, 等. 海南岛海湾与潟湖中海草的分布差异及影响分析[J]. 海洋湖沼通报, 2017(3): 74-84
Cai Z F, Chen S Q, Wu Z J, et al. Distribution differences and environmental effects of seagrasses between bays and lagoons of Hainan Island [J]. Transactions of Oceanology and Limnology, 2017(3): 74-84 (in Chinese)
[16] Lamb J B, van de Water J A, Bourne D G, et al. Seagrass ecosystems reduce exposure to bacterial pathogens of humans, fishes, and invertebrates [J]. Science, 2017, 355(6326): 731-733
[17] Fourqurean J W, Duarte C M, Kennedy H, et al. Seagrass ecosystems as a globally significant carbon stock [J]. Nature Geoscience, 2012, 5(7): 505-509
[18] Macreadie P I, Baird M E, Trevathan-Tackett S M, et al. Quantifying and modelling the carbon sequestration capacity of seagrass meadows: A critical assessment [J]. Marine Pollution Bulletin, 2014, 83(2): 430-439
[19] Nordlund L M, Jackson E L, Nakaoka M, et al. Seagrass ecosystem services: What’s next? [J]. Marine Pollution Bulletin, 2018, 134: 145-151
[20] Orth R J, Carruthers T J B, Dennison W C, et al. A global crisis for seagrass ecosystems [J]. BioScience, 2006, 56(12): 987-996
[21] Waycott M, Duarte C M, Carruthers T J, et al. Accelerating loss of seagrasses across the globe threatens coastal ecosystems [J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(30): 12377-12381
[22] Yang D T, Yang C Y. Detection of seagrass distribution changes from 1991 to 2006 in Xincun Bay, Hainan, with satellite remote sensing [J]. Sensors, 2009, 9: 830-844
[23] 陈石泉, 王道儒, 吴钟解, 等. 海南岛东海岸海草床近10a变化趋势探讨[J]. 海洋环境科学, 2015, 34(1): 48-53
Chen S Q, Wang D R, Wu Z J, et al. Discussion of the change trend of the seagrass beds in the east coast of Hainan Island in nearly a decade [J]. Marine Environmental Science, 2015, 34(1): 48-53 (in Chinese)
[24] 王帅. 陵水新村潟湖及其周边生态系统微塑料分布特征与表面微生物膜的形成与演替[D]. 三亚: 海南热带海洋学院, 2022: 11
Wang S. Distribution of microplastics and its biofilm formation and succession characteristics in Xincun lagoon and surrounding ecosystems [D]. Sanya: Hainan Tropical Ocean College, 2022: 11 (in Chinese)
[25] 陈石泉, 吴钟解, 陈晓慧, 等. 海南岛南部海草资源分布现状调查分析[J]. 海洋学报, 2015, 37(6): 106-113
Chen S Q, Wu Z J, Chen X H, et al. Investigation and analysis of the distribution status of seagrass resources in the southern part of Hainan Island [J]. Acta Oceanologica Sinica, 2015, 37(6): 106-113 (in Chinese)
[26] Goss H, Jaskiel J, Rotjan R. Thalassia testudinum as a potential vector for incorporating microplastics into benthic marine food webs [J]. Marine Pollution Bulletin, 2018, 135: 1085-1089
[27] Jones K L, Hartl M G J, Bell M C, et al. Microplastic accumulation in a Zostera marina L. bed at Deerness Sound, Orkney, Scotland [J]. Marine Pollution Bulletin, 2020, 152: 110883
[28] Menicagli V, Balestri E, Vallerini F, et al. Plastics and sedimentation foster the spread of a non-native macroalga in seagrass meadows [J]. The Science of the Total Environment, 2021, 757: 143812
[29] Chae Y, An Y J. Effects of micro- and nanoplastics on aquatic ecosystems: Current research trends and perspectives [J]. Marine Pollution Bulletin, 2017, 124(2): 624-632
[30] de los Santos C B, Krång A S, Infantes E. Microplastic retention by marine vegetated canopies: Simulations with seagrass meadows in a hydraulic flume [J]. Environmental Pollution, 2021, 269: 116050
[31] Menicagli V, Castiglione M R, Balestri E, et al. Early evidence of the impacts of microplastic and nanoplastic pollution on the growth and physiology of the seagrass Cymodocea nodosa [J]. Science of the Total Environment, 2022, 838: 156514
[32] Zhao L C, Ru S G, He J L, et al. Eelgrass (Zostera marina) and its epiphytic bacteria facilitate the sinking of microplastics in the seawater [J]. Environmental Pollution, 2022, 292: 118337
[33] Huang Y Z, Xiao X, Xu C C, et al. Seagrass beds acting as a trap of microplastics: Emerging hotspot in the coastal region? [J]. Environmental Pollution, 2020, 257: 113450
[34] Zhao S Y, Danley M, Ward J E, et al. An approach for extraction, characterization and quantitation of microplastic in natural marine snow using Raman microscopy [J]. Analytical Methods, 2017, 9(9): 1470-1478
[35] Coppock R L, Cole M, Lindeque P K, et al. A small-scale, portable method for extracting microplastics from marine sediments [J]. Environmental Pollution, 2017, 230: 829-837
[36] Unsworth R K F, Higgs A, Walter B, et al. Canopy accumulation: Are seagrass meadows a sink of microplastics? [J]. Oceans, 2021, 2(1): 162-178
[37] Sridhar A, Kannan D, Kapoor A, et al. Extraction and detection methods of microplastics in food and marine systems: A critical review [J]. Chemosphere, 2022, 286(Pt 1): 131653
[38] Nuelle M T, Dekiff J H, Remy D, et al. A new analytical approach for monitoring microplastics in marine sediments [J]. Environmental Pollution, 2014, 184: 161-169
[39] Imhof H K, Schmid J, Niessner R, et al. A novel, highly efficient method for the separation and quantification of plastic particles in sediments of aquatic environments [J]. Limnology and Oceanography: Methods, 2012, 10(7): 524-537
[40] Claessens M, van Cauwenberghe L, Vandegehuchte M B, et al. New techniques for the detection of microplastics in sediments and field collected organisms [J]. Marine Pollution Bulletin, 2013, 70(1-2): 227-233
[41] Nguyen B, Claveau-Mallet D, Hernandez L M, et al. Separation and analysis of microplastics and nanoplastics in complex environmental samples [J]. Accounts of Chemical Research, 2019, 52(4): 858-866
[42] Imhof H K, Laforsch C, Wiesheu A C, et al. Pigments and plastic in limnetic ecosystems: A qualitative and quantitative study on microparticles of different size classes [J]. Water Research, 2016, 98: 64-74
[43] La Nasa J, Biale G, Fabbri D, et al. A review on challenges and developments of analytical pyrolysis and other thermoanalytical techniques for the quali-quantitative determination of microplastics [J]. Journal of Analytical and Applied Pyrolysis, 2020, 149: 104841
[44] Fendall L S, Sewell M A. Contributing to marine pollution by washing your face: Microplastics in facial cleansers [J]. Marine Pollution Bulletin, 2009, 58(8): 1225-1228
[45] Hinojosa I A, Thiel M. Floating marine debris in fjords, gulfs and channels of southern Chile [J]. Marine Pollution Bulletin, 2009, 58(3): 341-350
[46] 王江涛, 赵婷, 谭丽菊, 等. 海洋微塑料来源、分布及生态效应研究进展[J]. 海洋科学, 2020, 44(7): 79-85
Wang J T, Zhao T, Tan L J, et al. Research progress in sources, distributions, and ecological effects of marine microplastics [J]. Marine Sciences, 2020, 44(7): 79-85 (in Chinese)
[47] Eriksen M, Lebreton L C M, Carson H S, et al. Plastic pollution in the world’s oceans: More than 5 trillion plastic pieces weighing over 250, 000 tons afloat at sea [J]. PLoS One, 2014, 9(12): e111913
[48] Thompson R, Moore C, Andrady A, et al. New directions in plastic debris [J]. Science, 2005, 310(5751): 1117
[49] Cozzolino L, Nicastro K R, Zardi G I, et al. Species-specific plastic accumulation in the sediment and canopy of coastal vegetated habitats [J]. Science of the Total Environment, 2020, 723: 138018
[50] Dahl M, Bergman S, Björk M, et al. A temporal record of microplastic pollution in Mediterranean seagrass soils [J]. Environmental Pollution, 2021, 273: 116451
[51] Ramili Y, Umasangaji H. An assessment of microplastics (MPs) sedimentary accumulation in seagrass meadows of mare island conservation area, North Maluku, Indonesia [J]. Omni-Akuatika, 2022, 18(S1): 48
[52] Kreitsberg R, Raudna-Kristoffersen M, Heinlaan M, et al. Seagrass beds reveal high abundance of microplastic in sediments: A case study in the Baltic Sea [J]. Marine Pollution Bulletin, 2021, 168: 112417
[53] Plee T A, Pomory C M. Microplastics in sandy environments in the Florida Keys and the panhandle of Florida, and the ingestion by sea cucumbers (Echinodermata: Holothuroidea) and sand dollars (Echinodermata: Echinoidea) [J]. Marine Pollution Bulletin, 2020, 158: 111437
[54] Hartline N L, Bruce N J, Karba S N, et al. Microfiber masses recovered from conventional machine washing of new or aged garments [J]. Environmental Science &Technology, 2016, 50(21): 11532-11538
[55] Gerstenbacher C M, Finzi A C, Rotjan R D, et al. A review of microplastic impacts on seagrasses, epiphytes, and associated sediment communities [J]. Environmental Pollution, 2022, 303: 119108
[56] Seeley M E, Song B, Passie R, et al. Microplastics affect sedimentary microbial communities and nitrogen cycling [J]. Nature Communications, 2020, 11: 2372
[57] van Cauwenberghe L, Devriese L, Galgani F, et al. Microplastics in sediments: A review of techniques, occurrence and effects [J]. Marine Environmental Research, 2015, 111: 5-17
[58] 张辉, 彭宇琼, 邹贤妮, 等. 南亚热带特大型水库浮游植物群落特征及其与环境因子的关系:以新丰江水库为例[J]. 湖泊科学, 2022, 34(2): 404-417
Zhang H, Peng Y Q, Zou X N, et al. The characteristics of phytoplankton community structure and its relationship with environmental factors of a large reservoir in subtropic of Southern China: A case study of Xinfengjiang Reservoir [J]. Journal of Lake Sciences, 2022, 34(2): 404-417 (in Chinese)
[59] Wu Y M, Guo P Y, Zhang X Y, et al. Effect of microplastics exposure on the photosynthesis system of freshwater algae [J]. Journal of Hazardous Materials, 2019, 374: 219-227
[60] Buwono N R, Risjani Y, Soegianto A. Spatio-temporal patterns of occurrence of microplastics in the freshwater fish Gambusia affinis from the Brantas River, Indonesia [J]. Environmental Pollution, 2022, 311: 119958
[61] Chagnon C, Thiel M, Antunes J, et al. Plastic ingestion and trophic transfer between Easter Island flying fish (Cheilopogon rapanouiensis) and yellowfin tuna (Thunnus albacares) from Rapa Nui (Easter Island) [J]. Environmental Pollution, 2018, 243: 127-133
[62] Foekema E M, De Gruijter C, Mergia M T, et al. Plastic in north sea fish [J]. Environmental Science &Technology, 2013, 47(15): 8818-8824
[63] Suhrhoff T J, Scholz-Böttcher B M. Qualitative impact of salinity, UV radiation and turbulence on leaching of organic plastic additives from four common plastics: A lab experiment [J]. Marine Pollution Bulletin, 2016, 102(1): 84-94
[64] Luo H W, Liu C Y, He D Q, et al. Effects of aging on environmental behavior of plastic additives: Migration, leaching, and ecotoxicity [J]. The Science of the Total Environment, 2022, 849: 157951
[65] 刘强, 徐旭丹, 黄伟, 等. 海洋微塑料污染的生态效应研究进展[J]. 生态学报, 2017, 37(22): 7397-7409
Liu Q, Xu X D, Huang W, et al. Research advances on the ecological effects of microplastic pollution in the marine environment [J]. Acta Ecologica Sinica, 2017, 37(22): 7397-7409 (in Chinese)
[66] 孙晓霞. 海洋微塑料生态风险研究进展与展望[J]. 地球科学进展, 2016, 31(6): 560-566
Sun X X. Progress and prospect on the study of the ecological risk of microplastics in the ocean [J]. Advances in Earth Science, 2016, 31(6): 560-566 (in Chinese)
[67] 杨秉倬, 黄河. 微塑料对红鲫鱼幼鱼抗氧化酶系统的影响[J]. 环境科学与技术, 2019, 42(12): 23-27
Yang B Z, Huang H. Effect of microplastics on antioxidant enzyme system in juvenile red crucian carp [J]. Environmental Science &Technology, 2019, 42(12): 23-27 (in Chinese)
[68] Ferreira G V B, Barletta M, Lima A R A. Use of estuarine resources by top predator fishes. How do ecological patterns affect rates of contamination by microplastics? [J]. The Science of the Total Environment, 2019, 655: 292-304