随着塑料制品的大量使用,微纳塑料污染问题逐渐成为人们重视的焦点。微纳塑料是一类直径小于5 mm的塑料颗粒,一般根据其来源,可分为初生微塑料和次生微塑料。初生微塑料是指生产的直径小于5 mm并直接释放到环境中的塑料。次生微塑料是通过物理、化学和生物等多种方式,使大体积的塑料降解、破碎形成的微塑料颗粒[1]。这些微塑料可以通过风、河流、地下径流和渗透等运输途径在土壤、大气和水环境中迁移,目前已经在室内空气、南极、北冰洋和马里亚纳海沟等地方都检测到了微塑料的存在[2]。环境中的微纳塑料能够通过消化道摄入、呼吸道吸入和皮肤直接接触等多种途径进入人体,并对人体造成潜在的健康威胁[3]。目前已在母乳[4]、肺部组织[5]和精液[6]等生物介质中检测到微纳塑料的存在。进入人体后,微纳塑料高表面积的特点可能会导致氧化应激和细胞毒性[7],而微纳塑料难以降解的特点又限制了它的排出,最终导致慢性炎症的发生[8]。此外,微纳塑料还可能导致免疫和神经退行性疾病发病率的增加[9]。
目前研究报道的微纳塑料检测主要手段包括热分析法和光谱分析法[10]。其中热分析法是破坏性方法,通过破坏微纳塑料检测样品,且不能提供有关微纳塑料数量和大小的相关信息[11]。光谱分析法主要包括傅里叶变换红外光谱法和拉曼光谱法,其中傅里叶变换红外光谱法不能识别尺寸小于20 μm的微纳塑料颗粒。
而拉曼光谱法是根据光的非弹性散射形成的光谱,可以通过分析散射光谱,获得分子运动的信息,从而获得材料的结构信息。但是该方法容易受到荧光干扰的影响,影响微纳塑料的识别,且灵敏度不高,难以实现痕量水平的化学和生物分析[12]。本课题将使用表面增强拉曼光谱法,它是在拉曼光谱技术上发展起来的一种新型分析手段,这种技术主要利用粗糙贵金属表面来吸附被测物质,使待测物质拉曼信号急剧增强,从而提高痕量污染物甚至是单分子的灵敏度[13]。表面增强拉曼光谱因为其灵敏度高、检测速度快、样品需求量少、无损、抑制荧光背景、数据处理简单和独特的指纹图谱特性等优点,很好地弥补了传统的微塑料检测方法的缺点,在检测微纳塑料方面展现出良好的应用前景。
金(Au)和银(Ag)作为粗糙贵金属都具有良好的增强拉曼活性。因为电磁波可以激发Au、Ag的表面等离子体共振(surface plasmon resonance, SPR),使得Au和Ag表面的电场强度显著增强,因此靠近金属的分子受到电场增强的影响,拉曼信号也急剧增强。其中Ag基纳米材料的增强能力最强[14]。目前有研究表明,Ag与Au所合成的纳米异质结构由于有电子补偿现象,因此表面均匀,且稳定性较好,更适用于微纳塑料检测方面的表面增强拉曼光谱应用[15]。因此本实验采用Au @Ag NPs作为SERS基底。
Xu等[16]考虑到微纳塑料的疏水问题,将金纳米颗粒(Au NPs)掺杂滤纸作为柔性SERS基底,可有效在纤维孔隙中捕获微纳塑料,并成功在自来水和池塘水中检测到了微纳塑料,证明了SERS检测微塑料的可行性。Jeon等[17]用再生纤维素(RC)和金纳米棒(Au NRs)和银纳米线(Ag NWs)通过简单的真空辅助过滤方法构建SERS基底,进行快速微纳塑料检测。Ag NWs网络结构致密,活性更好,同时Ag NWs/RC薄膜可以检测低至0.1 mg·mL-1的微塑料。Lê等[18]将银金纳米星插入阳极氧化铝纳米孔中,以此作为表面增强拉曼光谱衬底,成功从水中检测到0.4 μm的微纳塑料颗粒。SERS弥补了传统的微纳塑料检测方法繁琐,样品预处理程序繁杂,灵敏度低等缺点,在检测微纳塑料方面具有巨大的发展空间。
值得注意的是,目前大部分研究都聚焦于环境样品中的微纳塑料的检测,忽略了微纳塑料进入体内后器官暴露水平的检测,缺少人体摄入情况的相关研究,而肝脏血供丰富又是人体最大的解毒器官,微纳塑料会大量富集在肝脏内。所以本实验将使用SERS检测肝组织内微纳塑料的暴露情况,对微塑料颗粒污染的人类健康风险评估提供数据,为推出相应的公共卫生政策提供理论依据,为确定微纳塑料对人体的危害和公共卫生风险提供坚实的基础。
1 材料与方法(Materials and methods)
1.1 试剂
主要试剂信息见表1,所有试剂均为分析纯。
1.2 仪器
主要仪器信息见表2。
1.3 SERS检测条件
本实验中的拉曼光谱数据采集均使用实验室配置的拉曼光谱仪进行检测。该拉曼光谱仪的最大激光功率为275 mW,激光波长为785 nm,光斑直径约为105 μm。实验中一般将最大激发功率的30%设置为实验激发功率,积分时间设置为10 s。在检测过程中,每个样品随机选择5个区域进行拉曼信号采集,并计算5次测量结果的平均值和标准差作为拉曼光谱数据。
1.4 实验动物
所有与本课题有关的动物实验均已获得首都医科大学实验动物福利与伦理委员会的批准。本实验采用清洁级C57BL/6雄性小鼠,6~8周龄,体质量24~30 g,环境温度为21~25 ℃,湿度为50%左右。在整个研究进程中,小鼠可自由进食标准小鼠生长饲料。小鼠自由饮食饮水,适应环境一周后再进行随机分组和实验。
1.5 Au NPs的制备
本实验采用改进的Frens法进行Au NPs的制备。采用柠檬酸钠为还原剂,还原氯金酸溶液制备粒径大小约为30 nm的Au NPs。具体操作步骤如下。(1)1%氯金酸溶液制备:称量2 g四水合氯金酸粉末,溶于200 mL去离子水,放入棕色细口试剂瓶中,避光保存备用。(2)1%柠檬酸钠溶液制备:称量1 g柠檬酸三钠固体粉末,溶于100 mL去离子水中,放入棕色细口试剂瓶中,避光保存备用。(3)取200 mL的锥形瓶,先用去离子水清洗3遍,再加入干净的磁力搅拌子,用去离子水清洗2遍。(4)量取150 mL去离子水,加入锥形瓶中,先向锥形瓶中加入1.5 mL 1%的氯金酸溶液,混合均匀,再放到搅拌器上加热。(5)溶液沸腾后,开启搅拌,转速为600 r·min-1,一次性加入2.25 mL 1%的柠檬酸钠溶液,持续搅拌15 min。(6)反应结束后,溶液呈红色。停止加热,持续搅拌至室温,即可得到粒径约为25 nm的Au NPs。
表1 主要实验试剂
Table 1 Main experimental reagents

试剂Reagent纯度Purity生产厂家Manufacturer单分散聚苯乙烯微球 Monodisperse polystyrene microspheres-天津倍思乐Beisile, Tianjin 四水合氯金酸 Chloroauric acid hydrated≥99.8%国药集团 Sinopharm柠檬酸钠 Sodium citrate≥99%国药集团 Sinopharm硝酸银Silver nitrate≥99.8%国药集团 Sinopharm单晶硅片Monocrystalline silicon wafer-浙江立晶 Lijing, Zhejiang磷酸盐缓冲液 Phosphate buffer-北京索莱宝Solarbio, Beijing
表2 主要实验仪器
Table 2 Main experimental instruments
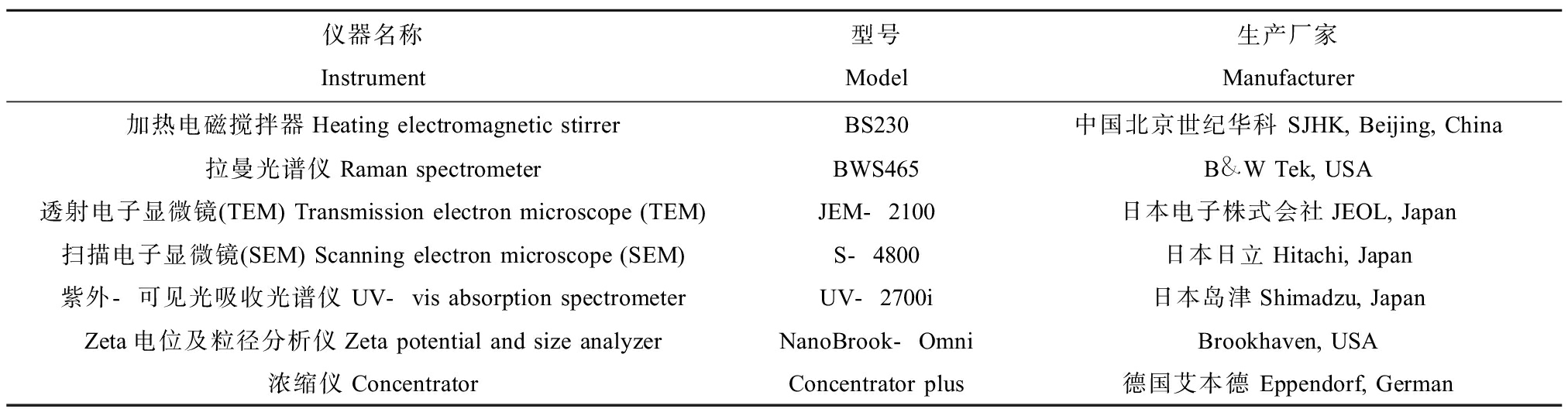
仪器名称Instrument型号Model生产厂家Manufacturer加热电磁搅拌器Heating electromagnetic stirrerBS230中国北京世纪华科 SJHK, Beijing, China拉曼光谱仪Raman spectrometerBWS465B&W Tek, USA透射电子显微镜(TEM) Transmission electron microscope (TEM)JEM-2100日本电子株式会社JEOL, Japan扫描电子显微镜(SEM) Scanning electron microscope (SEM)S-4800日本日立Hitachi, Japan紫外-可见光吸收光谱仪 UV-vis absorption spectrometerUV-2700i日本岛津Shimadzu, JapanZeta电位及粒径分析仪Zeta potential and size analyzerNanoBrook-OmniBrookhaven, USA浓缩仪ConcentratorConcentrator plus德国艾本德 Eppendorf, German
1.6 Au @Ag NPs的制备
采用柠檬酸钠还原法,还原硝酸银,在胶体金纳米粒子表面上包裹银层,得到粒径大小约为30 nm的Au @Ag NPs。具体操作步骤如下。(1)硝酸银溶液的制备:称取2.25 mg硝酸银固体粉末溶于1 mL去离子水中,获得硝酸银溶液。(2)取200 mL的锥形瓶,先用去离子水清洗3遍,再加入干净的磁力搅拌子,再用去离子水清洗2遍。(3)取75 mL上述制备的25 nm Au NPs于锥形瓶中,液体定容至150 mL。(4)向锥形瓶中加入1.5 mL 1%柠檬酸钠溶液后,将其放到搅拌器上,加热至沸腾后再开启搅拌。(5)向步骤4溶液中快速滴加1 mL硝酸银溶液,加热搅拌20 min,充分反应后,关闭加热,继续搅拌至室温,即可完成银层生长,得到粒径大小约为30 nm的Au @Ag NPs。(6)取出7 500 r·min-1条件下离心6 min,弃去上清,使用30 μL去离子水重悬备用。
1.7 Au @Ag NPs的物理化学性质表征
将制备完成的Au NPs、Au @Ag NPs使用去离子水稀释10倍,混匀后超声处理10 s,使用Zeta电位及粒径分析仪表征Au @Ag NPs粒径及Zeta电位变化,使用紫外-可见光吸收光谱仪记录Au NPs、Au @Ag NPs的主要吸收峰。将Au @Ag NPs使用无水乙醇溶液稀释200倍,混匀后超声处理,取1 μL溶液滴加于碳支持膜上,晾干后用于透射电子显微镜观察Au @Ag NPs形态。
1.8 拉曼光谱对微塑料的检测应用
配制不同浓度聚苯乙烯微塑料标准品溶液,将微塑料标准品浓度稀释为10~0.1 mg·mL-1,分别滴加在硅片上,干燥后使用拉曼光谱仪检测并收集微塑料标准品的拉曼光谱信号。
1.9 金核银壳SERS基底对微塑料的检测应用
配制不同浓度聚苯乙烯微塑料标准品溶液,将浓度稀释为5~0.05 mg·mL-1。将95 μL不同浓度的微塑料标准品溶液分别与5 μL Au @Ag NPs溶液充分震荡混匀。然后分别滴加在硅片上,干燥后使用拉曼光谱仪检测并收集微塑料标准品的SERS信号。
1.10 建立小鼠微塑料急性暴露模型
将雄性C57BL/6小鼠随机分为2组,分别为对照组和微塑料染毒组,每组3只。对照组尾静脉注射PBS缓冲液,微塑料染毒组按照25 mg·mL-1的浓度通过尾静脉注射微塑料标准品溶液200 μL。每隔2 d染毒一次,共染毒5次。
1.11 小鼠肝脏样本前处理
通过注射1%的戊巴比妥钠200 μL将小鼠麻醉,用眼科镊摘取小鼠眼球,收集全血于抗凝采血管中。小鼠处死后进行解剖,在冰面上迅速取出肝脏,进行肝脏内微塑料浓度的研究。
在电子天平上精确称量肝脏质量,取0.5 g肝脏组织放入1.5 mL离心管中,加入1 mL水和不锈钢研磨珠。再放入组织匀浆机中设定强度为70 Hz,研磨200 s。研磨完成后,吸取组织匀浆至100目滤网中进行过滤。取1 mL滤液于1.5 mL离心管中,再将离心管放入氮吹仪中,在60 ℃条件下氮吹浓缩4 h,得到小鼠肝脏样本粉末。
1.12 金核银壳SERS基底对小鼠肝脏内微塑料的检测应用
将前处理完成后的小鼠肝脏样本溶于500 μL去离子水中,充分混匀,再将小鼠肝脏样本溶液5 μL与20 μL Au @Ag NPs溶液充分震荡混匀(稀释5倍)。然后滴加在硅片上,干燥后使用拉曼光谱仪检测并收集微塑料标准品的SERS信号。
2 结果(Results)
2.1 微塑料颗粒透射电子显微镜和粒径表征
本实验采用的微塑料标准品是单分散聚苯乙烯微球,粒径为1 000 nm,浓度为2.5%(m/V)。从透射电子显微镜(TEM)结果可以看出,微塑料颗粒分散性良好且尺寸均匀(图1(a))。微塑料颗粒的粒径统计柱状图如图1(b)所示,表明微塑料颗粒平均粒径为 870.66 nm。
2.2 Au @Ag材料的粒径表征
Au @Ag采用柠檬酸钠还原法制备,首先使用柠檬酸钠还原氯金酸溶液制备Au NPs作为核心,随后使用柠檬酸钠溶液还原硝酸银,在Au纳米种子表面上沉积银层,形成均匀包裹的银壳。通过粒径表征Au NPs和Au @Ag NPs。其中Au NPs粒径分布均匀,平均粒径约为(20.51±0.09) nm(图2(a))。Au纳米种子表面均匀包裹的银壳形成后,Au @Ag NPs平均粒径增加到(24.27±0.19) nm(图2(b)),得到粒径分布较为均匀的Au @Ag纳米材料。
2.3 Au @Ag材料的TEM、紫外-可见吸收光谱和Zeta电位表征
通过TEM表征得到的Au @Ag纳米材料,由图3(a)可知所制备的30 nm Au @Ag NPs形貌大小均一且分散性良好。
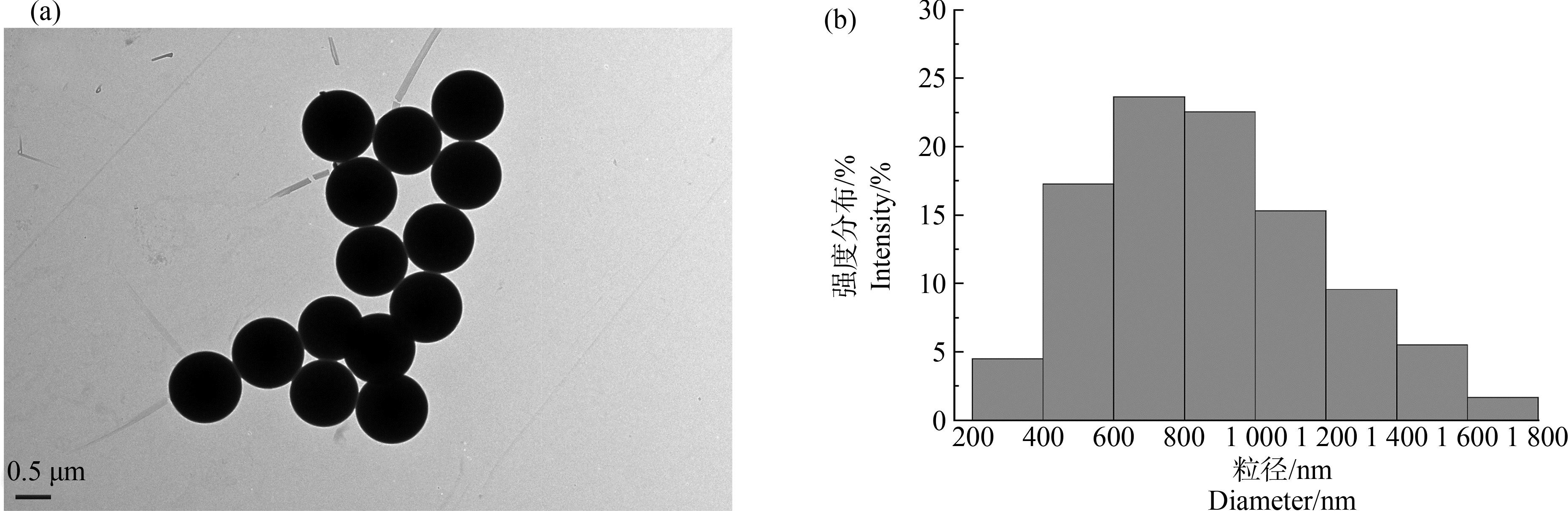
图1 微塑料的TEM图(a)和粒径统计柱状图(b)
Fig. 1 TEM image (a) and grain size distribution (b) of microplastics
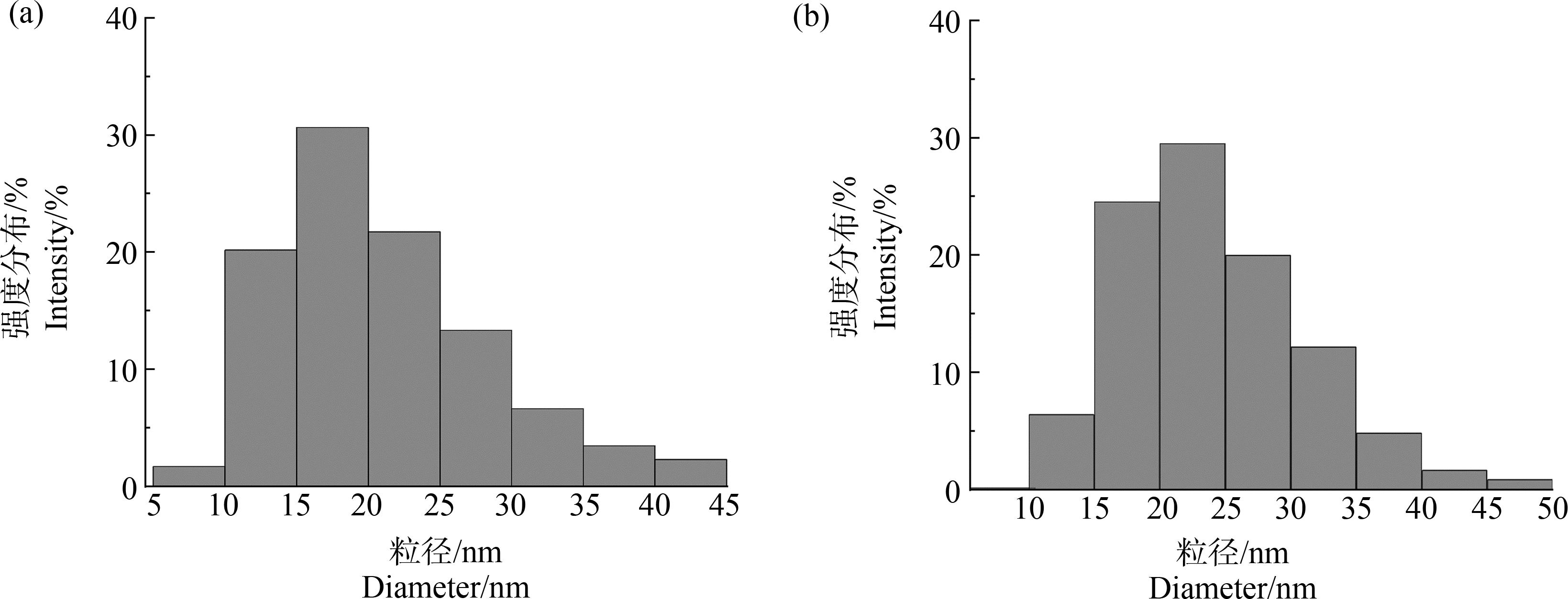
图2 Au NPs (a)和Au @Ag NPs (b)的粒径统计柱状图
Fig. 2 Grain size distribution of Au NPs (a) and Au @Ag NPs (b)
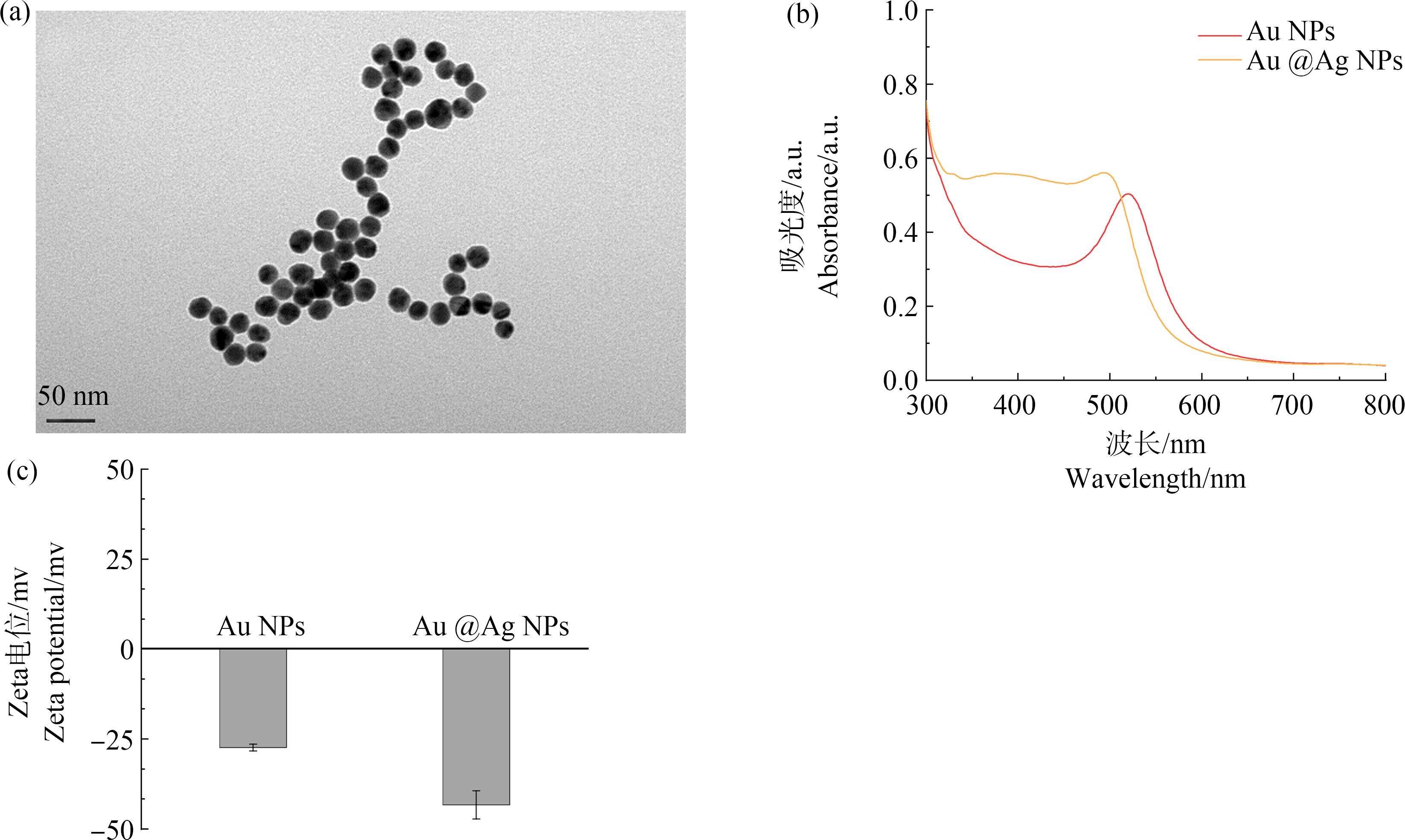
图3 Au @Ag NPs的TEM图 (a),Au NPs和Au @Ag NPs的紫外-可见光吸收光谱 (b)和Zeta电位值 (c)
Fig. 3 TEM image (a) of Au @Ag NPs, UV-vis spectrum (b) and Zeta potential (c) of Au NPs and Au @Ag NPs
使用紫外-可见吸收光谱对所制备的Au @Ag NPs进行检测。金属纳米颗粒的等离子共振峰与纳米材料的尺寸大小、形貌及元素组成密切相关。如图3(b)所示,Au NPs的光谱结果基本与文献报道结果[19]一致。随着银层在Au纳米种子表面沉积,紫外-可见吸收光谱峰明显蓝移,谱带强度增加,且Au @Ag NPs具有双峰的吸收性质,证明金银复合纳米颗粒的形成。
通过测量Au @Ag制备过程中各阶段产物的Zeta电位,辅助证明各阶段产物是否成功制备。如图3(c)所示,Au NPs的Zeta电位大约为(-27.3±0.96) mV,随着银壳在Au纳米表面形成,Au @Ag NPs的Zeta电位降为(-43.3±3.94) mV。
2.4 拉曼光谱对微塑料标准品的检测结果
本实验对微塑料标准品进行梯度稀释,制备了一系列微塑料标准品溶液(浓度范围为10~0.1 mg·mL-1)。分别滴加到硅片上,干燥后进行拉曼光谱检测,结果如图4(a)所示。微塑料的拉曼光谱特征峰与文献所报道的数据[20]基本相符,位于1 004 cm-1的特征峰在0.25 mg·mL-1以上都清晰可见。对每个样品进行5组检测,然后对拉曼位移1 004 cm-1的特征峰强度和微塑料标准品浓度的关系进行统计分析,得到拉曼光谱微塑料检测标准曲线(如图4(b)),线性回归方程是:
y=161.98+329.64x
线性相关系数(r2)是0.981。这些结果表明,1 004 cm-1处的拉曼光谱强度与微塑料标准品浓度呈现良好的线性关系。
2.5 金核银壳SERS基底对微塑料标准品的检测结果
本实验对微塑料标准品进行梯度稀释,制备了一系列微塑料标准品溶液(浓度范围为5~0.05 mg·mL-1),向梯度稀释微塑料标准品溶液中加入离心浓缩后的Au @Ag NPs,并充分混合,混合均匀后,分别滴加到硅片上,干燥后使用拉曼光谱仪进行检测,采用最大激发功率的30%。积分时间为10 000 ms。对每个样品进行5组检测,记录并保存数据。
所得结果如图5(a)所示,微塑料的拉曼光谱特征峰与文献所报道的数据[20]基本相符,微塑料特征峰处的拉曼位移为1 004 cm-1。微塑料浓度从5 mg·mL-1至0.05 mg·mL-1,所有特征峰的强度都有所提高。根据微塑料在拉曼位移1 004 cm-1处的峰强度与微塑料溶液浓度拟合曲线,得到SERS微塑料检测标准曲线(如图5(b)),拟合方程为:
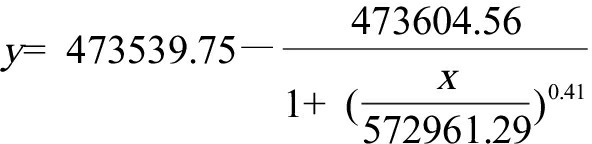
线性相关系数(r2)是0.992。将空白组拉曼强度值加3倍的标准差带回拟合方程,计算得到Au @Ag NPs检测微塑料的检测限为0.0175 mg·mL-1。由实验结果可知,该方法制备的Au @Ag NPs增强效果较好,Au @Ag NPs可作为SERS基底用于微塑料的检测。
2.6 金核银壳SERS基底对小鼠肝脏内微塑料浓度的检测结果
肝脏内微塑料浓度的检测结果如图6所示,微塑料的拉曼光谱特征峰与文献所报道的数据[20]基本相符,拉曼位移1 004 cm-1处可见微塑料特征峰,将微塑料在拉曼位移1 004 cm-1处峰强度的平均值732.3283代入SERS微塑料检测标准曲线,计算得出待测样品中的微塑料浓度为0.0987 mg·mL-1,由于在样品检测过程中加入Au @Ag NPs导致样品稀释5倍,所以肝组织悬液内微塑料浓度为0.493 mg·mL-1。检测前0.5 g肝脏样品经前处理后复溶于500 μL去离子水,由此可计算出肝组织内的微塑料质量浓度为0.493 mg·g-1。因此,以Au @Ag NPs为基底的SERS可以成功对微塑料肝脏内暴露情况进行检测。
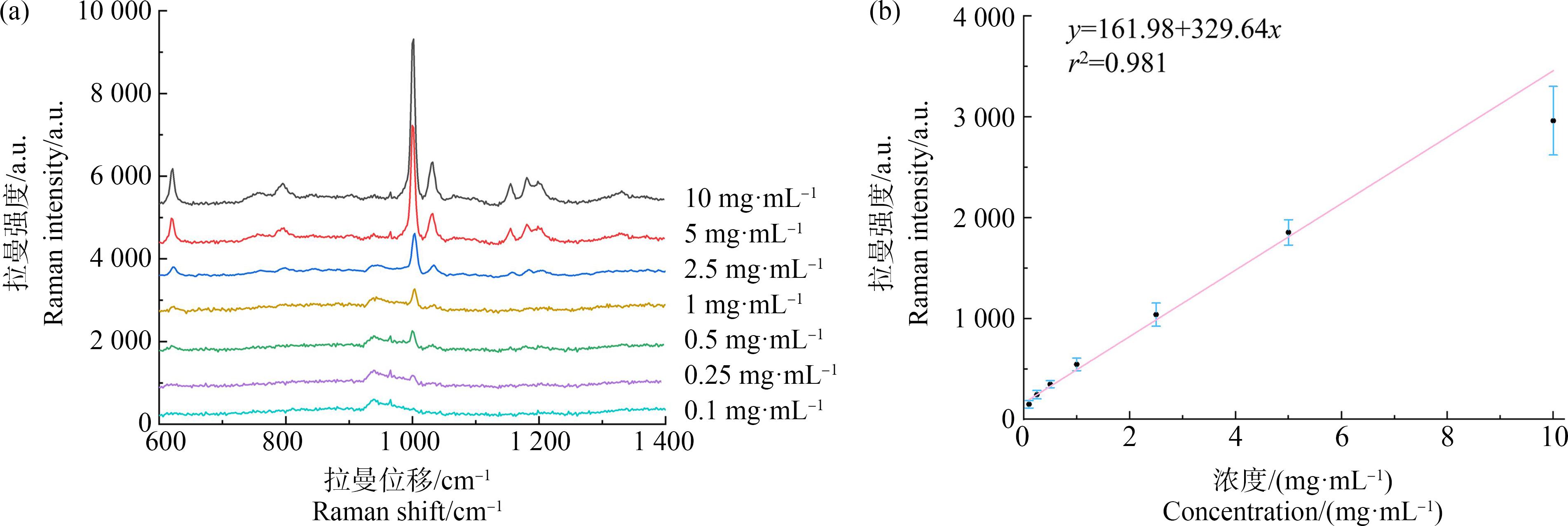
图4 拉曼光谱检测微塑料标准品的光谱(a)及标准曲线(b)
Fig. 4 Raman spectrum (a) and standard curve (b) of microplastics at different concentrations
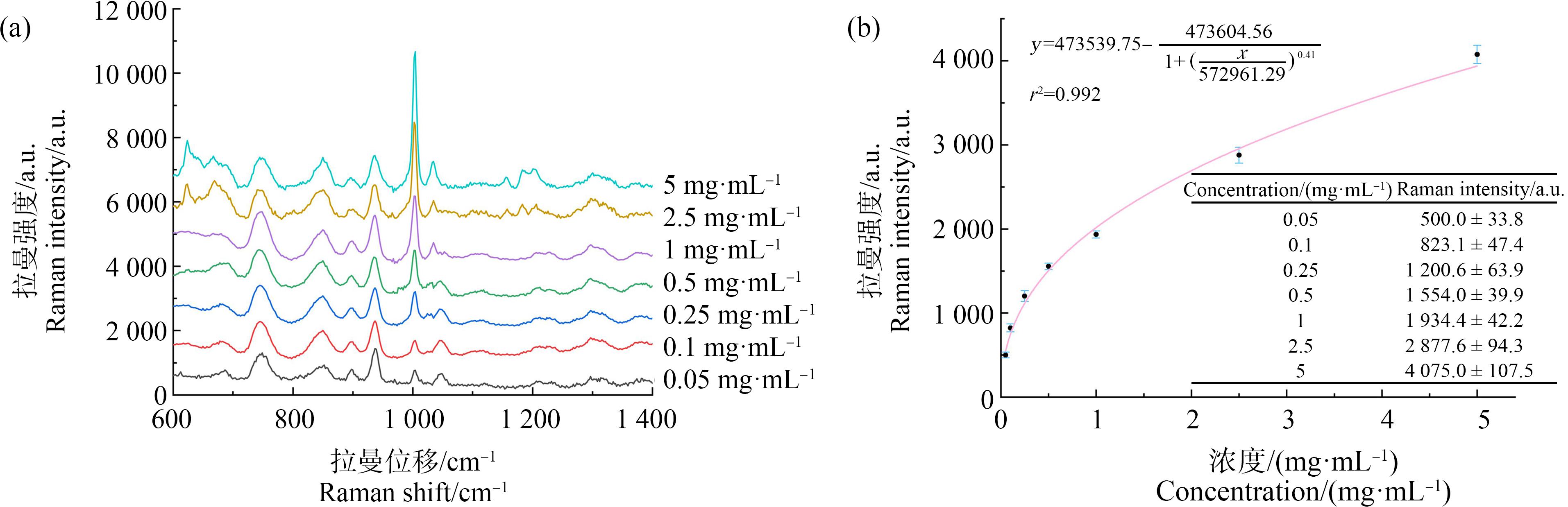
图5 表面增强拉曼光谱(SERS)检测微塑料标准品的光谱(a)及标准曲线(b)
Fig. 5 Surface-enhanced Raman spectroscopy (SERS) spectrum (a) and standard curve (b) of microplastics at different concentrations with Au @Ag NPs
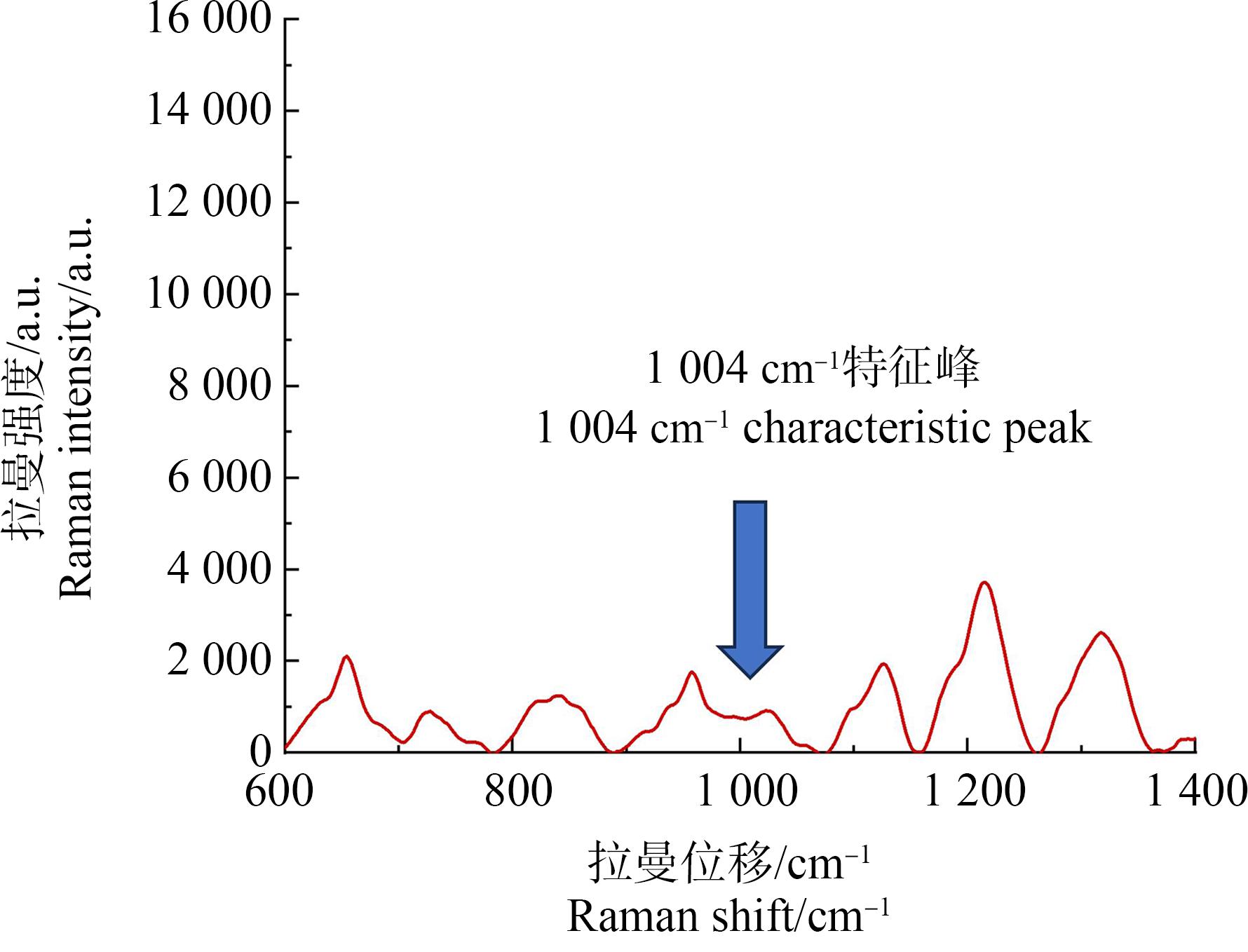
图6 小鼠肝组织悬液的拉曼光谱图
Fig. 6 Raman spectrum of mouse liver spectrum
3 讨论(Discussion)
传统微纳塑料检测方法通常存在样品预处理程序繁琐,检测时间长,不能定量分析等缺点,Lv等[21]通过一种以银胶体为活性底物的SERS方法,克服了液体中微纳塑料检测的局限性,在水环境样本中可以检测到浓度低至40 μg·mL-1的微纳塑料。在本实验中,以Au @Ag NPs作为SERS基底的微纳塑料检测方法,微纳塑料检测限低至17.5 μg·mL-1,优于前述检测方法,可见Au @Ag NPs大大增强了微纳塑料的拉曼信号,使其灵敏度得到大幅度提高。同时,本实验也对较小粒径(80 nm)的聚苯乙烯微塑料标准品溶液进行了拉曼和SERS检测,但是在拉曼位移1 004 cm-1处的拉曼信号的特征峰较弱,说明本检测方法尚存在一定的缺限,对于粒径较小的微纳塑料灵敏度仍然不高。Hu等[22]对SERS进行了改进,将碘化钾(KI)作为混凝剂和清洁剂,去除Ag NPs表面的杂质,成功检测到50 nm的微纳塑料。因此,在后续实验中,也可增加混凝剂和清洁剂前处理步骤,提高对小粒径微纳塑料颗粒检测的灵敏度。
目前大部分研究都以检测环境中的微纳塑料为重点,仅有少数研究关注微纳塑料肝脏内暴露的研究,且这些方法也存在局限性。Schwabl等[23]通过傅里叶变换红外(FT-IR)显微光谱法,分析了8名健康志愿者体内粪便样本,结果发现8份粪便样本的微纳塑料检测均呈阳性,共检测到9种塑料类型,尺寸在500 nm~10 μm之间。但是FT-IR显微光谱法存在一些无法避免的问题,其中包括样品的化学预处理步骤会降解微纳塑料并降低其回收率,且样品制备后残留的固体可能会掩盖FT-IR图像分析过程中的颗粒。本研究建立的检测方法减少了过度的前处理步骤,极大地避免检测过程中微纳塑料颗粒的损失。另外,Huang等[24]通过激光红外成像光谱仪和FT-IR显微光谱法分析了22份痰液样本中的微塑料,发现所有痰液样本中都存在微纳塑料,共检测出微纳塑料21种,大多数微纳塑料粒径小于500 μm。但是这种研究方法只能提供微纳塑料的丰度数据,不能对微塑料进行定量分析,且FT-IR显微光谱法灵敏度较低,无法对粒径小于20 μm的微纳塑料进行检测。Leslie等[25]通过热分解气相色谱-质谱联用法(Pyr-GC/MS)对400份血液样本进行了分析,其中77%的血液样本中存在塑料颗粒,血液中塑料颗粒的总和可量化浓度的平均值为1.6 μg·mL-1,粒径范围在700~500 000 nm之间。但是Pyr-GC/MS是热分析方法,这种方法会破坏微纳塑料检测样品,且前处理步骤复杂。Ragusa等[26]用拉曼显微光谱法对人胎盘中的微纳塑料进行了检测,在4个胎盘中发现了12个微塑料碎片,粒径大小5~10 μm不等。虽然该研究采用了拉曼分析法,但是没有对其微纳塑料内暴露情况进行定量分析,且检测到的微纳塑料最小粒径仅为5 μm。
综上所述,目前已报道的微纳塑料体内暴露检测方法都有各自的局限性,很难精确评估各器官微塑料暴露水平并进行定量分析。本实验则通过构建小鼠微塑料急性暴露模型,经过短时间的急性暴露后,取其肝脏制备组织悬液并进行检测,得到肝组织悬液微塑料浓度为0.493 mg·mL-1。再根据肝脏组织质量和检测溶液体积,计算出肝组织内的微塑料质量浓度为0.493 mg·g-1。从实验结果可以看出,SESRS能够精确定量肝脏微塑料的浓度,且样品前处理步骤简单,同时还避免了传统检测方法灵敏度和准确性较低的缺点,实现微塑料肝脏暴露水平的精确定量分析,为之后人体内的微纳塑料摄入情况的研究提供了新的思路和方法,且为微纳塑料对人体危害的研究提供技术支持。
[1] Gong J, Xie P. Research progress in sources, analytical methods, eco-environmental effects, and control measures of microplastics [J]. Chemosphere, 2020, 254: 126790
[2] Gan Q, Cui J W, Jin B. Environmental microplastics: Classification, sources, fates, and effects on plants [J]. Chemosphere, 2023, 313: 137559
[3] Lett Z, Hall A, Skidmore S, et al. Environmental microplastic and nanoplastic: Exposure routes and effects on coagulation and the cardiovascular system [J]. Environmental Pollution, 2021, 291: 118190
[4] Liu S J, Guo J L, Liu X Y, et al. Detection of various microplastics in placentas, meconium, infant feces, breastmilk and infant formula: A pilot prospective study [J]. The Science of the Total Environment, 2023, 854: 158699
[5] Jenner L C, Rotchell J M, Bennett R T, et al. Detection of microplastics in human lung tissue using μFTIR spectroscopy [J]. Science of the Total Environment, 2022, 831: 154907
[6] Zhao Q C, Zhu L, Weng J M, et al. Detection and characterization of microplastics in the human testis and semen [J]. The Science of the Total Environment, 2023, 877: 162713
[7] Danopoulos E, Twiddy M, West R, et al. A rapid review and meta-regression analyses of the toxicological impacts of microplastic exposure in human cells [J]. Journal of Hazardous Materials, 2022, 427: 127861
[8] Kumar R, Manna C, Padha S, et al. Micro(nano)plastics pollution and human health: How plastics can induce carcinogenesis to humans? [J]. Chemosphere, 2022, 298: 134267
[9] Prata J C, da Costa J P, Lopes I, et al. Environmental exposure to microplastics: An overview on possible human health effects [J]. The Science of the Total Environment, 2020, 702: 134455
[10] Sridhar A, Kannan D, Kapoor A, et al. Extraction and detection methods of microplastics in food and marine systems: A critical review [J]. Chemosphere, 2022, 286(Pt 1): 131653
[11] 范玉梅, 石佳颖, 高李璟. 土壤中微塑料的来源及检测[J]. 化工时刊, 2019, 33(6): 28-31
Fan Y M, Shi J Y, Gao L J. The source and detection of microplastics in soil systems [J]. Chemical Industry Times, 2019, 33(6): 28-31 (in Chinese)
[12] Yusuf A, Sodiq A, Giwa A, et al. Updated review on microplastics in water, their occurrence, detection, measurement, environmental pollution, and the need for regulatory standards [J]. Environmental Pollution, 2022, 292(Pt B): 118421
[13] Zhou X, Hu Z W, Yang D T, et al. Bacteria detection: From powerful SERS to its advanced compatible techniques [J]. Advanced Science, 2020, 7(23): 2001739
[14] Bi L Y, Wang X, Cao X W, et al. SERS-active Au@Ag core-shell nanorod (Au@AgNR) tags for ultrasensitive bacteria detection and antibiotic-susceptibility testing [J]. Talanta, 2020, 220: 121397
[15] 冯艳林, 王建霖, 宁鑫, 等. 金核/银壳纳米棒用于癌细胞的表面增强拉曼散射成像及肿瘤活体光谱检测[J]. 分析化学, 2022, 50(8): 1196-1204
Feng Y L, Wang J L, Ning X, et al. Au@Ag core-shell nanorods for surface enhanced Raman scattering imaging of cancer cells and in vivo cancer spectroscopic detection [J]. Chinese Journal of Analytical Chemistry, 2022, 50(8): 1196-1204 (in Chinese)
[16] Xu D W, Su W, Lu H W, et al. A gold nanoparticle doped flexible substrate for microplastics SERS detection [J]. Physical Chemistry Chemical Physics, 2022, 24(19): 12036-12042
[17] Jeon Y, Kim D, Kwon G, et al. Detection of nanoplastics based on surface-enhanced Raman scattering with silver nanowire arrays on regenerated cellulose films [J]. Carbohydrate Polymers, 2021, 272: 118470
[18] Lê Q T, Ly N H, Kim M K, et al. Nanostructured Raman substrates for the sensitive detection of submicrometer-sized plastic pollutants in water [J]. Journal of Hazardous Materials, 2021, 402: 123499
[19] 胡均鹏, 陈荣桥, 梁明, 等. 基于Au@Ag纳米粒子的表面增强拉曼光谱技术测定苹果和梨中的福美双[J]. 食品安全质量检测学报, 2022, 13(2): 366-372
Hu J P, Chen R Q, Liang M, et al. Determination of thiram in apples and pears by surface enhanced Raman spectroscopy based on Au@Ag nanoparticles [J]. Journal of Food Safety &Quality, 2022, 13(2): 366-372 (in Chinese)
[20] Xie L F, Gong K D, Liu Y Y, et al. Strategies and challenges of identifying nanoplastics in environment by surface-enhanced Raman spectroscopy [J]. Environmental Science &Technology, 2023, 57(1): 25-43
[21] Lv L L, He L, Jiang S Q, et al. In situ surface-enhanced Raman spectroscopy for detecting microplastics and nanoplastics in aquatic environments [J]. The Science of the Total Environment, 2020, 728: 138449
[22] Hu R, Zhang K N, Wang W, et al. Quantitative and sensitive analysis of polystyrene nanoplastics down to 50 nm by surface-enhanced Raman spectroscopy in water [J]. Journal of Hazardous Materials, 2022, 429: 128388
[23] Schwabl P, Köppel S, Königshofer P, et al. Detection of various microplastics in human stool: A prospective case series [J]. Annals of Internal Medicine, 2019, 171(7): 453-457
[24] Huang S M, Huang X X, Bi R, et al. Detection and analysis of microplastics in human sputum [J]. Environmental Science &Technology, 2022, 56(4): 2476-2486
[25] Leslie H A, van Velzen M J M, Brandsma S H, et al. Discovery and quantification of plastic particle pollution in human blood [J]. Environment International, 2022, 163: 107199
[26] Ragusa A, Svelato A, Santacroce C, et al. Plasticenta: First evidence of microplastics in human placenta [J]. Environment International, 2021, 146: 106274