拟除虫菊酯类农药(pyrethroid insecticides, PYRs)是一类模拟天然除虫菊素由人工合成的杀虫剂,主要用于农作物的害虫防治和室内除虫等卫生杀虫领域,占据着中国乃至全球杀虫剂市场的重要位置[1]。目前,发现PYRs在蔬菜、水果、茶叶等食物中普遍残留,在土壤和水体中也频繁检出[2]。PYRs可通过饮食摄入、呼吸、皮肤接触等途径进入人体,其中饮食是最主要的方式[3-4]。氯氰菊酯(cypermethrin, CP)是环境中检出率最高的PYRs之一[5]。一项关于浙江省农药残留情况的研究显示,通过对17种蔬菜的农药残留检测,人体每日摄入CP约为6.7 μg·kg-1[6]。随着使用量的增加,PYRs在环境及农产品中的残留问题日趋严重,使人群普遍受到PYRs的暴露,对生态环境和人类健康造成严重危害,其在生殖[7]、免疫[8]、神经毒性效应[9]等方面的潜在健康风险也受到广泛关注。
大量人群研究和动物实验均显示PYRs会影响雄性的生殖功能,降低精子质量[10-11]。已有研究表明PYRs作为内分泌干扰物(endocrine disrupting chemicals, EDCs)具有类雌激素效应和抗雄激素效应,作用于下丘脑-垂体-性腺轴(hypothalamus-pituitary-gonadal axis, HPG轴),导致体内激素稳态失衡,包括促性腺激素释放激素(gonadotropin releasing hormone, GnRH)、黄体生成素(luteinizing hormone, LH)、卵泡刺激素(follicle stimulating hormone, FSH)和性腺类固醇激素(如睾酮)[12]。近年来,母代暴露于环境污染物对子代的影响逐渐引起重视,研究报道哺乳期母鼠接触CP对断乳期雄性子代小鼠生殖内分泌有明显损害作用[13],围产期CP暴露会阻碍子代类固醇和配子形成以及导致精子表观基因异常[14]。我们之前的研究显示围产期低剂量CP暴露可诱导雌性子代小鼠青春期提前,增加相关激素的分泌[15],但目前关于围产期低剂量CP对子代雄性小鼠青春期影响的研究仍然十分匮乏,同时现有研究的剂量远高于人体日常暴露水平。另外,孕期和哺乳期PYRs暴露会对F1代雄性生殖系统造成损伤,诱导氧化损伤也可能是PYRs产生生殖毒性的重要机制之一[11]。脑组织是机体氧化代谢最活跃的器官,对脂质过氧化高度敏感,研究发现CP灌胃染毒使小鼠脑组织丙二醛(malondialdehyde, MDA)含量上升,谷胱甘肽过氧化物酶、总超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶活性和总抗氧化能力下降,表明PYRs可引起脑组织的脂质过氧化并降低其抗氧化能力[16-17]。
基于此,本研究拟通过小鼠孕期和哺乳期6.7、20和60 μg·kg-1·d-1 CP暴露,测定F1代雄性小鼠青春期启动日龄,并进一步探讨对子代小鼠下丘脑-垂体-睾丸轴(hypothalamus-pituitary-testis axis, HPT轴)相关基因、激素水平的影响,以及低浓度CP对下丘脑和睾丸外植体的氧化损伤,以期为进一步探索PYRs跨代生殖毒性提供科学依据和理论基础。
1 材料与方法(Materials and methods)
1.1 主要仪器与试剂
Epoch 2微孔板分光光度计(美国Bio-Tek);NanoDrop One超微量紫外分光光度计(美国Thermo Fisher);7500实时荧光定量PCR仪(美国Thermo Fisher);2720基因扩增仪(美国Applied Biosystems)。
氯氰菊酯(纯度≥99%)、无水氯化镁购于中国上海阿拉丁生化科技股份有限公司;小鼠促卵泡素酶联免疫分析试剂盒、小鼠黄体生成素酶联免疫分析试剂盒、小鼠促性腺激素释放激素酶联免疫分析试剂盒、小鼠睾酮酶联免疫分析试剂盒购于中国江苏酶免实业有限公司;RNA快速提取试剂盒购于中国上海奕杉生物科技有限公司;BeyoRTTM Ⅱ cDNA合成试剂盒(with gDNA Eraser)、Western及IP细胞裂解液、一氧化氮检测试剂盒、总谷胱甘肽检测试剂盒、总SOD活性检测试剂盒(WST-8法)、脂质氧化(MDA)检测试剂盒购于中国上海碧云天生物技术有限公司;PowerUpTM SYBRTM Green Master Mix购于美国Thermo Fisher;GAPDH、GnRH、转移抑制因子(kisspeptins-1, KISS-1)基因、促性腺激素α亚基(chorionic gonadotropin α subunit, CGα)基因、LHβ、FSH、类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein, StAR)基因、细胞色素P450(cytochrome p450 family 11 subfamily a polypeptide 1, CYP11A1)基因引物,D-葡萄糖,甘氨酸购于中国生工生物工程(上海)股份有限公司;二甲基亚砜(DMSO)购于中国威达优尔贸易(上海)有限公司;MEM培养基购于HyClone;DMEM/F12培养基购于Gibco;青霉素-链霉素溶液购于Biosharp;L-抗坏血酸购于Sigma-Aldrich。
1.2 实验动物及染毒方法
选用购于上海市计划生育科学研究所实验动物经营部(动物合格证号:SCXK(沪)2018-0006)的健康成年ICR小鼠雄性8只、雌性16只。动物房采用空调和自动排风装置保持通风,温度(23±1) ℃,湿度40%~70%,光暗周期为12 h,小鼠自由饮水和摄食,标准颗粒饲料喂饲。所有的动物饲养程序均得到了浙江中医药大学动物保护和使用委员会的批准。
24只ICR小鼠适应性培养一周后,以一雄二雌合笼饲养。将怀孕小鼠随机分为4组,从妊娠(gestational day, GD)第6天到产后(postnatal day, PND)第21天每天上午08:00—11:00接受溶解在玉米油中剂量为6.7、20和60 μg·kg-1·d-1 CP灌胃暴露。6.7 μg·kg-1·d-1为浙江省成人通过饮食暴露CP每日摄入量,20 μg·kg-1·d-1为WHO推荐每日允许摄入量,60 μg·kg-1·d-1为美国环境保护局(United States Environmental Protection Agency, US EPA)推荐的参考剂量。每组出生的子代雄性小鼠于PND22被随机分为2组,一组当日收集血清和下丘脑、垂体、睾丸组织分别用于激素和基因的测定,另一组每天上午08:00—11:00开始观察包皮是否分离,以确定小鼠的青春期启动日龄。
1.3 子代雄性小鼠HPT轴相关激素检测
对PND22子代雄性小鼠进行眼球采血,血样置于4 ℃冰箱保存30 min后取出,以3 000 r·min-1离心10 min,取上清液得到血清。根据试剂盒说明进行GnRH、FSH、LH和睾酮激素测定。
1.4 子代雄性小鼠HPT轴相关基因检测
根据RNA快速提取试剂盒说明书分别提取PND22子代雄性小鼠下丘脑、垂体和睾丸组织总RNA。用超微量紫外可见分光光度计对其浓度和纯度进行测定,保证其OD260/OD280在1.90~2.2之间,浓度不低于30 ng·μL-1。按试剂盒说明书合成cDNA,进行实时定量PCR(RT-PCR)反应。RT-PCR体系包括2 μL cDNA,10 μL SYBRG Master Mix,基因上下游引物各0.5 μL(浓度为10 μmol·L-1),7 μL ddH2O。引物由上海生工生物工程技术服务有限公司合成,RT-PCR引物序列见表1。使用7500 RT-PCR系统测定,每个基因的相对定量用2-ΔΔCT计算得到,并用内基因GAPDH进行标准化。
表1 RT-PCR引物
Table 1 RT-PCR primers

引物名称Primer name碱基序列(5’~3’)Primer sequence (5’~3’)GAPDHForward: CATCACTGCCACCCAGAAGACTReverse: GACACATTGGGGGTAGGAACACCYP11A1Forward: AATGCTGTCTACCAGATGTTCCReverse: TCGCTTCTGCCTTAAGTCCGnRHForward: TGATCCTCAAACTGATGGReverse: GTACATTCGAAGTGCTGGKISS-1Forward: CTGGTGCAGCGGGAGAAGReverse: GCGCAGGCCGAAGGACGαForward: TCTGGTCATGCTGTCCATGTReverse: GATATGCCCTGGAGAAGCAALHβForward: ATCACCTTCACCACCAGCATReverse: GACCCCCACAGTCAGAGCTAFSHβForward: GAAGAGTGCCGTTTCTGCATReverse: GTGCTGTCGCTGTCACACTTStARForward: AGAGGTGGCTATGCAGAAGGReverse: TCTGCAGGACCTTGATCTCC
1.5 雄性小鼠下丘脑和睾丸组织氧化应激指标的检测
PND21 ICR雄性小鼠脱颈处死后取下丘脑和睾丸组织,随机分为对照组0.1%(V∶V)DMSO和3个CP组(浓度为6.7、20和60 μg·L-1),分别暴露于120 μL含特定浓度CP的培养液(表2)[18]。外植体于5% CO2培养箱孵育24 h后,收集组织,样品可置于-80 ℃冰箱保存备用。根据试剂盒说明书用Western及IP细胞裂解液裂解组织样品,再进行NO含量、总谷胱甘肽(glutathione, GSH)含量、SOD酶活性和MDA含量检测。
1.6 实验动物及染毒方法
采用SPSS 22.0软件对各组数据进行统计学分析。实验结果以平均值±标准误(mean±SEM)表示。CP暴露组与对照组之间的差异采用单因素方差分析(One-Way ANOVA)。当P<0.05(图中用*表示)、P<0.01(图中用**表示)、P<0.001(图中用***表示)时差异具有统计学意义。
2 结果(Results)
2.1 环境剂量CP暴露对子代雄性小鼠青春期启动日龄的影响
将母鼠孕期和哺乳期暴露于6.7、20和60 μg·kg-1·d-1 CP,以生殖器官包皮分离(preputial separation, PPS)作为青春期启动标志,观察F1代雄性小鼠青春期启动日龄,并计算每日PPS%。实验结果如图1所示,各组子代雄性小鼠青春期启动平均日龄均有一定程度下降,与对照组相比,60 μg·kg-1·d-1组青春期启动平均日龄下降约1.7 d(P<0.01)。在PND28时60 μg·kg-1·d-1组所有子代雄性小鼠均已包皮分离,而对照组PPS%只有50%。另外,和对照组相比,20 μg·kg-1·d-1和60 μg·kg-1·d-1组的PPS日龄没有显著下降,对照组的青春期开始平均日龄与6.7 μg·kg-1·d-1组相差约0.8 d,与20 μg·kg-1·d-1组的平均日龄相差0.4 d左右。这说明孕期和哺乳期60 μg·kg-1·d-1 CP会显著诱导子代雄性小鼠青春期启动提前。
2.2 环境剂量CP暴露对子代雄性小鼠HPT轴的影响
将母鼠孕期和哺乳期暴露于6.7、20和60 μg·kg-1·d-1 CP,采集PND22子代雄性小鼠下丘脑、垂体和睾丸组织及血清,测定组织中相关基因的表达水平和血清中相关激素的含量,实验结果如图2~4所示。在下丘脑中,与对照组相比,CP组子代雄性小鼠血清中GnRH含量升高(图2(a)),其中20 μg·kg-1·d-1组有显著差异(P<0.05)。GnRH表达水平随着CP暴露剂量的增加均显著升高(P<0.001),且显示出剂量效应关系(图2(b))。而KISS-1表达水平随着CP暴露剂量的增加呈现下降趋势(图2(c)),与对照组相比,20 μg·kg-1·d-1和60 μg·kg-1·d-1组KISS-1表达水平显著降低(P<0.05)。
表2 培养基及试剂配比
Table 2 The mediums and reagent formula

组织Tissue培养基Medium试剂配比Reagent ratio下丘脑Hypothalamus最低必需培养基(MEM)Minimum essential media (MEM)MEM、25 mmol·L-1 D-葡萄糖、1 mmol·L-1 MgCl2、10 mmol·L-1甘氨酸、1%(V∶V)青霉素-链霉素溶液MEM, 25 mmol·L-1 D-glucose, 1 mmol·L-1 MgCl2,10 mmol·L-1 glycine, 1%(V∶V) penicillin-streptomycin solution睾丸Testis杜氏改良Eagle培养基/F12培养基(DMEM/F12)Dulbecco’s modified Eagle medium/nutrient mixture F-12 (DMEM/F12)DMEM/F12、284 mmol·L-1抗坏血酸、1%(V∶V)青霉素-链霉素溶液DMEM/F12, 284 mmol·L-1 L-ascorbic acid, 1%(V∶V) penicillin-streptomycin solution
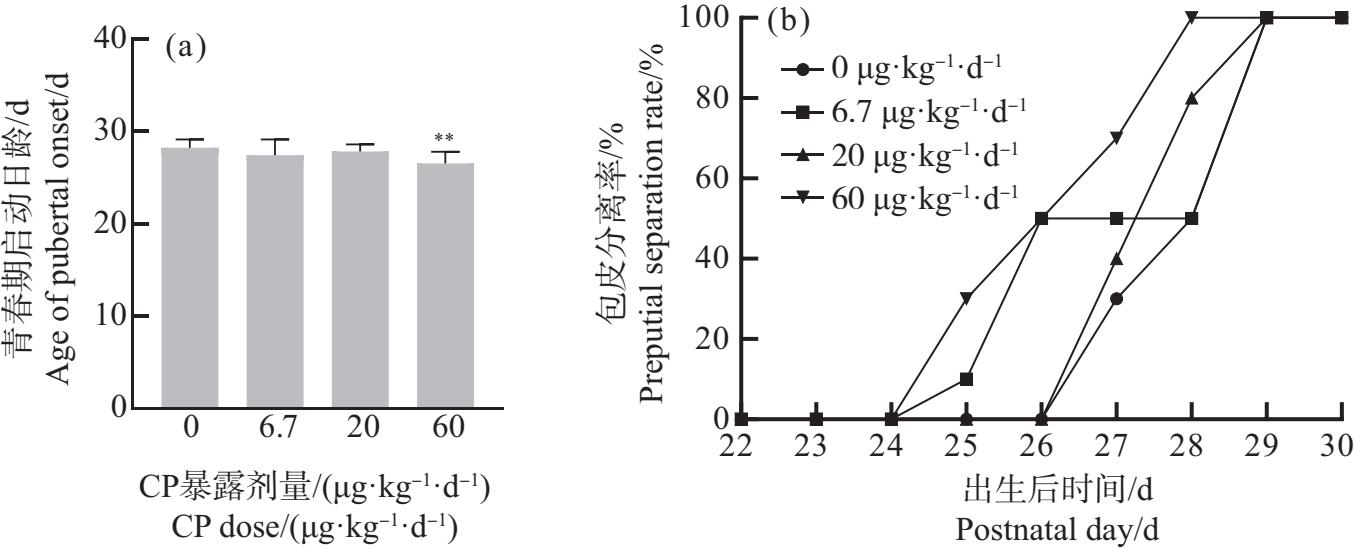
图1 孕期和哺乳期环境剂量氯氰菊酯(CP)暴露对子代雄性小鼠青春期启动日龄(a)和包皮分离率(b)的影响
注:**表示P<0.01。
Fig. 1 Effects of exposure to cypermethrin (CP) under environmental doses during pregnancy and lactation on puberty onset age (a) and preputial separation rate (b) in offspring male mice
Note: **represents P<0.01.
在垂体中,CP诱导子代雄性小鼠LH和FSH分泌升高(图3(a)~(b)),与对照组相比,60 μg·kg-1·d-1组LH水平显著升高(P<0.05)。6.7 μg·kg-1·d-1 CP均显著提高(P<0.01或P<0.001)促性腺激素亚单位基因(LHβ、FSHβ和CGα)的表达水平(图3(c)~(e)),20 μg·kg-1·d-1和60 μg·kg-1·d-1 CP暴露时,FSHβ表达水平显著上升(P<0.01或P<0.001),而CGα表达水平显著下降(P<0.05)。
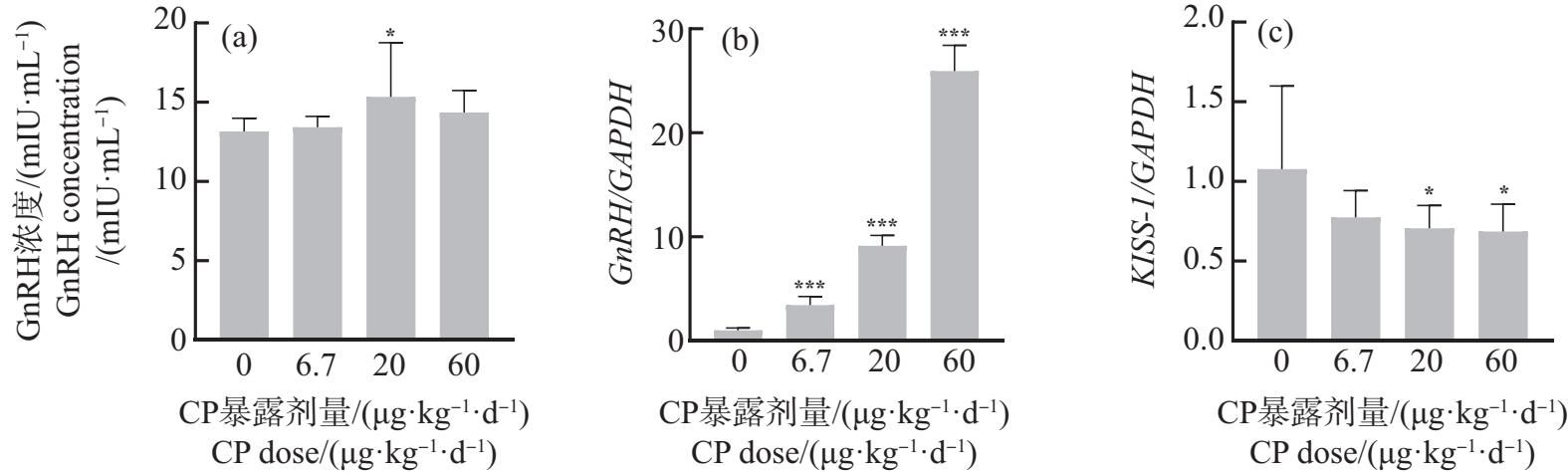
图2 孕期和哺乳期环境剂量CP暴露对子代雄性小鼠下丘脑的影响
注:*表示P<0.05,***表示P<0.001;GnRH表示促性腺激素释放激素基因,KISS-1表示转移抑制基因。
Fig. 2 Effects of CP exposure under environmental dose during pregnancy and lactation on hypothalamus of offspring male mice
Note: *represents P<0.05, ***represents P<0.001; GnRH stands for gonadotropin releasing hormone gene, KISS-1 stands for kisspeptins-1 gene.
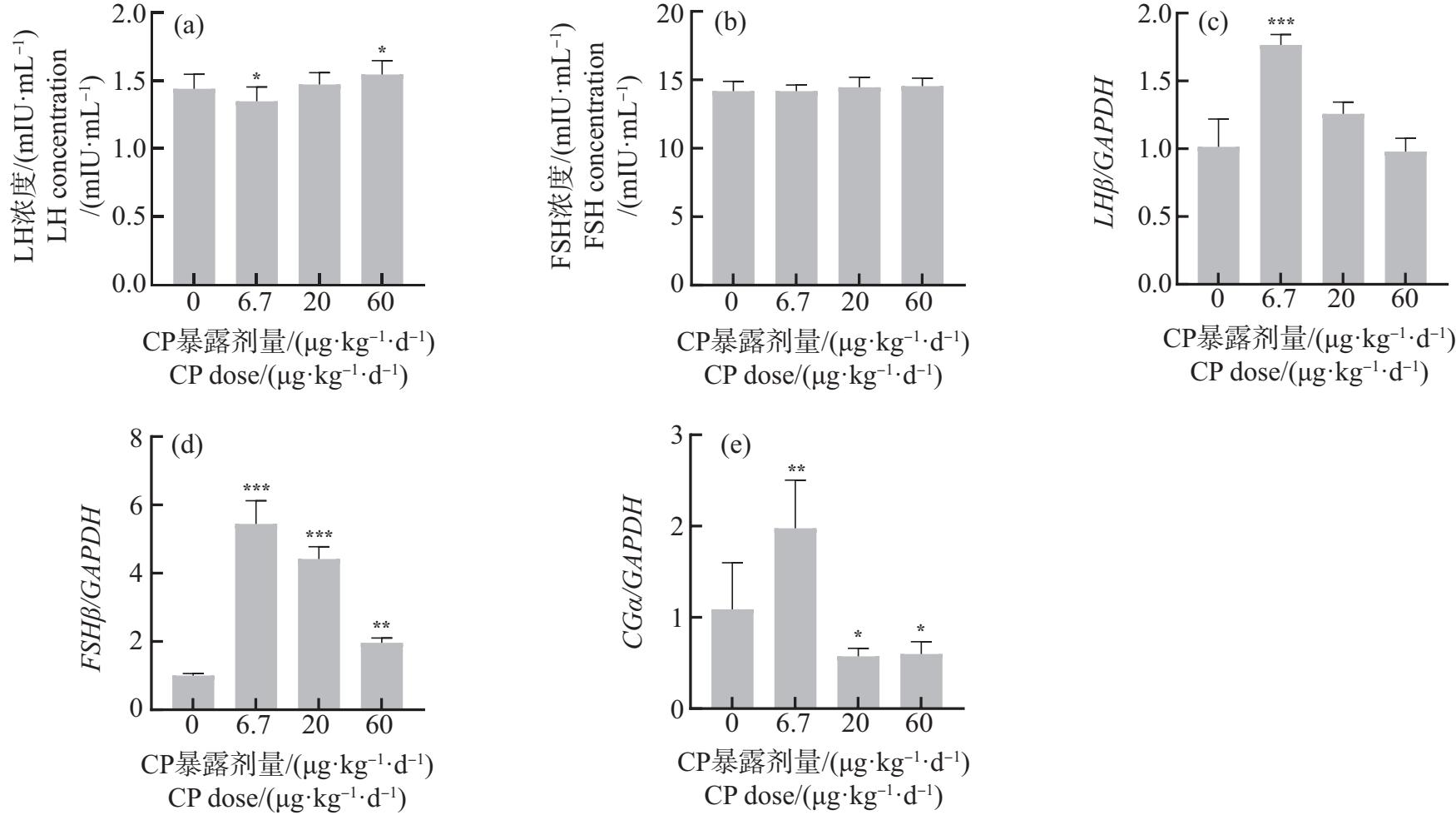
图3 孕期和哺乳期环境剂量CP暴露对子代雄性小鼠垂体的影响
注:*表示P<0.05,**表示P<0.01,***表示P<0.001;LH表示黄体生成素基因,FSH表示卵泡刺激素基因, CGα表示人类绒毛膜促性腺激素α亚基基因。
Fig. 3 Effects of CP exposure under environmental doses during pregnancy and lactation on pituitary of offspring male mice
Note: *represents P<0.05, **represents P<0.01, ***represents P<0.001; LH stands for luteinizing hormone gene, FSH stands for follicle stimulating hormone gene, and CGα stands for chorionic gonadotropin α gene.
在睾丸中,与对照组相比,60 μg·kg-1·d-1 CP显著诱导睾酮分泌和CYP11A1表达(P<0.05或P<0.01)(图4(a)和4(c))。CP总体上诱导StAR表达(图4(b)),其中20 μg·kg-1·d-1 CP提高StAR表达,且有显著性差异(P<0.05)。
2.3 低浓度CP对小鼠睾丸、下丘脑组织氧化应激水平的影响
将PND21 ICR小鼠睾丸、下丘脑外植体暴露于6.7、20和60 μg·L-1 CP 24 h,低浓度CP体外短时间暴露对小鼠睾丸、下丘脑组织氧化应激水平的影响如图5~6所示。在睾丸外植体中,与对照组相比,在20~60 μg·L-1 CP暴露下GSH含量显著降低(P<0.01或P<0.001),CP组GSH含量下降呈剂量效应关系(图5(a));总SOD活性和MDA含量在6.7 μg·L-1和60 μg·L-1 CP暴露下显著升高(P<0.05或P<0.01)(图5(b)~(c));CP组NO含量均显著升高(P<0.001)(图5(d))。在下丘脑外植体中,与对照组相比,CP组GSH含量均显著降低(P<0.001)(图6(a));总SOD活性在60 μg·L-1时显著降低(P<0.05)(图6(b));MDA含量在6.7~20 μg·L-1 CP暴露下降低,在60 μg·L-1时升高(P<0.05或P<0.001)(图6(c)),而NO含量无显著变化(图6(d))。这说明环境浓度(特别是60 μg·L-1)CP能在较短时间内诱导小鼠睾丸发生脂质过氧化。
3 讨论(Discussion)
EDCs是引起全球广泛关注的问题,并且在产前器官和神经系统形成和产后早期发育过程中可能具有潜在的巨大风险[19]。青春期作为儿童生长发育的关键时期,EDCs也会对其产生复杂的影响。据笔者所知,本研究首次报告了孕期和哺乳期暴露于环境剂量CP会提前子代雄性小鼠进入青春期的时间,这与之前的研究结果一致,即PND7~PND21雄性小鼠暴露于0.5~50 μg·kg-1·d-1 CP后青春期启动提前,并且在人群试验中CP暴露与青春期男孩促性腺激素浓度升高和青春期发动时相的提前显著相关[20]。然而,Singh等[21]却发现围产期暴露于1 mg·kg-1·d-1和25 mg·kg-1·d-1 CP会推迟子代雄性大鼠睾丸下垂和包皮分离的日龄。相反的实验结果可能与被试动物类别不同,或本研究暴露剂量较低等因素有关。例如,在母体邻苯二甲酸二正丁酯(dibutyl phthalate, DBP)暴露对子代雄性青春期启动影响的研究中,50~500 mg·kg-1·d-1 DBP暴露加速子代雄性小鼠青春期的启动,然而100 mg·kg-1·d-1 DBP暴露会导致子代雄性大鼠PPS延迟[22-23]。另外也有研究发现,青春期前小鼠睾丸对DBP的敏感度比大鼠更高[24]。
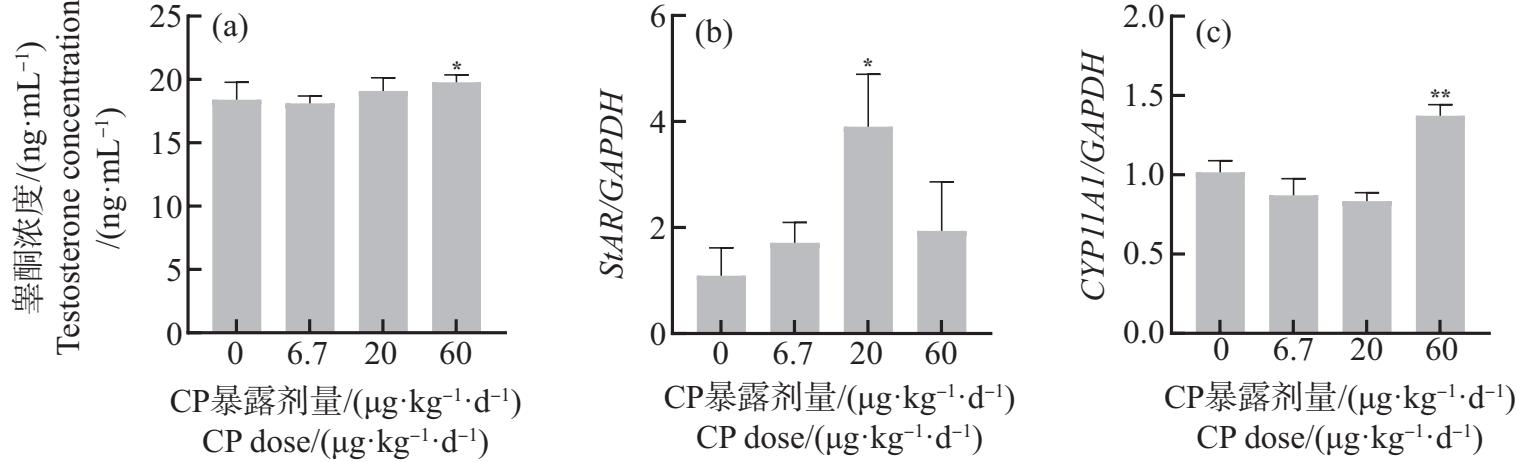
图4 孕期和哺乳期环境剂量CP暴露对子代雄性小鼠睾丸的影响
注:*表示P<0.05,**表示P<0.01;StAR表示类固醇激素合成急性调节蛋白基因,CYP11A1表示细胞色素P450基因。
Fig. 4 The effects of CP exposure under environmental doses during pregnancy and lactation on testis of offspring male mice
Note: *represents P<0.05, **represents P<0.01; StAR stands for steroidogenic acute regulatory protein gene, and CYP11A1 stands for cytochrome P450 family 11 subfamily A polypeptide 1 gene.
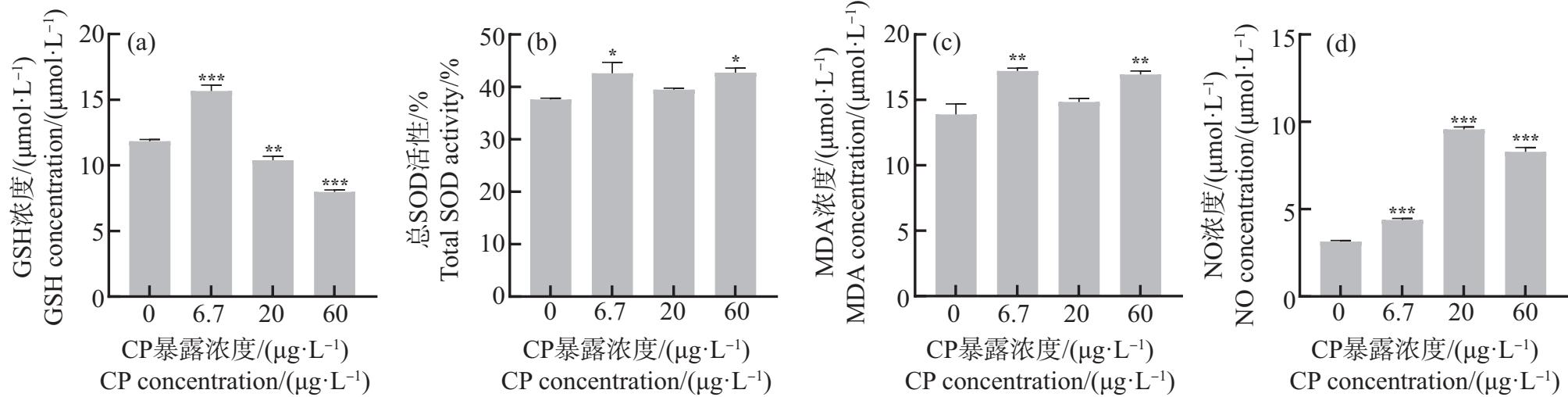
图5 CP暴露24 h后雄性小鼠睾丸外植体氧化应激指标检测结果
注:*表示P<0.05,**表示P<0.01,***表示P<0.001;GSH表示谷胱甘肽,SOD表示超氧化物歧化酶,MDA表示丙二醛,NO表示一氧化氮。
Fig. 5 Results of oxidative stress indexes in testis explants of male mice exposed to CP for 24 h
Note: *represents P<0.05, **represents P<0.01, ***represents P<0.001; GSH stands for glutathione, SOD stands for superoxide dismutase, MDA stands for malondialdehyde, and NO stands for nitric oxide.
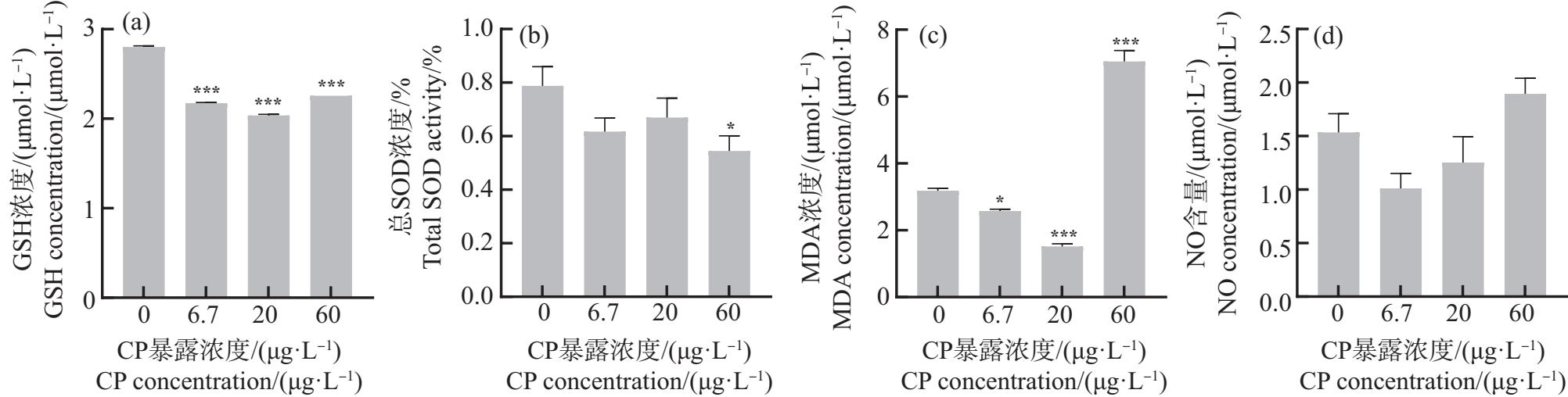
图6 CP暴露24 h后雄性小鼠下丘脑外植体氧化应激指标检测结果
注:*表示P<0.05,***表示P<0.001。
Fig. 6 Results of oxidative stress indexes in hypothalamus explants of male mice exposed to CP for 24 h
Note: *represents P<0.05, ***represents P<0.001.
HPT轴在青春期生长发育、雄激素合成和精子发生等过程中发挥重要作用。PYRs可直接作用于下丘脑分泌GnRH,通过与垂体促性腺细胞膜上的促性腺激素释放激素受体(gonadotropin-releasing hormone receptor, GnRHR)结合,影响LH和FSH的合成和分泌,这些促性腺激素随后刺激性腺产生性腺类固醇,性类固醇激素对下丘脑释放GnRH产生反馈作用,从而调控青春期时相的改变[25]。GnRH释放和青春期启动与KISS-1的表达产物亲吻素(kisspeptin)及其受体CPR54密切相关。kisspeptin是性早熟形成的关键因子,其表达增加可激活GnRH神经元,导致HPT轴的提前启动[26]。而本实验研究发现,环境剂量CP可抑制F1代小鼠下丘脑KISS-1表达,诱导GnRH分泌与GnRH表达,这说明CP可能直接调控下丘脑GnRH。现有研究报道,CP可以延迟钠离子通道失活状态和神经元细胞去极化,500 μg·L-1和5 000 μg·L-1 CP暴露会加快GnRH分泌的脉冲频率[18,27]。F1代小鼠GnRH分泌显著增高可能是钠离子通道紊乱造成的,同时CP对KISS-1的抑制可能与GnRH升高的负反馈有关。除了干扰离子通道,CP也能够结合类固醇受体发挥类激素活性,然而CP对激素受体活性的影响在不同细胞试验中差异较大,在MCF-7增殖试验中表现出显著的类雌激素作用[28],而在酵母和哺乳动物细胞的双荧光报告基因试验中表现出较弱的雌激素活性[29-31]。kisspeptin由位于下丘脑的第三脑室嘴缘室周带区域(rostral periventricular of the third ventricle, RP3V)和弓状核(arcuate nucleus, ARC)神经元群体产生,笔者猜测CP发挥类雌激素效应可能通过与性激素受体结合刺激RP3V内的kisspeptin神经元,而抑制ARC内的kisspeptin神经元,从而导致KISS-1转录水平下降[32]。
垂体是联系HPT轴中下丘脑和睾丸的重要部位,下丘脑GnRH的释放诱导垂体促性腺细胞分泌的促性腺激素(FSH和LH)驱动睾丸产生性类固醇,导致第二性征的出现[33]。促性腺激素蛋白由α亚基和β亚基组成,二者共用相同的α亚基由CGα编码,β亚基分别由FSHβ和LHβ编码[34]。有人群研究显示,CP暴露与LH和FSH的分泌呈正相关[20]。最近的证据表明,转录后控制促性腺激素功能可能是GnRHR和促性腺激素周期性积累的重要调节机制[35],例如Musashi调节因子可以特异性结合GnRHR 3’非翻译区并发挥翻译抑制作用[36]。本研究发现,在6.7 μg·kg-1·d-1的暴露剂量下,CP可诱导垂体促性腺激素亚基基因(CGα、LHβ和FSHβ)表达,且此剂量的CP可抑制F1代小鼠LH分泌,但对FSH则无明显影响。垂体促性腺激素亚基基因转录和翻译水平的不一致,可能是CP在其翻译层面产生了影响。
雄性生殖系统的正常分化、发生和功能的维持依赖于一定水平的睾酮,雄性青春期启动提前通常是睾酮分泌增加的直接结果。在睾酮合成中StAR和CYP11Al是重要的调控因子。本研究结果表明,CP分别诱导睾酮含量以及甾体激素合成相关基因(StAR和CYP11A1)表达的上调。血清中睾酮含量的增加可能是GnRH和LH分泌水平增加所诱发的,而子代雄性小鼠青春期启动提前可能是由睾酮对GnRH和LH分泌水平增加做出反馈的结果。但是在不同研究中,睾丸对CP暴露的响应不同,例如,哺乳期母鼠25 mg·kg-1·d-1 CP暴露显著降低PND21子代雄鼠CYP11A1及蛋白水平[37],围产期母鼠0.12~12 mg·kg-1·d-1 CP暴露显著降低PND21.5子代雄鼠血清睾酮水平[38],哺乳期母鼠25 mg·kg-1·d-1 CP暴露显著降低PND21子代雄鼠睾酮含量、CYP11A1和StAR表达水平[37],而这些研究的CP暴露剂量均远高于本实验。
钙离子通道通过控制钙离子进入细胞引起膜内外电位发生变化,从而进行一系列重要的生理活动,在性激素分泌中起关键作用[39]。胞内钙离子浓度的改变是雄性生殖细胞信号通路中重要的转导因素之一[40]。CP可增加小鼠睾丸支持细胞内钙离子浓度,钙离子超载导致线粒体膜通透性增加和电位降低,并且CP通过B细胞淋巴瘤2(B-cell lymphoma-2, Bcl-2)家族介导的钙离子相关的线粒体途径和钙离子/钙调蛋白(calmodulin, CaM)/钙调蛋白依赖性蛋白激酶Ⅱ(calmodulin-dependent protein kinaseⅡ, CaMKⅡ)途径诱导细胞凋亡[41]。在小鼠垂体LβT2细胞中,CP通过2种不同的途径破坏钙离子稳态,从而激活蛋白激酶C(protein kinase C, PKC)/丝氨酸/苏氨酸蛋白激酶(c-rapidly accelerated fibrosarcoma, c-Raf)/细胞外调节激酶1/2(extracellular-regulated kinase 1/2, ERK1/2)/即刻早期基因(immediate-early genes, IEGs)途径以促进细胞中促性腺激素亚基基因转录[42]。我们之前的研究发现,CP可直接作用于钙离子通道,引起垂体细胞和睾丸间质细胞中钙离子浓度的上升,调控其相关激素合成与基因表达,所以对钙离子通道的干扰可能是CP对促性腺激素和睾酮分泌产生影响的主要作用机制[18]。EDCs可通过多种途径影响雄性生殖系统的功能,是一个复杂的过程,因此需进一步探讨其毒性作用及可能的信号通路机制。
PYRs会通过产生活性氧扰乱细胞促氧化和抗氧化平衡,导致机体发生氧化应激反应,进而对生殖器官造成氧化损伤。一些体内实验研究显示,CP会提高睾丸中MDA和NO的水平,降低GSH含量和SOD的活性,而本实验中总SOD活性升高可能是对氧化应激反应负反馈的结果[11,43]。另外,PYRs可引起附睾精子氧化应激,对雄性小鼠生殖系统造成损害,如影响精子数量[44]、精子活力[45]等。其机制可能是PYRs通过增加脂质过氧化物、降低抗氧化酶活性产生活性氧自由基损伤精子细胞膜,导致膜完整性丧失、通透性增加、DNA损伤和细胞凋亡[46]。在人群实验中,相关研究也表明环境PYRs暴露可能对男性精子DNA和精液质量产生负面影响[47-48]。低浓度CP暴露不仅损伤睾丸组织,在下丘脑外植体暴露中也得出了相似的结果,而关于低剂量CP体内暴露对HPG轴功能的不利影响目前还不清楚,尽管PYRs影响睾丸抗氧化损伤系统而造成生殖毒性的研究较多,但极少涉及HPG轴,有关PYRs致雄性生殖毒性机制的研究还有待进一步深入。
[1] 李新. 拟除虫菊酯类杀虫剂研发及市场概况[J]. 农药, 2016, 55(9): 625-630
Li X. The R &D and market profile of the pyrethroid insecticides [J]. Agrochemicals, 2016, 55(9): 625-630 (in Chinese)
[2] 陈媛, 赖鲸慧, 张梦梅, 等. 拟除虫菊酯类农药在农产品中的污染现状及减除技术研究进展[J]. 食品科学, 2022, 43(9): 285-292
Chen Y, Lai J H, Zhang M M, et al. Status of pyrethroid pesticide pollution in agricultural products and technologies for its removal: A review [J]. Food Science, 2022, 43(9): 285-292 (in Chinese)
[3] 提清清, 聂兆广, 杨凡昌, 等. 拟除虫菊酯农药暴露途径及对人体健康的影响[J]. 环境科学与技术, 2017, 40(12): 240-248
Ti Q Q, Nie Z G, Yang F C, et al. Study on exposure routes of pyrethroid insecticides and its effects on human health [J]. Environmental Science &Technology, 2017, 40(12): 240-248 (in Chinese)
[4] Saillenfait A M, Ndiaye D, Sabaté J P. Pyrethroids: Exposure and health effects: An update [J]. International Journal of Hygiene and Environmental Health, 2015, 218(3): 281-292
[5] Tang W X, Wang D, Wang J Q, et al. Pyrethroid pesticide residues in the global environment: An overview [J]. Chemosphere, 2018, 191: 990-1007
[6] Yuan Y W, Chen C, Zheng C M, et al. Residue of chlorpyrifos and cypermethrin in vegetables and probabilistic exposure assessment for consumers in Zhejiang Province, China [J]. Food Control, 2014, 36(1): 63-68
[7] Jin Y X, Liu J W, Wang L G, et al. Permethrin exposure during puberty has the potential to enantioselectively induce reproductive toxicity in mice [J]. Environment International, 2012, 42: 144-151
[8] Righi D A, Xavier F G, Palermo-Neto J. Cyhalothrin increased c-fos immunoreactivity at the paraventricular nucleus of the hypothalamus in rats, and suppressed macrophage activity in an adrenal-dependent fashion [J]. Environmental Toxicology and Pharmacology, 2009, 27(1): 96-102
[9] Pitzer E M, Williams M T, Vorhees C V. Effects of pyrethroids on brain development and behavior: Deltamethrin [J]. Neurotoxicology and Teratology, 2021, 87: 106983
[10] Hu Y, Zhang Y, Vinturache A, et al. Effects of environmental pyrethroids exposure on semen quality in reproductive-age men in Shanghai, China [J]. Chemosphere, 2020, 245: 125580
[11] Zhang X, Zhang T T, Ren X H, et al. Pyrethroids toxicity to male reproductive system and offspring as a function of oxidative stress induction: Rodent studies [J]. Frontiers in Endocrinology, 2021, 12: 656106
[12] Zhang J Y, Zhang J, Liu R, et al. Endocrine-disrupting effects of pesticides through interference with human glucocorticoid receptor [J]. Environmental Science &Technology, 2016, 50(1): 435-443
[13] 马兴好, 宁萑, 王华, 等. 哺乳期氯氰菊酯暴露对断乳期雄性小鼠生殖内分泌的影响[J]. 环境与健康杂志, 2009, 26(6): 496-498, 565
Ma X H, Ning H, Wang H, et al. Effects of maternal cypermethrin exposure during lactation on testicles and steroidogenesis of weaning offspring [J]. Journal of Environment and Health, 2009, 26(6): 496-498, 565 (in Chinese)
[14] Irani D, Borle S, Balasinor N, et al. Maternal cypermethrin exposure during perinatal period dysregulates gonadal steroidogenesis, gametogenesis and sperm epigenome in F1 rat offspring [J]. Reproductive Toxicology, 2022, 111: 106-119
[15] Gan H Y, Zhu B Q, Zhou F M, et al. Perinatal exposure to low doses of cypermethrin induce the puberty-related hormones and decrease the time to puberty in the female offspring [J]. Environmental Science and Pollution Research International, 2023, 30(2): 2665-2675
[16] 柴晓静, 王振全, 邓晓辉, 等. Ⅱ-型拟除虫菊酯对雄性小鼠中枢神经系统氧化应激的影响[J]. 现代预防医学, 2007, 34(16): 3017-3019
Chai X J, Wang Z Q, Deng X H, et al. Effects of Ⅱ-pyrethrins on oxidative stress of central nervous system of mice [J]. Modern Preventive Medicine, 2007, 34(16): 3017-3019 (in Chinese)
[17] 周礼华, 高扬丽, 郭策, 等. 氯氰菊酯对小鼠大脑及小脑组织的氧化损伤[J]. 齐齐哈尔医学院学报, 2014, 35(14): 2032-2033
Zhou L H, Gao Y L, Guo C, et al. Effects of cypermethrin on oxidative damage of mice cerebral cortex and cerebellar cortex [J]. Journal of Qiqihar University of Medicine, 2014, 35(14): 2032-2033 (in Chinese)
[18] Ye X Q, Li F X, Zhang J Y, et al. Pyrethroid insecticide cypermethrin accelerates pubertal onset in male mice via disrupting hypothalamic-pituitary-gonadal axis [J]. Environmental Science &Technology, 2017, 51(17): 10212-10221
[19] Yilmaz B, Terekeci H, Sandal S, et al. Endocrine disrupting chemicals: Exposure, effects on human health, mechanism of action, models for testing and strategies for prevention [J]. Reviews in Endocrine &Metabolic Disorders, 2020, 21(1): 127-147
[20] 叶小青. 拟除虫菊酯杀虫剂暴露对青春期性成熟的影响及机制[D]. 杭州: 浙江大学, 2018: 43-46
Ye X Q. The effects and mechanism of pyrethroids exposure on pubertal development [D]. Hangzhou: Zhejiang University, 2018: 43-46 (in Chinese)
[21] Singh D, Bhagat S, Raijiwala P, et al. Perinatal exposure of pregnant rats to cypermethrin delays testicular descent, impairs fertility in F1 male progeny leading to developmental defects in F2 generation [J]. Chemosphere, 2017, 185: 376-385
[22] Ma T, Zhou Y, Xia Y H, et al. Environmentally relevant perinatal exposure to DBP disturbs testicular development and puberty onset in male mice [J]. Toxicology, 2021, 459: 152860
[23] Mylchreest E, Sar M, Cattley R C, et al. Disruption of androgen-regulated male reproductive development by di(n-butyl) phthalate during late gestation in rats is different from flutamide [J]. Toxicology and Applied Pharmacology, 1999, 156(2): 81-95
[24] Moody S, Goh H, Bielanowicz A, et al. Prepubertal mouse testis growth and maturation and androgen production are acutely sensitive to di-n-butyl phthalate [J]. Endocrinology, 2013, 154(9): 3460-3475
[25] Ye X Q, Liu J. Effects of pyrethroid insecticides on hypothalamic-pituitary-gonadal axis: A reproductive health perspective [J]. Environmental Pollution, 2019, 245: 590-599
[26] 李素环, 汪永红, 田占庄, 等. Kisspeptin/GPR54信号通路促使性早熟形成的作用观察[J]. 中国病理生理杂志, 2015, 31(8): 1345-1351
Li S H, Wang Y H, Tian Z Z, et al. Role of kisspeptin/GPR54 signaling pathways in prompting formation of precocious puberty [J]. Chinese Journal of Pathophysiology, 2015, 31(8): 1345-1351 (in Chinese)
[27] Shafer T J, Meyer D A, Crofton K M. Developmental neurotoxicity of pyrethroid insecticides: Critical review and future research needs [J]. Environmental Health Perspectives, 2005, 113(2): 123-136
[28] Chen H Y, Xiao J G, Hu G, et al. Estrogenicity of organophosphorus and pyrethroid pesticides [J]. Journal of Toxicology and Environmental Health Part A, 2002, 65(19): 1419-1435
[29] Taylor J S, Thomson B M, Lang C N, et al. Estrogenic pyrethroid pesticides regulate expression of estrogen receptor transcripts in mouse Sertoli cells differently from 17beta-estradiol [J]. Journal of Toxicology and Environmental Health Part A, 2010, 73(16): 1075-1089
[30] Tyler C R, Beresford N, van der Woning M, et al. Metabolism and environmental degradation of pyrethroid insecticides produce compounds with endocrine activities [J]. Environmental Toxicology and Chemistry, 2000, 19(4): 801-809
[31] Wielogórska E, Elliott C T, Danaher M, et al. Endocrine disruptor activity of multiple environmental food chain contaminants [J]. Toxicology in Vitro: An International Journal Published in Association with BIBRA, 2015, 29(1): 211-220
[32] 袁博, 柏金秀, 谢雪兰, 等. 中枢性性早熟基因诊断最新研究进展[J]. 中国性科学, 2021, 30(6): 134-137
Yuan B, Bai J X, Xie X L, et al. Advances in the gene diagnosis of central precocious puberty [J]. Chinese Journal of Human Sexuality, 2021, 30(6): 134-137 (in Chinese)
[33] Parent A S, Franssen D, Fudvoye J, et al. Developmental variations in environmental influences including endocrine disruptors on pubertal timing and neuroendocrine control: Revision of human observations and mechanistic insight from rodents [J]. Frontiers in Neuroendocrinology, 2015, 38: 12-36
[34] 马慧慧. 氯氰菊酯对小鼠垂体LβT2细胞分泌促性腺激素干扰作用的机制研究[D]. 杭州: 浙江大学, 2014: 1
Ma H H. Endocrine-disrupting effects of cypermethrin on synthesis of gonadotropin hormones in mouse pituitary cells [D]. Hangzhou: Zhejiang University, 2014: 1 (in Chinese)
[35] MacNicol A M, Odle A K, Childs G V. ELAVL1 elevates insights: The ups and downs of regulated mRNA translation in the control of gonadotropin release [J]. Endocrinology, 2019, 160(10): 2466-2468
[36] Odle A K, Beneš H, Melgar Castillo A, et al. Association of GnRHR mRNA with the stem cell determinant Musashi: A mechanism for leptin-mediated modulation of GnRHR expression [J]. Endocrinology, 2018, 159(2): 883-894
[37] Wang H, Wang S F, Ning H, et al. Maternal cypermethrin exposure during lactation impairs testicular development and spermatogenesis in male mouse offspring [J]. Environmental Toxicology, 2011, 26(4): 382-394
[38] Huang C B, Li X D. Maternal cypermethrin exposure during the perinatal period impairs testicular development in C57BL male offspring [J]. PLoS One, 2014, 9(5): e96781
[39] Götz V, Qiao S, Beck A, et al. Transient receptor potential (TRP) channel function in the reproductive axis [J]. Cell Calcium, 2017, 67: 138-147
[40] Geraci F, Giudice G. Mechanisms of Ca2+ liberation at fertilization [J]. Biochemical and Biophysical Research Communications, 2005, 335(2): 265-269
[41] Wang H X, Zhang R, Li Z, et al. Cypermethrin induces Sertoli cell apoptosis through mitochondrial pathway associated with calcium [J]. Toxicology Research, 2021, 10(4): 742-750
[42] Li F X, Ma H H, Liu J. Pyrethroid insecticide cypermethrin modulates gonadotropin synthesis via calcium homeostasis and ERK1/2 signaling in LβT2 mouse pituitary cells [J]. Toxicological Sciences, 2018, 162(1): 43-52
[43] Wang X Z, Liu S S, Sun Y, et al. Beta-cypermethrin impairs reproductive function in male mice by inducing oxidative stress [J]. Theriogenology, 2009, 72(5): 599-611
[44] Ravula A R, Yenugu S. Effect of oral administration of a mixture of pyrethroids at doses relevant to human exposure on the general and male reproductive physiology in the rat [J]. Ecotoxicology and Environmental Safety, 2021, 208: 111714
[45] Yuan C, Wang C, Gao S Q, et al. Effects of permethrin, cypermethrin and 3-phenoxybenzoic acid on rat sperm motility in vitro evaluated with computer-assisted sperm analysis [J]. Toxicology in Vitro: An International Journal Published in Association with BIBRA, 2010, 24(2): 382-386
[46] Wang Q, Shen J Y, Zhang R, et al. Effects and mechanisms of pyrethroids on male reproductive system [J]. Toxicology, 2020, 438: 152460
[47] Jurewicz J, Radwan M, Wielgomas B, et al. The effect of environmental exposure to pyrethroids and DNA damage in human sperm [J]. Systems Biology in Reproductive Medicine, 2015, 61(1): 37-43
[48] Ji G X, Xia Y K, Gu A H, et al. Effects of non-occupational environmental exposure to pyrethroids on semen quality and sperm DNA integrity in Chinese men [J]. Reproductive Toxicology, 2011, 31(2): 171-176