20世纪50年代起,塑料产业迅速发展,全球塑料产量逐年大幅增长[1]。塑料在工业生产和日常生活中的广泛应用给人们带来巨大便利,与此同时,塑料污染也随之而来。在环境中,塑料可以通过微生物作用、紫外线照射或物理磨损逐渐降解,进而产生塑料颗粒,目前将粒径<5 mm的塑料定义为微塑料(microplastics, MPs),<100 nm的定义为纳米塑料(nanoplastics, NPs)[2],微塑料与纳米塑料统称为微纳米塑料(micro-nano plastics, MNPs)。MNPs无处不在,有研究已在淡水[3]、泥沙[4]、土壤[5]、空气[6]等环境介质中检测到MNPs。由于MNPs体积小,比表面积大,可吸附或携带其他有害化学物质,被生物广泛摄入,进而将毒性扩散到食物链中,最终危及人类健康。
多项研究证实,水生生物(斑马鱼[7]、青鳉[8]、虎虾[9]等)和陆生动物(人[10]、小鼠[11]、鸡[12]等)的大脑、胃肠道、肝脏、肾脏和睾丸中均有MNPs蓄积,且对生物产生了诸多不利影响,包括摄食活动减少、肠道屏障功能障碍与代谢紊乱、炎症、神经毒性和生殖毒性等。近年研究显示,在人类皮肤[2]、胎盘[13]和粪便[14]中均能够检测到MPs。2022年Leslie等[15]首次在人类血液中发现了MNPs,增加了人体器官暴露于MNPs的风险,进一步引起了人们对MNPs诱导毒性作用的担忧。
目前,关于MNPs暴露影响的大多数报告都集中在海洋环境和海洋生物上,与之相比,MNPs对陆生哺乳动物健康风险的研究仍处于起步阶段。因此,本文系统概述微塑料在陆生哺乳动物体内的蓄积、生殖毒性效应、对肠道菌群的影响、炎症反应和神经毒性,以期为防治微塑料所致不良健康效应研究提供新的思路和见解。
1 微纳米塑料在陆生哺乳动物体内的分布与转运(Distribution and transport of micro-nano plastics in terrestrial mammals)
环境中MNPs在多种生物体内积累,导致食物链污染,威胁食物链中所有生物生命健康。动物摄入MNPs后不易降解,在机体中不断蓄积,通过循环系统对组织器官产生生理毒性。Im等[11]给小鼠灌胃0.2~0.3 μm(2.5 mg·(100 μL)-1)放射性同位素Cu-DOTA标记的聚苯乙烯(polystyrene, PS),发现塑料颗粒通过肠道吸收进入血液、肝脏、大脑、脾脏、睾丸、膀胱等组织,产生机体多种器官毒性。人类已不可避免通过多种途径接触MNPs(一次性餐具、水瓶、空气等),现已在人类及多种生物体中检测出MNPs,如表1所示。人类粪便中能检测到MNPs表明MNPs摄入量是较多的[14]。MNPs通过食物进入胃肠道后,未被消化吸收的MNPs随粪便被排出体外,但更小的MNPs则会进入体循环。Leslie等[15]发现人类血液中有MNPs,于是MNPs就可能通过血液运输到各个器官,但MNPs进入血液循环的机制仍不清楚,需要进一步研究。Ragusa等[16]在人类胎盘中发现约10 μm的微塑料,说明其可以通过呼吸系统和胃肠道进入血液,进而传递至胎盘。
当前MNPs的研究主要集中在不同粒径MNPs对组织造成的影响。Wang等[21]发现,300 nm、500 nm、1 μm、3 μm、6 μm等不同尺寸的PS-MNPs暴露于结肠癌Caco-2细胞24 h,其吸收率分别为78%、71%、48%、41%和28%,表明细胞对MNPs的摄取与其大小呈负相关。而活体研究表明,<10 μm的微塑料可以从肠道转移到淋巴和循环系统,并在肝脏、肾脏和大脑等组织中积累[22],<0.1 μm的纳米塑料可能穿过细胞膜、胎盘和大脑等[23-24]。MNPs粒径越小,越容易在体内吸收和转移[25]。体内实验和体外细胞实验中MNPs吸收差异的原因还不清楚,另外,吸收和蓄积的程度与微纳米塑料浓度是否相关也需进一步研究。
进入机体时,部分MNPs可以通过消化上皮和循环系统转运至其他组织和细胞,且该过程受粒径影响[26]。Meng等[10]研究发现小鼠饲喂MNPs(50 nm、300 nm、600 nm和4 μm) 1 h后,在血液中可检测到MNPs,24 h时在肾脏中发现MNPs存在,表明微塑料可能通过血液转移至组织器官。MNPs通过肠屏障,被肠上皮细胞吸收,进入体循环,在肾脏和其他器官中积累,与Im等[11]的研究结果一致。对人类来说,在初生婴儿使用塑料奶瓶时,就已经开始接触塑料。当在胎盘组织中发现MNPs颗粒时,引起了人们重视,表明在胎儿发育期间就已经开始接触MNPs,MNPs由母亲转移到未出生的婴儿体内。生物体摄取MNPs的最大颗粒直径是由物种的进食和消化器官的形态决定[27]。MNPs主要进入呼吸道和胃肠道,然后根据大小和形状可以转移到其他次生器官。这种转移依赖于粒子吸附、表面疏水性、细胞间供粒子通过的空间、表面功能化、蛋白质结构等因素。
2 微纳米塑料的毒性效应(Toxic effects of micro-nano plastics)
MNPs可能会对鱼类的肠道、肝脏、鳃和大脑造成结构性损伤,水生生物对MNPs的同化会导致有害影响,如炎症以及对生长、生存和繁殖的负面影响。而MNPs对陆生哺乳动物的相关数据并不丰富。虽然没有基于人类的直接研究证据,但基于其他物种的体外和体内研究表明,MNPs污染与多种疾病有关。目前,小鼠和大鼠是使用最多、研究较清楚的实验哺乳动物,通常被用作环境污染物健康风险的评估,包括PS、PE、PP等。MNPs颗粒可以通过摄入、吸入或者皮肤接触等途径在陆生哺乳动物体内蓄积,从而造成不可忽视的生物危害(图1)。研究发现,当PS纳米颗粒在小鼠结肠中积累时,可对结肠上皮屏障造成损伤,减少黏液产生,抑制紧密连接蛋白表达,改变肠道菌群组成[28]。此外,在啮齿类动物肝脏和肾脏中也检测到MNPs的存在,进而诱导组织炎症和氧化应激,脏器系数降低且代谢失衡[29]。MNPs还能够通过诱导氧化应激和线粒体损伤,促进心肌细胞的死亡,从而导致心脏纤维化的发展和心功能受损[30]。啮齿动物实验表明,MNPs可通过水、食物或空气等途径进入体内,到达机体器官和组织,引起生理变化、结构损伤和功能障碍。MNPs还可能吸收和携带各种污染物,增强其负面影响。但是,目前对MNPs在生物体内长期积累所产生的影响尚未被研究。
表1 人体生物样本中微纳米塑料的存在情况
Table 1 Presence of micro-nano plastics in human biological samples

微纳米塑料类型Types of micro-nano plastics微纳米塑料尺寸Micro-nano plastic size微纳米塑料丰度Abundance of micro-nano plastics样本Specimen参考文献ReferencesPP, PET, PE3 μm(0.69±0.84) 个·g-1(以单位组织质量计)(0.69±0.84) particles·g-1(Based on tissue mass)肺Lung tissue[17]PVC, PP, PBS20.34~307.29 μm(2.70±2.65) 个·g-1(2.70±2.65) particles·g-1胎盘Placenta[13]PET, PE, PS≥700 nm1.6 g·mL-1血液Blood[15]PC, PA, PP0.8~1.6 mm(28.1±15.4) 个·g-1(以单位组织质量计)(28.1±15.4) particles·g-1(Based on tissue mass)结肠Colectomy [10]PE, PVC, PP4~9 μm-母乳Breastmilk[18]PU, PES, CPE20~500 μm39.5 个·(10 mL)-139.5 particles·(10 mL)-1痰Sputum[19]PP, PET, PS, PE, PA, PC, PVC, PU20~800 μm1~36 个·g-11~36 particles·g-1粪便Feces[14]PS, PVC, PET, PMMA, POM, PP4~30 μm3.2 个·g-1(以单位组织质量计)3.2 particles·g-1(Based on tissue mass)肝脏Liver tissue[20]
注:PP表示聚丙烯;PET表示聚对苯二甲酸乙二醇酯;PE表示聚乙烯;PVC表示聚氯乙烯;PBS表示聚丁二酸丁二醇酯;PS表示聚苯乙烯;PC表示聚碳酸酯;PA表示聚酰胺;PU表示聚氨酯;PES表示聚醚砜;CPE表示氯化聚乙烯;PMMA表示聚甲基丙烯酸甲酯;POM表示聚甲醛。
Note: PP represents polypropylene; PET represents polyethylene terephthalate; PE represents polyethylene; PVC represents polyvinyl chloride; PBS represents poly butylene succinate; PS represents polystyrene; PC represents polycarbonate; PA represents polyamide; PU represents polyurethane; PES represents polyethersulfone; CPE represents chlorinated polyethylene; PMMA represents polymethyl methacrylate; POM represents polyformaldehyde.

图1 微纳米塑料对哺乳动物的毒性效应
Fig. 1 Toxic effects of micro-nano plastics on mammals
2.1 微纳米塑料的雄性生殖毒性效应(Male reproductive toxic effects of micro-nano plastics)
当下,MNPs对陆生哺乳动物的生殖毒性效应与机理的研究较少,且主要集中于小鼠和大鼠。有试验证实,MNPs能够在睾丸中积累并产生生殖毒性[31]。PS-NPs暴露可导致大鼠睾丸萎缩和生精小管变形,精子数量降低和精子DNA损伤[32]。PS-MPs暴露干扰小鼠血睾屏障(blood-testis barrier, BTB)降低睾丸系数、睾酮水平和精子质量[33]。Deng等[34]研究发现,被邻苯二甲酸酯污染的MPs增强了小鼠的生殖毒性。睾丸由于含有大量多不饱和脂肪酸,非常容易受到氧化损伤,氧化应激是男性不育的主要原因。Xie等[35]研究报道,直接暴露于PS-MPs会导致小鼠睾丸氧化应激,激活p38MAPK信号通路降低精子数量和活力。
不同浓度PS-MPs均可产生生殖毒性,且毒性呈浓度梯度依赖式。多项研究表明,MPs通过消化道进入睾丸组织并积累,这种积累会导致BTB的完整性受到损害,导致有害物更容易进入睾丸。Jin等[31]通过给小鼠灌胃荧光PS(4 μm和10 μm)发现MPs在小鼠睾丸中积累,诱导睾丸炎症并破坏血睾屏障。据报道,高浓度PS-MPs会降低精子数量、活力和质量,还会降低促卵泡激素(FSH)、促黄体生成素(LH)以及睾丸和血浆睾酮水平。Wei等[36]将雄性Balb/c小鼠暴露于MPs(4 μm和10 μm)28 d后,通过活性氧(reactive oxygen species, ROS)升高改变肌动蛋白结合蛋白的表达谱,降低BTB中连接蛋白的表达,导致BTB完整性破坏和精子发生功能障碍。
Jin等[37]报道,在饮用含不同浓度PS-MPs水180 d后,小鼠睾丸中类固醇生产相关蛋白和类固醇激素合成急性调节蛋白(StAR)水平显著下降。MPs还可能导致精子顶体和尾部损伤。在SD大鼠中进行28 d的重复口服毒性研究表明,以25 mg·kg-1·d-1的剂量,聚丙烯微塑料可诱导睾丸和附睾病变。最近一项研究报告称,暴露于PS-MPs 90 d后,雄性Wistar大鼠的附睾精子数量、活力和血清睾酮水平显著下降[38]。如图2所示,微塑料可以通过激活不同信号通路包括MAPK、AKT/mTOR等来影响雄性生殖功能,导致氧化应激增加、血睾屏障破坏、生精功能障碍、类固醇合成蛋白表达降低和促黄体生成素(luteinizing hormone, LH)下调。
2.2 微纳米塑料的雌性生殖毒性效应(Female reproductive toxic effects of micro-nano plastics)
卵巢是雌性动物重要的生殖和内分泌器官,氧化应激会引起卵母细胞的产生和类固醇激素分泌异常。最近一项研究发现,PS-MPs通过氧化应激激活Wnt/β-Catenin信号通路和卵巢颗粒细胞凋亡诱导大鼠卵巢纤维化,最终导致卵巢储备能力下降[39]。一旦卵巢功能受损,会导致女性生殖功能障碍。在雌性小鼠中,PS-MPs暴露引起卵巢大小和卵泡数量减少。暴露于PS-MPs后,雌鼠血清中卵泡刺激素、黄体生成素和睾酮水平升高,雌二醇水平降低。暴露于PS-MPs的小鼠怀孕率降低,产生的胚胎也更少。Haddadi等[40]试验发现,口服PS-MPs(5 μm)暴露(0.1 mg·d-1)24~26 d会干扰卵泡发生,如破坏Wistar大鼠的卵泡成熟、分化,并增加闭泡和囊肿卵泡的数量。在雌性大鼠中,还会由于MPs暴露致发情周期中断。与对照组大鼠相比,PS-MPs(5 μm)显著缩短了第4个发情周期的持续时间,并缩短了潮期的持续时间。Liu等[41]的研究同样表明持续暴露于PS-MPs(30 mg·kg-1)35 d会损害小鼠卵巢中卵泡的发育、质量和卵母细胞的成熟。大鼠颗粒细胞中MPs(0.5 μm)积累会干扰卵母细胞的正常功能、生长和分化,并通过凋亡、焦亡和纤维化导致雌性生殖毒性[39]。因此,大量暴露于MPs会加重各种毒性,如卵母细胞直径和数量减少、卵泡减少或空洞、卵巢炎症和卵巢储备减少。如图2所示,MPs影响女性生殖功能通过激活NLRP3、TLR4/NOX2和TGF-β纤维化改变,导致氧化应激增加、子宫内膜变薄、胶原沉积、炎症标志物含量增加、颗粒细胞的焦亡和凋亡,而卵巢储备、卵泡生长、颗粒细胞容量和抗穆氏管荷尔蒙水平下降。
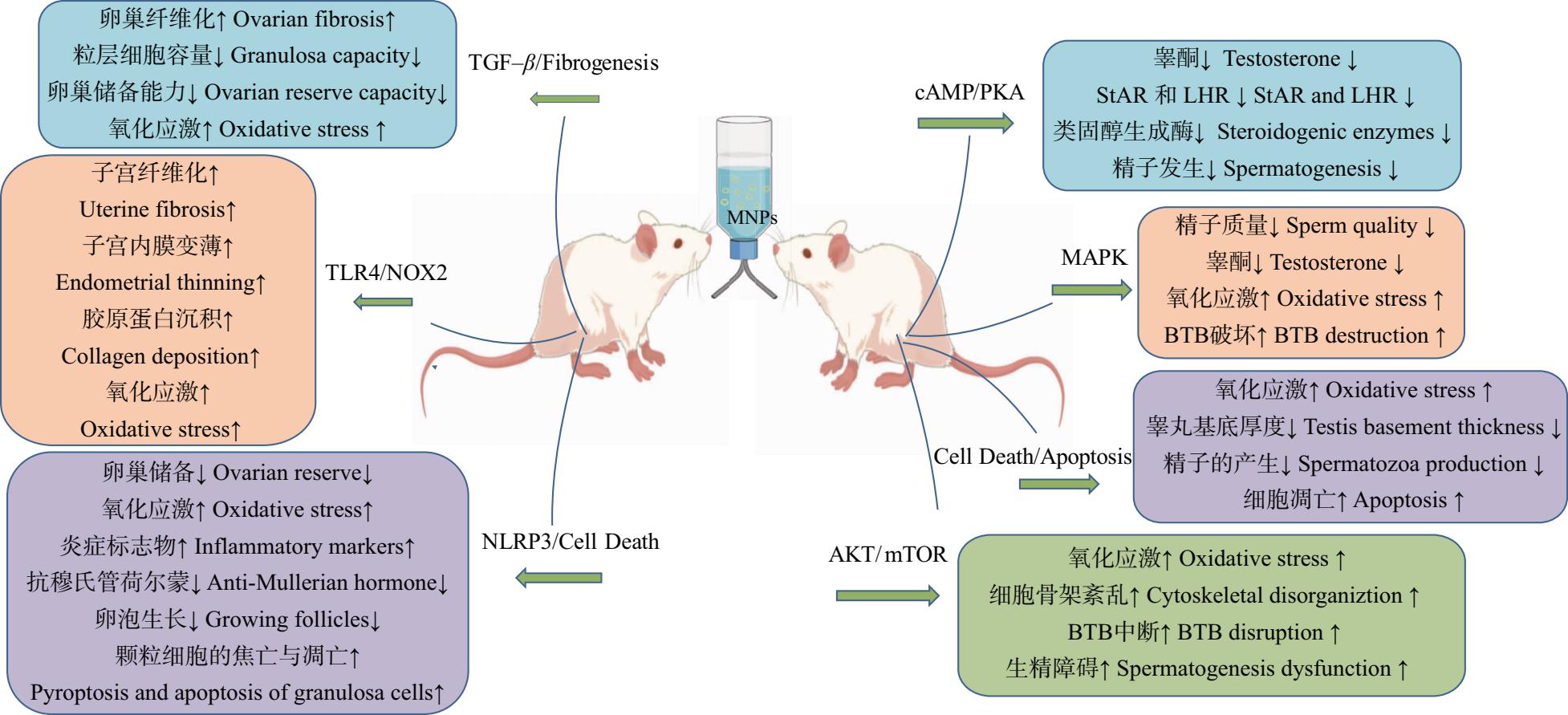
图2 微塑料对生殖系统的毒性效应
Fig. 2 Toxic effects of microplastics on the reproductive system
多项研究证明MNPs具有跨代的能力,通过母体传递给后代,并直接影响后代存活率和比例。对于动物育种来说,一旦MNPs在母体中大量积累,后代很难避免MNPs的影响,致使MNPs的积累更加广泛,最终可能会危及整个生物种群。MNPs的生殖毒性研究大多集中于雄性,经比较发现,PS-MPs对小鼠卵巢的累积和氧化应激作用明显大于睾丸[42],雌性可能更容易受到MNPs的影响。需要进一步研究MNPs对雌性的影响以及性别之间的差异。
2.3 微纳米塑料对肠道菌群的影响(Effects of micro-nano plastics on intestinal flora)
肠道菌群在维持宿主代谢稳态和免疫功能方面起着重要作用[43]。肠道菌群破坏可诱发宿主体内脂质、能量和氨基酸代谢异常,以及多种类型的肠炎。因此,MNPs对肠道微生物群稳态的毒性也值得关注。Lu等[44]研究发现PS-MNPs暴露导致小鼠粪便中厚壁菌门和α-变形菌门丰度降低。MNPs暴露引起肠道菌群失调可能进一步引起肝脏脂质代谢紊乱和机体炎症。Sun等[45]发现聚乙烯微塑料通过改变结肠菌群组成,导致小鼠结肠黏液蛋白产生减少,产生轻微的免疫反应,并增加了肠道菌群氨基酸代谢。聚乙烯微塑料暴露增强了肠道菌群对氨基酸的代谢能力,可能导致宿主对氨基酸更有效的利用。因此,聚乙烯微塑料暴露可能导致小鼠能量摄入特别是蛋白质摄入的减少,以及厚壁菌门/拟杆菌门肠道菌群比例降低。这2个过程可能形成前馈循环,更有效地利用摄入的氨基酸,增强宿主对蛋白质的消化吸收。
肠道微生物群落的改变可能会导致肠道炎症和其他相关疾病的增加。研究发现,肠道菌群与MNPs引起的睾丸疾病之间存在联系。Wen等[46]在粪便菌群移植(FMT)试验中,受体小鼠出现了肠道微生物的改变,根据斯皮尔曼相关(Spearman correlation)系数分析,拟杆菌(Bacteroides)和普雷沃氏菌(Prevotellaceae_UCG-001)丰度的升高与睾丸功能紊乱呈正相关。这表明MNPs暴露诱导的睾丸功能障碍可能是由肠源性T辅助细胞17(Th17)介导IL-17A信号通路引发炎症反应。
值得注意的是,越来越多证据表明,摄入高浓度MNPs可以改变模型动物的肠道微生物结构和相对丰度。例如,高浓度PS-MPs可诱导小鼠和斑马鱼肠道菌群紊乱和肝脏脂质代谢紊乱。持续摄入MNPs可能会减少肠道有益菌群,并导致生物体更严重的生理问题。但长期暴露于与环境相关的较大剂量MNPs对陆生哺乳动物的影响仍有待研究。
2.4 微塑料引发炎症反应(Micro-nano plastics trigger an inflammatory response)
MNPs生物体内蓄积可诱发组织炎症。而炎症的发生是以IL-1β、TNF-α、NF-κB等标志物的异常表达为特征[47]。NF-κB激活对炎症的发展至关重要,在Haghani等[48]的研究中,通过对暴露于≤0.2 μm环境细颗粒物的小鼠大脑皮层进行转录组分析,炎症基因和NF-κB转录水平显著增加。此外,Hou等[33]首次报道了PS-MPs暴露可显著促进p-NF-κB、炎症因子IL-1β和IL-6的表达,进而诱导小鼠睾丸炎症损伤,表明Nrf2/HO-1/NF-κB的相互调控可能是PS-MPs诱导炎症反应的机制之一。同样,Wang等[49]的研究数据显示,PS-MPs可诱导小鼠膀胱组织发生病变,并且导致TNF-α、pro-IL-1β和p-NF-κB、p65的表达水平显著升高,这可能是膀胱对PS-MPs刺激的反应。体内和体外实验均发现,与小粒径(<10 μm)PS-MNPs相比,大粒径(>100 μm)PS-MPs诱导炎症因子释放水平更高。
不同理化性质的塑料颗粒会引起不同的炎症反应,这取决于颗粒的靶点和位置。研究表明,颗粒与氧化应激诱导的炎症之间存在显著相关性[50]。ROS是参与炎症过程的主要因素之一,通过上调某些转录因子(NF-κВ、AP-1)诱发促炎基因变化。MNPs暴露在肾脏中引起氧化应激,也促进了一些炎症因子的表达,促进炎症反应[51]。然而,MNPs暴露通过促进ROS的产生诱导生物组织炎症发展,还有待进一步研究。
2.5 微纳米塑料对神经系统的毒性效应(Toxic effects of micro-nano plastics on the nervous system)
MNPs也可能通过食物链转移产生神经毒性,导致神经行为障碍。Deng等[52]发现长期暴露于PS (5 μm和20 μm)中会影响小鼠的15种神经递质,如乙酰胆碱酯酶活性下降,说明MNPs暴露可能降低小鼠神经传递效率。da Costa Araújo和Malafaia[53]研究发现,小鼠食用暴露于MNPs的蝌蚪(57.07 个·g-1)后,在面对危险时,潜伏和聚集行为减少。但Rafiee等[54]发现,将雄性Wistar大鼠暴露于25 nm和50 nm的PS-NPs 5周(每天灌胃1、3、6和10 mg·kg-1)后,未观察到统计学上显著的神经行为效应。不一致的研究结果说明,MNPs的大小、剂量、类型以及实验动物的差异会影响MNPs神经性毒性的评价,因此进一步开展广泛、深入和系统的研究,客观评价MNPs的生物毒性是非常必要的。
3 结论与展望(Conclusion and prospect)
MNPs作为一种环境污染物,其潜在集体危害性引起了广泛关注,现有文献初步明确其对哺乳动物的生殖系统、肠道菌群、神经系统具有一定生物学毒性,能引起炎症反应。MNPs能够跨代传递并影响后代存活率,对雌性生殖产生的影响还需要更详细和全面的研究。此外,MNPs暴露会改变肠道菌群的稳定性[55],可能会引起其他器官的一系列慢性疾病。值得我们注意的是,MNPs与炎症诱发之间存在相关性,进入人体的MNPs可能与免疫细胞相互作用,促进炎症细胞因子分泌致使炎症发生。然而MNPs毒性对陆生哺乳动物影响的评估非常有限,未来仍需重点关注。
本文通过系统总结分析,认为MNPs生物学毒性研究还存在一定的局限性,未来研究应集中在以下几个方面。(1)目前在生物体内的研究中,使用的MNPs颗粒均为全新制品,没有暴露于环境中,自然条件下进入机体的MNPs往往会在环境中停留,受环境因素的影响。在理想的实验环境下进行的MNPs研究可能低估了MNPs对生物体的危害,应进一步探究暴露于环境中的MNPs对生物的影响。(2)试验设计的MNPs摄入量大多显著超过天然样品和消费产品中的浓度,且试验中MNPs种类单一,形状规则,试验结果存在一定偏差,应避免脱离现实情况,刻意放大MNPs毒理学效应。另外,当前的研究数据可能是试验材料中的添加剂(如增塑剂、抗氧化剂、润滑剂等)和MNPs附着物引起,并非聚合物本身的毒性,未来的研究可重点关注合成材料方面的危害。(3)随着生物信息技术和高通量测序技术的快速发展,可以将16S rRNA测序、代谢组学、转录组学等方法与传统生物学实验方法相结合,深入研究MNPs的毒性机制。另外,由于目前塑料制品的不可替代性,应该加大MNPs安全降解方面的研究,例如,已经发现的具有降解MNPs能力的微生物,通过分泌多种胞外酶使聚合物解聚,以这类菌种作为降解酶的载体,开发一种新型功能菌,达到降解生物体内MNPs的目的。同时,更亟待开展MNPs危害防控和防治领域的研究,例如研究开发可修复或者治疗MNPs造成器官损害和相关疾病的保健品或者药物等。(4)不同粒径MNPs迁移至组织中的分子机制及其蓄积量尚未阐明,未来的研究重点应围绕MNPs突破血脑屏障、血睾屏障、胃肠液屏障等不同部位防护屏障的粒径阈值、迁移机制、损伤与防护方法等方面,这可为防治MNPs所致不良健康效应研究提供新的思路和见解,也为塑料产品的应用和生态环境管理提供参考。
[1] Alimba C G, Faggio C. Microplastics in the marine environment: Current trends in environmental pollution and mechanisms of toxicological profile [J]. Environmental Toxicology and Pharmacology, 2019, 68: 61-74
[2] Abbasi S, Turner A. Human exposure to microplastics: A study in Iran [J]. Journal of Hazardous Materials, 2021, 403: 123799
[3] 张耀丹, 李欣桐, 李永, 等. 淡水环境沉积物中微塑料的密度分离方法研究[J]. 中国环境监测, 2022, 38(2): 1-7
Zhang Y D, Li X T, Li Y, et al. Evaluation of the density separation methods for microplastics in inland freshwater environment sediments [J]. Environmental Monitoring in China, 2022, 38(2): 1-7 (in Chinese)
[4] 万顺, 徐国策, 李清顺, 等. 大理河流域微塑料空间分布及其来源[J]. 环境科学学报, 2022, 42(8): 293-303
Wan S, Xu G C, Li Q S, et al. Spatial distribution and source of microplastics in the Dali River Basin [J]. Acta Scientiae Circumstantiae, 2022, 42(8): 293-303 (in Chinese)
[5] 贾涛, 薛颖昊, 靳拓, 等. 土壤中微塑料的来源、分布及其对土壤潜在影响的研究进展[J]. 生态毒理学报, 2022, 17(5): 202-216
Jia T, Xue Y H, Jin T, et al. Research progress on sources,distribution and potential effects of microplastics in soil [J]. Asian Journal of Ecotoxicology, 2022, 17(5): 202-216 (in Chinese)
[6] 徐力波, 胡敏, 贾薇茜, 等. 大气环境中微塑料分布与迁移及生态环境影响研究进展[J]. 科学通报, 2022, 67(30): 3565-3579
Xu L B, Hu M, Jia Q J, et al. Distribution and transport of atmospheric microplastics and the environmental impacts: A review [J]. Chinese Science Bulletin, 2022, 67(30): 3565-3579 (in Chinese)
[7] 蔡亚云, 赵佳玥, 李文锋, 等. 不同粒径塑料微颗粒在斑马鱼腮组织中的积累及其对蒽毒性的影响[J]. 应用与环境生物学报, 2017, 23(6): 1154-1158
Cai YY, Zhao J Y, Li W F, et al. Retention of polystyrene particles of different sizes in zebrafish gills and their effect on toxicity of anthracene to gill cells [J]. Chinese Journal of Applied and Environmental Biology, 2017, 23(6): 1154-1158 (in Chinese)
[8] Wang J, Li Y J, Lu L, et al. Polystyrene microplastics cause tissue damages, sex-specific reproductive disruption and transgenerational effects in marine medaka (Oryzias melastigma) [J]. Environmental Pollution, 2019, 254(Pt B): 113024
[9] Hossain M S, Rahman M S, Uddin M N, et al. Microplastic contamination in Penaeid shrimp from the Northern Bay of Bengal [J]. Chemosphere, 2020, 238: 124688
[10] Meng X, Zhang J, Wang W, et al. Effects of nano- and microplastics on kidney: Physicochemical properties, bioaccumulation, oxidative stress and immunoreaction [J]. Chemosphere, 2022, 288(Pt 3): 132631
[11] Im C, Kim H, Zaheer J, et al. PET tracing of biodistribution for orally administered 64Cu-labeled polystyrene in mice [J]. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine, 2022, 63(3): 461-467
[12] Hou L L, Wang D X, Yin K, et al. Polystyrene microplastics induce apoptosis in chicken testis via crosstalk between NF-κB and Nrf2 pathways [J]. Comparative Biochemistry and Physiology Toxicology &Pharmacology, 2022, 262: 109444
[13] Zhu L, Zhu J Y, Zuo R, et al. Identification of microplastics in human placenta using laser direct infrared spectroscopy [J]. The Science of the Total Environment, 2023, 856(Pt 1): 159060
[14] Zhang N, Li Y B, He H R, et al. You are what You eat: Microplastics in the feces of young men living in Beijing [J]. The Science of the Total Environment, 2021, 767: 144345
[15] Leslie H A, vanVelzen M J M, Brandsma S H, et al. Discovery and quantification of plastic particle pollution in human blood [J]. Environment International, 2022, 163: 107199
[16] Ragusa A, Svelato A, Santacroce C, et al. Plasticenta: First evidence of microplastics in human placenta [J]. Environment International, 2021, 146: 106274
[17] Jenner L C, Rotchell J M, Bennett R T, et al. Detection of microplastics in human lung tissue using μFTIR spectroscopy [J]. Science of the Total Environment, 2022, 831: 154907
[18] Ragusa A, Notarstefano V, Svelato A, et al. Raman microspectroscopy detection and characterisation of microplastics in human breastmilk [J]. Polymers, 2022, 14(13): 2700
[19] Huang S M, Huang X X, Bi R, et al. Detection and analysis of microplastics in human sputum [J]. Environmental Science &Technology, 2022, 56(4): 2476-2486
[20] Horvatits T, Tamminga M, Liu B B, et al. Microplastics detected in cirrhotic liver tissue [J]. EBioMedicine, 2022, 82: 104147
[21] Wang Q Q, Bai J L, Ning B A, et al. Effects of bisphenol A and nanoscale and microscale polystyrene plastic exposure on particle uptake and toxicity in human Caco-2 cells [J]. Chemosphere, 2020, 254: 126788
[22] Yong C Q Y, Valiyaveettil S, Tang B L. Toxicity of microplastics and nanoplastics in mammalian systems [J]. International Journal of Environmental Research and Public Health, 2020, 17(5): 1509
[23] Gruber M M, Hirschmugl B, Berger N, et al. Plasma proteins facilitates placental transfer of polystyrene particles [J]. Journal of Nanobiotechnology, 2020, 18(1): 128
[24] Prüst M, Meijer J, Westerink R H S. The plastic brain: Neurotoxicity of micro- and nanoplastics [J]. Particle and Fibre Toxicology, 2020, 17(1): 24
[25] Browne M A, Dissanayake A, Galloway T S, et al. Ingested microscopic plastic translocates to the circulatory system of the mussel, Mytilus edulis L. [J]. Environmental Science &Technology, 2008, 42(13): 5026-5031
[26] Li Z K, Zhu S X, Liu Q, et al. Polystyrene microplastics cause cardiac fibrosis by activating Wnt/β-catenin signaling pathway and promoting cardiomyocyte apoptosis in rats [J]. Environmental Pollution, 2020, 265(Pt A): 115025
[27] Lambert S, Scherer C, Wagner M. Ecotoxicity testing of microplastics: Considering the heterogeneity of physicochemical properties [J]. Integrated Environmental Assessment and Management, 2017, 13(3): 470-475
[28] Qiao J Y, Chen R, Wang M J, et al. Perturbation of gut microbiota plays an important role in micro/nanoplastics-induced gut barrier dysfunction [J]. Nanoscale, 2021, 13(19): 8806-8816
[29] Wang Y L, Lee Y H, Hsu Y H, et al. The kidney-related effects of polystyrene microplastics on human kidney proximal tubular epithelial cells HK-2 and male C57BL/6 mice [J]. Environmental Health Perspectives, 2021, 129(5): 57003
[30] Wei J L, Wang X F, Liu Q, et al. The impact of polystyrene microplastics on cardiomyocytes pyroptosis through NLRP3/Caspase-1 signaling pathway and oxidative stress in Wistar rats [J]. Environmental Toxicology, 2021, 36(5): 935-944
[31] Jin H B, Ma T, Sha X X, et al. Polystyrene microplastics induced male reproductive toxicity in mice [J]. Journal of Hazardous Materials, 2021, 401: 123430
[32] Amereh F, Babaei M, Eslami A, et al. The emerging risk of exposure to nano(micro)plastics on endocrine disturbance and reproductive toxicity: From a hypothetical scenario to a global public health challenge [J]. Environmental Pollution, 2020, 261: 114158
[33] Hou B L, Wang F Y, Liu T, et al. Reproductive toxicity of polystyrene microplastics: in vivo experimental study on testicular toxicity in mice [J]. Journal of Hazardous Materials, 2021, 405: 124028
[34] Deng Y F, Yan Z H, Shen R Q, et al. Enhanced reproductive toxicities induced by phthalates contaminated microplastics in male mice (Mus musculus) [J]. Journal of Hazardous Materials, 2021, 406: 124644
[35] Xie X M, Deng T, Duan J F, et al. Exposure to polystyrene microplastics causes reproductive toxicity through oxidative stress and activation of the p38 MAPK signaling pathway [J]. Ecotoxicology and Environmental Safety, 2020, 190: 110133
[36] Wei Y X, Zhou Y, Long C L, et al. Polystyrene microplastics disrupt the blood-testis barrier integrity through ROS-mediated imbalance of mTORC1 and mTORC2 [J]. Environmental Pollution, 2021, 289: 117904
[37] Jin H B, Yan M H, Pan C, et al. Chronic exposure to polystyrene microplastics induced male reproductive toxicity and decreased testosterone levels via the LH-mediated LHR/cAMP/PKA/StAR pathway [J]. Particle and Fibre Toxicology, 2022, 19(1): 13
[38] Ilechukwu I, Ehigiator B E, Ben I O, et al. Chronic toxic effects of polystyrene microplastics on reproductive parameters of male rats [J]. Environmental Analysis, Health and Toxicology, 2022, 37(2): e2022015-e2022010
[39] An R, Wang X F, Yang L, et al. Polystyrene microplastics cause granulosa cells apoptosis and fibrosis in ovary through oxidative stress in rats [J]. Toxicology, 2021, 449: 152665
[40] Haddadi A, Kessabi K, Boughammoura S, et al. Exposure to microplastics leads to a defective ovarian function and change in cytoskeleton protein expression in rat [J]. Environmental Science and Pollution Research International, 2022, 29(23): 34594-34606
[41] Liu Z Q, Zhuan Q R, Zhang L Y, et al. Polystyrene microplastics induced female reproductive toxicity in mice [J]. Journal of Hazardous Materials, 2022, 424(Pt C): 127629
[42] Wei Z L, Wang Y Y, Wang S W, et al. Comparing the effects of polystyrene microplastics exposure on reproduction and fertility in male and female mice [J]. Toxicology, 2022, 465: 153059
[43] Yoshida S, Hiraga K, Takehana T, et al. A bacterium that degrades and assimilates poly(ethylene terephthalate) [J]. Science, 2016, 351(6278): 1196-1199
[44] Lu L, Wan Z Q, Luo T, et al. Polystyrene microplastics induce gut microbiota dysbiosis and hepatic lipid metabolism disorder in mice [J]. The Science of the Total Environment, 2018, 631-632: 449-458
[45] Sun H Q, Chen N, Yang X N, et al. Effects induced by polyethylene microplastics oral exposure on colon mucin release, inflammation, gut microflora composition and metabolism in mice [J]. Ecotoxicology and Environmental Safety, 2021, 220: 112340
[46] Wen S Y, Zhao Y, Liu S J, et al. Microplastics-perturbed gut microbiota triggered the testicular disorder in male mice: Via fecal microbiota transplantation [J]. Environmental Pollution, 2022, 309: 119789
[47] Zhang Y, Qi X, Chen X M, et al. Dietary selenomethionine ameliorates lipopolysaccharide-induced renal inflammatory injury in broilers via regulating the PI3K/AKT pathway to inhibit necroptosis [J]. Food &Function, 2021, 12(10): 4392-4401
[48] Haghani A, Cacciottolo M, Doty K R, et al. Mouse brain transcriptome responses to inhaled nanoparticulate matter differed by sex and APOE in Nrf2-Nfkb interactions [J]. eLife, 2020, 9: e54822
[49] Wang Y, Wang S C, Xu T, et al. A new discovery of polystyrene microplastics toxicity: The injury difference on bladder epithelium of mice is correlated with the size of exposed particles [J]. The Science of the Total Environment, 2022, 821: 153413
[50] Medina C, Santos-Martinez M J, Radomski A, et al. Nanoparticles: Pharmacological and toxicological significance [J]. British Journal of Pharmacology, 2007, 150(5): 552-558
[51] Yang H L, Lai H, Huang J, et al. Polystyrene microplastics decrease F-53B bioaccumulation but induce inflammatory stress in larval zebrafish [J]. Chemosphere, 2020, 255: 127040
[52] Deng Y F, Zhang Y, Lemos B, et al. Tissue accumulation of microplastics in mice and biomarker responses suggest widespread health risks of exposure [J]. Scientific Reports, 2017, 7: 46687
[53] da Costa AraújoA P, Malafaia G. Microplastic ingestion induces behavioral disorders in mice: A preliminary study on the trophic transfer effects via tadpoles and fish [J]. Journal of Hazardous Materials, 2021, 401: 123263
[54] Rafiee M, Dargahi L, Eslami A, et al. Neurobehavioral assessment of rats exposed to pristine polystyrene nanoplastics upon oral exposure [J]. Chemosphere, 2018, 193: 745-753
[55] Chen X B, Zhuang J S, Chen Q L, et al. Polyvinyl chloride microplastics induced gut barrier dysfunction, microbiota dysbiosis and metabolism disorder in adult mice [J]. Ecotoxicology and Environmental Safety, 2022, 241: 113809