沉积物是水环境中各类污染物的主要承载体,重金属等各类污染物进入水体后会在沉积物中不断蓄积,成为水体潜在新污染源,一旦水环境发生变化,沉积物中的重金属就会再次释放,造成二次污染,进而直接或间接影响人类健康[1]。同时,沉积物还是两栖类幼体等水生生物的营养来源,沉积物中重金属等污染物质直接影响着它们的生存质量[2]。因此,通过生物监测技术评估沉积物污染程度及其对水生生物的毒性效应,指示性更强。
生物监测技术通过生物个体、种群或群落因环境变化而产生的生理生化反应和群落结构变化等,直接反映环境污染的潜在毒性作用,指示环境污染程度及其导致综合生物效应的重要化学污染因子,被认为能够突破理化分析不能全面评估环境污染综合生态毒性效应的问题[3-6]。因此,涉及生物标记物的生物监测技术被广泛使用、生物标记物综合指数(IBRv2)应运而生,并在环境复合污染评估中起到重要作用[5-7]。然而,生物标记物种类繁杂,且在不同生物学水平上各指标的测定方法难易程度和成本差别很大,且缺乏明确的标准和规范。尤其是在野外自然环境中,不同的复合污染类型和受试生物物种差异对生物监测结果影响很大[5, 8],从而导致生物标记物的优选和适用性还需广泛研究和探索。
两栖类动物幼体常取食沉积物,不能脱离水体,皮肤具有高渗透性,对水质变化较为敏感[8]。研究显示蝌蚪对水环境中的重金属污染物有较高富集能力,在低污染浓度下可能导致蝌蚪发育异常甚至致畸[9]。这种特殊的生理特性使得两栖类常被作为一种检测水环境质量的良好指示性生物。
研究表明大部分矿区周围水域沉积物重金属含量超标,长期威胁着土著生物和居民健康,存在较强的潜在生态风险[10]。煤矿区废水渗漏是下游沉积物重金属污染的主要来源之一,由于管理和维护不当等多种原因,导致矿区有毒有害物质流入地表径流、湖泊等水体环境中,损害生物多样性[11]。相较于河流上、下游区域,矿区段沉积物重金属的综合潜在生态风险更大[2]。重金属具有种类繁多、不可逆、持久性强和难以治理等特点,无法在自然环境中降解,但可通过吸附作用蓄积到沉积物中,进而经过食物链的放大作用,危害水生生物以及人类健康,如Cd具有很强的致癌、致畸作用,对生物生长发育造成较大影响[7]。刘鹏等[9]发现当无尾两栖类蝌蚪受到重金属污染胁迫时,其形态、存活率、畸形率以及个体活动均产生较大变化,并且在组织、生理生化以及染色体水平上造成严重损伤。黄涛等[11]发现重金属复合污染通过损伤DNA、增加细胞微核率以及扰乱性激素分泌,从而对花背蟾蜍雄性性腺造成毒害作用。Reyes-Becerril等[12]发现甲基汞、镉和砷(Ⅲ)具有细胞毒性,并诱导发生氧化应激反应和细胞凋亡,从而对太平洋红鲷鱼产生影响。Zhang等[4]发现长期处于重金属污染的环境下,花背蟾蜍在生命周期早期用于免疫和抗氧化的能量分配显著降低。薄军等[13]利用IBRv2法和CYP1A多种生物标记物监测技术更加全面地反映了石油类污染的生物毒性效应。Si等[5]利用IBRv2法评价了尾矿库周边地下水中重金属污染程度和扩散范围,结果显示与内梅罗指数等物化监测评价结果高度一致。
目前,国内学者关于煤矿区水体污染对两栖类的生态毒性效应研究较多,生物标记物及其综合生物指数在我国水生环境质量评估中也有广泛应用[5-6, 13-14],但关于煤矿区沉积物污染对两栖类的综合毒性效应研究较少。基于此,本研究在利用内梅罗综合污染指数(P综合)和污染负荷指数(PLI)评价煤矿区周边水系中沉积物污染现状的同时,以生物标记物综合指数(IBRv2)来指示沉积物重金属复合污染程度及其生态毒性效应,并分析二者之间的因果关系,明确导致综合生物效应的重要化学污染因子。以期为煤矿区水环境污染的生物监测技术开发与生物标记物优选提供数据支持。
1 材料与方法(Materials and methods)
1.1 研究样地和布点
研究区域位于重庆市永川区内,地处低山浅丘地段,属亚热带季风湿润气候。境内河道属长江流域,主要水系有小安溪河,多年平均流量为21.7 m3·s-1 [15],该河流有10余条支流汇入,图1中的小溪流为其中之一。小安溪河依次进入涪江、嘉陵江后最终汇入长江,属于长江三级支流[15]。研究区域地下矿藏资源丰富,储量大,形成了以矿产资源为主的工业生产体系。本研究以流经某煤矿区的主要水系(小安溪和小溪流)为研究样地,以相对无污染的小安溪上游河段为对照样地,并按照煤矿废水的流向和煤矿区主要功能区共设置了4个样点(图1)。该煤矿区目前处于关停状态。

图1 采样点设置
注:S1、S2、S3和S4为取样站位。
Fig. 1 Sampling sites
Note: S1, S2, S3, and S4 are sampling sites.
S1为对照样地,位于小安溪上游相对洁净河段,该样点上游未见其他煤矿废水排放口。S2为煤矸石场渗漏水流区域,流出场区后进入小溪流(无名)继续流向洗煤厂方向。S3位于洗煤厂外小溪流中,该处承接了洗煤场废水,下游小溪流两侧分布有稻田和池塘。S4位于该小溪流汇入小安溪的汇入口下约100 m处,该处水质混合已较为均匀。
1.2 沉积物采样与元素分析
在每个样地设置3个相距10 m以上的采样断面。在每个断面距离两侧岸边2 m内的河道中,用沉积物采样器随机采集表层0~5 cm的沉积物,混合后制备成1个混合样品(约5 kg),各样地分别采集3个混合样品,置于无菌塑料袋中保存并编号,带回实验室后于阴凉通风口处自然风干,除去沙砾及动植物残骸等异物后分为两部分,一部分用于pH和重金属含量的测定;另一部分用于蝌蚪染毒实验。
将风干的沉积物样品置于研钵内用玛瑙棒研磨成粉状,过20目尼龙土壤筛,以1∶5的沉积物∶水溶液制备悬浮液,自然澄清后采用pH计(PHSJ-6L,雷磁,上海)测定pH值。过100目尼龙土壤筛用于重金属含量测定,采用开放式湿法消解,消解液为HNO3-HCl-HF-HClO4(9∶3∶10∶3,V∶V)的混合物,消化炉200 ℃消解约4 h。使用电感耦合等离子体(ICP)测定沉积物中Cu、Cr、Ni、Mn、Pb、Zn共6种重金属元素含量,使用标准溶液(钢研纳克)绘制标准曲线,6种重金属元素的标准曲线R2均>0.999。上机测定时每隔10个样品使用标液检验1次,回收率在(100±10)%时继续测定,否则重新测定[10]。
1.3 沉积物污染评价
沉积物重金属污染程度使用内梅罗污染综合指数法和污染负荷指数法进行评价。
(1)内梅罗综合污染指数法:
式中:Pi是单因子污染指数;Ci是元素i的实际测量值;Si是元素i的标准值,本文取重庆市土壤背景值[10];P综合是元素i的综合污染指数;![]() 是各元素Pi的平均值;Pimax是各元素中最大Pi值。P综合<0.7为清洁(安全),0.7≤P综合<1.0为尚清洁(警戒线),1.0≤P综合<2.0为轻度污染,2.0≤P综合<3.0为中度污染,P综合≥3.0为重度污染[1]。
是各元素Pi的平均值;Pimax是各元素中最大Pi值。P综合<0.7为清洁(安全),0.7≤P综合<1.0为尚清洁(警戒线),1.0≤P综合<2.0为轻度污染,2.0≤P综合<3.0为中度污染,P综合≥3.0为重度污染[1]。
(2)污染负荷指数法计算公式:
式中:PLI为污染负荷指数;n代表元素数量;Pn为第n种重金属的污染指数。PLI<1为无污染,1≤PLI<2为轻度污染,2≤PLI<3为中度污染,PLI≥3为重度污染[10]。
1.4 蝌蚪染毒实验设计
挑选大小、体型均一的健康蝌蚪进行急性染毒实验。染毒水箱规格为30 cm×30 cm×20 cm(长×宽×高)的亚克力透明水箱。分别取各样地的沉积物(阴干后过20目尼龙土壤筛)1.8 kg在水箱中铺装,厚度约为2 cm。再注入充分曝气24 h的自来水9 L,水深约为10 cm,用玻璃棒搅拌15 min使沉积物和水充分混合均匀,静置24 h。于每个水箱中随机放入大小、体型较为均一的蝌蚪12只,每个样地各设置3个水箱(平行试验),经沉积物水溶液染毒96 h,期间维持水温18~22 ℃,不投食。
1.5 生物样本采集与分析
染毒结束后,在各水箱分别随机取出9只未死亡蝌蚪,每3只为1组采集混合生物样品。断尾取血离心后吸取血清立即测定微核率(micronuclei, MN)。解剖后快速取其肝脏置于冰浴PBS缓冲溶液中清洗。称重计算肝脏脏器系数(liver organ coefficient, LOC),肝脏按照1∶99的质量比例加入冰浴PBS缓冲溶液中匀浆,并置于EP管进行离心,取上清液使用南京建成提供的试剂盒测定总抗氧化能力(total antioxidant capacity, T-AOC)、谷胱甘肽(glutathione, GSH)和丙二醛(malonaldehyde, MDA)含量,超氧化物歧化酶(superoxide dismutase, SOD)活性,微核率。
利用上述生物标记物计算IBRv2指数值,计算过程如下[5]:
IBRv2=∑|A|
Ai = Zi-Z0
Zi = (Yi-μ)/s
Yi = log (Xi/X0)
式中:Ai为生物标记物偏离指数,Zi和Z0为测试组和对照组生物标记物的均一化值,μ、s为各组均一化值的平均值和标准差;Xi和X0为测试组和对照组生物标记物的实测值,本文使用S1样地为对照组。
本着实验方法较简单、易操作、数据稳定性较高、试验成本低、推广应用性较强的原则,结合课题组前期研究工作,在不同生物学水平上筛选并构建了上述几种生物标记物的指标体系。它们在前人研究中也被广泛应用,在诸多研究中常会搭配其他指标构建出不同的生物标记物指标体系。
1.6 数据分析
利用Excel 2016和SPSS 28.0进行数据统计与分析。各样地的重金属含量和蝌蚪染毒后各生物指标之间的差异采用单因素方差分析(Duncan检验),显著性水平为P<0.05。
2 结果(Results)
2.1 煤矿区下游沉积物中重金属污染评价
对照区采样点(S1)位于煤矿区附近小安溪上游,研究区采样点(S2~S4)距离水稻田和池塘较近,4个样地pH范围为6.0~6.1,因此依据《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618—2018)风险筛选值(水田)(5.5
表1 煤矿区下游沉积物中重金属含量
Table 1 Heavy metals contents of sediments in downstream of coal mine area (mg·kg-1)
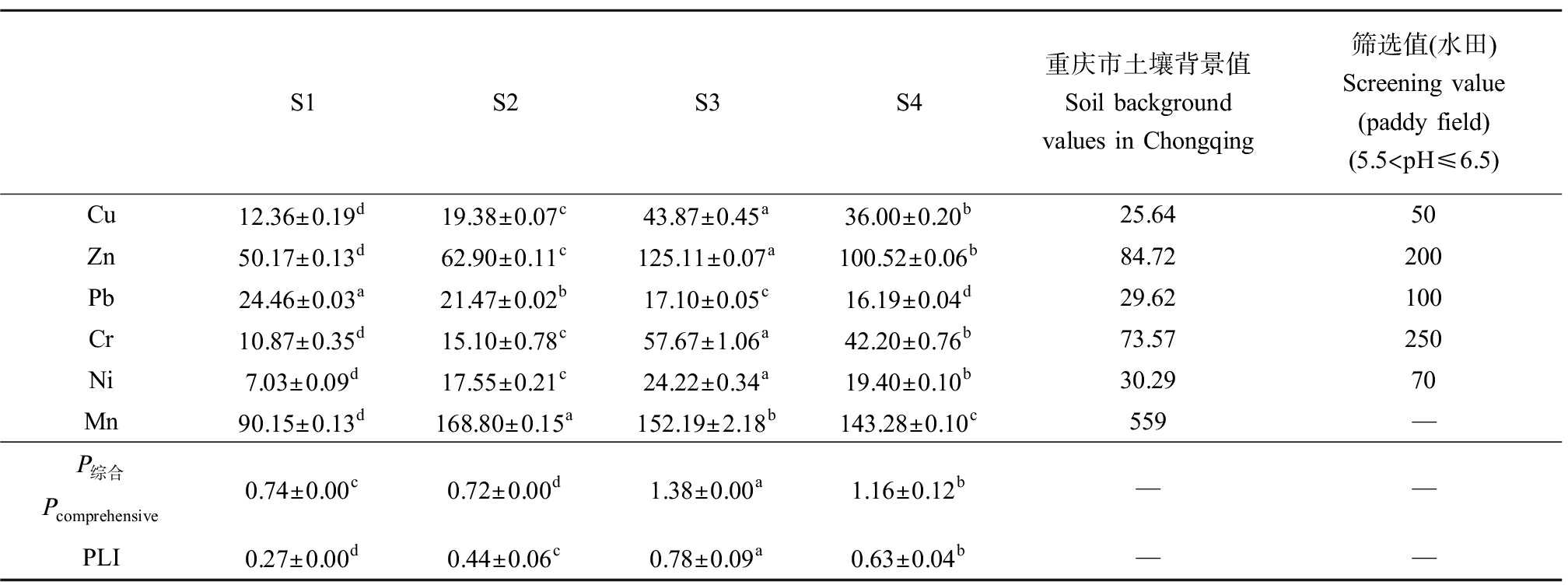
S1S2S3S4重庆市土壤背景值Soil background values in Chongqing筛选值(水田)Screening value (paddy field)(5.5 注:数据以平均值±标准偏差表示;不同字母表示各样地之间差异显著(P<0.05);P综合表示内梅罗综合污染指数(量纲为1);PLI表示污染负荷指数(量纲为1)。 Note: Data were expressed as mean ± standard deviation; different letters indicate significant differences among each sites (P<0.05); Pcomprehensive means Nemerow composite pollution index (Dimensionless); PLI means pollution load index (Dimensionless).
内梅罗综合污染指数指出,S3和S4样地污染程度为轻度污染,S1和S2为尚清洁(警戒线)(表1)。污染负荷指数显示各样地均处于无污染状态,其大小顺序为S3>S4>S2>S1。
2.2 煤矿区下游沉积物重金属污染对蝌蚪的毒性
暴露沉积物水溶液96 h后,各组蝌蚪均全部存活。各生物标记物详见图2。脏器系数能直观反映环境污染物对受试生物组织水平的毒性胁迫效应。与S1相比,S2、S3沉积物水溶液染毒后蝌蚪肝脏系数(LOC)显著增加(P<0.05)。GSH是生物体内重要的抗氧化剂和自由基清除剂,GSH本身也会被不断消耗。与S1相比,S2、S3、S4沉积物水溶液染毒后蝌蚪体内GSH含量均显著降低(P<0.05)。生物在受到环境胁迫时,体内会产生大量有害自由基,SOD则是清除体内有害自由基的主要抗氧化酶。与S1相比,S2、S3、S4沉积物水溶液染毒后蝌蚪体内SOD活性显著提高(P<0.05)。T-AOC代表机体抗氧化能力的总体水平,与生物体健康状况直接相关。与S1相比,S2、S3、S4沉积物水溶液染毒后蝌蚪体内T-AOC含量显著增加(P<0.05)。MDA含量能够较好地反映机体内脂质过氧化反应水平。与S1相比,S2、S3、S4沉积物水溶液染毒后蝌蚪肝脏内MDA含量显著增加(P<0.05)。污染物会造成生物体遗传物质损伤,染色体断裂而形成微核(MN)。与S1相比,S2、S3、S4沉积物水溶液染毒后蝌蚪的血细胞微核率显著提高(P<0.05)。
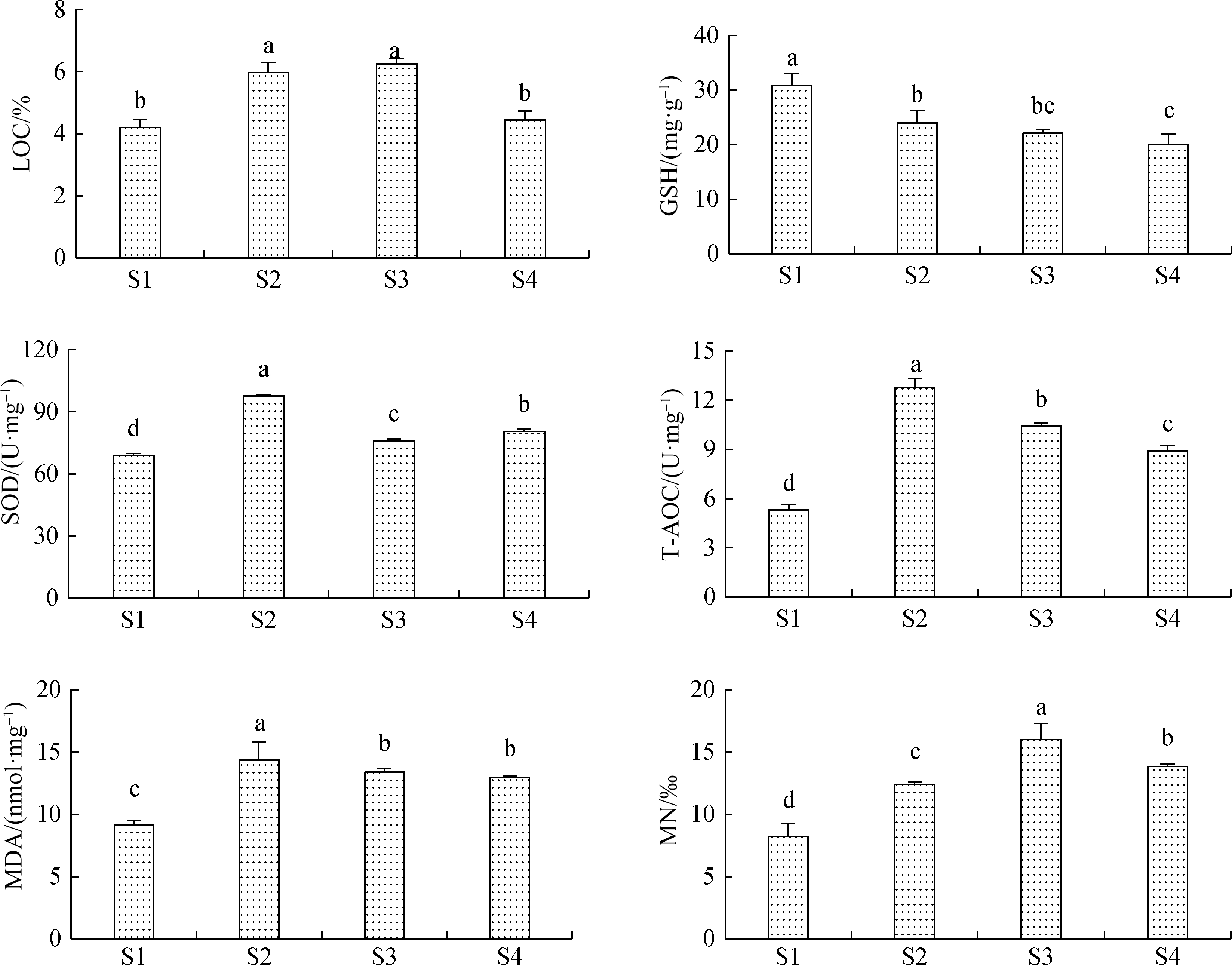
图2 沉积物水溶液重金属对美国青蛙蝌蚪的毒性
注:不同字母表示各样地之间差异显著(P<0.05);LOC,肝脏脏器系数;GSH,谷胱甘肽;
SOD,超氧化物歧化酶;T-AOC,总抗氧化能力;MDA,丙二醛;MN,微核率。
Fig. 2 Ecotoxicity of heavy metal pollution in sediment aqueous solution to tadpole of R. grylio
Note: Different letters indicate significant differences among each sites (P<0.05); LOC, liver organ coefficient; GSH, glutathione;
SOD, superoxide dismutase; T-AOC, total antioxidant capacity; MDA, malondialdehyde; MN, micronucleus rates.
2.3 IBRv2对沉积物污染的响应与指示
本研究中,对照样地的整体污染水平相对较低。因此,IBRv2值越大,可代表生物体各项指标受环境复合污染的毒性影响越大,或抑制或促进[5]。如图3所示,S3和S4样地的IBRv2值明显高于S2,表明该煤矿区主要污染来源于洗煤厂区域的废水排放,汇入小安溪后对小安溪水质造成显著影响。
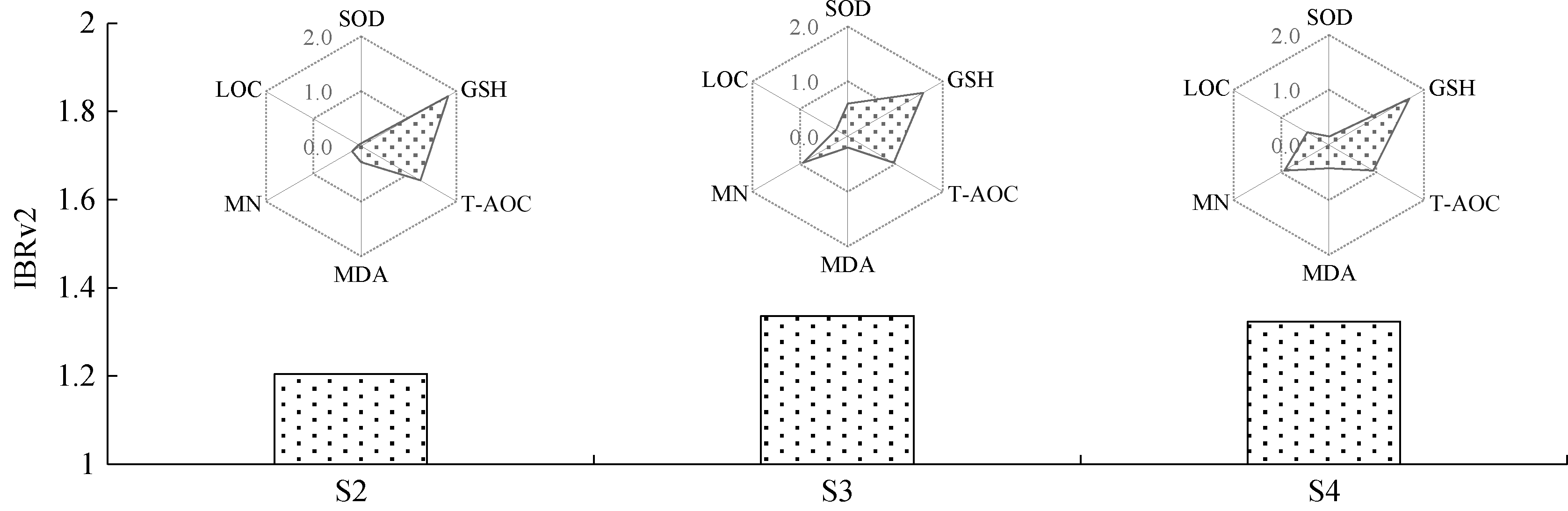
图3 各样地IBRv2值和各生物标记物的贡献度
Fig. 3 IBRv2 values and contributions of each biomarker
各生物学指标与污染指标之间的相关性分析如表2所示,结果显示IBRv2与P综合、PLI显著相关(P<0.05);IBRv2与Cu、Zn、Cr呈显著正相关,而与Pb、Mn呈显著负相关(P<0.05)。生物标记物LOC、T-AOC、MDA、MN这4种指标与P综合、PLI以及各重金属之间的相关性一致,均为除Pb外呈不同程度的正相关,而GSH的相关性正好相反。各生物标记物、IBRv2和各重金属元素、P综合、PLI之间的最高相关系数对应的指标也并不一致。从单指标来看,只有MN对环境因子综合污染水平(P综合、PLI)具有较好的指示作用。
表2 各生物标记物、IBRv2、P综合、PLI和重金属之间的相关性
Table 2 Correlations among biomarkers, IBRv2, Pcomprehensive, PLI, and heavy metals contents

LOCSODGSHT-AOCMDAMNIBRv2SOD0.522GSH-0.393 -0.420T-AOC0.828*0.879*-0.636 MDA0.7480.797-0.822*0.962*MN0.6660.270-0.894 *0.6530.797IBRv2-0.286-0.994*-0.791-0.886*-0.924*0.853*Cu0.408-0.068-0.831*0.3380.5420.932*0.983*Zn0.447-0.120-0.7720.3130.5030.922*0.951*Pb-0.372-0.2170.974*-0.510-0.719-0.932*-0.969*Cr0.391-0.193-0.7380.2410.4380.891*0.961*Ni0.7110.350-0.895*0.7180.845*0.996*0.773Mn0.7730.818*-0.7870.997**0.998**0.772-0.905*P综合Pcomprehensive0.278-0.355-0.6340.0770.2800.802*0.970*PLI0.5360.031-0.837*0.4510.6280.970*0.933*
注:皮尔逊相关系数,*表示显著相关(*P<0.05,**P<0.01)。
Note: Pearson correlation coefficients were calculated; asterisk indicated significant correlation (*P<0.05, **P<0.01).
3 讨论(Discussion)
本研究结果显示,沉积物中Cu、Zn、Ni、Cr、Mn这5种重金属元素在研究区(S2、S3、S4)样地的含量显著高于对照区(S1),其中Cu、Zn超过重庆市土壤背景值(表1),内梅罗综合污染指数显示S3和S4样地污染程度为轻度污染,这与涂春霖等[2]关于我国滇东典型煤矿区小流域沉积物重金属复合污染的研究结果相似,该研究显示受煤炭工业等人为活动和自然来源的综合影响,煤矿区部分点位Cu、Zn重金属达到轻度污染程度。Mn元素在S2和S3样地的含量显著高于S4,显示出煤矸石场和洗煤厂废水中Mn元素的含量均较高。整体而言,P综合和PLI均显示S3处沉积物重金属复合污染程度最高,该煤矿开采导致Zn、Cu、Cr、Ni、Mn这5种元素含量在周边水域环境中显著提高(表1)。这与前人研究结果相符,Jiang等[16]对我国东北到西南地区的30座典型煤矿区研究显示Mn、Zn、Cr、Ni等10多项指标在不同地区煤矿废水中均有不同程度的超标现象。任艳霞等[10]的研究显示我国西南地区某煤矿区土壤重金属污染的主要元素为Cd、Cu、Ni和Zn。
研究显示在同一流域内,随时间推移,沉积物中的重金属污染状况会不断加剧,从而威胁整个水环境系统[1]。即使少量的Cu、Zn、Ni等重金属元素污染,经过长期暴露后不仅会影响人和动物的健康问题,还会在体内积累,对机体造成不可逆的危害[14]。正常状况下脏器系数相对稳定,在受到污染物胁迫时,因器官受损或代偿性增长而导致脏器系数发生改变,较为严重的损伤效应包括肝脏充血、水肿、增生肥大或萎缩及其他退行性改变[8]。本研究中,与S1、S4相比,S2和S3的蝌蚪肝脏系数显著提高(图2(a)),表明沉积物中重金属等污染物对受试动物肝脏具有明显的刺激作用。
重金属对生物的重要毒害机制包括诱导生物体内产生大量活性氧自由基,且会提高活性氧的产生速率[17]。当抗氧化系统被破坏导致无法将活性氧自由基及时转化成为一种更小的分子时,就会出现DNA损伤、细胞凋亡和脂质过氧化现象[12, 17],而MDA含量能够较好地反映机体内脂质过氧化水平[11]。正常情况下,生物体内氧自由基的产生与清除处于动态平衡,若体内产生的自由基数量大于清除的数量,则会破坏细胞结构与功能,引起机体产生氧化应激反应,造成氧化损伤[17]。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)与过氧化氢酶(CAT)是机体维持抗氧化平衡所必需的主要抗氧化酶,其中SOD的主要功能是清除机体中的活性氧自由基,生成H2O2,利用CAT和GPx将其还原成H2O,从而消除过量的超氧自由基[5]。T-AOC能反映机体的总抗氧化水平,反映动物机体酶及非酶促体系对外来刺激机体的自由基代谢状态。如果机体T-AOC含量显著下降,则可表明机体内抗氧化酶系统被大量消耗,体内积累了较多的自由基[7]。GSH是机体内一种非常重要的抗氧化剂,由于GSH本身易被氧化消耗而在体内能够保护许多抗氧化酶免受自由基破坏。Armstrong等[17]发现GSH含量的降低是一种潜在的凋亡早期激活信号,随后产生的氧自由基会促使细胞发生凋亡。重金属等污染物质在受试动物体内积累就会导致蝌蚪遗传物质改变的几率增大,可通过微核率(MN)来检测。同时,核损伤也会导致遗传物质断裂,间接增加两栖类动物致癌和致突变的可能性[7]。
本研究中样地S2、S3、S4样地蝌蚪SOD活性和T-AOC含量与S1相比显著提高(图2),可以得出煤矿区废水渗漏的重金属污染对蝌蚪的抗氧化系统具有明显的激发作用。结合样地S2、S3、S4蝌蚪体内GSH含量与S1相比显著降低,暗示GSH含量处于不断的消耗之中。这是生物在受到污染环境胁迫时,体内产生大量有害自由基的直接作用结果。当污染较为严重时,体内的调节系统不能抵抗氧化压力,就会导致脂质过氧化反应,引起脂质氧化变性和遗传物质损伤[4, 17],进而导致了样地S2、S3、S4蝌蚪肝脏内MDA含量和血细胞微核率(MN)显著提高。
为了评估沉积物中重金属复合污染对蝌蚪的综合生态毒性效应,本研究采用IBRv2指数法,筛选生物标记物信号,来揭示所研究水环境的健康风险状态。整体而言,本研究中IBRv2的变化趋势与P综合、PLI基本一致(表1和图3),且IBRv2与P综合、PLI之间均呈显著相关关系(表2),可以看出IBRv2能较好地体现各样地重金属污染对生物的毒性效应,并能准确反映出不同污染样地底泥污染程度与变化趋势。这与前人研究用IBRv2指数反映了在不同污染样地测量的生物标记物的变化结果一致[5]。同时,与PLI相比,P综合与IBRv2的相关性更高(表2),P综合在一定程度上凸显了污染程度最高的环境因子毒性作用,这提示我们要更加关注污染区域的少数典型污染因子对生物体的毒性作用。
综上所述,该煤矿区废水渗漏导致Cu、Zn、Cr、Ni、Mn这5种元素含量在周边水域环境中显著提高。其中以洗煤厂区域(S3)沉积物中的重金属污染程度最高。煤矿废水渗漏增加了下游沉积物重金属污染对受试蝌蚪的毒性。以脏器系数、GSH、SOD、T-AOC、MDA、微核率为指标体系构建的IBRv2法能够很好地反映出煤矿区周边水系中沉积物重金属污染程度及其对两栖类的生态毒性效应,并能明确指出该煤矿区主要污染来源于洗煤厂区域的废水排放,已对其上一级河流小安溪的水质造成了显著影响。由此可见,IBRv2反映出的毒性影响与该煤矿区污染之间具有直接的因果关系。结合生物监测评价指标/指数和污染因子指标/指数之间的相关性分析可见,导致综合生物效应变化是各化学污染因子的联合作用所致。从IBRv2的角度来看,Cu、Zn、Cr的影响更为显著,可以认为它们是本研究中导致综合生物效应的主要化学污染因子。
值得注意的是,随着工业快速发展,新型污染物不断涌现,地表水体污染物种类也日益增多,仅《地表水环境质量标准》(GB 3838—2002)中的检测项已多达109项。且各类污染物之间也存在协同、拮抗等联合作用关系,对生物的综合毒害作用也是交错复杂,导致生物标记物与野外复合污染因子二者之间的相关关系难以理清。本文所测量的污染因子也可能并不是影响受试生物生存质量的关键因子,或者生物监测评价指标/指数对已测定的污染因子的响应敏感度不同。因此,本文中各生物标记物、IBRv2和各重金属元素、P综合、PLI之间的相关性表现出了诸多不一致的现象也是合理的。同时,染毒时间对各生物标记物的影响也是不同的,如本文中MN对环境因子综合污染水平(P综合、PLI)具有较好的指示作用,这不排除MN在短时间内没有被机体代谢掉而导致其在细胞中积累,从而在急性毒性试验中表现突出。综上,我们设想基于广泛的文献调研和前期工作基础,能够尽可能聚焦目标区域的代表性环境因子,力求探寻出相对敏感性较高、稳定性较好、分析方法较简单的生物标记物,从而能够更加便捷准确地反映出目标区域的环境污染问题,分析出导致生物效应的主要化学污染因子,明确其与综合生物效应之间直接/间接的因果关系。为煤矿区水环境污染的生物监测技术开发与生物标记物优选提供数据支持。
[1] 杨帆, 袁隆湖, 黎一夫, 等. 湖南省主要水系底泥重金属污染特征及其生态风险评价[J]. 生态学报, 2022, 42(5): 1934-1946
Yang F, Yuan L H, Li Y F, et al. Pollution characteristics and ecological risk assessment of heavy metals in sediments of main water systems in Hunan Province [J]. ActaEcologica Sinica, 2022, 42(5): 1934-1946 (in Chinese)
[2] 涂春霖, 杨坤, 和成忠, 等. 滇东典型煤矿区小流域沉积物重金属来源及风险评价[J]. 中国地质, 2023, 50(1): 206-221
Tu C L, Yang K, He C Z, et al. Sources and risk assessment of heavy metals in sediments of small watersheds in typical coal mining areas of Eastern Yunnan [J]. Geology in China, 2023, 50(1): 206-221 (in Chinese)
[3] Rashed M N. Monitoring of contaminated toxic and heavy metals, from mine tailings through age accumulation, in soil and some wild plants at Southeast Egypt [J]. Journal of Hazardous Materials, 2010, 178(1-3): 739-746
[4] Zhang W Y, Sun H, Su R, et al. Fat rather than health—Ecotoxic responses of Bufo raddei to environmental heavy metal stress during the non-breeding season [J]. Ecotoxicology and Environmental Safety, 2022, 244: 114040
[5] Si W T, He X Y, Li A L, et al. Application of an integrated biomarker response index to assess ground water contamination in the vicinity of a rare earth mine tailings site [J]. Environmental Science and Pollution Research International, 2016, 23(17): 17345-17356
[6] Samanta P, Im H, Na J, et al. Ecological risk assessment of a contaminated stream using multi-level integrated biomarker response in Carassius auratus [J]. Environmental Pollution, 2018, 233: 429-438
[7] 王进华, 柏彬彬, 邓婉菲, 等. 镉诱导文蛤鳃细胞凋亡和抗氧化生物标志物的响应[J]. 生态毒理学报, 2022, 17(2): 413-423
Wang J H, Bai B B, Deng W F, et al. Apoptosis of Meretrix meretrix gill cell and response of antioxidative biomarkers induced by cadmium [J]. Asian Journal of Ecotoxicology, 2022, 17(2): 413-423 (in Chinese)
[8] 司万童, 蒋海明, 栗利曼, 等. 花背蟾蜍性腺抗氧化酶对稀土尾矿库污染胁迫的响应[J]. 生态毒理学报, 2017, 12(2): 209-215
Si W T, Jiang H M, Li L M, et al. The response of antioxidant enzyme in Bufo raddei gonad to rare earth tailings pollution stress [J]. Asian Journal of Ecotoxicology, 2017, 12(2): 209-215 (in Chinese)
[9] 刘鹏, 陈辉, 赵文阁. 重金属对无尾两栖类蝌蚪的毒性效应研究进展[J]. 中国农学通报, 2011, 27(17): 273-276
Liu P, Chen H, Zhao W G. Research advances in toxicological effects of heavy metal on the anuran larvae [J]. Chinese Agricultural Science Bulletin, 2011, 27(17): 273-276 (in Chinese)
[10] 任艳霞, 周俊杰, 毕捷, 等. 渝西某煤矿区土壤重金属污染程度及其特征分析[J]. 南方农业学报, 2021, 52(7): 1905-1911
Ren Y X, Zhou J J, Bi J, et al. Pollution degree and characteristics of heavy metals in soil of a coal mine area in western Chongqing [J]. Journal of Southern Agriculture, 2021, 52(7): 1905-1911 (in Chinese)
[11] 黄涛, 刘菊梅, 彭琴, 等. 重金属复合污染场地对花背蟾蜍雄性性腺的毒性作用[J]. 环境工程, 2020, 38(6): 35-39, 74
Huang T, Liu J M, Peng Q, et al. Toxic effects of heavy metals contaminated site on male gonad of Bufo raddei [J]. Environmental Engineering, 2020, 38(6): 35-39, 74 (in Chinese)
[12] Reyes-Becerril M, Angulo C, Sanchez V, et al. Methylmercury, cadmium and arsenic(Ⅲ)-induced toxicity, oxidative stress and apoptosis in Pacific red snapper leukocytes [J]. Aquatic Toxicology, 2019, 213: 105223
[13] 薄军, 郑榕辉, 陈晔, 等. 应用鱼类生物标志物和IBRv2监测与评价泉州湾石油类污染生物效应状况[J]. 应用海洋学学报, 2016, 35(3): 380-390
Bo J, Zheng R H, Chen Y, et al. Applying fish biomarkers and IBRv2 for monitoring and assessing biological effects of petroleum hydrocarbon pollution in Quanzhou Bay [J]. Journal of Applied Oceanography, 2016, 35(3): 380-390 (in Chinese)
[14] Saleh Y S, Marie M A S. Use of Arius thalassinus fish in a pollution biomonitoring study, applying combined oxidative stress, hematology, biochemical and histopathological biomarkers: A baseline field study [J]. Marine Pollution Bulletin, 2016, 106(1-2): 308-322
[15] 翁薛柔, 叶琰, 叶勇, 等. 基于多种算法的小安溪流域降雨侵蚀力时空演变特征[J]. 农业工程学报, 2022, 38(4): 143-150
Weng X R, Ye Y, Ye Y, et al. Spatiotemporal characteristics of rainfall erosivity in Xiaoanxi Basin using multiple algorithms [J]. Transactions of the Chinese Society of Agricultural Engineering, 2022, 38(4): 143-150 (in Chinese)
[16] Jiang C F, Gao X B, Hou B J, et al. Occurrence and environmental impact of coal mine goaf water in Karst areas in China [J]. Journal of Cleaner Production, 2020, 275: 123813
[17] Armstrong J S, Steinauer K K, Hornung B, et al. Role of glutathione depletion and reactive oxygen species generation in apoptotic signaling in a human B lymphoma cell line [J]. Cell Death &Differentiation, 2002, 9(3): 252-263